Журнал эволюционной биохимии и физиологии, 2020, T. 56, № 3, стр. 224-231
АНТИОКИСЛИТЕЛЬНАЯ ЗАЩИТА В ГЕПАТОПАНКРЕАСЕ И НЕРВНЫХ ГАНГЛИЯХ МОЛЛЮСКА LYMNAEA STAGNALIS ПОСЛЕ ОСТРОЙ ЭКСПЕРИМЕНТАЛЬНОЙ ГИПЕРГЛИКЕМИИ
В. Н. Шаденко 1, А. В. Сидоров 1, *
1 Белорусский государственный университет
Минск, Республика Беларусь
* E-mail: sidorov@bsu.by
Поступила в редакцию 11.06.2019
После доработки 09.07.2019
Принята к публикации 22.07.2019
Аннотация
Исследовано состояние системы антиокислительной защиты в гепатопанкреасе (пищеварительной железе) и центральных нервных ганглиях моллюска Lymnaea stagnalis в норме и спустя сутки после вызванной острой экспериментальной гипергликемии (2-х часовая инкубация в 100 мМ растворе глюкозы). Установлено, что в нервных ганглиях такое воздействие приводит к 1.6- и 1.5-кратному увеличению содержания восстановленного глутатиона (Г-SH) и активности супероксиддисмутазы (СОД), наблюдаемых на фоне 1.3-кратного снижения количества общего белка. Активность Se-зависимой глутатионпероксидазы (Se-ГП) и уровень ТБК-активных продуктов не претерпевали статистически достоверных изменений. Для тканей гепатопанкреаса отмечено 1.3-кратное снижение количества ТБК-активных продуктов, отмечаемое на фоне 1.1-кратного увеличения содержания общего белка, при неизменности других компонентов антиокислительной защиты (СОД, Г-SH, Se-ГП). Предполагается, что более развитая система антиокислительной защиты центральных ганглиев необходима для обеспечения устойчивого функционирования нервных клеток Lymnaea при резких нарушениях глюкозного гомеостаза внутренней среды.
ВВЕДЕНИЕ
Поддержание постоянства уровня глюкозы во внутренней среде является одной из приоритетных задач функциональных систем организма. Тем не менее нейронные механизмы его реализации, в частности определяющие реакцию животного на уровень сахаров в пище, еще недостаточно понимаемы [1, 2]. Известно, что нервная ткань характеризуется чрезвычайно высоким уровнем метаболизма, а мозг человека потребляет 20–25% от общего количества кислорода (50% при максимальной активности) и 70% свободной глюкозы. При этом 85–90% ее аэробно окисляется до углекислого газа и воды, а в ткани мозга образуется 95% всего АТФ организма [3].
Высокая степень надежности, с которой контролируется и поддерживается заданная концентрация глюкозы во внутренней среде, одновременно указывает и на сигнальные свойства этого вещества, в том числе и в отношении нервных клеток [4]. У беспозвоночных, в частности у моллюсков, уровень сахаров (глюкозы) в гемолимфе может отличаться на несколько порядков в зависимости от текущего функционального состояния (сытые, голодные, активно питающиеся особи) [5], сезона года и внешнесредовых температур [6], как это отмечено для Lymnaea stagnalis. В свою очередь изменение глюкозного гомеостаза, в частности повышение уровня глюкозы, ассоциируется с усилением оборонительных реакций у наземных гастропод (Cepaea nemoralis) и изменяет реакцию нейронов на приложение гастроинтестинальных пептидов [7]. При стрептозоцин-индуцированном диабете отмечено снижение активности аденилатциклазы в гладких мышцах и гепатопанкреасе у беззубки (Anodonta cygnea) [8] и роговой катушки (Coretus corneus) [9], приводящей к модификации клеточных ответов на действие гормонов (инсулин, релаксин, соматостатин) и низкомолекулярных нейромедиаторов/нейромодуляторов – октопамина, дофамина, серотонина [9], известных регуляторов поведения у моллюсков.
Нервные клетки обладают большим числом митохондрий. Побочным продуктом функционирования их электронтранспортной цепи, очевидно усиливающегося при повышении уровня глюкозы, является наработка активных форм кислорода (АФК), включая супероксид анион ($^{\centerdot }{\text{O}}_{2}^{ - }$), пероксид водорода (H2O2) и гидроксильный радикал (•OH) – сигнальные свойства которых хорошо известны [10]. С одной стороны, это требует наличия развитой системы антиокислительной защиты, по сравнению с другими, не столь активными в метаболическом отношении органами, а с другой – изменение редокс-равновесия может обусловливать реакцию организма, в том числе и на кратковременные, быстропроходящие сдвиги содержания глюкозы, особенно в отношении беспозвоночных (моллюсков). Можно предположить, что резкое, быстропроходящее нарушение глюкозного гомеостаза во внутренней среде служит сигналом, инициирующим модификацию активности основных компонентов антиокислительной защиты нервных клеток, определяя новое редокс-состояние нервной ткани. С целью экспериментальной проверки высказанной гипотезы и была выполнена данная работа.
МАТЕРИАЛ И МЕТОДИКА
Животные и экспериментальные процедуры. Моллюсков – прудовик обыкновенный (Lymnaea stagnalis L.), собирали в мелких проточных водоемах (мелиоративные и водоотводные каналы) в осенний период года. В лаборатории их содержали в аквариумах, на каждую особь приходилось не менее 1 л воды, при температуре 2 0 ± 1°С. Смену воды проводили каждую неделю. Пищей служили листья салата (питание ad libitum). Использовали животных одинакового размерного класса, разделенных на две группы – контрольную (n = 37) и опытную (n = 36), не отличающихся по своим морфометрическим показателям друг от друга – массе: 3.08 ± 0.67 и 3.17 ± 0.71 г для контрольной и опытной групп соответственно (t = 0.58, P = 0.5645); высоте раковины: 3.7 ± 0.30 и 3.7 ± 0.32 см для контрольной и опытной групп соответственно (t = = 0.67, P = 0.5024).
Моллюсков обеих групп переносили в 10-л аквариумы, где они находились в течение 2 часов: опытной – в 100 мМ водном растворе глюкозы (ч.д.а., “Пять океанов”, Беларусь), контрольной – в “чистой”, отстоявшейся водопроводной воде. По окончании инкубации животных возвращали в аквариумы их постоянного содержания, где они находились последующие 24 ч, после чего производили забор экспериментального материала.
Приготовление гомогената тканей. Первоначально удаляли раковину, вскрывали полость цефалопедального синуса и производили забор проб гемолимфы, центрального кольца и буккальных нервных ганглиев, гепатопанкреаса (пищеварительной железы). Пробы гемолимфы и гепатопанкреаса были получены отдельно по каждой особи, на одну пробу нервных ганглиев приходились 3 нервные системы от разных моллюсков. Полученный материал замораживали и хранили при минус 20°С, используя по мере необходимости. Предварительно взвешенные пробы (аналитические весы ВЛР-200, точность 0.05 мг) измельчали при помощи стеклянного гомогенизатора. Гомогенаты гепатопанкреаса (разведение 1:20) и нервных ганглиев (разведение 1:140) готовили на основе холодной (4°С) дистиллированной воды. Пробы гемолимфы оставляли неразведенными.
Анализ содержания глюкозы. Концентрацию глюкозы определяли глюкозооксидазным методом (набор реагентов “Анализ Х”, Беларусь) с учетом всех предшествующих разведений материала. Измерения оптической плотности проводили при длине волны 520 нм, длина оптического пути 1 см, при 20°С посредством спектрофотометра Cary 50 (Variant Inc., Австралия). Объем материала для анализа – 100 мкл, время инкубации с реагентом (1 мл) – 30 мин. В качестве стандарта использовали 100 мкл свежеприготовленного 1 мМ раствора глюкозы. При оценке уровня глюкозы в гомогенатах гепатопанкреаса и нервных ганглиев к 250 и 100 мкл такого материала добавляли 50 и 15 мкл 50% ТХУ (трихлоруксусная кислота) соответственно. Связанный белок осаждали центрифугированием (6000 об./мин, 1 мин), а 100 мкл полученного супернатанта использовали для последующего анализа.
Система антиокислительной защиты в гомогенатах гепатопанкреаса и нервных ганглиев. Активность супероксиддисмутазы (СОД, КФ 1.15.1.1.) определяли спектрофотометрическим методом [11], основанным на оценке скорости аутоокисления флавоноида кверцетина, при длине волны 406 нм и оптического пути 1 см. Для каждой пробы измерение проводили в двух повторах. В контрольной пробе использовали равновеликий объем дистиллированной воды. При подготовке пробы полученные ранее гомогенаты гепатопанкреаса (дополнительно разведенный 1:10) или нервных ганглиев подвергали центрифугированию (6000 об./мин, 1 мин) для осаждения взвешенных частиц. Результат выражали в единицах активности фермента на мг общего белка (ед. акт./мг белка).
Активность Se-зависимой глутатионпероксидазы (Se-ГП, КФ 1.11.1.9) определяли по ее способности к детоксикации трет-бутил перекиси (2 мМ) в присутствии восстановленного глутатиона (Г-SH, 2 мМ) [12]. Реакционную смесь инкубировали 5 мин (гепатопанкреас) или 10 мин (нервные ганглии) при 25°С, останавливая пероксидазную реакцию добавлением 50% раствора ТХУ. Концентрацию Г-SH определяли по реакции с реактивом Эллмана (см. ниже) через 10 мин после его добавления. Контроль ставили к каждой пробе, но при этом гомогенаты гепатопанкреаса или нервных ганглиев вносили в реакционную смесь после добавления ТХУ. Удельную активность фермента представляли как количество восстановленного глутатиона, приходящегося на мг общего белка и окисленного за 1 мин (нмоль Г-SH/мг белка/мин).
Уровень восстановленного глутатиона (Г-SH) определяли спектрофотометрически при длине волны 412 нм и оптического пути 1 см, по реакции с 5.5’-дитиобис-нитробензойной кислотой (ДТНБ, реактив Эллмана), используя коэффициент молярной экстинкции (13 700 (моль/л)–1 см–1) согласно [13]. В ходе подготовки пробы осаждение белка гомогената гепатопанкреаса или нервных ганглиев проводили 50% раствором ТХУ с последующим центрифугированием (15 мин при 6000 об./мин). Реакцию с реактивом Эллмана (50 мкл) проводили в щелочной среде (pH = 8.9). Контролем служила проба, содержащая равновеликий объем дистиллированной воды. Результат выражали в количестве Г-SH на мг общего белка (нмоль Г-SH/мг белка).
Интенсивность процессов перекисного окисления липидов определяли по образованию в гомогенатах гепатопанкреаса и нервных ганглиев ТБК- (тиобарбитуровая кислота) активных продуктов по модифицированной методике [14]. При подготовке пробы гомогенаты гепатопанкреаса или нервных ганглиев добавляли к 0.5% раствору свежеприготовленной ТБК, оставляли на 5 мин, а затем прибавляли 50% раствор ТХУ и помещали пробу на водяную баню (100°С) на 15 мин. После этого пробы центрифугировали (6000 об./мин, 10 мин). Оптическую плотность супернатанта определяли при длине волны 532 нм и оптического пути 1 см, с учетом коэффициента молярной экстинкции для малонового диальдегида (МДА, 156 000 (моль/л)–1 см–1). Контролем служила проба, содержащая дистиллированную воду вместо гомогената. Результат выражали в количестве ТБК-активных продуктов на мг общего белка (нмоль/мг белка).
Определение количества белка проводили по методу Бредфорда [15] при длине волны 595 нм и оптического пути 1 см, при однократной повторности измерения для каждой пробы. Расчет производили на основании калибровочной кривой (бычий альбумин, от 100 до 1000 мкг/мл с шагом 100 мкг/мл) и полученного по ее данным уравнению линейной регрессии, на 30 мин после добавления в реагент гомогенатов гепатопанкреаса или нервных ганглиев. В контрольной пробе использовали равновеликий гомогенату объем дистиллированной воды.
Статистический анализ. Экспериментальные данные обрабатывали общепринятыми методами медико-биологической статистики [16], с использованием возможностей программы Statistica 6.0. Нормальность распределения для каждого ряда экспериментальных данных предварительно оценивали при помощи W-теста Шапиро–Уилка. В случае подтверждения нормальности распределения показателей для всех сравниваемых групп использовали параметрические методы оценки – t‑критерий Стьюдента для независимых пар, представляя данные в виде среднее ± стандартное отклонение. Если нормальность распределения не была подтверждена для всех экспериментальных групп, использовали непараметрические методы оценки и сравнения полученных результатов – U‑критерий Манна–Уитни (z) или Н-критерий Крускала–Уоллиса (дисперсионный анализ по однофакторной схеме) при сравнении двух или нескольких независимых выборок соответственно, представляя данные в виде – медиана (нижний; верхний квартили). Число наблюдений (n) указано отдельно для каждой анализируемой выборки. Достоверными считались данные при уровне значимости (P), равном или меньшем 0.05.
РЕЗУЛЬТАТЫ
Содержание глюкозы. Спустя сутки после окончания инкубации животных в высококонцентрированном растворе глюкозы статистически достоверных различий в содержании сахара в гемолимфе и нервных ганглиях у моллюсков опытной и контрольной групп выявлено не было (табл. 1). Для ткани гепатопанкреаса, напротив, отмечено 1.6-кратное возрастание концентрации глюкозы в опытной группе. Обращают на себя внимание и количественные различия в содержании глюкозы в зависимости от органа (ткани). В частности, для контрольной группы речь идет о 88 и 256-кратном ее увеличении в нервных ганглиях и гепатопанкреасе соответственно, по сравнению с концентрацией в гемолимфе (H = 51.7; P < 0.0001). Сравнение значений оцениваемого показателя для ткани нервных ганглиев и гепатопанкреаса контрольных животных выявило его статистически достоверное увеличение для последней группы – в 2.9 раза. У животных опытной группы соотношение концентраций глюкозы в гемолимфе, нервных ганглиях и гепатопанкреасе принципиально не отличалось от описанного, составляя 1:106:418 (H = 52.9; P < 0.0001), отражая уже отмеченное возрастание содержания глюкозы в тканях пищеварительной железы.
Таблица 1.
Концентрация глюкозы в тканях (органах) Lymnaea stagnalis спустя сутки после развития острой экспериментальной гипергликемии Table 1. Glucose concentration in Lymnaea stagnalis tissues (organs) 24 hours after exposure of experimental hyperglycemia
| Исследуемая ткань (орган) Studied tissue (organ) | Концентрация глюкозы, мМ Concentration of glucose, mÌ | U-тест Манна–Уитни (сравнение 2 экспери-ментальных групп) Mann–Whitney’s U-test(comparison of 2 experimental groups) |
|
|---|---|---|---|
| Контроль (аквариумная вода) Control (aquarian water) | Опыт (глюкоза, 100 мМ) Test (glucose, 100 mM) | ||
| Гемолимфа/Hemolymph | 0.12 (0.07; 0.20), n = 37 | 0.12 (0.06; 0.15), n = 36 | z = 0.63, P = 0.5294 |
| Нервные ганглии/Nervous ganglia | 10.6 (9.0; 13.7), n = 9 | 12.7 (10.9; 14.8), n = 10 | z = 0.82, P = 0.4142 |
| †z = 4.61, P < 0.0001 | †z = 4.60, P < 0.0001 | ||
| Гепатопанкреас/Hepato-pancreas | 30.7 (19.5; 48,4), n = 22 | 50.2 (39.1; 56.6), n = 22 | *z = 2.96, P = 0.0031 |
| †z = 6.38, P < 0.0001 | †z = 6.34, P < 0.0001 | ||
| #z = 2.92, P < 0.0035 | #z = 4.09, P < 0.0001 | ||
Различия статистически достоверны между контрольной и опытной группами (*) или по сравнению со значением для гемолимфы (†) и нервных ганглиев (#) для своей экспериментальной группы. Distinctions are statistically reliable between control and skilled groups (*) or in comparison with value for a haemolymph (†) and nervous ganglia (#) for the experimental group.
Система антиокислительной защиты. По прошествии 24 ч после экспериментального воздействия в тканях гепатопанкреаса было отмечено небольшое, но статистически значимое, в 1.1 раза, возрастание концентрации общего белка: с 65.3 ± ± 10.4 (n = 32) до 72.4 ± 14.0 (n = 28) мг/мл (t = 2.26, P = 0.0274) у животных опытной группы. У этих же особей наблюдалось и статистически достоверное 1.3-кратное снижение количества ТБК-активных продуктов. В то же время статистически достоверных изменений активности СОД, Se-ГП и уровня Г-SH отмечено не было (рис. 1).
Рис. 1.
Антиокислительная система в клетках гепатопанкреаса и центральных нервных ганглиях Lymnaea stagnalis в норме и через 24 ч после острой экспериментальной гипергликемии.
а – содержание восстановленного глутатиона (Г-SH), б – активность глутатионпероксидазы (Se-ГП), в – уровень ТБК-продуктов, г – активность супероксиддисмутазы (СОД).
Светлые столбики – контрольная, серые – опытная группы. Приведены значения исследованных показателей (числа над столбиками) и количество проб (n) для каждой экспериментальной серии. Для всех пар сравнения контрольной и опытной групп указано значение U-критерия Манна–Уитни (непараметрическое распределение) или t-критерия Стьюдента (нормальное распределение) для независимых групп и уровня значимости P. Статистически достоверные различия (P < 0.05) дополнительно отмечены звездочкой (*). Fig. 1. The antioxidant system in hepatopancreas cells and central nerve ganglia in Lymnaea stagnalis in norm and 24 hours after acute experimental hyperglycemia.a – content of reduced glutathione (G-SH), b – activity of glutathione peroxidase (Se-GP), c – level of TBK-products, d – superoxide dismutase (SOD) activity.Light columns – control, grey – experimental groups. The values of the investigated indicators (numbers above columns) and the number of samples (n) for each experimental series. For all pairs of comparisons of control and test the value of Mann–Whitney U-criterion (non-parameter distribution) or Student t-criterion is indicated (Normal distribution) for independent groups and significance level P. Statistically significant differences (P < 0.05) are additionally marked with an asterisk (*).
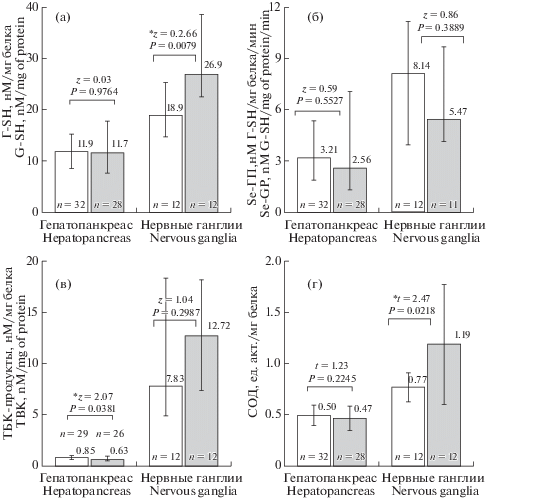
Со стороны системы антиокислительной защиты нервных ганглиев реакция была более заметной. Как и в случае с материалом гепатопанкреаса, было отмечено изменение содержания общего белка у моллюсков опытной группы. Речь в данном случае идет о снижении (в 1.3 раза) его концентрации, с 41.0 ± 9.4 (n = 12) до 32. 5 ± 16.3 (n = 12) мг/мл (t = = 2.08, P = 0.0377). Также у этих особей наблюдается 1.6-кратное увеличение уровня Г-SH и 1.5-кратное возрастание супероксиддисмутазной активности. Статистически достоверных изменений активности Se-ГП и количества ТБК-активных продуктов у животных опытной группы по сравнению с контрольной выявлено не было (рис. 1).
Отдельно стоит остановиться на различиях в анализируемых показателях для исследованных органов. Так, в контрольной группе для ткани нервных ганглиев, по сравнению с гепатопанкреасом, выявлено пониженное содержание общего белка, в 1.6 раза (t = 2.08, P = 0.0377). С другой стороны, в ткани нервных ганглиев обнаруживается повышенная активность СОД (в 1.5 раза; t = 7.03, P < 0.0001) и Se-ГП (в 2.5 раза; z = 2.45, P = 0.0143), а также отмечено повышенное содержание Г-SH (в 1.4 раза; z = 2.64, P = 0.0084). Однако наиболее выраженным было увеличение количества ТБК-активных продуктов, превышающее таковое для ткани гепатопанкреаса в 8.4 раза (z = 4.99, P < 0.0001). Отмеченные различия между органами схожи по всем рассматриваемым показателям, являются статистически достоверными и для материала, полученного от моллюсков опытной группы.
ОБСУЖДЕНИЕ
Инкубация Lymnaea stagnalis в растворе глюкозы высокой концентрации (100 мМ) приводит к развитию кратковременной (в течение 2 ч), быстроприходящей гипергликемии, ассоциируемой с многократным, примерно на порядок, возрастанием уровня глюкозы в гемолимфе животных (с 0.17 до 1.30 мМ) [17]. Эти значения возвращаются к исходному уровню (0.14 мМ) уже через 2 ч после переноса животных в “чистую” аквариумную воду. При этом нормализация содержания сахаров в гемолимфе Lymnae stagnalis, следующая за пиковым ее увеличением, может быть обусловлена особенностью водного обмена у прудовика, приводящего к “вымыванию” избыточной глюкозы гемолимфы за относительно короткий промежуток времени. Известно, что количество выводимой за 1 ч воды равно почти 4-кратному весу взрослых особей Lymnaea [18].
Нельзя исключить, что неизменность содержания глюкозы в нервных ганглиях у животных опытной группы связана с продукцией у моллюсков инсулин-подобных пептидов (molluscan insulin-related peptide, MIP), основным источников которых у Lymnaea stagnalis являются нейроэндокринные светло-зеленые клетки (light-green cells, LGC) [19], четыре кластера которых включают ∼150 пептид-содержащих нейронов, вовлеченных в нейрогормональную регуляцию процессов роста и размножения [20]. Усиление их электрической активности ассоциируется с поступлением глюкозы в клетки за счет активации электрогенного Na+-глюкозного транспортера [21]. Инъекция инсулин-подобных пептидов Aplysia californica приводит к снижению уровня глюкозы в гемолимфе [22]. Активация соответствующих рецепторов вызывает модификацию ионных токов в мембране нейронов Aplysia [23], изменяя свойства нервных клеток и обеспечивая утилизацию “избытка” глюкозы. Кроме того, MIP вовлечены в развитие долговременных изменений эффективности синаптической передачи [24]. В последнем случае речь может идти о вариации числа синаптических контактов между нейронами [25], поскольку способность инсулина и MIP инициировать формирование и ветвление отростков нейрона (спрутинг), также хорошо известна [26, 27]. Эти процессы несомненно требуют энергетического обеспечения, источником которого может служить повышенный уровень глюкозы в интерстиции. В отношении клеток гепатопанкреаса эффект оказывается не столь выраженным, что и обусловливает наблюдаемое возрастание содержания глюкозы у опытной группы, а также различия в уровне глюкозы между исследованными тканями гепатопанкреаса, нервных ганглиев и гемолимфы.
Таким образом, пониженное содержание глюкозы в клетках нервных ганглиев, по сравнению с клетками гепатопанкреаса, является отражением различий в уровне метаболизма данных органов – интенсивное использование субстрата (окисление) мозгом в противовес, например, накоплению гликогена в пищеварительной железе. В частности, синтез гликогена в гликоген-запасающих мантийных клетках Lymnaea stagnalis стимулируется при повышении концентрации глюкозы в гемолимфе [28]. У черноморского двухстворчатого моллюска Anadara kagoshimensis максимальное содержание глюкозы отмечено в клетках гепатопанкреаса и жабр, а наименьшее – в ноге, т.е. органе с высокой функциональной активностью [29]. Кроме того, для ноги характерны наибольшие значения уровня Г-SH и активности Se-ГП, что, как предполагают авторы, связано с адаптацией моллюска к гипоксии, т.е. условиям, «благоприятным» для наработки АФК. Преимущественная утилизация дополнительных порций глюкозы в нервных ганглиях Lymnaea приводит к наблюдаемому увеличению содержания Г-SH и активности СОД, позволяя успешно противодействовать перекисному окислению липидов (уровень ТБК-активных продуктов остается неизменным), сохраняя функциональные свойства нервных клеток, в том числе и пептид-содержащих, чувствительных к действию АФК [30]. В клетках гепатопанкреаса, в случае экспериментальной гипергликемии, речь идет об усилении анаболических процессов. Косвенным указанием на это служит наблюдаемое повышение содержания общего белка и уменьшение содержания ТБК-активных продуктов, что выражается в неизменности активности Se-ГП, СОД и количества Г-SH. Схожие рассуждения применимы и в отношении различий между уровнями антиокислительной защиты: выше в нервной ткани, как отражение процессов окисления энергетических субстратов, и ниже в гепатопанкреасе, как результат преимущественно анаболической активности.
У легочных моллюсков состояние гипергликемии (возрастание уровня глюкозы в гемолимфе, но не в ткани нервных ганглиев) может быть индуцировано путем создания гипоксии и связано с действием центрального гипергликемического фактора, вырабатываемого клетками церебральных ганглиев, как это отмечено для Lymnaea stagnalis [28], Megalobulimus oblongus [31] и Otala lactea [32]. При этом уровень глюкозы в гемолимфе нормализуется лишь после возврата к нормоксии [28, 31], т.е. фактически при интенсификации легочного дыхания. Это может указывать на способность глюкозы напрямую инициировать ответы со стороны нервных клеток, в том числе и не входящих в состав пищевой нейронной сети [33]. С другой стороны, образование и последующее постепенное накопление АФК в нервной ткани, вероятно, ограничивают дыхательную активность моллюсков, т.к. снижение общего свободно-радикального фона ассоциируется с усилением легочной респирации у Lymnaea stagnalis [34].
ЗАКЛЮЧЕНИЕ
Нарушение глюкозного гомеостаза выступает в качестве триггера ответных реакций в организме беспозвоночных. Кратковременные, быстропроходящие сдвиги концентрации глюкозы в гемолимфе моллюска Lymnaea stagnalis приводят к усилению антиокислительной защиты в клетках центральных нервных ганглиев, но не затрагивают антиоксидантный статус ткани гепатопанкреаса. Рассмотренные особенности могут быть связаны с различием в уровне обмена между тканями, отражая интенсивное потребление глюкозы нервными клетками, что выражается в усилении окислительных процессов, сопровождаемых компенсаторным увеличением активности антиокислительной системы нейронов.
Список литературы
Tups A., Benzler J., Sergi D., Ladyman S.R., Williams L.M. Central regulation of glucose homeostasis. Comp. Physiol. C. 7: 741–764. 2017.
Routh V.H. Glucose sensing neurons in the ventromedial hypothalamus. Sensors. 10: 9002–9025. 2010.
Гусев Е.И., Скворцова В.И. Ишемия головного мозга. М. 2001. [Gusev E.I., Skvortsova V.I. Ishemiya golovnogo mozga. [Brain ischemia] M. 2001 (in Russ)].
Levin B.E. Neuronal glucose sensing: still a physiological orphan? Cell metabolism. 6: 252–254. 2007.
Veldhuijzen J.P. Effects of different kinds of food, starvation and restart of feeding on the haemolymph-glucose of the pond snail Lymnaea stagnalis. Neth. J. Zool. 25: 89–102. 1974.
Каранова М.В. Сезонные изменения содержания свободных редуцирующих углеводов жидкостей тела пресноводного моллюска Lymnaea stagnalis. Известия Росс. акад. наук. Сер. биол. (4): 470–475. 2006. [Karanova M.V. Seasonal variation in the content of free reducing sugars in body fluids of freshwater mollusk Lymnaea stagnalis. Biol. Bull. 33: 382–386. 2006].
Shevelkin A.V. Facilitation of defense reactions during the consumption of food in snails: the participation of glucose and gastrin/cholecystokinin-like peptide. Neurosci. Behav. Physiol. 24: 115–124. 1994.
Кузнецова Л.А., Плеснева С.А., Чистякова О.В., Шпаков А.О., Бондарева В.М., Перцева М.Н. Стрептозотоциновая модель сахарного диабета у моллюска Anodonta cygnea: функциональное состояние аденилатциклазного сигнального механизма действия пептидов инсулинового суперсемейства и их влияние на ферменты углеводного обмена. Ж. эвол. биохим. и физиол. 43(6): 460–467. 2007. [Kuznetsova L.A., Plesneva S.A., Chistyakova O.V., Shpakov A.O., Bondareva V.M., Pertseva M.N. Streptozotocin model of diabetes mellitus in the mollusc Anodonta cygnea: functional state of the adenylyl cyclase mechanisms of action of insulin superfamily peptides and their effect on carbohydrate metabolism enzymes. J. Evol. Biochem. Physiol. 43(6): 460–467. 2007].
Шпаков А.О., Кузнецова Л.А., Плеснева С.А., Перцева М.Н. Динамика изменений функционального состояния гормончувствительной аденилатциклазной системы в тканях брюхоногих моллюсков в стрептозотониновой модели диабета. Бюл. эксп. биол. и мед. 146(10): 404–408. 2008. [Shpakov A.O., Kuznetsova L.A., Plesneva S.A., Pertseva M.N. Variations in functional activity of the hormone-sensitive adenylate cyclase system in tissues of gastropod mollusks with streptozotocin-induced diabetes. Bull Exp Biol Med. 146(4): 424–428. 2008].
Shpakov A.O., Kuznetsova L.A., Plesneva S.A., Pertseva M.N. Variations in functional activity of the hormone-sensitive adenylate cyclase system in tissues of gastropod mollusks with streptozotocin-induced diabetes. Bull. Exp. Biol. Med. 146(4): 424–428. 2008.
Finkel T. Oxygen radicals and signalling. Curr. Biol. 10: 248–253. 1998.
Kostyuk V.A., Potapovich A.I. Superoxide-driven oxidation of quercetin and a simple assay for determination of superoxide dismutase. Biochem. Int. 19: 1117–1124. 1989.
Flohe L., Cunzler W.A. Assays of glutathione peroxidase. Methods Enzymol. 105: 114–126. 1984.
Habeeb A.F. Reaction of protein sulfhydryl groups with Ellman’s reagent. Methods Enzymol. 25: 457–464. 1972.
Костюк В.А., Потапович А.И. Определение продуктов перекисного окисления липидов с помощью тиобарбитуловой кислоты в анаэробных условиях. Вопр. мед. химии. 33: 115–118. 1987. [Kostiuk V.A., Potapovich A.I. Determination of lipid peroxidation products using thiobarbituric acid in anaerobic states. Vopr. Med. Khim. 33: 115–118. 1987 (in Russ)].
Bradford M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. 72: 248–254. 1976.
Гланц С. Медико-биологическая статистика. М. 1998. [Glantz S. Primer of Biostatistics. NY: McGraw-Hill, Inс. 1994. (Russ Ed. Glants S. Mediko-biologicheskaya statistika. M. 1998)].
Шаденко В.Н., Сидоров А.В. Индукция экспериментальной гипергликемии у моллюска Lymnaea stagnalis при инкубации животных в высококонцентрированном растворе глюкозы. Журнал Белорусского государственного университета. Биология. 1: 79–84. 2019. [Shadenko V.N., Sidorov A.V. Induction of experimental hyperglycemia in mollusc Lymnaea stagnalis after animal’s incubation in high-concentrated glucose solution. Journal of the Belarusian State University. Biology. 1: 79–84. 2019 (in Russ)].
Van Aardt W.J. Quantitative aspects of the water balance in Lymnaea stagnalis (L.). Neth. J. Zool. 18: 253–312. 1967.
Smit A.B., Vreugenhil E., Ebberink R.H.M., Geraerts W.P.M., Klootwijk J., Joosse J. Growth controlling molluscan neurons produce the precursor of an insulin-related peptide. Nature. 331: 535–538. 1988.
Geraerts W.P.M. Control of growth by the neurosecretory hormone of the light green cells in the freshwater snail Lymnaea stagnalis. Gen. Comp. Endocrinol. 29: 61–67. 1976.
Kits K.S., Bobeldijk R.C., Crest M., Lodder J.C. Glucose-induced excitation in molluscan central neurons producing insulin-related peptides. Pflugers Arch. 417: 597–604. 1991.
Floyd P.D., Li L., Rubakhin S.S., Sweedler J.V., Horn C.C., Kupfermann I., Alexeeva V.Y., Ellis T.A., Dembrow N.C., Weiss K.R., Vilim F.S. Insulin prohormone processing, distribution, and relation to metabolism in Aplysia californica. J. Neurosci. 19: 7732–7741. 1999.
Jonas E.A., Knox R.J., Kaczmarek L.K., Schwartz J.H., Salomon D.H. Insulin receptor in Aplysia neurons: characterization, molecular cloning and modulation of ion currents. J. Neurosci. 16: 1645–1658. 1996.
Murakami J., Okada R., Sadamoto H., Kobayashi S., Mita K., Sakamoto Y., Yamagishi M., Hatakeyama D., Otsuka E., Okuta A., Sunada H., Takigami S., Sakakibara M., Fujito Y., Awaji M., Moriyama S., Lukowiak K., Ito E. Involvement of insulin-like peptide in long-term synaptic plasticity and long-term memory of the pond snail Lymnaea stagnalis. J. Neurosci. 33: 371–383. 2013.
Bailey C.H., Kandel E.R., Harris K.M. Structural Components of Synaptic Plasticity and Memory Consolidation. Cold Spring Harb. Perspect. Biol. 7: a021758. 2015.
Dickson B.J. Wiring the brain with insulin. Science. 300(5618): 440–441. 2003.
Kits K.S., de Vries N.J., Ebberink R.H.M. Molluscan insulin-related peptide promotes neurite outgrowth in dissociated neuron cultures. Neurosci. Lett. 109: 253–259. 1990.
Hemminga M.A., Maaskant J.J., van der Plas J., Gabbott P.A. The hyperglycemic factor of the CNS of the freshwater snail Lymnaea stagnalis: interaction with glucose stimulation of glycogen synthesis and evidence for its release during anaerobiosis. Gen. Comp. Endocrinol. 59: 301–307. 1985.
Гостюхина О.Л., Андреенко Т.И. Элементы низкомолекулярного звена антиоксидантной защиты в тканях черноморского моллюска Anadara kagoshimensis Bruguiere. Ж. эвол. биохим. и физиол. 51(4): 236–242. 2015. [Gostyukhina O.L., Andreenko T.I. Low molecular weight components of antioxidative defense system in the Black Sea mollusk Anadara Kagoshimensis Brugùiere. J. Evol. Biochem. Physiol. 51(4): 271–278. 2015].
Sidorov A.V. Effect of hydrogen peroxide on electrical coupling between identified Lymnaea neurones. Invert. Neurosci. 12(1): 63–68. 2012.
De Fraga L.S., Da Silva R.S., Achaval M., Zancan D.M. Carbohydrate metabolism in the central nervous system of the Megalobulimus oblongus snail during anoxia exposure and post-anoxia recovery. J. Exp. Zool. A Comp. Exp. Biol. 301: 968–978. 2004.
Abdraba A.M., Saleuddin A.S. A putative hyperglycemic factor from the cerebral ganglia of Otala lactea (Mollusca: Pulmonata). J. Comp. Physiol. B. 170: 219–224. 2000.
Alania M., Dyakonova V., Sakharov D.A. Hyperpolarization by glucose of feeding-related neurons in snail. Acta Biol. Hung. 55: 195–200. 2004.
Сидоров А.В., Маслова Г.Т. Состояние антиокислительной защиты в центральных нервных ганглиях моллюска Lymnaea stagnalis при модуляции активности NO-ергической системы. Ж. эвол. биохим. и физиол. 44(5): 453–458. 2008. [Sidorov A.V., Maslova G.T. State of antioxidative protection in central nervous ganglia of the mollusc Lymnaea stagnalis at modulation of activity of the NO-ergic system. J. Evol. Biochem. Physiol. 44(5): 435–441. 2008].
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


