Журнал эволюционной биохимии и физиологии, 2020, T. 56, № 3, стр. 197-206
ВЛИЯНИЕ ИНТРАНАЗАЛЬНО ВВОДИМЫХ ИНСУЛИНА И С-ПЕПТИДА НА АКТИВНОСТЬ АМФ-АКТИВИРУЕМОЙ ПРОТЕИНКИНАЗЫ, МИТОХОНДРИАЛЬНУЮ ДИНАМИКУ И МАРКЕРЫ АПОПТОЗА В ГИПОТАЛАМУСЕ КРЫС СО СТРЕПТОЗОТОЦИНОВЫМ ДИАБЕТОМ
К. В. Деркач 1, И. И. Зорина 1, И. О. Захарова 1, Н. Е. Басова 1, А. А. Бахтюков 1, А. О. Шпаков 1, *
1 Федеральное государственное бюджетное учреждение науки Институт эволюционной физиологии и биохимии
им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
* E-mail: alex_shpakov@list.ru
Поступила в редакцию 22.10.2019
После доработки 26.11.2019
Принята к публикации 10.12.2019
Аннотация
Важнейшими факторами, ведущими к развитию диабетической энцефалопатии при сахарном диабете 1-го типа (СД1), являются нарушения энергетического обмена и митохондриальной динамики и активация апоптотических процессов в нейронах мозга, что во многом обусловлено дефицитом инсулина и С-пептида в ЦНС. При этом дисфункции гипоталамических нейронов при СД1 приводят к нарушению пищевого поведения и центральной регуляции энергетического обмена. Одним из подходов для компенсации дефицита инсулина и С-пептида в мозге является их интраназальное введение, но его влияние на функциональное состояние гипоталамических нейронов в настоящее время мало изучено. Целью работы было изучить влияние интраназально вводимых инсулина и С-пептида на активность АМФ-активируемой протеинкиназы (AMPK) и на экспрессию Drp-1 и митофузинов (Mfn-1 и -2), ответственных за биогенез митохондрий, про- и антиапоптотических белков Bax и Bcl-2, ассоциированного с аутофагией белка Beclin-1 и меланокортиновых рецепторов (МКР) в гипоталамусе самцов крыс с СД1, вызванным инъекцией 50 мг/кг стрептозотоцина. Исследовали семидневное интраназальное введение диабетическим крысам (Д) инсулина (20 мкг/крыса/день, ДИ), С-пептида (36 мкг/крыса/день, ДС) и инсулина совместно с С-пептидом в дозах 12 и 36 мкг/крыса/день (ДИС12, ДИС36). В гипоталамусе крыс групп ДИ и ДИС36 отмечали нормализацию активности AMPK и соотношения Bax/Bcl-2, повышенных при СД1, восстановление экспрессии Drp-1, Mfn-2 и Beclin-1, а также усиление экспрессии МКР 4-го типа, ответственного за передачу анорексигенных сигналов, что было ассоциировано с ослаблением гиперфагии в этих группах. В группах ДИС12 и ДС восстанавливающие эффекты лечения были выражены слабее. Таким образом, интраназально вводимые инсулин и С-пептид, в наибольшей степени при введении в молярном соотношении 1:3, восстанавливают энергетический баланс и митохондриальную динамику и подавляют проапоптотические процессы в гипоталамусе крыс с тяжелой формой СД1, что лежит в основе их нейропротекторного действия.
ВВЕДЕНИЕ
В процессе эволюции пептидов инсулинового суперсемейства у высших позвоночных сформировались два основных их представителя – инсулин и инсулиноподобный фактор роста-1 (ИФР-1), которые имеют сходные рецепторы и внутриклеточные сигнальные каскады, хотя и различаются по своим физиологическим функциям и регуляторным свойствам в организме [1, 2]. Основным отличием инсулина от ИФР-1 является то, что в ходе посттрансляционного процессинга молекулы проинсулина происходит ее сайт-специфичный гидролиз, что приводит к образованию молекулы инсулина, состоящего из соединенных посредством дисульфидных связей А- и В-цепей, и молекулы С‑пептида, в то время как в случае про-ИФР-1 С‑цепь сохраняется в составе зрелой молекулы ИФР-1, соединяя в ней A- и B-цепи. Сразу после открытия С-пептида проинсулина начались исследования по изучению его возможной роли в регуляции физиологических и биохимических процессов в организме человека и других позвоночных животных. В результате было показано, что С-пептид наделен сигнальными функциями и осуществляет свои регуляторные эффекты через специфичные к нему рецепторы [3, 4], одним из которых является сопряженный с гетеротримерными G-белками рецептор GPR146 [5, 6]. Показано также, что С-пептид способен усиливать регуляторные эффекты инсулина, способствуя дезагрегации его олигомерных комплексов и тем самым повышая доступность инсулина для функционального взаимодействия с инсулиновыми рецепторами [7–9].
Поскольку в ходе посттрансляционного процессинга молекулы проинсулина в β-клетках поджелудочной железы С-пептид синтезируется в соотношении 1:1 к инсулину, то в условиях сахарного диабета 1-го типа (СД1), наряду с дефицитом инсулина, возникает и острый недостаток С-пептида, причем как на периферии, так и в ЦНС. Одним из осложнений СД1 является диабетическая энцефалопатия, которая характеризуется нейродегенеративными изменениями в различных структурах мозга, снижением когнитивного дефицита и нарушением центральной регуляции физиологических функций [10]. Основными триггерами нейродегенеративных процессов являются гипергликемия и дефицит инсулина, в том числе снижение его уровня в мозге, что вызывает повышение экспрессии и активности провоспалительных и проапоптотических факторов, нарушает митохондриальную динамику, индуцирует стресс эндоплазматического ретикулума в нейронах и глиальных клетках [11–13]. Поскольку при СД1 уровень С-пептида в мозге также снижается, то это может в еще большей степени усугубить ослабление инсулиновых сигнальных путей в ЦНС, а также снизить активность зависимых от С-пептида сигнальных каскадов в нейронах, глии и клетках эндотелия сосудов головного мозга. В соответствии с вышесказанным, одним из перспективных путей предотвращения диабетической энцефалопатии при СД1 является одновременное повышение внутримозгового уровня не только инсулина, но и С-пептида. Для этого в наибольшей степени подходит интраназальный способ их введения, который для С-пептида был апробирован нами ранее на различных моделях СД у крыс [14, 15], а для инсулина широко применяется для коррекции диабетической энцефалопатии и других нейродегенеративных заболеваний [16–18].
Мишенями инсулина в ЦНС являются АМФ-активируемая протеинкиназа (AMPK), важнейший энергетический сенсор клетки [19, 20], а также белки, вовлеченные в митохондриальную динамику и апоптотические процессы, в том числе динамин-подобный белок-1 (dynamin-related protein 1, Drp-1), контролирующий процесс деления митохондрий, и митофузины (Mfn), ответственные за процесс их слияния [21]. Имеются данные о том, что в условиях СД1 экспрессия и активность AMPK и митохондриальных белков в различных структурах мозга меняются [21–23], причем в случае AMPK эти изменения существенно отличаются от выявляемых на периферии [23–25]. Показано также, что в условиях СД1 в структурах мозга усиливается экспрессия проапоптотического белка Bax и снижается экспрессия антиапоптотического белка Bcl-2, что приводит к снижению выживаемости нейронов мозга [26]. Наряду с Mfn и белком Bcl-2 важную роль в повышении выживаемости нейронов играет белок Beclin-1, который регулирует в них процессы аутофагии [27, 28]. Следует, однако, отметить, что в гипоталамусе грызунов с СД1 экспрессия и функциональное состояние белков, контролирующих энергетический баланс гипоталамических нейронов, их митохондриальную динамику и апоптоз, практически не изучены. Не исследовано воздействие на них интраназально вводимого инсулина и С-пептида, а также их влияние на сигнальные каскады, отвечающие за регуляцию энергетического гомеостаза, в том числе меланокортиновых сигнальных путей.
Цель работы состояла в изучении влияния интраназально вводимых инсулина и С-пептида, в том числе при их совместном введении, на активность AMPK и экспрессию белков Drp-1, Mfn-1 и Mfn-2, ответственных за митохондриальную динамику, биохимических маркеров апоптоза и аутофагии – проапоптотического белка Bax, антиапоптотического белка Bcl-2 и индуктора аутофагии белка Beclin-1, а также на экспрессию меланокортиновых рецепторов (МКР) в гипоталамусе крыс с тяжелой формой стрептозотоцинового СД1.
МАТЕРИАЛ И МЕТОДИКА
Исследование проводили на трехмесячных самцах крыс линии Wistar, которым для индукции СД1 однократно внутрибрюшинно, в дозе 50 мг/кг, вводили стрептозотоцин (Sigma, США), растворенный в 0.1 М натрий-цитратном буфере (pH 4.5). Через 5 нед отбирали диабетических крыс с уровнем постпрандиальной глюкозы выше 15 ммоль/л. Для исследования формировали шесть групп животных (во всех n = 6): (1) контроль (К), (2) диабет (Д), (3) диабет с обработкой интраназально вводимым инсулином (ИИ) в дозе 20 мкг/крысу/день (ДИ), (4) С-пептидом в дозе 36 мкг/крысу/день (ДС36), (5) совместно инсулином и С-пептидом в дозах 20 и 36 мкг/крысу/день (ДИС36), (6) совместно инсулином и С-пептидом в дозах 20 и 12 мкг/крысу/день (ДИС12). Продолжительность введения препаратов составила 7 дней, контрольные крысы в те же сроки интраназально получали физиологический раствор. Для оценки гликемического статуса до начала и после окончания воздействия проводили измерение уровней постпрандиальной глюкозы и гликированного гемоглобина (HbA1c), используя тест-полоски One Touch Ultra (США) и набор Multi Test HbA1c System (Polymer Technology Systems, США). Уровень инсулина в крови оценивали с помощью набора Rat Insulin ELISA (Mercodia, Швеция). В конце эксперимента животных декапитировали под наркозом и забирали у них образцы гипоталамуса для изучения активности AMPK (по степени фосфорилирования) и экспрессии целевых генов и белков. На протяжении всего эксперимента у крыс оценивали массу тела и объем потребляемой пищи (в ккал/крыса/день).
Для оценки экспрессии митохондриальных и апоптотических белков (Drp-1, Mfn-1, Mfn-2, Bax, Bcl-2), а также фосфорилирования α-субъединиц AMPK по Thr172 и Ser485/491 использовали вестерн-блоттинг, для чего образцы тканей гипоталамуса гомогенизировали (1:20) в 20 мМ Tris-HCl-буфере (pH 6.8), содержащем 25 мМ ЭДТА, 0.1% Triton X-100, ингибиторы протеаз и фосфатаз, как описано ранее [29]. Гомогенат центрифугировали (100 g, 10 мин), к супернатанту добавляли 200 мМ Tris-HCl-буфер (pH 6.8), содержащий 400 мМ β-меркаптоэтанол, 4% SDS, 40% глицерин и 0.01% бромфеноловый синий (в соотношении 1:3). После нагревания (95° С, 3 мин) пробы разделяли в 8.5 – 14%-ном полиакриламидном геле в зависимости от анализируемого белка и переносили на нитроцеллюлозную мембрану (0.45 мкм, Bio-Rad, США). Далее мембраны в течение 1 ч обрабатывали 5%-ным раствором сухого обезжиренного молока в TBS–Tween-20-буфере (pH 7.6), после чего их в течение ночи при 4 °С инкубировали с первичными антителами Anti-AMPK-α2 (1:2000) (Novus Biologicals, USA), Anti-phospho-AMPK-α1/2(Thr172) (1:1000), Anti-phospho-AMPK-α1(Ser485)/α2(Ser491) (1:1000), Anti-Mfn-2 (1:1000), Anti-Drp-1 (1:1000), Anti-GAPDH (1:2000) (Cell Signaling Technology, США), Anti-Mfn-1 (1 мкг/мл) (Abcam, США). В качестве вторичных антител использовали Goat anti-rabbit IgG HRP (1:5000) (Cell Signaling Technology, США). Для выявления меченных антителами белков применяли набор для иммунохемилюминесценции “Novex ECL Reagents” (Invitrogen, США).
Экспрессию генов оценивали с помощью количественной ПЦР с обратной транскрипцией, как описано ранее [29], для чего из гипоталамуса выделяли тотальную РНК с помощью TRIzol Reagent (США). Кодирующую ДНК получали с помощью набора “MMLV RT Kit” (Евроген, Россия). Амплификацию проводили в смеси, содержащей 10 нг обратно транскрибированного продукта, по 0.4 мкМ прямого и обратного праймеров, используя среду qPCRmix-HS SYBR+LowROX (Евроген, Россия). Сигнал детектировали, используя амплификатор 7500 Real-Time PCR System (Thermo Fisher Scientific Inc., США). Экспрессию генов, кодирующих Drp-1, Mfn-1, Mfn-2, Bax, Bcl-2, Beclin-1, МКР 3-го и 4-го типов, определяли с помощью следующих праймеров: Drp-1 – GCTCAGTGCTGGAAAGCCTA (For) и ACTCCATTTTCTTCTCCTGTTGT (Rev); Mfn-1 – CTGGTGGAGATACAGGGCTAC (For) и ACAGCATTGCGTTGATGACA (Rev); Mfn-2 – ATGTCAAAGGGTACCTGTCCA (For) и CAATCCCAGATGGCAGAACTT (Rev); Bax – TAGCAAACTGGTGCTCAAGG (For) и TCTTGGATCCAGACAAGCAG (Rev); Bcl-2 – TAGCAAACTGGTGCTCAAGG (For) и TCTTGGATCCAGACAAGCAG (Rev); Beclin-1 – TTCAAGAT-CCTGGACCGAGTGAC (For) и AGACACCATCC-TGGCGAGTTTC (Rev); Mc3r – CAGCACATGGATAATATCTTCGACTCT (For) и GGCAATGGCCAGGAGGTT (Rev); Mc4r – TGGGTGTCATAAGCCTGTTGG (For) и GCGTCCGTGTCCGTACTG (Rev). В качестве референсного использовали ген 18S rRNA – GGACACGGACAGGATTGACA (For) и ACCCACGGAATCGAGAAAGA (Rev). Полученные данные рассчитывали с помощью метода delta-delta Ct [30].
Статистический анализ полученных данных проводили с помощью программы “Microsoft Office Excel 2007”. Данные представляли как M ± SEM. Нормальность распределения проверяли с помощью критерия Шапиро–Уилка. Для сравнения двух выборок с нормальным распределением использовали t-критерий Стьюдента, для сравнения трех и более групп – дисперсионный анализ с поправкой Бонферрони. Статистически значимыми считали отличия при уровне значимости p < 0.05.
РЕЗУЛЬТАТЫ
У диабетических крыс содержание постпрандиальной глюкозы и гликированного гемоглобина (HbA1c) было достоверно выше, чем в контроле, в то время как интраназальное введение им инсулина отдельно и в сочетании с С-пептидом улучшало эти показатели, причем содержание HbA1c в крови крыс группы ДИС36 было достоверно снижено в сравнении с группой Д (табл. 1). При этом все варианты обработки диабетических животных существенно не влияли на массу тела, сниженную в условиях СД1, и на острый дефицит инсулина (табл. 1).
Таблица 1.
Масса тела, потребление пищи и уровни глюкозы, гликированного гемоглобина и инсулина в крови крыс с СД1 и влияние на эти показатели обработки животных интраназально вводимыми инсулином и С-пептидом Table 1. Body weight, food intake and blood levels of glucose, glycated hemoglobin and insulin in rats with T1DM, as affected by intranasally administered insulin and C-peptide
| К/C | Д/D | ДИ/DI | ДС36/DC36 | ДИС36/DIC36 | ДИС12/DIC12 | |
|---|---|---|---|---|---|---|
| Масса тела, г/Body weight, g | 331 ± 6 | 278 ± 9* | 293 ± 10* | 281 ± 11* | 297 ± 12* | 288 ± 8* |
| Глюкоза, мМ/Glucose, mM | 4.7 ± 0.2 | 20.7 ± 1.7* | 17.3 ± 1.8* | 20.1 ± 1.5* | 16.7 ± 1.5* | 18.5 ± 1.4* |
| HbA1c, % | 4.3 ± 0.2 | 10.1 ± 0.6* | 8.2 ± 0.4* | 9.2 ± 0.5* | 7.7 ± 0.6*# | 8.8 ± 0.5* |
| Инсулин, нг/мл/Insulin, ng/mL | 0.72 ± 0.10 | 0.18 ± 0.03* | 0.17 ± 0.02* | 0.16 ± 0.03* | 0.19 ± 0.04* | 0.22 ± 0.04* |
| Потребление пищи, ккал/крыса/день/Food intake, kcal/rat/day | 64.6 ± 2.4 | 89.4 ± 5.2* | 74.0 ± 3.0 | 80.2 ± 2.4* | 69.2 ± 2.2# | 73.2 ± 2.0*# |
Примечание. * – различия с контрольной группой статистически значимы при p < 0.05; # – различия с группой Д статистически значимы при p < 0.05. Данные представлены как M ± SEM, n = 6. /Note. * – differences vs. control group are statistically significant at p < 0.05; # – differences vs. group D are statistically significant at p < 0.05. Data presented as M ± SEM, n = 6.
При изучении экспрессии мРНК митохондриальных белков и их количества было показано, что в гипоталамусе диабетических крыс без лечения экспрессия белка Drp-1, ответственного за деление митохондрий, повышается, в то время как экспрессия Mfn, ответственных за их слияние, напротив, снижается, причем различия между группами К и Д в случае экспрессии гена Drp-1 и количества белка Mfn-2 были статистически значимыми (табл. 2). В гипоталамусе крыс группы Д достоверно повышались как количество проапоптотического белка Bax, так и уровень экспрессии мРНК для гена Bax, результатом чего было повышение соотношения Bax/Bcl-2. Наряду с этим снижалась экспрессия мРНК для гена, кодирующего индуцирующий аутофагию белок Beclin-1 (табл. 2). Все эти данные свидетельствуют об активации апоптоза и нарушении митохондриальной динамики в гипоталамических нейронах в условиях тяжелой формы СД1. Интраназальное введение инсулина восстанавливало экспрессию генов Drp-1 и Mfn-2, повышало экспрессию гена антиапоптотического белка Bcl-2, тем самым нормализуя соотношение Bax/Bcl-2 (табл. 2). Еще более выраженный эффект оказывало введение совместно инсулина и С-пептида, которые были взяты в молярном соотношении 1:3. В группе ДИС36 нормализовалось соотношение про- и антиапоптотических белков Bax и Bcl-2, частично восстанавливалась экспрессия мРНК для гена Beclin-1. Количество белка Drp-1 в группе ДИС36 снижалось до контрольного уровня, а экспрессия гена Drp-1 становилась ниже ее значений в контроле. В группе ДИС12, где соотношение инсулина и С-пептида было эквимолярным, и в группе ДС36, которой вводили один С-пептид, также отмечали восстановление соотношения Bax/Bcl-2, экспрессии белка Drp-1 и кодирующего его гена, а также экспрессии генов Mfn-2 и Beclin-1, но эти эффекты были выражены слабее, чем в группе ДИС36 (табл. 2).
Таблица 2.
Экспрессия мРНК по данным количественной ПЦР и количество белка по данным вестерн-блоттинга для митохондриальных белков Drp-1, Mfn-1 и Mfn-2, про- и антиапоптотических белков Bax и Bcl-2 и стимулятора аутофагии белка Beclin-1 в гипоталамусе крыс с СД1 и влияние на них обработки инсулином и С-пептидом Table 2. mRNA expression, as evaluated by quantitative PCR, and protein levels, as determined by Western blotting for mitochondrial proteins Drp-1, Mfn-1 and Mfn-2, pro- and anti-apoptotic proteins Bax and Bcl-2, and autophagy-stimulating protein Beclin-1, in the hypothalamus of rats with T1DM, as affected by intranasal administration of insulin and C-peptide
| К/C | Д/D | ДИ/DI | ДС36/DC36 | ДИС36/DIC36 | ДИС12/DIC12 | |
|---|---|---|---|---|---|---|
| Экспрессия мРНК, RQ/Expression of mRNA, RQ | ||||||
| Drp-1 | 0.97 ± 0.07 | 1.33 ± 0.09* | 0.71 ± 0.09# | 0.92 ± 0.08# | 0.55 ± 0.05*# | 0.72 ± 0.11# |
| Mfn-1 | 1.01 ± 0.08 | 0.83 ± 0.11 | 1.02 ± 0.10 | 0.79 ± 0.14 | 0.93 ± 0.11 | 0.87 ± 0.17 |
| Mfn-2 | 1.04 ± 0.08 | 0.77 ± 0.11 | 1.30 ± 0.07# | 1.08 ± 0.11 | 1.00 ± 0.11 | 1.05 ± 0.17 |
| Beclin-1 | 1.02 ± 0.10 | 0.46 ± 0.05* | 0.68 ± 0.09 | 0.74 ± 0.12 | 0.74 ± 0.08# | 0.77 ± 0.08# |
| Bax | 1.01 ± 0.13 | 1.56 ± 0.14* | 1.14 ± 0.17 | 0.80 ± 0.05# | 0.58 ± 0.08*# | 0.89 ± 0.10# |
| Bcl-2 | 1.02 ± 0.11 | 0.71 ± 0.08 | 1.30 ± 0.19# | 0.77 ± 0.11 | 0.67 ± 0.03* | 0.90 ± 0.19 |
| Bax/Bcl-2 | 0.98 ± 0.04 | 2.24 ± 0.24* | 0.92 ± 0.13# | 1.11 ± 0.16# | 0.86 ± 0.12# | 1.07 ± 0.14# |
| Экспрессия белка, отн. ед./Protein expression, rel. units | ||||||
| Drp-1 | 1.04 ± 0.08 | 1.23 ± 0.02 | 1.00 ± 0.09 | 0.96 ± 0.06# | 0.98 ± 0.09# | 1.05 ± 0.08 |
| Мfn-1 | 0.73 ± 0.03 | 0.62 ± 0.04 | 0.68 ± 0.02 | 0.64 ± 0.04 | 0.63 ± 0.05 | 0.62 ± 0.04 |
| Мfn-2 | 0.92 ± 0.04 | 0.76 ± 0.03* | 0.82 ± 0.03 | 0.78 ± 0.04 | 0.78 ± 0.04 | 0.77 ± 0.04 |
| Bax | 0.91 ± 0.04 | 1.14 ± 0.07* | 0.99 ± 0.11 | 1.00 ± 0.10 | 0.88 ± 0.06 | 0.93 ± 0.09 |
| Bcl-2 | 1.20 ± 0.10 | 0.97 ± 0.03 | 1.05 ± 0.05 | 1.09 ± 0.06 | 1.14 ± 0.03# | 1.08 ± 0.06 |
| Bax/Bcl-2 | 0.77 ± 0.04 | 1.19 ± 0.10* | 0.95 ± 0.10 | 0.91 ± 0.04 | 0.77 ± 0.04# | 0.86 ± 0.07 |
Примечание. * – различия с контрольной группой статистически значимы при p < 0.05; # – различия с группой Д статистически значимы при p < 0.05. Данные представлены как M ± SЕМ, n = 6.
Note. * – differences vs. control group are statistically significant at p < 0.05; # – differences vs. group D are statistically significant at p < 0.05. Data presented as M ± SEM, n = 6.
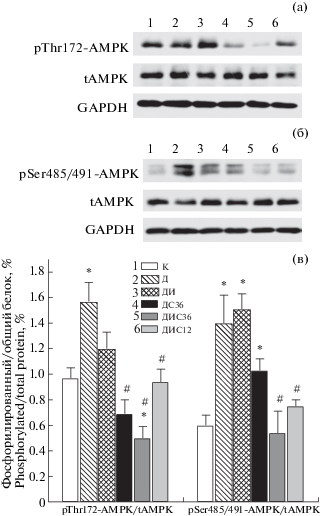
Одной из ключевых причин снижения выживаемости гипоталамических нейронов и нарушений в них митохондриальной динамики является изменение активности AMPK, основного энергетического сенсора клеток. Нами показано, что в условиях СД1 активность AMPK в гипоталамусе повышается, на что указывает достоверное повышение “стимулирующего” фосфорилирования α-субъединиц фермента по остатку Thr172. При этом, однако, повышается и “модулирующее” активность AMPK фосфорилирование ее α1/α2-субъединиц по остатку Ser485/491, что можно рассматривать как компенсаторный механизм, направленный на ослабление гиперактивации фермента (рис. 1). При обработке диабетических крыс инсулином отмечали тенденцию к снижению Thr172-фосфорилирования при сохранении Ser485/491-фосфорилирования AMPK, что может в конечном итоге приводить к некоторому снижению гиперактивации фермента. Во всех группах, которым вводили С‑пептид, отмечали статистически значимое снижение Thr172-фосфорилирования, а в группах ДИС36 и ДИС12 также сопряженное с этим снижение Ser485/491-фосфорилирования (рис. 1). В группе ДИС36 активность AMPK снижалась даже ниже контрольных значений (рис. 1).
Рис. 1.
Степень фосфорилирования α1/α2-субъединиц AMPK по остаткам Thr172 и Ser485/491 в гипоталамусе крыс с СД1 и влияние на них обработки инсулином и С-пептидом.
а – иммуноблоттинг с использованием антител против Thr172-фосфорилированных α-субъединиц AMPK и их нефосфорилированных форм; б – иммуноблоттинг с использованием антител против Ser485/491-фосфорилированных α1/α2-субъединиц AMPK и их нефосфорилированных форм; в – гистограммы для соотношений фосфорилированных и нефосфорилированных форм AMPK. Уровни экспрессии α-субъединиц AMPK нормированы по сигналу для глицеральдегидфосфатдегидрогеназы (GAPDH). * – различия с контрольной группой статистически значимы при p < 0.05; # – различия с группой Д статистически значимы при p < 0.05. Значения представлены как M ± SEM, n = 6.
Принятые на рисунках 1а и 1б сокращения: 1 – контрольная группа (К); 2 – диабетическая група (Д); 3 – диабетическая группа с лечением интраназально вводимым инсулином в дозе 20 мкг/крысу/день (ДИ); 4 – с лечением интраназально вводимым С-пептидом в дозе 36 мкг/крысу/день(ДС36); 5 – с совместным лечением инсулином и С-пептидом в дозе 36 мкг/крысу/день (ДИС36); 6 – с совместным лечением инсулином и С-пептидом в дозе 12мкг/крысу/день (ДИС12).
Fig. 1. The degree of phosphorylation of AMPK α1/α2 subunits at Thr172 and Ser485/491 in the hypothalamus of rats with T1DM as affected by intranasal administration of insulin and C-peptide.
a – immunoblotting with antibodies to Thr172-phosphorylated AMPK α-subunits and their unphosphorylated forms; b – immunoblotting with antibodies to Ser485/491-phosphorylated AMPK α1/α2 subunits and their unphosphorylated forms; в – histograms of the ratio of phosphorylated to unphosphorylated AMPK forms (ordinate axes). Expression levels of AMPK α-subunits are normalized to the GAPDH signal. * – differences vs. control group are statistically significant at p < 0.05; # – differences vs. group D are statistically significant at p < 0.05. Data presented as M ± SEM, n = 6. Abbreviations in Fig. 1a and 1b: 1 – control group (C), 2 – diabetic group (D), 3 – diabetic group treated with intranasal insulin at a dose of 20 µg/rat/day (DI), 4 – diabetic group treated with intranasal C-peptide at a dose of 36 µg/rat/day (DC36), 5 – diabetic group treated with a combination of intranasal insulin and C-peptide at a dose of 36 µg/rat/day (DIC36), 6 – diabetic group treated with a combination of intranasal insulin and C-peptide at a dose of 12 µg/rat/day (DIC12).
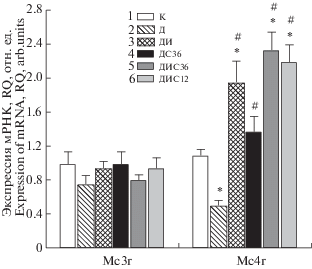
В условиях СД1 отмечается гиперфагия, что выражается в усилении потребления пищи, как показано нами в группе Д (табл. 1). Механизмами этого могут быть выявленная нами гиперактивация AMPK, вызывающая дисбаланс энергетических процессов в гипоталамических нейронах, и нарушение в них сигнальных каскадов, ответственных за пищевое поведение. Нами показано, что в гипоталамусе диабетических крыс на 54% снижается экспрессия гена Mc4r, кодирующего МКР 4-го типа, который опосредует анорексигенные эффекты меланокортиновых пептидов. У диабетических крыс, обработанных инсулином и С-пептидом, отмечали значительное повышение экспрессии гена Mc4r, причем во всех группах, получавших инсулин, она была в среднем в два раза выше, чем в группе К (рис. 2). Показана отрицательная корреляция между восстановлением экспрессии МКР 4‑го типа и потреблением пищи диабетическими крысами (табл. 1, рис. 2). При этом экспрессия гена Mc3r, кодирующего МКР 3-го типа, наделенного функциями ауторецептора, негативно регулирующего сигнальные пути, реализуемые через МКР 4‑го типа, при СД1 и всех изученных вариантах обработки животных существенно не менялась (рис. 2).
Рис. 2.
Экспрессия генов, кодирующих меланокортиновые рецепторы 3-го и 4-го типов, в гипоталамусе крыс с СД1 и влияние на них обработки инсулином и С-пептидом.
1 – группа К, 2 – Д, 3 – ДИ, 4 – ДС36, 5 – ДИС36, 6 – ДИС12. * – различия с контрольной группой статистически значимы при p < 0.05; # – различия с группой Д статистически значимы при p < 0.05. Значения представлены как M ± SEM, n = 6.
Fig. 2. Expression of genes encoding type 3 and 4 melanocortin receptors in the hypothalamus of rats with T1DM as affected by intranasal administration of insulin and C-peptide.
1 – group C, 2 – D, 3 – DI, 4 – DC36, 5 – DIC36, 6 – DIC12. * – differences vs. control group are statistically significant at p < 0.05; # – differences vs. group D are statistically significant at p < 0.05. Data presented as M ± SEM, n = 6.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Ранее нами было показано, что интраназальное введение крысам инсулина как отдельно, так и в смеси с С-пептидом влияет на метаболические показатели, хотя и в небольшой степени, ослабляет гипергликемию [14, 15, 31]. В настоящем исследовании нами показано, что среди изученных подходов лечения тяжелой формы СД1 значимое ослабление гипергликемии, оцениваемое по снижению уровня гликированного гемоглобина, достигалось только при совместном введении инсулина и С-пептида в соотношении 1:3. В этой связи необходимо отметить, что в условиях метаболических расстройств интраназальное введение инсулина в большей степени влияет на функции нервной и нейроэндокринной систем, чем на периферический глюкозный гомеостаз, и это является преимуществом применения интраназально вводимого инсулина, поскольку оно не приводит к развитию характерных для инъекционного инсулина гипогликемических эпизодов, представляющих опасность для жизни пациентов и способных усугубить дисфункции ЦНС при СД1 [11, 32]. Установлено, что интраназально вводимый инсулин распределяется в ЦНС и практически не поступает в периферический кровоток [17, 18], а выявленное нами в группе ДИС36 улучшение гликемического статуса обусловлено центральными механизмами его действия, в том числе, как можно полагать, активация инсулиновых путей в ЦНС опосредует ингибирование продукции глюкозы гепатоцитами [18].
Определенный вклад в ослабление гипергликемии может вносить ослабление гиперфагии у диабетических животных, как это показано в группах ДИС36 и ДИС12 (табл. 1). Одними из причин этого являются изменения в гипоталамических сигнальных путях, ответственных за регуляцию пищевого поведения. Нами впервые установлено, что у диабетических крыс при их обработке одним С-пептидом восстанавливалась сниженная при СД1 экспрессия гена, кодирующего МКР 4-го типа, через который реализуются анорексигенные влияния α-меланоцитстимулирующего гормона и других пептидов меланокортинового семейства. Более того, обработка крыс интраназально вводимым инсулином, как отдельно, так и совместно с С-пептидом повышала экспрессию гена Mc4r выше ее уровня в контроле, что было ассоциировано со снижением потребления пищи. В то же время масса тела у обработанных таким образом животных не только не снижалась, но и имела тенденцию к повышению, что может быть следствием улучшения энергетического обмена.
Общепринято, что активность гипоталамических систем, контролирующих пищевое поведение и метаболические процессы на периферии, зависит от функционального состояния митохондрий, энергетического статуса, активности апоптотических процессов и стресса эндоплазматического ретикулума в гипоталамических нейронах [25]. Полученные нами данные демонстрируют, что эти показатели в значительной степени меняются в гипоталамусе крыс с СД1 и в различной степени восстанавливаются при интраназальном введении инсулина и С-пептида.
Исключительно важную роль играет выявленная нами нормализация повышенной в условиях СД1 активности AMPK в гипоталамических нейронах диабетических крыс при их обработке С‑пептидом и его комбинацией с инсулином. В отличие от периферии, где в условиях СД1 активность AMPK снижается, в ЦНС, включая гипоталамус, наблюдается обратная картина. Гиперактивация AMPK обусловлена снижением уровня АТФ и усилением активности провоспалительных и гипоксических факторов в тканях мозга при СД1 и других метаболических расстройствах, результатом чего являются нарушения функций гипоталамических нейронов [23]. Показано, что повышение активности AMPK является одним из факторов, индуцирующих гиперфагию у крыс со стрептозотоциновым СД1 [24]. Следует, однако, учитывать, что наряду с повышением “стимулирующего” Thr172-фосфорилирования α-субъединиц AMPK усиливается и их “модулирующее” Ser485/491-фосфорилирование, что может в определенной степени ослаблять гиперактивацию AMPK. Так, в группах ДИС36 и ДИС12 Thr172-фосфорилирование снижается, по сравнению с группой Д, на 56 и 40%, а Ser485/491-фосфорилирование – на 61 и 46% соответственно (рис. 1).
Нами показано, что в гипоталамусе диабетических крыс повышается экспрессия белка Drp-1, который активирует процессы деления и фрагментации митохондрий, снижается экспрессия митофузинов, ответственных за слияние митохондрий и их укрупнение, повышается соотношение проаптототического белка Bax к антиапоптотическому белку Bcl-2, что указывает на усиление в гипоталамических нейронах апоптотических процессов, а также снижается экспрессия мРНК для белка Beclin-1, являющегося индуктором аутофагии. Эти данные свидетельствуют о запуске целого ряда механизмов, снижающих выживаемость гипоталамических нейронов при СД1, что хорошо согласуется с результатами, полученными другими авторами [21, 22, 26, 33]. Так, имеются данные о значительном повышении экспрессии белка Drp-1 в ЦНС в условиях нейродегенеративных заболеваний, в том числе ассоциированных с СД1, причем повышение уровня Drp-1 тесно связано с активацией в нейронах апоптотических и воспалительных процессов [21]. Значительное повышение экспрессии мРНК для гена Drp1 и количества белка Drp-1 обнаружено во фронтальной коре и гиппокампе мышей с тяжелой формой СД1 [22]. В условиях диабетической энцефалопатии, ишемии/реперфузии головного мозга и других нейродегенеративных заболеваний снижается экспрессия Mfn-1 и Mfn-2 – белков с ГТФазной активностью, которые ответственны за слияние внешних мембран митохондрий и обеспечивают их интегративные взаимодействия и обмен генетическим материалом [21, 22, 33]. Снижение экспрессии и функциональной активности митофузинов в гипоталамических нейронах влечет за собой усиление в них стресса эндоплазматического ретикулума и апоптоза и, как следствие, нарушение гипоталамической регуляции энергетического обмена [22, 34–36]. В структурах мозга при СД1 усиливается экспрессия проапоптотического белка Bax и одновременно с этим снижается экспрессия антиапоптотического белка Bcl-2, что приводит к повышению соотношения Bax/Bcl-2, запуску апоптотических каскадов и снижению выживаемости нейронов [26]. В различных структурах мозга в условиях стрептозотоцинового СД1 и других заболеваний, сопровождающихся активацией нейродегенеративных процессов, подавляется экспрессия белка Beclin-1, являющегося одним из индукторов аутофагии – одного из молекулярных механизмов, защищающих нейроны от апоптоза [27, 37].
Фармакологическое восстановление в ЦНС экспрессии и функциональной активности белков, вовлеченных в митохондриальную динамику и контроль выживаемости, в том числе при системном применении инсулина, может в значительной степени предотвратить развитие диабетической энцефалопатии. Так, нормализация экспрессии Bax и Bcl-2 в мозге животных с СД1 и нейродегенеративными заболеваниями с помощью инъекционного инсулина и фармакологических препаратов с нейропротекторной активностью подавляло апоптоз нейронов и глиальных клеток и предотвращало диабетическую энцефалопатию и развитие когнитивного дефицита [35, 38–40]. Обработка крыс с СД1 инъекционным инсулином или коэнзимом Q10 за 24 и 72 ч перед ишемией/реперфузией восстанавливала интрацеребральный уровень Mfn-2, сниженный у диабетических крыс без такой обработки [33]. Все вышесказанное свидетельствует о том, что инсулиновый дефицит в ЦНС является одним из факторов, хотя и не единственным, провоцирующим развитие нейродегенеративных процессов в мозге при СД1. Для его компенсации может быть использован интраназально вводимый инсулин, в том числе в смеси с С-пептидом, действие которого на экспрессию митохондриальных и апоптотических белков в гипоталамусе, как при диабетической энцефалопатии, так и при других нейродегенеративных расстройствах, остается не изученным. Имеется только одно исследование, авторы которого при четырехнедельном интраназальном введении инсулина старым мышам с когнитивным дефицитом выявили нормализацию у них экспрессии Bcl-2 в гиппокампе, что было ассоциировано с восстановлением когнитивных функций [41].
Нами показано, что лечение крыс с тяжелым СД1 интраназально вводимым инсулином, а также смесью инсулина и С-пептида в соотношении 1:3 восстанавливало соотношение Bax/Bcl-2, экспрессию гена Beclin-1 и экспрессию митохондриальных белков – Drp-1 и Mfn-2 (табл. 2). Важно отметить, что смесь инсулина и С-пептида, взятых в эквимолярном соотношении, была менее эффективной, хотя и улучшала показатели экспрессии белков, вовлеченных в митохондриальный биогенез, регуляцию апоптоза и аутофагии. Как можно полагать, это обусловлено влиянием соотношения между инсулином и С-пептидом на стабильность гомоолигомерных комплексов инсулина, в которых инсулин менее доступен для функционального взаимодействия с инсулиновым рецептором. Так, показано, что в присутствии С-пептида гомоолигомерные комплексы инсулина подвергаются структурным изменениям и(или) диссоциации, генерируя тем самым гетероолигомерные комплексы инсулина и С-пептида или мономерные формы инсулина, которые более эффективно взаимодействуют с инсулиновыми рецепторами [7–9]. Эффективность определенных соотношений инсулина и С-пептида зависит от степени их недостаточности в ЦНС при СД и других метаболических расстройствах. Тот факт, что лечение одним С-пептидом приводило к нормализации активности AMPK, восстанавливало экспрессию Drp-1 и соотношение Bax/Bcl-2, свидетельствует о том, что С-пептид, образуя комплексы с “остаточным” эндогенным инсулином, может усиливать его сигнальные пути в гипоталамусе и(или) способен самостоятельно активировать нейропротекторные каскады в гипоталамических нейронах.
Усиление регуляторных эффектов инсулина при образовании его комплекса с С-пептидом может быть обусловлено взаимодополняемостью этих молекул, обусловленной эволюцией пептидов инсулинового суперсемейства. В случае ИФР-1 эта взаимодополняемость приводит к тому, что последовательность, соответствующая C-пептиду, сохраняется в молекуле ИФР-1 и функционально важна для его специфической активности [2]. Важно отметить, что аффинность ИФР-1 к рецептору ИФР-1 выше, чем аффинность инсулина к рецептору инсулина, что, возможно, объясняется совмещением в молекуле ИФР-1 структуры инсулина и С-пептида. Присутствие последовательности С‑пептида в молекуле ИФР-1, как можно полагать, обусловливает отсутствие потенцирующего влияния С-пептида проинсулина на ИФР-1-зависимый сигналинг, в то время как активность инсулиновых сигнальных путей в его присутствии усиливается [42].
Таким образом, обработка диабетических крыс интраназально вводимым инсулином и С-пептидом приводит к нормализации в гипоталамусе животных повышенной в условиях СД1 активности AMPK, нормализации соотношения между экспрессией про- и антиапоптотических белков Bax и Bcl-2, восстановлению экспрессии белков Drp-1 и Mfn-2, ответственных за митохондриальную динамику, и белка Beclin-1, индуктора аутофагии, причем наиболее эффективным было совместное введение инсулина и С-пептида в молярном соотношении 1:3. В группах крыс, обработанных инсулином и С-пептидом, ослаблялась гиперфагия, что было ассоциировано с повышением экспрессии гипоталамических МКР 4-го типа, ответственных за трансдукцию анорексигенных сигналов, генерируемых меланокортиновыми пептидами. Полученные нами данные не только предоставляют дополнительные доказательства в пользу наличия у интраназально вводимых инсулина и С-пептида выраженного нейропротекторного эффекта при СД1, но и свидетельствуют о том, что выявленное ранее их положительное влияние на метаболические показатели и функции эндокринной и нервной системы в условиях СД1, а также показанная в настоящем исследовании нормализация пищевого поведения могут быть обусловлены их способностью восстанавливать энергетику, митохондриальную динамику и выживаемость гипоталамических нейронов.
Список литературы
Pertseva M.N., Shpakov A.O. Conservatism of the insulin signaling system in evolution of invertebrates and vertebrate animals. J. Evol. Biochem. Physiol. 38 (5): 547–561. 2002. https://doi.org/10.1023/A:1022008932029
Pertseva M.N., Shpakov A.O., Plesneva S.A., Kuznetsova L.A. A novel view on the mechanisms of action of insulin and other insulin superfamily peptides: involvement of adenylyl cyclase signaling system. Comp. Biochem. Physiol. 134 (1): 11–36. 2003. https://doi.org/10.1016/s1096-4959(02)00160-4
Wahren J., Kallas A., Sima A.A. The clinical potential of C-peptide replacement in type 1 diabetes. Diabetes. 61 (4): 761–772. 2012. https://doi.org/10.2337/db11-1423
Wahren J., Larsson C. C-peptide: new findings and therapeutic possibilities. Diabetes Res. Clin. Pract. 107 (3): 309–319. 2015. https://doi.org/10.1016/j.diabres.2015.01.016
Yosten G.L., Kolar G.R., Redlinger L.J., Samson W.K. Evidence for an interaction between proinsulin C-peptide and GPR146. J. Endocrinol. 218 (2): B1–B8. 2013. https://doi.org/10.1530/JOE-13-0203.Print 2013
Brunskill N.J. C-peptide and diabetic kidney disease. J. Intern. Med. 281 (1): 41–51. 2017. https://doi.org/10.1111/joim.12548
Shafqat J., Melles E., Sigmundsson K., Johansson B.L., Ekberg K., Alvelius G., Henriksson M., Johansson J., Wahren J., Jörnvall H. Proinsulin C-peptide elicits disaggregation of insulin resulting in enhanced physiological insulin effects. Cell. Mol. Life Sci. 63 (15): 1805–1811. 2006. https://doi.org/10.1007/s00018-006-6204-6
Jornvall H., Lindahl E., Astorga-Wells J., Lind J., Holmlund A., Melles E., Alvelius G., Nerelius C., Mäler L., Johansson J. Oligomerization and insulin interactions of proinsulin C-peptide: Threefold relationships to properties of insulin. Biochem. Biophys. Res. Commun. 391 (3): 1561–1566. 2010.
Nerelius C., Alvelius G., Jörnvall H. N-terminal segment of proinsulin C-peptide active in insulin interaction/desaggregation. Biochem. Biophys. Res. Commun. 403 (3–4): 462–467. 2010.
Chen R., Shi J., Yin Q., Li X., Sheng Y., Han J., Zhuang P., Zhang Y. Morphological and Pathological Characteristics of Brain in Diabetic Encephalopathy. J. Alzheimers Dis. 65 (1): 15–28. 2018.
Rehni A.K., Nautiyal N., Perez-Pinzon M.A., Dave K.R. Hyperglycemia/hypoglycemia-induced mitochondrial dysfunction and cerebral ischemic damage in diabetics. Metab. Brain Dis. 30 (2): 437–447. 2015.
Pugazhenthi S., Qin L., Reddy P.H. Common neurodegenerative pathways in obesity, diabetes, and Alzheimer’s disease. Biochim. Biophys. Acta Mol. Basis Dis. 1863 (5): 1037–1045. 2017.
Madhavi Y.V., Gaikwad N., Yerra V.G., Kalvala A.K., Nanduri S., Kumar A. Targeting AMPK in Diabetes and Diabetic Complications: Energy homeostasis, Autophagy and Mitochondrial health. Curr. Med. Chem. 2018.
Деркач К.В., Бондарева В.М., Шпаков А.О. Совместное интраназальное введение инсулина и С-пептида проинсулина крысам с сахарным диабетом 1-го и 2‑го типов восстанавливает у них метаболические показатели. Успехи геронтологии. 30 (6): 851–858. 2017. [Derkach K.V., Bondareva V.M., Shpakov A.O. Coadministration of intranasally delivered insulin and proinsulin C-peptide to rats with the types 1 and 2 diabetes mellitus restores their metabolic parameters. Advances in Gerontology. 8 (2): 139–146. 2018.]
Деркач К.В., Бондарева В.М., Перминова А.А., Шпаков А.О. С-пептид и инсулин при совместном введении улучшают метаболические показатели и активность аденилатциклазной системы в гипоталамусе, миокарде и эпидидимальном жире крыс с диабетом 2-го типа. Цитология. 61 (2): 139–149. 2019. [Derkach K.V., Bondareva V.M., Perminova A.A., Shpakov A.O. C-peptide and insulin during combined intranasal administration improve the metabolic parameters and activity of the adenylate cyclase system in the hypothalamus, myocardium, and epididymal fat of rats with type 2 diabetes. Cell Tissue Biol. 13 (3): 228–236. 2019.]
Francis G.J., Martinez J.A., Liu W.Q., Xu K., Ayer A., Fine J., Tuor U.I., Glazner G., Hanson L.R., Frey W.H., Toth C. Intranasal insulin prevents cognitive decline, cerebral atrophy and white matter changes in murine type I diabetic encephalopathy. Brain. 131 (12): 3311–3334. 2008.
Chen J., Hu L., Yang G., Hu Q. Current Therapeutic Strategy in the Nasal Delivery of Insulin: Recent Advances and Future Directions. Curr. Pharm. Biotechnol. 19 (5): 400–415. 2018.
Santiago J.C.P., Hallschmid M. Outcomes and clinical implications of intranasal insulin administration to the central nervous system. Exp. Neurol. 317: 180–190. 2019.
Huynh M.K., Kinyua A.W., Yang D.J., Kim K.W. Hypothalamic AMPK as a Regulator of Energy Homeostasis. Neural Plast. 2016: 2754078. 2016. https://doi.org/10.1155/2016/2754078
Neumann D., Viollet B. AMP-Activated Protein Kinase Signalling. Int. J. Mol. Sci. 20 (3): pii: E766. 2019.
Bertholet A.M., Delerue T., Millet A.M., Moulis M.F., David C., Daloyau M., Arnauné-Pelloquin L., Davezac N., Mils V., Miquel M.C., Rojo M., Belenguer P. Mitochondrial fusion/fission dynamics in neurodegeneration and neuronal plasticity. Neurobiol. Dis. 90: 3–19. 2016.
Chen C., Wang Y., Zhang J., Ma L., Gu J., Ho G. Contribution of neural cell death to depressive phenotypes of streptozotocin-induced diabetic mice. Dis. Model Mech. 7 (6): 723–730. 2014.
Wang B., Cheng K.K. Hypothalamic AMPK as a Mediator of Hormonal Regulation of Energy Balance. Int. J. Mol. Sci. 19 (11): pii: E3552. 2018.
Namkoong C., Kim M.S., Jang P.G., Han S.M., Park H.S., Koh E.H., Lee W.J., Kim J.Y., Park I.S., Park J.Y. Enhanced hypothalamic AMP-activated protein kinase activity contributes to hyperphagia in diabetic rats. Diabetes. 54 (1): 63–68. 2005.
Park S., Kim D.S., Kang S., Shin B.K. Chronic activation of central AMPK attenuates glucose-stimulated insulin secretion and exacerbates hepatic insulin resistance in diabetic rats. Brain Res. Bull. 108: 18–26. 2014.
Soleymaninejad M., Joursaraei S.G., Feizi F., Jafari Anarkooli I. The Effects of Lycopene and Insulin on Histological Changes and the Expression Level of Bcl-2 Family Genes in the Hippocampus of Streptozotocin-Induced Diabetic Rats. J. Diabetes Res. 2017: 4650939. 2017.
Fang L., Li X., Zhong Y., Yu J., Yu L., Dai H., Yan M. Autophagy protects human brain microvascular endothelial cells against methylglyoxal-induced injuries, reproducible in a cerebral ischemic model in diabetic rats. J. Neurochem. 135 (2): 431–440. 2015.
Shi B., Ma M., Zheng Y., Pan Y., Lin X. mTOR and Beclin1: Two key autophagy-related molecules and their roles in myocardial ischemia/reperfusion injury. J. Cell. Physiol. 234 (8): 12562–12568. 2019.
Derkach K., Zakharova I., Zorina I., Bakhtyukov A., Romanova I., Bayunova L., Shpakov A. The evidence of metabolic-improving effect of metformin in Ay/a mice with genetically-induced melanocortin obesity and the contribution of hypothalamic mechanisms to this effect. PLOS One. 14 (3): e0213779. 2019.
Schmittgen T.D., Livak K.J. Analyzing real-time PCR data by the comparative C (T) method. Nat. Protoc. 3 (6): 1101–1108. 2008.
Деркач К.В., Шпакова Е.А., Бондарева В.М., Шпаков А.О. Влияние интраназально вводимых С-пептида проинсулина и его С-концевого фрагмента на метаболические показатели у крыс со стрептозотоциновым диабетом. Журн. эвол. биохим. физиол. 54 (3): 212–214. 2018. [Derkach K.V., Shpakova E.A., Bon-dareva V.M., Shpakov A.O. The effect of intranasal administration of proinsulin C-peptide and its C-terminal fragment on metabolic parameters in rats with streptozotocin diabetes. J. Evol. Biochem. Physiol. 54 (3): 242–245. 2018.]
Mohseni S. Neurologic damage in hypoglycemia. Handb. Clin. Neurol. 126: 513–532. 2014.
Lu C.J., Guo Y.Z., Zhang Y., Yang L., Chang Y., Zhang J.W., Jing L., Zhang J.Z. Coenzyme Q10 ameliorates cerebral ischemia reperfusion injury in hyperglycemic rats. Pathol. Res. Pract. 213 (9): 1191–1199. 2017.
Schneeberger M., Dietrich M.O., Sebastián D., Imbernón M., Castaño C., Garcia A., Esteban Y., Gonzalez-Franquesa A., Rodríguez I.C., Bortolozzi A., Garcia-Roves P.M., Gomis R., Nogueiras R., Horvath T.L., Zorzano A., Claret M. Mitofusin 2 in POMC neurons connects ER stress with leptin resistance and energy imbalance. Cell. 155 (1): 172–187. 2013.
Diaz B., Fuentes-Mera L., Tovar A., Montiel T., Massieu L., Martínez-Rodríguez H.G., Camacho A. Saturated lipids decrease mitofusin 2 leading to endoplasmic reticulum stress activation and insulin resistance in hypothalamic cells. Brain Res. 1627: 80–89. 2015.
Ramírez S., Gómez-Valadés A.G., Schneeberger M., Varela L., Haddad-Tóvolli R., Altirriba J., Noguera E., Drougard A., Flores-Martínez Á., Imbernón M., Chivite I., Pozo M., Vidal-Itriago A., Garcia A., Cervantes S., Gasa R., Nogueiras R., Gama-Pérez P., Garcia-Roves P.M., Cano D.A., Knauf C., Servitja J.M., Horvath T.L., Gomis R., Zorzano A., Claret M. Mitochondrial Dynamics Mediated by Mitofusin 1 Is Required for POMC Neuron Glucose-Sensing and Insulin Release Control. Cell. Metab. 25 (6): 1390–1399. 2017.
Guan Z.F., Zhou X.L., Zhang X.M., Zhang Y., Wang Y.M., Guo Q.L., Ji G., Wu G.F., Wang N.N., Yang H., Yu Z.Y., Zhou H.G., Guo J.C., Liu Y.C. Beclin-1-mediated autophagy may be involved in the elderly cognitive and affective disorders in streptozotocin-induced diabetic mice. Transl. Neurodegener. 5: 22. 2016.
Guo Y.J., Wang S.H., Yuan Y., Li F.F., Ye K.P., Huang Y., Xia W.Q., Zhou Y. Vulnerability for apoptosis in the hippocampal dentate gyrus of STZ-induced diabetic rats with cognitive impairment. J. Endocrinol. Invest. 37 (1): 87–96. 2014.
Tian Z., Wang J., Xu M., Wang Y., Zhang M., Zhou Y. Resveratrol Improves Cognitive Impairment by Regulating Apoptosis and Synaptic Plasticity in Streptozotocin-Induced Diabetic Rats. Cell. Physiol. Biochem. 40 (6): 1670–1677. 2016.
Sanna R.S., Muthangi S., Sagar C., Devi S.A. Grape seed proanthocyanidin extract and insulin prevents cognitive decline in type 1 diabetic rat by impacting Bcl-2 and Bax in the prefrontal cortex. Metab. Brain Dis. 34 (1): 103–117. 2019.
Apostolatos A., Song S., Acosta S., Peart M., Watson J.E., Bickford P., Cooper D.R., Patel N.A. Insulin promotes neuronal survival via the alternatively spliced protein kinase CδII isoform. J. Biol. Chem. 287 (12): 9299–9310. 2012.
Li Z.G., Zhang W., Sima A.A. C-peptide enhances insulin-mediated cell growth and protection against high glucose-induced apoptosis in SH-SY5Y cells. Diabetes Metab. Res. Rev. 19 (5): 375–385. 2003.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


