Журнал эволюционной биохимии и физиологии, 2020, T. 56, № 3, стр. 232-244
ДЕЙСТВИЕ АЛЬФА-ТОКОФЕРОЛА НА ЖИЗНЕСПОСОБНОСТЬ КЛЕТОК PC12 ПРИ ОКИСЛИТЕЛЬНОМ СТРЕССЕ И ЭКСПРЕССИЮ ГЕНОВ ПРО- И АНТИАПОПТОТИЧЕСКИХ БЕЛКОВ МИТОХОНДРИЙ, SOD2 И ФАКТОРОВ ТРАНСКРИПЦИИ NRF-1, NRF-2 И TFAM
И. О. Захарова 1, А. О. Ахметшина 1, Л. В. Баюнова 1, Л. Р. Кижаева 1, Н. Ф. Аврова 1, *
1 Федеральное государственное бюджетное учреждение науки Институт эволюционной физиологии и биохимии
им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
* E-mail: avrova@iephb.ru
Поступила в редакцию 08.11.2019
После доработки 09.12.2019
Принята к публикации 16.01.2020
Аннотация
Показано, что альфа-токоферол (альфа-Т) при длительной (18 ч) преинкубации с ним достоверно повышает жизнеспособность клеток нейрональной линии РС12, подвергнутых окислительному стрессу, в микромолярных и наномолярных концентрациях; а при 30-минутной преинкубации он эффективен только в микромолярных концентрациях. Методом полимеразной цепной реакции в реальном времени (RT-PCR) показано, что перекись водорода в большей мере увеличивает в клетках PC12 экспрессию проапоптотического белка Bax, чем антиапоптотического белка Bcl-xL. Напротив, преинкубация клеток с альфа-Т до действия перекиси водорода увеличивает экспрессию Bcl-xL, не меняя экспрессию Bax, что, очевидно, способствует нормализации под влиянием альфа-Т отношения Bax/Bcl-xL в клетках РС12, увеличенного при действии прооксиданта. Найдено, что альфа-Т достоверно увеличивает экспрессию обладающих разнообразными функциями, в частности, активирующих биогенез митохондрий, факторов транскрипции NRF-2 и TFAM (но не NRF-1) в контрольных клетках PC12; кроме того, он снижает в них отношение Bax/Bcl-xL, что показано методом иммуноблоттинга. При этом перекись водорода и преинкубация с альфа-Т не вызывали достоверных изменений в экспрессии NRF-1, NRF-2 и TFAM в клетках PC12. Преинкубация с альфа-Т повышает экспрессию супероксиддисмутазы 2 (SOD2) в клетках PC12 на более ранних сроках после добавления перекиси водорода, чем при действии одного прооксиданта. Таким образом, в защитный эффект альфа-Т на клетки PC12 при окислительном стрессе, по-видимому, вносят вклад нормализация отношения Bаx/Bcl-xL и сравнительно раннее увеличение экспрессии SOD2. Увеличение альфа-Т экспрессии NRF-2 и TFAM в контрольных клетках РС12 позволяет предполагать небольшое усиление им процесса биогенеза митохондрий. Но в условиях окислительного стресса, для которого характерен дефицит макроэргов, активации под влиянием альфа-Т энергоемкого процесса биогенеза митохондрий в клетках РС12 не выявлено.
ВВЕДЕНИЕ
Одной из основных причин гибели нервных клеток при ишемических, нейродегенеративных и травматических поражениях мозга является чрезмерная активация свободнорадикальных реакций в нервных и других клетках мозга. Для мозга характерно очень высокое потребление кислорода. Его структуры особенно чувствительны к интенсификации свободнорадикальных реакций и обладают слабой способностью к регенерации [1, 2]. Нарушения равновесия между процессами образования свободных радикалов и способностью систем антиоксидантной защиты нейтрализовать или ослаблять их действие в конечном итоге приводят к разрушению белков, липидов и ДНК в клетках [3–5]. Активные формы кислорода (АФК) генерируются в различных органеллах клетки, но основным источником свободных радикалов считаются митохондрии [3, 6]. Митохондрии – не только источники энергии, в них синтезируется большая часть АТФ, но их можно рассматривать и как центры регуляции продукции АФК и клеточной гибели в результате некроза, апоптоза или аутофагии [7–9]. Нарушения функциональной активности митохондрий нервных клеток являются, как предполагают, скорее причиной нейродегенеративных заболеваний, а не их следствием [см., например, 10–11].
Альфа-Т является одним из компонентов витамина Е. Всего в состав этого витамина входят 8 соединений: альфа-, бета-, гамма- и дельта-токоферолы и альфа-, бета-, гамма- и дельта-токотриенолы. Все они обладают антиоксидантными свойствами и способностью модулировать сигнальные пути в клетках. Но альфа-Т является преобладающей формой витамина Е в организме животных и человека. В исследованиях, посвященных изучению механизма действия витамина Е, предпочитают использовать альфа-Т (а не витамин Е), т.к. это позволяет получать воспроизводимые результаты. При использовании же смеси разных токоферолов и токотриенолов из растительных источников достичь воспроизводимости результатов значительно труднее.
Альфа-Т представляет собой не только основной, но и наиболее активный компонент витамина Е. Альфа-Т и другие составляющие витамина Е могут непосредственно реагировать со свободными радикалами и превращать их в соединения, не имеющие неспаренного электрона. Этот эффект альфа-Т особенно ярко проявляется при короткой преинкубации с ним до индукции окислительного стресса в клетках. Механизм защитного действия альфа-Т и других компонентов витамина Е на клетки является сложным, его изучение необходимо для их успешного применения в клинической практике. Важную роль в защитном эффекте этих соединений играет модуляция ими активности сигнальных путей и уровня экспрессии генов [12–19]. Воздействие альфа-Т и сходных соединений приводит к стабилизации митохондрий и нормализации их функций, что способствует предотвращению нарушений метаболизма и функций других клеточных органелл. Одним из важных показателей стабильности митохондрий является отношение в клетках проапоптотического белка Bax к антиапоптотическому белку Bcl-2 или Bcl-xL.
Повышение жизнеспособности клеток, в частности нейронов, может быть и результатом усиления экспрессии таких транскрипционных факторов, как ядерный респираторный фактор 1 (NRF-1), ядерный респираторный фактор 2 (NRF-2), митохондриальный транскрипционный фактор А (TFAM) и коактиватор PGC-1 (PRC) [20–22]. Они осуществляют регуляцию транскрипции и репликации митохондриальной ДНК; усиливают экспрессию генов рецепторов ряда медиаторов; осуществляют координацию транскрипции ядерных и митохондриальных генов, участвующих в синтезе белков митохондрий, в том числе белков дыхательной цепи, регулируют взаимосвязь между нейрональной активностью и энергетическим метаболизмом; способствуют усилению биогенеза митохондрий [23–27]. Увеличение числа митохондрий при усилении их биогенеза повышает количество АТФ, синтезируемого клетками, что может приводить к предотвращению энергодефицита, к повышению жизнеспособности отдельных клеток и организма в целом. Но при этом сам процесс биогенеза митохондрий является весьма энергозатратным.
По современным представлениям митохондрии не являются статичными. Они вовлечены в процессы деления и слияния, что важно для удаления деполяризованных митохондрий, и в процессы митохондриального биогенеза, приводящие к созданию новых митохондрий [28–30]. Биогенез митохондрий – это сложнейший процесс, требующий согласованной транскрипции генов в ядре и небольшого количества генов мтДНК, ответственных за синтез белков митохондрий. Транскрипционным факторам NRF-1, NRF-2, TFAM и PGC-1alpha принадлежит важная роль в координации работы двух геномов. Данных о действии альфа-Т на экспрессию этих факторов транскрипции в первичных культурах нейронов или в клетках нейрональных линий в литературе нам не встретилось.
Целью нашей работы является изучение влияния альфа-Т и перекиси водорода на экспрессию про- и антиапоптотических белков (Bax и Bcl-xL соответственно), факторов транскрипции TFAM, NRF-1 и NRF-2 и PGC-1alpha и одного из ферментов антиоксидантной защиты – митохондриальной супероксиддисмутазы (SOD2) – в клетках нейрональной линии PC12 в норме и в условиях окислительного стресса, используя метод полимеразной цепной реакции в реальном времени (RT-PCR).
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
2.1. Материалы. В опытах использовали перекись водорода, альфа-Т фирмы Sigma (США), ингибитор РНКаз фирмы Синтол (Россия), реактив TRI Reagent (Molecular Research Center, Inc., США), PCR-микс 2.5х реакционную смесь (Синтол, Россия). Среда инкубации DMEM с L-глутамином, сыворотка крови плодов коровы, пенициллин, стрептомицин куплены у фирмы Биолот (Россия). Сыворотка крови плодов коровы приобретена также у фирмы HyСlone (США). Характеристика антител и других реагентов, использовавшихся в опытах с применением метода иммуноблоттинга, приведены в соответствующем разделе.
2.2. Условия культивирования клеток линии PC12. Исследования проводили на клетках PC12 (АТСС). Это клетки феохромоцитомной линии, происходящие из адренергических нейронов мозгового вещества надпочечников крыс. Клетки данной линии проявляют нейрональные свойства и широко используются для изучения процессов, происходящих в клетках нервной системы. Клетки выращивались в ростовой среде DMEM с глутамином (Биолот), содержащей 15% сыворотки крови плодов коровы (HyClone, США), пенициллин (100 ед/мл) и стрептомицин (100 мкг/мл) (Биолот, Россия) в СО2-инкубаторе (концентрация СО2 5%, температура 37°С). Для проведения опытов использовали ту же среду, но содержащую 10% сыворотки крови плодов коровы (Биолот, Россия). Опыты начинали через 24 ч после посева клеток [30]. Для изучения цитотоксичности перекиси водорода и защитного эффекта альфа-Т на клетки PC12 эти клетки высеивали в 24-луночные планшеты в количестве 2–3 × × 105/лунку. Для изучения влияния инкубации с альфа-Т на экспрессию генов белков Bax и Bcl-xL и транскрипционных факторов TFAM, NRF-1, NRF-2 в клетках PC12 эти клетки высеивали в количестве 1.8 × 106 клеток/2 мл среды/лунку в 6-луночные планшеты. Для изучения влияния 0.3 мМ перекиси водорода и преинкубации с альфа-Т на экспрессию генов вышеперечисленных белков митохондрий, транскрипционных факторов и фермента SOD2 клетки PC12 высеивали в количестве 1.1 × 106–1.4 × 106 клеток/2 мл среды/лунку в 6-луночные планшеты. При проведении этих опытов клетки PC12 преинкубировали в течение 24 ч со 100 нМ и 100 мкМ альфа-Т, затем среду в лунках меняли на свежую, добавляли перекись водорода до конечной концентрации 0.3 мМ. Уровень мРНК Bax, Bcl-xL и факторов транскрипции TFAM, NRF-1 и NRF-2alpha определяли через 12 и 24 ч после добавления к пробам перекиси водорода.
2.3. Определение цитотоксичности перекиси водорода и защитного действия альфа-Т на клетки PC12. Для определения влияния перекиси водорода и альфа-Т на жизнеспособность клеток PC12 измеряли выход лактатдегидрогеназы (ЛДГ) из разрушенных клеток в среду инкубации (ЛДГ-метод). Активность ЛДГ в среде инкубации определяли в аликвотах после центрифугирования в течение 5 мин при 200–300 g для того, чтобы избежать попадания неприкрепленных клеток. Для определения суммарной активности ЛДГ в пробах (в клетках и среде инкубации) проводили полный лизис клеток, воздействуя Тритоном X-100 в конечной концентрации 1% при комнатной температуре в течение 30 мин, затем определяли активность ЛДГ в пробах, подвергнутых лизису.
Активность ЛДГ определяли, измеряя для этих целей уровень NADH в пробах. Уменьшение оптической плотности проб регистрировали при 340 нм на спектрофотометре М 40 (Carl-Zeiss, Германия) в течение 5–6 мин, как это было ранее описано в литературе [31]. Реакцию проводили в среде следующего состава (мМ): 80 трис-HCl (pH 7.2), 200 NaCl, 1.6 пирувата, 0.2 NADH. Процент активности ЛДГ, вышедшей из клеток в среду инкубации, определяли как процент ферментативной активности в среде инкубации от общей активности фермента в пробах. Отсутствие живых клеток в пробах соответствует 100% активности ЛДГ в среде инкубации.
2.4. Экстракция РНК из клеток линии PC12. Тотальную РНК выделяли из клеток PC12, используя реактив TRI Reagent (Molecular Research Center, Inc., США) в соответствии с протоколом производителя. Выделенную РНК растворяли в воде, не содержащей ДНКаз и РНКаз (Синтол, Россия). Для повышения стабильности РНК в пробы добавляли 0.5 ед/мкл ингибитора РНКаз (Синтол, Россия). Измерение концентрации РНК проводили на спектрофотометре для микрообъемов Nanodrop TM 2000 (Thermo Fischer Scientific, США).
2.5. Обратная транскрипция. кДНК получали с помощью обратной транскрипции из 1 мкг РНК (в объеме 25 мкл) с помощью наборов ОТ-1 (Синтол, Россия) с использованием Random праймеров (1 мкл на 1 мкг РНК) и обратной транскриптазы MMLV (Синтол, Россия) – 1 мкл на 1 мкг РНК.
2.6. RT-PCR. Определение относительного уровня мРНК генов белков TFAM, NRF-1, NRF-2alpha (экспрессию NRF-2 определяли по экспрессии ее ДНК-связывающей субъединицы – NRF-2alpha), PGC-1alpha, Bax, Bcl-xL, SOD2 и GAPDH выполняли с помощью количественной RT-PCR на амплификаторе CFX96 Touch Real Time PCR System (Bio Rad Laboratories, Inc, США). Амплификация проводилась в смеси (конечный объем 25 мкл), содержащей 10 мкл PCR-микс 2.5х реакционной смеси с SYBR Green 1 (Синтол, Россия), 13.5 мкл воды, 1.1 мкл кДНК (получена обратной транскрипцией из 1 мкг РНК в объеме 25 мкл), прямой и обратный праймеры в конечной концентрации 0.8 мкМ (каждый из них добавлен в 0.2 мкл воды, лишенной РНКаз и ДНКаз). Экспрессию генов, осуществляющих синтез белков Bax, Bcl-xL, PGC-1alpha, SOD2 и GAPDH, NRF-1, NRF-2alpha, TFAM, определяли с помощью следующих праймеров:
Bax – GTTGCCCTCTTCTACTTTGC (For) и ATGGTCACTGTCTGCCATG (Rev),
Bcl-xL – AGCAGTCAGCCAGAACCCTA (For) и GAGATGGGCTCAACCAGTCC (Rev),
SOD2 – GTGGGAGTCCAAGGTTCAGG (For) и TAAGGCCTGTGGTTCCTTGC (Rev),
NRF-1 – AGAGACAGCAGACACGGTTG (For) и GCTGCGCCAACCTTAAA (Rev), NRF-2alpha – GTGGCTGAGCTCCACATGAT (For) и TCACTGCTTACCTGGGGAGA (Rev),
TFAM – TGGGCACAAGAAGCTGGTTA (For) и CATTCAGTGGGCAGAAGTC (Rev),
GAPDH – AACGGACACAGTCAAGGCTGA (For) и ACGCCAGTAGACTCCACGACAT (Rev).
Использовался следующий протокол RT-PCR-амплификации: начальная денатурация при 92°С в течение 2 мин, трехсегментная амплификация , состоящая из 35 циклов по 45 сек при 92°С (денатурация), 40 сек при 60°С (отжиг), 35 сек при 92°С (полимеризация), затем пробы однократно выдерживали при 72°С в течение 2 мин. В качестве контроля использовали ген глицеральальдегид-3-фосфатдегидрогеназы (GAPDH). Для количественной оценки экспрессии использовали метод delta-delta Ct. Экспрессию гена в пробах выражали в условных единицах, принимая его экспрессию в контрольных клетках за 1.0.
2.7. Иммуноблоттинг. Клетки PC12 лизировали в буфере, содержащем ингибиторы фосфатаз и протеаз, как это описано ранее [18], концентрацию белка в пробах определяли по методу Лоури. Пробы, содержащие равное количество белка (20–35 мкг), разделяли методом электрофореза. Для окраски мембран использовали первичные антитела к Bcl-xL (1:1000) и Вах (1:1000) (Cell Signaling Technology, США), в качестве вторичных антител – анти-кроличьи IgG (1:1000), конъюгированные с пероксидазой хрена – HRP (Cell Signaling Technology, США). Сигнал HRP усиливали реактивом ECL, приготовленным в лабораторных условиях (люминол-п-кумаровая кислота-перекись водорода). Хемилюминесцентное свечение фиксировали на фотопленке Premium X-Ray film (Phenix Research Products, США). Для нормализации данных мембраны окрашивали на альфа-тубулин (1:2000, Sigma). Проявленные фотопленки визуализировали на сканере Canon (CanoScan 8800F). Денситометрическая обработка данных проводилась с помощью программы NIH Image.
2.8. Cтатистическая обработка данных. Данные представлены в работе как среднее ± SEM. Статистическую достоверность между тремя и более группами данных рассчитывали на основании однофакторного дисперсионного анализа (ANOVA) с использованием тестов для множественных сравнений Тьюки или Даннетта (Tukey’s test или Dunnett’s test). Тест Даннетта применяется для сравнении данных двух и более групп с контрольными значениями. Для сравнения двух групп данных применяли t-критерий Стьюдента и метод попарных сравнений. Различия считали достоверными при p < 0.05.
РЕЗУЛЬТАТЫ
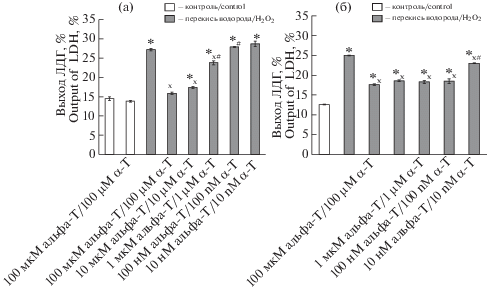
Показано, что защитный эффект альфа-Т на клетки PC12 зависит от его концентрации и от времени преинкубации с этим соединением. При короткой преинкубации (в течение 30 мин) альфа-Т повышал жизнеспособность клеток нейрональной линии PC12 в условиях окислительного стресса только в микромолярных концентрациях (рис. 1а), тогда как при действии 10 и 100 нМ альфа-Т его защитный эффект не проявлялся. А при преинкубации с ним в течение 18 ч альфа-Т оказывает на клетки РС12 защитный эффект не только в микро-, но и в наномолярных (10 и 100 нМ) концентрациях. Цитотоксический эффект перекиси водорода и защитный эффект альфа-Т оценивали по выходу ЛДГ из разрушенных клеток PC12, что характеризует степень поражения этих клеток при окислительном стрессе. При длительной преинкубации защитный эффект 100 нМ альфа-Т на жизнеспособность клеток РС12 в условиях окислительного стресса практически не отличался от эффекта различных микромолярных концентраций, а защитный эффект 10 нМ альфа-Т был достоверно ниже, чем при более высоких концентрациях этого протектора (рис. 1б).
Рис. 1.
Влияние преинкубации с альфа-Т на цитотоксичность перекиси водорода при действии на клетки РС12.
Данные представляют собой среднее ± SEM из 3 параллельных определений в типичном опыте из 4 поставленных. Клетки РС12 преинкубировали с разными концентрациями альфа-Т: а – в течение 30 мин, б – в течение 18 ч. Затем их подвергали действию 0.3 мМ перекиси водорода в течение 24 ч. Различия достоверны согласно ANOVA при использовании теста Tukey для множественных сравнений: * – по сравнению с контролем, p < 0.02, x – по сравнению с эффектом одной перекиси водорода, p < 0.02, # – по сравнению с эффектом всех более низких концентраций альфа-Т, p < 0.05.
Fig. 1. Effect of preincubation with α-tocopherol (α-T) on hydrogen peroxide cytotoxicity for PC12 cells.
Data presented as M ± SEM for 3 parallel measurements in a single typical experiment out of four. PC12 cells were preincubated with different α-T concentrations: a – for 30 min, b – for 18 h. Then, they were exposed to 0.3 mM H2O2 for 24 h. Differences are statistically significant according to ANOVA + Tukey’s multiple comparison test: * – vs. control (p < 0.02), x – vs. effect of H2O2 alone (p < 0.02), # – vs. effect of lower α-T concentrations (p < 0.05).
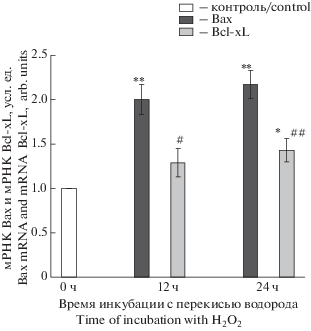
Представляло интерес выяснить влияние перекиси водорода и преинкубации с альфа-Т на экспрессию проапоптотического белка митохондрий Bax и антиапоптотического белка Bcl-xL, характерного для клеток РС12. Найдено, что перекись водорода через 12 и 24 ч после ее аппликации увеличивает уровень мРНК проапоптотического белка Bax в большей мере, чем уровень мРНК антиапоптотического белка Bcl-xL (рис. 2). Так, уровень мРНК Bax возрастал через 12 ч в 2.0 ± 0.17 раза (p < 0.01), а уровень мРНК Bcl-xL – лишь в 1.37 ± 0.16 раза (различия между возрастанием мРНК Bax и мРНК Bcl-xL достоверны, p < 0.05). Достоверно бóльшее возрастание уровня мРНК Bax, чем уровня мРНК Bcl-xL наблюдалось в клетках PC12 и при 24-часовом воздействии на них перекиси водорода (рис. 2).
Рис. 2.
Влияние перекиси водорода на уровень мРНК Bax и уровень мРНК Bcl-xL в клетках РС12, отражающие уровень экспрессии соответствующих генов.
Данные представлены как среднее ± SEM из 6 опытов. Клетки РС12 подвергали действию 0.3 мМ перекиси водорода в течение 24 ч. Уровни мРНК Bax и мРНК Bcl-xL в клетках PC12, отражающие уровни экспрессии соответствующих генов, выражали в условных единицах, принимая уровни экспрессии каждого из генов в контрольных клетках за 1.0. Различия достоверны согласно t критерию Стьюдента методом попарных сравнений: ** и * – по сравнению с контролем, * – p < 0.05, ** – p < 0.01, # и ## – по сравнению с увеличением мРНК Bax на том же сроке воздействия перекиси водорода, # – p < 0.05, ## – p < 0.01.
Fig. 2. Effect of hydrogen peroxide on Bax and Bcl-xL mRNA levels in PC12 cells which reflects expression levels of the respective genes.
Data are presented as M ± SEM for 6 experiments. PC12 cells were exposed to 0.3 mM H2O2 for 24 h. Bax and Bcl-xL mRNA levels are expressed in arbitrary units, taking individual gene expression levels in control cells for 1.0. Differences are statistically significant according to the paired Student’s t-test: * and ** – vs. control, * – p < 0.05, ** – p < 0.01; # and ## – vs. Bax mRNA increment during the same period of H2O2 exposure, # – p < 0.05, ## – p < 0.01.
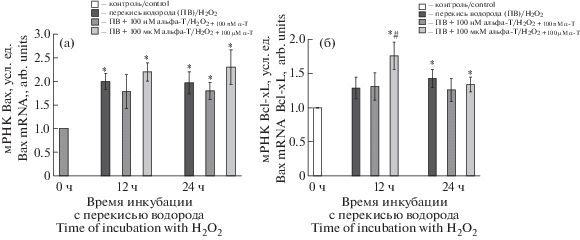
Альфа-Т, напротив, не изменял экспрессию гена Bax (рис. 3а). При этом преинкубация со 100 мкМ альфа-Т (рис. 3б) увеличивала уровень мРНК антиапоптотического белка Bcl-xL в клетках PC12 через 12 ч после добавления прооксиданта по сравнению с контролем (с 1.00 до 1.76 ± 0.23 условных единиц) и действием одной перекиси водорода (с 1.29 ± 0.16 до 1.76 ± 0.23 условных единиц). Различия в обоих случаях достоверны по t критерию Стьюдента при использовании метода попарных сравнений (p < 0.05, n = 6).
Рис. 3.
Влияние преинкубации с альфа-Т на уровень мРНК Bax и Bcl-xL мРНК в клетках РС12, подвергнутых действию перекиси водорода, через 12 ч и 24 ч после начала действия прооксиданта.
Данные представлены как среднее ± SEM из 6 опытов. Клетки РС12 преинкубировали со 100 нМ и 100 мкМ альфа-Т и затем подвергали действию 0.3 мМ перекиси водорода. Уровень Bax мРНК и Bcl-xL мРНК в пробах, характеризующий экспрессию соответствующих генов, выражали в условных единицах, принимая уровень в контрольных клетках за 1.0. Различия достоверны согласно t критерию Стьюдента при использовании метода попарных сравнений: * – по сравнению с контролем, p < 0.05, # – по сравнению с действием одной перекиси водорода в течение того же срока (12 ч), p < 0.05.
Fig. 3. Effect of preincubation with α-T on Bax mRNA and Bcl-xL mRNA levels in PC12 cells exposed to hydrogen peroxide 12 and 24 h after the onset of the prooxidant action.
Data are presented as M ± SEM for 6 experiments. PC12 cells were preincubated with 100 nM and 100 µM α-T and then exposed to 0.3 mM H2O2. Bax and Bcl-xL mRNA levels, which characterize expression levels of the respective genes, are expressed in arbitrary units, taking the control cells’ level for 1.0. Differences are statistically significant according to the paired Student’s t-test: * – vs. control, # – vs. effect of H2O2 alone during the same period (12 h), p < 0.05.
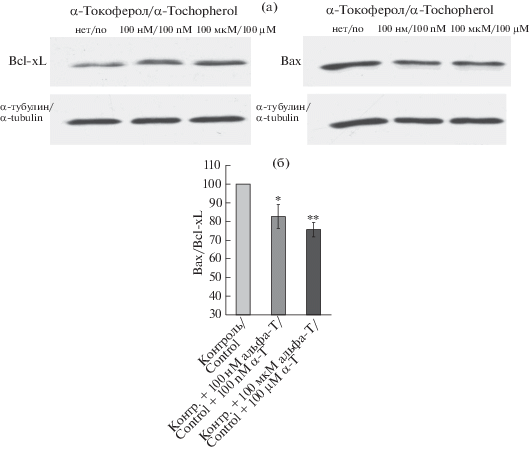
Показано также, что альфа-Т в микро- и наномолярной концентрации увеличивает в контрольных клетках PC12 уровень Bcl-xL и уменьшает уровень Bax и отношение Bax/Bcl-xL (рис. 4а и 4б), что способствует увеличению жизнеспособности клеток этой нейрональной линии. Это видно из данных иммуноблоттинга (рис. 4а). На рис. 4б показано, что преинкубации в течение 24 ч с 100 нМ и 100 мкМ альфа-Т приводит к снижению отношения Bax/Bcl-xL в клетках PC12 до 82.7 ± 6.3% и 75.6 ± 3.9% соответственно от этого соотношения в контроле, принятого за 100% (p < 0.05 и p < 0.01 соответственно, n = 7).
Рис. 4.
Влияние альфа-Т на отношение про- к антиапоптотическому белку (Bax/Bcl-xL) в контрольных клетках РС12.
Клетки РС12 инкубировали со 100 нМ и 100 мкМ альфа-Т в течение 18 ч. а – Иммуноблоты, показывающие влияние альфа-Т на содержание Bax и Bcl-xL в клетках РС12 в одном типичном опыте из 7 поставленных опытов. б – Данные представляют собой M ± SEM из 7 опытов. Содержание белков Bax и Bcl-xL нормализовали относительно альфа-тубулина и выражали в условных единицах, вычисляли отношение Bax/Bcl-xL. * и ** – различия достоверны по сравнению с контролем, принятым за 100%, согласно результатам однофакторного дисперсионного анализа (ANOVA) с использованием теста Tukey для множественных сравнений, * – p < 0.05, ** – p < 0.01.
Fig. 4. Effect of α-T on the proapoptotic to antiapoptotic protein ratio (Bax/Bcl-xL) in control PC12 cells.
PC12 cells were preincubated with 100 nM and 100 µM αT for 18 h. a – immunoblots showing the effect of α-T on Bax and Bcl-xL levels in PC12 cells in a single typical experiment out of 7. b – data are presented as M ± SEM for 7 experiments. Bax and Bcl-xL levels are normalized to α-tubulin and expressed in arbitrary units, calculating Bax/Bcl-xL. * and ** – differences are statistically significant vs. control taken for 100% according to ANOVA + Tukey’s multiple comparison test, * – p < 0.05, ** – p < 0.01.
Повышение жизнеспособности нервных клеток и клеток нейрональных линий может быть также результатом усиления экспрессии таких факторов транскрипции как NRF-1, NRF-2, TFAM и PGC-1alpha. Как указывалось во введении, этим факторам транскрипции принадлежит важная роль в регуляции клеточного метаболизма [23–27]. Проверка наличия транскрипционных факторов с помощью праймеров показала, что в клетках PC12 экспрессируются гены белков NRF-1, NRF-2 и TFAM. Экспрессию PGC-1alpha в клетках PC12 показать не удалось, хотя c помощью использованных в работе праймеров нами установлено наличие этого транскрипционного фактора в первичных культурах нейронов коры мозга. В настоящей работе изучено влияние альфа-Т на уровень экспрессии NRF-1, NRF-2 и TFAM в контрольных и подвергнутых действию перекиси водорода клетках PC12. Экспрессию NRF-2 оценивали по уровню мРНК NRF-2alpha (т.е. по экспрессии ДНК-связывающей субъединицы NRF-2alpha).
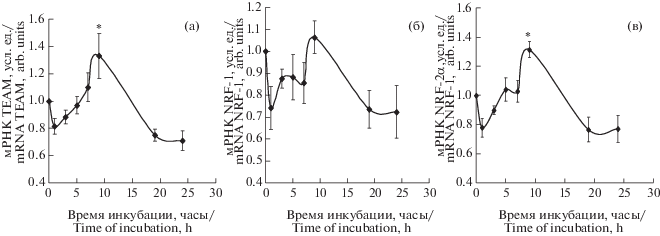
Изменение экспрессии генов факторов транскрипции TFAM, NRF-1 и NRF-2alpha (о котором судили по уровню соответствующих мРНК) в контрольных клетках РС12 через разные сроки после добавления к среде инкубации альфа-Т в конечной концентрации 100 мкМ показано на рис. 5а, 5б и 5в соответственно. При действии на клетки PC12 альфа-Т через 9 ч после его добавления в среду достоверно увеличивается экспрессия двух из трех изученных факторов транскрипции. Так, экспрессия NRF-2alpha достоверно увеличивалась с 1.00 в контроле до 1.31 ± 0.05 через 9 ч после добавления к пробам альфа-Т (p < 0.05 согласно ANOVA по тесту Даннетта для множественных сравнений, n = 6). NRF-2 контролирует экспрессию в ядре гена TFAM, который содержит в промоторе специфические последовательности для связывания с NRF-1 и NRF-2. Относительная концентрация мРНК TFAM также достоверно увеличивается в том же временном интервале (как и для NRF-2alpha) под влиянием альфа-Т с 1.0 в контроле до 1.33 ± 0.15 (p < 0.05 согласно ANOVA по тесту Даннетта, n = 6). Таким образом, выявлено небольшое, но достоверное увеличение экспрессии генов NRF-2 и TFAM, стимулирующих биогенез митохондрий, в конт-рольных клетках PC12 под влиянием альфа-Т.
Рис. 5.
Влияние альфа-Т на экспрессию генов факторов транскрипции, регулирующих биогенез митохондрий (NRF-1, NRF-2альфа и TFAM) в контрольных клетках РС12.
Данные представляют собой M ± SEM из 6 опытов. Клетки РС12 инкубировали со 100 мкМ альфа-Т от 1 ч до 24 ч. Уровни NRF-1мРНК, NRF-2альфа мРНК и TFAM мРНК выражали в условных единицах. Уровень экспрессии каждого из генов в контрольных клетках (не подвергнутых действию альфа-Т) принимали за 1.0. * – различия достоверны по сравнению с контролем согласно данным однофакторного дисперсионного анализа (ANOVA) с использованием теста Даннетта для множественных сравнений, p < 0.05.
Fig. 5. Effect of α-T on expression of genes of the transcription factors regulating mitochondrial biogenesis (NRF-1, NRF-2α and TFAM) in PC12 cells.
Data are presented as M ± SEM for 6 experiments. PC12 cells were incubated with 100 µM α-T for 1 to 24 h. NRF-1, NRF-2α and TFAM мРНК levels are expressed in arbitrary units. Expression levels of individual genes in control PC12 cells (not preincubated with α-T) are taken for 1.0. * – differences are statistically significant according to ANOVA + Dunnett’s multiple comparison test, p < 0.05.
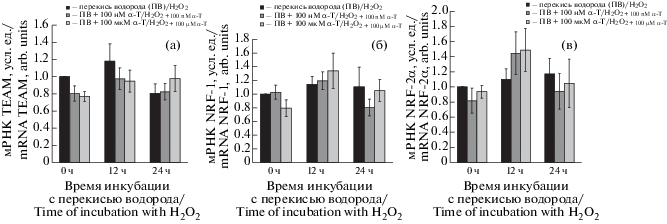
Известно, что перекись водорода способна активировать большое количество генов. Было показано влияние перекиси водорода на экспрессию факторов транскрипции, которые могут стимулировать биогенез митохондрий, и изучено влияние альфа-Т на этот процесс (рис. 6). Статистически достоверных изменений в экспрессии факторов транскрипции TFAM, NRF-1 и NRF-2, стимулирующих биогенез митохондрий, в клетках PC12 при действии на них одной перекиси водорода, либо перекиси водорода после преинкубации со 100 нМ или 100 мкМ альфа-Т выявить не удалось (рис. 6).
Рис. 6.
Влияние перекиси водорода и преинкубации с альфа-Т на экспрессию генов факторов транскрипции NRF-1, NRF-2 и TFAM в клетках РС12.
Клетки инкубировали в течение 24 ч со 100 нМ и 100 мкМ альфа-Т, затем их подвергали действию 0.3 мМ перекиси водорода в течение 24 ч. Уровни NRF-1 мРНК, NRF-2альфа мРНК и TFAM мРНК выражали в условных единицах. Уровень экспрессии каждого из генов в контрольных клетках принимали за 1.0. Не было выявлено достоверных изменений в экспрессии генов изученных факторов транскрипции под влиянием перекиси водорода или преинкубации с альфа-Т.
Fig. 6. Effect of hydrogen peroxide and preincubation with α-T on expression of genes of the transcription factors NRF-1, NRF-2 and TFAM in РС12 cells.
PC12 cells were preincubated with 100 nM and 100 µM α-T and then exposed to 0.3 mM H2O2 for 24 h. NRF-, NRF-2α and TFAM mRNA levels are expressed in arbitrary units. Expression level of each gene in PC12 cells is taken for 1.0. No statistically significant changes were revealed in expression of genes of the transcription factors under the effect of H2O2 or preincubation with α-T.
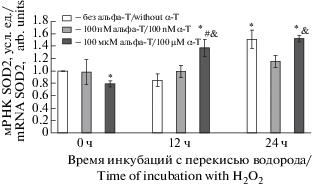
При преинкубации клеток PC12 со 100 мкМ альфа-Т наблюдалось достоверное увеличение уровня мРНК SOD2 через 12 ч после добавления прооксиданта по сравнению с эффектом одной перекиси водорода, с контролем и с контролем+100 мкМ альфа-Т (рис. 7). Сама перекись водорода также увеличивала экспрессию гена, осуществляющего биосинтез SOD2, но только на более поздних сроках после добавления прооксиданта (через 24 ч).
Рис. 7.
Влияние преинкубации с альфа-Т на уровень мРНК SOD2 в клетках РС12, подвергнутых действию перекиси водорода (через 12 ч и 24 ч после начала действия этого прооксиданта).
Данные представлены как среднее ± SEM из 6–7 опытов. Клетки РС12 преинкубировали со 100 нМ и 100 мкМ альфа-Т и затем подвергали действию 0.3 мМ перекиси водорода. Экспрессию гена в пробах выражали в условных единицах, принимая его экспрессию в контрольных клетках за 1.0. Различия достоверны согласно t критерию Стьюдента при использовании метода попарных сравнений: * – по сравнению с контролем, p < 0.05, # – по сравнению с действием одной перекиси водорода в течение того же срока (12 ч), p < 0.05, & – по сравнению с контролем + 100 мкМ альфа-Т, p < 0.01.
Fig. 7. Effect of preincubation with α-T on the SOD2 mRNA level in PC12 cells exposed to hydrogen peroxide 12 and 24 h after the onset of the prooxidant action.
Data are presented as M ± SEM for 6–7 experiments. PC12 cells were preincubated with 100 nM and 100 µM α-T and then exposed to 0.3 mM H2O2 for 24 h. Gene expression in samples are exressed in arbitrary units, taking its expression in control PC12 cells for 1.0. Differences are statistically significant according to the paired Student’s t-test: * – vs. control, p < 0.05, # – vs. effect of H2O2 alone during the same period (12 h), p < 0.05, & – vs. control + 100 µM α-T, p < 0.01.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Преинкубация с альфа-Т увеличивала жизнеспособность клеток нейрональной линии РС12, подвергнутых действию такого природного прооксиданта, как перекись водорода (рис. 1а и б), при длительной преинкубации с альфа-Т эффективным оказались не только микро-, но и наномолярные концентрации. Ранее нами было показано, что альфа-Т достоверно уменьшает апоптотическую гибель клеток РС12 [18] и нейронов коры мозга [19], вызванную действием прооксиданта, причем при длительной преинкубации с альфа-Т его эффект достоверен при действии как в микро-, так и в наномолярных концентрациях.
Защитный эффект и биологическая активность альфа-Т и других соединений, входящих в состав витамина Е, во многом обусловлены их способностью модулировать активность сигнальных путей и экспрессию генов в клетках различных органов. Так, альфа-Т при длительной преинкубации предохраняет от окислительной деструкции протеинкиназу B (Akt), уменьшает время максимальной активации протеинкиназы, регулируемой внеклеточными сигналами (ERK1/2), ингибирует активность протеинкиназы С-дельта при индукции в клетках окислительного стресса и оказывает воздействие на другие сигнальные пути в нервных и иных клетках; важную роль в повышении альфа-Т жизнеспособности клеток играет, по-видимому, изменение им уровня экспрессии генов, регулирующих обмен про- и антиапоптотических белков митохондрий [12–19].
Наряду с этим альфа-Т и другие компоненты витамина Е обладают и эффектами скэвенджеров, способных реагировать со свободными радикалами и лишать их неспаренного электрона. Одно время предполагали, что введение высоких доз этих соединений может предотвратить развитие окислительного стресса в тканях, при этом, чем больше этих соединений вводится, тем более выраженным будет позитивный эффект. Но это предположение не оправдалось. Так, широкомасштабные клинические испытания показали, что длительное введение людям с болезнями различной этиологии и в группах риска высоких доз витамина Е приводит к неблагоприятным последствиям, достоверно увеличивая смертность от разных причин по сравнению с группами людей, получавших “плацебо” [32, 33].
Интересные результаты получены нами при изучении влияния альфа-Т и перекиси водорода на экспрессию белков митохондрий Bax и Bcl-xL в клетках PC12. Оказалось, что перекись водорода в значительно большей степени повышает уровень мРНК проапоптотического белка митохондрий Bax, чем экспрессию гена антиапоптотического белка Bcl-xL, что способствует проявлению ее токсического эффекта на клетки PC12. Преинкубация со 100 мкМ альфа-Т, напротив, не влияла на экспрессию гена Bax, но достоверно увеличивала экспрессию гена антиапоптотического белка Bcl-xL (уровень мРНК Bcl-xL) в клетках PC12 через 12 ч после начала действия прооксиданта на клетки PC12. Эти результаты согласуются с данными об увеличении отношения про- к антиапоптотическому белку в клетках PC12 [34] и в нейронах коры мозга [19] под влиянием перекиси водорода и с данными о нормализации этого соотношения при действии альфа-Т [19]. Показано увеличение “индекса выживаемости” – Bcl-2/Bax (и соответственно снижение отношения Bax/Bcl-2) в нейронах (клетках-зернах) мозжечка под действием преинкубации с альфа-Т до действия прооксиданта [35]. Эти данные также согласуются с результатами, полученными в настоящей работе (рис. 4).
Данные об увеличении уровня мРНК SOD2 через 12 ч после добавления прооксиданта при преинкубации клеток PC12 с альфа-Т согласуются с представлениями о том, что альфа-Т способен модулировать экспрессию генов биосинтеза ферментов антиоксидантной защиты (в частности, SOD2 и каталазы) в клетках крови и эндотелиальных клетках [36, 37]. Показано также значительное увеличение уровня мРНК и активности фермента митохондриальной Mn-SOD (SOD2) в клетках крови крыс в результате введения им 100 и 30 мг/кг веса витамина Е дважды в неделю в течение 4 или 6 нед. [36]. Нам не встретилось такого рода работ, выполненных на нервных клетках.
Важнейшими транскрипционными факторами, регулирующими биогенез митохондрий, являются NRF-1, NRF-2, TFAM и PGC-1alpha. Проверки праймеров на данные транскрипционные факторы показала, что в клетках PC12 экспрессируются гены белков NRF-1, NRF-2 и TFAM, тогда как ген белка PGC-1alpha в этих клетках не выявляется. Функции, аналогичные PGC-1 alpha, при его отсутствии в клетках могут выполнять PGC-1 beta или PRC (соединение, обладающее свойствами коактиватора PGC-1), что, по-видимому, происходило и в нашем случае в клетках РС12. Интересно, что в литературе есть данные о том, что мыши, нокаутные по PGC-1alpha, жизнеспособны, хотя имеют ряд системных аномалий [38, 39].
Мы показали небольшое, но достоверное увеличение экспрессии мРНК NRF-2 и TFAM в контрольных клетках РС12 при действии на них 100 мкМ альфа-Т. Нами не выявлено изменения экспрессии генов транскрипционных факторов NRF-1, NRF-2 и TFAM при действии на клетки РС12 перекиси водорода или при их преинкубации с альфа-Т до действия на клетки этого прооксиданта. Данных о влиянии альфа-Т на процессы биогенеза митохондрий в нервных клетках в литературе нам не встретилось. Данные же о влиянии альфа-Т на процессы биогенеза митохондрий в клетках периферических органов единичны и в известной мере противоречивы. Так, инкубация с альфа-Т клеточной линии HepG2, происходящей из клеток печени человека, нормализовала процессы биогенеза митохондрий в этих клетках, нарушенные при действии токсина [40]. А введение альфа-Т крысам с экспериментально вызванным гастритом, напротив, оказывало неблагоприятный эффект, десинхронизировало адаптивные ответы, в том числе процессы биогенеза митохондрий, а также заметно снижало компенсаторное увеличение пролиферации клеток слизистой кишечника [41].
Нами показано, что альфа-Т в микро- и наномолярных концентрациях существенно уменьшает отношение про- к антиапоптотическому белку митохондрий (Bax/Bcl-xL) в клетках PC12 до воздействия на них прооксиданта. Снижение альфа-Т базального отношения про- к антиапоптотическому белку показано нами и в нейронах коры мозга [19]. Эти эффекты альфа-Т могут увеличивать жизнеспособность как нативных клеток, так и этих клеток, подвергнутых впоследствии действию прооксиданта.
Различные прооксиданты, в том числе перекись водорода, не только оказывают разрушающее воздействие на клетки, но и выполняют сигнальную функцию, активируя большое число транскрипционных факторов [42], вовлеченных в регуляцию пролиферации, апоптоза и дифференцировки клеток. В литературе имеются указания на то, что низкие концентрации токсинов, обладающих прооксидантным действием, стимулируют, а высокие концентрации, напротив, ингибируют биогенез митохондрий. Так, например, действие низких концентраций соли шестивалентного хрома на линию печеночных клеток HepG2 приводит к активации этого процесса, а действие его высоких концентраций, напротив, приводит к ингибированию митохондриального биогенеза в этих клетках [40]. Нами не выявлено достоверного изменения уровня мРНК NRF-1, NRF-2alpha и TFAM под влиянием перекиси водорода и в результате преинкубации со 100 мкМ или 100 нМ альфа-Т через 12 и 24 ч после начала воздействия прооксиданта на клетки PC12. Это, по-видимому, свидетельствует о том, что в условиях окислительного стресса, которые мы использовали в своих опытах, альфа-Т и перекись водорода не влияют на экспрессию генов этих факторов транскрипции. Поскольку биогенез митохондрий является весьма энергоемким и длительным процессом, в ходе эволюции животных могла сложиться такая реакция клеток на сильные стрессорные воздействия, приводящие к значительной активации свободнорадикальных процессов, которая позволяет максимально быстро и с наименьшими затратами усилить систему своей защиты. К таким реакциям можно, например, отнести увеличение экспрессии ферментов антиоксидантной защиты и/или антиапоптотических белков, но не усиление биогенеза митохондрий.
ЗАКЛЮЧЕНИЕ
Показано, что альфа-Т увеличивает жизнеспособность клеток нейрональной линии РС12 как при короткой (30 мин), так и при длительной (18 ч) преинкубации с ним до действия прооксиданта. Уменьшение отношения Bax/Bcl-xL и увеличение экспрессии генов факторов транскрипции NRF-2 и TFAM при действии альфа-Т на контрольные клетки PC12 приводят, очевидно, к улучшению их функционального состояния, что может, по-видимому, повышать их жизнеспособность при индукции окислительного стресса. Достоверных изменений экспрессии факторов транскрипции NRF-1, NRF-2 и TFAM в клетках PC12 под влиянием перекиси водорода и преинкубации с альфа-Т нами не выявлено. Это, по-видимому, связано с тем, что сильные токсические воздействия на клетки не приводят к активации энергоемкого и длительного процесса биогенеза митохондрий. При этом альфа-Т увеличивает экспрессию антиапоптотического Bcl-xL, что, очевидно, способствует нормализации увеличенного при окислительном стрессе отношения Bax/Bcl-xL, ускоряет увеличение экспрессии SOD2 в клетках PC12.
Список литературы
Halliwell B. Oxidative stress and neurodegeneration: where are we now? J. Neurochem. 97 (6): 1634–1658. 2006.
Cobley J.N., Fiorello M.L., Bailey D.M. 13 reasons why the brain is susceptible to oxidative stress. Redox Biology. 15: 490–503. 2018.
Suski J.M., Lebiedzinska M., Bonora M., Pinton P., Duszynski J., Wieckowski M.R. Relation between mitochondrial membrane potential and ROS formation. Methods Mol. Biol. 810: 183–205. 2012.
Bhat A.H., Dar K.B., Anees S., Zargar M.A., Masood A., Sofi M.A., Ganie S.A. Oxidative stress, mitochondrial dysfunction and neurodegenerative diseases; a mechanistic insight. Biomed. Pharmacother. 74: 101–110. 2015.
Halliwell B. Free radicals and antioxidants – quo vadis? Trends Pharmacol. Sci. 32 (3): 125–130. 2011.
Sarniak A., Lipińska J., Tytman K., Lipińska S. Endogenous mechanisms of reactive oxygen species (ROS) generation. Postepy Hig. Med. Dosw. 70: 1150–1165. 2016.
McBride H.M., Neuspiel M., Wasiak S. Mitochondria: more than just a powerhouse. Curr. Biol. 16 (14): R551–560. 2006.
Thornton C., Hagberg H. Role of mitochondria in apoptotic and necroptotic cell death in the developing brain. Clin. Chim. Acta. 451 (Pt A): 35–38. 2015.
Chen Z., Liu X., Ma S. The Roles of mitochondria in autophagic cell death. Cancer Biother. Radiopharm. 31 (8): 269–276. 2016.
Reddy P.H., Reddy T.P. Mitochondria as a therapeutic target for aging and neurodegenerative diseases. Curr. Alzheimer Res. 8 (4): 393–409. 2011.
Johri A., Beal M.F. Mitochondrial dysfunction in neurodegenerative diseases. J Pharmacol. Exp. Ther. 342 (3): 619–630. 2012.
Gohil K., Godzdanker R., O’Roark E., Schock B.C., Kaini R.R., Packer L., Cross C.E., Traber M.G. Alpha-tocopherol transfer protein deficiency in mice causes multi-organ deregulation of gene networks and behavioral deficits with age. Ann. N.-Y. Acad. Sci. 1031: 109–126. 2004.
Numakawa Y., Numakawa T., Matsumoto T., Yagasaki Y., Kumamaru E., Kunugi H., Taguchi T., Niki E. Vitamin E protected cultured cortical neurons from oxidative stress-induced cell death through the activation of mitogen-activated protein kinase and phosphatidylinositol 3-kinase. J. Neurochem. 97 (4): 1191–1202. 2006.
Ferri P., Cecchini T., Ambrogini P., Betti M., Cuppini R., Del Grande P., Ciaroni S. alpha-Tocopherol affects neuronal plasticity in adult rat dentate gyrus: the possible role of PKCdelta. J. Neurobiol. 66 (8): 793–810. 2006.
Azzi A. Molecular mechanism of alpha-tocopherol action. Free Rad. Biol. Med. 43 (1): 16–21. 2007.
Hernández-Pinto A.M., Puebla-Jiménez L., Arilla-Ferreiro E. alpha-Tocopherol decreases the somatostatin receptor-effector system and increases the cyclic AMP/cyclic AMP response element binding protein pathway in the rat dentate gyrus. Neuroscience. 162 (1): 106–117. 2009.
Betti M., Ambrogini P., Minelli A., Floridi A., Lattanzi D., Ciuffoli S., Bucherelli C., Prospero E., Frontini A., Santarelli L., Baldi E., Benetti F., Galli F., Cuppini R. Maternal dietary loads of α-tocopherol depress protein kinase C signaling and synaptic plasticity in rat postnatal developing hippocampus and promote permanent deficits in adult offspring. Nutr. Biochem. 22 (1): 60–70. 2011.
Zakharova I.O., Sokolova T.V., Bayunova L.V., Vlasova Y.A., Rychkova M.P. Avrova N.F. α-Tocopherol at nanomolar concentration protects PC12 cells from hydrogen peroxide-induced death and modulates protein kinase activities. Int. J. Mol. Sci. 13 (9): 11543–11568. 2012.
Zakharova I.O., Sokolova T.V., Vlasova Yu.A., Bayunova L.V., Rychkova M.P., Avrova N.F. α-Tocopherol at nanomolar concentration protects cortical neurons against oxidative stress. Int. J. Mol. Sci. 18 (1). pii: E216. 2017.
Suliman H.B., Carraway M.S., Welty-Wolf K.E., Whorton A.R., Piantadosi C.A. Lipopolysaccharide stimulates mitochondrial biogenesis via activation of nuclear respiratory factor-1. J. Biol. Chem. 278 (42): 41510–41518. 2003.
Stetler R.A., Leak R.K., Yin W., Zhang L., Wang S., Gao Y., Chen J. Mitochondrial biogenesis contributes to ischemic neuroprotection afforded by LPS pre-conditioni. J. Neurochem. 123 (Suppl 2): 125–137. 2012.
Whitaker R.M. Corum D., Beeson C.C., Schnellmann R.G. Mitochondrial Biogenesis as a Pharmacological Target: A New Approach to Acute and Chronic Diseases. Annu. Rev. Pharmacol. Toxicol. 56: 229–249. 2016.
Ivanova M.M., Radde B.N., Son J., Mehta F.F., Chung S.H., Klinge C.M. Estradiol and tamoxifen regulate NRF-1 and mitochondrial function in mouse mammary gland and uterus. J. Mol. Endocrinol. 51 (2): 233–246. 2013.
Priya A., Johar K., Nair B., Wong-Riley M.T. Nuclear respiratory factor 2 regulates the transcription of AMPA receptor subunit GluA2 (Gria2). Biochim. Biophys. Acta. 1843 (12): 3018–3028. 2014.
Nair B., Wong-Riley M.T. Transcriptional regulation of brain-derived neurotrophic factor coding exon IX: Role of nuclear respiratory factor 2. J. Biol. Chem. 291 (43): 22583–22593. 2016.
Li P.A., Hou X., Hao S. Mitochondrial biogenesis in neurodegeneration. J. Neurosci. Res. 95 (10): 2025–2029. 2017.
Li Z., Cogswell M., Hixson K., Brooks-Kayal A.R., Russek S.J.,Nuclear Respiratory Factor 1 (NRF-1) Controls the activity dependent transcription of the GABA-A receptor beta1 subunit gene in neurons. Front Mol. Neurosci. 11: 285. 2018.
Hock M.B., Kralli A. Transcriptional control of mitochondrial biogenesis and function. Annu. Rev. Physiol. 71: 177–203. 2009.
Scarpulla R.C. Nucleus-encoded regulators of mitochondrial function: integration of respiratory chain expression, nutrient sensing and metabolic stress. Biochim. Biophys. Acta. 1819 (9–10): 1088–1097. 2012.
Соколова Т.В., Рычкова М.П., Захарова И.О., Войнова И.В., Аврова Н.Ф. α-Токоферол в наномолярных концентрациях повышает жизнеспособность клеток PC12 при окислительном стрессе, роль модуляции активности сигнальных систем. Нейрохимия. 28 (3): 208–215. 2011. [Sokolova T.V., Rychkova M.P., Zakharova I.O., Voynova T.V., Avrova N.F. Alpha-tocopherol at nanomolar concentreations increases the viability of PC12 cells under oxidative stress condtitions. Neurochem. J. 5 (3): 183–190. 2011. (In Russ.)].
Vassault A. Lactate dehydrogenase: UV-method with pyruvate and NADH. In “Methods of Enzymatic Analysis”. Ed. H.U.Bergmeyer. Weinheim: Verlag Chemie, 3: 118–126. 1983.
Miller E.R., Pastor-Barriuso R., Dalal D., Riemersma R.A., Appel L.J., Guallar E. Meta-analysis: high-dosage vitamin E supplementation may increase all-cause mortalit. Ann. Intern. Med. 142 (1): 37–46. 2005.
Bjelakovic G., Nikolova D., Gluud C. Meta-regression analyses, meta-analyses, and trial sequential analyses of the effects of supplementation with beta-carotene, vitamin A, and vitamin E siP ngly or in different combinations on all-cause mortality: do we have evidence for lack of harm? PLoS One. 8 (9). e74558. 2013.
Jiang B., Liu J.H., Bao Y.M., An L.J. Hydrogen peroxide-induced apoptosis in PC12 cells and the protective effect of puerarin. Cell Biol. Int. 27 (12) 1025–1031. 2003.
Then S.M., Mazlan M., Mat Top G., Wan Ngah W.Z. Is vitamin E toxic to neuron cells? Cell. Mol. Neurobiol. 29 (4): 485–496. 2009.
Hajiani M., Razi F., Golestani A., Frouzandeh M., Owji A.A., Khaghani S., Ghannadian N., Shariftabrizi A., Pasalar P. Time- and dose-dependent differential regulation of copper-zinc superoxide dismutase and manganese superoxide dismutase enzymatic activity and mRNA level by vitamin E in rat blood cells. Redox Rep. 17 (3) 101–107. 2012.
Nakamura Y.K., Omaye S.T. Alpha-tocopherol modulates human umbilical vein endothelial cell expression of Cu/Zn superoxide dismutase and catalase and lipid peroxidation. Nutr. Res. 28 (10): 671–680. 2008.
Lin J., Wu P.H., Tarr P.T., Lindenberg K.S., St-Pierre J., Zhang C.Y., Mootha V.K., Jäger S., Vianna C.R., Reznick R.M., Cui L., Manieri M., Donovan M.X., W.Z., Cooper M.P., Fan M.C., Rohas L.M., Zavacki A.M., Cinti S. Shulman G.I., Lowell B.B., Krainc D., Spiegelman B.M. Defects in adaptive energy metabolism with CNS-linked hyperactivity in PGC-1alpha null mice. Cell. 119 (1): 121–135. 2004.
Leone T.C., Lehman J.J., Finck B.N., Schaeffer P.J., Wende A.R., Boudina S., Courtois M., Wozniak D.F., Sambandam N., Bernal-Mizrachi C., Chen Z., Holloszy J.O., Medeiros D.M., Schmidt R.E., Saffitz J.E., Abel E.D., Semenkovich C.F., Kelly D.P. PGC-1alpha deficiency causes multi-system energy metabolic derangements: muscle dysfunction, abnormal weight control and hepatic steatosis. PLoS Biol. 3 (4): e101. 2005.
Zhong X., de Cássia da Silveira E Sá R, Zhong C. Mitochondrial biogenesis in response to Chromium (VI) Toxicity in Human Liver Cells. Int. J. Mol. Sci. 18 (9). pii: E1877. 2017.
Olguín-Martínez M., Hernández-Espinosa D.R., Hernández-Muñoz R. α-Tocopherol administration blocks adaptive changes in cell NADH/NAD+ redox state and mitochondrial function leading to inhibition of gastric mucosa cell proliferation in rats. Free Radic. Biol. Med. 65: 1090–1100. 2013.
Marinho H.S., Real C., Cyrne L., Soares H., Antunes F. Hydrogen peroxide sensing, signaling and regulation of transcription factors. Redox Biol. 2: 535–562. 2014.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


