Журнал эволюционной биохимии и физиологии, 2020, T. 56, № 4, стр. 253-271
ЭВОЛЮЦИОННОЕ СТАНОВЛЕНИЕ И ФУНКЦИОНАЛЬНОЕ ЗНАЧЕНИЕ НЕЙРОНАЛЬНОЙ ОРГАНИЗАЦИИ (ЦЕНТР–ПЕРИФЕРИЯ) РОСТРАЛЬНЫХ СЛУХОВЫХ ЦЕНТРОВ ПОЗВОНОЧНЫХ
М. Г. Белехова 1, *, Н. Б. Кенигфест 1, Н. М. Чмыхова 1
1 Федеральное бюджетное государственное учреждение науки Институт эволюционной физиологии и биохимии
им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
* E-mail: belekhova@yahoo.com
Поступила в редакцию 29.01.20
После доработки 26.03.20
Принята к публикации 29.03.2020
Аннотация
В настоящей статье представлен обзор литературных данных о ростральных слуховых центрах амниот с акцентом на их организации типа центр–периферия (сердцевина–поясок, core-belt), связанных с лемнисковым (сердцевина) и экстралемнисковым, т.е. не лемнисковым (поясок), путями. Приведены результаты собственного иммуногистохимического исследования распределения в мезэнцефальном (MLD) и таламическом (Ov) слуховых ядрах голубей кальций-связывающих протеинов парвальбумина (PV) и калбиндина (CB), наглядно демонстрирующего его наличие у птиц. Рассматривается функциональное значение этого типа нейрональной организации, способной наиболее успешно обеспечить интеграцию результатов перцептивной обработки слуховой информации и ее аффективной оценки благодаря связям поясковых отделов слуховых центров с лимбическими центрами. В последних, в частности в амигдале, происходит аудиомоторная и аудиовегетативная передачи, ответственные за выбор и реализацию адекватных на данный момент форм поведения. Сравнительный анализ различных характеристик слуховых центров среди широкого круга позвоночных позволяет составить предположительное представление о происхождении, консервации и преобразованиях сердцевинного и пояскового отделов слуховых центров в процессе эволюции.
ВВЕДЕНИЕ
Молекулярно-биологический подход, занимающий в настоящее время передовые позиции в исследованиях мозга, несмотря на уникальные возможности, позволившие совершить прорыв в изучении механизмов нейрональной активности, не исключает необходимости исследовать частные свойства нейрональной организации нервных центров, ответственные за оптимальное осуществление свойственных им функций, а также за их связи с другими структурами мозга, которые обеспечивают включение сенсорных центров в целостные интегративные системы. Известны такие типы нейрональной организации структур мозга как: ламинарно-колонковая (сетчатка, кора больших полушарий, кора мозжечка, верхние бугры четверохолмия/тектум, центральные релейные отделы сенсорных центров таламуса), ламинарно-гломерулярная (обонятельные луковицы), организация типа центр-периферия (core-belt/shell) сенсорных центров, сетевидная организация (стриатум, ретикулярная формация). Примеры этих, принципиально сходных, типов нейрональной организации можно найти в соответствующих мозговых структурах у всех позвоночных, хотя они отличаются у представителей разных таксонов в результате филогенетических и адаптивных преобразований.
Настоящая статья посвящена нейрональной организации типа центр–периферия (сердцевина–поясок, core-belt), характерной для сенсорных центров амниот (млекопитающие, птицы, рептилии), на примере мезэнцефального и таламического слуховых ядер. Этот тип организации является структурно-функциональной основой двух параллельных путей слуховой системы: лемнискового (сердцевина) и не лемнискового (поясок). Они формируются в мезэнцефальном слуховом центре, переключаются соответственно в сердцевинном и поясковом отделах таламического слухового центра и оканчиваются в первичной и не первичных зонах слуховой коры. Высоко специализированный центральный (классический) путь получил название лемнискового, периферический, более диффузно организованный путь, – экстралемни-скового или не лемнискового [1–3]. Оба пути сохраняются на уровне конечного мозга, но не рассматриваются здесь детально в связи с отсутствием полного и бесспорного представления о гомологии не первичных отделов телэнцефальных слуховых зон среди позвоночных разного филогенетического уровня. Мы приводим результаты собственного иммуногистохимического исследования распределения в мезэнцефальном и таламическом слуховых ядрах голубя кальций-связывающих протеинов парвальбумина (PV) и калбиндина (CB), используемых как маркеры нейронов, обладающих разными морфо-функциональными свойствами. Различия PV и CB специфичности сердцевинного и пояскового отделов наглядно подтверждают организацию этих центров по типу центр–периферия. Дана его функциональная оценка как оптимальное “решение” вопроса о пусковой роли сенсорной сигнализации в организации поведения. Цель настоящей работы – выявить пути эволюции этого типа организации слуховых центров позвоночных и сочетания в нем черт их консерватизма и пластичности.
| Сокращения: |
| СаВРr – кальций-связывающие протеины |
| СВ – калбиндин |
| DVR – дорсальный вентрикулярный край |
| IC – colliculus inferior |
| ICC – nucleus centralis IC |
| ICS – nucleus superficialis IC |
| ICX – nucleus externus IC |
| ir – иммунореактивный |
| L – слуховое поле конечного мозга |
| L2 – центральный отдел L |
| L1, L3 – периферические отделы L |
| MGB – corpus geniculatum mediale |
| MLD – nucleus mesencephalicus lateralis, pars dorsalis |
| Mp – nucleus medialis posterior |
| nCe – nucleus centralis Ov |
| Ov – nucleus ovoidalis |
| Ovl – nucleus lateralis Ov |
| Ovm – nucleus medialis Ov |
| PV – парвальбумин |
| Re – nucleus reuniens |
| tOv – tractus ovoidalis |
КРАТКАЯ ОБЩАЯ ХАРАКТЕРИСТИКА ОРГАНИЗАЦИИ МЕЗЭНЦЕФАЛЬНОГО И ТАЛАМИЧЕСКОГО СЛУХОВЫХ ЦЕНТРОВ АМНИОТ – МЛЕКОПИТАЮЩИХ И ПТИЦ
Представление о существовании в слуховой и соматической сенсорных системах млекопитающих параллельных лемнискового (классический проекционный) и экстра/не лемнискового путей и обслуживающих их соответственно сердцевинных (core) и поясковых (belt/shell) отделов сенсорных центров имеет давнюю историю [4–10] (см. подробнее [11, 12]). Оно получило обоснование во многих морфофункциональных, нейрохимических, молекулярно-биологических, эмбриогенетических исследованиях у представителей позвоночных, включая человека, и в настоящее время рассматривается как главный общий принцип организации сенсорных центров [1–3, 12–18]. Ниже дана краткая характеристика двойной, сердцевинно-поясковой, организации ростральных слуховых центров у млекопитающих и птиц; приведено ограниченное число ссылок из очень большого количества работ по этой теме.
Млекопитающие
В слуховой системе млекопитающих лемнисковый путь последовательно переключается в сердцевинном отделе мезэнцефального (colliculus inferior, IС), в сердцевинном (вентральном) отделе таламического (corpus geniculatum mediale, MGB) центров, оканчиваясь в основном в слое IV первичной слуховой коры. Экстралемнисковый путь переключается в поясковых отделах IС (поверхностное и наружное ядра), далее в экстралемнисковых отделах слухового таламуса: медиальное и дорсальное ядра MGB, мультисенсорные парапоясковые (задние интраламинарные, супрагеникулятное, перипедункулярное ядра, медиальный отдел подушки). Эти экстралемнисковые центры проецируются более широко – в не первичные зоны слуховой коры, а также в лимбические структуры (базолатеральный отдел амигдалы, гипоталамус), базальные ганглии. Сердцевинные и поясковые отделы IС и MGB получают разные афферентные входы. Первые – исключительно или преимущественно слуховой из слуховых ядер ствола; они точно тонотопически организованы и содержат спектрально узко настроенные дисковидные нейроны. Вторые, мультисенсорные, получают, кроме слуховых, также соматические и зрительные входы; для них характерны клетки, чувствительные к широкому звуковому спектру, и не слуховые нейроны с большими рецептивными полями. Лемни-сковый, быстро проводящий, сенсорно специфичный путь осуществляет тонкую перцептивную обработку спектральных, временных черт и интенсивности слуховой информации, а более диффузно организованный экстралемнисковый путь – обработку временных, пространственных (локализация звука) параметров и более сложных (вокализационных) звуковых сигналов. Последний через проекции в амигдалу вовлечен в полисенсорную интеграцию и аудиомоторную активность, лежащие в основе организации разных форм поведения и обучения [1–5, 7–10, 12–14, 17, 19‒30]. Деление на первичные (сердцевинные) и непервичные (поясковые, парапоясковые) слуховые зоны сохраняется и в коре больших полушарий [13, 15, 26, 31–37]. Этот принцип организации слуховых центров млекопитающих находит подтверждение в различиях нейрохимических характеристик их сердцевинных и поясковых отделов [15, 38–40], включая различия в содержании разных типов кальций-связывающих протеинов [13, 15, 17, 25, 26, 32, 41, 42], а также различия метаболической активности [43–45]. Нейроны сердцевинного и пояскового отделов мезэнцефального (IC) и таламического (MGB) слуховых центров и слуховой коры происходят из разных герминальных зон и имеют разные сроки созревания в индивидуальном развитии [15]. Для более исчерпывающей характеристики лемнисковых и экстралемнисковых отделов слуховых центров млекопитающих см. работу [12].
Птицы
Слуховая система имеет сходные, как общий план организации, так и принципы кодирования звуковых сигналов в слуховых центрах у зауропсидных и млекопитающих амниот, хотя они отличаются у представителей разного филогенетического уровня в зависимости от степени развития периферического слухового аппарата и репертуара воспринимаемой слуховой информации [14, 46]. Слуховая система птиц также включает два основных пути – лемнисковый, последовательно переключающийся в сердцевинных отделах мезэнцефального (n. mesencephalicus lateralis, pars dorsalis, MLD) и таламического (n. ovoidalis, Ov) центров, и экстралемнисковый, переключающийся в поясковых отделах этих центров. Они проецируются в разные отделы слухового нидопаллиального поля L: первый в L2, второй в L1 и L3 и далее в их проекционные области мезо- и нидопаллиума. В обозначении ядер MLD, гомологичном colliculus inferior млекопитающих, сохраняется его название IС. У исследованных видов птиц (совы, куры, вьюрки, голуби) в MLD различают центральное (сердцевинное) ядро (ICC) и поясковые ядра – поверхностное (ICS) и наружное (ICX). В ICC в свою очередь выделяют подотделы: центральный, латеральный и медиальный. Дискретные области центрального и поясковых отделов MLD получают проекции разных слуховых стволовых ядер, кодирующих различные параметры звуковой сигнализации [46–50]. Таламический слуховой центр Ov птиц также состоит из центрального (сердцевинного) ядра (nCe) и периферических периовоидальных (поясковых) ядер (Ovm, Ovl, SPO), получающих проекции соответственно от центрального и периферических (поясковых) ядер MLD. Так же как у млекопитающих, сердцевинный и поясковый отделы мезэнцефального [47–58] и таламического [51, 52, 57, 59–70] центров имеют различные морфологические, ходологические, метаболические и нейрохимические характеристики, в том числе отличаются экспрессией разных типов кальций-связывающих протеинов. Различия между сердцевинной (L2) и поясковыми (L1 и L3) зонами сохраняются и в телэнцефальном слуховом центре – поле L. И так же как у млекопитающих, имеет место опережающее созревание нейронов поясковых отделов в эмбриогенезе по сравнению с нейронами сердцевинных отделов [40, 56]. Поясковые области таламического и телэнцефальных слуховых центров проецируются в структуры лимбического мозга, в частности в амигдалу, откуда слуховые сигналы переключаются на вегетативные и моторные центры [66, 71–76].
ИММУНОФЛУОРЕСЦЕНТНОЕ ИССЛЕДОВАНИЕ РАСПРЕДЕЛЕНИЯ ПАРВАЛЬБУМИНА И КАЛБИНДИНА В МЕЗЭНЦЕФАЛЬНОМ И ТАЛАМИЧЕСКОМ СЛУХОВЫХ ЦЕНТРАХ ГОЛУБЯ (СОБСТВЕННЫЕ ДАННЫЕ)
Подтверждены и дополнены наши прежние данные об организации этих центров голубя по типу центр–периферия, полученные с помощью стандартной иммуногистохимии [58, 69]. В настоящей работе, как в наших прежних исследованиях на голубях, выявление кальций-связывающих протеинов производили с использованием иммуноглобулинов, конъюгированных для СВ с тетраметилродамин изотиоцинатом (Sigma, США), дающим красное окрашивание, а для PV – с флюоросцеин изотиоционатом (Vector, США), дающим зеленое окрашивание. Двойная метка для экспрессии СВ и PV определялась по желто-зеленому или красно-зеленому цвету. Использована принятая номенклатура обозначений слуховых ядер среднего и переднего мозга птиц и млекопитающих. Эксперименты проводились в соответствии с биоэтическими правилами согласно протоколу, утвержденному комитетом по охране животных ИЭФБ РАН.
MLD (Colliculus inferior, IC)
В MLD четко различаются СВ-ir поясковые отделы ICS и ICX (красное окрашивание) и сердцевинный отдел IСС, характеризующийся смешанной популяцией PV-ir (зеленое окрашивание) и CB-ir (красное окрашивание) элементов. IСС заполнено плотным PV-ir фиброзно-точечным нейропилем и PV-ir округлыми и овоидными мультиполярными клетками с наибольшей плотностью в его центральном и вентральном отделах. Они перекрываются с менее плотным и слабо окрашенным CB-ir нейропилем, а также плотным скоплением CB-ir клеток, имеющих морфотип, сходный с морфотипом PV-ir клеток (рис. 1а, 1б, 1в; рис. 2а, 2б, 2в). В подавляющей части клеток IСС выявлена колокализация PV и CB (желто-зеленое/оранжевое окрашивание) (рис. 1а; рис. 2а, 2б, 2в). В отличие от IСС, в поясковых отделах MLD содержатся только CB-ir клетки и рассеянные фрагменты CB- и PV-ir волокон (рис. 1 а, 1б, 1в; рис. 2г, 2д, 2е). Для пояскового поверхностного ядра (ICS) типичны горизонтальные CB-ir клетки с длинными дендритами, распространяющимися вдоль дорсолатеральной поверхности ядра (рис. 2г, 2д, 2е). В наружном поясковом ядре (ICX), примыкающем к вентральному полюсу IСС, диффузно распределены также CB-ir клетки разных морфотипов с разнонаправленными дендритами (не демонстрировано). В обоих поясковых ядрах MLD никогда не выявлялись PV-ir клетки. Приведенные данные в основном совпадают с результатами стандартного иммуногистохимического исследования распределения PV и CB в MLD голубя [58]. Новый полученный факт, требующий дальнейшего изучения и функциональной оценки, – массивная колокализация PV и CB в клетках сердцевинного отдела MLD.
Рис. 1.
Распределение парвальбумин (PV) и калбиндин (CB) иммунореактивности в мезэнцефальном слуховом центре (MLD) голубя. а – PV + CB, б – PV, в – CB. Масштаб в мкм: 500.
Fig. 1. Distribution of parvalbumin (PV) and calbindin (CB) immunoreactivity in the pigeon mesencephalic auditory center (MLD). a – PV+CB, б – PV, в – CB. Scale, 500 µm.
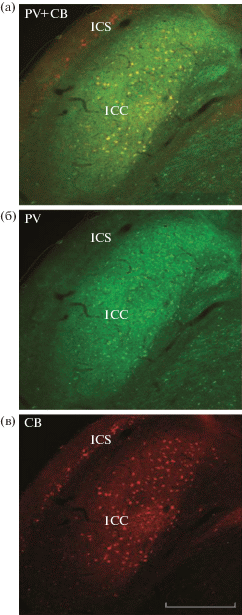
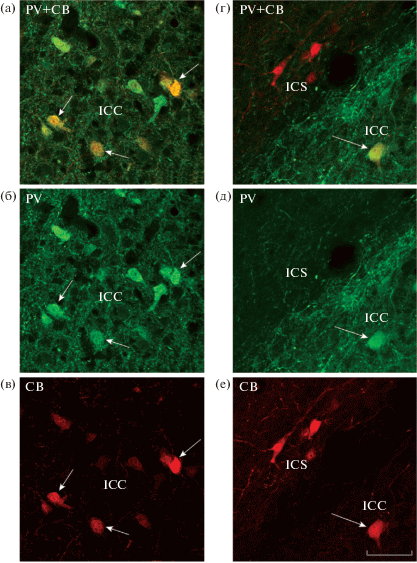
Рис. 2.
Колокализация PV и CB в клетках сердцевинного ядра IСС (а–в) и содержание только СВ в клетках пояскового ядра ICS (г–е) MLD голубя. Стрелками на а-е отмечены клетки IСС с ярко выраженной колокализацией PV и CB. Масштаб в мкм: 50.
Fig. 2. Colocalization of PV and CB in cells of the core nucleus ICC (a–в) and the CB content in cells of the belt nucleus ICS (г–е) in the pigeon MLD. Arrows in a–e indicate ICC cells with strongly expressed PV and CB colocalization. Scale, 50 µm.
Ov (Nucleus ovoidalis)
В Ov также четко различаются поясковые периовоидальные ядра Ovl, Ovm (красное окрашивание) и сердцевинный отдел nCe (преимущественно зеленое окрашивание). Интенсивно окрашенный фиброзно-точечный PV-ir нейропиль заполняет полностью nCe. Его очень высокая плотность, обилие прилежащих к телам клеток иммунореактивных окончаний и слабое зеленое окрашивание многих клеток (рис. 3а, 3б; рис. 4б) затрудняют выявление в них PV. Напротив, не плотный СВ-ir нейропиль nCe слабо окрашен; в нем хорошо выявляются многочисленные, хотя в основном слабо окрашенные, СВ-ir клетки (рис. 3в; рис. 4в). Нейроны, иммунореактивные к PV и к СВ, представлены округлыми и овоидными клетками сходного морфотипа и размеров, в которых обнаружена колокализация обоих протеинов. Она не всегда четко прослеживалась из-за слабой маркировки PV и CB в настоящих опытах (рис. 3а; рис. 4а, 4б, 4в) и возможно свойственна более значительной массе клеток nCe. В противоположность сердцевинному ядру nCe, поясковые ядра Ovl, Ovm состоят только из СВ-ir клеток и содержат рассеянные фрагменты PV-ir волокон. СВ-ir клетки морфологически отличаются от СВ-ir клеток nCe; они представлены преимущественно горизонтальными нейронами с дендритами, распространяющимися параллельно контуру ядра, и мультиполярными клетками (рис. 3а, 3в; 4г, 4д, 4е). Эти данные в основном совпадают с результатами стандартного иммуногистохимического исследования распределения PV и CB в Ov голубя [69]. Так же как в случае с MLD, требуются дальнейшее изучение и функциональная оценка колокализации PV и CB в клетках сердцевинного отдела Ov.
Рис. 3.
Распределение PV и CB иммунореактивности в таламическом слуховом центре (Ov) голубя.
а, б – в nCe видны редкие PV-ir клетки, интенсивно окрашенные, а также слабо окрашенные, плохо различимые из-за очень плотного PV-ir нейропиля. в – СВ-ir клетки четко видны на фоне не окрашенного СВ-ir нейропиля. а, в – СВ-ir клетки в Ovm и Ovl. Масштаб в мкм: 200.
Fig. 3. Distribution of PV and CB immunoreactivity in the pigeon thalamic auditory nucleus ovoidalis (Ov).
a, б – sparse PV-ir cells in nCe: heavily stained and poorly stained (hardly discernible due to very dense PV-ir neuropil). а, в – CB-ir cells are clearly seen against the background of unstained CB-ir neuropil. Scale, 200 µm.
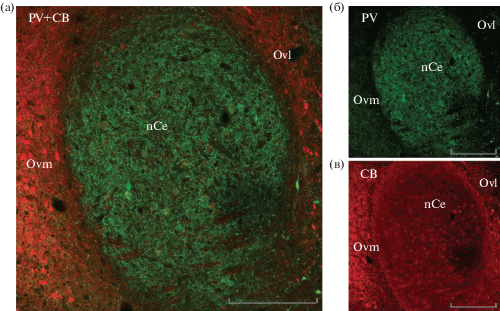
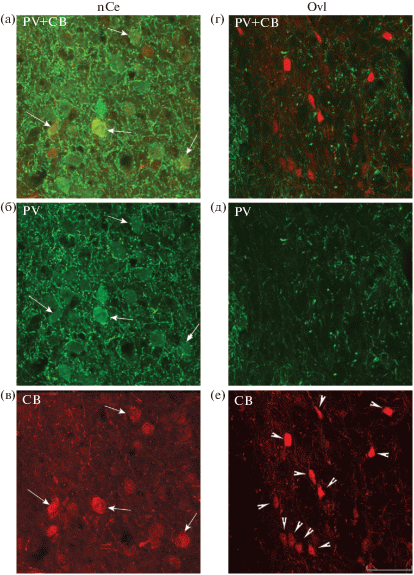
Рис. 4.
Колокализация PV и CB в клетках сердцевинного ядра nCe (а–в) и содержание только СВ в клетках пояскового ядра Ovl (г–е) таламического слухового центра (Ovl) голубя. Стрелками на а–в отмечены клетки nCe с колокализацией PV и CB, головками стрелок на г–е только СВ-ir клетки в Ovl. Масштаб в мкм: 50.
Fig. 4. Colocalization of PV and CB in cells of the core nucleus nCe (a–в) and CB alone in cells of the belt nucleus Ovl (г–е) in the pigeon n. ovoidalis. Arrows indicate nCe cells with PV and CB colocalization; arrowheads indicate only CB-ir cells in Ovl (г–е). Scale, 50 µm.
РАЗЛИЧИЯ PV И CB СПЕЦИФИЧНОСТИ В СЕРДЦЕВИННОМ И ПОЯСКОВОМ ОТДЕЛАХ СЛУХОВЫХ ЦЕНТРОВ КАК ОТРАЖЕНИЕ ИХ ЭВОЛЮЦИОННОЙ ПЛАСТИЧНОСТИ И КОНСЕРВАТИЗМА
На основании исследований, проведенных на приматах и человеке, была выдвинута гипотеза об альтернативном распределении PV в лемнисковых сердцевинных (core) отделах сенсорных ядер таламуса, а СВ – в матричном (matrix) субстрате, включающем поясковые отделы сенсорных ядер [13, 26]. Такое же комплементарное распределение PV и СВ в сердцевинном и поясковых отделах обнаружено в мезэнцефальном слуховом центре высших млекопитающих [41]. Однако это представление не подтвердилось полностью в многочисленных исследованиях на разных видах млекопитающих неприматов и птиц. В сердцевинных отделах таламических и мезэнцефальных слуховых центров выявлена значительная межвидовая вариабельность специфичности к разным типам CaBPr (включая калретинин по литературным данным) от полной альтернативности распределения PV- и СВ-ir клеток в сердцевинном и поясковых отделах, свойственной приматам, до их смешанного содержания или наличия только CB-ir клеток у разных видов млекопитающих [15, 32, 41, 77–83] и птиц [48, 49, 51, 56, 58, 69, 84–87], обитающих в разных экологических средах. Даже у приматов в сердцевинном вентральном отделе MGB при преобладании PV-ir клеток в меньшем количестве содержатся и CB-ir клетки. Такая значительная вариабельность согласуется с существованием в лемнисковом пути множественных каналов, формирующихся в стволовых слуховых ядрах, ответственных за обработку различных параметров звуковых сигналов, и последовательно проецирующихся в дискретные области сердцевинных отделов ростральных слуховых центров [18, 88–90]. Состав этих каналов варьирует у разных видов и определяется видовым репертуаром поступающей по ним информации. Они могут обслуживаться разными типами CaBPr в зависимости от базовых характеристик акустических сигналов (тональность, громкость, тембр). Напротив, экстралемнисковый поясковый отдел мезэнцефального и таламического слуховых центров обнаруживает избирательную СВ специфичность. Таким образом, альтернативность PV специфичности в лемнисковых сердцевинных, а CB – в экстралемнисковых поясковых отделах слуховых центров млекопитающих и птиц состоит не в полной их сегрегации между этими отделами, а в большой межвидовой вариабельности экспрессии PV и СВ в первых и доминировании моноспецифичности, избирательно к СВ, во вторых, отражая таким образом соответственно их эволюционно пластичные и консервативные черты.
ФУНКЦИОНАЛЬНОЕ ЗНАЧЕНИЕ ОРГАНИЗАЦИИ СЕНСОРНЫХ ЦЕНТРОВ ТИПА ЦЕНТР–ПЕРИФЕРИЯ
Формирование в эволюции нейрональной организации сенсорных центров определенного типа обусловлено отбором оптимального способа их функционирования, прежде всего механизма сенсомоторной интеграции. Ключевым фактором, запускающим необходимую форму моторного поведения, является сенсорная сигнализация. В последнее время значительно расширились сведения о путях проведения сенсорной информации к моторным центрам у млекопитающих. Показано, что сенсо-моторное переключение происходит не только в результате проведения из сенсорных полей коры в моторную область коры и базальные ганглии и далее к премоторным и моторным стволовым центрам, но также в сенсорных центрах разных уровней через нисходящие коллатерали восходящих к ним сенсорных путей [91, 92].
Вместе с тем в последнее время необычайно возрос интерес к другому пути сенсомоторной интеграции посредством переключения сенсорных сигналов из экстралемнисковых (поясковых) отделов подкорковых и корковых сенсорных центров в амигдале и далее в премоторные и моторные стволовые центры (limbic-motor interface). С этим лимбико-моторным взаимодействием связан выбор необходимой двигательной реакции, так как он осуществляется благодаря лимбической аффективной оценке биологической значимости сенсорных сигналов и доминирующего мотивационного состояния в данной конкретной ситуации.
Ключевой лимбической структурой, определяющей выбор необходимой формы поведения, является амигдалярный комплекс. Латеральное ядро паллиального базолатерального отдела амигдалы получает слуховые, зрительные и соматические проекции, медиальный отдел – обонятельные. Соответствующие сенсорные сигналы являются ключевыми в запуске той или иной адекватной формы социального поведения. Нейроны обоих отделов амигдалы проецируются в ее центральное ядро, где переключаются на моторные и автономные центры; последние ответственны за вегетативные, включая нейросекреторные, компоненты эмоциональных реакций. Базолатеральный и медиальный отделы амигдалы имеют индивидуальные реципрокные связи с не первичными сенсорными и лимбическими корковыми зонами. Они формируют две взаимодействующие мозговые нервные социальные сети [93]. Их связи с моторными центрами после переключения в центральном ядре амигдалы ответственны за соответствующие двигательные и вегетативные реакции. Таким образом осуществляется триггерная роль сенсорной сигнализации, получившей эмоциональную оценку, в организации и реализации таких форм социального поведения, как репродуктивное, пищедобывательное, защитное, агрессивное, которые в первую очередь обеспечивают выживание у всех позвоночных [22, 25, 93–97]. Ключевая роль амигдалы в этом процессе состоит в оценке объекта: “что это?” и “что с этим делать?” [96]. Прямой таламический путь к амигдале обеспечивает быструю, первостепенно важную ориентировочную реакцию на появление и местонахождение сенсорного сигнала, тогда как корковые проекции (непрямой путь) передают более богатую информацию после ее детальной перцептивной и когнитивной обработки. Оба потока сигнализации подвергаются аффективной оценке, определяющей необходимую форму поведения [23, 30, 98–102]. Множественные параллельные каналы в амигдале, отвечающие на эмоционально различные, позитивные или негативные, даже спектрально одинаковые сигналы, ответственны за разные поведенческие реакции [102]. Базолатеральная амигдала играет ключевую роль в образовании условных болевого и пищевого рефлексов на звуковой и зрительный сигналы, являясь необходимым компонентом системы, вовлеченной в приобретение, сохранение информации (память) и реализацию реакции страха [22, 25, 30, 94–97]. В основе обучения лежит механизм долговременной синаптической потенциации [30, 100, 101, 103].
В настоящее время показано значение контроля амигдалярной и гиппокампальной аффективно-оценочной функции со стороны бурно развивающихся в ходе эволюции лимбических и ассоциативных зон коры (цингулярная, ретросплениальная, орбитофронтальная, нижнетемпоральная). Oни представляют собой реципрокно связанные с амигдалой комплексы, которые обеспечивают поведенческие реакции на реальные и ожидаемые подкрепления условных сигналов и даже на их воспроизведение в памяти [104–106]. У человека амигдале принадлежит основная роль в эмоциональной оценке вокализационных сигналов – лингвистических (речь) и нелингвистических (плач, смех, музыка) – и в запуске соответствующего двигательного поведения [97, 107–110]. Участие в аффективной оценке звуковых сигналов других лимбических структур (перегородка, гиппокамп, гипоталамус) в статье не рассматривается, хотя они также вносят индивидуальный вклад в оценку слуховой сигнализации и в формирование необходимого поведения [93, 109, 111].
Принципиально сходная организация взаимоотношений сенсорных центров и амигдалы имеет место у птиц [93, 112–115]. Амигдалярный комплекс птиц (аркопаллиум в новой интерпретации) [112] также состоит из лимбического и соматосенсорного (интермедиарный) отделов. Последний сопоставим с базолатеральным ядром амигдалы млекопитающих. Он получает слуховые, тригеминальные и зрительные проекции, переключающиеся на вегетативные и моторные центры в центральном отделе аркопаллиума. Слуховые проекции, так же как у млекопитающих, происходят из поясковых областей таламического и телэнцефальных слуховых центров. Аркопаллиум содержит клетки, отвечающие на специфические вокальные звуки, контролирующие социо-коммуникативное поведение [66, 71–76, 115]. По крайней мере, две мозговые нервные социальные сети, связанные с сенсорным необонятельным базолатеральным и обонятельным медиальным отделами амигдалы, существуют и у млекопитающих, и у птиц [93]. Повреждение аркопаллиума вызывает нарушение обучения: избегание боли, отказ от несъедобного предмета, не подкрепляемого пищей [116–119]. Таким образом, амигдала птиц, так же как у млекопитающих, служит субстратом для связи акустической сигнализации с реализацией разных форм социального поведения [114, 115]. Критическую роль в восприятии, воспроизведении и сохранении в памяти вокальных (песенных) звуков и их переключении на моторные центры у певчих птиц играет система связей не первичных телэнцефальных слуховых зон с амигдалой. К этим вторичным слуховым зонам относятся каудальные отделы мезопаллиума и нидопаллиума, сопоставимые с корковыми не первичными/ассоциативными слуховыми зонами, конечными звеньями в иерархической обработке слуховой информации [74, 75, 120–125]. Эти зоны у птиц реагируют в основном на сложные вокальные сигналы, специфически активируются во время поведения ухаживания, контролируя выбор полового партнера. Они проецируются в интермедиарный аркопаллиум и далее переключаются на нейроны с нисходящими связями к моторным центрам, обеспечивая избирательность двигательной реакции. Хотя пути эволюции не первичных слуховых зон в паллиуме птиц и млекопитающих нуждаются в дальнейшем изучении, учитывая их дивергентное развитие, у тех и других имеет место принципиальное сходство в восприятии и двигательной реализации вокализационных сигналов. Оно состоит во взаимодействии не первичных поясковых отделов слуховых центров с лимбическими структурами, в частности с эмоциональным фильтром и моторным выходом амигдалы. Таким образом, у птиц и млекопитающих взаимодействие поясковых отделов экстралемнискового пути с лимбическими центрами необходимо для сенсо-моторной интеграции, лежащей в основе осуществления жизненно важных форм поведения.
Приведеная функциональная оценка организации слуховых центров типа центр–периферия позволяет заключить, что формирование этого типа организации у представителей амниот млекопитающих и птиц является наиболее радикальным эволюционным «решением» проблемы выбора фенотипа адекватного поведения, определяющего преимущество организмов в борьбе за существование [93, 102].
ЭВОЛЮЦИОННАЯ ОЦЕНКА ОРГАНИЗАЦИИ СЛУХОВЫХ ЦЕНТРОВ ПО ТИПУ ЦЕНТР–ПЕРИФЕРИЯ
Сравнение данных об организации слуховых центров у птиц и млекопитающих с данными, полученными на потомках их общих филогенетических предков (анцестральные рептилии) и на предшественниках рептилий (анцестральные амфибии), дает возможность оценить истоки и преобразования слуховых центров в ходе эволюции. Существует ли сходный тип организации центр–периферия слуховых центров у рептилий, древние формы которых дали начало птицам и млекопитающим?
Изучение ростральных слуховых центров рептилий значительно отстает от исследований на птицах и млекопитающих, хотя они занимают ключевое место в филогенезе для понимания происхождения и эволюционного развития мозга амниот. Кроме того, не утихают споры о гомологии структур переднего мозга среди амниот, что осложняет эволюционную оценку полученных данных. Вместе с тем к настоящему времени показано, что в разных дивергентных линиях рептилий (архозавры: крокодилы, не архозавры: ящерицы, черепахи) мезэнцефальный и таламический слуховые центры имеют черты, характерные для организации типа центр–периферия. Это позволяет предполагать, что такой тип организации этих центров уже существовал у общего предка амниот. Мезэнцефальный (torus semicircularis, TS) и таламический (n. reuniens/n. medialis posterior, Re/Mp) слуховые центры у современных черепах, крокодилов и ящериц также состоят из сердцевинного и пояскового отделов, обладающих различными цитоархитектоническими, ходологическими [126–135], функциональными нейрональными [136, 137], метаболическими [138], эмбриогенетическими [40, 139] и нейрохимическими характеристиками [40, 140], включая различия специфичности к разным типам CaBPr [138, 141, 142]. Вместе с тем степень сегрегации сердцевинного и пояскового отделов и их собственной компартментализации у рептилий меньше, чем у птиц и млекопитающих. Так, нейроны в сердцевинных отделах TS и Re/ Mp у черепах и ящериц обнаруживают как лемнисковые, так и экстралемнисковые свойства [136, 137]. Кроме того, разделение сердцевинного и пояскового отделов по ряду признаков, в том числе и по специфичности к PV и CB, уменьшается у черепах от мезэнцефального центра к таламическому и слабо намечено в конечном мозгу в вентральном отделе переднего DVR [138, 142]. В таламусе более четко разделение Re на компактную центральную и диффузную периферическую части имеет место у крокодилов [133].
Наличие в ростральных слуховых центрах у рептилий главных черт, свойственных организации типа центр–периферия у птиц и млекопитающих, позволяет и у рептилий предполагать существование сходного механизма реализации аудиомоторного поведения с вовлечением лимбического мозга, в том числе амигдалы. Амигдалярный комплекс рептилий, занимающий задний отдел DVR, также состоит из ядер, сопоставимых с амигдалярными ядрами млекопитающих на основании структурных, ходологических, нейрохимических и генотипических характеристик [102, 113, 143–145]. Дорсолатеральная область заднего DVR (предполагаемый гомолог паллиального базолатерального ядра амигдалы млекопитающих), у черепах и ящериц получает таламические и телэнцефальные сенсорные проекции. При этом известны немногочисленные данные, показывающие, что проекции в амигдалу происходят в основном в поясковых отделах таламических слуховых центров, тогда как проекции сердцевинных отделов адресованы телэнцефальным первичным слуховым зонам в вентральном отделе переднего DVR [131, 133, 134, 143].
Мир современных рептилий сохранил большое богатство и разнообразие видов, распространившихся в самых разных средах обитания. Известны значительные различия структурно-функциональной организации слуховой системы у рептилий разных видов. Различия касаются, в частности, спектральной чувствительности: черепахи воспринимают звуковые сигналы в низкочастотном диапазоне [136, 137, 146], крокодилы и ящерицы – в более высокочастотном [147, 148]. Не одинакова у разных видов и способность к вокализации и социальной активности. В отличие от черепах, вокализация хорошо развита у крокодилов и имеет представительство в паллиальной слуховой области более высокого порядка, сопоставимой с таковой у птиц [149, 150]. Каким образом эти и другие структурно-функциональные межвидовые различия связаны с особенностями организации сердцевинного и пояскового отделов слуховых центров и какова роль их взаимоотношений с лимбическими структурами, в частности с амигдалой, в выборе формы поведения у рептилий, требует дальнейшего изучения.
У амфибий организация по типу центр–периферия обнаружена только в мезэнцефальном слуховом торусе и отсутствует в таламическом и телэнцефальном слуховых центрах [40, 151]. Однако и у них амигдала получает мультисенсорный вход из дорсоталамических ядер, включая слуховое (заднее таламическое), реагирует на богатый репертуар коммуникативных вокализационных сигналов и имеет выход на моторные структуры. Повреждение амигдалы вызывает подавление способности различать социальные звуковые сигналы партнеров и реагировать на них адекватными моторными реакциями. Оно также нарушает выработку условной реакции пассивного избегания болевого раздражения. Таким образом, у амфибий, также как у представителей амниот, амигдала является ключевым звеном, контролирующим восприятие социальных сигналов и их сохранение в памяти [152–155]. Центральное ядро амигдалы, ответственное у амфибий за аудиомоторную интеграцию, сравнимо по своей функции с предшественником базолатерального ядра амигдалы млекопитающих [152, 154]. Учитывая отсутствие у амфибий в слуховом ядре таламуса деления на центр и периферию, его полисенсорные (сомато-слуховые) свойства и наличие проекций в амигдалу, ответственных за формирование ответных поведенческих реакций, можно полагать, что оно соответствует скорее экстралемнисковому отделу таламического ядра амниот.
Сравнение ростральных слуховых центров у амниот и анамний дает основание заключить, что у всех позвоночных они содержат поясковый отдел, обладающий экстралемнисковыми свойствами и связями с лимбической системой, обеспечивающими реализацию главных, жизненно важных функций организма (репродуктивные, гомеостатические, пищевые, защитные, агрессивные), ответственных за выживание. Этот древний отдел сохраняется и в слуховых центрах у высших позвоночных, обнаруживая высокую эволюционную консервативность. Центральный, сердцевинный отдел, обладающий лемнисковыми свойствами, формируется позднее, прогрессивно специализируется в филогенезе под влиянием совершенствования периферического слухового аппарата и эколого-адаптивных преобразований. Он достигает высокой степени дифференцировки у высших позвоночных, обнаруживая значительную пластичность в процессе эволюции.
Вопрос об эволюционном возрасте и путях эволюции первичных и не первичных сенсорных корковых зон млекопитающих до сих пор является предметом обсуждения; высказывается решение в пользу более древнего происхождения последних [37, 156].
Эволюционная “судьба” предкового не лемни-скового пояскового отдела слуховых центров, также как лемнискового сердцевинного отдела, претерпела огромные преобразования. Вследствие внедрения новых проекций в нем возникали новые подразделения, подвергавшиеся в ходе эволюции прогрессивной парцелляции и сегрегации. Их появление связано с обработкой возраставшего репертуара воспринимаемых звуковых и мультисенсорных сигналов и с сенсо-когнитивными функциями. Показано, что у приматов и человека увеличивается размер не первичных поясковых и перипоясковых (belt, parabelt) отделов MGB, реагирующих на сложные натуральные звуки (вокализационные, речь) [12, 157]. Значительно возрастает у млекопитающих число не первичных сенсорных, в том числе слуховых (до 15), и ассоциативных корковых зон. Именно их появление лежит в основе бурного развития и усложнения конечного мозга в эволюции млекопитающих. В слуховой системе они обеспечивают иерархическую обработку звуковой сигнализации, восприятие невербальных вокализационных сигналов и речи, получающих аффективную оценку благодаря связям с лимбическими структурами. Эти интегративные слуховые зоны более высокого порядка ответственны за сенсо-когнитивные функции [12, 158]. Как они возникли в эволюции? Существуют различные гипотезы, предлагающие возможное объяснение появления новых подразделений структур мозга в эволюции (филогенетические сегрегация, конверсация, пролиферация, модульная агрегация) (см. [159]). С генетическими преобразованиями, происходящими в примитивных не первичных корковых сенсорных зонах, включая слуховую, связано возникновение в них новых подразделений в эволюции (гипотезы: “филогенетического добавления” и “филогенетической дупликации”) [158–160]. Хотя нельзя исключить сложного взаимодействия генетическогого и эпигенетического факторов в этом процессе [161, 162].
У птиц после пересмотра старого представления о гомологии конечного мозга (см. [163]) слуховые зоны в каудальных отделах мезо- и нидопаллиума были отнесены к паллиальным слуховым зонам более высокого порядка, связанными с основным проекционным слуховым полем L. На основании функционального и ходологического сходства они сопоставимы с не первичными слуховыми корковыми зонами млекопитающих [74, 75, 120–125]. Не однозначной остается оценка места периферических отделов поля L (L1, L3 и СМ) в иерархии слуховых центров. Их рассматривают вместе с сердцевинным отделом L2 как гомологи слоев первичной слуховой коры млекопитающих на основании многих общих черт [70, 124]. Однако при этом они получают проекции из поясковых, периовоидальных, отделов таламического слухового ядра и могут быть отнесены к экстралемнисковой поясковой системе.
Результаты сравнительного анализа приводят к заключению, согласно которому поясковые отделы слуховых центров сохраняют филогенетически древние (плезиоморфные) черты среди позвоночных вплоть до высших представителей амниот, обслуживая жизненно необходимые функции, и являются таким образом высоко консервативными. С другой стороны, в ходе эволюции в результате генетических и эпигенетичских преобразований они приобретают новые (апоморфные) черты, связанные с расширением репертуара звуковой сигнализации, прежде всего вокализационной. При этом сохраняется тот же принцип организации слуховых центров типа центр–периферия и те же механизмы перцептивно-аффективной обработки звуковых сигналов и запуска аудиомоторного поведения. Сохраняется у высших амниот и ключевая роль амигдалы в аффективной оценке звуковых сигналов, но при этом в ходе эволюции в обработку слуховой информации вовлекаются филогенетически молодые, стремительно развивающиеся таламо- и кортико-кортикальные системы, формирующиеся в результате эволюционных преобразований их не лемнисковых поясковых отделов.
Этот путь эволюции сенсорных центров рассматривается в настоящее время в рамках концепции “коннективных циклов выживания” (“survival circuit conception”), в основе функционирования которых лежит главный общий механизм сенсо-моторной интеграции. Его истоки обнаруживаются уже на донервном уровне у одноклеточных организмов. Он присущ беспозвоночным и позвоночным животным, являясь у всех организмов необходимым условием их выживания [164, 165]. У всех позвоночных ключевым звеном в циклах выживания, ответственным за эмоциональное и аудиомоторное поведение, обеспечивающие жизненно критические функции (репродуктивные, гомеостатические, терморегуляторные, пищедобывательные, защитные), является амигдала [165, 166]. Циклы выживания являются сенсо-моторным интегративным аппаратом, настроенным на выбор информации из окружающей среды для адаптивного контроля поведения и соответствующих физиологических функций. Базисные компоненты циклов выживания высоко консервативны, существуют и качественно не отличаются у всех позвоночных, включая высших амниот приматов и человека. Они запускаются как наследственными, врожденными, механизмами, так и приобретенными в процессе обучения. В ходе эволюции прогрессивно возрастают состав и свойства воспринимаемых звуковых сигналов, появляются не первичные корковые слуховые зоны высшего порядка, связанные с лимбическими и ассоциативными полями. Благодаря этому у высших амниот выбор типа поведенческой реакции может быть сделан на основе эмоционально-когнитивной оценки обширного спектра сенсорных сигналов вплоть до их сознательного воспроизведения в памяти. У человека в связи с появлением речи, восприятием музыки появляются новые, осознанные, эмоции (гордость, печаль, стыд и др.), которые приводят к усложнению циклов выживания, вовлекая в их формирование лимбические, вербальные и ассоциативные области коры. Существуют ли их предшественники у млекопитающих до человека и у зауропсидных амниот, не известно, как и само существование у них предшественника когнитивного сознания.
СРАВНЕНИЕ ПРЕДЛАГАЕМОЙ ОЦЕНКИ ЭВОЛЮЦИОННОГО РАЗВИТИЯ РОСТРАЛЬНЫХ СЛУХОВЫХ ЦЕНТРОВ С ДРУГИМИ ПРЕДСТАВЛЕНИЯМИ ОБ ЭВОЛЮЦИИ СЕНСОРНЫХ ЦЕНТРОВ
1. В эволюционной концепции [167, 168] о лемно- и колло-таламотелэнцефальных системах обе системы рассматриваются в целом как филогенетически древние. При этом не учитывается их двойная, лемнисковая и экстралемнисковая, афферентация из центральных (сердцевинных) и периферических (поясковых) отделов мезэнцефальных центров. Приведенные нами данные позволяют в коллоталамических сенсорных ядрах, так же как в лемноталамических, различать отделы разного филогенетического возраста. И в тех и в других опережающее развитие в эволюции принадлежит экстралемнисковым периферическим отделам сенсорных центров, обеспечивающим у всех позвоночных критические для выживания функции.
2. Организация коллоталамических слуховых ядер амниот по типу центр–периферия является аргументом против гипотезы, согласно которой они рассматриваются у птиц и рептилий не как гомологи первичных релейных ядер таламуса млекопитающих, а как гомологи интраламинарного/заднего таламуса млекопитающих, проецирующегося в клауструм/базолатеральный отдел амигдалы [159, 169]. Ключевой факт, противоречащий этой гипотезе, состоит в том, что проекции в клаустро-амигдалярный комплекс характерны в основном для периферических, поясковых, отделов релейного таламического слухового ядра млекопитающих (MGВ), птиц (Оv) и рептилий (Re/Mр). Центральные, сердцевинные, отделы этих ядер проецируются соответственно в первичные слуховые поля: первичная слуховая область неокортекса млекопитающих, нидопаллиальное поле L2 птиц, вентральный отдел переднего DVR рептилий. Это дает основание поддержать представление о гомологии таламических слуховых центров птиц и рептилий с релейными слуховыми ядрами млекопитающих, а их телэнцефальные проекционные поля рассматривать как гомологичные согласно неокортикальной гипотезе [163, 170 ] .
ЗАКЛЮЧЕНИЕ
Происхождение в эволюции различных типов нейрональной организации мозговых центров обусловлено фенотипическим отбором механизмов оптимального выполнения их индивидуально специфического функционального назначения. Организация ростральных слуховых центров типа центр–периферия (core-belt) у амниот обеспечивает интеграцию перцептивной и аффективной обработки звуковых сигналов, поступающих из их периферических (поясковых) отделов в амигдалу, где они переключаются на вегетативные и моторные центры. Результатом перцептивно-аффективной интеграции является выбор функционально значимой на данный момент сенсорной посылки для реализации адекватной формы адаптивного поведения и его вегетативного обеспечения, как необходимое условие преимущества в борьбе за выживание. Этот древний, высоко консервативный механизм выбора необходимой формы аудиомоторного и аудиовегетативного поведения характерен для всех позвоночных. Истоки его прослежены на самом примитивном, донервном, уровне у одноклеточных организмов. В процессе эволюции позвоночных происходили прогрессивная специализация и усложнение обоих, центрального и периферического, отделов слуховых центров. Это обусловлено прогрессирующим развитием периферического воспринимающего аппарата, прежде всего расширением вокализационного репертуара. Благодаря этому в эволюции возрастали набор и характер сенсо-эмоциональных и сенсо-когнитивных механизмов, определяющих выбор адекватной формы поведения.
Список литературы
Hu B. Functional organization of lemniscal and non-lemniscal auditory thalamus. Exp. Brain Res. 193: 543–549. 2003. https://doi.org/10.1007/s00221-003-1611-5
Lee C.C. Exploring functions for the non-lemniscal auditory thalamus. Front. Neural. Circuits. 9: 69. 2015. https://doi.org/10.3389/fncir.2015.00069
Ito T., Malmierca M.S. Neurons, connections and microcircuits of the inferior colliculus. In: The Mammalian Auditory Pathways. Springer Verlag: New York. P. 127–157. 2018. https://doi.org/10.1007/978-1-4612-4416-5
Aitkin L.M.,Webster W.R., Veale J.L., Crosby D.C. Inferior colliculus. I. Comparison of response properties in central, pericentral and external nuclei of adult cat. J. Neurophysiol. 38: 1196–1207. 1975. https://doi.org/10.1152/jn.1975.38.5.1196
Cassaday J.H., Diamond I.T., Harting J.K. Auditory pathway to the cortex in Tupaia glis. J. Comp. Neurol. 166 (3): 303–340. 1976. https://doi.org/10.1002/cne.901660304
Kudo M., Niimi K. Ascending projections of the inferior colliculus onto the medial geniculate body in the cat studied by anterograde ang retrograde tracing techniques. Brain Res. 155 (1): 113–117. 1978. https://doi.org/10.1016/0006-8993(78)90310-4
Anderson R.A., Roth G.L., Aitkin L.M., Merzeniel M.M. The efferent projections of the central nucleus and the pericentral nucleus of the inferior colliculus in the cat. J. Comp. Neurol. 194 (3): 649–662. 1980. https://doi.org/10.1002/cne.901940311
Aitkin L.M., Kenyon C.E., Philpott P. The representation of the auditory and somatosensory systems in the external nucleus in the cat colliculus inferior. J. Comp. Neurol. 196 : 25–40. 1981. https://doi.org/10.1002/cne.901960104
Califord M.B., Aitkin L.M. Ascending projections to the medial geniculate body of the cat: evidence for multiple auditory pathways through thalamus. J. Neurosci. 3 (11): 2865–2880. 1983. https://doi.org/10.1523/JNEUROSCI.03-11-02365.1983
Tokunaga A., Sugita S., Otani K. Auditory and nonauditory subcortical afferents to the inferior colliculus in the rat. J. Hirnforsch. 25: 461–472. 1984. PMID: 6481158
Gruters K.G., Groh J.M. Sounds and beyond: multisensory and other non-auditory signals in the inferior colliculus. Front. Neural. Circuits. 6: 96. 2012. PMID: 23248584 PMCID: PMC3518932. https://doi.org/10.3389/fncir.2012.00096
Bartlett E.L. The organization and physiology of the auditory thalamus and its role in the processing acoustic features for speech reception and language. Brain and Language. 126: 29–48. 2013. https://doi.org/10.1016/j.bandl.2013.03.003
Jones E.G. Viewpoint: the core and matrix of thalamic organization. Neuroscience. 85 (2): 331–345. 1998. https://doi.org/10.1016/S0306-4522(97)00581-2
Grothe B., Carr C.E., Cassaday J.H., Fritsch B., Kцppl C. The evolution of central pathways and their neural processing patterns. In: Evolution of Vertebrate Auditory System. Springer Verlag: New York. P. 289–359. 2004. https://doi.org/10.1007/978-1-4419-8957-4
Zeng S.-J., Lin Y.-T., Tian C.-P., Song K.-J., Zhang X.-W., Zuo M.-X. Evolutionary significance of delayed neurogenesis in the core versus shell auditory areas of Mus musculus. J. Comp. Neurol. 515 (5): 600–613. 2009. https://doi.org/10.1002/cne.22076
Nakamura S., Marumi T., Tsutsui K., Lijima T. Difference in the functional significance between the lemniscal and paralemniscal pathways in the perception of direction of single-wisker stimulation examined by muscimol microinjection. Neurosci. Res. 64 (3): 323–329. 2009. https://doi.org/10.1016/j.neures.2009.04.005
Lee C.C., Sherman S.M. On the classification of the pathways in the auditory midbrain, thalamus and cortex. Hear. Res. 276 (1–2): 79–87. 2011. https://doi.org/10.1016/j.heares.2010.12.012
Straka M.M., Schmitz S., Lim H.H. Response features across the auditory midbrain reveal an organization consistent with a dual lemniscal pathway J. Neurophysiol. 112 (4): 981–988. 2014. https://doi.org/10.1152/jn.00008.2014
Oliver D.L., Hall W.C. The medial geniculate body of the tree shrew, Tupaia glis. II. Connections with the neocortex. Comp. Neurol. 182 : 4459–4493. 1978. https://doi.org/10.1002/cne.901820306
Coleman J.R., Clerici W.J. Sources of projections to subdivisions of the inferior colliculus in the rat. J. Comp. Neurol. 262 (2): 215–226. 1987. https://doi.org/10.1002/cne.902620204
Le Doux J.E., Ruggiero D.A., Reis D.J. Topographic organization of. convergent projections to the thalamus from the inferior colliculus and spinal cord in the rat. J. Comp. Neurol. 264 (1): 123–146. 1987. https://doi.org/10.1002/cne.902640110
Le Doux J.E., Farb C., Ruggiero D.A. Topographic organization of. neurons in the acoustic thalamus that project to the amygdale. J. Neurosci. 10 (4): 1043–1054. 1990. https://doi.org/10.1523/JNEUROSCI.10-04-01043.1990
Shinonaga Y., Takada M., Mizuno N. Direct projections from non-laminated divisions of medial geniculate nucleus to the temporal polar cortex and amygdale in the cat J. Comp. Neurol. 340 (3): 405–426. https://doi.org/10.1002/cne.903400310
Campeau S., Davis M. Involvment of subcortical and cortical afferents to the lateral nucleus of the amygdale in fear conditioning measured with fear-potentiated startle in rats trained concurrently with auditory and visual conditioned stimuli. J. Neurosci. 15 (3): 2312–2327. 1995. https://doi.org/10.1523/JNEUROSCI.15-03-02312.1995
Linke R., Braune G., Schwegler H. Differential projection of posterior paralaminar thalamic nuclei to the amygdaloid complex in the rat. Exp. Brain Res. 138 (1): 135–138. 2000. https://doi.org/10.1007/s002210000475
Jones E.G. Chemically defined parallel pathways in the monkey auditory system. Ann. N.Y. Acad. Sci. 999: 218–233. 2003. https://doi.org/10.1196/annals.1284.033
Zhou J., Shore S. Convergence of spinal trigeminal and cochlear nucleus projections in the inferior colliculus of the guinea pig. J. Comp. Neurol. 495 (1): 100–112. 2006. https://doi.org/10.1002/cne.20863
Anderson L.A., Wallace N.M., Palmer A.R. Identification of subdivisions in the medial geniculate body of the guinea pig. Hear.Res. 228 (1-2): 156–167. 2007. https://doi.org/10.1016/j.heares.2007.02.005
Künzle H. Amygdaloid connections in the lesser hedgehog tenrec. Brain Struct. Funct. 217 (1): 141–164. 2012. https://doi.org/10.1007/s00429-011-0328-7
Цветков Е.А., Краснощекова Е.И., Веселкин Н.П., Харазова А.Д. Амигдала: нейроанатомия и нейрофизиология страха. Журн. эвол. биохим. физиол. 51: 406–418. 2015. Tsvetkov E.A., Vesselkin N.P., Krasnoshchekova E.I., Kharazova A.D. Amigdala: Neuroanatomy and neurophysiology of fear. Journal of Evolutionary Biochemistry and Physiology. 51 (6): 456–470. 2015. https://doi.org/10.1134/S0022093015060022
Pandya D.N. Anatomy of the auditory cortex. Rev. Neurol. 151 (8–9): 486–494. 1995. PMID: 8578069
Cruikshank S.J., Killackey H.P., Metherate R. Parvalbumin and calbindin are differently distributed within primary and secondary subdivisions of the mouse auditory forebrain. Neuroscience. 105 (3): 553–569. 2000. https://doi.org/10.1016/S0306-4522(01)00226-3
Budinger E., Hell P., Scheich H. Functional organization of the auditory cortex of Mongolian gerbil (Meriones unguclatus): IV. Connections with anatomically characterized subcortical structures. Eur. J. Neurosci. 12 (5): 2452–2474. 2001. https://doi.org/10.1046/j.1460-9568.2000.00143.x
Pienkowski M., Harrison R.V. Tone response in core versus belt auditory cortex in developing chinchilla. J. Comp. Neurol. 492 (1): 101–199. 2005. https://doi.org/10.1002/cne.20708
De la Mothe L.A., Blumell S., Kajikawa Y., Hackett T.A. Thalamic connections of auditory cortex in marmoset monkeys: lateral belt and parabelt regions. Anat. Rec. 295 (5): 822–836. 2012. https://doi.org/10.1002/ar.22454
Smith P.H., Ulrich D.J., Manning K.A., Banks M.I. Thalamocortical projections to rat auditory cortex from the ventral and dorsal divisions of the medial geniculate body. J. Comp. Neurol. 520 (1): 34–51. 2012. https://doi.org/10.1002/cne.22682
Kaas J.H. The evolution of brains from early mammals to human. Wires Cog. Sci. 4: 33–45. 2013. https://doi.org/10.1002/wcs.1206
Cuello A.C., Kanazawa I. The distribution of substance P immunoreactive fibers in the rat central nervous system. J. Comp. Neurol. 178 (1): 129–156. 1978. https://doi.org/10.1002/cne.901780108
Durand S.E., Zuo M.X., Zhou S.L., Cheng M.-F. Avian auditory pathways show met- enkephalin-like immunoreactivity. Neuroreport. 4 (6): 727–730. 1993. https://doi.org/10.1097/00001756-199306000-00032
Zeng S.-J., Li J., Zhang X., Zuo M. Distinction of neurochemistry between the cores and their shells of auditory nuclei in tetrapode species. Brain Behav. Evol. 70 (1): 1–20. 2007. https://doi.org/10.1159/000101066
Sharma V., Nag T.C., Wadhwa S., Roy T.S. Stereological investigation and expression of calcium binding proteins in developing human inferior colliculus. J. Chem. Neuroanat. 37 (2): 78–86. 2009. https://doi.org/10.1016/j.jchemneu.2008.11.002
Cai D., Yue Y., Su X., Liu M., Wang Y., You L., Xie F., et al. Distinct anatomical connectivity patterns differentiate subdivisions of nonlemniscal auditory thalamus in mice. Cerebral Cortex. 29 (6): 2437–2454. 2019. https://doi.org/10.1093/cercor/bhy115
Gonzalez-Lima F., Cada A. Cytochrome oxidase activity in the auditory system of the mouse: a qualitative and quantitative histochemical study. Neurosci. 63 (2): 559–578. 1994. https://doi.org/10.1016/0306-4522(94)90550-9
Okoyama S., Oubayashi M., Ito M., Harad S. Neuronal organization of the rat inferior colliculus participating in four auditory pathways. Hear. Res. 218 (1–2): 72–80. 2006. https://doi.org/10.1016/j.heares.2006.04.004
Anderson A., Wallace N.M., Palmer A.R. Identification of subdivisions in the medial geniculate body of the guinea pig. Hear. Res. 228 (1–2): 156–167. 2007. https://doi.org/10.1016/j.heares.2007.02.005
Carr C.E., Soares D.D. Shared features of the auditory system of birds and mammals. In: Evolution of the Nervous System. Acad. Press Elsevier: Amsterdam and oth. Non-Mammalian Vertebrates. Vol. 1: 443–457. 2017.
Knudsen E.I. Subdivisions of the inferior colliculus in the barn owl (Tyto alba). J. Comp. Neurol. 218 (2): 174–186. 1983. https://doi.org/10.1002/cne.902180205
Wagner H., Güntürkün O., and Nieder B. Anatomical markers for the subdivisions of the barn owl,s inferior colliculus complex and adjacent peri-and subventricular structures. J. Comp. Neurol. 465 (1): 145–159. 2003. https://doi.org/10.1002/cne.10826
Logerot P., Krützfeldt N.O.E., Wild J.M., Kubke M.F. Subdivisions of the auditory midbrain (n. mesencephalicus lateralis, pars dorsalis) in zebra finches using calcium-binding protein immunocytochemistry. PloS One 6: e 20686. 2011. https://doi.org/10.1371/journal.pone.0020686
Niederleitner B., Luksch H.J. Neuronal morphology in subdivisions of the inferior colliculus of chicken (Gallus gallus). J. Chem. Neuroanat. 44 (1): 24–33. 2012. https://doi.org/10.1016/j.jchemneu.2012.03.004
Braun K., Scheich H., Schachner M., Heizmann C.W. Distribution of parvalbumin, cytochrome oxidase activity and 14 C-2-desoxyglucose uptake of the zebra finch. I. Auditory and vocal motor systems. Cell Tissue Res. 240: 101–115. 1985. https://doi.org/10.1007/BF00217563
Dezso A., Schwarz D.W., Schwarz I.E. A survey of the auditory midbrain, thalamus and forebrain in the chicken (Gallus domesticus) with cytochrome oxidase histochemistry. J. Otolaryngol. 22 (5): 391-396. 1993. PMID: 8283511
Puelles L., Robles C., Martinez-de-la-Torre M., Martinez S. New subdivisions scheme for avian torus semicircularis: histochemical maps in the chick. J. Comp. Neurol. 340 (1): 98–125. 1994. https://doi.org/10.1002/cne.903400108
Wild J.M. Convergence of somatosensory and auditory projections in the avian torus semicircularis, including the central auditory nucleus. J. Comp. Neurol. 358 (4): 465–486. 1995. https://doi.org/10.1002/cne.903580402
Lanuza E., Davies D.C., Landete J.M., Novejarque A., Martinez-Garcia F. Distribution of CGRP-like immunoreactivity in the chick and quail brain. J. Comp. Neurol. 421 (4): 515–532. 2000. https://www.researchgate.net/deref/http%3A%2F%2Fdx.doi.org%2F10.1002%2F(SICI)1096-9861(20000612)421%3A4%3C515%3A%3AAID-CNE4%3E3.0.CO%3B2-6
Zeng S.J., Lin Y.T., Yang L., Zhang X.W., Zuo M.X. Comparative analysis of neuronogenesis between core and shell regions in the chick (Gallus gallus domesticus). Brain Res. 1216: 24–37. 2008. https://doi.org/10.1016/j.brainres.2008.04.012
Lovell P.V., Mello C.V. Brain expression of cholecystokinin in the zebra finch (Taenioppigia guttata). J. Comp. Neurol. 519 (2): 211–237. 2011. https://doi.org/10.1002/cne.22513
Белехова М.Г., Кенигфест Н.Б., Чудинова Т.В., Веселкин Н.П. Распределение кальций-связывающих протеинов парвальбумина и калбиндина в мезэнцефальном слуховом центре голубя. Докл. РАН. 466: 361–365. 2016 a. Belekhova MG, Kenigfest NB, Chudinova TV, Vesselkin NP. Distribution of calcium-binding proteins, parvalbumin and calbindin, in the midbrain auditory centre (MLd) of a pigeon. Dokl Bio Sci. 466: 1–4. 2016a. (In Russ). https://doi.org/10.1134/S001249661601004X
Brauth S.E. Investigation of central auditory nuclei in the budgerigar with cytochrome oxidase histochemistry. Brain Res. 508 (1): 142–146. 1990. https://doi.org/10.1016/0006-8993(90)91127-3
Durand S.E., Tepper J.M., Cheng M.F. The shell region of the nucleus ovoidalis: a subdivision of avian auditory thalamus. J. Comp. Neurol. 323 (4): 495–518. 1992. https://doi.org/10.1002/cne.903230404
Wild J.M., Karten H.J., Frost B.J. Connections of the auditory forebrain in the pigeon (Columba livia). J. Comp. Neurol. 337 (1): 32–62. 1993. https://doi.org/10.1002/cne.903370103
Cheng M.F., Zuo M.X. Proposed pathway for vocal self-stimulation: met-enkephalinergic projections linking the midbrain vocal nucleus, auditory responsive thalamic regions and neurosecretory hypothalamus. J. Neurobiol. 25 (4): 361–379. 1994. https://doi.org/10.1002/neu.480250403
Proctor L., Konishi M. Representation of sound localization cues in the auditory thalamus of the barn owl. Proc. Nat. Acad. Sci. USA. 94 (19): 1021–25. 1997.https://doi.org/10.1073/pnas.94.19.10421
Cheng M.F., Peng J.P. Reciprocal call between the auditory thalamus and the hypothalamus: an antidromic study. Neuroreport. 8 (3): 653–658. 1997. https://doi.org/10.1097/00001756-199702100-00015
Zeng S., Zhang X., Peng W., Zuo M.X. Immunohistochemistry and neural connectivity of the Ov shell in song-bird and their evolutionary implications. J. Comp. Neurol. 470 (2): 192–209. 2004. https://doi.org/10.1002/cne.11042
Brauth S.E., Liang W., Hall W.S. Contact-call driven and tone-driven zenk expression in the nucleus ovoidalis of the budgerigar (Melopsittacus undulatus). Neuroreport. 17 (13): 1407–1410. 2006. https://psycnet.apa.org/doi/10.1097/01.wnr.0000233105.28279.fa
Белехова М.Г., Чудинова Т.В., Кенигфест Н.Б. Метаболическая активность таламического и телэнцефального слуховых центров голубя. Журн. эвол. биохим. физиол. 45: 512–517. 2009. Belekhova M.G., Chudinova T.V., Kenigfest N.B. Metabolic activity of pigeon thalamic auditory centers. Journal of Evolutionary Biochemistry and Physiology. 45 (5): 619–626. 2009. https://doi.org/10.1134/S0022093009050090
Белехова М.Г., Чудинова Т.В., Кенигфест Н.Б. Распределение кальций-связывающих протеинов парвальбумина и калбиндина в таламическом слуховом центре голубя. Журн. эвол. биохим. физиол. 51: 429–435. 2016 б. Belekhova M.G., Chudinova T.V., Kenigfest N.B. Distribution of calcium-binding proteins parvalbumin and calbindin in the thalamic auditory center in pigeons. Journal of Evolutionary Biochemistry and Physiology. 52 (6): 482–489. 2016. https://doi.org/10.1134/S1234567816060070
Wang Y., Zorio D.F.R., Karten H.J. .Heterogeneous organization and connectivity of the chicken auditory thalamus (Gallus gallus). J. Comp. Neurol. 525 (14): 3044–3071. 2017. https://doi.org/10.1002/cne.24262
Cheng M.F., Chalken M., Zuo M., Miller H. Nucleus taeniae of amygdale of birds; an anatomical and functional studies in ring dove (Streptopelia risoria) and European starling (Sturnus vulgaris). Brain Behav. Evol. 53 (5–6): 249–270. 1999. https://doi.org/10.1159/000006597
Cheng M.F., Durand S.E. Song and limbic brain: a new function for the birds own song. Ann. NY Acad. Sci. 1016: 611–627. 2004. https://doi.org/10.1196/annals.1298.019
Ikebushi I., Hasegawa T., Bischof H.J. Amygdala and socio-sexual behavior in male zebra finches. Brain Behav. Evol. 74 (4): 250–257. 2009. https://doi.org/10.1159/000264660
Atoji Y., Wild J.M. Afferent and efferent projections of the central caudal nidopallium in the pigeon. J. Comp. Neurol. 517: 350–370. 2009. https://doi.org/10.1159/000264660
Atoji Y., Wild J.M. Afferent and efferent projections of the mesopallium in the pigeon (Columba livia). J. Comp. Neurol. 520 (4): 717–741. 2012. https://doi.org/10.1002/cne.22763
Fuji T.G., Ikebushi I., Okanoya K. Auditory responses to vocal sounds in the song bird nucleus taeniae of the amygdala and adjacent arcopallium. Brain Behav. Evol. 87 (4): 275–289. 2016. https://doi.org/10.1159/000447233
Zettel M.L., Frizina R.D., Haider S.E., O’Neill W.E. Age-related changes in calbindin and calretinin immunoreactivity in the inferior colliculus of CBA/Ca J and C57B 1/6 mice. J. Comp. Neurol. 386 (1): 92–110. 1997.
Kelley P.E., Frizina R.D., Zettell M.L., Walton J.P. Differential calbindin-like immunoreactivity in the brainstem auditory of the chinchilla. J. Comp. Neurol. 320 (2): 196–212. 1992. https://doi.org/10.1002/cne.903200205
Vater M., Braun K. Parvalbumin, calbindin D-28k and calretinin immunoreactivity in the ascending auditory pathway of horseshoe bats. J. Comp. Neurol. 341 (4): 534–558. 1994. https://doi.org/10.1002/cne.903410409
De Venecia R.K., Smelser C.B., McMullen N.T. Parvalbumin is expressed in a reciprocal circuit linking the medial geniculate body and auditory neocortex in the rabbit. J. Comp. Neurol. 400 (3): 349–362. 1998. https://doi.org/10.1002/(sici)1096-9861(19981026)400:3%3C349::aid-cne5%3E3.3.co;2-c
Tardif E., Chiry O., Probst A., Magistretti P.J., Clarke S. Patterns of calcium-binding proteins in human inferior colliculus: identification of subdivisions and evidence for putative parallel systems. Neurosci. 116 (4): 1111–1121. 2003. https://doi.org/10.1016/S0306-4522(02)00774-1
Martin del Campo H., Kevin Measor, Khaleel A Razak Parvalbumin and calbindin expression in parallel thalamocortical pathways in a gleaning bat, Antrozous Pallidus. J. Comp. Neurol. 522 (10), 2431–45. 2014. https://doi.org/10.1002/cne.23541
Campos L.M.G., Osorio E.C., da Silva Santos G.L., Nogueira M.J., et al. Temporal changes in calcium binding proteins in the medial geniculatus nucleus of the monkey Sepajus paella. J. Chem. Neuroanat. 68: 45–54. 2015. https://doi.org/10.1016/j.jchemneu.2015.07.005
Takahashi T.T., Carr C.E., Brecha N., Konishi M. Calcium binding protein-like immunoreactivity labels the terminal field of nucleus laminaris of the barn owl. J. Neurosci. 7 (6): 1843–1856. 1987. https://doi.org/10.1523/JNEUROSCI.07-06-01843.1987
Heizmann C.W., Braun K. Calcium binding proteins. Molecular and functional aspects. In: The role of calcium in biological systems. CRC Press Inc.: Roca Raton, FL. 21–65. 1990. Google Scholar
Braun K., Scheich H., Heizmann C.W., Hunziker W. Parvalbumin and calbindin-D-28k immunoreactivity as developmental markers of auditory and vocal motot nuclei of the zebra finch. Neurosci. 40 (3): 853–869. 1991. https://doi.org/10.1016/0306-4522(91)90017-I
Pinaud R., Saldanha C.J., Wynne R.D., Lovell P.V., Mello C.V. The excitatory thalamo-“cortical” projection within the song control system of zebra finches is formed by calbindin-expressing neurons. J. Comp. Neurol. 504 (6): 601–618. 2007. https://doi.org/10.1002/cne.21457
Cant N.B., Benson C.G. Multiple topographically organized projections connect the central nucleus of the inferior colliculus to the ventral division of the medial geniculate nucleus in the gerbil, Meriones unguiculats. J. Comp. Neurol. 503 (3): 432–453. 2007. https://doi.org/10.1002/cne.21391
Wang Y., Karten H.J. Three subdivisions of the auditory midbrain in chicks (Gallus gallus) identified by their afferent and commissural projections. J. Comp. Neurol. 518 (8): 1199–1219. 2010. https://doi.org/10.1002/cne.22269
Storace D.A., Higgins N.C., Read H.L.Thalamic label patterns suggest primary band ventral auditory fields are distinct core regions. J. Comp. Neurol. 518 (10): 1630–1647. 2010. https://doi.org/10.1002/cne.22345
Guillery R.W., Sherman S.M. The thalamus as a motor output. Phil. Trans. R Soc. Lond. 357 (1428): 1809–1821. 2002. https://dx.doi.org/10.1098%2Frstb.2002.1171
Guillery R.W. Anatomical pathways that link perception and action. Progr. Brain Res. 149: 235–256. 2005. https://doi.org/10.1016/s0079-6123(05)49017-2
Medina L., Abellan A., Desfilis E. Evolution of pallial areas and networks involved in sociality: comparison between mammals and sauropsids. Frontiers Physiol. 10: 894. 2019. https://doi.org/10.3389/fphys.2019.00894
Doron N.N., Le Doux J.E. Organization of projections to the lateral amygdale from auditory and visual areas of the thalamus in the rat. J. Comp. Neurol. 412 (3): 383–409. 1999. PMID: 10441229
Le Doux J.E. Emotion circuits in the brain. Ann. Rev. Neurosci. 23: 155–184. 2000. https://doi.org/10.1146/annurev.neuro.23.1.155
Pesoa L. Emotion and cognition and the amygdale: from “what is it ? to”what to be done?”. Neuropsychol. 48 (12): 3416–3429. 2010. https://dx.doi.org/10.1016%2Fj.neuropsychologia.2010.06.038
Gadziolla M.A., Shandhag S.I., Wenstrup J.J. Two distinct representations of social vocalization in the basolateral amygdale. J. Neurophysiol. 115(2): 868–886. 2016. https://dx.doi.org/10.1152%2Fjn.00953.2015
Мухина Ю.К. Афферентные связи базолатерального отдела амигдалоидного комплекса мозга кошки. Арх. анат. гистол. эмбриол. 88: 25–34. 1985. Mukhina Ju.K. Afferentnye svjazi bazolateralnogo otdela amigdaloidnogo kompleksa mozga koshki. Arkhiv Anat. Gistol. Embriol. 88: 25–34. 1985. (In Russ).
Mascagni F., McDonald A.J., Coleman J.R. Corticoamygdaloid and corticocortical projections of the rat temporal cortex: a Phaseolus vulgaris leucoagglutinin study. Neurosci. 57 (3): 697–715. 1993. https://doi.org/10.1016/0306-4522(93)90016-9
Li X.F., Stutzmann G.F., Le Doux J.E. Convergent but temporally separated inputs to lateral amygdale from the auditory thalamus. Learn. Mem. 3 (2–3): 229–242. 1996. https://doi.org/10.1101/lm.3.2-3.229
Antunes R., Moita M.A. Discriminative auditory fear learning recuires both tuned and nontuned auditory pathways to the amygdale. J. Neurosci. 30 (29): 9782–9787. 2010. https://doi.org/10.1523/jneurosci.1037-10.2010
Janak P.H., Tue K.M. From circuits to behavior in amygdale. Nature. 517 (7534): 284–292. 2015. https://doi.org/10.1038/nature14188
Bergstrom H.C., Johnson L.R. An organization of visual and auditory fear conditioning in the lateral amygdale. Neurobiol. Learn. Memory. 116: 1–13. 2014. https://doi.org/10.1016/j.nlm.2014.07.008
Saddors M.P., Gallagher M., Schoenbaum G. Rapid associative encoding in basolateral amygdale depends on connections with orbitofrontal cortex. Neuron. 46 (2): 321–331. 2005. https://doi.org/10.1016/j.neuron.2005.02.018
Rudebeck P.H., Walton M.E., Millette B.H., Shirley E., Rushwworth M.F., Bannerman DH. Distinct contribution of frontal areas to emotional and social behavior in the rat. Eur. J. Neurosci. 26 (8): 2315–2326. 2007. https://doi.org/10.1111/j.1460-9568.2007.05844.x
Lichtenberg N.T., Pennigton Z.T., Holley S.M., Greenfield V.Y., Cepeda C. et al. // Basolateral amygdala to orbitofrontal projections enable cue-triggered reward expectations. J. Neurophysiol. 37 (35): 8374–8384. 2017. https://doi.org/10.1523/jneurosci.0486-17.2017
Sander K., Bechmann A., Scheich H. Audition of laughing and crying leads to right amygdale activation in a low noise fMRI setting. Brain Res. Brain Res. Prot. V. 11 (2): 81–91. 2003. https://doi.org/10.1016/s1385-299x(03)00018-7
Naumann R.T., Kanwal J.S. Basolateral amygdala respond robustly to social calls: spiking characteristics of single unit activity. J. Neurophysiol. 105 (2): 2389–2404. 2011. https://doi.org/10.1152/jn.00580.2010
Fruhholz S., Trost W., Grandjean D. The role of medial temporal limbic system in voice and music. Progr. Neurobiol. 123: 1–17. 2014. https://doi.org/10.1016/j.pneurobio.2014.09.003
Zhao Y., Sun Q., Chen G., Yang J. Hearing emotional sounds: category representation in the human amygdale. Soc. Neurosci. 13 (1): 117–128. 2018. https://doi.org/10.1080/17470919.2016.1267040
Xiao C., Liu Y., Xu J., Can X., Xiao Z. Septal and hippocampal neurons contribute to auditory relay and fear conditioning. Front. Cell. Neurosci. 12:102 (1–17). 2018. https://doi.org/10.3389/fncel.2018.00102
Reiner A., Perkel D.J., Bruce L.L., Butler A.B., Csillag A. et al. Avian Brain Nomenclatura Forum. Revised nomenclature for avian telencephalon and some other related brainstem nuclei. J. Comp. Neurol. 473 (3): 377–414. 2004. https://doi.org/10.1002/cne.20118
Martinez-Garcia F., Novejarque A., Lanuza E. Evolution of the amygdala in vertebrates. In: Evolution of the Nervous System. Academic Press Elsevier: Amsterdam and oth. 2. Nonmammalian vertebrates: 255– 334. 2007.
Saint-Dizier H., Constantin P., Davies D.C., Leterrier C., Lлvy F., Richar S. Subdivisions of the arcopallium posterior amygdale complex are differentially involved in the control of fear behavior of the Japanese quil. Brain Res. Bull. 79 (5): 288–295. 2009. https://doi.org/10.1016/j.brainresbull.2009.03.004
Xin Q., Ogura Y., Uno L., Matsushima T. Selective contribution of the telencephalic arcopallium to the social facilitation of foraging efforts in the domestic chick. Eur. J. Neurosci. 45 (3): 365–380. 2017. https://doi.org/10.1111/ejn.13475
Daffers R. Active avoidance behavior following archistriatal lesions in pigeon. J. Comp. Physiol. Psychol. 89 (10): 1169–1179. 1975. https://doi.org/10.1037/h0077181
Lowndes M., Davis D.C. The effect of archistriatal lesion on one trial passive avoidance learning in chick. Eur. J. Neurosci. 6 (4): 525–530. 1994. https://doi.org/10.1111/j.1460-9568.1994.tb00296.x
Lowndes M., Davis DC. The effect of archistriatal lesion on “open-field” and fear/avoidance behavior in the domestic chick. Behav. Brain Res. 72 (1-2): 25–32. 1995.https://doi.org/10.1016/0166-4328(95)00026-7
Gao M., Lengersdorf D., Stüttgen M.C., Güntürkün O. NMDA receptors in the avian amygdale and premotor arcopallium mediate distinct aspects of appetitive learning. Behav. Brain Res. 343: 71–82. 2018. https://doi.org/10.1016/j.bbr.2018.01.026
Vates G.E., Broome B.M., Mello C.V., Nottebohm F. Auditory pathways of caudal telencephalon and their relation to the song system of adult male finches (Taeniopygia guttata). J. Comp. Neurol. 366 (4): 613–642. 1996. https://doi.org/10.1002/(sici)1096-9861(19960318)366:4%3C613::aid-cne5%3E3.0.co;2-7
Genter T.Q., Hulse S.H., Ball G.F. Functional differences in forebrain auditory regions during learned vocal recognition in songbirds. J. Comp. Physiol. A. 190 (12): 1001–1010. 2004. https://doi.org/10.1007/s00359-004-0556-x
Sadananda M., Korte S., Bischof H.J. Afferentation of a caudal forebrain area activated during courtship behavior: a tracing study in the zebra finch (Taeniopygia guttata). Brain Res. 1184: 108–120. 2007. https://doi.org/10.1016/j.brainres.2007.09.040
Prather JF. Auditory signal processing in communication: perception and performance of vocal sounds. Hear. Res. 305: 144–155. 2013. https://doi.org/10.1016/j.heares.2013.06.007
Calabrese A., Woolsey S.M.N. Coding principles of the canonical cortical microcircuit in the avian brain. Proc. Natl. Acad. Sci. USA. 112 (11): 3517–3522. 2015. https://doi.org/10.1073/pnas.1408545112
Danning J.l., Maze S.E., Atwood E.J., Prather J.F. Caudal mesopallial neurons in female songbirds bridge sensory and motor brain regions. J. Comp. Neurol. 526 (10): 1703–1711. 2018. https://doi.org/10.1002/cne.24440
Pritz M.B. Ascending connections of a midbrain auditory area in a crocodile, Caiman crocodilius. J. Comp. Neurol. 153 (2): 179–193. 1974. https://doi.org/10.1002/cne.901530204
Foster R.E., Hall W.C. The organization of auditory pathways in a reptile Iguana iguana. J. Comp. Neurol. 178 (4): 783–832. 1978. https://doi.org/10.1002/cne.901780412
Browner R.H., Kennedy M.C., Facelle T. The cytoarchitecture of the torus in the red-eared turtle. J. Comp. Neurol. 169 (2): 207–223. 1981. https://doi.org/10.1002/jmor.1051690207
Butler A.B., Bruce L.L. Nucles laminaris of the torus semicircularis: projection to the spinal cord in reptiles. Neurosci. Lett. 25 (3): 221–226. 1981. https://doi.org/10.1016/0304-3940(81)90395-5
Woodson W., Künzle H. Distribution and structural characterization of neurons giving rise to descending spinal projections in the turtle, Pseudemys scripta elegans. J. Comp. Neurol. 212 (4): 336–348. 1982. https://doi.org/10.1002/cne.902120403
Belekhova M.G., Zharskaja V.D., Khachunts A.S., Gaidaenko G.V., Tumanova N.L. Connectionss of the mesencephalic, thalamic and telencephalic auditory centers in turtles: Some structural bases for audisomatic interrelations. J. Hirnforsch. B. 26 (2): 127–152. 1985. PMID: 2410486
Künzle H. Projections from the cochlear nuclear complex to rhombencephalic auditory centers and inferior colliculus in the turtle. Brain Res. 379: 307–319. 1986. https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0020686#
Pritz M.B., Stritzel M.E. A second auditory area in the non-cortical telencephalon of a reptile. Brain Res. 569 (1): 146–151. 1992. https://doi.org/10.1016/0006-8993(92)90381-i
Белехова М.Г. Таламо-амигдалярные слухо-соматические связи – древняя консервативняя черта организации мозга амниот (Анализ собственных и литературных данных. Гипотеза). Журн. эвол. биохим. физиол. 30: 454–473. 1994. Belekhova M.G. Thalamo-amygdalar auditory-somatosensory projections are primitive conservative brain character of amniotes (analysis of literature and own data, hypotheses) J. Evol. Bioch. A. Physiol. 30: 454–473. 1994.(In Russ).
Diaz C., Yanes C., Trujillo CM., Puelles L.Cytoarchitectonic subdivisions in the subtectal midbrain of the lizard Gallotia galotti. J. Neurocytol. 29 (8): 569–593. 2000. https://doi.org/10.1023/a:1011067918585
Khachunts A.S. Electrophysiological characteristics of representation of auditory and somatosensory systems in the turtle midbrain. Neurophysiology 14: 191–198. 1983. https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0020686#
Khachunts A.S., Belekhova M.G. Characteristics of representations of the auditory and somatosensory systems in the thalamus of the turtle: electrophysiologic study. Neurophysiology. 18 (4): 443–453. 1986. (In Russ.). PMID: 3762789
Belekhova M.G., Chudinova T.V., Repérant J., Ward R., Jay B., Vesselkin N.P. and Kenigfest N.B. Core-and-belt organisation of the mesencephalic and forebrain auditory centres in turtles: expression of calcium-binding proteins and metabolic activity. Brain Res. 1345: 84–102. 2010. https://doi.org/10.1016/j.brainres.2010.05.026
Xi C., Chen Q., Zeng S.-J., Lin Y.-T., Huang Y.-F., Kiu Y., Zhang X.-W., Zuo M.X. Sites of origin and developmental core and shell regions of torus semicircularis in the Chinese softshell turtle (Pelodiccus sinensis). J. Comp. Neurol. 519 (13): 2677–2696. 2011. https://doi.org/10.1002/cne.22646
Belekhova M.G., Kenigfest N.B., Vesselkin N.P., Rio J.-P., Repйrant J., Ward R. Evolutonary significance of different neurochemical organization of the internal and external regions of auditory centers in the reptilian brain: an immunocytochemical and reduced NADPH-diaphorase histochemical study in turtles. Brain Res. 925 (1): 100–106. 2002. https://doi.org/10.1016/s0006-8993(01)03255-3
Yan K., Tang Y.-Z., Carr C.E. Calcium-binding protein immunoreactivity characterizes the auditory system of Gekko gecko. J. Comp. Neurol. 518 (17): 3409–3426. 2010. https://doi.org/10.1002/cne.22428
Chudinova T.V., Belekhova M.G., Tostivint E., Rio J.-P., Ward R., Kenigfest N.B. Differences in CB- and PV-chemospecificity in the centres of the ascending auditory pathway of turtles revealed by double immunofluorescence labeling. Brain Res. 1473: 87–103. 2012. https://doi.org/10.1016/j.brainres.2012.07.022
Lanuza E., Belekhova M.G., Martinez-Marcos A., Font C., Martinez-Garcia F. Identification of the basolateral amygdale; an anatomical investigation of afferents to the posterior dorsal ventricular ridge of the lizard Podarcis hispanica. Eur. J. Neurosci. 10 (11): 3517–3574. 1998. https://doi.org/10.1046/j.1460-9568.1998.00363.x
Chkheidze D.D., Belekhova M.G. Projections of olfactory bulbs and non-olfactory telencephalic structures in amygdaloid complex of the turtle Testudo horsfieldi: a study using anterograde tracer technique. J. Evol. Bioch. Physiol. 41(5): 561–569. 2005.Translated from Zhurnal Evolyutsionnoi Biokhimii i Fiziologii, 41(5): 450–456. 2005. PMID: .16316043
Medina L., Bupesh M., Abellan A. Contribution of genoarchitecture to understanding forebrain evolution and development with particular emphasis on the amygdale. Brain Behav. Evol. 78 (3): 216–236. 2011. https://doi.org/10.1159/000330056
Piniak W.E.D., Mann D.A., Harms C.A., Jones T.T., Eckert S.A. Hearing in the juvenile green sea turtle (Chelonia midas): a comparison under water and aerial hearing using auditory evoked potentials. PLoS One. 2016. 11: e0159711. https://doi.org/10.1371/journal.pone.0159711
Higgs D.M. Brittan-Powell E.F., Soares D., Sonza M.J., Carr C.E. et al. Amphibious auditory responses of the American alligator (Alligator mississipiensis). J. Comp. Physiol. A. Neuroethol. Sens. Neural Behav. Physiol. 188 (3): 217–223. 2002. https://doi.org/10.1007/s00359-002-0296-8
Brittan-Powell E.F., Cristensen-Dalsgaard J., Tang J., Carr C.E., Dooling R.J. The auditory brainstem responses in two lizard species. Acoust. Soc. Am. 128 (2): 78–7–792. 2010. https://dx.doi.org/10.1121%2F1.3458813
Vergene A., Pritz M.B., Mathevon N. Acoustic communication in crocodilians: from behavior to brain. Biol. Rev. Camb. Philos. Soc. 84 (3): 391–411. 2009. https://doi.org/10.1111/j.1469-185x.2009.00079.x
Berroozi M., Billings B.K., Helluy X., Gьntьrkьn O., Stцckens F. Functional MRI in the Nile crocodile: a new avenue for evolutionary neurobiology. Proc. Biol. Sci. 285:(1877). 2018. https://doi.org/10.1098/rspb.2018.0178
Huang Y.F., Zhang J.Y., Xi C., Zeng S.J., Zhang X.W., Zuo M.X. Germinal sites and migrating routes of cells in the mesencephalic and diencephalic auditory areas in the African clawed frog (Xenopus laevis). Brain Res. 1373: 67–78. 2011. https://doi.org/10.1016/j.brainres.2010.12.026
Moreno N., Gonzalez A. Localization and connectivity of the lateral amygdala in anuran amphibians. J. Comp. Neurol, 479 (2): 130–148. 2004. https://doi.org/10.1002/cne.20298
Laberge F., Roth G. Organization of the sensory input to the telencephalon in the fire-belled toad, Bombina orientalis. J. Anat. 502 (1): 55–78. 2007. https://doi.org/10.1002/cne.21297
Hall I.C., Ballagh I.H., Kelley D.B. The Xenopus amygdale mediates appropriate vocal communicative signals. J. Neurosci. 33 (36): 14534–14548. 2013. https://doi.org/10.1523/JNEUROSCI.1190-13.2013
Paddington M.H., Daneri M.F., Papini M.R., Muzio R.N. Telencephalic neural activation following passive avoidance learning in a terrestrial toad. Brain Behav. Res. 315: 75–82. 2016. https://doi.org/10.1016/j.bbr.2016.08.003
Slutsky D.A., Manger P.R., Kubitzer L. Multiple somatosensory areas in parietal cortex of the California grand squirrel (Spermoohilus beecheyll). J. Comp. Neurol. 416 (4): 521–539. 2000. https://doi.org/10.1002/(sici)1096-9861(20000124)416:4%3C521::aid-cne8%3E3.0.co;2-#
Winer J.A. The human medial geniculate body. Hear Res. 15 (3): 225–247. 1984. https://doi.org/10.1016/0378-5955(84)90031-5
Kaas J.H., Hackett T.A., Tramo M.J. Auditory processing in primates cerebral cortex. Curr. Opin. Neurobiol. 9 (2): 164–170. 1999. https://doi.org/10.1016/s0959-4388(99)80022-1
Striedter J.F. Principles of Brain Evolution. University California Press: Irvine. 2005.
Kaas J.H. Reconstructing the areal organization of the neocortex of the first mammals. Brain Behav. Evol. 78 (1): 7–21. 2011. https://doi.org/10.1159/000327316
Krubitzer L., Hoffman K.J. Arealization of the neocortex in mammals: genetic and epigenetic contributions. Brain Behav. Evol. 55 (6): 201–208. 2000. https://doi.org/10.1159/000006667
Krubitzer L. The magnificent compromise : cortical field evolution in mammals. Neuron. 56 (2): 201–208. 2007. https://doi.org/10.1016/j.neuron.2007.10.002
Karten H.J. Vertebrate brain and evolutionary connectomics: on the origins of mammalian “neocortex”. Philos. Trans. R. Soc. Lond. Biol. Sci. 370: (1684). 2015. https://doi.org/10.1098/rstb.2015.0060
Le Doux J.E. Rethinking the emotional brain. Neuron. 73 (4): 653–676. 2012a. https://doi.org/10.1016/j.neuron.2012.02.004
Le Doux J.E. Evolution of human emotion: a view through the fear. Progr. Brain. Res. 195: 431–442. 2012 b. https://dx.doi.org/10.1016%2FB978-0-444-53860-4.00021-0
Martinez-Garcia F., Lanuza E. Evolution of the vertebrate survival circuits. Curr. Opin. Behav. Sci. 24: 113–123. 2018. https://doi.org/10.1016/j.cobeha.2018.06.012
Butler A.B. The evolution of the dorsal thalamus of jawed vertebrates, including mammals: cladistic analysis and a new hypothesis. Brain Res. Rev. 19 (1): 29–65. 1994. https://doi.org/10.1016/0165-0173(94)90003-5
Butler A.B., Hodos W. Comparative Vertebrate Neuroanatomy. Evolution and Adaptation. 2-nd Edition. Hoboken, New Jersey: Wiley-Interscience. 2005.
Puelles L. Thoughts on the development structure and evolution of the mammalian and avian telencephalic pallium. Phil. Trans. R. Soc. B. 156 (1414): 1583–1598. 2001. https://doi.org/10.1098/rstb.2001.0973
Wild J.M., Krützfeldt N.O.E. Neocortical-like organization of avian auditory cortex. Brain Behav. Evol. 76 (2): 89–92. 2010. https://doi.org/10.1159/000320215
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


