Журнал эволюционной биохимии и физиологии, 2020, T. 56, № 4, стр. 285-298
СТРУКТУРА И ЭВОЛЮЦИЯ СЕНСОРНОЙ ПОВЕРХНОСТИ АНТЕНН РУЧЕЙНИКОВ ИЗ ЭНДЕМИЧНЫХ ТРИБ BAICALININI И THAMASTINI (TRICHOPTERA: APATANIIDAE) ОЗЕРА БАЙКАЛ
М. Ю. Валуйский 1, *, С. И. Мельницкий 1, **, В. Д. Иванов 1, ***
1 Санкт-Петербургский государственный университет, кафедра энтомологии
Санкт-Петербург, Россия
* E-mail: Sphingonaepiopsis@gmail.com
** E-mail: simelnitsky@gmail.com
*** E-mail: v-ivanov@yandex.ru
Поступила в редакцию 28.01.2020
После доработки 20.02.2020
Принята к публикации 03.05.2020
Аннотация
Исследование кутикулярных структур у 10 видов Apataniidae из разных филогенетических ветвей семейства позволило определить состав сенсорной поверхности антенн, который включает 8 типов и подтипов сенсилл: длинные трихоидные, изогнутые трихоидные, хетоидные, грибовидные псевдоплакоидные, копьевидные псевдоплакоидные, базиконические и коронарные сенсиллы, а также бемовы щетинки. Установлены основные особенности распределения сенсилл Apataniidae. Выявлены направления эволюции антеннальных структур в пределах эндемичных триб Baicalinini и Thamastini озера Байкал.
ВВЕДЕНИЕ
Современная мировая фауна ручейников семейства Apataniidae включает 207 видов, относящихся к 18 родам, что составляет небольшую долю в пределах отряда Trichoptera, насчитывающего более 16 780 видов (http://www.clemson.edu/cafls/departments/esps/database/trichopt/). Представители Apataniidae распространены в палеарктической, неарктической и ориентальной областях [1]. Структура этого семейства до конца не определена: помимо 2 общепризнанных подсемейств Apataniinae и Moropsychinae, в его состав включают еще 4 рода с неясным таксономическим положением: голарктический Allomyia и неарктические Manophylax, Moselyana и Pedomoecus. Семейство Apataniinae входит в состав надсемейства Limnephiloidea инфраотряда Plenitentoria подотряда цельнощупиковых ручейников (Integripalpia) и является важной группой для понимания и выявления филогенетических связей внутри Plenitentoria.
В последние годы интенсивно развиваются исследования антеннальных сенсилл ручейников, которые крайне разнообразны по морфологии и особенностям локализации на поверхности флагелломеров антенн [2–12]. Сенсорные антеннальные структуры ручейников включают более 20 типов и подтипов сенсилл, при этом антенны отдельных видов могут нести от 6 до 13 типов различных структур [5–10]. Продемонстрировано, что у ручейников и чешуекрылых имеется принципиальное сходство в строении антеннальных сенсилл [3, 4, 7, 8, 13].
Эндемичная фауна ручейников озера Байкал представлена 14 видами из 7 родов и 2 триб семейства Apataniidae: Baicalina bellicosa Martynov, 1914, B. levanidovae Ivanov et Menshutkina, 1996, B. reducta Martynov, 1924, B. thamastoides Martynov, 1914, Baicalinella foliata Martynov, 1914, Baicalodes ovalis Martynov, 1914, Protobaicalina multispinosa Mey, 1994, P. nigrostriata Martynov, 1914, P. spinosa Martynov, 1914, P. tallingi Rozhkova, 1996, Protoradema baicalensis Martynov, 1914, P. setosum Martynov, 1924, Radema infernale Hagen, 1872, и Thamastes dipterus Hagen, 1858.
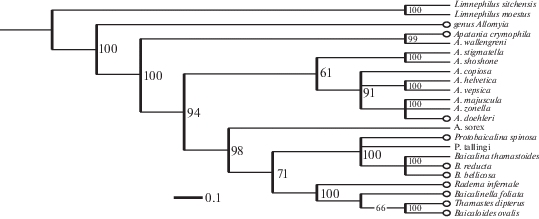
А.В. Мартынов [14] предполагал, что все многообразие байкальских Apataniidae могло сформироваться на основе архаичных форм, близких к представителям рода Apatania, которые исходно попали в водоем. Первая филогенетическая схема байкальских ручейников, основанная, главным образом, на признаках строения генитального аппарата, была предложена В.Д. Ивановым и Т.В. Меншуткиной [15]. В дальнейшем монофилия байкальских триб Baicalinini и Thamastini семейства Apataniidae была подтверждена по результатам анализа молекулярных данных [16].
Как недавно показано на примере ручейников Ecnomus tenellus (Ecnomidae), обладающих широким распространением, у удаленных друг от друга популяций вида размер и количество антеннальных сенсилл различаются [10], что может быть связано с дивергенцией структур сенсорных поверхностей в ходе продолжающегося видообразования. На уровне близкородственных, недавно дивергировавших видов байкальских представителей семейства Apataniidae, подобные различия могут быть более выражены. Наше исследование направлено на анализ строения и особенностей расположения сенсорного вооружения антенн байкальских ручейников и сопоставление этих данных с филогенетическими схемами триб Baicalinini и Thamastini, основанными на морфологических и молекулярных признаках. Результаты данной работы будут полезны для дальнейших исследований в областях электрофизиологии, этологии и коммуникации насекомых.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЙ
Исследованные виды
Особенности строения антеннальной поверхности были исследованы у 10 видов Apataniidae: Allomyia sajanensis Levanidova, 1967; Apatania crymophila McLachlan, 1880; Apatania doehleri Schmid, 1954; Baicalina bellicosa Martynov, 1914; Baicalina reducta Martynov, 1924; Baicalinella foliata (Martynov, 1914); Baicaloides ovalis (Martynov, 1914); Protobaicalina spinosa (Martynov, 1914); Radema infernale Hagen, 1872 и Thamastes dipterus Hagen, 1858. В работе были использованы преимущественно самцы, данные по самкам были получены для A. doehleri и Th. dipterus. В работе использовался материал, собранный авторами в различных регионах Сибири, а также из коллекции ЗИН РАН (Санкт-Петербург).
Для реконструкции таксономического положения исследуемых видов в анализ филогении включен дополнительный материал по нуклеотидным последовательностям, полученный с сайта GenBank (https://www.ncbi.nlm.nih.gov/genbank/): A. crymophila McLachlan, 1880, A. copiosa (McLachlan, 1875); A. vepsica Ivanov, 1991; A. doehleri Schmid, 1954; A. helvetica (Nielsen, 1950) и Allomyia tripunctata (Banks, 1900).
Сканирующая электронная микроскопия
От каждого вида были взяты 2–4 антенны от разных экземпляров обоих полов. Антенны каждого экземпляра были отделены от головной капсулы и дегидратированы за счет помещения на 10 мин в 96% этанол, а затем смонтированы на столики для электронной микроскопии, покрытые электропроводящей углеродной липкой лентой. При монтировании антенну располагали вентральной стороной кверху, что обусловлено необходимостью исследовать сенсорные поля на вентральной поверхности флагелломеров. Покрытие препаратов золотом толщиной 20 нм было выполнено с помощью напылительной установки Leica EM SCD500 Ресурсного центра СПбГУ. Снимки поверхности антеннальных сегментов были получены с помощью сканирующего электронного микроскопа Tescan MIRA3 LMU при увеличении от 400× до 6000×, с рабочим напряжением 9 кВ (микроскоп находится в Ресурсном центре молекулярных и клеточных технологий Научного Парка СПбГУ).
Анализ количественных признаков сенсилл
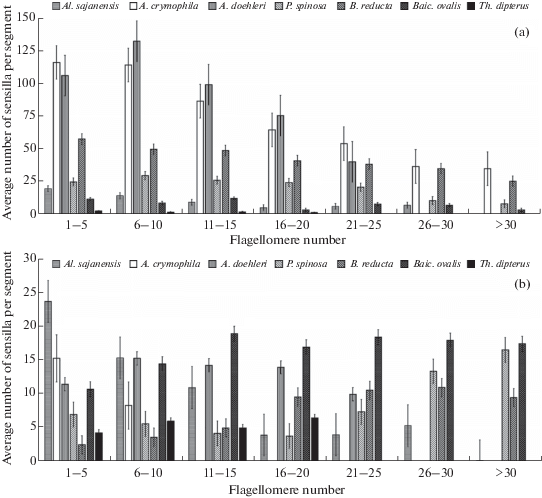
Измерение размеров и подсчет сенсилл выполнены с помощью программы ImageJ 1.50d. Для получения корректных значений длины (для продольно-вытянутых волосковидных структур) и диаметра (для округлых и уплощенных сенсилл) были измерены сенсиллы, расположенные в средней части сегмента, чтобы избежать периферийных искажений, обусловленных работой микроскопа. Средние значения длины и диаметра сенсорных образований были получены в MS Excel 2010. Пересчет количества сенсилл с видимой поверхности на весь сегмент выполнен по ранее опубликованной методике с использованием постоянных коэффициентов [23]. Для вычисления среднего количества сенсилл для каждой антенны флагелломеры были объединены в группы по пять сегментов. В качестве проксимальных в данной статье приняты сегменты с 1 по 10, остальные условно считаются дистальными.
Анализ нуклеотидных последовательностей COI был выполнен по молекулярным данным, взятым с сайта GenBank (https://www.ncbi.nlm.nih.gov/genbank/) и ранее представленным в статьях Трибоя и соавт. [16] и Салоканнела и соавт. [17]. С этими данными были скомбинированы признаки сенсорной поверхности антенн, полученные в ходе исследования, для дальнейшего анализа. Реконструкция филогении была проведена с использованием 10 млн. итераций запуска анализа и пересчета постериорных вероятностей на серверной версии MrBayes 3.2.6 [18, 19] вычислительного кластера CIPRES Science Gateway [20] (https://www.phylo.org/). Для определения анцестрального состояния признаков сенсилл был проведен парсимониальный анализ полученной филогении с помощью инструментов пакета ancstates в программе Mesquite 3.2.
Поведение ручейников
Поведенческие наблюдения проводили на открытом прибойном побережье оз. Байкал в мае-июне 2002 года. Ряд видов эндемичных апатаниид Байкала хорошо отличимы визуально, что облегчает их определение в природе. Изучение пойманных насекомых в лаборатории подтвердило правильность полевых определений.
РЕЗУЛЬТАТЫ
Состав сенсорной поверхности антенн Apataniidae
Сенсорный комплекс антенн ручейников семейства Apataniidae включает 8 типов структур: длинные трихоидные, изогнутые трихоидные, хетоидные, грибовидные псевдоплакоидные, копьевидные псевдоплакоидные, базиконические и коронарные сенсиллы, а также бемовы щетинки на двух базальных сегментах антенн. Этот набор сенсилл, так же как и их структурные и количественные особенности, одинаков для обоих полов. Сенсиллы, в зависимости от размера, можно условно разделить на два яруса – верхний (выше 5 µm) и нижний.
Бемовы щетинки – короткие волоски, которые присутствуют на скапусах и педицеллумах антенн всех Apataniidae. Их средняя длина составляет 14.9 ± 2.0 µm. Каждая щетинка представляет собой гладкий конический кутикулярный отросток, выходящий из округлой теки. Эти механорецепторные образования у всех исследованных Apataniidae обладают консервативным строением кутикулярной части и сходными размерами, что, вероятно, обусловлено их функцией.
Верхний ярус сенсорной поверхности флагеллумов Apataniidae состоит из многочисленных длинных трихоидных, изогнутых трихоидных и хетоидных сенсилл.
Длинные трихоидные сенсиллы (рис. 1, 2: f–g; lts) у примитивного представителя семейства Allomyia sajanensis имеют типичное строение, характерное для многих ручейников. Эти волоски, лежащие по направлению к вершине антенны, имеют косую исчерченность и достигают в длину 51.0 ± 3.6 µm. У других исследованных видов эти сенсиллы обычно короче (в среднем от 26.5 ± 0.8 µm у B. reducta до 50.5 ± 2.6 µm у A. doehleri), однако их длина сильно варьирует в пределах одного вида. Длинные трихоидные сенсиллы Apataniidae зачастую имеют особую форму: поверхность каждого волоска покрыта глубокими бороздами, края которых формируют шиповидные отростки. Таким образом, длинные трихоидные сенсиллы Apataniidae выглядят зазубренными, что достаточно редко встречается в других семействах ручейников.
Рис. 1.
Сегменты антенн ручейников семейства Apataniidae.
Обозначения: lts – длинные трихоидные сенсиллы; cts – изогнутые трихоидные сенсиллы; chs – хетоидные сенсиллы; mps – грибовидные псевдоплакоидные сенсиллы; bcs – базиконическая сенсилла; s – теки выпавших длинных трихоидных сенсилл; sf – сенсорные поля. Масштаб: 50 µm.
Примечания: a – 8-й флагелломер Allomyia sajanensis Levanidova; b – 7-й флагелломер Apatania doehleri Schmid; c – 22-й флагелломер Baicalina reducta Mart.; d – 25-й флагелломер Protobaicalina spinosa Mart.; e – 7-й флагелломер Baicaloides ovalis Mart.; f – 4-й флагелломер Thamastes dipterus Hagen.
Fig. 1. Antennal segments in Apataniidae.
Abbreviations: lts – long trichoid sensilla; cts – curved trichoid sensilla; chs – chaetoid sensilla; mps – mushroom-like pseudoplacoid sensilla; bcs – basiconic sensilla; s – sockets of detached long trichoid sensilla; sf – sensory fields. Scale bar: 50 µm.
Notes: a – 8th flagellomere of Allomyia sajanensis Levanidova; b – 7th flagellomere of Apatania doehleri Schmid; c – 22nd flagellomere of Baicalina reducta Mart.; d – 25th flagellomere of Protobaicalina spinosa Mart.; e – 7th flagellomere of Baicaloides ovalis Mart.; f – 4th flagellomere Thamastes dipterus Hagen.
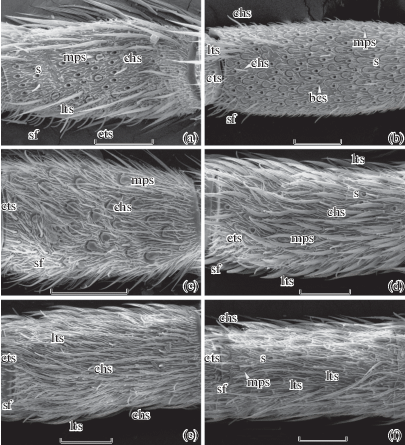
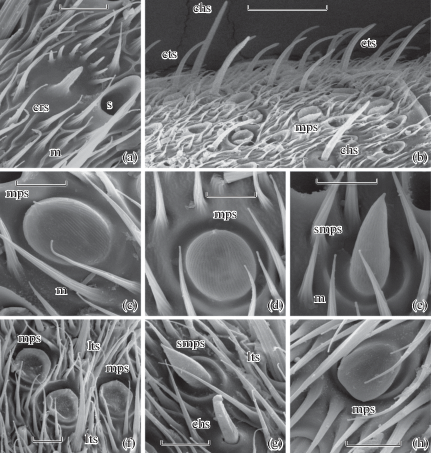
Рис. 2.
Антеннальные сенсиллы Apataniidae.
Обозначения: crs – коронарная сенсилла; smps – копьевидные псевдоплакоидные сенсиллы; m – микротрихии. Остальные обозначения как на рис. 1. Масштаб: a – 5 µm; b – 20 µm; c–e – 4 µm; f–g – 5 µm; h – 4 µm.
Примечания: A – коронарная сенсилла на 26-м флагелломере Al. sajanensis; b – участок вентральной поверхности 6-го флагелломера Al. sajanensis с сенсорным полем; c – выпуклая грибовидная псевдоплакоидная сенсилла на 10-м флагелломере Apatania crymophila; d – выпуклая грибовидная псевдоплакоидная сенсилла на 9-м флагелломере A. doehleri; e – копьевидная псевдоплакоидная сенсилла на 9-м флагелломере A. doehleri; f – грибовидные псевдоплакоидные сенсиллы на участке вентральной поверхности 14-го флагелломера B. reducta; g – участок вентральной поверхности 25-го флагелломера B. reducta; h – грибовидная псевдоплакоидная сенсилла на 31-м флагелломере Baic. ovalis.
Fig. 2. Antennal sensilla in Apataniidae.
Abbreviations: crs – coronary sensillum; smps – spear-shaped pseudoplacoid sensilla; m – microtrichia. Other abbreviations are the same as on Fig. 1. Scale bar: a – 5 µm; b – 20 µm; c–e – 4 µm; f–g – 5 µm; h – 4 µm.
Notes: a – coronary sensillum on 26th flagellomere of Al. sajanensis; b – ventral part of surface of 6th flagellomere of Al. sajanensis with sensory field; c – convex mushroom-like pseudoplacoid sensillum on 10th flagellomere of Apatania crymophila; d – convex mushroom-like pseudoplacoid sensillum on 9th flagellomere of A. doehleri; e – spear-shaped pseudoplacoid sensillum on 9th flagellomere of A. doehleri; f – mushroom-like pseudoplacoid sensilla on ventral surface of 14th flagellomere of B. reducta; g – part of ventral surface on 25th flagellomere of B. reducta; h – mushroom-like pseudoplacoid sensillum on 31st flagellomere of Baic. ovalis.
Изогнутые трихоидные сенсиллы у всех исследованных видов обладают сходной формой и размером (рис. 1: a–f, 2: b: cts). Это короткие волоски с гладкой поверхностью, изогнутые по направлению к вершине антенны, их длина варьирует в диапазоне от 12.7 ± 0.3 µm у Th. dipterus до 18.5 ± 0.4 µm у A. doehleri (рис. 4: b). Размер и форма этих структур в пределах семейства варьируют в диапазоне, сопоставимом с изменчивостью у многих других Trichoptera. Во многих таксономических группах ручейников изогнутые трихоидные сенсиллы группируются в обособленные группы, образуя на антеннах сенсорные поля [10, 19].
Рис. 3.
Схема распределения антеннальных сенсилл по поверхности сегмента в разных эволюционных ветвях семейства Apataniidae.
Примечания: a – Al. sajanensis; b – род Apatania; c – трибы Baicalinini и Thamastini.
Обозначения типов сенсилл как на рисунках 1 и 2.
Fig. 3. Schematic distribution of sensilla on the antennal segment in different evolutionary lines of Apataniidae.
Notes: a – Al. sajanensis; b – genus Apatania; c – tribes Baicalinini and Thamastini.
Abbreviations are the same as on Fig. 1 and 2.
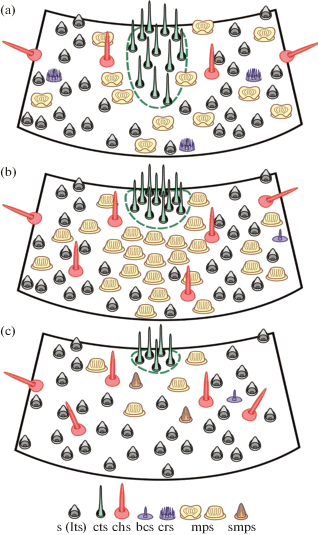
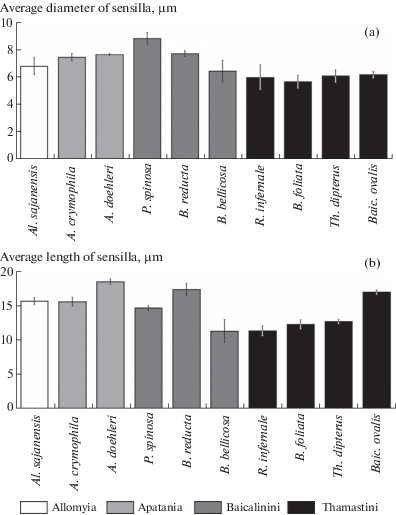
Рис. 4.
Сравнение размеров грибовидных псевдоплакоидных (а) и изогнутых трихоидных (b) сенсилл у исследованных представителей Apataniidae.
Fig. 4. Dimentional comparision of mushroom-like pseudoplacoid (а) and curved trichoid (b) sensilla in Apataniidae.
Хетоидные сенсиллы представляют собой слабо изогнутые волоски с продольной исчерченностью, сидящие на куполообразно выступающем основании (рис. 1: a–f, 2: b, g; chs). Они направлены почти перпендикулярно поверхности кутикулы. У Al. sajanensis хетоидные сенсиллы наиболее длинные (19.8 ± 0.7 µm), сопоставимые по размерам с хетоидными сенсиллами других семейств ручейников, в то время как у остальных Apataniidae они укорочены: их длина уменьшается от 18.3 ± 3 µm у A. crymophila и A. doehleri до 11.0 ± 0.4 µm у Baicaloides ovalis, в последнем случае они практически не возвышаются над ярусом лежащих наклонно длинных трихоидных сенсилл.
Нижний ярус сенсорной поверхности сформирован преимущественно псевдоплакоидными сенсиллами. Помимо них, на поверхности флагеллумов Apataniidae обнаруживаются одиночные коронарные и базиконические сенсиллы.
Псевдоплакоидные сенсиллы в пределах семейства демонстрируют наибольшее структурное разнообразие. У представителей данного семейства отмечены грибовидные и копьевидные псевдоплакоидные сенсиллы. У Al. sajanensis на антеннах имеется относительно небольшое число псевдоплакоидных сенсилл (рис. 5: а) асимметричной вогнуто-грибовидной формы с приподнятыми латеральными краями, диаметром 6.8 ± ± 0.3 µm (рис. 1: a, mps).
Рис. 5.
Количественное распределение грибовидных псевдоплакоидных (а) и изогнутых трихоидных (b) сенсилл Apataniidae.
Fig. 5. Quantitative distribution of mushroom-like pseudoplacoid (а) and curved trichoid (b) sensilla in Apataniidae.
Ручейники рода Apatania обладают выпуклыми грибовидными псевдоплакоидными сенсиллами, вытянутыми вдоль оси антенны (рис. 1: b, 2: c–d). Эти сенсиллы имеют продольные борозды с микропорами. Дистальный край сенсиллы приподнят над кутикулой и иногда имеет несколько коротких зубцов. Средний диаметр грибовидных псевдоплакоидных сенсилл у Apatania составляет от 7.5 ± ± 0.2 µm (A. crymophila) до 7.6 ± 0.1 µm (A. doehleri) (рис. 4: a).
Грибовидные псевдоплакоидные сенсиллы у разных видов из эндемичных байкальских триб Apataniidae бывают как выпуклыми, так и вогнутыми. Их форма может изменяться на одной антенне от почти округлой до сильно вытянутой овальной. Диаметр этих сенсилл зачастую меньше, чем у Apatania, и существенно варьирует от вида к виду. Самые мелкие псевдоплакоидные сенсиллы обнаружены у Th. dipterus (6.1 ± 0.2 µm), а самые крупные – у P. spinosa (8.8 ± 0.2 µm) (рис. 4: a).
Копьевидные псевдоплакоидные сенсиллы (рис. 2: e, g; smps) встречаются на отдельных флагелломерах у A. doehleri, P. spinosa, B. reducta, Baicalodes ovalis и Th. dipterus. Они представляют собой вытянутые конические образования со слабовыраженными продольными бороздами, в которых имеются микропоры, как у грибовидных псевдоплакоидных сенсилл. Размер копьевидных сенсилл сопоставим с грибовидными и составляет в среднем от 6.0 ± 0.1 µm у Th. dipterus до 9.3 ± 0.4 µm у P. spinosa.
Коронарные сенсиллы (рис. 2: a; crs) обнаружены только у примитивного представителя семейства Al. sajanensis. Их теки лежат вровень с поверхностью кутикулы и окружены незамкнутым периферийным венчиком укороченных (около 1 µm) микротрихий. Эти микротрихии всегда растут только с дистальной стороны основания сенсиллы. Кутикулярная часть сенсиллы достигает в длину 3.6 ± ± 0.1 µm и имеет продольные бороздки. Вероятно, в ходе эволюции коронарные сенсиллы утратили венчик микротрихий у большинства Apataniidae, поскольку вместо них на кутикуле встречаются базиконические сенсиллы.
Базиконические сенсиллы (рис. 1: b; bcs) обнаружены у большинства исследованных видов и отсутствуют у Baicaloides ovalis и Al. sajanensis (в последнем случае они замещены коронарными сенсиллами). Они представляют собой продольно исчерченные выросты длиной от 3.0 ± 0.1 до 4.2 ± 0.1 µm, каждый отросток отходит от овальной теки, которая представляет собой ровную площадку на кутикуле диаметром 6.5 ± 0.3 µm. Структура, размеры и количество базиконических сенсилл сходны с коронарными, а совместно эти сенсиллы никогда не встречаются, что указывает на гомологию этих двух типов образований.
Распределение антеннальных сенсилл Apataniidae
Антеннальные сенсиллы Apataniidae обладают тремя вариантами распределения: неспецифическим, специфическим и групповым (сенсорные поля).
Бемовы щетинки обладают специфическим распределением: они располагаются на вентролатеральных поверхностях скапуса и педицеллума, единообразно у всех исследованных видов. Их количество в среднем не превышает 50 сенсилл на сегмент.
Грибовидные псевдоплакоидные сенсиллы ручейников рода Apatania, а также Al. sajanensis и B. reducta обладают неспецифическим распределением, а их количество уменьшается от основания к вершине антенны. На вентральных поверхностях флагелломеров эти сенсиллы встречаются в большем количестве, чем на дорсальных. Антенны Al. sajanensis имеют в среднем до 22.4 ± 2.5 этих сенсилл на каждом из проксимальных и до 6.1 ± 0.5 на каждом дистальном флагелломерах. У Apatania эти структуры очень многочисленны, их среднее количество может достигать 128.8 ± 9.9 сенсилл на каждом из первых 15-ти флагелломеров и дистальнее снижается до 29.8 ± 9.1 сенсилл на сегмент (рис. 5: a).
У Th. dipterus, Baicaloides ovalis, P. spinosa и B. bellicosa среднее количество грибовидных псевдоплакоидных сенсилл на сегментах невелико (рис. 3, 5: а). Эти структуры оказываются специфически сгруппированными вблизи сенсорных полей в дистальной части каждого флагелломера. Вместе с тем число грибовидных псевдоплакоидных сенсилл сокращается у этих видов от базальных (в среднем 10.9 ± 0.7 сенсилл на сегмент) к субапикальным (5.2 ± 0.5) членикам. При таком специфическом распределении этих образований проксимальная часть каждого флагелломера остается покрытой только длинными трихоидными сенсиллами.
Копьевидные псевдоплакоидные сенсиллы сохраняют неспецифическое распределение по отношению к грибовидным и встречаются спорадически на вентральной стороне в разных частях сегментов. Они располагаются поодиночке, и их общее количество не превышает 10 сенсилл на антенну.
Помимо псевдоплакоидных, неспецифическим распределением обладают длинные трихоидные сенсиллы. Эти волоски покрывают более или менее равномерно всю поверхность антенны.
Хетоидные, базиконические и коронарные сенсиллы демонстрируют специфическое распределение. При этом хетоидные сенсиллы у всех исследованных видов утрачивают исходно присущее им фиксированное распределение [9], их количество возрастает и место расположения на кутикуле становится более вариабельным, чем у ранее изученных представителей Trichoptera. Количество хетоидных сенсилл составляет в среднем 7.5 ± 0.3 на сегмент, причем на субапикальных и апикальных флагелломерах этих сенсилл больше всего. Базиконические и коронарные сенсиллы располагаются латерально или дорсолатерально в средней части сегмента, но иногда встречаются и вблизи дистального края. Каждый флагелломер несет 1 или 2 базиконические сенсиллы, которые на некоторых сегментах отсутствуют. У Al. sajanensis одиночные коронарные сенсиллы встречаются на сегментах дистальнее 10-го; отдельные флагелломеры могут нести 2 сенсиллы этого типа. При сравнении среднего количества базиконических, коронарных и хетоидных сенсилл на проксимальных и дистальных флагелломерах не выявлено достоверных различий.
Изогнутые трихоидные сенсиллы в семействе Apataniidae группируются в сенсорные поля, расположенные вентрально или вентролатерально вблизи дистального края флагелломера (рис. 1: sf). Сенсорные скопления Al. sajanensis овальной формы, продольно вытянуты, не имеют четких границ и включают, помимо изогнутых трихоидных, одиночные грибовидные псевдоплакоидные и хетоидные сенсиллы. На члениках в основании антенны встречается в среднем 25.6 ± 0.8 изогнутых трихоидных сенсилл. Субапикальные скопления более компактные и содержат в среднем 11.0 ± 1.5 сенсилл (рис. 5: b). Сенсорные поля Apatania представляют собой плотные группы, каждая из которых включает не более 20 изогнутых трихоидных сенсилл, расположенных вентрально по обе стороны от границы сегмента. Наиболее развиты они вблизи основания флагеллума. Поля сенсилл у видов, относящихся к трибам Baicalinini и Thamastini, слабо выражены и насчитывают в среднем от 2.5 ± 0.6 до 19.0 ± 0.8 сенсилл вблизи дистального края сегмента. У P. spinosa, B. reducta и B. bellicosa наибольшее развитие получают дистальные сенсорные поля на сегментах с 20-го по 30-й, они содержат в среднем 10.8 ± 0.5 сенсилл, в то время как проксимальные поля включают 4.7 ± 1.5 сенсилл. У Th. dipterus среднее число сенсилл в группах слабо варьирует на всем протяжении антенны: 14.8 ± 0.8 сенсилл на каждом из флагелломеров с 1‑го по 15-й, и 15.8 ± 0.8 сенсилл на каждом из сегментов дистальнее 15-го. У Baicaloides ovalis наблюдается та же тенденция (Рис. 5: b). Особенности распределения сенсилл по поверхности антенн у исследованных представителей Apataniidae показаны на рис. 3.
ОБСУЖДЕНИЕ
Особенности сенсорного набора антенн Apataniidae
Антеннальный комплекс Apataniidae включает 7 типов структур, характерных для многих других семейств ручейников. Уникальные особенности – отсутствие стилоконических сенсилл у всех исследованных видов и наличие копьевидных псевдоплакоидных сенсилл, которые обнаружены у A. doehleri и всех видов байкальских триб Baicalinini и Thamastini. Хотя стилоконические сенсиллы, вероятно, входят в общий план строения антеннальной поверхности Trichoptera [9, 10], они обычно немногочисленны и встречаются спорадически на отдельных сегментах. Одиночные псевдоплакоидные сенсиллы копьевидного подтипа структурно близки к грибовидным сенсиллам Apatania и не найдены у других ручейников. Строение копьевидных сенсилл предполагает их происхождение из грибовидных псевдоплакоидных сенсилл. Данный тип сенсилл впервые описывается для представителей таксона Amphiesmenoptera. Также у представителей исследуемого семейства найдены зазубренные длинные трихоидные сенсиллы. Такая форма длинных трихоидных сенсилл известна у отдельных представителей Stenopsychidae, Phryganeidae и Lepidostomatidae [5–8].
Поведенческие и экологические особенности ручейников из триб Baicalinini и Thamastini
Формирование эндемичной фауны ручейников Байкала – уникальное эволюционное событие. В связи с гетерогенностью надсемейства Limnephiloidea (в состав которого входит семейство Apataniidae) интересно рассмотреть особенности химической коммуникации у представителей эндемичных ручейников озера Байкал из триб Baicalinini и Thamastini. Для этой группы ручейников отмечена тенденция к уменьшению и даже редукции стернальных феромонных желез [21]. У вида Thamastes dipterus железы редуцировались у обоих полов. Этот вид является наиболее характерным примером адаптации к условиям прибойной зоны озера Байкал. Редукция передних и почти полное исчезновение задней пары крыльев привели к утрате насекомыми способности к полету, в связи с чем эти ручейники могут перемещаться только при помощи ног. Достаточно длинные и толстые щетинки на члениках лапок средней и задней пары ног позволяют ручейникам этого вида перемещаться по поверхности озера с большой скоростью [15]. Спаривание у этого вида происходит на водной поверхности озера далеко от берега. В ходе наблюдений авторами было отмечено, что копулирующие пары Thamastes dipterus не встречаются на берегу, в отличие от схожих по морфологическим адаптациям короткокрылых видов Baicalina reducta и Baicalina thamastoides. Можно предполагать, что этот вид частично или целиком отказался от химической коммуникации, и основную роль в обеспечении встречи полов стала занимать, по-видимому, визуальная коммуникация.
Наличие феромонных желез не всегда свидетельствует о том, что они играют ключевую роль в определении полового партнера [22, 23]. Многие виды ручейников озера Байкал образуют массовые скопления на берегу, в которых, как правило, присутствуют сразу несколько видов. На юго-западном берегу озера Байкал в мае–июне 2002 г. авторами данной статьи были отмечены в прибрежной полосе, как на поверхности, так и под прибрежной галькой скопления ручейников, включающие в себя до семи видов Apataniidae: Baicalina bellicosa, Baicalina levanidovae, Baicalina reducta, Baicalina thamastoides, Baicalinella foliata, Baicalodes ovalis и Thamastes dipterus. В подобных скоплениях, некоторые из которых состоят из сотен и тысяч насекомых, использование химических стимулов для коммуникации становится практически невозможным действием. В таких ситуациях феромонная коммуникация мало эффективна, так как в полной мере наблюдается эффект феромонного насыщения [24]. Известно, что в условиях феромонного насыщения те виды, у которых доминирует феромонная коммуникация в регуляции полового поведения, теряют способность к распознаванию полового партнера. Кроме того, феромоны байкальских ручейников, возможно, близки у разных видов по химическому составу между собой, так как перенасыщенный феромонными смесями воздух одновременно активизирует половое поведение у различных видов, что является одной из характерных особенностей популяций байкальских ручейников.
Наблюдения за экологическими и поведенческими особенностями в массовых скоплениях имаго ручейников на побережьях озера показывают синхронность вылета близких видов, малую избирательность полового поведения и нарушения половой коммуникации. Можно предполагать, что жесткий половой отбор на несовместимость гениталий у близких видов привел к стремительным морфологическим изменениям и быстрому разделению видов трибы Baicalinini и Thamastini на несколько родов.
Эволюционные тенденции сенсорной поверхности антенн Apataniidae
Комбинированный анализ данных по COI, ранее опубликованных в литературе [16, 17], и признаков антеннальной поверхности (рис. 6) подтвердил выделенные ранее монофилетические трибы Baicalinini и Thamastini, в то время как филогения рода Apatania осталась не до конца выясненной и требует дополнительного изучения. Показано также базальное положение рода Allomyia в системе апатаниид, что подтверждает результаты предыдущих исследований [15]. Добавление в анализ морфологических данных не нарушает установленную ранее таксономическую структуру семейства.
Рис. 6.
Реконструкция филогении семейства Apataniidae, полученная при комбинированном анализе COI–последовательностей и признаков антеннальных сенсилл. Цифрами обозначены значения апостериорной вероятности поддержки ветвей.
Fig. 6. Combined phylogenetic tree of Apataniidae based on the analysis of COI gene sequences and additional characters of antennal sensilla.
Признаки, выделяемые для сенсорной поверхности антенн Apataniidae (рис. 7, 8), относятся к трем категориям: структурные (форма грибовидных, длинных трихоидных и базиконических сенсилл), размерные (средняя длина копьевидных и хетоидных, а также средний диаметр грибовидных псевдоплакоидных сенсилл) и количественные (количество псевдоплакоидных и изогнутых трихоидных сенсилл, а также распределение сенсорных полей по антенне). По результатам парсимониального анализа распределения признаков в пределах Apataniidae прослеживается ряд эволюционных тенденций, связанных с модификацией строения кутикулярной части некоторых сенсилл, изменением их количества и сменой типов распределения. Признаки сенсорной поверхности антенн (рис. 7, 8) распределяются внутри семейства особым образом, группируясь в три кластера, соответствующих на филогенетической схеме родам Allomyia, Apatania и трибам Baicalinini и Thamastini. Это свидетельствует в пользу того, что ручейники рода Apatania обладают особым набором сенсилл, отличающимся от исходного состояния, а представители байкальских триб, в свою очередь, вторично претерпели глубокую модификацию чувствительного антеннального комплекса.
Рис. 7.
Схема распределения признаков антеннальных сенсилл (обозначены цифрами), использованных в анализе. Белым показано состояние признака “0”, черным – “1”.
Примечание:
1. Форма грибовидных псевдоплакоидных сенсилл: 0 – вогнутая с приподнятыми латеральными краями; 1 – выпуклая.
2. Структура базиконических и коронарных сенсилл: 0 – без периферийного венчика укороченных микротрихий (базиконические); 1 – с незамкнутым венчиком микротрихий (коронарные).
3. Наличие на антенне копьевидных псевдоплакоидных сенсилл: 0 – отсутствуют; 1 – имеются.
4. Средний диаметр грибовидных псевдоплакоидных сенсилл: 0 – более 7 µm (медианное значение для всех исследованных видов); 1 – менее 7 µm.
Fig. 7. The distribution pattern of sensillar characters 1–4 (indicated by numbers) used in the analysis. White stands for the character state “0”, black stands for “1”.
Notes:
1. Shape of mushroom-like pseudoplacoid sensilla: 0 – concave with raised lateral edges; 1 – convex.
2. Structure of basiconic and coronary sensilla: 0 – peripheral ring of truncated microtrichia (basiconic) is absent; 1 – with an open ring of microtrichia (coronary).
3. Presence of spear-shaped pseudoplacoid sensilla on the antenna: 0 – absent; 1 – present.
4. Average diameter of mushroom-like pseudoplacoid sensilla: 0 – >7 μm (median value for all studied species); 1 – <7 µm.
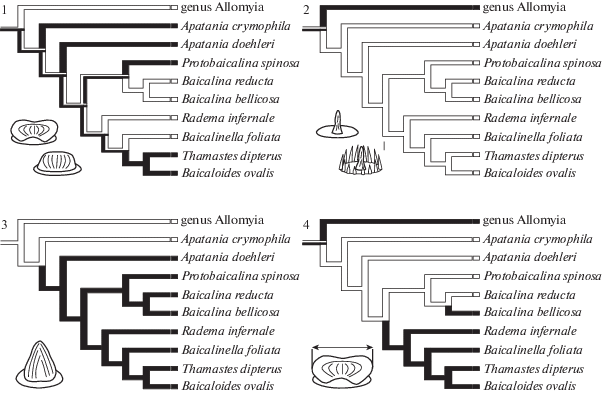
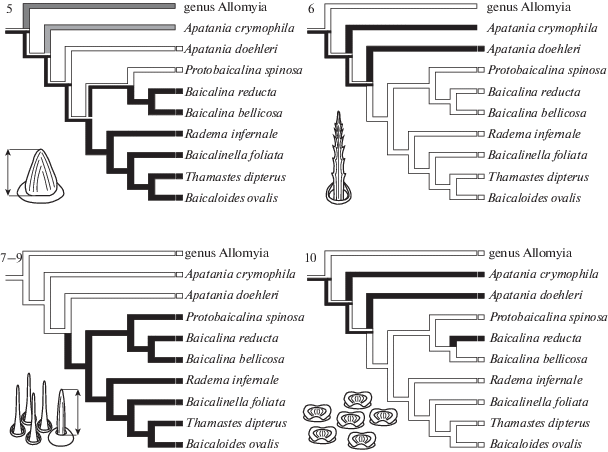
Рис. 8.
Схема распределения признаков антеннальных сенсилл (обозначены цифрами), использованных в анализе. Белым показано состояние признака “0”, черным “1”, серым – отсутствие признака.
Примечания:
5. Средняя длина копьевидных псевдоплакоидных сенсил: 0 – более 8 µm (медианное значение для всех исследованных видов); 1 – менее 8 µm.
6. Форма длинных трихоидных сенсилл: 0 – со слабо выраженной косой исчерченностью; 1 – с сильно выраженной исчерченностью, за счет которой формируются шиповидные отростки.
7. Средняя длина хетоидных сенсилл: 0 – более 15.0 µm (медианное значение для всех исследованных видов); 1 – менее 15.0 µm
8. Количество изогнутых трихоидных сенсилл в сенсорных полях на базальных флагелломерах: 0 – более 10 сенсилл (поля сенсилл хорошо заметны); 1 – менее 10 сенсилл на сегмент (мелкие слабо очерченные сенсорные поля).
9. Наличие сенсорных полей в дистальной части антенны: 0 – среднее количество изогнутых трихоидных сенсилл в дистальных полях снижается более чем в два раза по сравнению с проксимальными; 1 – среднее количество сенсилл сопоставимо в дистальных и проксимальных полях.
10. Среднее количество грибовидных псевдоплакоидных сенсилл на базальных сегментах (с первого по десятый флагелломеры): 0 – мало (менее 66); 1 – много (более 66).
Fig. 8. The distribution pattern of sensillar characters 5−10 used in the analysis. White stands for the character state “0”, black stands for “1”.
Notes:
5. Average length of spear-shaped pseudoplacoid sensilla: 0 – >8 µm (median value for species studied); 1 – <8 µm.
6. Shape of the long trichoid sensilla: 0 – with a faint inclined striation; 1 – with a pronounced striation giving rise to spike-shaped processes.
7. Average length of the chaetoid sensilla: 0 – >15.0 µm (median value for all species studied); 1 – <15.0 µm.
8. Number of curved trichoid sensilla in sensory fields on basal flagellomeres: 0 – >10 sensilla (sensory fields are clearly visible); 1 – <10 sensilla per segment (small feebly delineated sensory fields).
9. Presence of sensory fields on the distal part of antenna: 0 – the average number of curved trichoid sensilla in distal fields is twice lesser then in proximal; 1 – the average number of sensilla is about the same in distal and proximal fields.
10. Average number of mushroom-like pseudoplacoid sensilla on the basal segments (flagellomeres 1 to 10): 0 – low (<66); 1 – high (>66).
Принимая во внимание базальное расположение рода Allomyia на филогенетическом древе, следует рассматривать набор признаков сенсилл Al. sajanensis как близкий к исходному для всего семейства. Сенсиллы этого вида не имеют выраженных особенностей в структуре и расположении по сравнению с сенсиллами ручейников из базальных семейств Plenitentoria [6]. На архаичное строение грибовидных псевдоплакоидных сенсилл Allomyia указывает то, что за пределами Apataniidae эти сенсиллы обычно имеют вогнутую форму и относительно крупные размеры (рис. 7, признаки 1 и 4). У Allomyia коронарные сенсиллы сохраняют архаичное строение, в то время как у прочих исследованных видов Apataniidae они модифицируются, утрачивая венчик микротрихий (рис. 7, признак 2). Переход от коронарных сенсилл к базиконическим у Apataniidae происходит, вероятно, в ходе ранней эволюции семейства. Хетоидные сенсиллы Al. sajanensis утрачивают фиксированное распределение, которое исходно характерно для этих образований. Специфическое, но не фиксированное распределение хетоидных сенсилл наблюдается у всех Apataniidae. Таким образом, отсутствие уникальных признаков в строении, размерах и распределении антеннальных сенсилл Al. sajanensis означает, что исходно сенсорный аппарат антенн Apataniidae не был специализирован в сравнении с другими семействами ручейников из лимнефилоидной эволюционной ветви.
Набор признаков антеннальных сенсилл у разных видов Apatania неоднороден. Антенны этих ручейников покрыты большим количеством грибовидных псевдоплакоидных сенсилл с выпуклой поверхностью (рис. 7, признак 1; рис. 8, признак 10). Вероятно, у общего предка Apatania и триб Baicalinini и Thamastini псевдоплакоидные сенсиллы обладали большой структурной изменчивостью, что привело к формированию копьевидных псевдоплакоидных сенсилл, обнаруженных у A. doehleri (рис. 7, признак 3). Структурная лабильность сохраняется у современных представителей: в пределах рода форма псевдоплакоидных сенсилл даже на одной антенне сильно варьирует от округлой до вытянутой. Другие сенсиллы Apatania также приобретают особую форму, например, длинные трихоидные сенсиллы образуют боковые шиповидные отростки (рис. 8, признак 6). Сенсорные поля представителей рода Apatania, в отличие от Al. sajanensis, более компактны, их место расположения оказывается приближенным к границе сегмента, хотя распределение по антенне остается архаичным (рис. 8, признак 9). В пределах рода нет статистически достоверных различий в размерах и количестве сенсилл. Вероятно, род Apatania имеет промежуточную степень специализации сенсорной поверхности, при которой многие структуры оказываются модифицированы неуникальным образом.
Антенны ручейников эндемичных триб Baicalinini и Thamastini обладают особой сенсорной поверхностью, которая в ходе эволюции значительно редуцировалась. На кутикуле сохраняются многочисленные длинные трихоидные сенсиллы архаичного строения, не имеющие латеральных выростов (рис. 8, признак 6). Хетоидные сенсиллы, которые хорошо развиты у других апатаниид, укорачиваются (рис. 8, признак 7). Среднее количество псевдоплакоидных сенсилл уменьшается у всех эндемичных видов, за исключением B. reducta, у которого эти образования вторично становятся относительно многочисленными (рис. 8, признак 10). Структурная лабильность грибовидных псевдоплакоидных сенсилл сохраняется: их форма меняется на уплощенную или почти вогнутую у Baicalinini, в то время как размеры у разных видов сильно варьируют, демонстрируя как увеличение диаметра (P. spinosa), так и уменьшение (B. bellicosa). У Thamastini эти сенсиллы остаются выпуклыми, но уменьшаются в диаметре (рис. 7, признак 4). Копьевидные псевдоплакоидные сенсиллы сохраняются у всех эндемичных видов (рис. 7, признак 3), хотя их размер уменьшается в обеих трибах (рис. 8, признак 5). Изогнутые трихоидные сенсиллы Baicalinini и Thamastini не претерпевают структурных изменений и сохраняют среднюю длину, близкую к исходной для семейства. Среднее количество сенсилл в полях на базальных флагелломерах сокращается, что в сочетании с сохранением сенсорных полей в дистальной части антенны приводит к формированию особого типа распределения, противоположного наблюдаемому у большинства представителей отряда ручейников (рис. 8, признаки 8–9). Общее число изогнутых трихоидных сенсилл на антенне остается низким, и иногда поля включают 3–5 таких сенсилл.
Наиболее выражена модификация чувствительного кутикулярного комплекса у представителей трибы Thamastini. Антенны этих ручейников несут, помимо многочисленных длинных трихоидных сенсилл, слабовыраженные сенсорные поля, одиночные хетоидные, базиконические и псевдоплакоидные сенсиллы. Таким образом, преобразование сенсилл, начавшееся в ходе эволюции рода Apatania, привело у байкальских ручейников к редукции сенсорной поверхности антенн.
Список последовательностей COI, использованных в работе:
COI gene sequences used in this study:
| Род/Genus | Вид/Specie | Номер в базе данных № in the database | Источник Source |
| Apatania | A. majuscula | KR153087.1 | Triboy et al., 2017 |
| A. stigmatella | KC559549.1 | Triboy et al., 2017 | |
| A. zonella | KM535616.1 | Hebert et al., 2014 | |
| A. helvetica | KT613192.1 | Triboy et al., 2017 | |
| A. sorex | HQ945648.1 | iBOL | |
| A. crymophila | HM382215.1 | iBOL | |
| A. wallengreni | HM381094.1 | iBOL | |
| A. shoshone | GU711419.1 | iBOL | |
| A. copiosa | KX144177.1 | Kjer, 2016 | |
| A. vepsica | KX293093.1 | Zhou et al., 2016 | |
| A. doehleri | KX105453.1 | Zhou et al., 2017 | |
| Protobaicalina | P. tallingi | KR153116.1 | Triboy et al., 2017 |
| P. spinosa | KR153124.1 | Triboy et al., 2017 | |
| Baicalina | B. thamastoides | KR153144.1 | Triboy et al., 2017 |
| B. reducta | KR153143.1 | Triboy et al., 2017 | |
| B. bellicosa | KR153132.1 | Triboy et al., 2017 | |
| Baicalinella | B. foliata | KR153104.1 | Triboy et al., 2017 |
| Radema | R. infernale | KR153093.1 | Triboy et al., 2017 |
| Thamastes | Th. dipterus | KR153097.1 | Triboy et al., 2017 |
| Baicaloides | B. ovalis | KR153114.1 | Triboy et al., 2017 |
| Allomyia | Al. tripunctata | HM382213.1 | iBOL |
| Limnephilus | L. sitchensis | HQ560527.1 | iBOL |
| L. moestus | KM536710.1 | Hebert et al., 2014 |
Список литературы
Иванов В.Д., Мельницкий С.И. Ручейники семейства Apataniidae фауны России и сопредельных стран. Проблемы водной энтомологии России и сопредельных стран: Материалы Х трихоптерологического симпозиума и IV Всероссийского симпозиума по амфибиотическим и водным насекомым; СОГУ им. К.Л. Хетагурова. Владикавказ: Изд-во СОГУ. 144. 22–26. 2010. [Ivanov V.D., Melnitsky S.I. Caddisflies of the family Apataniidae in the fauna of Russia and adjacent countries. Problems of the aquatic entomology of of Russia and adjacent countries: Materials of Xth Trchopterological Symposium and IV All-Russian Symposium on Amphibiotic and Aquatic Insects. North Osetian State University. Vladikavkaz: SOGU Publ. 144. 22–26. 2010. (In Russ.)]
Tozer W. External antennal morphology of the adult and larva of Nectopsyche albida (Walker) (Trichoptera: Leptoceridae). Freshwater Invertebr. Biol. 1: 35–43. 1982.
Faucheux M.J. Antennal sensilla of Sabatinca sterops Turner (Lepidoptera: Micropterigidae). Transactions of the Royal Society of South Australia. 128 (2): 187–194. 2004a.
Faucheux M.J. Sensilla placodea on the antennae of Lepidoptera. Ann. Soc. Entomol. Fr. 40 (1): 105–107. 2004b. https://doi.org/10.1080/00379271.2004.10697409
Ivanov V.D., Melnitsky S.I. Structure and morphological types of the antennal olfactory sensilla in Phryganeidae and Limnephilidae (Insecta: Trichoptera). Zoosymposia. 5: 210–234. 2011. https://doi.org/10.11646/zoosymposia.5.1.16
Ivanov V.D., Melnitsky S.I. Diversity of the olfactory sensilla in caddis-flies (Trichoptera). Zoosymposia 10: 224–233. 2016. https://doi.org/10.11646/zoosymposia.10.1.20
Melnitsky S.I., Ivanov V.D. Structure and localization of sensilla on antennae of caddisflies (Insecta: Trichoptera). J. Evol. Biochem. Physiol. 47 (6): 593–602. 2011. https://doi.org/10.1134/S0022093011060111
Melnitsky S.I., Ivanov V.D. Structure of the antennal olfactory sensilla in the genus Molanna (Trichoptera: Molannidae). Zoosymposia. 10: 292–300. 2016. https://doi.org/10.11646/zoosymposia.10.1.27
Valuyskiy M.Yu., Melnitsky S.I., Ivanov V.D. Structure of antennal sensilla in the caddisfly genus Rhyacophila Pictet (Trichoptera, Rhyacophilidae). Entomol. Rev. 97 (6): 703–722. 2017. https://doi.org/10.1134/S001387381706001X
Valuyskiy M.Yu., Melnitsky S.I., Ivanov V.D. Comparative analysis of antennal surfaces in adult caddisflies of the genus Ecnomus McLachlan (Trichoptera, Ecnomidae). Entomol. Rev. 99 (3): 302–309. 2019. https://doi.org/10.1134/S0013873819030035
Melnitsky S.I., Ivanov V.D., Valuyskiy M.Yu., Zueva L.V., Zhukovskaya M.I. Comparison of sensory structures on the antenna of different species of Philopotamidae (Insecta: Trichoptera). Arthropod Struct. Dev. 47: 45–55. 2018. https://doi.org/10.1016/j.asd.2017.12.003
Melnitsky S.I., Ivanov V.D., Valuisky M.Yu., Zhukovskaya M.I., Zueva L.V. Structure of antennal pseudoplacoid sensilla in the caddisfly Philopotamus montanus Donovan (Trichoptera, Philopotamidae). Entomol. Rev. 99 (4): 446–455. 2019. https://doi.org/10.1134/S0013873819040031
Larsson M.C., Hallberg E., Kozlov M.V., Francke W., Hansson B.S., Löfstedt C. Specialized olfactory receptor neurons mediating intra- and interspecific chemical communication in leafminer moths Eriocrania spp. (Lepidoptera: Eriocraniidae). J. Exp. Biol. 205 (7): 989–998. 2002.
Мартынов А.В. Ручейники. Практическая энтомология Л., 1924. [Martynov A.V. Trichoptera. Practical Entomology. Leningrad. 1924. (In Russ.).]
Ivanov V.D., Menshutkina T.V. Endemic caddisflies of the lake Baikal (Trichoptera, Apataniidae). Braueria. 23: 13–28. 1996.
Triboy T.I., Nepokrytykh A.V., Rozhkova N.A., Bukin Yu.S., Sherbakov D.Yu. Molecular evolution of the Lake Baikal endemic caddisflies (Trichoptera). Russ. J. Genetics. 53 (4): 509–513. 2017. https://doi.org/10.1134/S1022795417040147
Salokannel J., Rantala M.J., Wahlberg N. DNA-barcoding clarifies species definitions of Finnish Apatania (Trichoptera: Apataniidae). Entomol. Fennica. 21 (1): 1–11. 2010. https://doi.org/10.33338/ef.84493
Huelsenbec J.P., Ronquist F. Mrbayes: Bayesian inference of phylogeny. Bioinformatics. 17 (8): 754–755. 2001. https://doi.org/10.1093/bioinformatics/17.8.754
Ronquist F., Huelsenbeck J.P. Mrbayes 3: Bayesian phylogenetic inference under mixed models. Bioinformatics. 19 (12): 1572–1574. 2003. https://doi.org/10.1093/bioinformatics/btg180
Miller M.A., Pfeiffer W., Schwartz T. “Creating the CIPRES Science Gateway for inference of large phylogenetic trees” in Proceedings of the Gateway Computing Environments Workshop (GCE). 14 Nov. 2010. New Orleans, LA. 1–8. 2010. https://doi.org/10.1109/GCE.2010.5676129
Мельницкий С.И. Сравнительный анализ морфологии IV и V стернитов брюшка Amphiesmenoptera. Труды II Всероссийского симпозиума по амфибиотическим и водным насекомым, Воронеж. 111–118. 2004. [Melnitsky S.I. Comparative analysis of morphology of the IVth and Vth abdominal sternites in Amphiesmenoptera. Proceedings of IInd All-Russian Symposium on Amphibiotic and Aquatic Insects. Voronezh. 111–118. 2004.]
Ivanov V.D., Melnitsky S.I. Structure of the sternal pheromone glands in caddisflies (Trichoptera). Entomol. Rev. 79 (8): 926–942. 1999.
Ivanov V.D., Melnitsky S.I. Structure of pheromone glands in Trichoptera. Nova Suppl. Ent., Keltern. 15: 17–28. 2002.
Ivanov V.D. Principles of the sexual communication in caddisflies (Insecta, Trichoptera) In: K. Wiese (Eds.). Sensory Systems of Arthropods, Basel, Birkhuser Verlag. 609–626. 1993.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


