Журнал эволюционной биохимии и физиологии, 2020, T. 56, № 5, стр. 359-367
ВОЗРАСТНЫЕ И СЕЗОННЫЕ ИЗМЕНЕНИЯ АНТИОКСИДАНТНОЙ ЗАЩИТЫ МЫШЕЧНОЙ ТКАНИ И МОРФОМЕТРИЧЕСКИХ ПАРАМЕТРОВ ЭРИТРОЦИТОВ У ОНДАТРЫ (ONDATRA ZIBETHICUS)
Е. П. Антонова 1, *, В. А. Илюха 1, А. Г. Кижина 1, Л. Б. Узенбаева 1, Е. А. Хижкин 1, С. Н. Калинина 1, И. В. Баишникова 1, Э. Ф. Печорина 1
1 Институт биологии КарНЦ РАН, ФИЦ “Карельский научный центр РАН”
Петрозаводск, Россия
* E-mail: antonova88ep@mail.ru
Поступила в редакцию 06.02.2020
После доработки 26.03.2020
Принята к публикации 03.04.2020
Аннотация
В процессе приспособления к полуводному образу жизни у ондатры (Ondatra zibethicus) сформировались многочисленные адаптации, направленные на поддержание гомеостаза. Целью работы являлось исследование антиоксидантной защиты мышечной ткани и морфометрических параметров эритроцитов у ондатры в зависимости от возраста и сезона года. Исследование было проведено на молодых животных, отловленных осенью, и взрослых – в весенний и осенний периоды на Северо-Западе России (Республика Карелия). Показана возрастная изменчивость некоторых изученных показателей у животных осенью: у взрослых ондатр активность каталазы в скелетной мышце ниже, а респираторная функция крови – выше за счет более низкой площади эритроцитов, чем у ювенильных особей. У взрослых ондатр наблюдались сезонные изменения показателей: в весенний период активности каталазы в сердце и супероксиддисмутазы в скелетной мышце были выше, а уровни низкомолекулярных антиоксидантов (α-токоферол и восстановленный глутатион) как в сердечной, так и скелетной мышце ниже, чем осенью. После продолжительного подледного периода жизни у ондатр весной в периферической крови обнаружены в основном зрелые формы эритроцитов, при этом их средний диаметр и площадь выше, чем у взрослых особей, отловленных осенью. Результаты исследования, как и данные, полученные на других видах, подтверждают участие антиоксидантной системы и эритроцитов в механизмах поддержания кислородного гомеостаза у ныряющих млекопитающих.
ВВЕДЕНИЕ
Переход млекопитающих из наземной среды обитания в водную сопровождается многочисленными морфологическими, физиологическими и биохимическими компенсаторными изменениями, направленными на увеличение продолжительности погружений и поддержание кислородного гомеостаза [1–4]. Наблюдаемые при погружении брадикардия и вазоконстрикция периферических сосудов приводят к снижению конвективной доставки кислорода и гипоксии в некоторых тканях, при этом после ныряния кровоток восстанавливается и наблюдается реоксигенация [1]. Как дефицит кислорода, так и его повышенное потребление может приводить к усиленной генерации активных форм кислорода (АФК) [2]. Уровень АФК в тканях регулируется как скоростью их генерации, так и антиоксидантной системой, которая включает низкомолекулярные антиоксиданты (восстановленный глутатион (GSH), α-токоферол и ретинол) и антиоксидантные ферменты (супероксиддисмутаза (СОД), каталаза, глутатион-зависимые пероксидазы и трансферазы) [3, 4]. Нарушение баланса между образованием кислородных радикалов и антиоксидантной защитой приводит к окислительному стрессу [2]. Анализ данных о механизмах устойчивости ныряющих млекопитающих к дефициту кислорода приводит к заключению, что, вероятнее всего, имеет место многофакторное влияние (возраст, сезон, особенности питания и поведения) на антиоксидантную систему. В основном подобные исследования выполнены на крупных морских млекопитающих (китообразные и различные виды тюленей) [2–4], в то время как сведения об адаптациях пресноводных ныряльщиков, также испытывающих гипоксию–реоксигенацию, крайне малочисленны и фрагментарны.
Среди полуводных млекопитающих особое место занимает ондатра (Ondatra zibethicus L., 1766) (Rodentia, Arvicolinae), которая, несмотря на небольшие размеры, может совершать погружения продолжительностью до 8–12 мин [5]. При значительном объеме исследований по анатомическим и физиологическим приспособлениям ондатр к нырянию ограничены работы по биохимическим адаптациям. Более того, на сегодняшний день нет четкого понимания того, каким образом формируются биохимические приспособления к смене кислородных условий у этого полуводного млекопитающего в онтогенезе. Полевые исследования показали [6], что продолжительность ныряния существенно не различается между неполовозрелыми (1–2 мес) и половозрелыми особями ондатры, однако у молодых животных наблюдается бо́льшее количество коротких погружений по сравнению со взрослыми [5]. Помимо возрастных, у ондатр выявлены сезонные изменения поведения [7], что обусловливает широкий спектр адаптивных приспособлений для поддержания гомеостаза. Во-первых, в подледный период ондатры наиболее толерантны к повышению СО2 во вдыхаемом воздухе за счет увеличения сродства гемоглобина к O2 [7]. Авторы связывают это с тем, что зимой в гнездовых камерах хаток обитает до 5 взрослых особей, что приводит к накоплению CO2 и снижению уровня O2 [7]. Во-вторых, поскольку ондатра не запасает пищу на зиму, она вынуждена быть активной подо льдом водоемов в зимне-весеннее время [5, 6, 8]. В таких условиях увеличивается продолжительность ныряний во время поиска корма, что в совокупности с другими факторами приводит к значительному росту запасов кислорода в крови и мышечной ткани у животных зимой по сравнению с особями, отловленными летом [6, 8].
Вследствие недостаточной изученности влияния возраста и сезона на системы, участвующие в поддержании кислородного гомеостаза у полуводных млекопитающих, целью работы явилось исследование антиоксидантной защиты мышечной ткани и морфометрических параметров эритроцитов у ондатр, отловленных осенью (молодые и взрослые) и весной (взрослые).
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
Работа выполнена с соблюдением международных принципов Хельсинкской декларации о гуманном отношении к животным и правил проведения работ с использованием экспериментальных животных. Объектами исследования являлись ондатры (Ondatra zibethicus L., 1766), пойманные в осенний (15.10–17.10) и весенний (30.04–01.05) периоды на оз. Миккильское в окрестностях п. Эссойла (Республика Карелия). Осенью выборка состояла из животных первой генерации (juv, возраст 5–6 мес; 5♂/6♀, m = 652.72 ± 29.33 г) и взрослых ондатр (ad, возраст более 12 месяцев; 8♂/4♀, 969.09 ± ± 59.23 г). Весной были отловлены только взрослые особи (ad, возраст более 12 месяцев; 3♂/2♀, 840.00 ± 22.80 г).
В образцах сердечной и скелетной мышц были проанализированы активность антиоксидантных ферментов (СОД (КФ 1.15.1.1) и каталазы (КФ 1.11.1.6)), содержание восстановленного глутатиона (GSH) и α-токоферола. Для определения активности антиоксидантных ферментов гомогенаты тканей готовили в 0.05 М фосфатном буферном растворе (рН = 7.0), после чего центрифугировали при 6000 g в течение 15 мин. Активность антиоксидантных ферментов определяли спектрофотометрически: СОД – по модифицированной адренохромной методике [9], каталазы – по количеству разложенной перекиси водорода [10]. Содержание белка определяли по методу Лоури [11] с использованием в качестве стандарта бычьего сывороточного альбумина. За 1 усл. ед. активности СОД принимали количество фермента, способное затормозить реакцию автоокисления адреналина на 50%. Активность каталазы выражали в мкмоль Н2О2, разложенной за 1 мин. Активность ферментов рассчитывали на 1 мг белка.
Содержание GSH определяли по методу Эллмана [12] и выражали в мкмоль/г ткани. Для этого гомогенаты тканей органов готовили в 0.02 М ЭДТА-Nа2, после центрифугирования (в течение 15 мин при 5000 g) к супернатантам добавляли 50% ТХУ для осаждения белков, затем вновь центрифугировали (15 мин при 3000 g). В полученных супернатантах после добавления 0.4 М трис-буферного раствора и реактива Эллмана (рН полной реакционной смеси составлял 8.0) спектрофотометрически (λ = 412 нм) определяли уровень GSH.
Концентрацию α-токоферола определяли методом ВЭЖХ [13]. Хроматографическое разделение α-токоферола осуществляли на микроколоночном жидкостном хроматографе “Милихром 6” с ультрафиолетовым детектором, элюентом служила смесь гексана с изопропанолом (98.5:1.5). Для построения калибровочных кривых использовали стандартный раствор α-токоферола (“Sigma”, США).
Периферическую кровь получали из хвостовой вены, после животных декапитировали. Свежеприготовленные и высушенные мазки крови окрашивались по Паппенгейму красителем-фиксатором Мая–Грюнвальда и красителем Романовского (MiniMed, Россия). Исследование проводилось с помощью светового микроскопа (Axioscop 40, Karl Zeiss) с цветной цифровой видеокамерой (Pixera 150ES). Производили микроскопическую съемку 10 полей зрения каждого препарата, полученного от исследуемых животных. Измерение морфометрических параметров эритроцитов (площади поверхности и диаметра) осуществлялось с применением методики NCR (nuclear-cytoplasmic ratio), входящей в пакет программного обеспечения “ВидеоТест 4.0”. Полученные данные обрабатывали общепринятыми статистическими методами, используя пакеты программ MS Excel и Statgraphics. Сравнение проводили c применением непараметрического U-критерия Вилкокcона–Манна–Уитни. Статистически значимыми считали различия при р < 0.05.
РЕЗУЛЬТАТЫ
В результате проведенного исследования выявлены возрастные изменения антиоксидантной защиты мышечной ткани ондатр (рис. 1). Достоверные различия по активности антиоксидантных ферментов и содержанию низкомолекулярных антиоксидантов между молодыми и взрослыми животными, отловленными осенью, наблюдались только в скелетной мышце – активность каталазы была ниже у половозрелых особей (рис. 1, c).
Рис. 1.
Активность супероксиддисмутазы (a), содержание α-токоферола (b), активность каталазы (c) и уровень восстановленного глутатиона (d) в условных единицах в тканях у ондатр разного возраста и сезона отлова. Черные столбики – молодые ондатры (осень), столбики со штриховкой – взрослые животные (осень), белые столбики – взрослые ондатры (весна); 1 – сердце, 2 – скелетная мышца; ♦ – различия достоверны по сравнению с молодыми животными (р < 0.05); * – различия достоверны по сравнению с животными, отловленными весной (р < 0.05).
Fig. 1. Superoxide dismutase activity (a), levels of α-tocopherol (b), catalase activity (c) and glutathione levels (d) in tissues of muskrats of different ages and caught in different season. Black bars – juveniles (autumn), hatched bars – adults (autumn), white bars – adults (spring); 1 – heart, 2 – skeletal muscle; ♦ – significant difference vs. juveniles (р < 0.05); * – significant difference vs. animals caught in spring (р < 0.05).
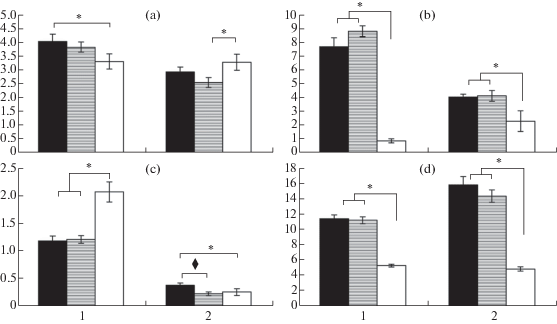
Помимо незначительных возрастных различий изученных показателей, нами были обнаружены сезонные: в сердце активность СОД была ниже (рис. 1, a), а каталазы выше у ондатр весной (рис. 1, c), чем у особей из осенней выборки. Напротив, в скелетной мышце активность СОД повышалась к весне (рис. 1, a), а каталазы снижалась (между молодыми осенними и зимовавшими ондатрами) (рис. 1, c). При этом содержание α-токоферола (рис. 1, b) и GSH (рис. 1, d) как в сердечной, так и скелетной мышце было достоверно выше у животных, отловленных осенью, по сравнению с особями из весенней выборки (рис. 1, b, d).
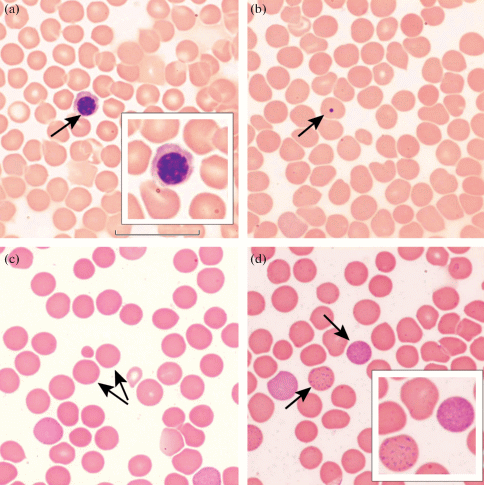
В результате исследования нами были обнаружены некоторые особенности в морфологии клеток эритроцитов (рис. 2). На светооптическом уровне эритроциты у ондатр имеют свойственную большинству видов млекопитающих морфологию. У всех исследованных ондатр они, как правило, были представлены зрелыми формами (округлые, безъядерные нормоциты) (рис. 2, c), также иногда встречались полихроматофильные эритроциты, нормобласты (рис. 2, a) и клетки с включениями (базофильная пунктация и тельца Жолли) (рис. 2, b, d). Базофильная зернистость (остатки рибосом) в эритроцитах проявлялась в виде множества мелких голубых точек, диффузно расположенных в цитоплазме (рис. 2, d). Необходимо отметить, что в осенний период базофильная субстанция в эритроцитах встречалась почти у всех взрослых животных, в то время как у молодых ондатр она, как правило, отсутствовала (за исключением одной особи). Практически у всех изученных животных в цитоплазме эритроцитов обнаружены остатки ядерного вещества (тельца Жолли) в виде однородных темно-фиолетовых сферических структур (рис. 2, b).
Рис. 2.
Эритроциты ондатры: a – эритроциты молодых животных, отловленных осенью, стрелка указывает на оксифильный нормобласт; b – эритроциты взрослых животных, отловленных осенью, стрелка – клетка с включением (тельце Жолли); c – нормоциты у ондатр из весенней выборки (стрелка), d – эритроциты с базофильной пунктацией (стрелка) у животных, пойманных весной. Масштабный отрезок 25 мкм. Окраска по Паппенгейму, масляная иммерсия.
Fig. 2. Muskrat erythrocytes: a – juvenile animals caught in autumn; arrow indicates oxyphilic normoblast); b – adult animals caught in autumn; arrow points to the cell with an inclusion (Howell-Jolly body); c – normocytes (arrow) in animals caught in spring; d – erythrocytes with basophilic stippling (arrow) in animals caught in spring. Scale bar, 25 μm. Stained after Romanowsky (May-Grünwald, Pappenheim), oil immersion.
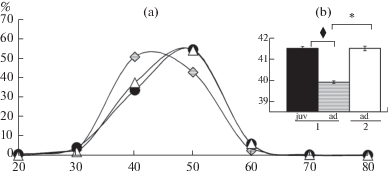
При исследовании морфометрических параметров эритроцитов периферической крови ондатр были выявлены достоверные внутривидовые различия (рис. 3). Так, например, в осенний период площадь эритроцитов у молодых ондатр была больше, чем у взрослых животных, но весной у половозрелых особей данный показатель был аналогичен молодым ондатрам, отловленным в октябре. Необходимо отметить, что у молодых животных из осенней и взрослых особей из весенней выборок преобладали эритроциты бо́льших размеров (45–55 мкм2), а у взрослых ондатр, пойманных осенью – более мелкие клетки (35–45 мкм2) (рис. 3).
Рис. 3.
Гистограмма распределения эритроцитов по площади (a) и ее средние значения (b) у ондатр разного возраста и сезона отлова. По вертикали – частота встречаемости эритроцитов определенного размера (%). По горизонтали – площадь поверхности эритроцита (мкм2); juv – молодые животные, ad – взрослые животные; ♦ – различия достоверны по сравнению с молодыми животными (р < 0.05); * – различия достоверны по сравнению с животными, отловленными весной (р < 0.05).
Fig. 3. Histogram of erythrocyte frequency distribution by their surface area (a) and its mean value (M ± SEM) (b) in muskrats of different ages and caught in different seasons. Ordinate – occurrence frequency of erythrocytes of a certain size (%). Abscissa – erythrocyte surface area (μm2); juv – juvenile animals, ad – adult animals; ♦ – significant difference vs. juvenile animals (р < 0.05); * – significant difference vs. animals caught in spring (р < 0.05).
ОБСУЖДЕНИЕ
Возрастные изменения изученных показателей. Адаптивные изменения физиологических систем, участвующих в поддержании кислородного гомеостаза, у разных видов ныряющих млекопитающих обнаруживаются, как правило, на тех стадиях онтогенетического развития, которые приурочены к началу активного плавания и ныряния. В природе способность к нырянию у ондатр существенно не увеличивается с возрастом или размером тела, и одно-двух месячные ондатры демонстрируют продолжительность ныряния, схожую с взрослыми животными [6, 14]. Однако небольшой размер тела и низкая тепловая инерция ювенильных ондатр способствуют более частому водному переохлаждению и значительному снижению продолжительности погружения при гипотермии, по сравнению с половозрелыми особями [14]. Более того, из-за меньших запасов кислорода в скелетных мышцах молодые ондатры более зависимы от анаэробного метаболизма при нырянии [6] и, следовательно, уровень гипоксии тканей у них может быть выше, чем у тренированных животных. Именно в скелетной мышце мы обнаружили различия в антиоксидантной защите между животными разного возраста, отловленными осенью (рис. 1), – активность каталазы была выше у молодых ондатр, чем у взрослых. Возможно, это связано с более высоким уровнем миоглобина в скелетной мышце у последних [6]. Хорошо известно, что ныряющие млекопитающие отличаются от наземных видов более высоким содержанием миоглобина и сродством его к кислороду [5]. Помимо того, что миоглобин участвует в запасании кислорода, он, взаимодействуя с H2O2, обладает прямыми антиоксидантными свойствами [15].
Результаты других исследований свидетельствуют о гетерохронности возрастных изменений антиоксидантного статуса тканей ныряющих млекопитающих [3, 4]. Так, например, в скелетных мышцах тюленя-хохлача (Cystophora cristata, Erxleben 1777) обнаружено, что у взрослых особей содержание GSH, пероксиредоксинов, активности СОД и глутатионпероксидазы (ГПО) были выше, а каталазы и глутатионредуктазы (ГР) ниже, чем у детенышей [4]. При этом продукция супероксидного радикала (O2•–) увеличивалась, а уровень перекисного окисления липидов (ПОЛ), карбонилированных белков и повреждений ДНК не изменялся с возрастом у этого вида [3]. Авторы предполагают [3, 4], что внутриклеточная продукция пероксида водорода (H2O2) поддерживается на необходимом физиологическом уровне в процессе онтогенеза тюленя-хохлача, потому что ГПО и пероксиредоксины снижают базальный уровень H2O2, в то время как активность каталазы растет в ответ на увеличение концентрации H2O2. В исследовании на болотной бурозубке (Sorex palustris Richardson, 1828), мелком полуводном млекопитающем, было показано, что активность антиоксидантных ферментов (СОД, каталаза, ГПО) в скелетных мышцах у взрослых была выше, чем у молодых, при этом с возрастом выявлено увеличение содержания только одного маркера окислительного стресса – ПОЛ [16]. Схожие данные были получены на неадаптированных к нырянию лабораторных крысах – активность антиоксидантных ферментов (СОД, каталаза, ГПО и ГР) и уровень ПОЛ в скелетных мышцах также увеличивались в ходе онтогенеза [17].
Несмотря на то что большое значение в адаптациях морских млекопитающих играют низкомолекулярные антиоксиданты [2–4], в нашем исследовании не обнаружено достоверных изменений содержания α-токоферола и GSH в мышечной ткани у ондатры с возрастом (рис. 1). Это может быть связано либо со становлением антиоксидантной системы у ондатры к 5–6 мес, либо с различиями в стратегиях антиоксидантной защиты у ныряльщиков. Ранее нами была обнаружена видоспецифичность связанных с нырянием изменений активности антиоксидантных ферментов и содержания GSH [18]. Более того, в исследовании Cantú-Medellín et al. [2] было показано, что в тканях морских ныряльщиков с наибольшей продолжительностью погружения (кашалоты, Kogia spp.) по сравнению с поверхностным ныряльщиком (афалина, Tursiops truncatus Montagu, 1821) образование O2•–, общий уровень GSH и содержание маркеров окислительного стресса были выше, а активность СОД – ниже. Авторы предполагают, что высокая активность СОД в тканях афалин по сравнению с кашалотами может привести к увеличению продукции Н2О2, которая, в свою очередь, влечет за собой серию каскадных реакций ПОЛ [2].
Пероксид водорода, как и некоторые продукты ПОЛ через различные сигнальные пути могут модифицировать экспрессию гена основного регулятора эритропоэза – эритропоэтина. Известно, что продукция эритропоэтина почками и печенью увеличивается в ответ на тканевую гипоксию, снижение гематокрита, артериальную гипоксемию или повышение сродства гемоглобина к кислороду [19]. Предполагают, что у ныряльщиков тканевая гипоксия стимулирует синтез эритропоэтина, который впоследствии способствует образованию эритроцитов для увеличения запасов O2 в крови [5, 20]. Несмотря на преимущества хранения O2 в крови, повышенные уровни гематокрита и эритроцитов вызывают увеличение вязкости крови, рост артериального давления и скорости свертывания крови. Действительно, высокое количество эритроцитов редко встречается у мелких млекопитающих, генетически адаптированных к гипоксии. В период погружения и вазоконстрикции периферических сосудов вязкость крови, как и размер клеток крови, приобретают дополнительную значимость. В результате проведенного исследования не обнаружено различий по количеству полихроматофильных эритроцитов и нормобластов между молодыми и взрослыми ондатрами в осенний период, однако площадь эритроцитов у ювенильных ондатр была больше, чем у взрослых животных (рис. 3). Известно, что форма и размер эритроцитов связаны с газотранспортной функцией клеток, и, возможно, обнаруженное нами преобладание более мелких эритроцитов в крови у пойманных осенью взрослых ондатр необходимо для увеличения диффузионной поверхности клетки и эффективного обеспечения тканей кислородом [21].
Сезонные особенности изученных показателей. Сезонные колебания температуры и доступности пищи оказывают значительное влияние на поведение ондатр. На Северо-Западе России с сентября по октябрь у животных начинается подготовка к длительному подледному образу жизни. Ондатры перемещаются на более глубокие части водоемов с запасами растительности и строят зимние убежища с дополнительными кормовыми хатками. Многочисленные визуальные или с использованием биотелеметрии наблюдения позволили установить, что в безледный период животные активны в основном в сумеречно-ночное время, а подо льдом – круглосуточно [7, 8]. Ондатры с ноября по апрель проводят в жилищах почти такое же время, что и в летние месяцы, однако в подледный период в хатках уровень СО2 выше и может достигать 10%, а уровень O2 снижаться до 18% [7, 8]. Лишь немногие виды в природе сталкиваются с более серьезными сезонными изменениями концентрации СО2 в норах, чем O. zibethicus в северных широтах [7]. Зимой по сравнению с летним периодом ондатры более толерантны к повышению СО2 во вдыхаемом воздухе: выявлено увеличение сродства гемоглобина к O2 (улучшение связывания O2 в легких) и изменение эффекта Бора (эффективная отдача O2 в тканях) [5, 7]. Более того, в зимне-весеннее время ондатры реже покидают жилище, но при этом продолжительность погружений возрастает по сравнению с летом [5, 6]. Ранее было обнаружено [8], что у ондатр, отловленных в феврале, запасы кислорода в крови и мышечной ткани на 41.7% выше, чем у летних особей. Эти значительные изменения происходят за счет достоверного увеличения размеров сердца и легких, гематокрита, концентрации Hb, объема крови, кислородной емкости крови и содержания миоглобина в скелетных мышцах животных в зимний период [8]. Во время поисковых и кормовых погружений животного низкая температура воды зимой приводит к усилению вазоконстрикции периферических сосудов и, как следствие, к гипоксии тканей и возможному окислительному стрессу. В результате нашего исследования выявлена сезонная изменчивость активности антиоксидантных ферментов у ондатр: в сердце активность каталазы, а в скелетной мышце активность СОД повышались к весне. Наряду с этим уровень низкомолекулярных антиоксидантов (α-токоферол и GSH) как в сердечной, так и скелетной мышце был выше у животных, пойманных осенью, по сравнению с особями из весенней выборки. Более низкое содержание α-токоферола в мышечных тканях ондатр, отловленных весной, может быть следствием ухудшения качества растительной пищи в этот период, а обнаруженная тканеспецифичность сезонных изменений активности ферментов – с различиями в энергообеспечении сердечной и скелетной тканей. При продолжительном нырянии грызунов ток крови перенаправляется в коронарные, бронхиальные и церебральные артерии и наблюдаются уменьшение притока крови к скелетным мышцам и дефицит O2 [22], что приводит к увеличению в крови количества лактата, вырабатываемого в мышцах в результате анаэробного гликолиза. Схожие изменения в лактатдегидрогеназной системе выявлены при интенсивных физических нагрузках млекопитающих, в том числе у человека [23]. Необходимо отметить, что эритроциты участвуют в транспортировке лактата от клеток-продуцентов к клеткам-потребителям, причем роль этих клеток возрастает у тренированных людей [23].
Ранее было показано увеличение запасов O2 в крови у ондатр в зимний период [6–8], в том числе за счет повышения гематокрита и количества эритроцитов, также отмечено уменьшение объема эритроцитов у зимних животных по сравнению с летними [6]. В нашем исследовании мы не выявили активизации эритропоэза у ондатр (судя по количеству полихроматофильных эритроцитов), отловленных весной. Однако средний диаметр и площадь эритроцитов у них были выше, чем у взрослых животных осенью. Обнаруженные противоречия могут быть связаны со временем сбора проб, так, в исследованиях MacArthur и соавторов ондатр отлавливали в январе и феврале, когда температура воздуха была значительно ниже 0°С [6, 8]. Возможно, что более мелкие эритроциты у ондатр зимой способствуют повышению респираторной функции крови [21]. Данные результаты подтверждаются и другими исследованиями [24, 25]: у мелких грызунов (Mus musculus и Myodes glareolus Schreber, 1780) также были обнаружены увеличение кислородной емкости крови и уменьшение размеров эритроцитов в зимний период. Однако весной диаметр эритроцитов у этих видов увеличивался и достигал максимума в летние месяцы. Темботова с соавт. предполагают [25], что процесс замещения мелких эритроцитов, имеющихся в кровотоке у грызунов в зимний период на крупные в летний сезон, происходит постепенно в течение 3–4 мес, начиная с конца зимы, а противоположное явление наблюдается осенью, начиная с конца лета. В нашем исследовании мы также обратили внимание на наличие эритроцитов разных размеров в препаратах крови ондатр, отловленных весной (рис. 2, c).
Интересно, что в некоторых работах на морских млекопитающих отмечено стимулирующее влияние продолжительности и глубины погружения на средний объем эритроцита. Например, ранее было обнаружено, что только один гематологический показатель (средний объем эритроцита) положительно коррелирует с максимальной продолжительностью погружения, развивающейся в ходе онтогенеза обыкновенного тюленя (Phoca vitulina L., 1758) [20]. Схожая зависимость наблюдалась при искусственном вскармливании детенышей южных слонов (Mirounga leonina L., 1758), у которых с началом активных погружений (возраст 3 недели) происходило увеличение среднего объема эритроцита [26]. Тем не менее у диких детенышей обыкновенного тюленя не обнаружено значительного увеличения среднего объема эритроцита в раннем постнатальном онтогенезе [27]. Согласно данным литературы, более крупные эритроциты чаще подвержены деформируемости, что обусловлено несколькими параметрами, в частности, такими как отношение площади поверхности клетки к ее объему и эластичность клеточной мембраны [28]. При этом немаловажную роль в этих процессах играет α-токоферол, который является необходимым компонентом мембран эритроцитов и, участвуя в антиоксидантной защите, увеличивает их структурно-функциональную стабильность. Наряду с этим было показано, что особое значение α-токоферол имеет при гипотермии, способствуя снижению окислительного стресса [29]. Учитывая указанные факты и снижение в тканях ондатры в весенний период уровня α-токоферола, можно сделать предположение о высокой устойчивости эритроцитов. В исследуемых нами образцах крови признаков деформированности и изменения морфологии поверхности эритроцитов, как правило, не обнаружено.
ЗАКЛЮЧЕНИЕ
В результате проведенного исследования выявлены незначительные различия в антиоксидантной защите мышечной ткани между молодыми и взрослыми животными в осенний период, что, возможно, связано со становлением антиоксидантной системы. У животных из осенней выборки установлено преобладание более мелких эритроцитов в крови у взрослых ондатр по сравнению с ювенильными животными, что, вероятно, необходимо для увеличения диффузионной поверхности клетки. При изучении сезонных изменений антиоксидантного статуса мышечной ткани у этого полуводного вида отмечены снижение содержания низкомолекулярных антиоксидантов и тканеспецифическое увеличение активности антиоксидантных ферментов к весне. Несмотря на обнаруженные ранее многочисленные приспособления ондатр к зимним условиям обитания [6–8], весной нами в периферической крови ондатр не выявлено активизации эритропоэза: эритроциты представлены, как правило, зрелыми формами, при этом их средняя площадь была выше, чем у взрослых особей в осенний период.
Таким образом, возрастные и сезонные изменения антиоксидантной защиты сердечной и скелетной мышцы и морфометрических параметров эритроцитов, по-видимому, являются компенсаторными механизмами у адаптированной к полуводному образу жизни ондатры. Полученные результаты дополняют имеющиеся сведения по регуляции поддержания постоянства внутренней среды ныряющих млекопитающих, однако существует еще много нерешенных вопросов в этой области исследований, в частности, большое значение приобретают молекулярно-генетические механизмы активации антиоксидантной системы.
Список литературы
Allen K.N., Vázquez-Medina J.P. Natural tolerance to ischemia and hypoxemia in diving mammals: a review. Front. Physiol. 10: 1–10. 2019. https://doi.org/10.3389/fphys.2019.01199
Cantú-Medellín N., Byrd B., Hohn A., Vázquez-Medina J.P., Zenteno-Savín T. Differential antioxidant protection in tissues from marine mammals with distinct diving capacities. Shallow/short vs. deep/long divers. Comp. Biochem. Physiol., Part A: Mol. Integr. Physiol. 158: 438–443. 2011. https://doi.org/10.1016/j.cbpa.2010.11.029
Vázquez-Medina J.P., Olguín-Monroy N.O., Maldonado P.D., Santamaría A., Königsberg M., Elsner R., Hammilll M.O., Burns J.M., Zenteno-Savín T. Maturation increases superoxide radical production without increasing oxidative damage in the skeletal muscle of hooded seals (Cystophora cristata). Can. J. Zool. 89: 206–212. 2011. https://doi.org/10.1139/Z10-107
Vázquez-Medina J.P., Soñanez-Organis J.G., Burns J.M., Zenteno-Savín T., Ortiz R.M. Antioxidant capacity develops with maturation in the deep-diving hooded seal. J. Exp. Biol. 214: 2903–2910. 2011. https://doi.org/10.1242/jeb.057935
MacArthur R.A., Weseen G.L., Campbell K. L. Diving experience and the aerobic dive capacity of muskrats: does training produce a better diver? J. Exp. Biol. 206: 1153–1161. 2003. https://doi.org/10.1242/jeb.00221
MacArthur R.A., Humphries M.M., Fines G.A., Campbell K.L. Body oxygen stores, aerobic dive limits, and the diving abilities of juvenile and adult muskrats (Ondatra zibethicus). Physiol. Biochem. Zool. 74: 178–190. 2001. https://doi.org/10.1086/319662
MacArthur R.A. Seasonal changes in hematological and respiratory properties of muskrat (Ondatra zibethicus) blood. Can. J. Zool. 62 (4): 537–545. 1984. https://doi.org/10.1139/z84-080
MacArthur R.A. Seasonal changes in the oxygen storage capacity and aerobic dive limits of the muskrat (Ondatra zibethicus). J. Comp. Physiol. B. 160: 593–599. 1990. https://doi.org/10.1007/BF00258987
Misra H.P., Fridovich I. The role of superoxide anion in the autoxidation of epinephrine and a simple assay for superoxide dismutase. J. Biol. Chem. 247: 3170 – 3175. 1972.
Beers R.F., Sizer I.N. A spectral method for measuring the breakdown of hydrogen peroxide by catalase. J. Biol. Chem. 195 (1): 133–140. 1952.
Lowry O.H., Rosenbrough N.J., Farr A.L., Randall R.J. Protein measurement with the Folin phenol reagent. J. Biol. Chem. 193 (1): 265–275. 1951.
Sedlak J., Lindsay R.H. Estimation of total, protein-bound and non-protein sulfhydryl groups in tissue with Ellman’s reagent. Anal. Biochem. 25: 192–205. 1968. DOI: (68)90092-4.https://doi.org/10.1016/0003-2697
Скурихин В.Н., Двинская Л.М. Определение α-токоферола и ретинола в плазме крови сельскохозяйственных животных методом микроколоночной высокоэффективной жидкостной хроматографии. С.-хоз. биол. 4: 127–129. 1989. [Skurikhin V.N., Dvinskaya L.M., Determination of α-tocopherol and retinol in blood plasma of agricultural animals by microcolumn highperformance liquid chromatography. S-kh. Biol. 4: 127–129.1989. (In Russ)].
Hindle A.G., Senkiw R.W., MacArthur R.A. Body cooling and the diving capabilities of muskrats (Ondatra zibethicus): A test of the adaptive hypothermia hypothesis. Comp. Biochem. Physiol., Part A: Mol. Integr. Physiol. 144: 232–241. 2006. https://doi.org/10.1016/j.cbpa.2006.03.001
Hendgen-Cotta U.B., Kelm M., Rassaf T. Myoglobin functions in the heart. Free Radic. Biol. Med. 73: 252–9. 2014. https://doi.org/10.1016/j.freeradbiomed.2014.05.005
Hindle A.G., Lawler J.M., Campbell K.L. et al. Muscle aging and oxidative stress in wild-caught shrews. Comp. Biochem. Physiol., Part B: Biochem. Mol. Biol. 155 (4): 427–434. 2010. https://doi.org/10.1016/j.cbpb.2010.01.007
Ji L.L., Dillon D., Wu E. Alteration of antioxidant enzyme with aging in rat skeletal muscle and liver. Am. J. Physiol. 258: 918–923. 1990. https://doi.org/10.1152/ajpregu.1990.258.4.R918
Sergina S., Antonova E., Ilyukha V., Łapiński S., Lis M., Niedbała P., Unzhakov A., Belkin V. Biochemical adaptations to dive-derived hypoxia/reoxygenation in semiaquatic rodents. Comp. Biochem. Physiol., Part B: Biochem. Mol. Biol. 2015. Vol. 190. P. 37–45. https://doi.org/10.1016/j.cbpb.2015.08.012
Ratcliffe P.J., Ebert B.L., Firth J.D., Gleadle J.M., Maxwell P.H., Nagao M., et al. Oxygen regulated gene expression: erythropoietin as a model system. Kidney Int. 51: 514–526. 1997. https://doi.org/10.1038/ki.1997.72
Thomas A., Ono K. Diving related changes in the blood oxygen stores of rehabilitating harbor seal pups (Phoca vitulina). PLoS One. 10 (6): 1–16. 2015. https://doi.org/10.1371/journal.pone.0128930
Holland R.A., Forster R.E. The effect of size of red cells on the kinetics of their oxygen uptake. J. Gen. Physiol. 49 (4): 727–42. 1966. https://doi.org/10.1085/jgp.49.4.727
Галанцев В.П., Камардина Т.А., Коваленко Р.И. Реакции сердечно-сосудистой системы и биоэнергетический метаболизм в связи с адаптацией к апноэ. Физиол. ж. им. И.М. Сеченова. 80 (90): 117–123. 1994. [Galancev V.P., Kamardina T.A., Kovalenko R.I. Cardiovascular system reactions and bioenergy metabolism in relation to adaptation to apnea. Fiziol. Zh. im. I.M. Sechenova. 80 (90): 117–123. 1994. (In Russ)].
Opitz D., Lenzen E., Opiolka A., Redmann M., Hellmich M., Bloch W., Brixius K., Brinkmann C. Endurance training alters basal erythrocyte MCT-1 contents and affects the lactate distribution between plasma and red blood cells in T2DM men following maximal exercise. Can. J. Physiol. Pharmacol. 93 (6): 413–9. 2015. https://doi.org/10.1139/cjpp-2014-0467
Tarakhtii E.A., Davydova Yu.A. Seasonal variation in hematological indices in bank vole (Clethrionomys glareolus) in different reproductive states // Biology Bulletin. 34 (1): C. 9–19. 2007. https://doi.org/10.1134/S1062359007010025
Темботова Э.Ж., Емкужева М.М., Темботова Ф.А. Сезонная динамика показателей периферической крови домовой мыши (Mammalia, Rodentia) в горах Центрального Кавказа. Вестник Адыгейского государственного университета. Сер. Естественно-математические и технические науки. 4 (147): 71–76. 2014. [Tembotova E.Z., Emkuzheva M.M., Tembotova F.A. Seasonal dynamics of house mouse (Mammalia, Rodentia) blood parameters under mountain conditions of the Central Caucasus. Vestnik Adygeyskogo gosudarstvennogo universiteta. Ser. Yestestvenno-matematicheskiye i tekhnicheskiye nauki. 4 (147): 71–76. 2014. (In Russ)].
Bryden M., Lim G. Blood parameters of the southern elephant seal (Mirounga leonina) in relation to diving. Comp. Biochem. Physiol. 28: 139–148. 1969. DOI: (69)91328-0.https://doi.org/10.1016/0010-406X
Clark C.A., Burns J.M., Schreer J.F., Hammill M.O. A longitudinal and cross-sectional analysis of total body oxygen store development in nursing harbor seals (Phoca vitulina). Comp. Biochem. Physiol., Part B: Biochem. Mol. Biol. 177: 217–27. 2007. https://doi.org/10.1007/s00360-006-0123-6
Novozhilov A.V., Katyukhin L.N. Dynamics of hematological blood parameters of white rats in postnatal ontogenesis. J. Evol. Biochem. Physiol. 44 (6): 724–734. 2008. https://doi.org/10.1134/S0022093008060094
Klichkhanov N.K., Ismailova J.G., Astaeva M.D., Cha-labov Sh.I. Influence of vitamins C and E on free radical processes in blood rats in acute moderate hypothermia. Biology Bulletin. 46: 536–543. 2020. https://doi.org/10.1134/S1062359019060086
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


