Журнал эволюционной биохимии и физиологии, 2020, T. 56, № 5, стр. 350-358
СПЕЦИАЛИЗАЦИЯ НЕЙРОНОВ СЛУХОВОГО ЦЕНТРА СРЕДНЕГО МОЗГА И ПЕРВИЧНОЙ СЛУХОВОЙ КОРЫ МЫШИ MUS MUSCULUS С РАЗЛИЧНЫМИ ПАТТЕРНАМИ ОТВЕТА ПРИ ЧАСТОТНО-ВРЕМЕННОЙ ОБРАБОТКЕ КОММУНИКАЦИОННЫХ СИГНАЛОВ
М. А. Егорова 1, *, А. Г. Акимов 1
1 Федеральное государственное бюджетное учреждение науки Институт эволюционной физиологии и биохимии
им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
* E-mail: ema6913@yandex.ru
Поступила в редакцию 12.03.20
После доработки 29.03.20
Принята к публикации 03.04.2020
Аннотация
В работе исследовали специализацию нейронов центрального ядра заднего холма среднего мозга и первичной слуховой коры домовой мыши с различными паттернами ответов к обработке моделей коммуникационного сигнала мышей – крика дискомфорта мышат. С этой целью внеклеточно регистрировали ответы одиночных нейронов, вызванные моделями крика дискомфорта мышат и сериями моделей, состоящих из 4-х компонентов, следующих с разными межстимульными интервалами (0–1000 мс). У трети нейронов центрального ядра заднего холма показано спектральное облегчение ответов на различные двух- и трехтоновые комбинации частотных составляющих крика. Около 80% таких комбинационно-чувствительных нейронов имели тонические характеристики активности, т.е. тонические, фазно-тонические, паузные и позднелатентные разряды. Исследование ответов нейронов центрального ядра на серии моделей крика дискомфорта показало, что при коротких межстимульных интервалах (0–50 мс) ответы на 2-й–4-й сигналы в серии полностью подавлялись или значительно уменьшались почти у двух третей исследованных нейронов, т.е. проявлялась адаптация к сериям звуков. Такие нейроны имели фазные или пачечные разряды. У трети нейронов адаптация не проявлялась. Для них был характерен тонический тип разряда. Все нейроны первичных областей слуховой коры (переднего и первичного слуховых полей) продемонстрировали эффект адаптации в ответах на серии моделей крика дискомфорта. Разряды нейронов были фазными или пачечными.
ВВЕДЕНИЕ
Нейроны центрального ядра заднего холма среднего мозга домовой мыши по паттернам ответов на тональные импульсные сигналы могут быть отнесены к двум принципиально различным типам. Первый отличается тоническими характеристиками активности, т.е. импульсный ответ нейрона продолжается в течение всего действия акустического сигнала. Среди ответов нейронов центрального ядра преобладание тонической активности показано для тонических, фазно-тонических, паузных и позднелатентных разрядов [1–3]. Второй тип нейронов отличается фазными характеристиками активности, при которых ответ нейрона значительно короче длительности сигнала. Такие нейроны имеют фазный или пачечный разряд. Разряды нейронов первичных полей слуховой коры (первичного слухового поля А1 и переднего слухового поля AAF), как наркотизированных кетамином, так и бодрствующих домовых мышей, имеют в подавляющем большинстве фазные характеристики, т.е. фазные и пачечные разряды [4–6]. Различия в характеристиках импульсной активности нейронов позволяют предполагать их функциональную специализацию в частотно-временной обработке звуков.
В представленной работе исследовали специализацию нейронов слухового центра среднего мозга и слуховой коры с различными паттернами ответов к частотно-временной обработке моделей коммуникационного сигнала раннего онтогенеза мышей – крика дискомфорта мышат “wriggling call” и его последовательностей. Крик состоит из трех основных гармоник, сосредоточенных в области 5, 10 и 15 кГц, мышата излучают его в виде серий из 2–5 сигналов [7, 8], при этом мыши-матери воспринимают естественный крик и его модели как значимые, если они следуют сериями из четырех сигналов с интервалами 100–400 мс [8].
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
В работе производили внеклеточную регистрацию импульсной активности одиночных нейронов центрального ядра заднего холма среднего мозга и первичных областей слуховой коры (полей А1 и AAF) домовых мышей Mus musculus, самок гибридов F1 линий СBA и C57BL/6 в возрасте 8–15 нед. Эксперименты выполняли в условиях общей анестезии, поддерживаемой инъекциями смеси кетамина (кетавет, 35 мг/кг) и ксилазина (ромпун, 0.1 мг/кг) в соответствии с принципами Базельской декларации и рекомендациями Физиологической секции Российского национального комитета по биологической этике.
Методика подготовки животного к эксперименту и регистрации импульсной активности нейронов подробно описана ранее [4–6, 9, 10]. При подготовке к эксперименту на слуховом центре среднего мозга у животного оперативно открывали доступ к левому заднему холму [9, 10]. После удаления твердой мозговой оболочки на обнаженную поверхность мозга наносили 2–3 капли теплого силикона. Открытие доступа к слуховой коре начинали с удаления кожи над латеральной частью левой височной кости. Мышцы отодвигали при помощи хирургического крючка. В латеральной части височной кости высверливали отверстие (приблизительно 5 × 3 мм). Его ростральная граница располагалась на 1–2 мм ростральнее sutura squamosa. С каудальной стороны оно было ограничено sutura lambdoidea, с дорсальной стороны – linea temporalis, с вентральной – ventral sutura squamosa [6]. Твердую мозговую оболочку оставляли интактной. Перед началом регистрации ответов нейронов голову жестко фиксировали в головодержателе таким образом, чтобы дорсальная поверхность мозга располагалась горизонтально.
Генерация сигналов и регистрация спайковой активности нейронов обеспечивались возможностями специализированного уникального программного обеспечения (программа TMS2), разработанного Dr. I.Е. Schulze-Kruger (Гамбург, Германия) на базе системной платы ТМS320C30 System Board, встроенной в РС, совмещающей ЦАП и АЦП функции (TI-Instruments Dallas, USA; тактовая частота 200 кГц, разрешение по амплитуде 16 бит). После усиления (усилитель Amphyton 25U-002C; PO Lorta) сигналы поступали на звукоизлучатель Sonotrack (Metris, Голландия), неравномерность частотной характеристики которого составляла ±5 дБ в диапазоне частот 3–65 кГц. Излучатель был расположен контралатерально стороне регистрации импульсной активности на расстоянии 60 см под углом 45° справа относительно сагиттальной плоскости. Ось излучателя была соотнесена с наружным слуховым проходом уха. Уровни звукового давления сигналов (УЗД, дБ над 20 мкПа) измеряли в точке расположения ушной раковины животного с помощью системы Брюль & Кьер: 6,5 мм микрофона 4135, предусилителя 2633 и измерительного усилителя 2606. При максимальных значениях используемых сигналов (85 дБ УЗД) уровень основной частоты, по крайней мере, на 35 дБ (а как правило, более, чем на 50 дБ) превышал уровень продуктов нелинейных искажений в звукогенерирующем тракте. Контроль частотных характеристик сигналов осуществлялся с помощью программы спектрального анализа акустических сигналов “Waterfall” и интерфейсной системы СЕD1401plus (Cambridge Electronic Design, Cambridge, UK) либо ЦАП–АЦП системой Ronald UA-55 Quad-Capture, программа “Cool Edit Pro 2.0”.
На протяжении эксперимента животное находилось в звукозаглушенной анэхоидной камере. Эксперимент начинали с аудиовизуального определения характеристической частоты (ХЧ) и порога ответа нейрона на тон ХЧ. Нейрональные ответы усиливали в 10 000 раз, фильтровали (диапазон пропускаемых частот 0.3–10 кГц) (WPI, усилитель DAM 80; Science Products, Hofheim, Germany) и выводили параллельно на осциллограф (Tectronix 5A14N), громкоговоритель и оконный дискриминатор (WPI 120; Science Products) с последующим введением в компьютер. Импульсную активность нейронов оцифровывали при помощи интерфейса СЕD1401 plus и записывали на РС (программа Spike2).
В центральном ядре заднего холма в качестве регистрирующих электродов использовали стеклянные микропипетки, заполненные 3М раствором KCl, с сопротивлением 4–8 мОм. Электроды вводили стереотаксически в область левого заднего холма, на 1.0–1.5 мм каудальнее и на 0.8–1.5 мм латеральнее λ-точки, что соответствовало расположению центрального ядра заднего холма мыши [11–14].
Вольфрамовые изолированные лаком микроэлектроды с сопротивлением кончика 3–8 мОм вводили ортогонально поверхности мозга в каудальную часть височной коры левого полушария, соответствующую расположению слуховой коры животного [15]. Ввиду выраженности у мышей индивидуальных топографических различий в локализации полей слуховой коры для определения их границ у каждого животного производили морфофизиологическое картирование. Оно осуществлялось под визуальным контролем расположения электрода на поверхности коры мозга. Основным критерием локализации полей А1 и AAF служило наличие в этих структурах тонотопической организации с градиентом частот по ростро-каудальной оси, показанное в работе [15]. В поле A1 ХЧ нейронов убывали в ростро-каудальном направлении, в поле AAF порядок частот инвертировался, т.е. они возрастали в ростро-каудальном направлении. Регистрацию ответов нейронов производили на глубине 300–600 мкм, что соответствовало расположению III–V слоев коры.
При исследовании спектральных механизмов анализа сложных коммуникационных сигналов критерием отбора нейронов для регистрации служило наличие у них возбудительного ответа на естественный крик дискомфорта мышат “wriggling call”. Для каждого нейрона были получены характеристики ответов на “wriggling call”, его синтетическую модель и шесть комбинаций частотных составляющих, т.е. на любые две из трех основных гармоник попарно либо каждую из трех в отдельности. Модель крика была образована тремя равными по мощности тональными составляющими частотой 5, 10 и 15 кГц длительностью 70 мс, включая время нарастания и спада (по 5 мс). Уровень каждого сигнала был равен 70 дБ УЗД. Каждый сигнал предъявляли 19 раз с частотой повторения 1 в секунду. Анализ импульсной активности выполнен для 122 нейронов центрального ядра заднего холма с ХЧ от 4.8 до 23.0 кГц.
Для воспроизведения временной структуры серий крика дискомфорта применяли звуковые последовательности, образованные четырьмя 100-мс тональными посылками, частота которых соответствовала ХЧ нейрона. Интервал между тональными составляющими одной серии был одинаков, а в различных сериях варьировал от 0 до 1000 мс (0, 2, 4, 10, 20, 50, 100, 200, 500, 700 и 1000 мс). Каждую серию предъявляли 20 раз с интервалом в 2 c. Подсчитывали число спайков в ответе нейрона на каждый из тональных сигналов, составляющих серию. Для оценки временной динамики адаптации строили зависимости числа спайков в ответе от интервала между сигналами (кривые восстановления ответа). Исследовано 145 нейронов центрального ядра заднего холма с ХЧ от 2.9 до 43.0 кГц и 102 нейрона первичной слуховой коры с ХЧ от 5.0 до 30.0 кГц. 61 нейрон был локализован в поле А1, 41 – в поле AAF.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Оценку избирательности реакций одиночных нейронов центрального ядра заднего холма на естественный крик дискомфорта и его модели производили по величине ответа, т.е. по количеству спайков в ответе (рис. 1). Анализ количества спайков в ответах четверти нейронов (30 единиц, 25%) выявил спектральное облегчение ответов на различные двухтоновые комбинации частотных составляющих крика, трехтоновую модель и сам крик. Критерием облегчения, или нелинейной суммации, являлось превышение не менее чем на 20% величины ответов на двух- и трехкомпонентные сигналы по сравнению с суммой ответов на соответствующие отдельные компоненты. Нейроны с такими реакциями были обнаружены ранее в слуховой коре и задних холмах среднего мозга летучих мышей и названы комбинационно-чувствительными [16, 17].
Рис. 1.
Особенности ответов двух нейронов центрального ядра заднего холма на “wriggling call”, его модель и комбинации частотных составляющих крика.
a – фазный нейрон не проявляет избирательности к двух- и трехкомпонентным сигналам; b – комбинационно-чувствительный фазно-тонический нейрон. В верхней части – перистимульные гистограммы ответов нейронов на “wriggling call”, его отдельные частотные компоненты (5, 10 и 15 кГц), их комбинации и модель. По оси абсцисс – время; по оси ординат – количество спайков за 19 предъявлений сигнала. Величина бина – 2 мс. Жирная горизонтальная линия – отметка стимула. В нижней части – величина ответа нейрона, вызванного “wriggling call” (w.c.), его отдельными частотными компонентами и синтетической моделью. По оси ординат – количество спайков за 19 предъявлений сигнала. По оси абсцисс – типы сигналов. Цифрами указаны частоты сигналов, кГц.
Fig. 1. Responsiveness of two neurons in the inferior colliculus central nucleus to a wriggling call, its model and combinations of its frequency components. (a) Phasic neuron shows no selectivity to two- and three-component signals; (b) combination-sensitive phasic-tonic neuron. In the upper part – peristimulus time histograms of neuronal responses evoked by a wriggling call, its frequency components (5, 10 and 15 kHz), two-tone combinations of components and three-tone model. Abscissa: time (ms). Ordinate: the number of spikes for 19 signal presentations (N). The bin width is 2 ms. Solid bold horizontal lines below the columns of peristimulus time histograms show the presence duration of the acoustic stimulus. In the lower part – neuronal responses evoked by a wriggling call, its frequency components (5, 10 and 15 kHz), two-tone combinations of components and three-tone model. Ordinate: the number of spikes for 19 signal presentations.
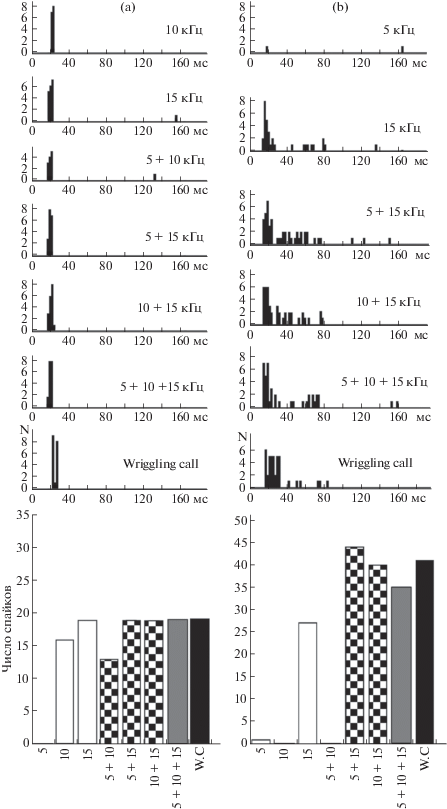
Почти все зарегистрированные нами комбинационно-чувствительные нейроны (90%; 27 единиц) имели тонические характеристики активности, т.е. тонические, фазно-тонические, паузные и позднелатентные разряды (рис. 1, b). У 3-х комбинационно-чувствительных нейронов (10%) разряды были фазными. Остальные 92 нейрона не проявляли свойств комбинационно-чувствительных единиц (рис. 1, а). Среди последних 28 нейронов имели фазные характеристики ответа, что составляло 87.5% от всех фазных единиц. Достоверное преобладание нейронов с тоническими разрядами в группе комбинационно-чувствительных единиц подтверждается тестом χ2 (χ2 = 4.961, число степеней свободы –1, p < 0.03).
Исследование ответов нейронов центрального ядра заднего холма на серии моделей крика дискомфорта показало, что при коротких межстимульных интервалах (0–50 мс) ответы на 2-й–4‑й сигналы в серии полностью подавлялись или значительно уменьшались у 86 из 145 исследованных нейронов (59%), т.е. проявлялась адаптация к сериям звуков (рис. 2, а). Такие нейроны имели фазные или пачечные разряды. Увеличение межстимульного интервала в серии приводило к постепенному восстановлению ответа на следующие за первым сигналы. Функции восстановления ответа были монотонны. Значение межстимульного интервала, при котором начиналось восстановление ответов, у разных нейронов варьировало от 4 до 50 мс, причем ответы на 2-й–4-й сигналы восстанавливались практически синхронно. Полное восстановление ответов, когда их величина не отличалась от величины ответа на первый сигнал, наблюдалось при межстимульных интервалах от 200 мс до 700 мс. При этом более чем у 90% нейронов ответ полностью восстанавливался при межстимульном интервале, не превышавшем 500 мс. У остальных 59 нейронов (41%) адаптация не проявлялась (рис. 2, b). Для них был характерен тонический тип разряда (тонический, фазно-тонический, паузный и позднелатентный ответы) с выраженными поздними компонентами ответа.
Рис. 2.
Примеры двух нейронов центрального ядра заднего холма с выраженной постстимульной адаптацией к серии сигналов (а) и без нее (b). В верхней части рисунка – перистимульные гистограммы ответов нейронов, вызванных сериями тональных импульсов с различными межстимульными интервалами. Значение межстимульного интервала для каждой серии указано цифрами на диаграмме. Величина бина – 2 мс. По оси абсцисс – время; по оси ординат – число спайков. Под каждой гистограммой приведена отметка стимула, представляющего собой серию из 4 тональных импульсов длительностью 100 мс каждый. В нижней части рисунка – зависимость величины ответа этих же нейронов на 2-й, 3-й и 4-й сигналы серии от межимпульсного интервала (кривые восстановления ответов). Величина ответа нейрона на каждый компонент нормирована относительно его ответа на 1-й сигнал серии, т.е. равна отношению числа спайков в ответе нейрона на соответствующий сигнал к числу спайков в ответе на 1-й сигнал.
Fig. 2. Examples of two neurons in the mouse inferior colliculus central nucleus with strong poststimulus adaptation (a) and without adaptation (b). On the top: peristimulus time histograms of neuronal responses evoked by a series of tones with different interstimulus intervals. The values of intertone intervals are denoted by figures. The bin width is 2 ms. Abscissa: time, ms. Ordinate: number of spikes, N. Solid bold horizontal line under each histogram marks the temporal structure of the stimulus consisting of four 100-ms tones. At the bottom: adaptation recovery curves of the same neurons, i.e. dependences of responses to the second, third and fourth tones in a series on the intertone intervals. The value of the response (spike number) to each component is normalized relative to the spike number in the response to the first tone in a series, i.e. equal to a ratio of the spike number in responses to the second–fourth tones in a series and the spike number in the response to the first tone.
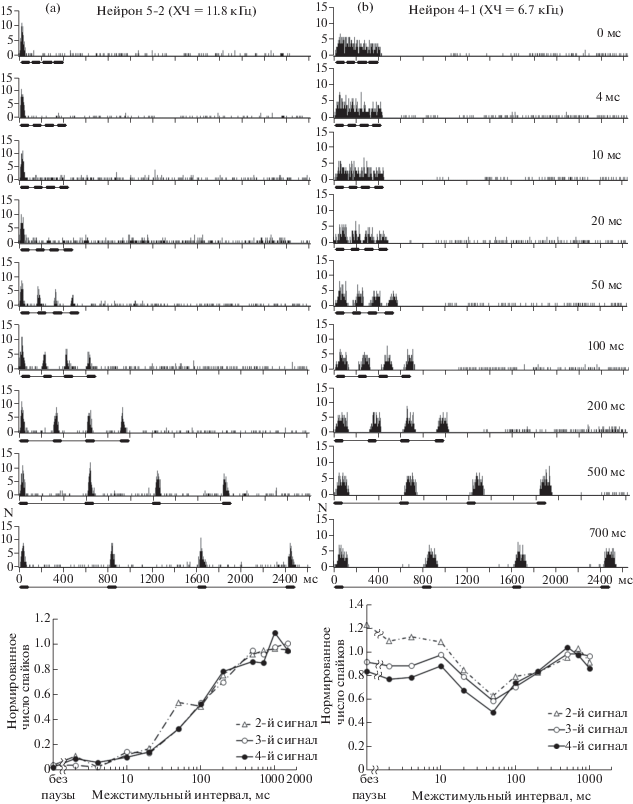
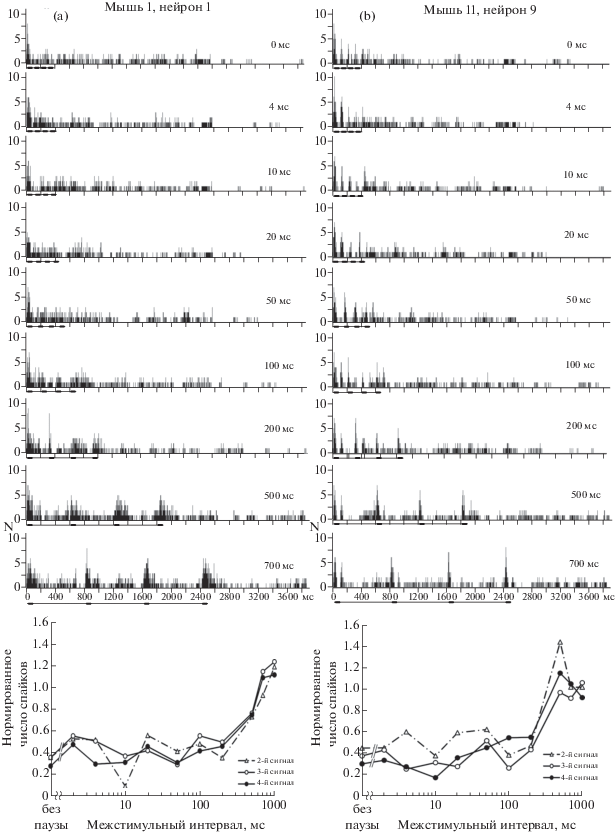
Исследование ответов нейронов первичной слуховой коры (полей А1 и AAF) на серии моделей крика дискомфорта продемонстрировало эффект адаптации в ответах подавляющего большинства исследованных нейронов мыши (93 единицы, 91%). Только у девяти нейронов эффект адаптации не был выражен. Возможно, ее проявления нельзя было отследить в силу высокой и нерегулярной (залповой) спонтанной активности этих нейронов. У всех остальных единиц адаптация выражалась в отсутствии или значительном снижении активности, вызванной следующими за 1-м компонентами серии звуков при относительно коротких интервалах между ними (0–100 мс, рис. 3, а, b). Нормированные функции восстановления ответа на 2-й, 3‑й и 4-й сигналы в серии возрастали с увеличением межстимульного интервала вплоть до полного восстановления ответа (рис. 3). У разных нейронов восстановление ответов начиналось при различных межстимульных интервалах (10–200 мс) (рис. 3, а, b). Преобладали нейроны с порогом восстановления, равным 50–200 мс (72 единицы, 71%). У нейрона поля А1, приведенного на рис. 3, а, восстановление ответа начиналось при межстимульных интервалах 100 мс. При малых межстимульных интервалах ответы приведенного на рис. 3, b нейрона поля AAF, вызванные 2-м–4-м сигналами серии, не подавлялись полностью. Выраженное восстановление величины ответов начиналось при межстимульных интервалах 200 мс. Полное восстановление ответов, когда их величина не отличалась от ответа на первый компонент серии, наблюдалось при межстимульных интервалах от 200 мс до 1000 мс. При этом у половины нейронов ответ полностью восстанавливался при межстимульном интервале, не превышавшем 500 мс, и почти у 90% нейронов – при межстимульном интервале, не превышавшем 700 мс. Все нейроны имели фазные характеристики активности (фазные и пачечные разряды).
Рис. 3.
Примеры нейронов первичного (AI, а) и переднего (AAF, b) полей слуховой коры мыши с различной динамикой временной постстимульной адаптации. Обозначения – см. рис. 2.
Fig. 3. Examples of neurons in the primary (AI, a) and anterior (AAF, b) fields of the mouse auditory cortex with different dynamics of temporal poststimulus adaptation. Descriptions as in Fig. 2.
Таким образом, в работе продемонстрирована различная избирательность нейронов центрального ядра заднего холма среднего мозга и первичной слуховой коры домовой мыши с фазными и тоническими характеристиками активности к моделям крика дискомфорта мышат “wriggling call” и его последовательностям. Показано, что частотная обработка сложных многокомпонентных звуков и, в первую очередь, коммуникационных сигналов с несколькими формантами происходит путем усиления ответа на них за счет спектрального облегчения у нейронов с тоническими характеристиками активности. Специализация нейронов центрального ядра заднего холма среднего мозга мыши с тоническими компонентами ответов (тоническими, фазно-тоническими, паузными и позднелатентными разрядами) к обработке спектральной информации была показана также при исследовании феномена критических полос слуха, фундаментального механизма спектрального анализа звуков. Нейроны, обеспечивавшие кодирование свойств критических полос слуха мыши, имели преимущественно тонические характеристики активности [18, 19].
В данном исследовании показано, что как в слуховом центре среднего мозга мыши, так и в первичной слуховой коре этого животного, во временном интервале 0–500 мс наблюдалось явление адаптации активности нейронов к повторяющимся сигналам, выражающееся в снижении ответов нейрона на сигналы, следовавшие за первым сигналом в серии. Кодирование временных характеристик адаптации, т.е. временных интервалов, определяющих, очевидно, группирование и разделение звуковых событий, осуществлялось преимущественно нейронами с фазными характеристиками активности. Специализация фазных нейронов к обработке временной информации подтверждается исследованиями фазных нейронов в различных слуховых центрах. Нейроны с фазным типом разряда впервые по ходу восходящих слуховых проекций показаны на уровне кохлеарных ядер [20]. Это – нейроны вентрального кохлеарного ядра, так называемые клетки-октопусы [20, 21]. Клетки-октопусы являются вставочными интернейронами кохлеарных ядер и предположительно выполняют функцию нейронов-детекторов начала сигнала [21]. Изучение временны́х характеристик активности фазных нейронов центрального ядра задних холмов (такие нейроны имеют преимущественно V‑образные возбуждающие частотные рецептивные поля с широкой частотной настройкой) показало высокую стабильность латентных периодов их ответов [22]. Низкая частотная избирательность таких нейронов указывает на инвариантность их реакций на звуки с различными физическими характеристиками, что позволило предположить специализацию V-образных нейронов центрального ядра задних холмов как детекторов начала сигнала.
Список литературы
Егорова М.А. Временные свойства импульсной активности одиночных слуховых нейронов задних холмов мыши. Сенсорные системы. 22 (3): 203–213. 2008. [Egorova M.A. Temporal Characteristics of Single Neuron Evoked Activity in the Mouse Auditory Midbrain. Sensorn. Sistemy. 22 (3): 203–213. 2008. (In Russ)].
Egorova M.A. Peculiarities of Time Patterns of Discharges of Single Auditory Neurons of Mouse Inferior Colliculi. J. Evol. Biochem. Physiol. 44 (5): 637–641. 2008. https://doi.org/10.1134/S0022093008050149
Ehret G. The auditory midbrain, a “shunting yard” of acoustical information processing. The Central Auditory System. Eds. Ehret G., Romand R. New York, Oxford: Oxford University Press. 259–316. 1997.
Egorova M.A. Frequency selectivity of neurons of the primary auditory field (A1) and anterior auditory field (AAF) in the auditory cortex of the house mouse (Mus musculus). J. Evol. Biochem. Physiol. 41 (4): 476–480. 2005.
Egorova M.A., Khorunzhii G.D., Akimov A.G. The Timescale of Adaptation in Tonal Sequence Processing by Mouse Primary Auditory Cortical Neurons. J. Evol. Biochem. Physiol. 55 (6): 497–501. 2019. https://doi.org/10.1134/S0022093019060085
Joachimsthaler B., Uhlmann M., Miller F., Ehret G., Kurt S. Quantitative analysis of neuronal response properties in primary and higher-order auditory cortical fields of awake house mice (Mus musculus). Eur. J. of Neurosci. 39: 904–918. 2014. https://doi.org/10.1111/ejn.12478
Egorova M.A., Akimov A.G. Acoustic characteristics in the low-frequency nest call of the house mouse (Mus musculus) early ontogenesis. Acoustical Physics. 56 (3): 391–397. 2010. https://doi.org/10.1134/S1063771010030152
Gaub S., Ehret G. Grouping in auditory temporal perception and vocal production is mutually adapted: the case of wriggling calls of mice. J. Comp. Physiol. 191: 1131–1135. 2005. https://doi.org/10.1007/s00359-005-0036-y
Егорова М.А., Вартанян И.А., Эрет Г. Нейрофизиологические предпосылки слуховых критических полос на уровне среднего мозга. Сенсорные системы. 16 (1): 3–12. 2002. [Egorova M.A., Vartanian I.A., Ehret G. Neurophysiological Correlates of Critical Bands in the Auditory Midbrain. Sensorn. Sistemy. 16 (1): 3–12. 2002. (In Russ)].
Egorova M., Ehret G., Vartanian I., Esser K.-H. Frequency response areas of neurons in the mouse inferior colliculus. I. Threshold and tuning characteristics. Exp. Brain Research. 140: 145–161. 2001. https://doi.org/10.1007/s002210100786
Sidman R.L., Angevine J.B., Pierce E.T. Atlas of the mouse brain and spinal cord. Boston: Harvard University Press. 1971.
Ehret G., Moffat A. J. M. Inferior colliculus of the house mouse. II. Single unit responses to tones, noise and tone-noise combinations as a function of sound intensity. J. Comp. Physiol. V. 156: 619–635. 1985. https://doi.org/10.1007/BF00619112
Stiebler I., Ehret G. Inferior colliculus of the house mouse. I. A quantitative study of tonotopic organization, frequency representation and tone-threshold distribution. J. Comp. Neurol. 238: 65–76. 1985. https://doi.org/10.1002/cne.902380106
Romand R., Ehret G. Development of tonotopy in the inferior colliculus. I. Electrophysiological mapping in house mice. Dev. Brain Res. 54: 221–234. 1990. https://doi.org/ (90)90145-Ohttps://doi.org/10.1016/0165-3806
Stiebler I., Neulist R., Fichtel I., Ehret G. The auditory cortex of the house mouse: left-right differences, tonotopic organization and quantitative analysis of frequency representation. J.Comp. Physiol. A. 181: 559–571. 1997. https://doi.org/10.1007/s003590050140
Suga N. Auditory neuroethology and speech processing: complex-sound processing by combination-sensitive neurons. Auditory Function. The Neurobiological Bases of Hearing. Eds. Edelman G.M., Gall W.E., Cowan W.M. New York: Wiley. 679–720. 1988.
Portfors C.V., Sinex D.G. Coding of communication sounds in the inferior colliculus. The inferior colliculus. Eds J.A. Winer, C.E. Schreiner. New York: Springer. 411–425. 2005.
Egorova M., Ehret G. Tonotopy and inhibition in the midbrain inferior colliculus shape spectral resolution of sounds in critical bands. Eur. J. of Neurosci. 28: 675–692. 2008. https://doi.org/10.1111/j.1460-9568.2008.06376.x
Egorova M.A., Akimov A.G. Spectral coding in auditory midbrain neurons. J. of Integr. Neurosci. 12 (1): 1–15. 2013. https://doi.org/10.1142/S0219635213500027
Rhode W.S., Oertel D., Smith P.H. Physiological response properties of cells labeled intracellularly with horseradish peroxidase in cat ventral cochlear nucleus. J. Comp. Neurol. 213 (4): 448–463. 1983. https://doi.org/10.1002/cne.902130407
Golding N.L., Robertson D., Oertel D. Recordings from slices indicate that octopus cells of the cochlear nucleus detect coincident firing of auditory nerve fibers with temporal precision. J. Neurosci. 15 (4): 3138–3153. 1995. https://doi.org/10.1523/JNEUROSCI.15-04-03138.1995
Khorunzhii G.D., Egorova M.A. Time Characteristics of Impulse Activity of Neurons with the V-Shaped Frequency Receptive Fields in the House Mouse (Mus musculus) Auditory Midbrain. J. Evol. Biochem. Physiol. 50 (4): 357–361. 2014. https://doi.org/10.1134/S0022093014040097
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


