Журнал эволюционной биохимии и физиологии, 2020, T. 56, № 6, стр. 447-455
АKT-, ERK-, NF-KB-СИГНАЛЬНЫЕ КАСКАДЫ В НЕЙРОНАХ СУПРАОПТИЧЕСКОГО И ПАРАВЕНТРИКУЛЯРНОГО ЯДЕР ГИПОТАЛАМУСА ПРИ СТАРЕНИИ У МЫШЕЙ СО СВЕРХЭКСПРЕССИЕЙ HER2/NEU
Е. Д. Бажанова 1, 2, 3, *, Д. Л. Теплый 3, Л. К. Хужахметова 4, В. Н. Анисимов 5
1 Федеральное государственное бюджетное учреждение науки
“Институт токсикологии Федерального медико-биологического агентства” России
Санкт-Петербург, Россия
2 Федеральное государственное бюджетное учреждение науки
“Институт эволюционной физиологии и биохимии им. И.М. Сеченова”, Российской академии наук
Санкт-Петербург, Россия
3 Астраханский государственный университет
Астрахань, Россия
4 Федеральное государственное бюджетное образовательное учреждение высшего образования
Астраханский ГМУ Министерства здравоохранения России
Астрахань, Россия
5 Федеральное государственное бюджетное учреждение “Научно-исследовательский институт онкологии
имени Н.Н. Петрова” Министерства здравоохранения России
Санкт-Петербург, Россия
* E-mail: bazhanovae@mail.ru
Поступила в редакцию 19.05.2020
После доработки 29.06.2020
Принята к публикации 07.07.2020
Аннотация
Рецепторы семейства эпидермального фактора роста широко экспрессируются в различных тканях организма, в том числе в головном мозге, и играют большую роль в регуляции биологических процессов (пролиферация, миграция клеток, клеточная смерть и т.д.). Цель работы – изучить участие сигнальных путей, связанных с выживанием клеток (AKT-, ERK-, NF-kB-каскады), в регуляции апоптоза нейронов гипоталамуса в экспериментальных моделях физиологического и патологического (сверхэкспрессия HER2/neu) старения. Также исследовано влияние цитокинов FASL и TNF-alpha на данные сигнальные каскады. В работе использованы ускоренно стареющие HER2/neu трансгенные мыши, дикий тип – линия FVB/N. В супраоптическом и паравентрикулярном ядрах гипоталамуса определен уровень антиапоптотического белка survivin методом иммуногистохимии и экспрессия белков цитокинзависимых каскадов (FASL, TNF-alpha), белков-членов путей выживания: фосфорилированные формы AKT, ERK и NF-kВ методом Western blotting. Выявлено, что АКТ-, ЕRK-каскады не играют заметной роли при старении у FVB/N мышей, однако активация FAS-сигнального пути и снижение активности NF-kB-пути могут привести к увеличению доли гибнущих нейронов. При старении у мышей HER2/neu устойчивость нейронов к апоптозу обеспечивается сочетанием путей выживания – в супраоптическом ядре наблюдается активация ЕRK-пути, в паравентрикулярном – NF-kB- и АКТ-путей. Кроме того, выявлена супрессия FAS пути, что также приводит к низкому уровню апоптоза.
ВВЕДЕНИЕ
Как известно, апоптоз играет важную роль в развитии старения и многих заболеваний, связанных со старением. Старение мозга неизбежно связано с потерей нейронов, меньшей при физиологическом старении [1, 2] и значительно большей при нейродегенеративных заболеваниях [3, 4]. Соответственно, большое значение приобретает исследование процессов апоптоза, в том числе изучение про- и антиапоптотических сигнальных каскадов.
Сигнальные каскады PI3K/Akt (фосфатидилинозитол 3-киназа), ERK1/2 и NF-κB (IkappaB kinase (IKK)-ядерный фактор kappaB) – это пути выживания, их активация приводит к снижению апоптоза [5–7]. HER2 относится к семейству рецепторов эпидермального фактора роста (EGFR, epidermal growth factor receptor). Он широко экспрессируется в различных тканях организма, в том числе в головном мозге, и играет важную роль в регуляции биологических процессов (пролиферация, миграция клеток, клеточная смерть и т.д.). EGF/EGFR система активирует внутриклеточные киназные каскады, проводящие антиапоптотические сигналы (PI3K/Akt, ERK1/2, NF-κB) [5]. В настоящее время исследование патологического старения, а именно ускоренного старения, представляет большой интерес как для фундаментальной биологии, так и для практической медицины. В нашем исследовании моделью патологического старения были трансгенные мыши со сверхэкспрессией HER-2/neu. Сверхэкспрессия активированного HER-2/neu у трансгенной самки мышей FVB/N приводит к злокачественной трансформации эпителиальных клеток молочных желез с последующим развитием нескольких аденокарцином молочных желез [8]. Выявленная гиперинсулинемия, гипергликемия, снижение активности антиоксидантной системы и репродуктивной системы у трансгенных мышей HER-2/neu являются биомаркерами преждевременного старения [9]. Таким образом, трансген HER-2/neu не только инициирует малигнизацию эпителиальных клеток молочных желез, но также вызывает гормонально-метаболические изменения, характерные для ускоренного старения [9].
Очевидно, что при старении функционирование данных путей может изменяться, однако подобных работ в литературе немного. Мозг является органом с высокой степенью метаболизма, и необходимы отлаженные регуляторные механизмы для удовлетворения этой потребности в энергии. Как известно, гипоталамус является важным регуляторным органом, сочетающим нервный и эндокринный аспекты регуляции. Супраоптическое (СОЯ) и паравентрикулярное (ПВЯ) ядра гипоталамуса продуцируют вазопрессин и окситоцин, кроме других биологически активных веществ, нейромедиаторов и т.д. Эти ядра обеспечивают регуляцию множества биологических процессов, в первую очередь стрессорных ответов организма, адаптационных реакций. Клетки СОЯ, крупноклеточного ядра, регулируют водно-солевой баланс организма, а также имеются данные об участии этого центра в регуляции функции щитовидной железы [10]. ПВЯ является уникальным центром координации вегетативных функций организма. Клеточный состав ПВЯ неоднороден: оно состоит из крупных, средних и мелких клеток, объединяемых в группы на основании общности строения и цитофизиологии. ПВЯ связано с регуляцией стресс-реакции организма, адаптивных реакций, пищевого поведения, лактации, беременности, c тиреоидной функцией, показано участие этого нейросекреторного центра в углеводном обмене [10, 11]. Данные об изменении количества нейронов при старении в различных ядрах гипоталамуса противоречивы, так, не выявлено изменения числа нейронов ПВЯ с возрастом у крыс [12], мышей [13] и у человека [14], но обнаружено увеличение числа нейронов СОЯ и ПВЯ у самцов обезьян [15]. Другие авторы показали снижение количества активно функционирующих нейросекреторных клеток крупноклеточных ядер гипоталамуса (СОЯ, ПВЯ) старых (24 мес) крыс (в СОЯ на 25%, в ПВЯ на 21%) [16, 17]. Гипоталамические ядра вовлечены в патогенез болезни Альцгеймера и других нейродегенеративных заболеваний, однако изменения в гипоталамусе не так значительны по сравнению с потерей нейронов в коре головного мозга и мозжечка [18]. Очевидно, что изменения нейросекреторных центров, связанные со старением, будут влиять на множество функций организма. Таким образом, исследование инволюционных нарушений СОЯ и ПВЯ, в том числе механизмов апоптоза клеток этих ядер, является интересным и актуальным.
Поскольку сигнальные пути PI3K/Akt и AMPK в нейронах участвуют в регуляции клеточной энергии и метаболизма, изменение их приводит к различным заболеваниям [19]. Так, показано, что у мышей с D-galactose-индуцированным старением наблюдается снижение фосфорилирования PI3K и AKT, что приводит к потере нейронов гиппокампа. При этом активация с помощью изучаемых лекарственных трав PI3K/Akt-зависимого пути приводит к улучшению возрастзависимой когнитивной дисфункции и неврологического дефицита [20]. В экспериментах на крысах, получавших инъекции D-galactose, обнаружено значительное повреждение фосфорилирования PI3K/Akt в нейронах, что индуцирует апоптоз посредством митохондриального и внешнерецепторного путей (повышение экспрессии Fas, Fas ligand, Fas-associated death domain (FADD), t-Bid, Bax, cytochrome c, активированной caspase-8, -9, -3) [21]. TNF-alpha и FASL являются индукторами апоптоза. Связывание этих лигандов с их рецепторами вызывает агрегацию рецепторов и образование макромолекулярного комплекса DISC (death-inducing signaling complex), который, в зависимости от клеточного состояния, может привести к апоптозу [22]. В повышении уровня апоптоза нейронов при старении, показанном нами ранее [2, 17, 23], также может играть роль изменение экспрессии антиапоптотического белка survivin, члена семейства белков-ингибиторов апоптоза (inhibitors of apoptosis proteins, IAP). Survivin, мультифункциональный белок, участвует в контроле митоза, апоптоза и клеточного ответа на стресс. Этот белок активно экспрессируется в раннем онтогенезе, но у взрослых организмов уровень его в тканях низкий [24].
Нейровоспаление вовлечено в старение мозга и нейрональную гибель при болезни Альцгеймера [25]. Например, NF-κB p65 и ERK сигнальные пути задействованы в регуляции экспериментального нейровоспаления на модели нейрональной клеточной культуры SH-SY5Y при введении липополисахарида [25]. Провоспалительные цитокинзависимые пути играют важную роль в регуляции апоптоза при патологическом старении (сверхэкспрессия онкогена HER2) [17]. Показано значительное влияние сверхэкспрессии HER2/neu на механизмы регуляции гибели нейронов, приводящее к высокой резистентности клеток к возрастзависимому апоптозу, и активное участие TNF-сигнальных путей в данном процессе.
Использованная нами модель для изучения ускоренного старения – трансгенные мыши HER2/neu. Сверхэкспрессия данного онкогена обуславливает значительные изменения во внутриклеточных регуляторных механизмах, что находит выражение в повышенной выживаемости клеток и является базой для возможного онкогенеза. Однако почти нет данных об участии AKT-, ERK-, NF-kB-путей в регуляции клеточной гибели в процессе старения. В связи с этим целью работы было изучить участие сигнальных путей выживания (AKT-, ERK-, NF-kB-опосредованные каскады), в регуляции апоптоза нейросекреторных клеток гипоталамуса при физиологическом и патологическом (сверхэкспрессия онкогена HER2/neu) старении. Кроме того, исследовано влияние проапоптотического лиганда FASL и TNF-alpha, cпособного активировать пути как гибели, так и выживания клеток, на данные сигнальные каскады.
МАТЕРИАЛЫ И МЕТОДЫ
Для оценки влияния сверхэкспрессии гена HER2/neu использованы ускоренно стареющие HER2/neu трансгенные мыши-самки разного возраста (2, 10 мес), полученные из Italian National Research Center of Aging; разведение поддерживается в НИИ онкологии им. Петрова (Санкт-Петербург, Россия), дикий тип – линия FVB/N (2, 18 мес). Животные были разделены на группы: молодые мыши FVB/N (9 особей), старые мыши FVB/N (8 особей), молодые мыши HER2/neu (9 особей), старые мыши HER2/neu (8 особей), общее количество 34 мыши. Масса тела молодых животных – 18–22 г, старых животных – 30–35 г. Животные содержались в виварии в стандартных условиях в соответствии с требованиями ГОСТ 33216-2014 по 4‒5 особей в клетке на стандартном рационе при свободном доступе к воде и пище.
Под золетиловым наркозом (золетил 4 мг/кг массы) мыши были декапитированы. Всю работу с животными выполняли в соответствии с Национальным стандартом Российской Федерации ГОСТ Р-53434-2009 “Принципы надлежащей лабораторной практики”, Приказом Минздрава РФ от 01.04.16 г. № 199н “Об утверждении правил надлежащей лабораторной практики”, Протоколом Комиссии по биоэтике ИЭФБ РАН № 2/2019 от 20.02.2019. После стандартной фиксации в 4% формалине изготавливали свежезамороженные срезы (7 мкм) гипоталамической области мозга, содержащей СОЯ и ПВЯ. Проводили иммуногистохимическое определение антиапоптотического белка survivin (Anti-Survivin antibody [EPR17358] ab182132, 1:500, Abcam, США). В гипоталамических СОЯ и ПВЯ определен уровень экспрессии survivin с помощью светового микроскопа (20X) (Zeiss Axiolab, Carl Zeiss Inc., Германия) с последующей денситометрией (VideoTest).
В СОЯ и ПВЯ гипоталамуса оценивали экспрессию белков цитокинзависимых каскадов (FAS-, TNF-зависимых): FAS лиганд (FASL, CD178) Antibody (PA1-21019, 1 µg/mL, Thermo Fisher Scientific, USA) и TNF-alpha (ab9739, 0.1 µg/ml, Abcam, США), и белков-членов путей выживания: активные (фосфорилированные) формы AKT, ERK и NF-kВ (р-AKT (Thr308, 1:1000), р-ERK (Thr202/Tyr204, 1:1000), Cell Signaling, США), р‑NF-kВ (ab90532, 1:500, Abcam, США), (Western blotting). Ткани гомогенизировали в лизатном буфере, содержащем ингибиторы протеазы и фосфатазы (Sigma-Aldrich, St.Louis, MO, США). Белки из геля переносили на нитроцеллюлозную мембрану. Мембраны инкубировали в 3% обезжиренном молоке в Трис буфере (0.1% Твин 20, 0.2 мМ Трис, 137 мМ NaCl) в течение 30 мин, а затем инкубировали в течение ночи с первичными антителами. Затем мембраны инкубировали с вторичными антителами, кролик (1:8000; Sigma-Aldrich, США) или мышь (1:80 000; Sigma-Aldrich, США), с последующей усиленной хемилюминесцентной детекцией (Amersham, GE Healthcare, Little Chalfont, Buckinghamshire, UK), далее проводили денситометрию (ImageJ). Для контроля количества белка в пробах проводили Western blotting с антителами к GAPDH (glyceraldehyde-3-phosphate dehydrogenase, ab9485, 1:2000, Abcam, США).
С учетом малого количества единиц наблюдения для проверки гипотезы нормальности распределения использовали W-тест Шапиро–Уилка для малых выборок, который является наиболее эффективным, так как он обладает большей мощностью по сравнению с альтернативными критериями проверки нормальности. В связи с тем, что производится множественное сравнение, использовали тест Тьюки, так как распределение нормальное и групповые дисперсии однородны. Различия считали статистически значимыми при p < 0.05 (компьютерная программа Microsoft Office Excel 2007).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Старение связано с системным воспалением и клеточным апоптозом, индуцированным появляющимися физиологическими дисфункциями [26]. В настоящее время показано, что роль цитокинзависимого TNF-сигнального каскада в апоптозе неоднозначна – помимо индукции клеточной гибели с участием caspase-8, -3 [22], наблюдается антиапоптотическое действие TNF, связанное с активацией независимых путей выживания – NF-kВ, MAPK-EGFR пути [27, 28], либо PI3K-AKT пути [27].
Было исследовано участие лигандов – FAS Ligand (CD178, FasL) и TNF-alpha – в активации сигнальных путей, связанных с выживанием клеток (NF-KB-, AKT-, ERK-каскады), в регуляции апоптоза нейронов гипоталамуса у мышей дикого типа и ускоренно стареющих HER2/neu трансгенных мышей при старении. По данным литературы TRAIL, FASL (FAS Ligand), FAS, FADD являются проапоптотическими факторами, тогда как TNFR1 (TNF-receptor 1), TRADD также могут оказывать антиапоптотическое действие через пути выживания клеток - NF-kB- и р38-MAPK-EGFR пути [22].
Мыши дикого типа
У молодых мышей дикого типа уровень FASL в обоих изучаемых ядрах гипоталамуса невысок и увеличивается при старении в ПВЯ, содержание TNF-alpha не изменяется в СОЯ старых FVB/N мышей и снижается в ПВЯ (рис. 1). При этом в СОЯ и ПВЯ возрастают экспрессия FAS рецептора, адапторных белков FADD, TRADD, caspase-8, ‑3 и уровень апоптоза [17]. Ранее мы показали, что у мышей дикого типа апоптоз (метод TUNEL) при старении возрастает в СОЯ в 6.8 раза, а в ПВЯ в 9.4 раза [17]. Таким образом, в нейросекреторных клетках данных ядер гипоталамуса наблюдается возрастзависимая активация FAS-сигнального пути (табл. 1).
Рис. 1.
Экспрессия FASL и TNF-alpha в нейросекреторных клетках супраоптическом (СОЯ) и паравентрикулярном (ПВЯ) ядрах мышей FVB/N и HER2/neu (Western blotting). Ось ординат – оптическая плотность FASL (М ± m) и TNF-alpha в (М ± m) СОЯ и ПВЯ мышей FVB/N и HER2/neu. Здесь и далее: обозначения – м – молодые мыши, с – старые мыши. Оптическая плотность представлена в условных единицах. (*) – достоверность различий между показателями молодых и старых мышей одной линии (p ≤ 0.05), и (о) – значение различий между индексами старых мышей FVB/N и HER2/neu (p ≤ 0.05), молодых мышей FVB/N и HER2/neu (p ≤ 0.05). Молодые мыши FVB/N, n = 9, старые мыши FVB/N, n = 8, молодые мыши HER2/neu, n = 9, старые мыши HER2/neu, n = 8.
Fig. 1. Expression of FASL and TNF-alpha in neurosecretory cells of the supraoptic (SON) and paraventricular (PVN) nuclei in FVB/N and HER2/neu mice (Western blotting). Ordinate – optical density of FASL (M ± m) and TNF-alpha in (M ± m) in the SON and PVN of FVB/N and HER2/neu mice. Hereinafter: y – young mice, a – aged mice. Optical density is expressed in arbitrary units. * – significance of differences between indices of young vs. aged mice of the same line (p ≤ 0.05); о – significance of differences between indices of aged FVB/N vs. HER2/neu mice (p ≤ 0.05), young FVB/N vs. HER2/neu mice (p ≤ 0.05). Young FVB/N mice (n = 9), aged FVB/N mice (n = 8), young HER2/neu mice (n = 9), aged HER2/neu mice (n = 8).
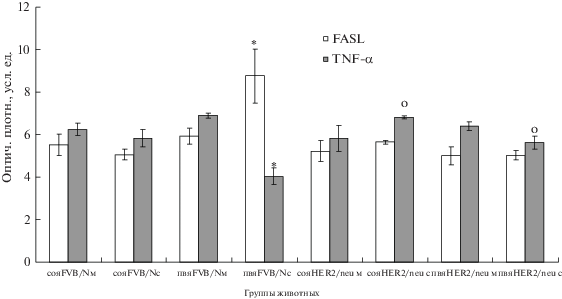
Таблица 1.
Изменения экспрессии изученных про- и антиапоптотических факторов при старении в нейронах СОЯ и ПВЯ у мышей FVB/N и HER2/neu Таble 1. Age-related changes in expression of the studied pro- and anti-apoptotic factors in neurons of the SON and PVN of FVB/N and HER2/neu mice
| Маркер/ Marker | Роль в механизмах апоптоза/ The role in apoptosis mechanisms | Изменения при старении у мышей линии/ Changes during aging in mouse line | |||
|---|---|---|---|---|---|
| FVB/N | HER2/neu | ||||
| СОЯ/SON | ПВЯ/PVN | СОЯ/SON | ПВЯ/PVN | ||
| FASL | Проапоптотический фактор/Proapoptotic factor | = | + | = | = |
| TNF-alpha | Может оказывать как про-, так и антиапоптотическое действие/May have both pro- and anti-apoptotic effects | = | – | = | = |
| p-NF-kB | Антиапоптотический фактор/Antiapoptotic factor | – | – | – | + |
| survivin | Антиапоптотический фактор/Antiapoptotic factor | – | – | + | + |
| р-ЕRK | Антиапоптотический фактор/Antiapoptotic factor | = | = | + | + |
| р-АКТ | Антиапоптотический фактор/Antiapoptotic factor | = | = | – | + |
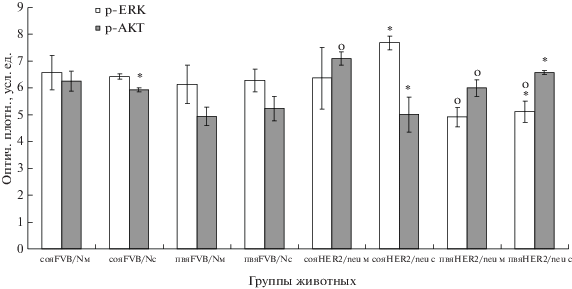
Уровень р-NF-kB в нейронах гипоталамуса мышей FVB/N на поздних этапах онтогенеза снижается как в СОЯ, так и в ПВЯ, и параллельно уменьшается экспрессия survivin, антиапоптотического белка (рис. 1, 2), являющегося одной из мишеней NF-kB-пути [29]. Это соотносится с повышением уровня апоптоза клеток [17]. Нет изменений в содержании фосфорилированных форм AKT и ERK (p-AKT, p-ERK) (рис. 3) Очевидно, что сигнальные каскады, связанные с выживанием (АКТ, ЕRK), не играют заметной роли в обоих нейроэндокринных центрах при старении у FVB/N мышей, а пониженная активность NF-kB может привести к возрастанию клеточной гибели нейросекреторных клеток гипоталамуса старых мышей (рис. 1–3), [17] (табл. 1).
Рис. 2.
Экспрессия р-NF-kB (Western blotting) и survivin (иммуногистохимия) в нейросекреторных клетках СОЯ и ПВЯ мышей FVB/N и HER2/neu. Левая ось ординат – экспрессия р-NF-kB (оптическая плотность) (М ± m) в СОЯ и ПВЯ мышей FVB/N и HER2/neu. Правая ось ординат – экспрессия survivin (оптическая плотность) (М ± m) в СОЯ и ПВЯ мышей FVB/N и HER2/neu.
Fig. 2. Expression of p-NF-kB (Western blotting) and survivin (immunohistochemistry) in neurosecretory cells in the SON and PVN of FVB/N and HER2/neu mice. Left ordinate – p-NF-kB expression (optical density) (M ± m) in the SON and PVN of FVB/N and HER2/neu mice. Right ordinate – survivin expression (optical density) (M ± m) in the SON and PVN of FVB/N and HER2/neu mice.
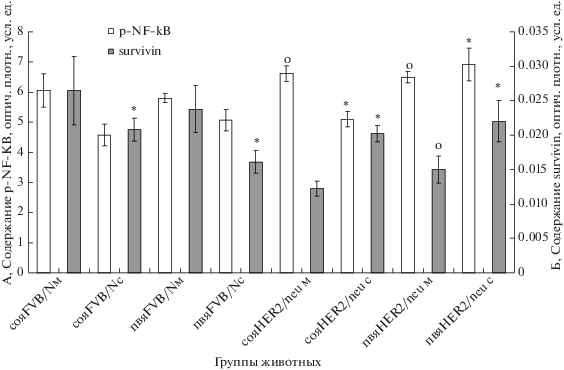
Рис. 3.
Экспрессия р-ЕRK и р-АКТ в нейросекреторных клетках СОЯ и ПВЯ мышей FVB/N и HER2/neu (Western blotting). Ось ординат – оптическая плотность р-ЕRK (М ± m) и р-АКТ (М ± m) в СОЯ и ПВЯ мышей FVB/N и HER2/neu.
Fig. 3. Expression of p-ERK and p-AKT in neurosecretory cells of the SON and PVN in FVB/N and HER2/neu mice (Western blotting). Ordinate – optical density of p-ERK (M ± m) and p-AKT (M ± m) in the SON and PVN of FVB/N and HER2/neu mice.
Трансгенные мыши
У молодых трансгенных животных уровень апоптоза (метод TUNEL) в СОЯ и ПВЯ невысокий и не отличается от данного показателя у мышей дикого типа, при этом нет отличий между изучаемыми нейросекреторными центрами [17]. У мышей этой линии не изменяется уровень FASL в нейросекреторных клетках СОЯ и ПВЯ гипоталамуса при старении, и содержание данного лиганда в ПВЯ старых HER2/neu мышей ниже, чем у мышей дикого типа (рис. 1). Синтез рецептора FAS в изучаемых центрах у старых HER2/neu мышей ниже по сравнению с диким типом, экспрессия FADD не изменяется [17]. Таким образом, при патологическом старении (у HER2/neu мышей) наблюдается супрессия FAS пути в гипоталамусе (СОЯ и ПВЯ) (рис. 1), что приводит к низкому уровню апоптоза у старых HER2/neu мышей [17]. Доля гибнущих клеток в СОЯ и ПВЯ гипоталамуса у мышей этой линии не отличается от уровня данного показателя у молодых мышей и значительно ниже (в СОЯ в 5 раз, в ПВЯ – в 2.5 раза), чем у старых мышей FVB/N [17] (табл. 1).
У старых трансгенных животных уровень TNF-alpha в обоих изученных гипоталамических ядрах выше, чем у мышей дикого типа (рис. 1). Связывание TNF-α с TNF-RI индуцирует образование мембраносвязанного комплекса, состоящего из множества молекул, в том числе TRAF-2, TRADD, IAP и IKKs, который в основном запускает активацию NF-κB и обеспечивает выживание клеток посредством регуляции транскрипции ингибитора caspase-8 c-FLIP [22]. Мы показали, что содержание р-NF-kB у трансгенных мышей при старении снижается в СОЯ и увеличивается в ПВЯ, при этом экспрессия данного фактора больше, чем у мышей дикого типа (рис. 2). IAP, входящие в состав этого комплекса – ингибиторы апоптотических протеинов (в том числе survivin), являются триггерами NF-kB-каскада [22]. Выявлено повышение экспрессии survivin в нейросекреторных клетках изученных ядер гипоталамуса у мышей HER2/neu при старении, можно соотнести данное увеличение экспрессии с высоким, по сравнению с данным показателем у старых мышей дикого типа, содержанием TNF-alpha у трансгенных мышей (рис. 2, табл. 1).
Показано, что TNF-α способен индуцировать фосфорилирование AKT [27] и ERK-сигнального пути, зависящего также от уровня экспрессии ростовых факторов и их рецепторов (EGF/EGFR) [30]. В наших экспериментах в нейронах гипоталамуса HER2/neu мышей при старении уровень р-ЕRK возрастает в СОЯ, превышая аналогичный показатель у старых мышей дикого типа, без изменений в ПВЯ (рис. 3, табл. 1).
Содержание р-АКТ у HER2/neu мышей выше уровня данного белка во всех группах мышей дикого типа, за исключением СОЯ старых трансгенных мышей (рис. 3). Вероятно, повышенная экспрессия TRADD, не меняющаяся в онтогенезе у мышей HER2/neu [17], участвует в активации NF-kВ, ERK и AKT путей выживания, т.е. TNF-зависимый путь при сверхэкспрессии HER2/neu играет важную роль в обеспечении устойчивости клеток к апоптозу. Это подтверждается данными других авторов, показано, что EGF/EGFR система, к которой относится и HER2, приводит к активации внутриклеточных киназных антиапоптотических каскадов, таких как PI3K/AKT и NF-kB [5]. Возможно, ERK и AKT сигнальные пути предупреждают DISC-опосредованное проапоптотическое расщепление каспаз [28]. Подобный механизм существует в эпителиальных нетрансформированных клетках молочной железы, когда ингибирование EGFR-сигнального пути вызывает up-регуляцию ингибитора caspase-8 FLICE-ингибирующего белка (FLIP(L)) и делает клетки более чувствительными к TRAIL (tumor necrosis factor-related apoptosis-inducing ligand)-индуцированному апоптозу. При этом важную роль играет ERK-каскад [31].
Таким образом, резистентность клеток к апоптозу при старении у трансгенных мышей со cверхэкспрессией HER2 обеспечивается не одним фактором, а сочетанием различных путей выживания – в СОЯ старых HER2/neu животных повышается содержание р-ЕRK, в ПВЯ – увеличивается уровень р-NF-kB и р-АКТ (рис. 2, 3, табл. 1).
ЗАКЛЮЧЕНИЕ
Таким образом, у старых мышей дикого типа в нейронах СОЯ и ПВЯ гипоталамуса наблюдается возрастзависимая активация FAS-сигнального пути апоптоза. Показано, что АКТ-, ЕRK-сигнальные каскады, связанные с выживанием, не играют заметной роли при старении в СОЯ и ПВЯ FVB/N мышей, однако снижение активности NF-kB-пути (уменьшение уровня р-NF-kB и экспрессии survivin) может привести к возрастанию апоптоза нейросекреторных клеток гипоталамуса старых мышей дикого типа.
У старых мышей HER2/neu устойчивость клеток гипоталамуса к апоптозу обеспечивается сочетанием различных путей выживания – в СОЯ наблюдается активация ЕRK-пути, в ПВЯ – NF-kB- и АКТ-путей. Предполагается, что в активации данных путей играет роль повышенная экспрессия TRADD. Кроме того, при патологическом старении (сверхэкспрессия HER2/neu) наблюдается супрессия FAS пути, что также приводит к низкому уровню апоптоза в СОЯ и ПВЯ.
Список литературы
Yu Y., Feng L., Li J., Lan X., A L., Lv X., Zhang M., Chen L. The alteration of autophagy and apoptosis in the hippocampus of rats with natural aging-dependent cognitive deficits. Behav. Brain Res. 334: 155–162. 2017. https://doi.org/10.1016/j.bbr.2017.07.003
Bazhanova E.D., Teply D.L. The apoptosis regulation mechanisms in hypothalamic neurons in physiological and pathological (overexpression of oncogene HER-2/neu) aging. The chapter in the book “Hypothalamus in Health and Diseases”, InTech, Rijeka, Croatia. 99–131. 2018. https://doi.org/10.5772 / intechopen.72694
Dulamea A.O. Role of Oligodendrocyte Dysfunction in Demyelination, Remyelination and Neurodegeneration in Multiple Sclerosis. Adv. Exp. Med. Biol. 958: 91–127. 2017. https://doi.org/10.1007/978-3-319-47861-6_7
Рева И.В., Ямамото Т.Т., Одинцова И.А., Мартыненко С.Г., Тоторкулов Р.И., Николаенко Г.А., Лемешко Т.Н., Индык М.В., Шмелёв М.Е., Вершинина С.С., Балдаев С.Н., Альбрандт К.Ф., Рева Г.В. Апоптоз и его роль в нарушении функций нейронов. Современные проблемы науки и образования. 6: 1–24. 2016. https://doi.org/10.17513/spno.25497
Lisi S., Sisto M., Ribatti D., D’Amore M., De Lucro R., Frassanito M.A., Lorusso L., Vacca A., Lofrumento D.D. Chronic inflammation enhances NGF-β/TrkA system expression via EGFR/MEK/ERK pathway activation in Sjögren’s syndrome. J. Molec. Med. 92: 523–537. 2014. https://doi.org/10.1007/s00109-014-1130-9
Tao H., Cheng L., Yang R. Downregulation of miR-34a Promotes Proliferation and Inhibits Apoptosis of Rat Osteoarthritic Cartilage Cells by Activating PI3K/Akt Pathway. Clin. Interv. Aging. 15: 373–385. 2020. https://doi.org/10.2147/CIA.S241855
Zhang Y., Liu X., Zhang J., Xu Y., Shao J., Hu Y., Shu P., Cheng H. Inhibition of miR-19a partially reversed the resistance of colorectal cancer to oxaliplatin via PTEN/PI3K/AKT pathway. Aging (Albany NY). 12 (7): 5640–5650. 2020. https://doi.org/10.18632/aging.102929
Muller W.J., Ho J., Siegel P.M. Oncogenic activation of Neu/ErbB-2 in a transgenic mouse model for breast cancer. Biochem. Soc. Symp. 63: 149–157. 1998.
Panchenko A.V., Popovich I.G., Trashkov A.P., Egormin P.A., Yurova M.N., Tyndyk M.L., Gubare-va E.A., Artyukin I.N., Vasiliev A.G., Khaitsev N.V., Zabezhinski M.A., Anisimov V.N. Biomarkers of aging, life span and spontaneous carcinogenesis in the wild type and HER-2 transgenic FVB/N female mice. Biogerontology. 17 (2): 317–324. 2016.
Поленов А.Л. Морфофункциональная организация нейросекреторных клеток гипоталамуса / в кн. Нейроэндокринология. Под ред. Поленова А.Л. СПб.: РАН, 1993. Ч. 1. С. 31–70. 398 с. [Polenov A.L. Morfofunkcional’naya organizaciya nejrosekretornyh kletok gipotalamusa / v kn. Nejroendokrinologiya. Pod red. Polenova A.L. SPb.: RAN, 1993. V. 1. 31–70. (In Russ)].
Поленов А.Л., Константинова М.С., Гарлов П.Е. Гипоталамо-гипофизарный нейроэндокринный комплекс / в кн. Нейроэндокринология. Под ред. Поленова А.Л. СПб.: РАН, 1993. Ч. 1. С. 139–187. 398 с. [Polenov A.L., Konstantinova M.S., Garlov P.E. Gipotalamo-gipofizarnyj nejroendokrinnyj kompleks / v kn. Nejroendokrinologiya. Pod red. Polenova A.L. SPb.: RAN, 1993. Ch. 1. S. 139–187. (In Russ)].
Sartin J.L., Lamperti A.A. Neuron numbers in hypothalamic nuclei of young, middle-aged and aged male rats. Experientia. 41: 109–111. 1985.
Sturrock R.R. Stability of neuron number in the ageing mouse paraventricular nucleus. Ann. Anat. 174: 337–340. 1992.
Goudsmit E., Hofman M.A., Fliers E., Swaab D.F. The supraoptic and paraventricular nuclei of the human hypothalamus in relation to sex, age and Alzheimer’s disease. Neurobiol. Aging. 11: 529–536. 1990.
Roberts D.E., Killiany R.J., Rosene D.L. Neuron Numbers in the Hypothalamus of the Normal Aging Rhesus Monkey: Stability Across the Adult Lifespan and Between the Sexes. J. Comp. Neurol. 520 (6): 1181–1197. 2012. https://doi.org/10.1002/cne.22761
Hsu H.K., Peng M.-T. Hypothalamic neuron number of the old female rats // Gerontology. 24: 434–440. 1978.
Бажанова Е.Д., Анисимов В.Н. Участие FAS- и TNF-зависимых путей в механизмах апоптоза в гипоталамусе при физиологическом и патологическом старении. Успехи геронтологии. 33 (1): 34–39. 2020. [Bazhanova E.D., Anisimov V.N. FAS- and TNF-dependent ways participation in apoptosis mechanisms in hypothalamus in physiological and pathological aging. Adv. Geront. 33 (1): 34–39. 2020. (In Russ)].
Baloyannis S.J., Mavroudis I., Mitilineos D., Baloyannis I.S., Costa V.G. The Hypothalamus in Alzheimer’s Disease: A Golgi and Electron Microscope Study. Am. J. Alzheimers Dis. Other Demen. 30 (5): 478–487. 2015. https://doi.org/10.1177/1533317514556876
Dhani S., Ghazi T., Nagiah S., Baijnath S., Singh S.D., Chuturgoon A.A. Fusaric acid alters Akt and ampk signalling in c57bl/6 mice brain tissue. FoodChem. Toxicol. 138: 111252. 2020. https://doi.org/10.1016/j.fct.2020.111252
Zhao M., Tang X., Gong D., Xia P., Wang F., Xu S. Bungeanum Improves Cognitive Dysfunction and Neurological Deficits in D-Galactose-Induced Aging Mice via Activating PI3K/Akt/Nrf2 Signaling Pathway. FrontPharmacol. 11: 71. 2020. https://doi.org/10.3389/fphar.2020.00071
Chen H.I., Ou H.C., Chen C.Y., Yu S.H., Cheng S.M., Wu X.B., Lee S.D. Neuroprotective Effect of Rhodiola crenulata in D-Galactose-Induced Aging Model. Am. J. Chin. Med. 5: 1–18. 2020. .https://doi.org/10.1142/S0192415X20500196
Micheau O., Shirley S., Dufour F. Death receptors as targets in cancer. Brit. J. Pharmacol. 169: 1723–1744. 2013. https://doi.org/10.1111/bph.12238
Хужахметова Л.К., Теплый Д.Л., Бажанова Е.Д. Фармакологическая коррекция изменений уровня апоптоза нейронов супрахиазматического ядра гипоталамуса и пинеалоцитов у крыс при старении и стрессе. Успехи геронтологии. 32 (6): 915–922. 2019. [Khuzhakhmetova L.K., Teply D.L., Bazhanova E.D. Pharmacological correction of alterations of apoptosis of the neurons of the hypothalamus supraciasmatic nucleus and pinealocytes during aging and stress. Adv. Geront. 2019. 32 (6): 915–922. (In Russ.)].
McKenzie J.A., Grossman D. Role of the Apoptotic and Mitotic Regulator Survivin in Melanoma. Anticancer Research. 32: 397–404. 2012.
Liu Y., Fu Y., Zhang Y., Rose G.M., He X., Yi X., Ren R., Li Y., Zhang Y., Wu H., Lv C., Zhang H. Butein attenuates the cytotoxic effects of LPS-stimulated microglia on the SH-SY5Y neuronal cell line. Eur. J. Pharmacol. 868: 172858. 2020. https://doi.org/10.1016/j.ejphar.2019.172858
Kangas R., Törmäkangas T., Heinonen A., Alen M., Suominen H., Kovanen V., Laakkonen E.K., Korhonen M.T. Declining Physical Performance Associates with Serum FasL, miR-21, and miR-146a in Aging. Sprinters Biomed. Res. Int. 2017: 8468469. 2017. https://doi.org/10.1155/2017/8468469
Lee C.-W., Lin C.-C., Lin W.-N., Liang K.-C., Luo S.-F., Wu C.-B., Wang S.-W., Yang C.-M. TNF-induces MMP-9 expression via activation of Src/EGFR, PDGFR/PI3K/Akt cascade and promotion of NF-B/p300 binding in human tracheal smooth muscle cells. Amer. J. Physiol. Lung Cell. molec. Physiol. 292: L799–L812. 2007. https://doi.org/10.1152/ajplung.00311.2006
Nishimura M., Shin M.-S., Singhirunnusorn P., Suzuki S., Kawanishi M., Koizumi K., Saiki I., Sakurai H. TAK1-Mediated Serine/Threonine Phosphorylation of Epidermal Growth Factor Receptor via p38/Extracellular Signal-Regulated Kinase: NF-B-Independent Survival Pathways in Tumor Necrosis Factor Alpha Signaling. Molec. Cell. Biol. 29 (20): 5529–5539. 2009. https://doi.org/10.1128/MCB.00375-09
Subramanian C., Grogan P.T., Opipari V.P., Timmermann B.N., Cohen M.S. Novel natural withanolides induce apoptosis and inhibit migration of neuroblastoma cells through down regulation of N-myc and suppression of Akt/mTOR/NF-κB activation. Oncotarget. 9 (18): 14509–14523. 2018. https://doi.org/10.18632/oncotarget.24429
Segawa R., Shigeeda K., Hatayama T., Dong J., Mizuno N., Moriya T., Hiratsuka M., Hirasawa N. EGFR transactivation is involved in TNF-α-induced expression of thymic stromal lymphopoietin in human keratinocyte cell line. J. Dermatol. Sci. 89 (3): 290–298. 2018. https://doi.org/10.1016/j.jdermsci.2017.12.008
Yerbes R., López-Rivas A., Reginato M.J., Palacios C. Control of FLIPL expression and TRAIL resistance by the extracellular signal-regulated kinase1/2 pathway in breast epithelial cells. CellDeathDiffer. 19 (12): 1908–1916. 2012. https://doi.org/10.1038/cdd.2012.78
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


