Журнал эволюционной биохимии и физиологии, 2020, T. 56, № 6, стр. 413-429
ПРЕНАТАЛЬНЫЙ СТРЕСС КАК ФАКТОР РАЗВИТИЯ АДДИКТИВНЫХ СОСТОЯНИЙ
В. А. Стратилов 1, *, Е. И. Тюлькова 1, О. В. Ветровой 1, 2
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: stratilov.v@icloud.com
Поступила в редакцию 08.06.2020
После доработки 11.07.2020
Принята к публикации 12.07.2020
Аннотация
В настоящее время вопрос о роли ненаследственных факторов в формировании аддиктивных состояний вызывает большой интерес. В обзоре проанализированы результаты клинических и фундаментальных исследований молекулярно-клеточных основ аддикций, вызванных стрессорными воздействиями во время эмбрионального развития. Рассмотрены современные представления о неблагоприятном влиянии стрессорного ответа матери во время беременности на развитие медиаторных систем мозга плода, их дальнейшее функционирование и взаимодействие в постнатальном онтогенезе. Основное внимание уделено значимости взаимодействий между дофамин- и глутаматергической системами структур, обеспечивающих функционирование механизмов внутреннего подкрепления, роли глюкокортикоидов в настройке этих взаимодействий и последствиям неадекватной глюкокортикоидной стимуляции в период развития мозга для дальнейшего формирования аддиктивных патологий, таких как алкогольная и никотиновая зависимости.
ВВЕДЕНИЕ
Аддикции, или зависимости – это навязчивая патологическая потребность у субъекта в определенной деятельности, влекущей за собой срабатывание системы “вознаграждения” и “ожидания вознаграждения” [1] в мозге, преимущественно связанной с дофаминергическими структурами. Предполагается, что к развитию аддикций приводят снижение чувствительности системы “вознаграждения” к естественным стимулам, нарушение “контроля”, или, напротив, увеличение активности систем “эмоциональной памяти и подкрепления”, “мотивации к действию” [2].
Основная проблема нейробиологии аддикций заключается в отсутствии понимания причин широкой вариабельности индивидуальной предрасположенности к зависимостям [3, 4]. Накоплен существенный массив информации о наследственных факторах риска развития аддикций [5, 6], однако до сих пор не сформирована цельная картина представлений о влиянии факторов внешней среды, особенно в период перинатального онтогенеза, на эффективность функционирования системы “ознаграждения”. Клинические данные и результаты экспериментальных исследований на животных показывают влияние стресса матери, сопровождающегося выбросом эндогенных глюкокортикоидных гормонов, или введения их синтетических аналогов на дальнейшее физическое [7–10] и когнитивное развитие потомства, возникновение сердечно-сосудистых патологий [11, 12], ухудшение способности к обучению [13] и формирование ряда нейродегенеративных заболеваний и психоэмоциональных расстройств [14, 15].
Настоящая работа направлена на обобщение и концептуальный анализ данных о вовлечении стрессорных воздействий в перинатальном периоде в формирование аддиктивных патологий. Основное внимание уделено роли глюкокортикоидных стрессорных гормонов в нормальном и патологическом созревании и дальнейшем взаимодействии дофаминергической и глутаматергической медиаторных систем, определяющих эффективность работы систем внутреннего подкрепления. Широко рассматривается влияние пренатального стресса на склонность к таким социально-значимым аддиктивным расстройствам, как наркотическая, алкогольная и никотиновая зависимости.
РОЛЬ ГЛЮКОКОРТИКОИДНОЙ СИСТЕМЫ В ФОРМИРОВАНИИ АДДИКТИВНЫХ СОСТОЯНИЙ
Во взрослом организме существует явная зависимость между стрессом и развитием аддикций. Стрессорная реакция опосредуется многими факторами, ключевая роль среди которых принадлежит глюкокортикоидным гормонам. Глюкокортикоиды оказывают свое влияние путем связывания с глюкокортикоидными и минералокортикоидными рецепторами (GR и MR соответственно), функционирующими как транскрипционные факторы, регулирующие экспрессию большого числа генов, а также опосредующими быстрые негеномные эффекты в некоторых областях мозга [16, 17]. Помимо обеспечения стрессорной реакции, глюкокортикоидам отводится центральная роль в поддержании метаболизма, регуляции иммунной системы и регенеративного потенциала взрослого организма, а также в правильном развитии плода. Кроме того, глюкокортикоиды стимулируют выброс нейропептидов, таких как динорфин, энкефалин, тахикинин, кортиколиберин и нейротензин, особенно в области базальных ганглиев и прилежащего ядра [18, 19].
В эмбриогенезе GR экспрессируются в большинстве тканей, в фетальной и материнской частях плаценты. Участвуя в процессах органогенеза и гистогенеза, GR необходимы с самого начала эмбрионального развития. Для человека и грызунов показано, что изменения внутренней среды на ранних стадиях развития имеют решающее значение для программирования тканеспецифических паттернов экспрессии GR [20–27]. Для мозга, в частности, нормальная стимуляция GR критична для созревания дофаминергической системы, в особенности в мезолимбичеких участках [28].
Важнейшая роль глюкокортикоидной системы матери в нормальном созревании плода предопределяет тяжесть последствий изменения ее функционирования в патогенезе пренатального стресса. Глюкокортикоиды влияют на уязвимость мозга плода и новорожденного к гипоксии–ишемии, однако результаты противоречивы и зависят от экспериментального протокола [29–32]. Модификации уровня глюкокортикоидов в течение пренатального периода приводят к перепрограммированию развития мозга и влияют на созревание механизмов нейропластичности [33, 34], что отражается в поведении и способности к обучению в дальнейшей жизни [35]. В контексте современного общества такое перепрограммирование зачастую оказывает негативное влияние на дальнейшую жизнь человека, пережившего пренатальный стресс. Подавляющее большинство исследований рассматривает исключительно негативный аспект повышенного уровня глюкокортикоидов в пренатальном периоде, но также появляются работы, акцентирующие внимание на возможной физиологической стороне данного явления. В частности, эволюционно оно могло играть важную роль в подготовке особей к выживанию в суровых условиях, вероятно путем ускоренного раннего постнатального развития мозга, тем самым повышая шансы на репродукцию [36–38].
Изучение анамнеза эмоционально нестабильных детей показывает, что их матери чаще переживали хронический эмоциональный стресс в течение беременности по сравнению с матерями эмоционально стабильных детей [39]. Дети, рожденные от матерей, переживших стресс во время беременности, имеют проблемы с темпераментом и поведением в будущем [40], а также проблемы с концентрацией внимания в возрасте 7 лет [41]. Некоторые авторы ассоциируют повышенные уровни глюкокортикоидов в пренатальном периоде с последующим развитием аутизма, синдромом дефицита внимания, гиперактивностью и другими патологиями, непосредственно связанными с изменениями в дофаминергической системе [14]. При изучении анамнеза пациентов также выявлено, что тяжелые психоэмоциональные травмы матери в первый триместр беременности ассоциированы с повышенным риском развития шизофрении [15]. Дети, матери которых пережили сильный стресс во время беременности, в возрасте 6 месяцев, 5 и даже 10 лет демонстрируют повышенную активность гипоталамо-гипофизарно андренокортикальной системы (HPA) [40]. Устойчивая гиперактивация HPA и нарушения ее регуляции в детском возрасте вносят значительный вклад в развитие предрасположенности к аффективным расстройствам в течение всей последующей жизни. В модельных экспериментах на крысах показана тесная взаимосвязь между нарушением глюкокортикоидного гомеостаза матери и развитием поведенческих отклонений в постнатальном периоде у потомства. У грызунов усиливается тревожность [42–44] и нередко появляется ангедония [45, 46]. Пренатальный стресс вызывает изменение активности дофаминергических нейронов в VTA, что в электрофизиологических исследованиях проявляется в их гипервозбудимости у мышей [47]. Потомство стрессированных на последней неделе беременности крыс демонстрирует повышенную склонность к самоинъецированию большими дозами амфетамина по сравнению с контролем [48], а также проявляют большую склонность к потреблению морфина [49] и кокаина [50].
В регуляции взаимодействия между глюкокортикоидной системой матери и плода значительную роль играют катехоламины – адреналин и норадреналин. Катехоламины проходят через гематоплацентарный барьер, попутно связываясь с рецепторами в тканях самой плаценты [51]. В исследованиях на трофобластах человека было показано, что норадреналин и адреналин вызывают быстрое уменьшение транскрипции HSD2 (Hydroxysteroid dehydrogenase 2) – фермента, катализирующего быструю инактивацию глюкокортикоидов [52]. HSD2 играет большую роль в раннем пренатальном периоде, предохраняя плод от воздействия 80–90% материнских глюкокортикоидов [53, 54]. Однако к поздним срокам гестации экспрессия гена HSD2 уменьшается [55], что повышает влияние глюкокортикоидной системы матери на плод. То есть плод наиболее чувствителен к стрессу матери на поздних сроках пренатального развития. Однако при сильных повторяющихся стрессах, которые вызывают длительный выброс катехоламинов, глюкокортикоиды могут оказывать свое влияние и на более ранних сроках эмбриогенеза.
HSD2 не влияет на синтетические глюкокортикоиды, в связи с чем они беспрепятственно проходят через гематоплацентарный барьер на всех сроках пренатального развития. Кроме того, в in vitro исследованиях было показано, что дексаметазон вызывает увеличение транскрипции HSD2 [56], что на поздних сроках теоретически может приводить к разобщению между глюкокортикоидной системой матери и плода.
Сведения относительно того, на каких сроках беременности человека повышенный уровень глюкокортикоидов в крови матери оказывает наибольшее негативное влияние на развитие дофаминергической системы, противоречивы. В экспериментах на грызунах наибольший неблагоприятный эффект на развитие дофаминергической системы, в частности ведущий к формированию аддиктивных состояний, вызывают стрессорные воздействия на последней неделе гестации, что, впрочем, может быть связано не только с прямым действием глюкокортикоидов на дофаминергическую систему, но и на другие нейрохимические системы, взаимосвязанные с ней. Среди наиболее изученных стоит выделить глутаматергическую медиаторную систему и систему нейрогормона HPA кортиколиберина.
Немаловажным является тот факт, что пренатальный стресс оказывает влияние на развитие иммунной системы потомства [57]. Несмотря на противоречивость результатов, полученных с использованием парадигмы пренатального стресса, в целом можно считать, что стресс матери ослабляет пролиферацию лимфоцитов и активность макрофагов, снижает общий уровень провоспалительных цитокинов у потомства во взрослом периоде [58]. Вторым важным моментом является то, что глюкокортикоиды оказывают системное супрессирующие действие на иммунную систему матери, снижая активность транспорта материнских иммуноглобулинов через плаценту [58], но повышая уровень провоспалительных цитокинов. У человека во время беременности в ответ на стресс повышается уровень TNF-α и IL-10, но снижается уровень IL-6 [59], что предположительно может оказывать влияние на развитие плода. Наличие взаимосвязи между иммунным ответом матери и развитием мозга плода было обнаружено в экспериментах с введением вирусных антигенов беременным самкам крыс. Усиленный иммунный ответ матери вызывал у потомства увеличение количества дофаминергических нейронов и их раннее пренатальное созревание [60], что указывает на роль иммунной системы матери в развитии дофаминергической системы мозга плода. Ввиду того, что до сих пор не ясно, какой из компонентов материнского иммунитета может оказывать влияние на развитие дофаминергических нейронов потомства и как с этим может быть связан стресс матери, данный вопрос требует дальнейшего изучения.
ФОРМИРОВАНИЕ И СОЗРЕВАНИЕ ДОФАМИНЕРГИЧЕСКОЙ СИСТЕМЫ МОЗГА
Первые исследования дофамина (DA) как нейромедиатора начались более полувека назад с изучения болезни Паркинсона. В современном представлении DA система, обеспечивая такие функции центральной нервной системы, как концентрация внимания, и являясь основой психической пластичности, выполняет роль регулятора “тонкой настройки” работы головного мозга.
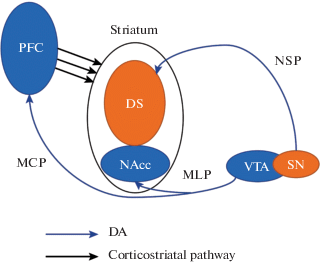
DA нейроны располагаются в основном в черной субстанции (SN) и вентральной тегментальной области (VTA), проецируясь на различные структуры мозга и тем самым образуя сложную нейромодуляторную систему, необходимую для многочисленных двигательных, когнитивных и мотивационных процессов. Так, DA нейроны из VTA проецируют эфферентные пути в вентральный стриатум и префронтальную кору и образуют соответственно мезостриатный и мезокортикальный DA пути [61, 62]. Именуемые вместе как мезокортиколимбический путь, они отвечают за чувство удовольствия (рис. 1) [63, 64].
Рис. 1.
Упрощенная схема проекций дофаминергических нейронов среднего мозга. Мезокортикальный (MCP) и мезолимбический пути показаны стрелкой от VTA к коре и прилежащему ядру (NAcc). Нейроны этого пути являются ключевым звеном системы “вознаграждения” мозга, выполняют функцию оценки внешнего события (Value signals/Valience), определения его значимости среди других внешних событий (Salience signaling/Salience), а также обеспечивают работу паттерна “Ошибка предсказания” (Prediction error). Нигростриатный путь (NSP), идущий к дорсальному стриатуму (DS) от ядра черной субстанции (SNc), участвует в реализации произвольных движений. Кортикостриатный путь показан стрелками от коры к стриатуму.
Fig. 1. A simplified diagram of midbrain dopamine neuronal projections. The mesocortical (MCP) and mesolimbic pathways are indicated (arrow) traveling from the VTA to the cortex and the adjacent nucleus accumbens (NAcc). Neurons of this pathway are a key element of the brain “reward” system; they perform the external event evaluation function (Value signals/Valience), determining the significance of the given event among the other external events (Salience signaling / Salience), and also ensure the operation of the Prediction Error pattern. The nigrostriatal pathway (NSP) traveling to the dorsal striatum (DS) from the substantia nigra (SNc) is involved in the implementation of voluntary movements. The corticostriatal pathway is indicated traveling from the cortex to the striatum (arrows).
В литературе широко рассматриваются такие функции DA системы, как механизм “ошибки предсказания” (Prediction error), оценка внешнего события как положительного или отрицательного (Valience signaling), определение его значимости среди других внешних событий (Salience signaling) [65, 66]. Так как DA система играет важную роль в оценке результата обучения, изменения, возникающие в нейронах данной системы, потенциально могут приводить к ментальным девиациям, от аддиктивных расстройств до шизофрении [67, 68].
Стандартным способом выявления зрелых DA нейронов признана иммуногистохимическая двойная визуализация фермента биосинтеза DA тирозингидроксилазы (TH) и дофаминового транспортера (DAT), участвующего в процессе обратного захвата DA [69].
Основные исследования клеток-предшественников DA нейронов проводились относительно недавно после открытия ряда транскрипционных факторов, характерных для прогениторных DA клеток. При выявлении клеток-предшественников DA нейронов ключевыми маркерами являются транскрипционные факторы PITX3 (Pituitary homeobox 3), LMX1b (LIM homeobox transcription factor 1-beta), OTX2 (Orthodenticle homeobox 2) и NURR1 (Nuclear receptor related 1) [70]. Клетки-предшественники DA нейронов локализуются на вентральной срединной линии нервной трубки [71]. В период раннего пренатального развития граница среднего мозга определяется сигналами истмического организатора, участка, который развивается на стыке среднего и заднего мозга и регулирует дифференцировку соседних нейронов путем выделения сигнальных молекул [72, 73].
У крыс DA нейроны зарождаются на 10-е сутки пренатального развития на вентральной средней линии базальной пластинки [71, 74]. Именно к этому сроку клетки-предшественники начинают экспрессировать транскрипционный фактор NURR1, который регулирует транскрипцию генов th и dat [75, 76]. Экспрессия NURR1 продолжается и в постнатальном онтогенезе, что делает данный белок универсальным маркером DA нейронов. К 12‑м суткам пренатального развития у крыс прогениторные клетки начинают синтезировать TH [77]. Кроме того, в это время клетки-предшественники DA нейронов мигрируют в место их финального расположения (VTA и SN) [78], начинается экспрессия PITX3 [79, 80]. В дальнейшем, вплоть до 15-х суток пренатального онтогенеза, у уже находящихся на своем месте DA нейронов начинается рост аксонов в сторону их рецептивных зон. Имеется большое количество работ, посвященных изучению роста аксонов нейронов мезостриатного пути [78], остается малоизученным вопрос о развитии мезокортикального пути и о проекции DA нейронов в гиппокамп, латеральную хабенулу и миндалевидное тело.
При изучении развития патологий DA системы существенную роль играет процесс пренатальной иннервации DA нейронами таргетных нервных структур. Важную роль в пространственной ориентации аксонов DA нейронов среднего мозга играют комплексы белков аксонального наведения: ROBO-Slit [81–84], NTN1/DCC [85]. Аксоны нейронов, экспрессирующих рецепторы ROBO, отталкиваются от структур, выделяющих лиганд Slit. Комбинированное действие ROBO-Slit комплекса участвует в росте аксонов к переднему мозгу [84–87]. У мышей, нокаутированных по генам DCC (рецептор к NTN1, активно экспрессируемый клетками-предшественниками DA нейронов), в постнатальном периоде отсутствует сенсибилизация к амфетамину [88]. Это говорит о большой роли данного сигнального пути в образовании синаптических контактов DA нейронов, а также о роли пластических изменений в развитии аддиктивных патологий.
При созревании DA системы большое значение имеет сбалансированная регуляция GR кортикостероидами матери [89], в связи с чем стрессорные воздействия во время беременности могут существенно повышать риск нарушения функций DA системы потомства, в частности способствуя развитию расстройств аддиктивного спектра и шизофрении [15, 48]. Большинство исследований, посвященных онтогенезу дофаминергической системы в целом и ее измененного развития в частности при различных пренатальных воздействиях, не учитывали фактор полового диморфизма [90], в настоящее время признанного значимым для изучения таких патологий, как аутизм, паркинсонизм, а также шизофрения [90]. Половые различия также обнаружены в развитии наркомани у человека [91], а склонность к потреблению кокаина после пренатального стресса была более выраженной у самцов [92].
РОЛЬ ГЛУТАМАТЕРГИЧЕСКОЙ СИСТЕМЫ МОЗГА В РЕГУЛЯЦИИ ДОФАМИНЕРГИЧЕСКИХ НЕЙРОНОВ
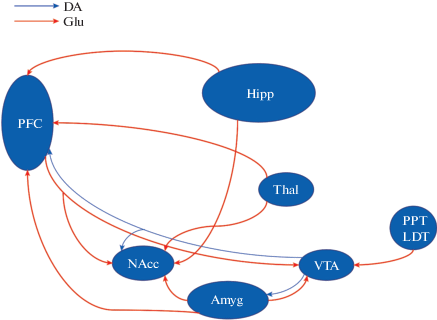
К развитию аддикций приводят изменения не только в DA системе, но и в сопряженных с ней медиаторных системах. Наиболее распространенной возбуждающей медиаторной системой мозга, опосредующей более чем 70% синаптических передач в центральной нервной системе, является глутаматергическая. Хорошо изучена глутаматергическая регуляция со стороны гиппокампа, таламуса и миндалевидного тела DA нейронов, идущих от VTA в префронтальную кору и прилежащее ядро. При этом глутаматергическое взаимодействие происходит и между областями мезокортиколимбической системы в основном под контролем префронтальной коры, в то время как VTA в первую очередь регулируется субкортикальными структурами (рис. 2) [93, 94].
Рис. 2.
Схематичное изображение известных глутаматергических (Glu) и дофаминергических (DA) проекций системы “вознаграждения” мозга. Сокращения: PFC – префронтальная кора, Thal – таламус, VTA – область вентральной покрышки, NAcc – прилежащее ядро вентрального стриатума, Amyg – миндалевидное тело, PPT – педункулопонтинное ядро, LDT – латеродорсальное тегментальное ядро.
Fig. 2. A schematic representation of the known glutamate (Glu) and dopamine (DA) projections of the brain “reward” system. Abbreviations: PFC – prefrontal cortex, Thal – thalamus, VTA – ventral tegmental area, NAcc – nucleus accumbens, Amyg – amygdala, PPT – pedunculopontine tegmentum, LDT – lateradorsal tegmentum.
Изменения, возникающие в глутаматергической системе в период развития наркотической зависимости, были хорошо изучены на кокаиновых и амфетаминовых моделях. На крысах было показано, что однократное введение кокаина или метамфетамина сопровождается активацией ERK-киназы, зависимой от NMDA рецепторов [95–97]. К быстрым эффектам потребления кокаина или амфетамина также следует отнести локальное повышение уровня глутамата в прилежащем ядре [98–100], дорсальном стриатуме [101] и VTA [102, 103]. При повторном предъявлении кокаина или амфетамина в DA нейронах VTA развивается сенсибилизация к глутамату, сопровождаемая кратковременным увеличением ответа от AMPA рецепторов [104, 105]. При хроническом потреблении кокаина у взрослых интактных животных в ответ на повторное введение происходит прогрессирующее со временем повышение локомоторной активности [106]. Морфологически такая поведенческая сенсибилизация проявляется в увеличении плотности дендритных шипиков нейронов прилежащего ядра [107, 108].
Нарушение чувствительности взаимодействия между медиаторными системами DA и глутамата может формироваться в ответ на стрессорные воздействия в период эмбриогенеза. В частности, показано, что перинатальный стресс вызывает устойчивое увеличение количества DA D2 рецепторов [109, 110] и NMDA рецепторов глутамата в области стриатума, префронтальной коры и CA1 гиппокампа [109]. Однако в модели раннего постнатального стресса на мышах, за исключением снижения экспрессии гена Grin2b в области гипоталамуса, изменения в экспрессии генов глутаматергической системы не наблюдаются [111]. Изменения активности глутаматергической системы в префронтальной коре, развивающиеся в результате пренатального стресса, приводят к нарушениям глутаматного ответа нейронов на повторные стрессы во взрослом возрасте, что проявляется в усиленном фосфорилировании NR-1(Ser896) и NR-2B(Ser1303) субъединиц NMDA рецептора у пренатально стрессированных крыс на повторный стресс, кроме того, автор установил увеличение фосфорилирования αCaMKII (α кальций-кальмодулин зависимая протеинкиназа II), маркера кальциевых флуктуаций, по Thr286 [112]. Стресс на третьей неделе гестации крыс усиливает выброс глутамата и DA в прилежащем ядре в ответ на инъекцию кокаина у взрослых экспериментальных животных по сравнению с контрольными [113], что в свою очередь может усиливать эксайтотоксический эффект глутамата.
Сопоставляя данные об изменениях, возникающих в глутаматергической системе после пренатального стресса в различных областях мозга, с результатами изучения влияния наркотических веществ у интактных животных, можно предположить, что пренатальный стресс является существенным фактором риска развития аддиктивных состояний. Способствуя выработке и усугубляя течение наркотической зависимости, морфофункциональные изменения структур мозга под влиянием пренатального стресса потенциально могут пролонгировать абстинентный синдром и вызывать мощный эксайтотоксический глутаматный ответ даже после однократного введения наркотических веществ [113].
В относительно недавних исследованиях было обнаружено, что пренатальный стресс снижает количество α7 никотиновых ацетилхолиновых рецепторов в пятом слое префронтальной коры [114], что, вероятно, приводит к снижению их холинергической регуляции [115]. Это в свою очередь способствует снижению активности ГАМК нейронов в VTA, получающих глутаматергическую стимуляцию от префронтальной коры и иннервирующих дофаминергические нейроны VTA, что также может объяснять повышенную склонность к развитию зависимостей у пренатально стрессированных крыс [115] и вносить свой вклад в развитие никотиновой зависимости. Однако при рассмотрении данной гипотезы следует обратить внимание на более поздние исследования, в которых установлено снижение количества дендритных шипиков нейронов префронтальный коры [116] и связанное с этим уменьшение количества всех белков, которые могут быть детектированы в префронтальной коре.
ВОВЛЕЧЕНИЕ КОРТИКОЛИБЕРИНА ВО ВЗАИМОДЕЙСТВИЕ ГЛУТАМАТЕРГИЧЕСКОЙ И ДОФАМИНЕРГИЧЕСКОЙ СИСТЕМ
Кортиколиберин (CRF) рассматривается как один из ключевых нейроэндокринных модуляторов, опосредующих эффекты пренатального стресса на развитие аддиктивных патологий. Давно известно о наличии CRF-позитивных терминалей в области VTA, однако только в недавних исследованиях было показано, что CRF-позитивные терминали образуют синаптические контакты с DA и глутаматергическими нейронами VTA. При этом 83% содержащих CRF аксонов, образующих синапсы с DA нейронами в VTA, являются глутаматергическими [117]. Глутаматергические нейроны, содержащие CRF, вероятно, являются частью системы, модулирующей работу DA нейронов под влиянием стрессорных стимулов. Наличие синапсов CRF в VTA предполагает механизм взаимодействия между стресс-ассоциированным нейропептидом CRF и мезокортиколимбической системой DA. Это хорошо согласуется с результатами, полученными группой Ванга, в которых при выработке у крыс самоинъецирования кокаином, а затем угашении рефлекса нажима на рычаг при замене кокаина физиологическим раствором, было обнаружено, что удары током приводят к возобновлению поведения, направленного на поиск кокаина, и повышают уровень глутамата в области VTA, а введение неселективного антагониста CRF полностью блокирует эти эффекты [118]. Стрессорный удар током вызывает количественно одинаковый выброс CRF в VTA у выработавших ранее кокаиновую зависимость и контрольных крыс, но только у выработавших ранее кокаиновую зависимость крыс локальный выброс CRF вызывает увеличение уровня глутамата в VTA, который в свою очередь оказывает действие на дофаминергические нейроны. Это наблюдение позволяет сделать вывод о том, что потребление кокаина изменяет реакцию глутаматергических нейронов VTA на CRF, а не реакцию CRF системы на удары током [118].
Становится очевидным, что воздействие CRF на глутаматергические нейроны в VTA при стресс-реакции предопределяет возобновление наркотической зависимости. Эти выводы получили подтверждение еще в одном эксперименте на крысах с выработанным рефлексом самоинъецирования кокаина. После угашения рефлекса нажатия на рычаг прямое введение CRF в область VTA вызывает увеличение уровня глутамата и возобновление поиска кокаина. Таким образом, CRF участвует в компульсивном потреблении кокаина, а возможно, и в потреблении других наркотических веществ [118].
В литературе содержится недостаточно данных относительно развития системы CRF в области VTA. Значительно больше данных о формировании системы CRF получено на миндалевидном теле – структуре мозга, отвечающей за формирование чувства страха и тревожного поведения. В данном участке мозга в большом количестве содержатся CRF-продуцирующие клетки. В нейронах экспрессируются MR, GR, а также рецепторы CRF. Было показано, что содержание CRF в миндалевидном теле повышено у взрослых пренатально стрессированных крыс [119], что может обусловливать их тревожность и повышенную чувствительность к аверсивным стимулам [120]. В целом вопрос влияния пренатального стресса на развитие CRF системы требует более детального изучения.
ЧАСТНЫЕ СЛУЧАИ АДДИКЦИЙ И ИХ ВОЗМОЖНАЯ ВЗАИМОСВЯЗЬ СО СТРЕССОРНЫМИ ВОЗДЕЙСТВИЯМИ В ПРЕНАТАЛЬНОМ ПЕРИОДЕ
Никотиновая зависимость. Несмотря на то что никотин не считается тяжелым наркотиком, его потребление наносит колоссальный ущерб. По данным ВОЗ, ежегодно в мире от последствий употребления табака погибают до 8 млн. человек.
Являясь основным компонентом табачного дыма, именно никотин отвечает за развитие табачной зависимости [121]. Никотин свободно проникает через гематоэнцефалический барьер и с высокой афинностью связывается с никотиновыми ацетилхолиновыми рецепторами (nAChR), представляющими собой катионные каналы. Считается, что в VTA никотин опосредует свой эффект через активацию nAChR, колокализованных с глутаматными рецепторами на DA нейронах, что способствует выбросу дофамина [122–125]. Альтернативная гипотеза дополняет это представление, предполагая также наличие nAChR на пресинаптической мембране глутаматергических проекций в VTA. В таком случае активация этих рецепторов никотином усиливает выброс глутамата в VTA, где глутамат начинает оказывать свое возбуждающее действие на DA нейроны (рис. 3) [126].
Рис. 3.
Упрощенная иллюстрация возможного влияния nAСhR на регуляцию выброса глутамата, ГАМК и дофамина. Вследствие того, что на пресинаптических терминалях ГАМК- и глутаматергических нейронов располагаются преимущественно разные типы nAChR, их десенсибилизация протекает по-разному. Длительное потребление никотина усиливает влияние глутаматергических нейронов на DA VTA нейроны, которые в свою очередь после его потребления выбрасывают большее количество дофамина в прилежащее ядро (NAcc). Сокращения: VTA – вентральная тегментальная область, DA –дофамин, GluR – глутаматные рецепторы, GABAR – ГАМК рецепторы, DAR – дофаминовые рецепторы, nAChR – никотиновый ацетилхолиновый рецептор.
Fig. 3. A simplified illustration of the possible effect of nAСhR on the regulation of glutamate, GABA and dopamine release. Due to the fact that the presynaptic terminals of GABA- and glutamatergic neurons predominantly contain different types of nAChR, their desensitization proceeds differently. Long-term nicotine intake enhances the effect of glutamatergic neurons on DA VTA neurons, which then release more dopamine into the nucleus accumbens (NAcc). Abbreviations: VTA – ventral tegmental region, DA – dopamine, GluR – glutamate receptors, GABAR – GABA receptors, DAR – dopamine receptors, nAChR – nicotinic acetylcholine receptor.
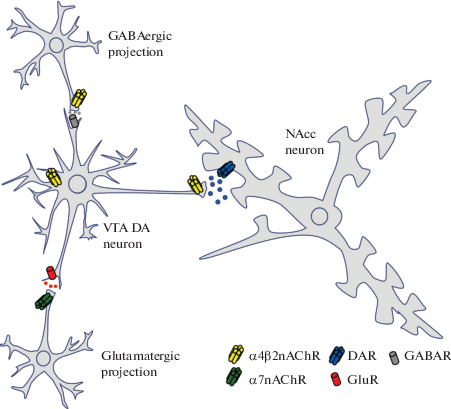
a4β2nAChR и a7nAChR являются наиболее распространенными типами ацетилхолиновых рецепторов в мозге [127]. Активация a4β2nAChR, расположенных преимущественно на телах DA нейронов, приводит к увеличению их спайковой активности и повышению уровня DA в прилежащем ядре и префронтальной коре. На аксонах глутаматергических нейронов преимущественно располагаются a7nAChR рецепторы (рис. 3) [127, 128].
Различными научными группами было показано, что никотин также вызывает долговременную потенциацию нейронов гиппокампа, усиливая NMDA-зависимые токи [129–131]. Кроме того, было отмечено увеличение уровня глутамата в ответ на предъявление никотина в неокортексе, дорсальном стриатуме, прилежащем ядре и гипоталамусе [132–135], а введение антагониста ионотропных глутаматных рецепторов предотвращало никотин-индуцированое повышение дофамина в стриатуме [136]. Эти данные указывают на локализацию nAChR на пресинапсе глутаматергических нейронов и важную роль глутамата в возникновении эффектов никотина, косвенно подтверждают альтернативную гипотезу, впрочем, не опровергая основную.
Никотиновая зависимость, как и прочие, не развивается после однократного приема никотина. За развитие зависимости отвечают более длительные пластические изменения в мозге, которые возникают в глутаматергической системе при хроническом приеме никотина. Длительное потребление никотина ассоциировано с десенсибилизацией и уменьшением количества nAChR, причем скорость десенсибилизации среди разных видов нейронов отличается. Например, десенсибилизация ГАМК-ергических нейронов происходит быстрее, чем глутаматергических, в связи с тем, что на их терминалях преобладают разные типы nAChR (см. рис 3) [137]. Это приводит к ослаблению выброса ГАМК в вентральной тегментальной области по отношению к глутамату после приема никотина, в свою очередь избыток глутамата и недостаток ГАМК усиливают выброс DA в прилежащем ядре (рис. 3) [137].
Во многих работах было показано, что длительное потребление никотина вызывает изменения уровня экспрессии белков, участвующих в глутаматергической передаче. В частности, было обнаружено, что хроническое введение никотина мышам и крысам приводит к снижению уровня белков NR2A и NR2B (являются субъединицами NMDA рецепторов) в стриатуме [138], но увеличению их содержания во фронтальной коре [124]. Кроме того, в области VTA повышается уровень GluR2/3 субъединиц AMPA рецепторов [139]. В то же время использование ингибитора mGluR5 вызывает ослабление подкрепляющих эффектов никотина [140, 141], что говорит о вовлечении данного типа рецепторов в формирование и закрепление никотиновой зависимости. Имеются одиночные работы, описывающие влияние пренатального стресса на последующее развитие никотиновой зависимости. В частности, было показано, что пренатально стрессированные крысы более уязвимы к развитию никотиновой зависимости [110], а абстинентный синдром у таких крыс пролонгирован [142]. Также известно, что пренатальный стресс усиливает локомоторную активность после приема никотина по сравнению с контролем [143]. Эти данные позволяют предположить, что пренатальный стресс, вызывающий стабильное увеличение количества NMDA [109], а также D2 DA рецепторов [109, 110, 143] в префронтальной коре и стриатуме, будет способствовать развитию никотиновой зависимости у взрослых, а также изменять течение абстинентного синдрома, однако в литературе практически отсутствуют данные по этой теме.
Алкогольная зависимость. Алкоголизм является одной из наиболее социально значимых проблем. По оценкам ВОЗ, на 2010 г. около 208 млн. человек страдают алкоголизмом, что составляет 4.1% населения планеты старше 15 лет.
Установлена тесная взаимосвязь между стрессом и последующим потреблением алкоголя как у людей, так и у животных [144–146]. Такие патологии, как депрессия, тревожность и посттравматическое стрессовое расстройство известны как существенный фактор риска развития алкоголизма [145, 147].
Как и в случае с никотином, следует различать краткоcрочные и хронические эффекты потребления алкоголя. Мгновенный эффект потребления алкоголя, а именно увеличение уровня внеклеточного глутамата сходен с таковым при потреблении никотина. С применением метода микродиализа было обнаружено увеличение уровня глутамата в гиппокампе [148], миндалевидном теле [149] и прилежащем ядре [148, 150]. Кроме того, в электрофизиологических исследованиях было показано ингибирующее действие алкоголя на NMDA-зависимые токи во многих областях мозга, таких как гиппокамп [151–153] и прилежащее ядро [154]. В VTA, вероятно, NMDA-зависимо, снижается спайковая активность ГАМК нейронов [155], что, возможно, и приводит к возникновению подкрепляющих эффектов этанола, опосредованных выбросом дофамина в прилежащем ядре после его употребления [156].
К отсроченным эффектам потребления алкоголя у взрослых интактных крыс следует отнести H-Ras зависимое фосфорилирование NR2A субъединиц NMDA рецепторов нейронов гиппокампа и их последующую интернализацию, при этом в нейронах гиппокампа становится больше NR2B содержащих NMDA рецепторов [157]. Интересно, что содержащие NR2B субъединицы NMDA рецепторы наиболее подвержены ингибирующему действию этанола [158]. Фосфорилированию подвергаются и другие субъединицы NMDA рецептора в различных структурах мозга с вовлечением Fyn киназы [159], протеинкиназ А [160] и С [161].
Хроническое потребление алкоголя приводит к компенсаторному усилению экспрессии генов субъединиц NMDA рецептора, в частности наиболее подверженных ингибированию NR2A и NR2B [162–165], а также GluR2/3 субъединиц AMPA рецептора [166, 167] в коре больших полушарий и гиппокампе. Поэтому при остром абстинентном синдроме центральная нервная система переходит в состояние гипервозбудимости, что проявляется в агрессивном поведении больных. Этот эффект успешно подавляется антагонистами NMDA рецепторов [168, 169]. Помимо изменений в ионотропной глутаматергической передаче, хроническое потребление этилового спирта также ингибирует mGluR-опосредованную фосфолипазную активность [180 ] и вызывает снижение транскрипции mGluR1,3,5,7 в гиппокампе [171].
В отличие от гиппокампа и неокортекса, влияние хронического потребления этанола на глутаматную систему в VTA изучено не так широко. На крысах показано, что при длительном потреблении алкоголя в этой структуре мозга происходит увеличение количества GluR1 субъединиц AMPA рецептора и NR1 субъединиц NMDA рецептора [172].
В связи с тем, что развитие алкоголизма тесно связано с изменениями в глутаматергической системе, взаимосвязь между пренатальным стрессом и предрасположенностью к алкоголизму вызывает большой интерес. Пренатальный стресс не влияет на базальное потребление алкоголя [173, 174] (но см. [116]), однако последствия его потребления у пренатально стрессированных и интактных крыс различны: в прилежащем ядре пренатально стрессированных животных хроническое потребление алкоголя вызывает увеличенную по сравнению с контролем индукцию ΔFosB – транскрипционного фактора, ассоциированного с развитием аддикций [174].
У пациентов, страдающих алкоголизмом [175], и у зависимых от алкоголя крыс [176] наблюдается снижение активности HPA. Для пренатально стрессированных животных снижение активности HPA показано уже после однократного приема алкоголя [177].
Следует отметить, что развитие алкогольной зависимости у пренатально стрессированных крыс изучено более детально по сравнению с зависимостями от других веществ. Однако и данный вопрос нуждается в дальнейших исследованиях. В частности, эффект повышенной склонности к потреблению алкоголя вследствие повторного стресса у взрослых пренатально стрессированных животных требует детального изучения [178].
ЗАКЛЮЧЕНИЕ
Таким образом, накопленные в настоящий момент данные указывают на тесную взаимосвязь между стрессорными воздействиями в период пренатального онтогенеза и вероятностью развития аддиктивных состояний. В то время как во взрослом возрасте чрезмерная психологическая нагрузка является существенным фактором риска формирования аддикций, стресс матери во время эмбрионального развития оказывает базовый программирующий эффект в формировании аддиктивного фенотипа. Результаты сравнения статистических исследований анамнезов пациентов и моделирования на животных сходных воздействий в пренатальном онтогенезе хорошо согласуются. Становится очевидной степень влияния глюкокортикоидной нейроэндокринной системы и ее нарушения вследствие пренатального стресса на взаимодействие дофамин- и глутаматергической систем потомства, что проявляется в изменении чувствительности дофаминовой системы “вознаграждения” к естественным стимулам и в конечном счете формирует основу для предрасположенности к развитию аддиктивных патологий. Несмотря на значительный прогресс в изучении роли нарушений пренатального развития в формировании склонности к аддикциям, накопленный материал о взаимодействии пространственно-временных аспектов влияния стресса на плод и модификации молекулярно-клеточных механизмов развития мозга остается недостаточным для эффективного практического использования в клинике. Следовательно, эти вопросы требуют дальнейшего интенсивного изучения.
Работа выполнена при финансовой поддержке РФФИ (грант № 19-315-90003).
Список литературы
Schultz W. Neuronal Reward and Decision Signals: From Theories to Data. Physiological Reviews. 95 (3): 853–951. 2015. https://doi.org/10.1152/physrev.00023.2014
de Greck M., Supady A., Thiemann R., Tempelmann C., Bogerts B., Forschner L., Ploetz K.V., Northoff G. Decreased neural activity in reward circuitry during personal reference in abstinent alcoholics – a fMRI study. Hum. Brain Mapp. 30 (5): 1691–1704. 2009. https://doi.org/10.1002/hbm.20634
Martins S.S., Santaella-Tenorio J., Marshall B.D., Maldonado A., Cerdá M. Racial/ethnic differences in trends in heroin use and heroin-related risk behaviors among nonmedical prescription opioid users. Drug Alcohol Depend. 151: 278–283. 2015. https://doi.org/10.1016/j.drugalcdep.2015.03.020
Nielsen D.A., Ho A., Bahl A., Varma P., Kellogg S., Borg L., Kreek M.J. Former heroin addicts with or without a history of cocaine dependence are more impulsive than controls. Drug Alcohol Depend. 124 (1–2): 113–120. 2012. https://doi.org/10.1016/j.drugalcdep.2011.12.022
Crabbe J. Genetic contributions to addiction. Annu. Rev. Psychol. 53: 435–465. 2002. https://doi.org/10.1146/annurev.psych.53.100901.135142
Briand L., Blendy J. Molecular and genetic substrates linking stress and addiction. Brain Res. 1314: 219–234. https://doi.org/10.1016/j.brainres.2009.11.002
Bloom S.L., Sheffield J.S., McIntire D.D., Leveno K.J. Antenatal dexamethasone and decreased birth weight. Obstet. Gynecol. 97 (4): 485–490. 2001. https://doi.org/10.1016/s0029-7844(00)01206-0
French N.P., Hagan R., Evans S.F., Godfrey M., Newn-ham J.P. Repeated antenatal corticosteroids: size at birth and subsequent development. Am. J. Obstet. Gynecol. 180 (1 Pt 1): 114–121. 1999. https://doi.org/10.1016/s0002-9378(99)70160-2
Nyirenda M.J., Welberg L.A., Seckl J.R. Programming Hyperglycaemia in the Rat Through Prenatal Exposure to Glucocorticoids-Fetal Effect or Maternal Influence? J. Endocrinol. 170 (3): 653–660. 2001. https://doi.org/10.1677/joe.0.1700653
Reinisch J.M., Simon N.G., Karwo W.G., Gandelman R. (1978) Prenatal exposure to prednisone in humans andanimals retards intra-uterine growth. Science. 202: 436–438 1978. https://doi.org/10.1126/science.705336
Doyle L.W., Ford G.W., Davis N.M., Callanan C. Antenatal corticosteroid therapy and blood pressure at 14 years of age in preterm children. Clin. Sci. 98: 137–142. 2000. https://doi.org/10.1042/cs0980137
Dalziel S.R., Walker N.K., Parag V., Mantell C., Rea H.H., Rodgers A., Harding J.E. Cardiovascular risk factors after antenatal exposure to betamethasone: 30-year follow-up of a randomised controlled trial. Lancet. 365 (9474): 1856–1862. 2005. https://doi.org/10.1016/S0140-6736(05)66617-2
Aleksandrov A.A., Polyakova O.N., Batuev A.S. The effects of prenatal stress on learning in rats in a Morris maze. Neurosci. Behav. Physiol. 31 (1): 71–74. 2001. https://doi.org/10.1023/a:1026682415860
O’Donnell K., O’Connor T.G., Glover V. Prenatal stress and neurodevelopment of the child: Focus on the HPA axis and role of the placenta. Dev. Neurosci. 31 (4): 285–292. 2009. https://doi.org/10.1159/000216539
Khashan A.S., Abel K.M., McNamee R., Pedersen M.G., Webb R.T., Baker P.N., Kenny L.C., Mortensen P.B. Higher risk of offspring schizophrenia following antenatal maternal exposure to severe adverse life events. Arch. Gen. Psychiatry. 65 (2): 146–152. 2008. https://doi.org/10.1001/archgenpsychiatry.2007.20
de Kloet E.R., Karst H., Joels M. Corticosteroid hormones in the central stress response: quick-and-slow. Front. Neuroendocrinol. 29: 268–272. 2008. https://doi.org/10.1016/j.yfrne.2007.10.002
Karst H., Berger S., Turiault M., Tronche F., Schütz G., Joëls M. 2005. Mineralocorticoid receptors are indispensable for nongenomic modulation of hippocampal glutamate transmission by corticosterone. Proc. Natl. Acad. Sci. U. S. A. 102: 19204–19207. 2005. https://doi.org/10.1073/pnas.0507572102
Angulo J.A., McEven B.S. Molecular aspects of neuropeptide regulation and function in the corpus striatum and nucleus accumbens. Brain. Res. Rev. 19: 1–28. 1994. https://doi.org/10.1016/0165-0173(94)90002-7
Schoffelmeer A.N., Voorn P., Jonker A.J., Wardeh G., Nestby P., Vanderschuren L.J., De Vries T.J., Mulder A.H., Tjon G.H. Morphine-induced increase in D-1 receptor regulated signal transduction in rat striatal neurons and its facilitation by glucocorticoid receptor activation: possible role in behavioral sensitization. Neurochem. Res. 21: 1417–1423. 1996. https://doi.org/10.1007/BF02532383
Xiong F., Zhang L. Role of hypothalamic-pituitary-adrenal axis in developmental programming of health and disease. Front. Neuroendocrinol. 34: 27–46. 2013. https://doi.org/10.1016/j.yfrne.2012.11.002
Weaver I.C., Champagne F.A., Brown S.E., Dymov S., Sharma S., Meaney M.J., Szyf M. Reversal of maternal programming of stress responses in adult offspring through methyl supplementation: altering epigenetic marking later in life. J. Neurosci. 25: 11045–11054. 2005. https://doi.org/10.1523/JNEUROSCI.3652-05.2005
Weaver I.C., D’Alessio A.C., Brown S.E., Dymov S., Hellstrom I.C., Sharma S., Szyf M., Meaney M.J. The transcription factor nerve growth factor-inducible protein a mediates epigenetic programming: altering epigenetic marks by immediate-early genes. J. Neurosci. 27: 1756– 1768. 2007. https://doi.org/10.1523/JNEUROSCI.4164-06.2007
Mueller B.R., Bale T.L. Sex-specific programming of offspring emotionality after stress early in pregnancy. J. Neurosci. 28: 9055–9065. 2008. https://doi.org/10.1523/JNEUROSCI.1424-08.2008
Oberlander T.F., Weinberg J., Papsdorf M., Grunau R., Misri S., Devlin A.M. Prenatal exposure to maternal depression, neonatal methylation of human glucocorticoid receptor gene (NR3C1) and infant cortisol stress responses. Epigenetics. 3: 97–106. 2008. https://doi.org/10.4161/epi.3.2.6034
Turner J.D., Pelascini L.P., Macedo J.A., Muller C.P. Highly individual methylation patterns of alternative glucocorticoid receptor promoters suggest individualized epigenetic regulatory mechanisms. Nucleic. Acids. Res. 36: 7207–7218. 2008. https://doi.org/10.1093/nar/gkn897
Turner J.D., Alt S.R., Cao L., Vernocchi S., Trifonova S., Battello N., Muller C.P. Transcriptional control of the glucocorticoid receptor: CpG islands, epigenetics and more. Biochem. Pharmacol. 80: 1860–1868. 2010. https://doi.org/10.1016/j.bcp.2010.06.03
Cole T.J., Blendy J.A., Monaghan A.P., Krieglstein K., Schmid W., Aguzzi A., Fantuzzi G., Hummler E., Unsicker K., Schütz G. Targeted disruption of the glucocorticoid receptor gene blocks adrenergic chromaffin cell development and severely retards lung maturation. 9 (13): 1608–1621. 1995. https://doi.org/10.1101/gad.9.13.1608
Härfstrand A., Fuxe K., Cintra A., Agnati L.F., Zini I., Wikström A.C., Okret S., Yu Z.Y., Goldstein M., Steinbusch H. Glucocorticoid receptor immunoreactivity in monoaminergic neurons of rat brain. Proc. Natl. Acad. Sci. U. S. A. 83: 9779–9783. 1986. https://doi.org/10.1073/pnas.83.24.9779
Tombaugh G.C., Yang S.H., Swanson R.A., Sapolsky R.M. Glucocorticoids exacerbate hypoxic and hypoglycemic hippocampal injury in vitro: biochemical correlates and a role for astrocytes. J. Neurochem. 59: 137–146. 1992. https://doi.org/10.1111/j.1471-4159.1992.tb08884.x
Flavin M.P. Influence of dexamethasone on neurotoxicity caused by oxygen and glucose deprivation in vitro. Exp. Neurol. 139: 34–38. 1996. https://doi.org/10.1006/exnr.1996.0078
Tuor U.I. Glucocorticoids and the prevention of hypoxic-ischemic brain damage. Neurosci. Biobehav. Rev. 21: 175–179. 1997. https://doi.org/10.1016/S0149-7634(96)00007-3
Whitelaw A., Thoresen M. Antenatal steroids and the developing brain. Arch. Dis. Child. Feta.l Neonat. 83 (2): F154–F157. 2000. https://doi.org/10.1136/fn.83.2.f154
Meyer J.S. Early adrenalectomy stimulates subsequent growth and development of the rat brain. Exp. Neurol. 82: 432–446. 1983. https://doi.org/10.1016/0014-4886(83)90415-6
Yehuda R., Fairman K.F., Meyer J.S. Enhanced brain cell proliferation following early adrenalectomy in the rat. J. Neurochem. 53: 241–248. 1989. https://doi.org/10.1111/j.1471-4159.1989.tb07320.x
Weinstock M. The long-term behavioural consequences of prenatal stress. Neurosci. Biobehav. Rev. 32: 1073–1086. 2008. https://doi.org/10.1016/j.neubiorev.2008.03.002
Seckl J.R., Holmes M.C. Mechanisms of disease: glucocorticoids, their placental metabolism and fetal “programming” of adult pathophysiology. Nat. Rev. Endocrinol. 2007. 3 (6): 479–488. https://doi.org/10.1038/ncpendmet0515
Pluess M., Belsky J. Prenatal Programming of Postnatal Plasticity? Dev. Psychopathol. 2011. 23 (1): 29–38. https://doi.org/10.1017/S0954579410000623
Hartman S., Freeman S.M., Bales K.L., Belsky J. Prenatal Stress as a risk-and an opportunity-factor. Psychol. Sci. 2018. 29 (4): 572–580. https://doi.org/10.1177/0956797617739983
Ward A.J. Prenatal stress and childhood psychopathology. Child. Psychiatry. Hum. Dev. 22: 97–110. 1991. https://doi.org/10.1007/BF00707788
Gutteling B.M., de Weerth C., Sophie H.N., Willemsen-Swinkels S.H., Huizink A.C., Mulder E.J., Gerard H.A., Visser G.H., Buitelaar J.K. The effects of prenatal stress on temperament and problem behavior of 27-month-old toddlers. Eur. Child Adolesc. Psychiatry. 14 (1): 41–51. 2005. https://doi.org/10.1007/s00787-005-0435-1
Gutteling B.M., de Weerth C., Zandbelt N., Mulder E.J., Visser G.H., Buitelaar J.K. Does Maternal Prenatal Stress Adversely Affect the Child’s Learning and Memory at Age Six? J. Abnorm. Child. Psychol. 34 (6): 789–798. 2006. https://doi.org/10.1007/s10802-006-9054-7
Estanislau C., Morato S. Prenatal stress produces more behavioral alterations than maternal separation in the elevated plus-maze and in the elevated T-maze. Behav. Brain Res. 163: 70–77. 2005. https://doi.org/10.1016/j.bbr.2005.04.003
Murmu M.S., Salomon S., Biala Y., Weinstock M., Braun K., Bock J. Changes of spine density and dendritic complexity in the prefrontal cortex in offspring of mothers Exposed to Stress During Pregnancy. Eur. J. Neurosci. 24 (5): 1477–1487. 2006. https://doi.org/10.1111/j.1460-9568.2006.05024.x
Vallée M., Mayo W., Dellu F., Le Moal M., Simon H., Maccari S. Prenatal stress induces high anxiety and postnatal handling induces low anxiety in adult offspring: correlation with stress-induced corticosterone secretion. J. Neurosci. 17: 2626–2636. 1997. https://doi.org/10.1523/JNEUROSCI.17-07-02626.1997
Alonso S.J., Damas C., Navarro E. Behavioral despair in mice after prenatal stress. J. Physiol. Biochem. 56 (2): 77–82. 2000. https://doi.org/10.1007/BF03179902
Hauser J., Feldon J., Pryce C.R. Direct and dam-mediated effects of prenatal dexamethasone on emotionality, cognition and HPA axis in adult Wistar rats. Horm. Behav. 56 (4): 364–375. 2009. https://doi.org/10.1016/j.yhbeh.2009.07.003
Razavinasab M., Sheibani V., Kohlmeier K.A., Nazeri M., Shabani M. Hyperexcitability of VTA dopaminergic neurons in male offspring exposed to physical or psychological prenatal stress. Prog. Neuropsychopharmacol. Biol. Psychiatry. 2020. 101: 109923. https://doi.org/10.1016/j.pnpbp.2020.109923
Deminière J.M., Piazza P.V., Guegan G., Nora A., Maccari S., Le Moal M., Simon H. Increased locomotor response to novelty and propensity to intravenous amphetamine self-administration in adult offspring of stressed mothers. Brain. Res. 586 (1): 135–139. 1992. https://doi.org/10.1016/0006-8993(92)91383-p
Nazeri M., Ebrahimi A., Aghaei I., Ravandi S.G., Shabani M. Psychological stress has a higher rate of developing addictive behaviors compared to physical stress in rat offspring. EXCLI. J. 2017. 16: 903–913. https://doi.org/10.17179/excli2016-685
Pastor V., Pallarés M.E., Antonelli M.C. Prenatal stress increases adult vulnerability to cocaine reward without affecting pubertal anxiety or novelty response. Behav. Brain. Res. 2018. 339: 186–194. https://doi.org/10.1016/j.bbr.2017.11.035
Ganapathy V., Ramamoorthy S., Leibach F.H. Transport and metabolism of monoamines in the human placenta: A review. Placenta. 14: 35–51. 1993. https://doi.org/10.1016/S0143-4004(05)80281-4
Sarkar S., Tsai S., Nguyen T.T., Plevyak M., Padbury J.F., Rubin L.P. Inhibition of placental 11β-hydroxysteroid dehydrogenase type 2 by catecholamines via α-adrenergic signaling. Am. J. Physiol. Regul. Integr. Comp. Physiol. 281 (6): 1966–1974. 2001. https://doi.org/10.1152/ajpregu.2001.281.6.R1966
Benediktsson R., Calder A.A., Edwards C.R., Seckl J.R. Placental 11 beta-hydroxysteroid dehydrogenase: A key regulator of fetal glucocorticoid exposure. Clin. Endocrinol. 46 (2): 161–166. 1997. https://doi.org/10.1046/j.1365-2265.1997.1230939.x
Meaney M.J., Szyf M., Seckl J.R. Epigenetic mechanisms of perinatal programming of hypothalamic-pituitary-adrenal function and health. Trends Mol. Med. 13 (7): 269–277. 2007. https://doi.org/10.1016/j.molmed.2007.05.003
Brown R.W., Diaz R., Robson A.C., Kotelevtsev Y.V., Mullins J.J., Kaufman M.H., Seckl J.R. The ontogeny of 11 beta-hydroxysteroid dehydrogenase type 2 and mineralocorticoid receptor gene expression reveal intricate control of glucocorticoid action in development. Endocrinology. 137 (2): 794–797. 1996. https://doi.org/10.1210/endo.137.2.8593833
Tzschoppe A., Fahlbusch F., Seidel J., Dörr H.G., Rascher W., Goecke T.W., Beckmann M.W., Schild R.L., Struwe E., Dötsch J. Dexamethasone stimulates the expression of leptin and 11β-HSD2 in primary human placental trophoblastic cells. Eur. J. Obstet. Gynecol. Reprod. Biol. 156 (1): 50–55. 2011. https://doi.org/10.1016/j.ejogrb.2011.01.008
Horn S.R., Roos L.E., Berkman E.T., Fisher P.A. Neuroendocrine and immune pathways from pre- and perinatal stress to substance abuse. Neurobiol. Stress. 2018. 9: 140–150. https://doi.org/10.1016/j.ynstr.2018.09.004
Merlot E., Couret D., Otten W. Prenatal stress, fetal imprinting and immunity. Brain. Behav. Immun. 2008. 22 (1): 42–51. https://doi.org/10.1016/j.bbi.2007.05.007
Coussons-Read M.E., Okun M.L., Nettles C.D. Psychosocial stress increases inflammatory markers and alters cytokine production across pregnancy. Brain. Behav. Immun. 2007. 21 (3): 343–350. https://doi.org/10.1016/j.bbi.2006.08.006
Vuillermot S., Weber L., Feldon J., Meyer U. A longitudinal examination of the neurodevelopmental impact of prenatal immune activation in mice reveals primary defects in dopaminergic development relevant to schizophrenia. J. Neurosci. 2010. 30 (4): 1270–1287. https://doi.org/10.1523/JNEUROSCI.5408-09.2010
Braver T.S., Barch D.M., Cohen J.D. Cognition and control in schizophrenia: a computational model of dopamine and prefrontal function. Biol. Psychiatry. 46: 312–328. 1999. https://doi.org/10.1016/s0006-3223(99)00116-x
Koob G.F. Hedonic valence, dopamine and motivation. Mol. Psychiatry. 1 (3): 186–189. 1996.
Bromberg-Martin E.S., Matsumoto M., Hikosaka O. Dopamine in motivational control: rewarding, aversive, and alerting. Neuron. 2010. 68 (5): 815–834. https://doi.org/10.1016/j.neuron.2010.11.022
Matsumoto M., Hikosaka O. Representation of negative motivational value in the primate lateral habenula. Nat. Neurosci. 12 (1): 77–84. 2009. https://doi.org/10.1038/nn.2233
Ferdinand N.K., Mecklinger A., Kray J., Gehring W.J. The processing of unexpected positive response outcomes in the mediofrontal cortex. J. Neurosci. 32 (35): 12087–12092. 2012. https://doi.org/10.1523/JNEUROSCI.1410-12.2012
Bayer H.M., Glimcher P.W. Midbrain dopamine neurons encode a quantitative reward prediction error signal. Neuron. 47 (1): 129–141. 2005. https://doi.org/10.1016/j.neuron.2005.05.020
Di Chiara G. Nucleus accumbens shell and core dopamine: differential role in behavior and addiction. Behav. Brain Res. 137: 75–114. 2002. https://doi.org/10.1016/S0166-4328(02)00286-3
Grace A.A. Phasic versus tonic dopamine release and the modulation of dopamine system responsivity: a hypothesis for the etiology of schizophrenia. Neuroscience 41 (1): 1–24. 1991. https://doi.org/10.1016/0306-4522(91)90196-u
Blanchard V., Raisman-Vozari R., Vyas S., Michel P.P., Javoy-Agid F., Uhl G., Agid Y. (1994) Differential expression of tyrosine hydroxylase and membrane dopamine transporter genes in subpopulations of dopaminergic neurons of the rat mesencephalon. Brain. Res. Mol. Brain. Res. 22: 29–38. 1994. https://doi.org/10.1016/0169-328x(94)90029-9
Abeliovich A., Hammond R. Midbrain dopamine neuron differentiation: factors and fates. Dev. Biol. 304: 447–454. 2007. https://doi.org/10.1016/j.ydbio.2007.01.032
Ono Y., Nakatani T., Sakamoto Y., Mizuhara E., Minaki Y., Kumai M., Hamaguchi A., Nishimura M., Inoue Y., Hayashi H., Takahashi J., Imai T. Differences in neurogenic potential in floor plate cells along an anteroposterior location: midbrain dopaminergic neurons originate from mesencephalic floor plate cells. Development. 134 (17): 3213–3225. 2007. https://doi.org/10.1242/dev.02879
Liu A., Joyner A.L. Early anterior/posterior patterning of the midbrain and cerebellum. Annu. Rev. Neurosci. 24: 869–896. 2001. https://doi.org/10.1146/annurev.neuro.24.1.869
Rhinn M., Brand M. The midbrain–hindbrain boundary organizer. Curr. Opin. Neurobiol. 11: 34–42. 2001. https://doi.org/10.1016/s0959-4388(00)00171-9
Ye W., Shimamura K., Rubenstein J.L., Hynes M.A., Rosenthal A. FGF and Shh signals control dopaminergic and serotonergic cell fate in the anterior neural plate. Cell. 93: 755–766. 1998. https://doi.org/10.1016/s0092-8674(00)81437-3
Saucedo-Cardenas O., Quintana-Hau J.D., Le W.D., Smidt M.P., Cox J.J., De Mayo F., Burbach J.P., Conneely O.M. Nurr1 is essential for the induction of the dopaminergic phenotype and the survival of ventral mesencephalic late dopaminergic precursor neurons. Proc. Natl. Acad. Sci. U. S. A. 95: 4013–4018. 1998. https://doi.org/10.1073/pnas.95.7.4013
Smits S.M., Ponnio T., Conneely O.M., Burbach J.P., Smidt M.P. Involvement of Nurr1 in specifying the neurotransmitter identity of ventral midbrain dopaminergic neurons. Eur. J. Neurosci. 18: 1731–1738. 2003.
Gates M.A., Torres E.M., White A., Fricker-Gates R.A., Dunnett S.B. Re-examining the ontogeny of substantia nigra dopamine neurons. Eur. J. Neurosci. 23: 1384–1390. 2006. https://doi.org/10.1111/j.1460-9568.2006.04637.x
Bissonette G.B., Roesch M.R. Development and function of the midbrain dopamine system: what we know and what we need to. Genes. Brain. Behav. 15: 62–73. 2016. https://doi.org/10.1111/gbb.12257
Smidt M.P., Smits S.M., Bouwmeester H., Hamers F.P., van der Linden A.J., Hellemons A.J., Graw J., Burbach J.P. Early developmental failure of substantia nigra dopamine neurons in mice lacking the homeodomain gene Pitx3. Development. 131: 1145–1155. 2004. https://doi.org/10.1242/dev.01022
van den Munckhof P., Luk K.C., Ste-Marie L., Montgo-mery J., Blanchet P.J., Sadikot A.F., Drouin J. Pitx3 is required for motor activity and for survival of a subset of midbrain dopaminergic neurons. Development. 130: 2535–2542. 2003. https://doi.org/10.1242/dev.00464
Hivert B., Liu Z., Chuang C.Y., Doherty P., Sundaresan V. Robo1 and Robo2 are homophilic binding molecules that promote axonal growth. Mol. Cell. Neurosci. 21: 534–545. 2002. https://doi.org/10.1006/mcne.2002.1193
Holmes G.P., Negus K., Burridge L., Raman S., Algar E., Yamada T., Little M.H. Distinct but overlapping expression patterns of two vertebrate slit homologs implies functional roles in CNS development and organogenesis. Mech. Dev. 79: 57–72. 1998. https://doi.org/10.1016/s0925-4773(98)00174-9
Lin L., Rao Y., Isacson O. Netrin-1 and slit-2 regulate and direct neurite growth of ventral midbrain dopaminergic neurons. Mol. Cell. Neurosci. 28: 547–555. 2005. https://doi.org/10.1016/j.mcn.2004.11.009
Marillat V., Cases O., Nguyen-Ba-Charvet K.T., Tessier-Lavigne M., Sotelo C., Chedotal A. Spatiotemporal expression patterns of slit and robo genes in the rat brain. J. Comp. Neurol. 442: 130–155. 2002. https://doi.org/10.1002/cne.10068
Serafini T., Colamarino S.A., Leonardo E.D., Wang H., Beddington R., Skarnes W.C., Tessier-Lavigne M. Netrin-1 is required for commissural axon guidance in the developing vertebrate nervous system. Cell. 87: 1001–1014. 1996. https://doi.org/10.1016/S0092-8674(00)81795-X
Bagri A., Marin O., Plump A.S., Mak J., Pleasure S.J., Rubenstein J.L., Tessier-Lavigne M. Slit proteins prevent midline crossing and determine the dorsoventral position of major axonal pathways in the mammalian forebrain. Neuron. 33: 233–248. 2002. https://doi.org/10.1016/s0896-6273(02)00561-5
Gates M.A., Coupe V.M., Torres E.M., Fricker-Gates R.A., Dunnett S.B. Spatially and temporally restricted chemoattractive and chemorepulsive cues direct the formation of the nigro-striatal circuit. Eur. J. Neurosci. 19: 831–844. 2004. https://doi.org/10.1111/j.1460-9568.2004.03213.x
Flores C., Manitt C., Rodaros D., Thompson K.M., Rajabi H., Luk K.C., Tritsch N.X., Sadikot A.F., Stewart J., Kennedy T.E. Netrin receptor deficient mice exhibit functional reorganization of dopaminergic systems and do not sensitize to amphetamine. Mol. Psychiatry. 10: 606–612. 2005.
Härfstrand A., Fuxe K., Cintra A., Agnati L.F., Zini I., Wikström A.C., Okret S., Yu Z.Y., Goldstein M., Steinbusch H. Glucocorticoid receptor immunoreactivity in monoaminergic neurons of rat brain. Proc. Natl. Acad. Sci. U. S. A. 83 (24): 9779–9783. 1986. https://doi.org/10.1073/pnas.83.24.9779
Gillies G.E., Virdee K., Pienaar I., Al-Zaid F., Dalley J.W. Enduring, sexually dimorphic impact of in utero exposure to elevated levels of glucocorticoids on midbrain dopaminergic populations. Brain. Sci. 2016. 7 (1): 5. https://doi.org/10.3390/brainsci7010005
Becker J.B. Sex differences in addiction. Dialogues. Clin. Neurosci. 2016. 18 (4): 395–402.
Thomas M.B., Hu M., Lee T.M., Bhatnagar S., Becker J.B. Sex-specific susceptibility to cocaine in rats with a history of prenatal stress. Physiol. Behav. 2009. 97 (2): 270–277. https://doi.org/10.1016/j.physbeh.2009.02.025
Groenewegen H.J., Wright C.I., Beijer A.V., Voorn P. Convergence and segregation of ventral striatal inputs and outputs. Ann. N. Y. Acad. Sci. 877: 49–63. 1999. https://doi.org/10.1111/j.1749-6632.1999.tb09260.x
Omelchenko N., Sesack S.R. Glutamate synaptic inputs to ventral tegmental area neurons in the rat derive primarily from subcortical sources. Neuroscience. 146: 1259–1274. 2007. https://doi.org/10.1016/j.neuroscience.2007.02.016
Hanson G.R., Singh N., Merchant K., Johnson M., Gibb J.W. The role of NMDA receptor systems in neuropeptide responses to stimulants of abuse. Drug. Alcohol. Depend. 37: 107–110. 1995. https://doi.org/10.1016/0376-8716(94)01065-s
Valjent E., Corvol J.C., Pages C., Besson M.J., Maldonado R., Caboche J. Involvement of the extracellular signalregulated kinase cascade for cocaine-rewarding properties. J. Neurosci. 20: 8701–8709. 2000. https://doi.org/10.1523/JNEUROSCI.20-23-08701.2000
Jenab S., Festa E.D., Nazarian A., Wu H.B., Sun W.L., Hazim R., Russo S.J., Quinones-Jenab V. Cocaine induction of ERK proteins in dorsal striatum of Fischer rats. Mol. Brain. Res. 142: 134–138. 2005. https://doi.org/10.1016/j.molbrainres.2005.08.015
Robinson S.E., Maher J.R., McDowell K.P., Kunko P.M. Effects of cocaine and the cocaine analog CFT on glutamatergic neurons. Pharmacol. Biochem. Behav. 50: 627–633. 1995. https://doi.org/10.1016/0091-3057(94)00355-6
Smith J.A., Mo Q., Guo H., Kunko P.M., Robinson S.E. Cocaine increases extraneuronal levels of aspartate and glutamate in the nucleus accumbens. Brain. Res. 683: 264–269. 1995. https://doi.org/10.1016/0006-8993(95)00383-2
Reid M.S., Hsu K.J., Berger S.P. Cocaine and amphetamine preferentially stimulate glutamate release in the limbic system: studies on the involvement of dopamine. Synapse. 27: 95–105. 1997. https://doi.org/10.1002/(SICI)1098-2396(199710)27:2<95::AID-SYN1>3.0.CO;2-6
McKee B.L., Meshul C.K. Time-dependent changes in extracellular glutamate in the rat dorsolateral striatum following a single cocaine injection. Neuroscience. 133: 605–613. 2005. https://doi.org/10.1016/j.neuroscience.2005.02.020
Kalivas P.W., Duffy P. D1 receptors modulate glutamate transmission in the ventral tegmental area. J. Neurosci. 15: 5379–5388. 1995. https://doi.org/10.1523/JNEUROSCI.15-07-05379.1995
Kalivas P.W., Duffy P. Repeated cocaine administration alters extracellular glutamate in the ventral tegmental area. J. Neurochem. 70: 1497–1502. 1998. https://doi.org/10.1046/j.1471-4159.1998.70041497.x
White F.J., Hu X.T., Zhang X.F., Wolf M.E. Repeated administration of cocaine or amphetamine alters neuronal responses to glutamate in the mesoaccumbens dopamine system. J. Pharmacol. Exp. Ther. 273: 445–54. 1995.
Zhang X.F., Hu X.T., White F. J., Wolf M.E. Increased responsiveness of ventral tegmental area dopamine neurons to glutamate after repeated administration of cocaine or amphetamine is transient and selectively involves AMPA receptors. J. Pharmacol. Exp. Ther. 281: 699–706. 1997.
Gass J., Olive F. Glutamatergic substrates of drug addiction and alcoholism. Biochem. Pharmacol. 75 (1): 218–265. 2008. https://doi.org/10.1016/j.bcp.2007.06.039
Robinson T., Kolb B. Alterations in the morphology of dendrites and dendritic spines in the nucleus accumbens and prefrontal cortex following repeated treatment with amphetamine or cocaine. Eur. J. Neurosci. 11 (5): 1598–1604. 1999. https://doi.org/10.1046/j.1460-9568.1999.00576.x
Li Y., Kolb B., Robinson T. The location of persistent amphetamine induced changes in the density of dendritic spines on medium spiny neurons in the nucleus accumbens and caudate-putamen. Neuropsychopharmacology. 28 (6): 1082–1085. 2003. https://doi.org/10.1038/sj.npp.1300115
Berger M.A., Barros V.G., Sarchi M.I., Tarazi F.I., Antonelli M.C. Long-term effects of prenatal stress on dopamine and glutamate receptors in adult rat brain. Neurochem. Res. 27 (11): 1525–1533. 2002. https://doi.org/10.1023/a:1021656607278
Said N., Lakehayli S., El Khachibi M., El Ouahli M., Nadifi S., Hakkou F., Tazi A. Prenatal stress induces vulnerability to nicotine addiction and alters D2 receptors’ expression in the nucleus accumbens in adult rats. Neuroscience. 304: 279–285. 2015. https://doi.org/10.1016/j.neuroscience.2015.07.029
Решетников В.В., Лепешко А.А., Рябушкина Ю.А., Студеникина А.А., Меркулова Т.И., Бондарь Н.П. Отсроченные эффекты раннего постнатального стресса на когнитивные способности и экспрессию генов глутаматергической системы у мышей. Нейрохимия. 35 (2): 140–150. [Reshetnikov V.V., Lepeshko A.A., Ryabushkina Yu.A., Studenikina A.A., Merkulova T.I., Bondar N.P. The long-term effects of early postnatal stress on gognitive abilities and expression of genes of the glutamatergic system in mice. Neurochem. J. 35 (2): 140–150. (In Russ)] https://doi.org/10.7868/S1027813318020061
Fumagalli F., Pasini M., Frasca A., Drago F., Racagni G., Riva A.M. Prenatal stress alters glutamatergic system responsiveness in adult rat prefrontal cortex. J. Neurochem. 109 (6): 1733–1744. 2009. https://doi.org/10.1111/j.1471-4159.2009.06088.x
Kippin T.E., Szumlinski K.K., Kapasova Z., Rezner B., See R.E. Prenatal stress enhances responsiveness to cocaine. Neuropsychopharmacology. 33 (4): 769–782. 2008. https://doi.org/10.1038/sj.npp.1301447
Baier C.J., Pallarés M.E., Adrover E., Monteleone M.C., Marcela A Brocco M.A., Barrantes F.J., Antonelli M.C. Prenatal restraint stress decreases the expression of alpha-7 nicotinic receptor in the brain of adult rat offspring. Stress. 2015. 18 (4): 435–445. https://doi.org/10.3109/10253890.2015.1022148
Pastor V., Antonelli M.C., Pallarés M.E. Unravelling the link between prenatal stress, dopamine and substance use disorder. Neurotox. Res. 2017. 31: 169–186. https://doi.org/10.1007/s12640-016-9674-9
Dong E., Guidotti A., Zhang H., Pandey S.C. Prenatal stress leads to chromatin and synaptic remodeling and excessive alcohol intake comorbid with anxiety-like behaviors in adult offspring. Neuropharmacology. 2018. 140: 76–85. https://doi.org/10.1016/j.neuropharm.2018.07.010
Tagliaferro P., Morales M. Synapses between corticotrophin–releasing factor–containing axon terminals and dopaminergic neurons in the ventral tegmental area are predominantly glutamatergic. Neuropsychopharmacology. 33 (4): 769–782. 2008. https://doi.org/10.1038/sj.npp.1301447
Wang B., Shaham Y., Zitzman D., Azari S., Wise R.A., You Z.B. Cocaine experience establishes control of midbrain glutamate and dopamine by corticotropin-releasing factor: a role in stress-induced relapse to drug seeking. J. Neurosci. 25: 5389–5396. 2005. https://doi.org/10.1523/JNEUROSCI.0955-05.2005
Cratty M.S., Ward H.E., Johnson E.A., Azzaro A.J., Birkle D.L. Prenatal stress increases corticotropin-releasing factor (CRF) content and release in rat amygdala minces. Brain. Res. 675 (1–2): 297–302. 1995. https://doi.org/10.1016/0006-8993(95)00087-7
Ward H.E., Johnson E.A., Salm A.K., Birkle D.L. Effects of prenatal stress on defensive withdrawal behavior and corticotropin releasing factor systems in rat brain. Physiol. Behav. 70 (3–4): 359–366. 2000. https://doi.org/10.1016/s0031-9384(00)00270-5
Benowitz N.L. Pharmacology of nicotine: addiction, smoking – induced disease, and therapeutics. Annu. Rev. Pharmacol. Toxicol. 49: 57–71. 2009. https://doi.org/10.1146/annurev.pharmtox.48.113006.094742
Laviolette S.R., van der Kooy D. The neurobiology of nicotine addiction: bridging the gap from molecules to behavior. Nat. Rev. Neurosci. 5: 55–65. 2004. https://doi.org/10.1038/nrn1298
Wonnacott S., Sidhpura N., Balfour D.J. Nicotine: from molecular mechanisms to behaviour. Curr. Opin. Pharmacol. 5: 53–59. 2005. https://doi.org/10.1016/j.coph.2004.12.002
Picciotto M.R., Corrigall W.A. Neuronal systems underlying behaviors related to nicotine addiction: neural circuits and molecular genetics. J. Neurosci. 22: 3338–3341. 2002. https://doi.org/10.1523/JNEUROSCI.22-09-03338.2002
Watkins S.S., Koob G.F., Markou A. Neural mechanisms underlying nicotine addiction: acute positive reinforcement and withdrawal. Nicotine. Tob. Res. 2: 19–37. 2000. https://doi.org/10.1080/14622200050011277
Jones I.W., Wonnacott S. Precise localization of alpha7 nicotinic acetylcholine receptors on glutamatergic axon terminals in the rat ventral tegmental area. J. Neurosci. 24: 11244–11252. 2004. https://doi.org/10.1523/JNEUROSCI.3009-04.2004
Dani J.A., Bertrand D. Nicotinic acetylcholine receptors and nicotinic cholinergic mechanisms of the central nervous system. Annu. Rev. Pharmacol. Toxicol. 47: 699–729. 2007. https://doi.org/10.1146/annurev.pharmtox.47.120505.105214
Marchi M., Risso F., Viola C., Cavazzani P., Raiteri M. Direct evidence that release-stimulating alpha7 nicotinic cholinergic receptors are localized on human and rat brain glutamatergic axon terminals. J. Neurochem. 80 (6): 1071–1078. 2002. https://doi.org/10.1046/j.0022-3042.2002.00805.x
Fujii S., Ji Z., Morita N., Sumikawa K. Acute and chronic nicotine exposure differentially facilitate the induction of LTP. Brain. Res. 846: 137–143. 1999. https://doi.org/10.1016/s0006-8993(99)01982-4
Yamazaki Y., Jia Y., Hamaue N., Sumikawa K. Nicotine induced switch in the nicotinic cholinergic mechanisms of facilitation of long-term potentiation induction. Eur. J. Neurosci. 22: 845–860. 2005. https://doi.org/10.1111/j.1460-9568.2005.04259.x
Yamazaki Y., Jia Y., Niu R., Sumikawa K. Nicotine exposure in vivo induces long-lasting enhancement of NMDA receptor-mediated currents in the hippocampus. Eur. J. Neurosci. 23: 1819–1828. 2006. https://doi.org/10.1111/j.1460-9568.2006.04714.x
Toth E., Vizi E. S., Lajtha A. Effect of nicotine on levels of extracellular amino acids in regions of the rat brain in vivo. Neuropharmacology. 32 (8): 827–832. 1993. https://doi.org/10.1016/0028-3908(93)90192-6
Gioanni Y., Rougeot C., Clarke P.B., Lepouse C., Thier-ry A.M., Vidal C. Nicotinic receptors in the rat prefrontal cortex: increase in glutamate release and facilitation of mediodorsal thalamo-cortical transmission. Eur. J. Neurosci. 11: 18–30. 1999. https://doi.org/10.1046/j.1460-9568.1999.00403.x
Meshul C.K., Kamel D., Moore C., Kay T.S., Krentz L. Nicotine alters striatal glutamate function and decreases the apomorphine-induced contralateral rotations in 6-OHDAlesioned rats. Exp. Neurol. 175: 257–274. 2002. https://doi.org/10.1006/exnr.2002.7900
Reid M.S., Fox L., Ho L.B., Berger S.P. Nicotine stimulation of extracellular glutamate levels in the nucleus accumbens: neuropharmacological characterization. Synapse. 35 (2): 129–136. 2000. https://doi.org/10.1002/(SICI)1098-2396(200002)35:2<129::AID-SYN5>3.0.CO;2-D
Toth E., Sershen H., Hashim A., Vizi E.S., Lajtha A. Effect of nicotine on extracellular levels of neurotransmitters assessed by microdialysis in various brain regions: role of glutamic acid. Neurochem. Res. 17: 265–271. 1992. https://doi.org/10.1007/BF00966669
Mansvelder H.D., Mertz M., Role L.W. Nicotinic modulation of synaptic transmission and plasticity in cortico-limbic circuits. Semin. Cell. Dev. Biol. 20 (4): 432–440. 2009. https://doi.org/10.1016/j.semcdb.2009.01.007
Adriani W., Granstrem O., Macri S., Izykenova G., Dambinova S., Laviola G. Behavioral and neurochemical vulnerability during adolescence in mice: studies with nicotine. Neuropsychopharmacology. 29: 869–878. 2004. https://doi.org/10.1038/sj.npp.1300366
Wang F., Chen H., Steketee J.D., Sharp B.M. Upregulation of ionotropic glutamate receptor subunits within specific mesocorticolimbic regions during chronic nicotine selfadministration. Neuropsychopharmacology. 32: 103–109. 2007. https://doi.org/10.1038/sj.npp.1301033
Paterson N.E., Semenova S., Gasparini F., Markou A. The mGluR5 antagonist MPEP decreased nicotine self-administration in rats and mice. Psychopharmacology. 167 (3): 257–264. 2003. https://doi.org/10.1007/s00213-003-1432-z
Dravolina O.A., Zakharova E.S., Shekunova E.V., Zvartau E.E., Danysz W., Bespalov A.Y. mGlu1 receptor blockade attenuates cue- and nicotine-induced reinstatement of extinguished nicotine self-administration behavior in rats. Neuropharmacology. 52: 263–269. 2007. https://doi.org/10.1016/j.neuropharm.2006.07.023
Said N., Lakehayli S., El Khachibi M., El Ouahli M., Nadifi S., Hakkou F., Tazi A. Effect of prenatal stress on memory, nicotine withdrawal and 5HT1A expression in raphe nuclei of adult rats. Int. J. Dev. Neurosci. 43: 92–98. 2015. https://doi.org/10.1016/j.ijdevneu.2015.04.008
Koehl M., Bjijou Y., Le Moal M., Cador M. Nicotine-induced locomotor activity is increased by preexposure of rats to prenatal stress. Brain. Res. 882 (1–2): 196–200. 2000. https://doi.org/10.1016/s0006-8993(00)02803-1
Brady K.T., Sonne S.C. The role of stress in alcohol use, alcoholism treatment, and relapse. Alcohol. Res. Health. 23 (4): 263–271. 1999.
Breese G.R., Overstreet D.H., Knapp D.J., Navarro M. Prior multiple ethanol withdrawals enhance stress-induced anxiety-like behavior: inhibition by CRF1- and benzodiazepine-receptor antagonists and a 5-HT1a-receptor agonist. Neuropsychopharmacology. 2005. 30 (9): 1662–1669. https://doi.org/10.1038/sj.npp.1300706
Siegmund S., Vengeliene V., Singer M.V., Spanagel R. Influence of age at drinking onset on long-term ethanol self-administration with deprivation and stress phases. Alcohol. Clin. Exp. Res. 29 (7): 1139–1145. 2005. https://doi.org/10.1097/01.alc.0000171928.40418.46
Driessen M., Meier S., Hill A., Wetterling T., Lange W., Junghanns K. The Course of Anxiety, Depression and drinking behaviours after completed detoxification in alcoholics with and without comorbid anxiety and depressive disorders. Alcohol. Alcohol. 36 (3): 249–255. 2005. https://doi.org/10.1093/alcalc/36.3.249
Moghaddam B., Bolinao M.L. Biphasic effect of ethanol on extracellular accumulation of glutamate in the hippocampus and nucleus accumbens. Neurosci. Lett. 178: 99–102. 1994. https://doi.org/10.1016/0304-3940(94)90299-2
Roberto M., Shweitzer P., Madamba S.G., Stouffer D.G., Parsons L.H., Siggins G.R. Acute and chronic ethanol alter glutamatergic transmission in rat central amygdala: an in vitro and in vivo analysis. J. Neurosci. 24: 1594–1603. 2004. https://doi.org/10.1523/JNEUROSCI.5077-03.2004
Selim M., Bradberry C.W. Effect of ethanol on extracellular 5-HT and glutamate in the nucleus accumbens and prefrontal cortex: comparison between the lewis and fischer 344 rat strains. Brain. Res. 716 (1–2): 157–164. 1996. https://doi.org/10.1016/0006-8993(95)01385-7
Lovinger D.M., White G., Weight F.F. Ethanol inhibits NMDA activated ion current in hippocampal neurons. Science. 243: 1721–1724. 1989. https://doi.org/10.1126/science.2467382
Lima-Landman M.T., Albuquerque E.X. Ethanol potentiates and blocks NMDA-activated single-channel currents in rat hippocampal pyramidal cells. FEBS. Lett. 247: 61–67. 1989. https://doi.org/10.1016/0014-5793(89)81241-4
Hoffman P.L., Rabe C.S., Moses F., Tabakoff B. N-Methyl-Daspartate receptors and ethanol: inhibition of calcium flux and cyclic GMP production. J. Neurochem. 52: 1937–1940. 1989. https://doi.org/10.1111/j.1471-4159.1989.tb07280.x
Nie Z., Madamba S.G., Siggins G.R. Ethanol inhibits glutamatergic neurotransmission in nucleus accumbens neurons by multiple mechanisms. J. Pharmacol. Exp. Ther. 271 (3): 1566–1573. 1994.
Stobbs S.H., Ohran A.J., Lassen M.B., Allison D.W., Brown J.E., Steffensen S.C. Ethanol suppression of ventral tegmental area GABA neuron electrical transmission involves N-methyl-D-aspartate receptors. J. Pharmacol. Exp. Ther. 311 (1): 282–289. 2004. https://doi.org/10.1124/jpet.104.071860
McBride W.J., Murphy J.M., Gatto G.J., Levy A.D., Yoshimoto K., Lumeng L., Li T.K. CNS mechanisms of alcohol self-administration. Alcohol. Alcohol. Suppl. 2: 463–467. 1993.
Suvarna N., Borgland S.L., Wang J., Phamluong K., Auberson Y.P., Bonci A., Ron D. Ethanol alters trafficking and functional N-methyl-D-aspartate receptor NR2 subunit ratio via HRas. J. Biol. Chem. 280: 31450–31459. 2005. https://doi.org/10.1074/jbc.M504120200
Masood K., Wu C., Brauneis U., Weight F.F. Differential ethanol sensitivity of recombinant N-methyl-D-aspartate receptor subunits. Mol. Pharmacol. 45: 324–329. 1994.
Wang J., Carnicella S., Phamluong K., Jeanblanc J., Ronesi J.A., Chaudhri N., Janak P.H., Lovinger D.M., Ron D. Ethanol induces long-term facilitation of NR2B-NMDA receptor activity in the dorsal striatum: implications for alcohol drinking behavior. J. Neurosci. 27: 3593–3602. 2007. https://doi.org/10.1523/JNEUROSCI.4749-06.2007
Ferrani-Kile K., Randall P.K., Leslie S.W. Acute ethanol affects phosphorylation state of the NMDA receptor complex: implication of tyrosine phosphatases andprotein kinase A. Mol. Brain. Res. 115: 78–86. 2003. https://doi.org/10.1016/s0169-328x(03)00186-4
Snell L.D., Tabakoff B., Hoffman P.L. Involvement of protein kinase C in ethanol-induced inhibition of NMDA receptor function in cerebellar granule cells. Alcohol. Clin. Exp. Res. 18: 81–85. 1994. https://doi.org/10.1111/j.1530-0277.1994.tb00884.x
Trevisan L., Fitzgerald L.W., Brose N., Gasic G.P., Heinemann S.F., Duman R.S., Nestler E.J. Chronic ingestion of ethanol upregulates NMDAR1 receptor subunit immunoreactivity in rat hippocampus. J. Neurochem. 62: 1635–1638. 1994. https://doi.org/10.1046/j.1471-4159.1994.62041635.x
Sircar R., Sircar D. Repeated ethanol treatment in adolescent rats alters cortical NMDA receptor. Alcohol. 2006. 39: 51–58.
Narita M., Soma M., Narita M., Mizoguchi H., Tseng L.F., Suzuki T. Implications of the NR2B subunit-containing NMDA receptor localized in mouse limbic forebrain in ethanol dependence. Eur. J. Pharmacol. 401: 191–195. 2000. https://doi.org/10.1016/s0014-2999(00)00428-3
Sircar R. Ethanol alters N-methyl-D-aspartate receptor regulation in the hippocampus of adolescent rats. Neuroreport. 28 (11): 625–629. 2017. https://doi.org/10.1097/WNR.0000000000000787
Chandler L.J., Norwood D., Sutton G. Chronic ethanol upregulates NMDA and AMPA, but not kainate receptor subunit proteins in rat primary cortical cultures. Alcohol. Clin. Exp. Res. 23: 363–370. 1999.
Bruckner M.K., Rossner S., Arendt T. Differential changes in the expression of AMPA receptors genes in rat brain after chronic exposure to ethanol: an in situ hybridization study. J. Hirnforsch. 38: 369–376. 1997.
Tsai G., Coyle J.T. The role of glutamatergic neurotransmission in the pathophysiology of alcoholism. Annu. Rev. Med. 49: 173–184. 1998. https://doi.org/10.1146/annurev.med.49.1.173
Tsai G., Gastfriend D.R., Coyle J.T. The glutamatergic basis of human alcoholism. Am. J. Psychiatry. 152: 332–340. 1995. https://doi.org/10.1176/ajp.152.3.332
Smith T.L. Selective effects of ethanol exposure on metabotropic glutamate receptor and guanine nucleotide stimulated phospholipase C activity in primary cultures of astrocytes. Alcohol. 11: 405–409. 1994. https://doi.org/10.1016/0741-8329(94)90025-6
Simonyi A., Christian M.R., Sun A.Y., Sun G.Y. Chronic ethanol-induced subtype- and subregion-specific decrease in the mRNA expression of metabotropic glutamate receptors in rat hippocampus. Alcohol. Clin. Exp. Res. 28: 1419–1423. 2004. https://doi.org/10.1097/01.alc.0000139825.35438.a4
Ortiz J., Fitzgerald L.W., Charlton M., Lane S., Trevisan L., Guitart X., Shoemaker W., Duman R.S., Nestler E.J. Biochemical actions of chronic ethanol exposure in the mesolimbic dopamine system. Synapse. 21: 289–298. 1995. https://doi.org/10.1002/syn.890210403
Weinberg J. Effects of early experience on responsiveness to ethanol: a preliminary report. Physiol. Behav. 40: 401–406. 1987. https://doi.org/10.1016/0031-9384(87)90068-0
Van Waes V., Enache M., Berton O., Vinner E., Lhermitte M., Maccari S., Darnaudéry M. Effect of prenatal stress on alcohol preference and sensitivity to chronic alcohol exposure in male rats. Psychopharmacology. 214 (1): 197–208. 2011. https://doi.org/10.1007/s00213-009-1765-3
King A., Munisamy G., de Wit H., Lin S. Attenuated cortisol response to alcohol in heavy social drinkers. Int. J. Psychophysiol. 59 (3): 203–209. 2006. https://doi.org/10.1016/j.ijpsycho.2005.10.008
Richardson H.N., Lee S.Y., O’Dell L.E., Koob G.F., Rivier C.L. Alcohol self-administration acutely stimulates the hypothalamicpituitary- adrenal axis, but alcohol dependence leads to a dampened neuroendocrine state. Eur. J. Neurosci. 28: 1641–1653. 2008. https://doi.org/10.1111/j.1460-9568.2008.06455.x
Van Waes V., Enache M., Dutriez I., Lesage J., Morley-Fletcher S., Vinner E., Lhermitte M., Vieau D., Maccari S., Darnaudery M. Hyporesponse of the hypothalamic-pituitary-adrenocortical axis after an ethanol challenge in prenatally stressed adolescent male rats. Eur J. Neurosci. 24: 1193–1200. 2006. https://doi.org/10.1111/j.1460-9568.2006.04973.x
Maccari S., Morley-Fletcher S. Effects of prenatal restraint stress on the hypothalamus-pituitary-adrenal axis and related behavioural and neurobiological alteration. Psychoneuroendocrinology. 32: S10–S15. 2007. https://doi.org/10.1016/j.psyneuen.2007.06.005
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


