Журнал эволюционной биохимии и физиологии, 2020, T. 56, № 7, стр. 519-523
СРАВНИТЕЛЬНОЕ ИССЛЕДОВАНИЕ ФОТОХИМИИ МИКРОБИАЛЬНЫХ РОДОПСИНОВ (I ТИПА) И РОДОПСИНОВ ЖИВОТНЫХ (II ТИПА)
А. С. Медведева 1, О. А. Смитиенко 1, Т. Б. Фельдман 1, 2, М. А. Островский 1, 2, *
1 Институт биохимической физики им. Н.М. Эмануэля РАН
Москва, Россия
2 Кафедра молекулярной физиологии Биологического факультета МГУ им. М.В. Ломоносова
Москва, Россия
* E-mail: ostrovsky3535@mail.ru
Поступила в редакцию 10.07.2020
После доработки 26.08.2020
Принята к публикации 26.08.2020
Аннотация
Светочувствительные белки родопсины представлены во всех царствах живых организмов. Родопсины I типа (микробиальные) как правило, выполняют фотоэнергетическиую функцию; большинство родопсинов II типа – фоторецепторные белки животных. В работе представлено сравнение спектральных характеристик и фотохимических реакций трех различных родопсинов: бактериородопсина галофильной архебактерии H. salinarum, родопсина почвенной психротрофной бактерии E. sibiricum и зрительного родопсина палочек быка. Рассматривается стационарное поглощение белков, параметры фотохимической реакции, такие как скорость изомеризации хромофора (ретиналя) и образования первых продуктов, а также вероятность обратной фотореакции и наличие спонтанной тепловой изомеризации ретиналя. Предполагается, что в ходе эволюции механизм взаимодействия ретиналя с ближайшим белковым окружением в хромофорном центре зрительных родопсинов животных (родопсинов II типа) как фотоинформационных белков стал более совершенным и специфичным.
Родопсины – это ретиналь-содержащие белки (РСБ), представляют собой обширную группу светочувствительных трансмембранных белков, преобразующих энергию света для выполнения различных биологических функций у представителей всех царств живых организмов.
Большое количество представителей родопсинов I типа или микробиальных родопсинов функционируют как ионные насосы, выполняя фотоэнергетическую функцию (простейший фотосинтез) [1–4]. Большинство родопсинов II типа функционируют как G-белок-связывающие рецепторы животных, обеспечивая фотоинформационную, в первую очередь зрительную, функцию [5]. Общей для всех родопсинов является структура апобелка (опсина), представленная семью трансмембранными α-спиралями и хромофорной группой (ретиналь), ковалентно связанной с лизиновым остатком опсина в седьмой α-спирали. Хромофорный центр – наиболее консервативный домен всех РСБ. Белковое окружение ретиналя обеспечивает спектральную настройку РСБ и способствует его сверхбыстрой фотоизомеризации, протекающей в фемтосекундном временном диапазоне [6, 7] с высоким квантовым выходом [8, 9] и являющейся первичной реакцией в процессе функционирования РСБ. В процессе этой фотохимической реакции происходит запасание энергии кванта света в химическую энергию конформационных перестроек белка, которая будет использована в дальнейшем для выполнения различных функций. Интересно отметить тот факт, что аналогичная реакция фотоизомеризации ретиналя в растворе протекает с небольшим квантовым выходом и в 2.5–6 раз медленнее, чем в белковом окружении [10, 11].
Несмотря на обширные литературные данные, касающиеся родопсинов и I, и II типов, некоторые фундаментальные вопросы остаются открытыми. Один из таких вопросов – их эволюционное происхождение, единого мнения по которому не существует. Считается, что родопсины I типа (например, бактериородопсин) появились одновременно с возникновением биосферы Земли, около 3–3.5 млрд лет назад, а родопсины II типа как G-белок-связывающие белки – около 1 млрд лет назад (подробнее см. [12]). Несмотря на похожую структуру, эти белки не обнаруживают сходства на уровне аминокислотной последовательности [13]. Поэтому можно предположить, что они могли возникнуть независимо, в результате конвергентной эволюции. С другой стороны, нельзя исключить и того, что они могли произойти от общего утерянного предшественника [14].
В этой связи сравнение характеристик родопсинов I и II типов, связанных с их функциями, представляет существенный интерес. В данной работе представлен обзор полученных нами ранее результатов, касающихся сравнения спектральных характеристик, и фотохимических реакций трех различных родопсинов [15–23]. Два из них – представители родопсинов I типа: бактериородопсин галофильной архебактерии Halobaсterium salinarum (BR) и недавно открытый родопсин (ESR) почвенной психротрофной бактерии Exiguobacterium sibiricum, найденной в сибирской вечной мерзлоте возрастом около 3 млн лет [24]. ESR близок по строению к протонным насосам морских бактерий – протеородопсину и ксантородопсину, и в меньшей степени протонному насосу – BR [25, 26]. Третий родопсин – это классический зрительный родопсин II типа – родопсин палочек быка Bos taurus (Rh). Спектральные характеристики и фотохимические реакции Rh, BR и ESR исследовались нами методами стационарной спектрофотометрии и фемтосекундной абсорбционной лазерной спектроскопии.
Все представители родопсинов I и II типов характеризуются широкой полосой поглощения c весьма высоким коэффициентом экстинкции, в нашем случае с максимумами 498 нм (Rh), 568 нм (BR) и 528 нм (ESR). Положение максимума полосы поглощения каждого белка адаптировано к спектральной характеристике световой среды, в которой он функционирует. По существу, положение максимума полосы поглощения родопсинов и I, и II типов подчиняется законам дарвиновского естественного отбора. Ярким тому примером может служить спектральная настройка родопсина двух популяций креветок одного и того же вида Mysis relicta [27–29]. Одна из популяций обитает в почти полной темноте в глубоком озере, куда доходит лишь немного света в области 680 нм, и у которой, соответственно, максимум спектра поглощения родопсина смещён в длинноволновую область (560 нм). Другая, морская популяция, обитает в прибрежных водах, куда доходит больше света, в том числе коротковолновый свет. Максимум спектра поглощения родопсина у этой популяции смещён в коротковолновую область – 530 нм.
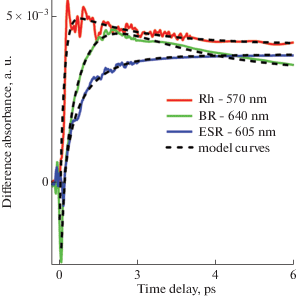
Что касается параметров фотохимической реакции, то между родопсинами I и II типов просматриваются различия, связанные с особенностями строения хромофорного центра, а также, с конформацией хромофора – полностью-транс (родопсины I типа) и 11-цис (родопсины II типа) ретиналя. При поглощении кванта света хромофорная группа РСБ переходит в электронно-возбужденное состояние. Переход затем в основное состояние сопровождается изомеризацией ретиналя, скорость которой сильно отличается в родопсинах I и II типов. В случае BR и ESR первый фотопродукт с изомеризованным ретиналем (интермедиат J) образуется за 500 и 700 фс, соответственно (рис. 1) [6, 21–23]. Для BR квантовый выход этой реакции довольно высок и составляет ϕ = 0.64 [8]. В случае Rh фотоизомеризация ретиналя происходит за более короткое время, а именно, всего за 50–80 фс [18, 30–32] и также с высоким квантовым выходом ϕ = 0.65 [9]. Это самая быстрая реакция в фотохимии, известная на сегодняшнее время. Фотоизомеризация ретиналя приводит к образованию первого продукта – фотородопсина (рис. 1). Сверхбыструю изомеризацию в Rh связывают с отсутствием у 11-цис ретиналя, в отличие от полностью-транс ретиналя микробиальных родопсинов, небольшого барьера на поверхности потенциальной энергии возбужденного состояния, а также со строением хромофорного центра, в частности с сильным электростатическим взаимодействием ретиналя с ароматическим кластером [33]. Существенное различие в скорости фотореакции родопсинов I и II типов представляется функционально важным.
Рис. 1.
Кинетические кривые фотоиндуцированного поглощения Rh, BR и ESR, представленные на характерных длинах волн зондирования (сплошные линии), а также соответствующие модельные экспоненциальные кривые (пунктирные линии), позволившие определить характерные времена наблюдаемых процессов. Время образования первичных промежуточных продуктов фотореакций Rh, BR и ESR с изомеризованным ретиналем составило 50−100 фс для фотородопсина (Rh), 500 фс для продукта J (BR) и 700 фс для продукта J (ESR). Время образования следующих промежуточных продуктов – батородопсина (Rh), продукта K (BR) и продукта K (ESR) составило 2, 1.8 и 6.3 пс, соответственно. Экспоненциальные кривые были построены независимо на разных длинах волн в широком спектральном диапазоне. Значение характерного времени определенного процесса было рассчитано как среднее, с учетом всех длин волн, на которых данный процесс наблюдался и доминировал.
Fig. 1. Kinetic curves of the Rh, BR and ESR photoinduced absorption, presented at the characteristic probing wavelengths (solid lines), as well as the corresponding model exponential curves (dotted lines), which made it possible to determine the characteristic times of the observed processes. The formation times of the primary intermediate products of Rh, BR and ESR photoreactions with isomerized retinal were 50−100 fs for photorhodopsin (Rh), 500 fs for product J (BR), and 700 fs for product J (ESR). The formation times of the following intermediate products – bathorhodopsin (Rh), product K (BR), and product K (ESR), were 2, 1.8, and 6.3 ps, respectively. Exponential curves were plotted independently at different wavelengths over a wide spectral range. The value of the characteristic time of a certain process was calculated as an average, taking into account all wavelengths at which this process was observed and dominated.
Еще одним функциональным преимуществом родопсина II типа (Rh), связанным со структурой его хромофорного центра и взаимодействием с хромофорной группой, является практически полное отсутствие спонтанной тепловой изомеризации 11-цис ретиналя в темноте, подобной темновой, спонтанной изомеризации полностью-транс→13-цис в молекуле BR и некоторых других родопсинов I типа [34]. Это связано с высоким тепловым барьером изомеризации 11-цис ретиналя в Rh (45 ккал/моль), что препятствует ложному запуску процесса фототрансдукции [35, 36]. Физиологический смысл столь высокого теплового барьера изомеризации 11-цис ретиналя и столь высокой скорости и эффективности его фотоизомеризации состоит в том, чтобы, с одной стороны, исключить ложное срабатывание Rh в темноте (уменьшить, насколько это возможно, темновой, тепловой шум) и, с другой стороны, чтобы использовать энергию поглощенного кванта света именно для фотохимической реакции изомеризации с минимальной возможностью ее рассеяния в виде тепла или высвечивания в виде флуоресценции (квантовый выход флуоресценции Rh исключительно мал – 1.2 × 10–5 [37]).
Для всех РСБ характерны обратные фотореакции, которые могут быть инициированы из разных промежуточных продуктов прямой фотореакции. Важным отличием родопсинов II типа от родопсинов I типа в отношении обратных фотореакций является то, что эффективность обратной фотоизомеризации ретиналя (полностью-транс→11-цис) в раннем продукте зрительного родопсина – батородопсине в пять раз меньше обратной фотоизомеризации ретиналя (13-цис→полностью-транс) в продукте K бактериородопсина [31]. Иными словами, вероятность обратной фотореакции в зрительном родопсине существенно меньше, чем в микробиальном.
Судя по всему, в ходе эволюции РСБ внутримолекулярный механизм взаимодействия ретиналя как хромофорной группы с его ближайшим белковым окружением в хромофорном центре стал более совершенным и специфичным для зрительных родопсинов как фотоинформационных белков по сравнению с более древними микробиальными родопсинами как, в основном, фотоэнергетическими (фотосинтез) белками. Такое совершенство и специфичность хромофорного центра зрительного родопсина обеспечивают надёжность и эффективность прямой реакции фотоизомеризации 11-цис ретиналя, запускающей процесс фототрансдукции.
Работа поддержана Российским фондом фундаментальных исследований (№ 18-015-00305, № 17-00-00166).
Список литературы
Ernst O.P., Lodowski D.T., Elstner M., Hegemann P., Brown L.S., Kandori H. Microbial and animal rhodopsins: structures, functions, and molecular mechanisms. Chem. Rev. 114: 126−163. 2014. https://doi.org/10.1021/cr4003769
Kurihara M., Sudo Y. Microbial rhodopsins: wide distribution, rich diversity and great potential. BPPB. 12: 121–129. 2015. https://doi.org/10.2142/biophysico.12.0_121
Kandori H. Ion-pumping microbial rhodopsins. Front. Mol. Biosci. 2: 52. 2015. https://doi.org/10.3389/fmolb.2015.00052
Gushchin I. and Gordeliy V. Microbial rhodopsins. Membrane protein complexes: structure and function. Subcellular Biochemistry. Ed. Harris J., Boekema E. Singapore. Springer: 2018. https://doi.org/10.1007/978-981-10-7757-9
Ostrovsky M.A. and Feldman T.B. Chemistry and molecular physiology of vision: Light-sensitive protein rhodopsin. Russ. Chem. Rev. 81(11): 1071–1090. 2012. https://doi.org/10.1070/RC2012v081n11ABEH004309
Dobler J., Zinth W., Kaiser W., Oesterhelt D. Excited-state reaction dynamics of bacteriorhodopsin studied by femtosecond spectroscopy. Chem. Phys. Lett. 144: 215−220. 1988. https://doi.org/10.1016/0009-2614(88)87120-3
Schoenlein R.W., Peteanu L.A., Mathies R.A., Shank C.V. The first step in vision: femtosecond isomerization of rhodopsin. Science. New Series. 254: 412−415. 1991. https://doi.org/10.1126/science.1925597
Govindjee R., Balashov S.P., Ebrey T.G. Quantum efficiency of the photochemical cycle of bacteriorhodopsin. Biophys. J. 58: 597−608. 1990. https://doi.org/10.1016/s0006-3495(90)82403-6
Kim J.E., Tauber M.J., Mathies R.A. Wavelength dependent cis-trans isomerization in vision. Biochemistry. 40(46): 13774–13778. 2001. https://doi.org/10.1021/bi0116137
Zgrablic G., Novello A.M., Parmigiani F. Population branching in the conical intersection of the retinal chromophore revealed by multipulse ultrafast optical spectroscopy. J. Am. Chem. Soc. 134: 955−961. 2012. https://doi.org/10.1021/ja205763x
Kandori H., Katsuta Y., Ita M., Sasabe H. Femtosecond fluorescence study of the rhodopsin chromophore in solution. J. Am. Chem. SOC. 117: 2669−2670. 1995. https://doi.org/10.1021/ja00114a040
Ostrovsky M.A. Rhodopsin: evolution and comparative physiology. Paleontol. J. 51(5): 562–572. 2017. https://doi.org/10.1134/S0031030117050069
Shen L., Chen C., Zheng H., Jin L. The evolutionary relationship between microbial rhodopsins and Metazoan rhodopsins. Sci. World J. 2013: 435651. 2013. https://doi.org/10.1155/2013/435651
Mackin A., Roy R.A., Theobald D.L. An empirical test of convergent evolution in rhodopsins. Mol. Biol. Evol. 31: 85–95. 2014. https://doi.org/10.1093/molbev/mst171
Smitienko O.A., Shelaev I.V., Gostev F.E., Fel’dman T.B., Nadtochenko V.A., Sarkisov O.M., Ostrovsky M.A. Coherent processes in formation of primary products of rhodopsin photolysis. Dokl. Biochem. Biophys. 421: 194–198. 2008. https://doi.org/10.1134/S160767290804008X
Smitienko O.A., Mozgovaya M.N., Shelaev I.V., Gostev F.E., Feldman T.B., Nadtochenko V.A., Sarkisov O.M., Ostrovsky M.A. Femtosecond formation dynamics of primary photoproducts of visual pigment rhodopsin. Biochemistry (Moscow). 75(1): 25–35. 2010. https://doi.org/10.1134/S0006297910010049
Mozgovaya M.N., Smitienko O.A., Shelaev I.V., Gos-tev F.E., Feldman T.B., Nadtochenko V.A., Sarkisov O.M., Ostrovsky M.A. Photochromism of visual pigment rhodopsin on the femtosecond time scale: coherent control of retinal chromophore isomerization. Dokl. Biochem. Biophys. 435: 302–306. 2010. https://doi.org/10.1134/S1607672910060062
Nadtochenko V.A., Smitienko O.A., Feldman T.B., Mozgovaya M.N., Shelaev I.V., Gostev F.E., Sarkisov O.M., Ostrovsky M.A. Conical intersection participation in femtosecond dynamics of visual pigment rhodopsin chromophore cis-trans photoisomerization. Dokl. Biochem. Biophys. 446: 242–246. 2012. https://doi.org/10.1134/S1607672912050080
Smitienko O., Nadtochenko V., Feldman T., Balatskaya M., Shelaev I., Gostev F., Sarkisov O., Ostrovsky M. Femtosecond laser spectroscopy of the rhodopsin photochromic reaction: a concept for ultrafast optical molecular switch creation (ultrafast reversible photoreaction of rhodopsin). Molecules. 19: 18351–18366. 2014. https://doi.org/10.3390/molecules191118351
Shelaev I.V., Mozgovaya M.N., Smitienko O.A., Gostev F.E., Feldman T.B., Nadtochenko V.A., Sarkisov O.M., Ostrovskii M.A. Femtosecond dynamics of primary processes in visual pigment rhodopsin. Russ. J. Phys. Chem. B. 8(4): 510–517. 2014. https://doi.org/10.1134/S1990793114040101
Feldman T.B., Smitienko O.A., Shelaev I.V., Gostev F.E., Nekrasova O.V., Dolgikh D.A., Nadtochenko V.A., Kirpichnikov M.P., Ostrovsky M.A. Femtosecond spectroscopic study of photochromic reactions of bacteriorhodopsin and visual rhodopsin. J. Photochem. Photobiol. B. Biol. 164: 296–305. 2016. https://doi.org/10.1016/j.jphotobiol.2016.09.041
Smitienko O.A., Nekrasova O.V., Kudriavtsev A.V., Yakovleva M.A., Shelaev I.V., Gostev F.E., Dolgikh D.A., Kolchugina I.B., Nadtochenko V.A., Kirpichnikov M.P., Feldman T.B., Ostrovsky M.A. Femtosecond and picosecond dynamics of recombinant bacteriorhodopsin primary reactions compared to the native protein in trimeric and monomeric forms. Biochemistry Moscow. 82(4): 490–500. 2017. https://doi.org/10.1134/S0006297917040113
Smitienko O.A., Feldman T.B., Petrovskaya L.E., Nekrasova O.V., Yakovleva M.A., Shelaev I.V., Gostev F.E., Cherepanov D.A., Kolchugina I.B., Dolgikh D.A., Nadtochenko V.A., Kirpichnikov M.P., Ostrovsky M.A. Comparative femtosecond spectroscopy of primary photoreactions of Exiguobacterium sibiricum rhodopsin and Halobacterium salinarum bacteriorhodopsin. J. Phys. Chem. B. 2020. (in press).
Rodrigues D.F., Ivanova N., He Z., Huebner M., Zhou J., Tiedje J.M. Architecture of thermal adaptation in an Exiguobacterium sibiricum strain isolated from 3 million year old permafrost: A genome and transcriptome approach. BMC Genom. 9: 547. 2008. https://doi.org/10.1186/1471-2164-9-547
Gushchin I., Chervakov P., Kuzmichev P., Popov A.N., Round E., Borshchevskiy V., Ishchenko A., Petrovskaya L., Chupin V., Dolgikh D.A., Arseniev A.S., Kirpichnikov M., Gordeliy V. Structural insights into the proton pumping by unusual proteorhodopsin from nonmarine bacteria. Proc. Natl. Acad. Sci. USA. 110: 12631−12636. 2013. https://doi.org/10.1073/pnas.1221629110
Petrovskaya L., Balashov S., Lukashev E., Imasheva E., Gushchin I.Y., Dioumaev A., Rubin A., Dolgikh D., Gordeliy V., Lanyi J. ESR – a retinal protein with unusual properties from Exiguobacterium sibiricum. Biochemistry (Moscow). 80: 688−700. 2015. https://doi.org/10.1134/s000629791506005x
Jokela-Määttä M., Pahlberg J., Lindström M., Zak P., Porter M., Ostrovsky M.A., Cronin T.W., Donner K. Visual pigment absorbance and spectral sensitivity of Mysis relicta (Crustacea, Mysida) in different light environments. J. Comp. Physiol. A. 191: 1087−1097. 2005. https://doi.org/10.1007/s00359-005-0039-8
Feldman T., Yakovleva M., Lindström M., Donner K., Ostrovsky M. Eye adaptation to different light environments in two populations of Mysis relicta: a comparative study of carotenoids and retinoids. J. Crust. Biol. 30(4): 636−642. 2010. https://doi.org/10.1651/09-3218.1
Belikov N., Yakovleva M., Feldman T., Demina O., Khodonov A., Lindström M., Donner K., Ostrovsky M. Lake and sea populations of Mysis relicta (Crustacea, Mysida) with different visual-pigment absorbance spectra use the same A1 chromophore. PLoS ONE. 9(2): 1−8. 2014. https://doi.org/10.1371/journal.pone.0088107
Polli D., Altoè P., Weingart O., Spillane K.M., Manzoni C., Brida D., Tomasello G., Orlandi G., Kukura P., Mathies R.A. Conical intersection dynamics of the primary photoisomerization event in vision. Nature. 467: 440−443. 2010. https://doi.org/10.1038/nature09346
Johnson P.J., Halpin A., Morizumi T., Prokhorenko V.I., Ernst O.P., Miller R.J.D. Local vibrational coherences drive the primary photochemistry of vision. Nature Chem. 7:980–986. 2015. https://doi.org/10.1038/nchem.2398
Mathies R.A. A coherent picture of vision. Nature Chem. 7: 945–947. 2015. https://doi.org/10.1038/nchem.2406
Kholmurodov Kh.T., Feldman T.B., Ostrovsky M.A. Interaction of chromophore, 11-cis-retinal, with amino acid residues of the visual pigment rhodopsin in the region of protonated Schiff base: a molecular dynamics study. Russ. Chem. Bull. International Edition. 56(1): 20–27. 2007. https://doi.org/10.1007/s11172-007-0004-5
Oesterhelt D., Meentzen M., Schuhmann L. Reversible dissociation of the purple complex in bacteriorhodopsin and identification of 13-cis and all-trans-retinal as its chromophores. Eur. J. Biochem. 40: 453−463. 1973. https://doi.org/10.1111/j.1432-1033.1973.tb03214.x
Baylor D.A., Nunn B.J., Schnapf J.L. The photocurrent, noise and spectral sensitivity of rods of the monkey Macaca fascicularis. J. Physiol. 357: 575−607. 1984. https://doi.org/10.1113/jphysiol.1984.sp015518
Baylor D.A. Photoreceptor signals and vision. Proctor lecture. Invest. Ophthalmol. Vis. Sci. 28(1): 34−49. 1987.
Doukas A.G., Junnarkar M.R., Alfano R.R., Callender R.H., Kakitani T., Honig. B. Fluorescence quantum yield of visual pigments: Evidence for subpicosecond isomerization rates. Proc. Natl. Acad. Sci. USA. 81: 4790−4794. 1984. https://doi.org/10.1073/pnas.81.15.4790
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


