Журнал эволюционной биохимии и физиологии, 2020, T. 56, № 7, стр. 651-652
ПУТИ АКТИВАЦИИ Е3-УБИКВИТИН ЛИГАЗ ПРИ ФУНКЦИОНАЛЬНОЙ РАЗГРУЗКЕ МЫШЦ
Т. Л. Немировская *
ГНЦ РФ Институт медико-биологических проблем РАН
Москва, Россия
* E-mail: Nemirovskaya@bk.ru
При гипокинезии скелетные мышцы подвергаются атрофии. Плохо изучены сигнальные пути, инициирующие экспрессию основных мышечных E3-лигаз (atrogin-1 и MuRF-1), убиквитинирующих белки при функциональной разгрузке мышц. Известна роль Akt/mTOR/p70S6k сигнального пути, при супрессии которого во время разгрузки транскрипционный фактор FOXO может дефосфорилироваться, проникать в ядро и запускать экспрессию Е3-лигаз. Однако мы нередко сталкивались со случаями, когда экспрессия Е3-лигаз работала рассогласовано с фосфорилированием пути Akt-FOXO. Вероятно, при разгрузке мышц работают другие сигнальные пути, активирующие работу Е3 лигаз. Мы обнаружили, что гистондеацетилазы (HDACs) 1, а также 4/5 регулируют экспрессию Е3 лигазы atrogin-1 с помощью транскрипционных факторов миогенина и TFEB при разгрузке мышц. Мы также показали, что p38 MAPK (одна из трех MAP киназ, которые активируются фосфорилированием: p38 MAPK, ERK и JNK) регулирует экспрессию MuRF-1 (но не atrogin-1), влияя на фосфорилорование FOXO3 при разгрузке мышц. Известно, что при функциональной разгрузке мышц происходит накопление макроэргических фосфатов (АТФ, PCr) и ионов Ca в мышечных волокнах (Ohira Y. et al., 1994, Shenkman B.S., Nemirovskaya T.L., 2008). Для многих тканей внеклеточный АТФ является основным аутокринно-паракринным медиатором клеточной сигнализации. Мы предположили, что АТФ и “медленный” Са могут стимулировать запуск внутриклеточных сигнальных путей и атрофических процессов при разгрузке мышц. Мы показали, что ингибирование паннексиновых каналов при 3х-дневной мышечной разгрузке предотвращает экспрессию MuRF-1. Механизм этого процесса может быть таким: при разгрузке АТФ из мышцы через паннексиновые каналы выходит во внеклеточное пространство. Нуклеотиды затем могут взаимодействовать с каналами P2Y (G protein Y-coupled receptors), которые активируют PI3-киназу гамма (PI3K) (в Т-каналах мембраны и, в конечном итоге, IP3 рецепторы (IP3R), находящиеся в ядре и саркоплазматическом ретикулуме). Активация IP3R может вызывать слабый сигнал высвобождения кальция, который способствует (возможно, с другими сигнальными каскадами) активации транскрипционных факторов, что приводит к экспрессии или репрессии генов, участвующих в модуляции фенотипа мышц. Эта гипотеза в настоящее время проверяется.
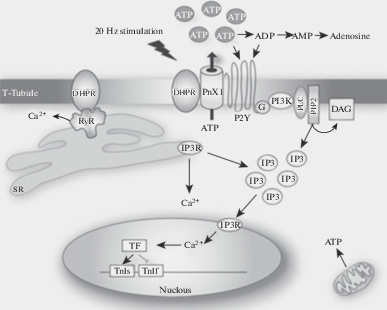
Рис. 1.
АТФ высвобождается через каналы паннексин-1 (PnX1) после низкочастотной стимуляции; сенсором напряжения являются дигидропиридиновые рецепторы (DHPR). АТФ быстро разлагается на аденозиндифосфат (АДФ), аденозинмонофосфат (АМФ) и аденозин под действием эктонуклеотидаз. АТФ и АДФ могут действовать на P2Y рецепторы, связанные с G белком Y, которые, в свою очередь, активируют PI3 киназу в мембране Т-трубочек. PI3 киназа катализирует фосфорилирование фосфатидилинозитолдифосфата (PIP2), давая PIP3 высоко заряженный остаток, который рекрутирует фосфолипазу C (PLC) в мембрану, запуская гидролиз PIP2 на диацилглицерин (DAG) и инозитол 1,4,5 трифосфат (IP3). IP3 будет связываться с рецепторами IP3, присутствующими как в ядерной оболочке, так и в саркоплазматической сети, вызывая слабый сигнал высвобождения кальция, как в цитозоле, так и нуклеоплазме, что способствует (возможно, с другими сигнальными каскадами) активации факторов транскрипции (TF), приводящих к экспрессии или репрессии генов, вовлеченных в фенотип мышечных клеток.
Финансирование работы: РФФИ 20-015-00138, РНФ 18-15-00062.
Список литературы отсутствует.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


