Журнал эволюционной биохимии и физиологии, 2021, T. 57, № 1, стр. 63-70
ГЛИКОГЕН КАК ЗАПАСАЮЩИЙ ЭНЕРГЕТИЧЕСКИЙ СУБСТРАТ ЯДЕРНЫХ ЭРИТРОЦИТОВ РЫБ
Ю. А. Силкин 1, *, Е. Н. Силкина 1, М. Ю. Силкин 1
1 Карадагская научная станция им. Т.И. Вяземского – природный заповедник РАН – филиал
Федерального государственного бюджетного учреждения науки Федерального исследовательского центра
“Институт биологии южных морей им. А.О. Ковалевского РАН”
Феодосия, Россия
* E-mail: ysilkin@mail.ru
Поступила в редакцию 05.07.2020
После доработки 10.08.2020
Принята к публикации 07.10.2020
Аннотация
Исследовали содержание гликогена в эритроцитах двух видов хрящевых (Raja clavata, Dasyatis pastinaca) и четырех видов черноморских костистых рыб (Trachurus mediterraneus ponticus, Spicara flexuosa, Diplodus annularis, Scorpaena porcus). Показано, что в эритроцитах костистых рыб накопление гликогена, примерно в два раза превышало этот показатель у исследованных скатов. Ввиду уникальной способности эритроцитов ската – морской лисицы (Raja clavata), хорошо переносить содержание целостности клеток in vitro на холоде (+4°С), прослежена динамика расхода гликогена в эритроцитах на протяжении 11-суточного их хранения до распада клеток. Показано, что клетки экономно осуществляют траты гликогена, расход которого за весь период 11-суточного хранения составлял в эритроцитах морской лисицы 52%. Эритроциты скорпены (Scorpaena porcus) были гораздо менее устойчивыми к содержанию их на холоде. Период устойчивости взвешенных в физиологическом растворе эритроцитов скорпены не превышал двух суток. За этот период в эритроцитах скорпены не наблюдали значимых изменений концентрации гликогена.
ВВЕДЕНИЕ
Ядерные эритроциты рыб относятся к нередуцированным клеткам, имеющим ядро, митохондрии и преимущественно аэробный тип обмена. Это означает, что эритроциты рыб в отсутствие дефицита кислорода активно потребляют его в митохондриальном комплексе для компенсации своих энергетических потребностей [1]. Кроме этого, эритроциты рыб имеют полный набор гликолитических энзимов для анаэробного метаболизма глюкозы и набор ферментов для синтеза гликогена [2]. В литературе дискутируется вопрос о том, какой из углеводных или неуглеводных субстратов является главным в энергетике эритроцитов рыб. Можно было бы полагать, что, как и у млекопитающих, основным субстратом является глюкоза плазмы крови рыб. Однако это может быть отчасти справедливо только для рыб, в плазме которых имеется стабильно высокий уровень этого углеводного субстрата. У рыб с высоким уровнем гликемии в плазме концентрация глюкозы может колебаться между видами от 2.0 до 11 ммоль/л плазмы крови [3]. В плазме некоторых рыб уровень глюкозы может иметь на порядок более низкие значения и составлять 0.1–0.2 ммоль/л плазмы крови [4]. Такой уровень гликемии у этих рыб уже никак не может быть достаточным для покрытия энергетических потребностей их эритроцитов. В литературе высказываются предположения, что такие эритроциты могут использовать другие субстраты для ресинтеза АТФ, включая как жиры (олеаты), аминокислоты (аланин), так и производные углеводного метаболизма (пируват и лактат) [5]. Еще менее изучен вопрос о роли и значении внутриклеточного гликогена эритроцитов рыб. Является ли гликоген эритроцитов основным энергетическим углеводом для эритроцитов, как это доказано, например, для мышц и печени рыб или его можно отнести к “минорному” компоненту субстратного обеспечения? Содержание гликогена в эритроцитах хрящевых и костистых рыб можно отнести к неизученному вопросу. Поэтому основной целью настоящего исследования являлось изучение внутриклеточной концентрации гликогена эритроцитов у некоторых хрящевых и костистых черноморских рыб. Для понимания участия гликогена в поддержании энергетики клетки in vitro в цели данного исследования также входило изучение динамики его утилизации в эритроцитах рыб при хранении клеток на холоде при +4°С.
МАТЕРИАЛЫ И МЕТОДИКА
Объектами исследования служили эритроциты 2 видов хрящевых и 4 видов костистых черноморских рыб, отловленных у Восточного побережья Крыма. Хрящевые рыбы – скаты: морская лисица (Raja clavata Linnaeus) и морской кот (Dasyatis pastinaca Linnaeus). Костистые рыбы: ставрида (Trachurus mediterraneus ponticus Aleev), смарида (Spicara flexuosa Rafineaque), ласкирь (Diplodus annularis Linnaeus), скорпена (Scorpaena porcus Linnaeus). Выбранные виды рыб отличались по эволюционному положению и по экологической специализации.
Скаты относятся к древним, хрящевым видам рыб. Морская лисица (шиповатый скат) и морской кот (хвостокол) различались по своим температурным предпочтениям. Шиповатый скат – холодолюбивый вид, обитающий на 30–70 м глубине, плохо переносит температуру выше +20°С. Хвостокол – теплолюбивый вид, легко переносит температуру +25°С и выше, может подходить близко к берегу и находиться на 0.5 м глубине в летнее время.
Представленные костистые рыбы отличались по скоростным характеристикам и степени оседлости. Ставрида – самый скоростной и постоянно кочующий, пелагический вид. Смарида, ласкирь – прибрежные маломигрирующие, маневренные виды рыб, обитающие среди зарослей водорослей. Скорпена – прибрежный, малоподвижный, оседлый вид, обитающий среди камней, хищник-засадчик.
Объекты исследования были отловлены у Восточного побережья Крымского полуострова в осенне-зимнее время. Отловленных скатов до экспериментов в течение 3–5 сут содержали в непроточном, хорошо аэрируемом бассейне, емкостью в 25 м3, из расчета 2 м3 на одну особь. Костистых рыб содержали в 2 аэрируемых бассейнах, емкостью в 1 м3, из расчета 100 литров на особь. Температура воды в бассейнах составляла 14–16°С, перед экспериментом рыб не кормили.
В процессе экспериментов с рыбами все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Кровь получали у скатов пункцией сердца гепаринизированной иглой (от каждой особи на опыт), а у костистых рыб пункцией хвостовой вены специально заточенной стеклянной пипеткой (от 5–7 особей на опыт – у ставриды и от 2–3 особей на пробу у скорпены, смариды и ласкиря). Выделенную кровь помещали в пробирку с соответствующим для хрящевых и костистых рыб охлажденным на льду физиологическим раствором c гепарином (0.5 МЕ/мл) в соотношении 1 : 10. Затем эритроциты отмывали от плазмы, дважды добавляя физиологический раствор и осаждали клетки центрифугированием при 1500–2000 об/мин на центрифуге К-23 (Германия). Надосадочную жидкость отсасывали, а эритроциты рыб разводили физиологическим раствором до гематокрита, равным 0.25–0.35. Состав отмывающего и инкубирующего физиологического раствора для скатов был следующего состава (мМ): 220 NaCl + 300 мочевины + 50 Трис – HCl (pH = 7.4). Состав отмывающего и инкубирующего физиологического раствора для костистых рыб не содержал мочевину и состоял (мМ) из: 180 NaCl + 10 и Трис – HCl (pH = 7.4).
Определение гликогена в эритроцитах рыб проводили по общепринятой методике, основанной на цветной реакции с антроном [6] и адаптированной для рыб (Морозова, 1971). Для определения количества исследуемого углеводного субстрата отбирали 0.1 мл (для всех исследуемых видов) суспензии эритроцитов с четко определенным гематокритом (Ht = 0.25–0.35), величину которого затем учитывали при расчетах. Отобранную пробу суспензии эритроцитов (0.1 мл) фиксировали в 30% КОН и нагревали в кипящей водяной бане в течение 20 мин для гидролиза белков. Затем пробы охлаждали, добавляли в них 0.5 мл основного раствора (25 г сернокислого цинка, 5 г хлористого натрия на 100 мл воды) и проводили осаждение гидролизата 4.5 мл этилового спирта. После осаждения пробы центрифугировали в течение 15 мин при скорости, равной 3000 об/мин.; отделяли осадок, осушали его на воздухе и растворяли в 1 мл 4% соляной кислоты. Полученный элюат фильтровали и производили повторное осаждение гликогена в 8 мл этилового спирта (в пробу). После этого пробы опять подвергали центрифугированию при 5000 об/мин в течение 15 мин, затем осадок растворяли горячей водой (по 5 мл). 1 мл такого раствора использовали для цветной реакции с антроном (+2 мл 0.2% растворенного в концентрированной серной кислоте антрона). Концентрацию цветного экстракта определяли с помощью прибора Specol-11 (Германия).
Расчет производили по формуле:
Для исследования динамики утилизации гликогена эритроцитами суспензии эритроцитов морской лисицы и скорпены хранили в холодильнике при +4°С в течение 1, 3, 5, 8 и 11 сут при ежедневном визуальном контроле уровня гемолиза клеток в суспензии и определении содержания гликогена в эритроцитах по вышеописанной методике.
Полученные результаты выражали в мг % сырого веса клеток. Данные подвергали статистической
обработке и представляли как среднее арифметическое ± средняя ошибка ( ). Все результаты были получены при проведении 7–15 независимых экспериментов для
каждого исследованного вида рыб. Достоверность различий определяли с помощью критерия
Стьюдента. Различия считались достоверными при p < 0.05.
). Все результаты были получены при проведении 7–15 независимых экспериментов для
каждого исследованного вида рыб. Достоверность различий определяли с помощью критерия
Стьюдента. Различия считались достоверными при p < 0.05.
РЕЗУЛЬТАТЫ
Результаты по содержанию гликогена (мг %) в эритроцитах хрящевых и костистых исследованных рыб представлены в табл. 1.
Как видно из табл. 1 эритроциты всех исследованных рыб накапливали гликоген в больших количествах, сопоставимых с накоплением этого субстрата в мышцах рыб [7]. Так, в эритроцитах костистых рыб его накопление колебалось в диапазоне от 242.2 до 372.3 мг %. Необходимо отметить, что накопление гликогена в эритроцитах костистых рыб было, в среднем, в два раза более высоким по сравнению с эритроцитами хрящевых рыб. При этом эритроциты исследованных скатов показали практически одинаковые значения накопления внутриклеточного гликогена (табл. 1). Среди костистых рыб можно проследить тенденцию зависимости внутриклеточной концентрации гликогена от естественной подвижности исследованных видов. Так, эритроциты наиболее подвижной ставриды имели самый высокий уровень внутриклеточного гликогена. У маневренного ласкиря, характеризующегося средней подвижностью, также можно отметить высокое содержание гликогена. У смариды и малоподвижной скорпены его концентрация была на 18–35% ниже (табл. 1), что указывало на достаточно большой разброс в колебаниях этого показателя в эритроцитах с низким уровнем двигательной активности рыб.
Таблица 1.
Содержание гликогена (мг %) в эритроцитах некоторых черноморских рыб
| Класс рыб | Вид рыбы | Содержание гликогена в эритроцитах в мг % сырой массы суспензии | n |
|---|---|---|---|
| Хрящевые | Raja clavata L. | 142.8 ± 15.0 * | 8 |
| Dasyatis pastinaca L. | 139.2 ± 10.0 * | 8 | |
| Костистые | Trachurus mediterraneus ponticus Aleev | 372.3 ± 39.1 | 15 |
| Diplodus annularis l. | 326.8 ± 22.5 | 7 | |
| Spicara flexuosa R. | 242.2 ± 14.0 | 12 | |
| Scorpaena porcus L. | 305.5 ± 35.5 | 11 |
Эритроциты морской лисицы являются уникальными клетками ввиду высокой устойчивости in vitro их суспензий, способных до 11 сут в холоде (+4°С) без признаков видимого гемолиза сохранять свою целостность. Благодаря этому нам удалось проследить динамику изменения содержания внутриклеточного гликогена в эритроцитах ската на протяжении указанного выше периода хранения. Полученные результаты выражали в % к физиологическому состоянию, принятому за 100% (рис. 1).
Рис. 1.
Динамика изменения концентрации гликогена в эритроцитах морской лисицы в процессе содержания клеток на холоде (+4°С).
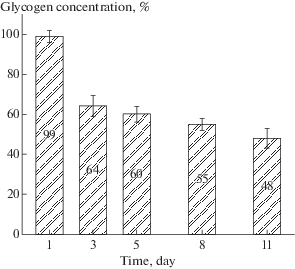
Как видно на рис. 1 эритроциты морской лисицы в процессе хранения их при +4оС достаточно медленно теряли гликоген. В первые сутки потери практически отсутствовали. На третьи–пятые сутки его убыль составляла 36–40%. В последующий период хранения клеток гликоген тратился еще медленнее и его потери к 8-м суткам были 45%, а на 11-е сутки – 52% (рис. 1).
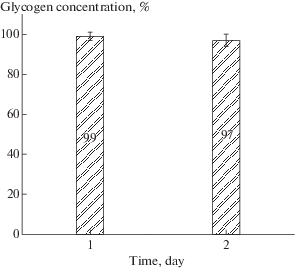
Эритроциты скорпены были гораздо менее устойчивыми к хранению по сравнению с клетками ската. Устойчивость клеточных суспензий скорпены при хранении в холоде во времени не превышала двух суток (рис. 2). Как видно на рис. 2 красные клетки крови скорпены на протяжении всего 2-х суточного периода хранения практически не теряли гликоген и его уровень оставался стабильным до начала гемолитических процессов в суспензии клеток, которые наступали через 48 ч с момента выделения клеток из организма (рис. 2).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Эритроциты рыб относятся к клеткам с аэробным метаболизмом, о чем свидетельствуют литературные источники [8] и наши исследования скоростей поглощения кислорода митохондриями этих клеток [9]. Благодаря наличию митохондрий и цикла трикарбоновых кислот эритроциты рыб потенциально могут использовать in vivo разные энергетические субстраты. Так, было показано, что эритроциты форели (Oncorhynchus mykiss) и американского угря (Anguilla rostrata) могут окислять глюкозу, лактат и аланин [5, 10]. Эритроциты карпа (Cyprinus carpio) в дополнение к этим субстратам могут использовать пируват и глютамат [11]. Использование разных субстратов эритроцитами рыб можно было бы рассматривать как важное преимущество ядерных эритроцитов особенно в условиях гипотермии, голодания, гипоксии или при ацидозных состояниях. Однако вопрос об использовании других субстратов в энергетике эритроцитов рыб при стрессовых состояниях остается спорным, особенно если учесть, что для их вовлечения в метаболизм необходим кислород, который в этих случаях как раз и является лимитирующим фактором.
Хорошо известно, что эритроциты млекопитающих не содержат ядра и в физиологических условиях, как источник энергии, утилизируют только глюкозу. Отсутствие цитохромной системы минимизирует кислородные потребности безъядерных эритроцитов, и их энергетическая система функционирует на основе анаэробного гликолиза. Глюкоза из русла крови проникает в эритроцит с помощью специфического переносчика, расположенного в мембране, не зависит от инсулина и не является лимитирующим фактором. Выделенные из организма человека, лишенные глюкозы эритроциты быстро погибают ввиду снижения внутриклеточной концентрации АТФ, которое вызывает падение поддержки градиента концентрации на мембране Na+ и K+, накопления метгемоглобина и окисленного глутатиона [2]. Из всего сказанного можно полагать, что эритроциты млекопитающих и человека не нуждаются в запасании глюкозы в виде гликогена. Тем не менее активный метаболизм гликогена был продемонстрирован как в нормальных эритроцитах человека [12], так и в богатых гликогеном красных клетках крови, вызванных их гликоген-накопительной болезнью (тип III и тип IV) а [13]. В норме содержание гликогена в безъядерных эритроцитах невелико. В эритроцитах человека по разным оценкам его величина составляла от 57.3 до 69.5 мг/г Hb [14, 15].
Гликоген в эритроцитах рыб, как и в других тканях, является запасаемым этими клетками углеводом. Однако, в отличие от мышечного или печеночного гликогена, который в этих тканях рыб относится к быстро мобилизуемому энергетическому субстрату, роль эритроцитарного гликогена не совсем ясна. Так, не ясно, когда и при каких условиях происходит накопление полисахарида в эритроцитах. Не ясно, когда и при каких условиях происходит его мобилизация и тем более не ясна его роль, как субстрата в энергетике эритроцитов рыб. Немногочисленные данные по накоплению гликогена в эритроцитах рыб свидетельствуют о том, что его внутриклеточная концентрация варьирует в широком диапазоне. Так, в эритроцитах атлантической трески (Gadus morhua) его концентрация составляла 0.35 мкмоль глюкозных единиц г–1 клеток, а в эритроцитах европейского керчака (Myoxocephalus scorpius) – 2.9 мкмоль глюкозных единиц г–1 клеток [4]. Величина накопления гликогена в эритроцитах керчака была близка накоплению его в эритроцитах морского ворона (Hemitripterus ame-ricanus) (3.9 мкмоль глюкозных единиц г–1 клеток), тогда как уровень накопления полисахарида в эритроцитах атлантической трески был сопоставим с его внутриклеточной концентрацией в эритроцитах радужной форели [16].
Полученные нами результаты по содержанию гликогена в эритроцитах хрящевых и костистых черноморских рыб показали (табл. 1), что в эритроцитах скатов накопление этого энергетического субстрата в два раза было ниже по сравнению с красными клетками крови костистых рыб. Небольшое накопление гликогена могло свидетельствовать о более низком уровне энергетического метаболизма в эритроцитах хрящевых рыб в сравнении с костистыми. В пользу этого предположения могут свидетельствовать наши исследования по изучению дыхательной активности митохондриального комплекса эритроцитов хрящевых и костистых рыб [9]. Нами показано, что эритроциты костистых рыб характеризовались большими скоростями поглощения кислорода по сравнению с эритроцитами скатов в ответ на стимуляцию дыхательной активности митохондрий энергетическими субстратами – глутаматом, малатом и сукцинатом. Высокий уровень гликогена в эритроцитах костистых рыб может также указывать на большую активизацию их ферментов, осуществляющих синтез запасаемого полисахарида. Безусловно, для биосинтетических процессов гликогеногенеза важным фактором является концентрация глюкозы в крови. Поэтому глюкозу крови и внутриклеточный гликоген эритроцитов рыб можно рассматривать как две взаимосвязанные компоненты одного единого пула субстратного обеспечения углеводами в системе плазма–эритроциты. Немногочисленные данные свидетельствуют, что уровень глюкозы в крови скатов не имеет высоких значений. Так, содержание глюкозы в крови пресноводного ската (Hypanus sabinus) составляло 0.71 ± ± 0.1 ммоль/л [17]. У морского ската (Dasyatis ame-ricana) концентрация глюкозы в крови также была невысокой и составляла 1.69 ммоль/л [18]. Возможно, низкий уровень глюкозы в плазме черноморских скатов является значимой предпосылкой низкого уровня гликогена в эритроцитах этих рыб. Однако низкое содержание глюкозы в плазме крови скатов не является общим признаком для хрящевых рыб. У их ближайших родственников – более подвижных акул, характеризующихся высоким уровнем метаболизма, содержание глюкозы в плазме крови было, как минимум, на порядок выше. Так, в плазме карибской рифовой акулы (Carcharhinus perezi) содержание глюкозы в плазме крови составляло 10.4 ммоль/л, а у акулы-няньки (Ginglymostoma cirratum) – 20.0 ммоль/л [19].
Согласно литературным данным концентрация глюкозы в крови костистых рыб также имеет очень большую вариабельность, при этом некоторые виды имеют уровень субстрата ниже 1 ммоль/л, а другие – уровень, превышающий 10 моль/л [20]. У морских видов рыб – европейского керчака (Myoxocephalus scorpius), куннера – голубого окуня (Tautogolabrus adsperdus), атлантического лосося (Salmo salar), атлантической трески (Gadus morhua) концентрация глюкозы в плазме крови рыб составляла соответственно: 0.73, 1.95, 4.1, 4.0 ммоль/л [4]. В нашей лаборатории тоже проводили определение концентрации глюкозы в плазме некоторых морских костистых рыб [7]. Так, у ставриды, смариды, скорпены уровень глюкозы в плазме крови составлял 7.7, 10.3 и 1.8 ммоль/л соответственно. Исходя из этих данных нами не установлено какой-либо корреляции между концентрацией глюкозы в плазме крови и содержанием гликогена в эритроцитах исследованных черноморских костистых рыб (табл. 1).
Условия, при которых это происходит, и сам вопрос гликогеногенеза в эритроцитах рыб практически не исследованы. Нам, в доступной литературе, не удалось найти источников посвященных этом вопросу. Тем более не ясно, при каких условиях эритроциты рыб используют накопленный гликоген in vivo и in vitro. Эритроциты ската морской лисицы относятся к уникальным клеткам в отношении их способности длительно сохранять свою целостность in vitro. Выделенные и взвешенные в физиологическом растворе клетки сохранялись на холоде (+4°С) до 11 сут без видимых признаков гемолиза. Это позволило проследить динамику использования гликогена эритроцитами рыб при длительном хранении. Как видно на рис. 1 в процессе хранения гликоген постепенно расходовался эритроцитами ската для поддержания своих энергетических потребностей. К концу срока хранения его концентрация составляла 48%, что свидетельствовало о вовлечении этого полисахарида в клеточный метаболизм в отсутствие других энергетических субстратов в физиологическом растворе, в котором эритроциты были отмыты и взвешены для хранения. Отсутствие в физиологическом растворе глюкозы делает процесс использования эритроцитами внутриклеточного гликогена неизбежным и, скорее всего, единственным возможным вариантом для поддержания своего метаболизма. Довольно пологое падение величины его внутриклеточной концентрации можно объяснить способностью клеток при стрессовых ситуациях блокировать свои энергетические затраты на 80% и тем самым экономно расходовать внутриклеточные ресурсы [8]. Выделение клеток и хранение их в физиологическом растворе как раз можно отнести к существенному стрессу для эритроцитов рыб. Ввиду нестойкости эритроцитов скорпены при хранении в холоде (+4°С) и их гемолиза после двухсуточного содержания (рис. 2) нам не удалось проследить динамику внутриклеточной концентрации гликогена в этих клетках. Эритроциты других исследованных костистых рыб были еще менее стойкими и начинали самопроизвольно разрушаться через 17–24 ч после выделения (не опубликованные данные).
Сам факт использования гликогена эритроцитами рыб в процессе хранения свидетельствует о востребованности этого субстрата эритроцитами, величина накопления которого в них сопоставима с уровнем этого полисахарида в белых мышцах рыб [7]. Это подчеркивает значимость гликогена для эритроцитов в тех жизненных случаях, когда использование других субстратов затруднено или невозможно. На возможность использования гликогена в качестве эндогенного источника энергии указали в своих исследованиях Д. Пескуэро и соавт. [21]. Для вовлечения гликогена в метаболизм эритроцитов, по-видимому, критически важным является падение концентрации глюкозы в плазме крови. Такие ситуации в жизни рыб встречаются часто и связаны, например, со стрессовыми мышечными нагрузками, длительными периодами голодания [22]. Особое место занимают гипоксийные состояния, которые случаются у рыб достаточно часто. Как известно, углеводы относятся к субстратам, утилизация которых может происходить анаэробно и при этом не требуется расхода кислорода. В эритроцитах их метаболизм осуществляется по классическому пути Эмдена–Мейергофа и, хотя выход энергетических эквивалентов АТФ в 16 раз уступает аэробному распаду, у рыб такой путь утилизации глюкозы востребован. Как показал ряд исследований [5, 11, 16, 21], глюкоза плазмы у рыб является основным субстратом для получения энергии. Даже в присутствии нормального напряжения кислорода глюкоза крови используется эритроцитами анаэробно и, как минимум, 30% этого субстрата преобразуется в лактат [5]. Видимо, использование глюкозы и гликогена эритроцитами рыб в качестве анаэробного источника позволяет экономить переносимый этими клетками кислород. Следует подчеркнуть, что низкое содержание гликогена в эритроцитах свойственно холодолюбивым рыбам, треске и радужной форели. У этих видов экономия кислорода не имеет смысла ввиду отсутствия дефицита кислорода в холодной среде их обитания. У исследованных нами теплолюбивых подвижных рыб (ставрида, ласкирь, смарида) содержание внутриклеточного гликогена было высоким. Высокое содержание гликогена было отмечено также у прибрежных сидячих форм рыб (керчак, морской ворон [16]), а также и у исследованной нами скорпены, которые имели существенно большие запасы этого полисахарида, чем холодолюбивые треска и радужная форель. Прибрежные виды рыб чаще испытывают гипоксийные состояния и использование глюкозы и гликогена в этих ситуациях позволяет экономить переносимый ими кислород для обеспечения энергетики других жизненно-важных тканей и органов. Такие же потребности в экономии кислорода необходимы теплолюбивым подвижным рыбам, у которых парциальное давление кислорода в среде падает с повышением ее температуры, а высокий энергетический обмен требует переноса эритроцитами больших объемов кислорода. Как мы полагаем, важность такого использования углеводов в специализированных клетках, какими являются эритроциты, было подхвачено естественным отбором и доведено до “совершенства” в безъядерных эритроцитах млекопитающих. Это позволило максимально увеличить КПД газотранспортной системы млекопитающих и занять им господствующее положение в царстве животных.
Эритроциты некоторых рыб относятся к клеткам, которые наделены высокой толерантностью к гипоксии/аноксии и другим стрессовым факторам, и способны быстро перепрограммировать свой метаболизм в сторону вовлечения гликогена в энергетический процесс для коррекции продуцирования и потребления АТФ [23]. Это позволяет предотвратить катастрофические последствия резких колебаний внутриклеточного АТФ и энергетического статуса клетки в целом. Такая перегруппировка энергетики клетки при дефиците кислорода в сторону предпочтительного использования гликогена свойственна и другим тканям стрессоустойчивых рыб [24–26] и, по-видимому, лежит в основе их толерантности. Как уже сообщали Р. Фергюсон и соавт. [8], в отсутствие кислорода эритроциты рыб сохраняют только 20–30% энергетического метаболизма, что совпадает с долей вклада углеводов в общий обмен красных клеток крови [5]. Такое совпадение позволяет высказать предположение о том, что эти 30% энергетических затрат являются необходимой и достаточной базой для обеспечения текущих потребностей эритроцитов рыб в поддержание своего функционального состояния. Остальные 70% энергетики клеток, видимо, расходуются на поддержание биосинтетических и регенерационных молекулярных процессов, что способствует более длительному поддержанию их газотранспортной функции и бóльшему нахождению эритроцитов в кровотоке рыб. Как известно, у рыб продолжительность “жизни” эритроцитов примерно в два раза выше, чем у млекопитающих, и составляет более 200 сут [27].
Полученные данные по содержанию гликогена в эритроцитах рыб расширяют наши представления о важности участия этого углеводного субстрата в энергетике этих клеток и открывают перспективу дальнейших исследований. Эти исследования должны быть направлены на выяснение факторов и механизмов, вызывающих активацию/деактивацию вовлечения гликогена в энергетический метаболизм эритроцитов рыб, что важно для понимания адаптационных возможностей этих клеток и гидробионтов в целом.
Список литературы
Phillips M.C.L., Moyes C.D., Tufts B.L. The effects of cell ageing on metabolism in rainbow trout (Oncorhynchus mykiss) red blood cells. J. Exp. Biol. 203: 1039–1045. 2000.
Липунова Е.А., Скоркина М.Ю. Физиология крови. Белгород: Из-во БелГУ. 324 с. 2007. [Lipunova E.A., Skorkina M.Ju. Fiziologija krovi. Belgorod: Iz-vo BelGU. 324 s. 2007. (in Russ)].
Polakof S., Panserat S., Soengas J.L., Moon T.W. Glucose metabolism in fish: a review. J. Comp. Physiol. B 182: 1015–1045. 2012. https://doi.org/10.1007/s00360-012-0658-7
Driedzic W.R., Clow K.A., Short C.E. Glucose uptake and metabolism by red blood cells from fish with different extracellular glucose levels. J. Exp. Biol. 216: 437–446. 2013. https://doi.org/10.1242/jeb.079178
Walsh P.J., Wood C.M., Thomas S., Perry S.F. Characterization of red blood cell metabolism in rainbow trout. J. Exp. Biol. 154: 475–489. 1990.
Морозова А.Л. Исследование содержания углеводов и фосфорных соединений в тканях ставриды и скорпены при разном функциональном состоянии. Автореф. канд. дисс. Л., 1971. 24 с. [Morozova A.L. Issledovanie soderzhaniya uglevodov i fosfornyh soedinenij v tkanyah stavridy i skorpeny pri raznom funkcional’nom sostoyanii. Avtoref. kand. diss. L. 1971. (in Russ)].
Морозова А.Л., Астахова Л.П., Силкина Е.Н. Углеводный обмен при плавании рыб, глава VII в монографии “Элементы физиологии и биохимии общего и активного обмена у рыб”. К.: Наукова Думка. С. 122–143. 1978. [Morozova A.L., Astahova L.P., Silkina E.N. Uglevodnyj obmen pri plavanii ryb, glava VII v monografii “Jelementy fiziologii i biohimii obshhego i aktivnogo obmena u ryb”. K.: Naukova Dumka. S. 122–143. 1978. (in Russ)].
Ferguson R.A., Tufts B.L., Boutilier R.G. Energy metabolism in trout red cells: consequences of adrenergic stimulation in vivo and in vitro. J. Exp. Biol. 143: 133–147. 1989
Silkin Yu.A., Korotkov S.M., Silkina E.N. The Study of the Bioenergetic Characteristics of the Red Blood Cells of Black Sea Fish: the Common Stingray (Dasyatis pastinaca L.) and Black Scorpionfish (Scorpaena porcus L.). Biophysics. 62 (3): 434–439. 2017. https://doi.org/10.1134/S0006350917030204
Soengas J.L., Moon T.W. Uptake and metabolism of glucose, alanine and lactate by red blood cells of the American eel Anguilla rastrata. J. Exp. Biol. 198: 877–888. 1995.
Nikinmaa M., Tiinonen K. Substrate transport and utilization in fish erythrocytes. Acta Physiol. Scand. 152: 183–189. 1994. https://doi.org/10.1111/j.1748-1716.1994.tb09798.x
Mouses S.W., Bashan N., Gutman A. Glycogen metabolism in the normal red blood cells. Blood. 40 (6): 836–8432. 1972.
Mouses S.W., Bashan N., Gutman A., Ockerman P.A. Glycogen metabolism in glycogen-rich erythrocytes. Blood. 44 (2): 275–284. 1974.
Sidbury J.B. Jr., Cornblath M., Fisher J., House E. Glycogen in erythrocytes of patients with glycogen storage disease. Pediatrics. 27: 103–111. 1961.
Miwa I., Suzuki S. An improved quantitative assay of glycogen in erythrocytes. Ann. Clin. Biochem. 39: 612–613. 2002. https://doi.org/10.1177/000456320203900613
Dridzic W.R., Clow K.A., Short C.E. Extracellular glucose can fuel metabolism in red blood cells from high glycemic Atlantic cod (Gadus morhua) but not low glycemic short-horned sculpin (Myoxocephalus scorpius). J. Exp. Biol. 217: 3797–3804. 2014. https://doi.org/10.1242/jeb.110221
Lambert F.N., Treberg J.R., Anderson W.G., Brandt C., Evans A.N. The physiological stress response of the Atlantic stingray (Hypanus sabinus) to aerial exposure. Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology. 219–220: 38–43. 2018. https://doi.org/10.1016/j.cbpa.2018.02.009
Cain D.K., Harms C.A., Segars A. Plasma biochemistry reference values of wild-caught southern stingrays (Dasyatis americana). J. Zoo. Wildl. Med. 200. 35 (4): 471–476. 2004. https://doi.org/10.1638/03-107
Bouyoucos I.A., Talwar B.S., Brooks E.J., Brownscombe J.W., Cooke S.J., Suski S., Mandelman J.W. Exercise intensity while hooked is associated with physiological status of longline-captured sharks. Conserv. Physiol. 20.6 (1): 1–13. 2018. https://doi.org/10.1093/conphys/coy074
Polakof S., Mommsen T.P., Soengas J.L. Glucosensing and glucse homeostasis from fish to mammals // Comp. Biochem. Physiol. 160B: 123–149. 2011. https://doi.org/10.1016/j.cbpb.2011.07.006
Pesquero J., Roig T., Bermudez J., Sanchez J. Energy metabolism by trout red blood cells: substrate utilization // J. Exp. Biol. 193: 183–190. 1994. PMID: 9317599
Плисецкая Э.М. О гормональной регуляции углеводного обмена у низших позвоночных (круглоротых и рыб). Автореферат докт дис. Ленинград. 38 с. 1972. [Pliseckaja Je. M. O gormonal’noj reguljacii uglevodnogo obmena u nizshih pozvonochnyh (kruglorotyh i ryb). Avtoreferat dokt dis. Leningrad. 38 s. 1972. (in Russ)].
Солдатов А.А., Парфенова И.А., Новицкая В.Н. Содержание одновалентных катирнов и АТФ в эритроцитах морских рыб при экспериментальной гипоксии. Укр. биохим. журн. 82: 36–41. 2010. [Soldatov A.A., Parfenova I.A., Novickaya V.N. Soderzhanie odnovalentnyh katirnov i ATF v eritrocitah morskih ryb pri eksperimental’noj gipoksii. Ukr. biohim. zhurn. 82: 36–41. 2010 (in Russ)].
Солдатов А.А., Головина И.В., Колесникова Е.Э., Сысоева И.В., Сысоев А.А., Кухарева Т.А., Кладченко Е.С. Активность ферментов энергетического обмена и содержание АТФ в тканях мозга и жабр морского ерша Scorpaena porcus Linnaeus при кратковременной гипоксии. Ж. эвол. биохим. и физиол. 56 (3): 213–223. 2020. [Soldatov A.A., Golovina I.V., Kolesnikova E.E., Sysoeva I.V., Sysoev A.A., Kuhareva T.A., Kladchenko E.S. Aktivnost’ fermentov energeticheskogo obmena i soderzhanie ATF v tkanyah mozga i zhabr morskogo ersha Scorpaena porcus Linnaeus pri kratkovremennoj gipoksii. J. Evol. Biohim. Phys. 56 (3): 213–223. 2020. (in Russ)].https://doi.org/10.31857/S0044452920010143
Serebrenikova T.P., Nesterov V.P. Activation of glycogen phosphorylases by glycogen phosphorylase kinases: dependence on ATP concentration and species specificity of the enzymes. J. Evol. Biohim. Phys. 38 (2): 242–244. 2002.
Шмелев В.К., Серебреникова Т.П. Влияние температуры на кинетику фосфорилазной реакции и активацию фосфорилазы под действием киназы фосфорилазы у ската Dasyatis pastinaca. Украинский биохимический журнал. 1987. 59 (1): 34–38. [Shmelev V.K., Serebrenikova T.P. Effect of temperature on the kinetics of the phosphorylase reaction and phosphorylase activation induced by phosphorylase kinase in the skate Dasyatis pastinaca/ Ukrainskij biohimicheskij zhurnal. 1987. 59 (1): 34–38].
Солдатов А.А. Особенности организации и функционирования системы красной крови рыб. Ж. эвол. биохим. и физиол. Т. 41. № 3. С. 217–223. 2005. [Soldatov A.A. Osobennosti organizacii i funkcionirovaniya sistemy krasnoj krovi ryb. J. Evol. Biohim. Phys. 41 (3): 217–223. 2005. (in Russ)].
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии