Журнал эволюционной биохимии и физиологии, 2021, T. 57, № 2, стр. 165-171
АДАПТАЦИЯ К НИЗКИМ ТЕМПЕРАТУРАМ ИКРОНОЖНЫХ МЫШЦ ТРАВЯНОЙ ЛЯГУШКИ RANA TEMPORARIA В НАЧАЛЕ АНАБИОЗА
М. В. Каранова *
Лаборатория криобиологии и биофизики воды
Московская область, г. Пущино, Россия
* E-mail: karanovari@mail.ru
Поступила в редакцию 07.07.2020
После доработки 02.10.2020
Принята к публикации 17.10.2020
Аннотация
При изучении влияния сезонного снижения температуры на состав свободных аминокислот и нингидринположительных вторичных метаболитов в мышцах лягушки R. temporaria выявлено увеличение пула аланина в начале зимней спячки, от 2.43 мкмоль/г сырой массы в летний период до 6.10 мкмоль/г, а также 3-метилгистидина, от 1.52 до 2.80 мкмоль/г. Впервые в мышцах пойкилотермных животных, – а именно, у лягушек, – обнаружены цистеиновая кислота и фосфоэтаноламин, количество которых к началу зимней спячки значительно повышалось, особенно для цистеиновой кислоты: от 0.91 до 2.15 мкмоль/г. Уровень таурина в мышцах R. temporaria оказался намного ниже по сравнению с животными более низкой и более высокой ступеней филогенеза, однако в начале зимней спячки он увеличивался почти в 3 раза. Предполагается, что аккумуляция названных метаболитов связана с протекторной ролью этих соединений при температурах, экстремально низких для выживания R. temporaria.
ВВЕДЕНИЕ
Эктотермные холодостойкие животные, не обладающие совершенной терморегуляцией, выживают в строго определенных пределах пониженных температур благодаря способности к низкотемпературной адаптации. В эволюции биохимической адаптации пойкилотермов выделено три основных типа стратегии: количественная адаптация – изменения в концентрациях компонентов биохимических процессов; качественная – включение в метаболизм новых видов макромолекул; модуляционная – изменения активности существующих макромолекул [1]. Адаптация к низким температурам может осуществляться совместным действием всех трех типов и каждого в отдельности. Помимо снижения интенсивности метаболизма, смены набора изоферментов и подготовки липидного компонента мембран, многие животные синтезируют и различные виды защитных соединений, криопротекторов, или адаптогенов.
Свободные протеиногенные аминокислоты выполняют важнейшую функцию создания метаболического фона низкотемпературной адаптации, который определяет адаптивные возможности организма [2, 3]. Некоторые из аминокислот, аккумулируясь при низких температурах в органах или в гемолимфе в значительном количестве, выполняют, вероятно, и протекторную роль [2–4]. Согласно нашим исследованиям, в низкотемпературных адаптациях эктотермов, – в частности, рыб, – особую роль играют также некоторые вещества, которые, в отличие от протеиногенных аминокислот, не являются активными участниками метаболизма и относятся к вторичным метаболитам, но их уровень при околонулевых температурах повышается весьма значительно [5, 6]. К ним относятся фосфоро- и серосодержащие соединения: фосфоэтаноламин, фосфосерин, цистеиновая кислота, таурин [5, 6]. Аккумуляция этих метаболитов при низких температурах специфична для органов и животных и, вероятно, играет важную роль в адаптации.
Мышцы амфибий анатомически и морфологически отличаются от мышц рыб, но участие свободных аминокислот в мышечной адаптации к низким температурам, в состоянии анабиоза, практически не изучено. Лишь две работы, выполненные на свистящей квакше Pseudacris crucifer и лесной лягушке Rana sylvatica, посвящены изучению состава свободных аминокислот в мышечной ткани при воздействии низких температур [2, 7]. В качестве объектов для аналогичных целей были использованы и рептилии: два вида черепах и подвязочный уж Thamnophis sirtalis [8, 9].
Для понимания эволюции процессов низкотемпературной адаптации интересно иметь представление и о возможном участии в мышцах амфибий вышеназванных вторичных метаболитов (фосфоро- и серосодержащих соединений) – данные по этой теме в литературе совершенно отсутствуют.
Травяная лягушка Rana temporaria, представитель семейства настоящих лягушек, является обычным видом бесхвостых амфибий в умеренном климатическом поясе европейской части России. Наиболее комфортно амфибии чувствуют себя при температуре 17–20°С; пониженная температура воздуха не ограничивает их активность даже при 2–3°С, но с наступлением регулярных заморозков их активность прекращается и наступает состояние анабиоза, отличающееся от гибернации млекопитающих, прежде всего, отсутствием периодов бодрствования [6]. Анабиоз травяных лягушек не столь продолжителен для земноводных, обитающих в наших широтах, и длится в среднем 180 дней, однако в очень суровые зимы, когда водоемы, в которых они зимуют, промерзают до дна, может случаться их массовая гибель.
Изучение механизмов толерантности к низким температурам земноводных, переходных между гидробионтами и наземными животными, выявление соединений, являющихся активными (и подчас, специфическими) участниками процессов адаптации на тех или иных этапах эволюции, представляет несомненный интерес и добавит новое знание для понимания механизмов низкотемпературной адаптации, необходимого для практических задач криобиологии и криомедицины.
Задача данного исследования заключалась: 1) в выявлении особенностей состава свободных аминокислот и нингидринположительных вторичных метаболитов (фосфомоноэфиров и серосодержащих кислот) мышц лягушек в зимний период в сравнении с летним; 2) в сравнении полученных данных с имеющимися литературными данными для животных, стоящих на более ранних и более поздних стадиях филогененеза.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
Объект исследования. Поимка травяных лягушек R. temporaria осуществлялась в 2015–2017 гг. в неглубоких водоемах окрестностей Пущино (54°50' с.ш., 37°36' в.д.) в середине июня при среднесуточной температуре +17º С и в третьей декаде ноября (–2°С) – из водоема, частично покрытого рыхлым льдом. Вес животных составлял 34 ± 5 г. Декапитация летних лягушек и извлечение икроножных мышц осуществлялись на следующий день после поимки; декапитация зимних лягушек осуществлялась спустя несколько дней после отлова, в первых числах декабря; в этот период они находились в аквариуме при температуре +4°С. Отлов и содержание животных, доставленных в лабораторию, осуществляли в соответствии с правилами, принятыми “II Европейской конвенцией по защите животных, используемых для экспериментов или в других научных целях” (1986). Депротеинизацию и гомогенизацию мышечной ткани проводили в 0.2 n хлорной кислоте в соотношении веса ткани и объема кислоты 1:9 (w/v) и центрифугировали при 20 000 об/мин в течение 15 мин, при 0°С на центрифуге Centricon. Супернатант (S1) нейтрализовали 0.2 n КOH (S2); до использования хранили при –20°С.
Концентрацию свободных аминокислот и нингидринположительных соединений (НПС) определяли методом ионообменной жидкостной хроматографии на автоматическом анализаторе аминокислот LC-2000 (Германия). Разделение аминокислот проводили на ионообменной колонке (0.37 × 35.0 см), в которой неподвижной фазой являлась катионообменная смола Ostion LG ANB [10]. Для элюирования использовали трехступенчатый градиент натрий-цитратного буфера с возрастающей ионной силой и pH: № 1 – 0.3 М, pH 2.98, № 2 – 0.4 М, pH 3.81, № 3 – 0.45 М, pH 9.97. Рабочая температура колонки постоянная, 55°С. В колонку вводили 100 мкл биоматериала (S2), соответствующего исходному 1 мг мышечной ткани. Постколоночная модификация аминокислот проводилась с нингидрином, интенсивность окрашивания аминокислот и НПС измерялась спектрофотометрически при 570 нм. Пределы обнаружения аминокислот – от 0.3 нмоль, пределы определения – от 1 до 20 нмоль.
Для количественного определения аминокислот в каждой серии опытов получали хроматограмму стандартной смеси аминокислот и НПС: таурина, фосфоэтаноламина, фосфосерина и цистеиновой кислоты (фирм “Sigma” и “Hitachi”). Содержание свободных аминокислот выражали в мкмоль/г сырой массы.
Статистический анализ выполняли, используя пакет статистических программ для Microsoft Excel 2010. Данные выражали как среднее из 3 параллельных проб (n = 3), в каждой из которых использовалось 2 особи (итого 6 особей) ± ошибка среднего значения (М ± s.e.m.).
РЕЗУЛЬТАТЫ
Протеиногенные аминокислоты и 3-метилгистидин. Концентрация свободных протеиногенных аминокислот мышечной ткани из летней и зимней популяций R. temporaria представлена в табл. 1 и 2. Характерной особенностью летнего периода среди заменимых аминокислот (табл. 1) является соотношение аланина к глутаминовой кислоте, при котором пул аланина составляет приблизительно две трети от пула глутаминовой кислоты (2.4 и 4.0 мкмоль/г сырой массы соответственно для аланина и глутаминовой кислоты). Уровень аспарагиновой кислоты в мышцах летнего периода, 1.35 мкмоль/г, составляет приблизительно одну треть от пула глутаминовой кислоты. В мышечной ткани R. temporaria в значительном, но меньшем, количестве обнаружены также гистидин и его производное, непротеиногенная аминокислота 3-метилгистидин (2.2 и 1.52 мкмоль/г соответственно).
Таблица 1.
Пулы заменимых аминокислот икроножных мышц лягушки R. temporaria летом и в начале гибернации (мкмоли/г сырой массы)
| Аминокислоты | Июнь | Декабрь |
|---|---|---|
| Аспарагин | 1.35 ± 0.13 | 0.55 ± 0.05* |
| Серин | 1.24 ± 0.11 | 1.0 ± 0.1 |
| Глутамин | 4.0 ± 0.3 | 3.0 ± 0.3* |
| Глицин | 1.50 ± 0.13 | 1.35 ± 0.12 |
| Аланин | 2.4 ± 0.2 | 6.1 ± 0.6* |
| ГАМК | <0.01 | <0.01 |
| Гистидин | 2.2 ± 0.2 | 2.6 ± 0.2 |
| 3-метилгистидин | 1.52 ± 0.14 | 2.8 ± 0.2* |
| Общий пул | 14.3 ± 1.3 | 17.5 ± 1.8 |
Таблица 2.
Пулы незаменимых аминокислот икроножных мышц лягушки R. temporaria летом и в начале гибернации (мкмоли/г сырой массы)
| Аминокислоты | Июнь | Декабрь |
|---|---|---|
| Треонин | 2.05 ± 0.19 | 2.9 ± 0.3* |
| Валин | 0.39 ± 0.03 | 0.30 ± 0.03 |
| Метионин | 0.09 ± 0.02 | 0.08 ± 0.01 |
| Изолейцин | 0.14 ± 0.02 | 0.11 ± 0.02 |
| Лейцин | 0.23 ± 0.02 | 0.20 ± 0.02 |
| Лизин | 1.38 ± 0.12 | 0.9 ± 0.1 |
| Общий пул | 4.3 ± 0.4 | 4.5 ± 0.5 |
Соотношение аланина к глутаминовой кислоте мышц R. temporaria заметно изменяется в начале зимнего периода по сравнению с летним: количество аланина увеличивается от 2.4 до 6.1 мкмоль/г. Заметное увеличение концентрации отмечается для 3-метилгистидина, от 1.52 до 2.8 мкмоль/г. На фоне повышения уровня названных соединений в начале гибернации травяной лягушки происходит заметное уменьшение пулов дикарбоновых аминокислот: аспарагиновой – от 1.35 до 0.55 мкмоль/г, глутаминовой – от 4.0 до 3.0 мкмоль/г (табл. 1). Уровень серина и глицина, 1.24 и 1.50 мкмоль/г, соответственно, почти не изменился; уровень γ-аминомасляной кислоты (ГАМК) был ниже предела ее количественного определения (1 нмоль).
Характерной особенностью летнего периода среди незаменимых аминокислот (табл. 2) является существенная концентрация гидроксиаминокислоты треонина (2,05 мкмоль/г) и основной аминокислоты лизина (1.38 мкмоль/г). В начале анабиоза R. temporaria уровень этих аминокислот изменяется противоположным образом: у треонина увеличивается до 2.90 мкмоль/г, а у лизина уменьшается до 0.94 мкмоль/г.
В отличие от треонина и лизина, серосодержащая аминокислота метионин и аминокислоты с разветвленной боковой цепью, – валин, изолейцин и лейцин, – присутствуют в очень небольшой концентрации и в начале гибернации R. temporaria их уровень практически не изменяется (табл. 2).
Суммарное количество заменимых аминокислот у зимних животных выше, чем у летних, и составляет 17.5 мкмоль/г (табл. 1). Суммарный пул незаменимых аминокислот у зимних животных почти не отличается от летнего пула (табл. 2). Таким образом, общий баланс аминокислот, вероятно, отражает преобладание процессов протеолиза над процессами синтеза белков.
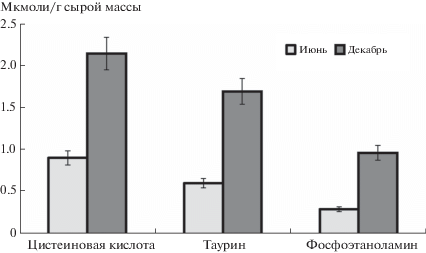
Вторичные метаболиты. Результаты изучения влияния сезонного снижения температуры на состав вторичных метаболитов мышечной ткани R. temporaria представлены на рис. 1. Своеобразие и сложность перехода от водного образа жизни к наземному отражены в появлении новых соединений: цистеиновой кислоты и фосфоэтаноламина 0.91 и 0.30 мкмоль/г, соответственно, а также в низком летнем уровне 2-аминоэтансульфоновой кислоты, или таурина (0.61 мкмоль/г). К началу зимнего периода пулы таурина, цистеиновой кислоты и фосфоэтаноламина увеличиваются в 2–3 раза, при этом уровень цистеиновой кислоты по-прежнему выше, чем уровень таурина или фосфоэтаноламина, и составляет 2.15 мкмоль/г.
ОБСУЖДЕНИЕ
Результатом эволюции мышечной системы амфибий стало резкое изменение характера их движений в сравнении с рыбами и соответствующее усложнение мускулатуры [11]. Мышцы конечностей у лягушек, в отличие от рыб, делятся на две главные группы, приводящие и отводящие, а мышцы туловища уже не делятся на миомеры, а принимают вид продольных и косых лент. Такие анатомические и морфологические изменения, наряду с изменением образа жизни, наверно, могут сопровождаться и биохимическими изменениями состава мышечной ткани, включая изменение соотношения пулов свободных аминокислот и возможное появление каких-то “новых” вторичных метаболитов. Эти изменения особенно ярко проявляются в процессе адаптации к низким температурам и у разных видов животных имеют свои особенности.
Так, в данной работе показано, что в мышцах лягушек R. temporaria, в отличие от рыб Perccottus glenii [12], свободная аспарагиновая кислота присутствует уже в значительном количестве, обретая, вероятно, существенную роль в усложненных задачах метаболизма амфибий. В мышцах летнего периода она составляет около одной трети от пула глутаминовой кислоты, 1.35 мкмоль/г (табл. 1), но зимой ее уровень понижается до 0.55 мкмоль/г.
Весомое участие аланина в низкотемпературной адаптации травяной лягушки сопряжено с убылью глутаминовой кислоты (табл. 1), от которой, возможно, и заимствованы аминогруппы для синтеза аланина. Возрастание количества аланина соответствует феномену повышения его уровня у лесных и свистящих лягушек, зимой вмерзающих в лед и выдерживающих экспериментальное замораживание до –4°С в течение 36–48 ч [2, 7]. У лесных лягушек R. sylvatica в результате экспозиции при –2.5°С в течение 2 сут выявлено увеличение пула аланина от 5.34 до 13.15 мкмоль/г [2]. У свистящих квакш Pseudacris crucifer при замораживании до –4°С в течение 36 ч происходит еще более значительное увеличение уровня аланина, от 1.68 до 5.85 мкмоль/г, обусловленное, как предполагают авторы, криопротекторным воздействием этой аминокислоты [2, 7]. В пользу криопротекторного эффекта аланина свидетельствует также огромное возрастание его концентрации, в 14 раз, в гемолимфе бабочки Pieris brassicae при –6°С [4].
Обращает на себя внимание значительное количество гистидина и 3-метилгистидина, 2.20 и 1.52 мкмоль/г, выявленных в летний период. О присутствии гистидина, причем в наибольшем по сравнению с другими аминокислотами количестве (особенно, у головастиков), сообщалось только в работе, выполненной на мышцах лягушки-быка R. catesbeiana [13]. Интересен и обнаруженный в нашей работе факт существенного увеличения 3‑метилгистидина в начале гибернации R. temporaria, до 2.80 мкмоль/г (табл. 1), выявляющий особенности метаболизма и специфику участия в низкотемпературной адаптации свободных аминокислот травяной лягушки. О функции непротеиногенной аминокислоты 3-метилгистидина известно не так много; известно, что он является продуктом метаболизма актина и миозина и отражает уровень распада белков в мышечной ткани. Asatoor и соавт. [14] когда-то посвятили 3-метилгистидину работу, показав его присутствие в актине крыс.
Аминокислотный состав мышц разных видов рептилий кажется, по сравнению с таковым R. temporaria, более своеобразным и даже необычным. Например, для мышц черепах Chrysernys picta rnarginata и C. picta bellii характерно необычайно высокое содержание метаболически малоактивного валина, 2.488 и 3.409 мкмоль/г, соответственно, и очень высокое содержание ГАМК, часто отсутствующей не только в мышцах лягушек, но и в мышцах других позвоночных [8].
Большинство незаменимых аминокислот (метионин, валин, изолейцин, лейцин) присутствует в мышцах R. temporaria в очень небольшом количестве (табл. 2). В процессе сезонного снижения температуры и наступившего затем оцепенения их пулы практически не изменяются. Исключением является пул треонина, возросший от 2.0 мкмоль до 2.9 мкмоль/г, и лизин, уровень которого, напротив, снизился от 1.38 до 0.9 мкмоль/г (табл. 2). Увеличение количества треонина коррелирует с уменьшением количества аспарагиновой кислоты (табл. 1), из которой он мог образоваться. Стабильный уровень незаменимых свободных аминокислот особенно важен для синтеза белков и регуляторных пептидов, и в этих процессах баланс незаменимых аминокислот играет особенно важную роль: заменимые могут быть легко синтезированы из кетокислот или других относительно простых предшественников. В связи с этим следует отметить, что в мышцах свистящей квакши Pseudacris crucifer, напротив, уровень незаменимых аминокислот, изолейцина, лейцина и лизина (треонин и валин не обнаружены) при замораживании животных до –4°С в течение 36 ч увеличивается в 3–6 раз [7]. Незаменимые аминокислоты лесной лягушки R. sylvatica при замораживании незначительно уменьшают свои пулы [2]. Наличие свободных незаменимых аминокислот только в следовых количествах и наблюдаемое постоянство их концентраций указывают на существование чрезвычайно эффективных механизмов регулирования.
Суммарное количество заменимых аминокислот у зимних животных выше, чем у летних, и составляет 17.5 мкмоль/г по сравнению с летними 14.3 мкмоль/г (табл. 1). Суммарное количество незаменимых аминокислот у зимних животных почти совпадает с летним пулом (табл. 2). Таким образом, общий баланс аминокислот может предполагать преобладание процессов протеолиза над процессами синтеза белков.
В данной работе впервые в мышцах земноводных обнаружены цистеиновая кислота и фосфоэтаноламин. Об этих веществах не сообщалось даже в классических работах Churchill и Storey, выполненных на мышцах лягушек [2, 7]; вероятно, используемый авторами метод не позволял выявить эти НПС. Присутствие названных вторичных метаболитов в мышцах R. temporaria свидетельствует о специфике обменных процессов лягушек, а их аккумуляция в состоянии анабиоза – о специфике адаптации при низких температурах (рис. 1). Значимость полученной информации дополняется отсутствием названных вторичных метаболитов в мышцах рыб-телеостов и др. [5], что свидетельствует о появлении в мышечной ткани земноводных новых биохимических особенностей по сравнению с предыдущим уровнем филогенеза.
Цистеиновая кислота не обнаруживается в мышечных тканях предшествующих стадий филогенеза, – по крайней мере, у рыб не выявляется [5, 12], зато в существенном количестве присутствует на более высоких ступенях эволюции и уже не только в мышцах. Этот промежуточный продукт серосодержащих кислот обнаружен в мышцах млекопитающих (включая человека), в плазме крови, в эритроцитах людей [15–17], в гипоталамусе крыс, чувствительном к радикальным температурным сдвигам [18]. Во время соревнований, когда возрастает количество свободных радикалов, уровень цистеиновой кислоты повышается в плазме человека в три раза; возможно, этот эффект обусловлен антиоксидантными свойствами этой субстанции [16, 17]. Цистеиновая кислота образуется в результате окисления цистеина в цистеинсульфиновую кислоту, которая затем окисляется в цистеиновую, а та, через образование гипотаурина, превращается в таурин [16, 19]. Низкое содержание таурина в мышечной ткани R. temporaria (рис. 1) – неожиданный факт данного исследования, вероятно, напрямую связанный с накоплением цистеиновой кислоты, предшественника таурина.
Таурин к началу зимы в мышцах лягушек все же накапливается, но не в таком количестве, как у рыб-телеостов, где он аккумулируется зимой, несмотря на то, что его пул и летом достаточно велик [3, 5, 12]. Согласно литературным данным, таурин не синтезируется в мышцах из-за отсутствия цистеиндиоксигеназы – первого фермента катаболического пути цистеина, приводящего к таурину [20]. Пул таурина в мышцах зависит от его доставки, осуществляемой зависящим от хлора транспортером таурина (TauT, SLC6A6 gene) [20]. В тканях организмов более древних филогенетических уровней количество таурина наиболее значительно – например, у литоральных моллюсков и рыб [3]. Любопытным моментом является и то, что значительное падение уровня таурина в мышцах лягушки по сравнению с мышцами рыб носит, “с точки зрения эволюции”, временный характер и, возможно, связано с отсутствием в них транспортера таурина. В мышцах более высокоразвитых животных таурин присутствует вновь в большом количестве [9, 12, 19, 21], но теперь вне зависимости от низкой температуры. Исключительно яркой иллюстрацией к этому утверждению являются эксперименты, проведенные на ужах Thamnophis sirtalis, отловленных в сентябре-месяце при температуре окружающей среды +15 °C [9]. После отлова животных температуру снижали на 1°C в день до установления +3°C, и далее поддерживали на уровне +3°C в течение 2–3 нед. В это время животные находились в состоянии гибернации. Аккумуляции таурина (как и протеиногенных аминокислот) в мышечной ткани охлажденных, гибернирующих ужей не наблюдалось, но ведь крайне важно иметь в виду, что уровень таурина изначально, в контроле (+15°C), был очень высоким, 18.06 мкмолей/г [9].
В меньшем количестве, чем в мышцах ужей, таурин присутствует в мышцах черепах Chrysernys picta rnarginata и C. picta bellii, однако изменение его пула при снижении температуры до –2.5°C установлено лишь частично: таурин выходил из хроматографической колонки, вследствие недостаточной селективности сорбента, в одном пике с аланином, поэтому авторы представили суммарную величину их пулов (7.4 и 7.7 мкмоль/г при +5 и ‒2.5°C) [8]. Можно предположить, что возрастание количества таурина после охлаждения если имело место, то оно было незначительным.
Согласно литературным данным, в мышцах человека таурин является аминокислотой, самой преобладающей в количественном отношении, но еще более высокая концентрация ее – в сердце, в сетчатке глаза, в эритроцитах, значительная концентрация и в мозге [19, 22]. О широком спектре эффектов таурина написаны сотни, если не тысячи статей, поэтому предположение о его функции при низких температурах можно делать, учитывая его влияние на системы антиоксидантной защиты, функционирование транспортных систем, процессы синтеза и деградации свободных серосодержащих аминокислот, стабилизацию клеточных мембран и т.д. [19].
Фосфоэтаноламин, отсутствовавший в мышцах рыб [12], но обнаруженный в данной работе в мышечной ткани лягушек, был впервые выявлен автором в мозге прудовых рыб P. glenii, причем в значительном количестве – именно при низких температурах, 0°С [5]. О присутствии фосфоэтаноламина в мышцах амфибий и рептилий не упоминалось ни в одной работе, поскольку разделение и идентификация этого соединения требует использования другого метода, с нингидрином в качестве окрашивающего агента (в нашем случае, это метод Шпахмана и соавт. [10]). Однако фосфоэтаноламин, причем в значительном количестве, был обнаружен автором в мозге исследуемых лягушек R. temporaria [6], а Ташики и Бакстером – в мозге зимних жаб Bufo boreas, где его количество превышало пул таурина в 10 раз [23]; известно о его присутствии и в мозге млекопитающих [18]. Образование этого вторичного метаболита, возможно, обусловлено процессами биосинтеза и распада мембранных фосфолипидов или же, напротив, – синтезом из АТФ и этаноламина с последующим использованием для построения глицерофосфолипидов и сфингомиелина [24]. Предшествующие данные об аккумуляции фосфоэтаноламина в мозге лягушек в зимнее время [6], в совокупности с настоящими результатами, но уже по отношению к мышцам, могут предполагать адаптогенную функцию этого соединения, как и цистеиновой кислоты, при низких температурах. О том, что функция фосфоэтаноламина, вероятно, изменяется в зависимости от органа и стадии филогенеза, свидетельствует накопление литературных данных о значительном изменении количества фосфоэтаноламина при некоторых патологиях и стрессах, о его антиангиогенной и антиметастазной активности у человека, об участии в активизации иммунной системы [25]. Таким образом, механизмы, функционирующие в мышцах амфибий при низких температурах как адаптивные, переходят на более высокую ступень филогенеза и функционируют там при нормальных температурах, участвуя в каких-то других процессах.
ВЫВОДЫ
1. При переходе от водного образа жизни к наземному происходит усложнение механизма низкотемпературной адаптации, находящее отражение в качественном изменении биохимического состава ее звеньев.
2. В икроножной мышце лягушки R. temporaria в начале анабиоза при температуре +4°С выявлена существенная перестройка метаболизма свободных аминокислот, которая сопровождалась значительной аккумуляцией аланина и, в меньшей степени, 3-метилгистидина.
3. Впервые в мышцах пойкилотермных животных, травяных лягушек R. temporaria, обнаружены цистеиновая кислота и фосфоэтаноламин. Количество этих вторичных метаболитов в начале гибернации значительно выше, чем в летний период.
4. Низкое содержание таурина, выявленное в мышцах лягушек и не свойственное мышцам животных предшествующей и последующих стадий филогенеза, предполагает изменение свойств ферментов (или состава участников), задействованных в метаболизме серосодержащих аминокислот земноводных.
5. Аккумуляция метаболитов, вызванная низкой температурой, может быть связана с протекторной ролью этих соединений.
Список литературы
Hochachka P.W., Somero G.N. Biochemical Adaptation: Mechanism and Process in Physiological Evolution New York: Oxford University Press; 466 p. 2002.
Storey K.B., Storey J.M. Freeze tolerant frogs: cryoprotectants and tissue metabolism during freeze-thaw cycles. Can. J. Zoology. 64 (1): 49–56. 1986.
Karanova M. Influence of Low Temperature on the Evolution of Amino Acids Pools Adaptive Modifications in Poikilothermic Animals (review). Int. J. Biochem. Biophys. 1 (2): 33–40. 2013.
Sømme L. The effect of temperature and anoxia on haemolymph composition and supercooling in three overwintering insects. J. Insect Physiol. 13: 805–814. 1967.
Каранова М.В. Влияние сезонного снижения температуры и холодового шока на состав свободных аминокислот и фосфомоноэфиров в разных органах ротана-головешки Perccottus glenii (Eleotridae). Вопр. ихтиол. 58 (4): 486–495. 2018. [Karanova M.V. Impact of Seasonal Temperature Decrease and Cold Shock on the Composition of Free Amino Acids and Phosphomonoethers in Various Organs of Amur Sleeper Perccottus glenii (Eleotridae). J. Ichthyol. 58 (4): 570–579. 2018. (In Russ)].
Каранова М.В. Вторичные метаболиты и аспарагиновая кислота в мозге амфибий R. temporaria как низкотемпературные адаптогены. Ж. эвол. биох. и физиол. 56 (3): 207–212. 2020. [Karanova M.V. Secondary Metabolites and Aspartic Acid in the Brain of the Frog Rana temporaria as Low-Temperature Adaptogens. J. Evol. Biochem. Physiol. 56 (3): 207–212. 2020. (In Russ)].
Churchill T.A., Storey K.B. Organ Metabolism and Cryoprotectant Synthesis during Freezing in Spring Peepers Pseudacris crucifer. Copeia. 1996 (3): 517–525. 1996.
Churchill T.A., Storey K.B. Natural freezing survival by painted turtles Chrysernys picta rnarginata and C. picta bellii . Amer. J. Physiol. 11: R530– R537. 1992.
Churchill T.A., Storey K.B. Freezing survival of the garter snake Thamnophis sirtalis. Canadian J. Zoology.70 (1): 99–105. 2011.
Spachman D.H., Stein W.H., Moore S. Automatic recording apparatus for use in the chromatography of amino acids. Anal. Chem. 30 (7): 1190–1206. 1958.
Шмальгаузен И.И. Основы сравнительной анатомии позвоночных животных. М.: Советская наука. 512 с. 1947.
Каранова М.В. Состав свободных аминокислот крови и мышц ротана Perccottus glenii в период подготовки и завершения гибернации. Ж. эвол. биохим. и физиол. 45 (1): 59–67. 2009. [Karanova M.V. Free amino acid composition in blood and muscle of the gobi Perccottus glehni at the period of preparation and completion of hibernation. J. Evol. Biochem. Physiol. 45 (1): 67–77. 2009].
Nakagawa H., Lindsay R.H., Cohen P.P. Composition and labeling patterns of “free” and protein amino acids in Rana catesbeiana tadpoles and frogs. Arch. Biochem. Biophys. 106: 299–306. 1964.
Asatoor A.M., Armstrong M.D. 3-Methylhistidine, a component of actin. Biochem. Biophys. Res. Com. 26 (2): 168–174. 1967.
Мурадян А.Ш., Едигарян А.Н., Галоян А.А. Содержание аминокислот и других нингидринположительных соединений в сердечной мышце крупного рогатого скота. АН Арм. ССР. Биол. журнал Армении. XXXIV (9): 968–972. 1981.
Гараева О.И. Серосодержащие аминокислоты как маркеры состояния стресса. Fiziol. şi Sanocreatol. Bul. AŞM. Ştiinţele vieţii. 3 (315): 50–62. 2011.
Grimble F.R. The effects of sulfur amino acid intake on immune function in humans. J. Nutr. 136 (6): 1660–1665. 2006.
Шейбак В.М., Лях И.В., Дорошенко Е.М., Смирнов В.Ю., Могилевец О.Н. Свободные аминокислоты и их азотсодержащие метаболиты в гипоталамусе крыс при острой интоксикации динилом и их корреляция с аминокислотным спектром плазмы крови. Вестник ВГМУ. 11 (1): 31–35. 2012. [Shejbak V.M., Lyah I.V., Doroshenko E.M., Smirnov V.Yu., Mogilevec O.N. Svobodnye aminokisloty i ih azotsoderzhashchie metabolity v gipotalamuse krys pri ostroj intoksikacii dinilom i ih korrelyaciya s aminokislotnym spektrom plazmy krovi. Vestnik VGMU. 11(1): 31–35. 2012. (In Russ)].
Harris R., Wen S. Review: Taurine: A ”very essential” amino acid. Mol. Vis. 18: 2673–2686. 2012.
Ito T., Kimura Y., Uozumi Y., Takai M., Muraoka S., Matsuda T., Ueki K., Yoshiyama M., Ikawa M., Okabe M., Schaffer S.W., Fujio Y., Azuma J. Taurine depletion caused by knocking out the taurine transporter gene leads to cardiomyopathy with cardiac atrophy. J. Mol. Cell. Cardiol. 44: 927–937. 2008.
Iwata K. Nitrogen metabolism in the mudskipper, Periophthalmus cantonens: Changes in free amino acids and related compounds in various tissues under conditions of ammonia loading, with special reference to its high ammonia tolerance. Comp. Biochem. Physiol. Part A: Physiol. 91 (3): 499–508. 1988.
Galloway S.D., Talanian J.L., Shoveller A.K., Heigenhauser G.J, Spriet L.L. Seven days of oral taurine supplementation does not increase muscle taurine content or alter substrate metabolism during prolonged exercise in humans. J. Appl. Physiol. 105 (2): 643–651. 2008.
Tachiki K.H., Baxter C.F. Taurine: levels in brain tissue: the need for reevaluation. J. Neurochem. 33 (5): 1125–1129. 1979.
Morozov V.I., Sakuta G.A., Kalinski M.I. Sphingosine-1-phosphate: distribution, metabolism and role in the regulation of cellular functions. Ukr. Biochem. J. 85 (1): 5–21. 2013.
Ferreira A.K., Meneguelo R., Pereira A. et al. Anticancer Effects of Synthetic Phosphoethanolamine on Ehrlich Ascites Tumor: An Experimental Study. Anticancer Res. 32 (1): 95–104. 2012.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии