Журнал эволюционной биохимии и физиологии, 2021, T. 57, № 2, стр. 124-135
ВЛИЯНИЕ НИЗКОМОЛЕКУЛЯРНЫХ АЛЛОСТЕРИЧЕСКИХ АГОНИСТОВ РЕЦЕПТОРА ЛЮТЕИНИЗИРУЮЩЕГО ГОРМОНА НА ЕГО ЭКСПРЕССИЮ В СЕМЕННИКАХ САМЦОВ КРЫС
А. А. Бахтюков 1, К. В. Деркач 1, И. В. Романова 1, В. Н. Сорокоумов 1, 2, Т. В. Соколова 1, А. И. Говди 1, 2, И. Ю. Морина 1, А. А. Перминова 1, 3, А. О. Шпаков 1, *
1 Федеральное государственное бюджетное учреждение науки Институт эволюционной физиологии и биохимии
им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
3 Федеральное государственное бюджетное учреждение “НМИЦ им. В.А. Алмазова” Минздрава России
Санкт-Петербург, Россия
* E-mail: alex_shpakov@list.ru
Поступила в редакцию 23.09.2020
После доработки 29.10.2020
Принята к публикации 16.11.2020
Аннотация
Хорионический гонадотропин человека (ХГЧ) и лютеинизирующий гормон (ЛГ) регулируют тестикулярный стероидогенез, взаимодействуя с ортостерическим сайтом, расположенным во внеклеточном домене рецептора ЛГ (ЛГР). Применение ХГЧ и ЛГ в медицине сопряжено с побочными эффектами, которые обусловлены гиперактивацией ЛГ-зависимых каскадов и развитием резистентности клеток-мишеней к эндогенным гонадотропинам вследствие снижения активности и экспрессии ЛГР. Альтернативой гонадотропинам являются низкомолекулярные соединения, взаимодействующие с трансмембранным аллостерическим сайтом ЛГР. Целью работы было изучить взаимосвязь между стероидогенными эффектами ХГЧ и тиено[2,3-d]пиримидиновых производных (ТР) с активностью ЛГР-агонистов и их способностью влиять на экспрессию гена Lhr, кодирующего ЛГР, in vitro при действии на первичную культуру клеток Лейдига крысы и in vivo при введении самцам крыс. ХГЧ с высокой эффективностью стимулировал продукцию тестостерона на ранней стадии воздействия на клетки Лейдига (через 30 мин) и при однократном введении самцам крыс (через 3 ч), превосходя по этому показателю ТР. Через 1–3 ч после обработки клеток Лейдига и при длительном введении крысам стероидогенный эффект ХГЧ снижался и становился сопоставимым с ТР. В клетках Лейдига и семенниках крыс ХГЧ подавлял экспрессию гена Lhr, которая в условиях in vivo частично восстанавливалась на 7–10-е сутки, что сопровождалось небольшим повышением стероидогенного эффекта ХГЧ, но существенно ниже его значений в первый день. Обработка соединением ТР03, наиболее активным из изученных ТР, слабо влияла на экспрессию гена Lhr в клетках Лейдига и значимо повышала ее в семенниках крыс при длительном введении препарата. Стероидогенный эффект ТР03 положительно коррелировал с экспрессией гена Lhr. При обработке стареющих крыс стероидогенный эффект ТР03 снижался, что было ассоциировано с отсутствием его стимулирующего эффекта на экспрессию ЛГР. Таким образом, при длительном введении ТР оказывают умеренно выраженный, стабильный во времени, стимулирующий эффект на продукцию тестостерона, но не снижают экспрессию ЛГР, что предотвращает резистентность семенников к эндогенным гонадотропинам при стимуляции стероидогенеза.
ВВЕДЕНИЕ
Эндогенными стимуляторами рецептора лютеинизирующего гормона (ЛГР), относящегося к суперсемейству G-белок-сопряженных рецепторов, являются продуцируемые лютеотропоцитами аденогипофиза гонадотропины – лютеинизирующий гормон (ЛГ) и гипофизарная форма хорионического гонадотропина человека (ХГЧ). Они связываются с высокоаффинным ортостерическим сайтом, который расположен в значительном по размеру внеклеточном домене рецептора [1]. Результатом такого связывания является активация Gs-белков, ответственных за стимуляцию аденилатциклазы и цАМФ-зависимых путей, и Gq/11-белков, осуществляющих стимуляцию фосфолипазы С и кальций-зависимых путей, а также активация регуляторных белков β-аррестинов, контролирующих лиганд-опосредуемый эндоцитоз ЛГР и стимуляцию каскада митогенактивируемых протеинкиназ [2, 3]. Несмотря на структурное сходство и связывание с одним и тем же рецептором, ЛГ и ХГЧ функционально различаются, что обусловлено различными путями эволюции их молекул у млекопитающих, которые привели к дивергенции сигнальных путей и внутримолекулярных мишеней ЛГ и ХГЧ у приматов и человека [4]. Так, ЛГ в большей степени контролирует каскад митогенактивируемых протеинкиназ и 3-фосфоинозитидные каскады, в то время как ХГЧ является мощным стимулятором цАМФ-зависимых путей и зависимого от них стероидогенеза.
В медицине для активации рецептора ЛГ обычно используют выделяемый из мочи беременных женщин плацентарный ХГЧ [5, 6]. Несмотря на высокую активность ХГЧ, при длительном использовании его фармакологических доз отмечают десенситизацию ЛГР и развитие резистентности тканей-мишеней к эндогенным гонадотропинам, подавление активности гипоталамо-гипофизарно-гонадной оси, активацию пролиферативных процессов в гонадах, что может привести к злокачественному перерождению клеток. Вследствие этого последние годы разрабатываются аллостерические агонисты и положительные модуляторы ЛГР, которые специфично, хотя и с более низким сродством в сравнении с гонадотропинами, взаимодействуют с ЛГР. Их мишенями являются аллостерические сайты, расположенные как в трансмембранном канале ЛГР [7, 8], так и в его цитоплазматических петлях [9, 10]. Следует отметить, что в большинстве эволюционно древних G-белок-сопряженных рецепторов ортостерический сайт локализован внутри трансмембранного домена. Вследствие этого предполагают, что в процессе эволюции ЛГР и других рецепторов гликопротеиновых гипофизарных гормонов произошла инверсия ортостерического сайта в аллостерический, причем это произошло сравнительно недавно, что предопределяет появление таких рецепторов только у позвоночных животных [11, 12].
Наибольший интерес среди аллостерических регуляторов ЛГР представляют низкомолекулярные полные агонисты трансмембранного аллостерического сайта рецептора, сконструированные на основе тиено[2,3-d]пиримидинов [7, 13, 14]. В условиях in vivo при однократном введении самцам крыс даже наиболее активные тиено[2,3-d]пиримидиновые производные (ТР) существенно уступали ХГЧ по способности стимулировать продукцию тестостерона [15–17]. В то же время при длительном введении отмечали сближение стероидогенных эффектов аллостерических агонистов и гонадотропина, что может быть обусловлено снижением чувствительности клеток Лейдига к стимуляции гонадотропинами в условиях ХГЧ-индуцированной стимуляции стероидогенеза. Имеются основания полагать, что основной причиной этого являются разнонаправленные изменения экспрессии ЛГР в семенниках крыс, обработанных ТР и ХГЧ.
Одним из основных направлений применения гонадотропинов для коррекции мужских репродуктивных дисфункций в клинике является лечение различных форм гипогонадотропных состояний, а также предотвращение возрастного ослабления стероидогенной функции. Если при лечении гипогонадотропного гипогонадизма чувствительность ЛГР к действию ЛГ, как правило, сохраняется и снижается только в процессе длительной гонадотропиновой терапии, то основной причиной возрастного андрогенного дефицита является резистентность клеток Лейдига к действию ЛГ [18], что делает терапию гонадотропинами в этом случае малоэффективной. Именно этим обусловлено снижение при старении продукции тестостерона клетками Лейдига [19]. Вследствие этого применение аллостерических регуляторов ЛГР могло бы стать хорошей альтернативой препаратам ЛГ и ХГЧ.
Целью настоящей работы было сравнительное изучение влияния однократного и длительного введения самцам крыс разработанных нами ТР и гонадотропина (ХГЧ) на продукцию тестостерона и интратестикулярную экспрессию гена, кодирующего ЛГР. При этом в случае пятидневного введения одного из таких производных (ТР03) и ХГЧ исследовали молодых и стареющих животных с ослабленной стероидогенной функцией, а также с помощью иммуногистохимического подхода оценивали у них количество и распределение ЛГР в семенниках. Изучали также кратковременные эффекты ТР03 и ХГЧ на уровни тестостерона и экспрессию рецептора ЛГ в условиях in vitro при их инкубации с первичной культурой клеток Лейдига крысы.
МАТЕРИАЛ И МЕТОДИКА
Для экспериментов были взяты самцы крыс Wistar возраста 3–4 и 18 месяцев, которых содержали на стандартном рационе со свободным доступом к воде и пище. Все процедуры проводили в соответствии с правилами, разработанными и утвержденными Комитетом по биоэтике ИЭФБ РАН (15.02.2018 г.), и правилами и требованиями, изложенными в документах “European Communities Council Directive 1986” (86/609/EEC) и “Guide for the Care and Use of Laboratory Animals”.
Синтез ТР – соединений 5-амино-N-(трет-бутил)-2-(метилтио)-4-(3-(никотинамидо)фенил)тиено[2,3-d]пиримидин-6-карбоксамида (TP03), 5-амино-N-трет-бутил-4-(3-(1-метил-1H-пиразол-4-карбоксамидо)фенил)-2-(метилсульфанил)тиено[2,3-d]пиримидин-6-карбоксамида (TP04) и 5-амино-N-(трет-бутил)-4-(3-(2-метоксиникотинамидо)фенил)-2-(метилтио)тиено[2,3-d]пиримидин-6-карбоксамида (TP21), осуществляли путем ацилирования 5-амино-4-(3-аминофенил)-N-трет-бутил-2-(метилсульфанил)тиено[2,3-d]пиримидин-6-карбоксамида, как описано ранее [20, 21]. Структуру синтезированных соединений подтверждали с помощью 1H-ЯМР-спектроскопии, используя спектрометр Bruker Avance III 400 (“Bruker”, Германия) и масс-спектрометрию высокого разрешения, используя спектрометр micrOTOF (“Bruker”, Германия).
В каждом эксперименте использовали по шесть самцов крыс Wistar одинакового возраста, со сходной массой тела и без видимых признаков патологии. ТР растворяли в ДМСО и вводили в/б, однократно или в течение нескольких дней (инъекции выполняли ежедневно в 11.00) в суточных дозах 15 мг/кг/сутки для ТР03 и ТР04 и 25 мг/кг/сутки для ТР21. ХГЧ (“Московский эндокринологический завод”, Россия) вводили подкожно в те же сроки в суточной дозе 50 МЕ/крысу. Используемые дозы препаратов соответствовали тем дозам, которые, по результатам предварительных экспериментов, вызывали эффект, соответствующий половине максимального стероидогенного эффекта TP. Контрольным крысам вместо препаратов вводили ДМСО. Уровень тестостерона оценивали через 3 ч после введения препаратов, перед декапитацией, учитывая то, что в этот период времени стероидогенный эффект гонадотропина еще не снижался, а эффект ТР03, ТР04 и ТР21 выходил на плато. Образцы крови для измерения уровня тестостерона получали из хвостовой вены, наркотизируя крыс с помощью 2%-ного раствора лидокаина (2–4 мг/кг массы тела). Концентрацию тестостерона определяли с помощью набора “Тестостерон-ИФА” (“Алкор-Био”, Россия) и спектрофотометра “Anthos Absorbance Reader 2020” (“Anthos Labtec Instruments”, Австрия). После забора крови на тестостерон, через 3 ч после последней инъекции препаратов, крыс наркотизировали с помощью ингаляции 4–5% (v/v) изофлураном и забирали у них яички для оценки в них экспрессии генов ЛГР и проведения иммуногистохимического анализа семенных канальцев.
Частично очищенные клетки Лейдига выделяли из семенников самцов крыс в соответствии с методом [22], как описано ранее [23]. Крыс наркотизировали 4–5%-ным изофлураном, декапитировали и извлекали семенники, которые затем декапсулировали и промывали раствором Хенкса, содержащим 20 мМ Na-HEPES-буфер (pH 7.4), 0.1% БСА и 0.025 мг/мл ингибитора трипсина (буфер А). В течение 5–10 мин при 34°С проводили диссоциацию клеток семенников с помощью коллагеназы (0.25 мг/мл). Эту процедуру останавливали добавлением пятикратного объема буфера А, удаляли семенные канальцы пропусканием образовавшейся суспензии через нейлоновый фильтр (d = 100 мкм). Фильтрат центрифугировали (200 g, 10 мин), и осажденные клетки дважды промывали буфером А. Полученная фракция клеток, наряду с клетками Лейдига, в небольшом количестве содержала герминативные клетки, сперматозоиды и эритроциты. Клетки суспендировали в среде инкубации DMEM/F12 в соотношении 1:1, вносили в 24-луночные планшеты и инкубировали с ТР03 (в ДМСО) или ХГЧ (в физиологическом растворе) при температуре 37°С в атмосфере, содержащей 5% СО2. Продолжительность инкубации составила 30 мин, 1 и 3 ч. В контрольные пробы добавляли ДМСО. После обработки клеток ТР03 или ХГЧ содержимое лунок центрифугировали (10 000 g, 5 мин), супернатант отбирали и использовали для определения концентрации тестостерона в инкубационной среде с помощью набора “Тестостерон-ИФА” (“Алкор-Био”, Россия).
Экспрессию мРНК гена Lhr, кодирующего ЛГР, в семенниках крыс (in vivo) или в осажденных путем центрифугирования (10 000 g, 5 мин) культивируемых клетках Лейдига (in vitro) оценивали с помощью количественной ПЦР в реальном времени, как описано ранее [24]. Для этого из семенников с помощью реагента ExtraRNA (“Evrogen”, Россия) выделяли тотальную РНК. Обратную транскрипцию проводили, используя набор “MMLV RT Kit” (“Evrogen”, Россия). Для количественной оценки экспрессии гена Lhr использовали амплификатор 7500 Real-Time PCR System (“Thermo Fisher Scientific Inc.”, США) и праймеры CTGCGCTGTCCTGGCC (For) и CGACCTCATTAAGTCCCCTGAA (Rev). В качестве референсного использовали ген β-актина (Actb). Результаты анализировали с помощью порогового метода ΔΔСt и программного обеспечения 7500 Software v2.0.6 и Expression Suite Software v1.0.3. Значения RQ рассчитывали по отношению к контролю.
Для иммуногистохимического анализа ЛГР семенники фиксировали в течение 48 ч (+4°C) в 4%-ном растворе пара-формальдегида (“Sigma”, США), промывали 0.9% натрий-фосфатным буфером (PBS), погружали в PBS, содержащий 30% сахарозу (4°C) и замораживали на сухом льду с использованием среды Tissue-Tek® (“Sacura Finetek Europe”, Нидерланды). Серии поперечных срезов из различных уровней яичка (6 мкм) готовили с помощью криостата Leiсa CM-1520 (“Leica Microsystems”, Германия) и монтировали на стеклах SuperFrost/plus (“Menzel”, Германия). В дальнейшем срезы промывали PBS, обрабатывали 0.6% перекисью водорода в PBS (30 мин) для блокирования активности эндогенной пероксидазы, снова промывали PBS (10 мин), а затем тем же буфером, но содержащим 0.1% Тритон X-100 (PBST) (20 мин). Далее срезы инкубировали в течение 1 ч в блокирующем растворе (3% сыворотки козы и 2% БСА в PBST). Инкубацию с первичными поликлональными антителами кролика к ЛГР крысы (“LSBio”, США) осуществляли в 1% блокирующем растворе в разведении 1:1000 в течение ночи при комнатной температуре. После отмывки в PBST (40 мин) срезы инкубировали в течение 1 ч в PBST с вторичными биотинилированными антителами козы против IgG кролика (“VectorLabs”, Великобритания) в разведении 1 : 500. Затем срезы в течение 30 мин промывали с помощью PBS и инкубировали в течение 1 ч в PBS, содержащем стрептавидин-пероксидазу (“BioLegend”, США) (разведение 1 : 700). После промывки в PBS срезы обрабатывали PBS, содержащим 0.03% перекиси водорода и 0.05% 3,3'-диаминобензидина (“Sigma-Aldrich”, США). Реакцию останавливали промывкой дистиллированной водой, после чего срезы помещали под покровное стекло с глицерином. Специфичность иммунной реакции контролировали с помощью отрицательного контроля (реакция в отсутствие антител). Микрофотографии (по 20 для каждого животного) с разных уровней семенников были получены с помощью микроскопа “Carl Zeiss Imager A1” (объектив ×20, “Carl Zeiss”, Германия) с одинаковыми оптическими характеристиками для исследуемых групп животных. Оптические плотности определяли количественно с помощью программы Image J NIH Analysis (“NIH”, США). На каждой микрофотографии анализировали пять различных участков семенных канальцев и определяли оптическую плотность ЛГР-иммунопозитивного материала, которую выражали в условных единицах. Результаты нормировали относительно контроля, принятого за 1.00.
Статистический анализ экспериментальных данных проводили с помощью программы “Microsoft Office Excel 2007”. Нормальность распределения проверяли с помощью критерия Шапиро–Уилка. Для сравнения двух выборок с нормальным распределением использовали t-критерий Стьюдента, для сравнения трех групп – дисперсионный анализ с поправкой Бонферрони. Статистически значимыми считали отличия при уровне значимости p < 0.05. Данные представляли как M ± SEM.
РЕЗУЛЬТАТЫ
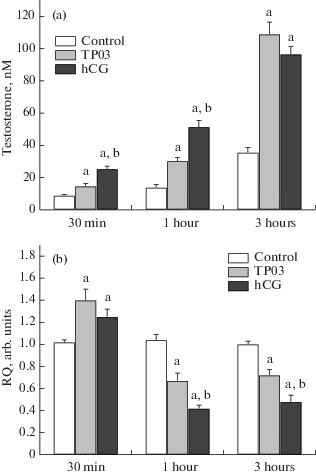
Концентрация тестостерона в инкубационной среде культуры клеток Лейдига, обработанных 10 мкМ ТР03, статистически значимо повышалась через 30 мин, 1 и 3 ч (p < 0.05). При этом стероидогенный эффект ХГЧ (1 МЕ/мл) развивался быстрее, и через 30 мин прирост уровня тестостерона, вызываемый гонадотропином, был в три раза выше эффекта ТР03. Однако в дальнейшем эффект ХГЧ нарастал медленнее, чем таковой ТР03 (рис. 1а). Вследствие этого значения AUC0.5–3, представляющие собой интегрированную площадь под кривой “концентрация тестостерона (нМ) – время (ч)”, для ТР03 и ХГЧ были сходными и составили 150 ± 8 и 167 ± 6 соответственно. При обработке ТР03 и ХГЧ отмечали снижение экспрессии гена Lhr, кодирующего ЛГР, но оно было выражено в большей степени в случае гонадотропина и через 1 и 3 ч экспрессия гена Lhr в клетках Лейдига, обработанных ТР03, была выше таковой в сравнении с клетками, обработанными ХГЧ (рис. 1b). Эти данные свидетельствуют о том, что при действии на культивируемые клетки Лейдига как аллостерический, так и ортостерический агонисты ЛГР, взятые в концентрациях, вызывающих полумаксимальный стероидогенный ответ, с одинаковой эффективностью стимулируют продукцию тестостерона, а также снижают экспрессию гена Lhr, причем ингибирующее влияние гонадотропина выражено в большей степени.
Рис. 1.
Влияние инкубации первичной культуры клеток Лейдига крысы с аллостерическим агонистом ТР03 и гонадотропином на содержание тестостерона в инкубационной среде (а) и экспрессию гена рецептора лютеинизирующего гормона (b). a – различия между контролем и группами с обработкой ТР03 и ХГЧ статистически значимы при p < 0.05; b – различия между группами с обработкой ТР03 и ХГЧ статистически значимы при p < 0.05. Данные представлены в виде M ± SEM, n = 6.
В экспериментах in vivo при введении половозрелым трехмесячным самцам крыс ТР наблюдали существенные различия в их эффектах на продукцию тестостерона и экспрессию гена ЛГР в семенниках. При однократном введении стероидогенный эффект ХГЧ (50 МЕ/крысу, п/к) превосходил эффекты ТР03, ТР04 (оба – 15 мг/кг, в/б) и ТР21 (25 мг/кг, в/б) (табл. 1), в то время как при трехдневном введении стероидогеные эффекты ТР и гонадотропина существенно не различались (табл. 1). Исключение составляло только соединение ТР21, которое по своему стероидогенному эффекту в третий день обработки уступало ХГЧ и ТР03 (табл. 1). Через 3 ч после однократного введения ТР03, ТР04 и ТР21 экспрессия гена Lhr не менялась, в то время как в случае гонадотропина она снижалась в два раза (табл. 1). На третьи сутки обработки отмечали почти полное подавление экспрессии гена Lhr в группе с обработкой ХГЧ, и, напротив, ее повышение в группе с обработкой ТР03. При этом в группах, которым вводили ТР04 и ТР21, экспрессия гена рецептора ЛГ либо не менялась (ТР04), либо имела тенденцию к снижению (ТР21) (табл. 1). При этом отчетливо прослеживается взаимосвязь между величиной стероидогенного эффекта и уровнем экспрессии гена Lhr.
Таблица 1.
Влияние однократной и трехдневной обработки самцов крыс с помощью ТР03, ТР04 и ТР21 и гонадотропина на уровень тестостерона в крови и экспрессию гена рецептора лютеинизирующего гормона в семенниках
| Контроль, ДМСО/ Control, DMSO | ХГЧ, 50 МЕ/крысу/ hCG, 50 IU/rat | ТР03, 15 мг/кг/mg/kg | ТР04, 15 мг/кг/mg/kg | ТР21, 25 мг/кг/mg/kg | |
|---|---|---|---|---|---|
| Уровень тестостерона в крови, нМ/Testosterone level in the blood, nM | |||||
| Однократное введение/Single administration | 17.4 ± 1.4 | 121.6 ± 9.0 a | 63.6 ± 5.5 a,b | 52.5 ± 2.8 a,b | 47.8 ± 2.4 a,b |
| Трехдневное введение/3-day administration | 15.1 ± 1.1 | 68.2 ± 5.1 a | 76.9 ± 7.1 a | 57.0 ± 2.8 a | 43.4 ± 4.8 a,b,c |
| Экспрессия гена Lhr, RQ, отн. Ед/The expression of Lhr gene, RQ, arbitrary units | |||||
| Однократное введение/Single administration | 1.01 ± 0.03 | 0.49 ± 0.08 a | 0.89 ± 0.05 | 0.94 ± 0.05 | 0.84 ± 0.06 |
| Трехдневное введение/3-day administration | 1.03 ± 0.06 | 0.17 ± 0.02 a | 1.68 ± 0.12 a,b | 1.12 ± 0.11 b,c | 0.74 ± 0.08 b,c |
Примечание. Оценка уровня тестостерона и определение экспрессии гена Lhr проводились через 3 ч после введения препаратов. a – различия между контролем и группами с обработкой ХГЧ или ТР статистически значимы при p < 0.05; b – различия между группами с обработкой ХГЧ и ТР статистически значимы при p < 0.05; c – различия между группами с обработкой ТР03 и ТР04 или ТР21 статистически значимы при p < 0.05. Данные представлены в виде M ± SEM, n = 6.
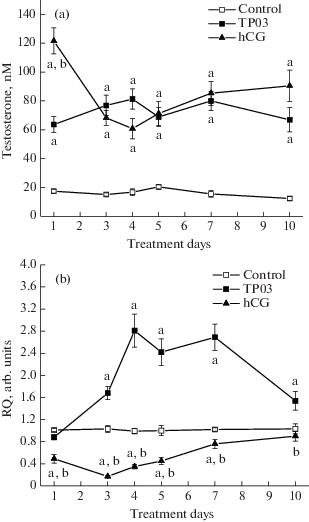
На примере соединения ТР03 показано, что при длительной, в течение 10 дней, обработке самцов крыс стероидогенный эффект ТР03 менялся слабо (рис. 2а). Экспрессия гена Lhr, увеличиваясь на третий день введения, в дальнейшем оставалась повышенной (рис. 2b). Только на 10-й день обработки отмечали небольшое снижение уровня тестостерона и экспрессии гена ЛГР (рис. 2). Стероидогенный эффект ХГЧ на третий день снижался в сравнении с первым днем обработки, и только на 7-й и 10-й дни в небольшой степени восстанавливался (рис. 2а). В то же время экспрессия гена Lhr, достигнув минимума на третий день, затем начинала постепенно повышаться и на 10-й день уже значимо не отличалась от контроля (рис. 2b). Рассчитанные значения AUC1–10(test) для продукции тестостерона (интегрированная площадь под кривой “концентрация тестостерона (нМ) – время (дни)”) в группах с обработкой ТР03 и ХГЧ составили 664 ± 22 и 741 ± 32 и статистически значимо не различались, существенно превышая этот показатель в контроле (145 ± 6, p < 0.05). Значение AUC1–10(expr) для экспрессии гена Lhr (интегрированная площадь под кривой “RQ (отн. ед.) – время (дни)”) в группе с обработкой ХГЧ (5.0 ± 0.3) было достоверно ниже значений AUC1–10(expr) как в контроле (9.1 ± ± 0.2), так и в группе с обработкой ТР03 (18.9 ± 0.9). Таким образом, стероидогенный эффект ТР03 был более устойчивым во времени, чем эффект ХГЧ, а обработка крыс аллостерическим агонистом сопровождалась не снижением, а повышением тестикулярной экспрессии гена, кодирующего ЛГР.
Рис. 2.
Влияние однодневной и длительной обработки самцов крыс с помощью ТР03 и ХГЧ на уровень тестостерона в крови (а) и экспрессию гена рецептора лютеинизирующего гормона в семенниках (b). Оценку уровня тестостерона и определение экспрессии гена Lhr проводили через 3 ч после введения препаратов. a – различия между контролем и группами с обработкой ТР03 и ХГЧ статистически значимы при p < 0.05; b – различия между группами с обработкой ТР03 и ХГЧ статистически значимы при p < 0.05. Данные представлены в виде M ± SEM, n = 6.
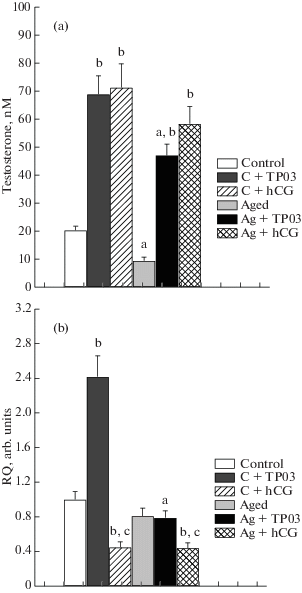
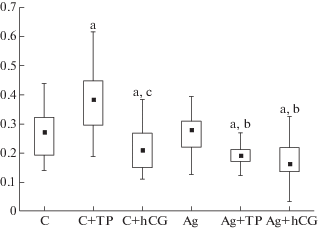
На заключительном этапе исследовали влияние пятидневного введения ТР03 и ХГЧ на стероидогенез, тестикулярную экспрессию гена Lhr, а также на плотность и распределение ЛГР-иммунопозитивного материала в семенниках трехмесячных (контроль) и стареющих (18 мес) самцов крыс. Несмотря на снижение базового уровня тестостерона в крови стареющих животных, стероидогенные эффекты ТР03 и ХГЧ у них сохранялись, хотя в группе Ст + ТР уровень тестостерона был существенно ниже, чем в группе К + ТР (рис. 3). В семенниках стареющих крыс не было выявлено повышения экспрессии гена Lhr при обработке ТР03, но в той же степени, как и в контроле, была снижена экспрессия этого гена при обработке гонадотропином (рис. 3).
Рис. 3.
Уровни тестостерона и экспрессия рецептора ЛГ у контрольных и стареющих, 18-тимесячных крыс, и влияние на них обработки ТР03 и ХГЧ в течение 5 дней. a – различия между группами контрольных и стареющих крыс статистически значимы при p < 0.05; b – различия между группами крыс с обработкой ТР03 или ХГЧ и без таковой статистически значимы при p < 0.05; c – различия между группами, обработанными ТР03 и ХГЧ статистически значимы при p < 0.05.
Иммуногистохимический анализ семенников трехмесячных крыс показал, что обработка ТР03 приводила к увеличению количества ЛГР-иммунопозитивного материала в семенных канальцах, в то время как обработка ХГЧ на него не влияла (рис. 4a–c, рис. 5). У стареющих крыс число ЛГР существенно не менялось в сравнении с контролем, а их обработка ТР03 и ХГЧ снижала количество ЛГР-иммунопозитивного материала, в наибольшей степени в случае гонадотропина (рис. 4d–f, 5). Несмотря на то, что наибольшее количество ЛГР локализовано в клетках Лейдига, основных мишенях ЛГ, ЛГР-иммунопозитивный материал также выявлен в головках созревающих сперматозоидов (рис. 4a–c).
Рис. 4.
Иммуномечение рецептора лютеинизирующего гормона (ЛГР) в семенниках трехмесячных (контроль) и стареющих самцов крыс Wistar и влияние на него пятидневной обработки с помощью ТР03 и ХГЧ. a – C (К), b – C + TP (К + + ТР), c – C + hCG (К + ХГЧ), d – Ag (Ст) , e – Ag + TP (Ст + ТР), f – Ag + hCG (Ст + ХГЧ). Черные стрелки указывают на ЛГР-иммунопозитивность в клетках Лейдига, локализованных вокруг сосудов и капилляров между извитыми семенными канальцами. Пунктирные стрелки указывают на ЛГР-иммунопозитивность в головках сперматозоидов. Масштаб, 100 мкм.
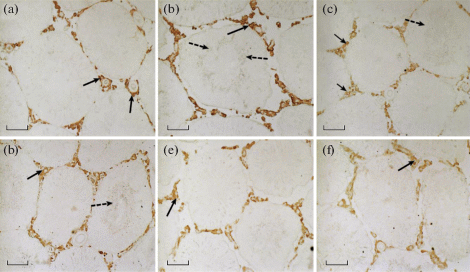
Рис. 5.
Количество рецептора ЛГ в клетках Лейдига трехмесячных (контроль) и стареющих самцов крыс по данным иммуногистохимического анализа и влияние на него обработки ТР03 и ХГЧ. По оси ординат – оптическая плотность в условных единицах. a – различия с контролем статистически значимы при p < 0.05; b – различия между стареющими крысами без введения препаратов и с введением ТР03 и ХГЧ статистически значимы при p < 0.05; c – различие между группами, обработанными ТР03 и ХГЧ, статистически значимы при p < 0.05.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Регуляторные эффекты гонадотропинов с ЛГ-подобной активностью – ЛГ, гипофизарной формы ЛГ и плацентарного ХГЧ, а также низкомолекулярных аллостерических агонистов на основе тиено[2,3-d]пиримидинов реализуются через ЛГР [2, 3, 6]. Гонадотропины специфично связываются с внеклеточным доменом ЛГР, где локализован высокоаффинный ортостерический сайт, и потому их относят к ортостерическим лигандам, в то время как ТР проникают внутрь трансмембранного канала ЛГР и взаимодействуют с локализованным там аллостерическим сайтом, вследствие чего их относят к аллостерическим агонистам этого рецептора [2, 7, 8, 25]. С одной стороны, в обоих случаях происходит переход ЛГР в активную конформацию, в которой он приобретает способность функционально взаимодействовать с нижележащими транс-дукторными белками – G-белками и β-аррестинами, и вызывать ЛГ-зависимые ответы в клетке-мишени. С другой стороны, гонадотропины стабилизируют множество активных конформаций ЛГР, стимулируя сразу несколько внутриклеточных мишеней, в том числе ответственных за десенситизацию и даун-регуляцию ЛГР, в то время как аллостерические агонисты стабилизируют преимущественно одну активную конформацию ЛГР и потому являются избирательными в отношении ЛГ-зависимых путей [7, 8, 26]. При этом даже в случае ЛГ и ХГЧ наблюдается определенная избирательность активации ими внутриклеточных мишеней, которая сформировалась в процессе коэволюции этих гормонов и специфичного к ним рецептора. Предполагают, что эта избирательность обусловлена различным паттерном аллостерических влияний на гормон-связанную форму ЛГР [4].
Избирательность регуляции внутриклеточных каскадов является общим свойством аллостерических регуляторов G-белок-сопряженных рецепторов [27, 28]. Это является следствием происходящей в процессе эволюции аллостерических влияний на паттерн активных конформаций рецепторов [28]. Другим важным отличием аллостерических агонистов от лигандов ортостерического сайта является более мягкая стимуляция внутриклеточных эффекторов, что обусловлено более низким сродством аллостерических агонистов к рецептору [28–30]. Принято считать, что природные аллостерические агонисты эволюционировали от положительных аллостерических модуляторов, постепенно приобретая функции агонистов. В случае ТР показано, что они способны усиливать регуляторные эффекты низких концентраций ХГЧ, оказывая на ЛГ-зависимый сигналинг потенцирующее действие и проявляя тем самым свойства как агонистов, так и положительных модуляторов [25].
Нами показано, что ТР03, имеющий наибольший стероидогенный эффект среди разработанных низкомолекулярных агонистов ЛГР, по активности уступает ХГЧ на ранней стадии инкубации с клетками Лейдига (в первые 30 мин) и при однократном введении самцам крыс (через 3 ч). Ранее нами было показано, что ТР в существенно меньшей степени стимулируют активность аденилатциклазы в тестикулярных мембранах, выделенных из семенников крысы, в сравнении с гонадотропином [14, 20, 21]. В то же время повышение длительности воздействия на клетки-мишени приводит к существенному изменению соотношений стимулирующих эффектов ТР и ХГЧ. Так, уже через 3 ч после инкубации клеток Лейдига с ТР03 его стероидогенный эффект не уступал таковому гонадотропина (рис. 1). При введении ТР самцам крыс в течение 3 и более дней их стероидогенные эффекты были сопоставимы с таковыми гонадотропина, причем это было справедливо как для контрольных, так и стареющих животных (табл. 1, рис. 2–4). Одной из основных причин этого является снижение экспрессии гена, кодирующего ЛГР, в семенниках крыс, многократно обработанных гонадотропином, а также в клетках Лейдига, инкубированных с ХГЧ в течение 1 ч и более. При этом ТР не снижали экспрессию гена Lhr, и более того, как продемонстрировано нами для ТР03, повышали ее при длительном введении самцам крыс. Необходимо отметить, что в случае длительного введения гонадотропина, на 7-й и 10-й дни обработки, экспрессия гена Lhr начинала восстанавливаться, что сопровождалось плавным повышением стероидогенного эффекта ХГЧ, хотя и сильно уступающего таковому в первый день обработки.
Важнейшим фактором, вызывающим ослабление экспрессии ЛГР, является вызываемая гонадотропином гиперактивация цАМФ-зависимых каскадов, которая происходит на ранних стадиях обработки клеток Лейдига в условиях in vitro и самцов крыс в условиях in vivo. Недавно было показано, что индуцированная ХГЧ активация цАМФ-зависимых путей и их основного эффекторного звена, протеинкиназы А, в клетках Лейдига повышает экспрессию фарнезоидного рецептора-α (Farnesoid-X-Receptor alpha, FXRα), основного рецептора желчных кислот. Этот рецептор в семенниках функционирует как транскрипционный фактор, являясь негативным регулятором экспрессии гена Lhr [31–33]. Тем самым реализуется короткая отрицательная обратная связь между повышением уровня цАМФ в клетках Лейдига в ответ на стимуляцию гонадотропином и снижением гормональной чувствительности этих клеток [32]. ТР более мягко стимулируют продукцию цАМФ на ранних стадиях воздействия на клетки-мишени [20, 21], и тем самым не вызывают гиперактивации протеинкиназы А. Базируясь на этом и на обнаруженном нами сохранении и даже повышении экспрессии гена Lhr, имеются все основания полагать, что ТР03 и, возможно, другие ТР слабо влияют на активность фактора FXRα, предотвращая тем самым его ингибирующее влияние на экспрессию ЛГР.
В пользу взаимосвязи между стимулирующим эффектом ТР на продукцию тестостерона и их влиянием на экспрессию гена Lhr свидетельствуют данные по сравнительному анализу эффективности ТР03, ТР04 и ТР21 при их трехдневном введении самцам крыс. ТР03 имел наиболее выраженный стероидогенный эффект и при этом повышал экспрессию гена Lhr, в то время как ТР21 был наименее активным стимулятором продукции тестостерона, и это было ассоциировано со снижением экспрессии ЛГР (табл. 1). В случае ХГЧ отмечали значительное подавление экспрессии гена Lhr, но стероидогенный эффект гонадотропина был сопоставимым с таковым ТР03. Это может быть обусловлено тем, что для умеренно выраженной, стабильной во времени, стимуляции ЛГ-зависимых путей в случае воздействия высокоактивного ортостерического агониста достаточно небольшого количества ЛГР в клетках Лейдига. Тем самым при обработке ХГЧ в семенниках крыс запускаются компенсаторные механизмы, которые направлены на предотвращение гиперпродукции тестостерона, и поддерживают стероидогенез на уровне, который сопоставим с таковым при воздействии ТР.
У стареющих крыс базовая продукция тестостерона снижалась, что является характерным признаком возрастного ослабления тестикулярной функции [15, 34–36]. При этом нами показано, что стероидогенный эффект ХГЧ при его введении стареющим животным в течение пяти дней сохранялся, в то время как соответствующий эффект ТР03 снижался. Это снижение было ассоциировано с отсутствием стимулирующего влияния ТР03 на тестикулярную экспрессию гена Lhr. Следует отметить, что экспрессия этого гена у контрольных и стареющих крыс, получавших ХГЧ, была сходной (рис. 3). Иммуногистохимические исследования показали, что в семенниках трехмесячных крыс, получавших ТР03, количество ЛГР-иммунопозитивного материала повышалось, в то время как у стареющих животных оно было снижено (рис. 4, 5). При этом количество ЛГР-иммунопозитивного материала в семенниках крыс, получавших ХГЧ, снижалось как у молодых, так и у стареющих животных (рис. 4, 5). Одними из причин изменений стимулирующего эффекта ТР03 на экспрессию ЛГР у стареющих крыс могут быть функциональные изменения в тестикулярных гормональных системах, в первую очередь в аденилатциклазной системе и цАМФ-зависимых сигнальных путях [37–40], а также нарушение рибосомального синтеза и посттрансляционного процессинга тестикулярных белков, что характерно для старения и обусловлено усилением окислительного стресса, воспаления, стресса эндоплазматического ретикулума в семенниках [41, 42].
Таким образом, нами впервые показано, что аллостерические агонисты ЛГР на основе тиено[2,3-d]пиримидина как при однократном, так и при длительном введении самцам крыс вызывают умеренно выраженный стероидогенный эффект, но при этом не подавляют экспрессии гена Lhr, а в случае наиболее активного соединения ТР03 повышают экспрессию этого гена. Это отличает их от ХГЧ, стероидогенный эффект которого в первый день обработки достигает максимума, затем в значительной степени ослабевает, что ассоциировано с подавлением экспрессии гена Lhr, и только через 7 дней начинает постепенно восстанавливаться, что обусловлено нормализацией экспрессии ЛГР. Различия в динамике эффектов ТР03 и ХГЧ воспроизводятся и в условиях in vitro при воздействии на систему стероидогенеза и экспрессию гена ЛГР в первичной культуре клеток Лейдига. Показано, что структурно различные ТР различаются по стероидогенным эффектам и влиянию на экспрессию гена Lhr, что, вероятно, обусловлено особенностями их взаимодействия с трансмембранным аллостерическим сайтом ЛГР. В семенниках стареющих крыс стероидогенный эффект ТР03 при его длительном введении ослабевал, что было ассоциировано с исчезновением его стимулирующего эффекта на экспрессию ЛГР. Все вышесказанное позволяет сделать вывод, что при длительном введении ТР умеренно стимулируют тестикулярный стероидогенез и не вызывают снижения экспрессии ЛГР, что важно для предотвращения развития резистентности семенников к эндогенным гонадотропинам в условиях фармакологической стимуляции стероидогенеза. Этот вывод важен в плане использования аллостерических агонистов ЛГР во вспомогательных репродуктивных технологиях, поскольку препараты ХГЧ и рекомбинантного ЛГ при их введении женщинам с целью обеспечения нормального созревания фолликулов и индукции овуляции вызывают синдром гиперстимуляции яичников, как результат гиперактивации ЛГ-зависимых систем, и провоцируют развитие резистентности яичников к гонадотропинам [2, 6, 43, 44].
Список литературы
Nakabayashi K., Kudo M., Hsueh A.J., Maruo T. Activation of the luteinizing hormone receptor in the extracellular domain. Mol. Cell. Endocrinol. 202 (1–2): 139–144. 2003. https://doi.org/10.1016/s0303-7207(03)00075-3
Riccetti L., Yvinec R., Klett D., Gallay N., Combarnous Y., Reiter E., Simoni M., Casarini L., Ayoub M.A. Human luteinizing hormone and chorionic gonadotropin display biased agonism at the LH and LH/CG receptors. Sci. Rep. 7 (1): 940. 2017. https://doi.org/10.1038/s41598-017-01078-8
De Pascali F., Reiter E. β-arrestins and biased signaling in gonadotropin receptors. Minerva Ginecol. 70 (5): 525–538. 2018.https://doi.org/10.23736/S0026-4784.18.04272-7
Casarini L., Santi D., Brigante G., Simoni M. Two Hormones for One Receptor: Evolution, Biochemistry, Actions, and Pathophysiology of LH and hCG. Endocr Rev. 39 (5): 549–592. 2018.https://doi.org/10.1210/er.2018-0006529905829
Choi J., Smitz J. Luteinizing hormone and human chorionic gonadotropin: origins of difference. Mol. Cell. Endocrinol. 383 (1-2): 203–213. 2014. https://doi.org/10.1016/j.mce.2013.12.009
Riccetti L., De Pascali F., Gilioli L., Potì F., Giva L.B., Marino M., Tagliavini S., Trenti T., Fanelli F., Mezzullo M., Pagotto U., Simoni M., Casarini L. Human LH and hCG stimulate differently the early signalling pathways but result in equal testosterone synthesis in mouse Leydig cells in vitro. Reprod. Biol. Endocrinol. 15 (1): 2. 2017.https://doi.org/10.1186/s12958-016-0224-3
van Koppen C.J., Zaman G.J., Timmers C.M., Kelder J., Mosselman S., van de Lagemaat R., Smit M.J., Hanssen R.G. A signaling-selective, nanomolar potent allosteric low molecular weight agonist for the human luteinizing hormone receptor. Naunyn Schmiedebergs Arch. Pharmacol. 378 (5): 503–514. 2008. https://doi.org/10.1007/s00210-008-0318-3
Nataraja S.G., Yu H.N., Palmer S.S. Discovery and development of small molecule allosteric modulators of glycoprotein hormone receptors. Front. Endocrinol. (Lausanne) 6: 142. 2015. https://doi.org/10.3389/fendo.2015.00142
Derkach K.V., Shpakova E.A., Shpakov A.O. Palmitoylated peptide 562–572 of luteinizing hormone receptor increases testosterone level in male rats. Bull. Exp. Biol. Med. 158 (2): 209–212. 2014. https://doi.org/10.1007/s10517-014-2724-5
Shpakova E.A., Sorokoumov V.N., Akent’ev A.V., Derkach K.V., Tennikova T.B., Shpakov A.O. The relationship between micelle formation and biological activity of peptide 562–572 of luteinizing hormone receptor modified by decanoyl radicals. Cell Tissue Biol. 11 (3): 227–233. 2017. https://doi.org/10.1134/S1990519X17030105
Troppmann B., Kleinau G., Krause G., Gromoll J. Structural and functional plasticity of the luteinizing hormone/choriogonadotrophin receptor. Hum Reprod Update. 19 (5): 583–602. 2013.https://doi.org/10.1093/humupd/dmt023
Hollander-Cohen L., Böhm B., Hausken K., Levavi-Sivan B. Ontogeny of the specificity of gonadotropin receptors and gene expression in carp. Endocr Connect. 8 (11): 1433–1446. 2019. 10.1530/EC-19-0389
van de Lagemaat R., Raafs B.C., van Koppen C., Timmers C.M., Mulders S.M., Hanssen R.G. Prevention of the onset of ovarian hyperstimulation syndrome (OHSS) in the rat after ovulation induction with a low molecular weight agonist of the LH receptor compared with hCG and rec-LH. Endocrinology. 152 (11): 4350–4357. 2011. https://doi.org/10.1210/en.2011-1077
Shpakov A.O., Dar’in D.V., Derkach K.V., Lobanov P.S. The stimulating influence of thienopyrimidine compounds on the adenylyl cyclase systems in the rat testes. Dokl. Biochem. Biophys. 456: 104–107. 2014. https://doi.org/10.1134/S1607672914030065
Bakhtyukov A.A., Derkach K.V., Dar’in D.V., Sharo-va T.S., Shpakov A.O. Decrease in the basal and luteinizing hormone receptor agonist-stimulated testosterone production in aging male rats. Adv. Gerontol. 9 (2): 179–185. 2019. https://doi.org/10.1134/S2079057019020036
Bakhtyukov A.A., Derkach K.V., Dar’in D.V., Shpakov A.O. Conservation of steroidogenic effect of the low-molecular-weight agonist of luteinizing hormone receptor in the course of its long-term administration to male rats. Dokl. Biochem. Biophys. 484 (1): 78–81. 2019. https://doi.org/10.1134/S1607672919010216
Bakhtyukov A.A., Derkach K.V., Gureev M.A., Dar’in D.V., Sorokoumov V.N., Romanova I.V., Morina I.Y., Stepochkina A.M., Shpakov A.O. Comparative Study of the Steroidogenic Effects of Human Chorionic Gonadotropin and Thieno[2,3-D]pyrimidine-Based Allosteric Agonist of Luteinizing Hormone Receptor in Young Adult, Aging and Diabetic Male Rats. Int. J. Mol. Sci. 21 (20): 7493. 2020. https://doi.org/10.3390/ijms21207493
Harman S.M., Metter E.J., Tobin J.D., Pearson J., Blackman M.R.; Baltimore Longitudinal Study of Aging. Longitudinal effects of aging on serum total and free testosterone levels in healthy men. J. Clin. Endocrinol. Metab. 86 (2): 724–731. 2001. https://doi.org/10.1210/jcem.86.2.7219
Midzak A.S., Chen H., Paoadopoulus V., Zirkin B.R. Leydig cell aging and the mechanisms of reduce testosterone synthesis. Mol. Cell. Endocrinol. 299 (1): 23–31. 2009. https://doi.org/10.1016/j.mce.2008.07.016
Derkach K.V., Legkodukh A.S., Dar’in D.V., Shpakov A.O. The stimulating effect of thienopyrimidines structurally similar to Org 43553 on adenylate cyclase activity in the testes and on testosterone production in male rats. Cell Tissue Biol. 11 (1): 73–80. 2017. https://doi.org/10.1134/S1990747816030132
Derkach K.V., Dar’in D.V., Bakhtyukov A.A., Loba-nov P.S., Shpakov A.O. In vitro and in vivo studies of functional activity of new low molecular weight agonists of the luteinizing hormone receptor. Biochemistry (Moscow). Suppl. Ser. A: Memb. Cell Biol. 10 (4): 294–300. 2016. https://doi.org/10.1134/S1990747816030132
Abayasekara D.R., Kurlak L.O., Band A.M., Sullivan M.H., Cooke B.A. Effect of cell purity, cell concentration, and incubation conditions on rat testis Leydig cell steroidogenesis. In Vitro Cell. Dev. Biol. 27 (3) : 253–259. 1991. https://doi.org/10.1007/BF02630926
Бахтюков А.А., Соколова Т.В., Дарьин Д.В., Деркач К.В., Шпаков А.О. Сравнительное изучение стимулирующего эффекта низкомолекулярного агониста рецептора лютеинизирующего гормона и хорионического гонадотропина на стероидогенез в клетках Лейдига крысы. Рос. физиол. журн. им. И.М. Сеченова. 103 (10): 1181–1192. 2017 [Bakhtyukov A.A., Sokolova T.V., Dar’in D.V., Derkach K.V., Shpakov A.O. The comparative study of the stimulating effect of low-weight-molecular agonist of the luteinizing hormone receptor and the human chorionic gonadotropin on the steroidogenesis in the rat Leydig cells. Ross. Fiziol. Zh. im. I.M. Sechenova. 103 (10): 1181–1192. 2017. (In Russ)].
Bakhtyukov A.A., Derkach K.V., Dar’in D.V., Stepochkina A.M., Shpakov A.O. A low molecular weight agonist of the luteinizing hormone receptor stimulates adenylyl cyclase in the testicular membranes and steroidogenesis in the testes of rats with type 1 diabetes. Biochemistry (Moscow). Suppl. Series A: Memb. Cell Biol. 13 (4): 301–309. 2019. https://doi.org/10.1134/S1990747819040032
Shpakov A.O., Derkach K.V. The new pharmacological approaches for the regulation of functional activity of G protein-coupled receptors (Chapter 6). In: Evolutionary Physiology and Biochemistry – Advances and Perspectives. Intech Open Access Publisher, Rijeka, Croatia. 61–74. 2018. https://doi.org/10.5772/intechopen.73322
Derkach K.V., Bakhtyukov A.A., Shpakov A.A., Dar’in D.V., Shpakov A.O. Specificity of heterotrimeric G protein regulation by human chorionic gonadotropin and low-molecular agonist of luteinizing hormone receptor. Cell Tissue Biol. 11 (6): 475–482. 2017. https://doi.org/10.1134/S1990519X17060037
Kenakin T., Christopoulos A. Signalling Bias in New Drug Discovery: Detection, Quantification and Therapeutic Impact. Nat. Rev. Drug Discovery. 12: 205–216. 2013. https://doi.org/10.1038/nrd3954
Lindsley C.W., Emmitte K.A., Hopkins C.R., Bridges T.M., Gregory K.J., Niswender C.M., Conn P.J. Practical Strategies and Concepts in GPCR Allosteric Modulator Discovery: Recent Advances with Metabotropic Glutamate Receptors. Chem. Rev. 116 (11): 6707–6741. 2016. https://doi.org/10.1021/acs.chemrev.5b00656
Wenthur C.J., Gentry P.R., Mathews T.P., Lindsley C.W. Drugs for Allosteric Sites on Receptors. Annu. Rev. Pharmacol. Toxicol. 54: 165–184. 2014. https://doi.org/10.1146/annurev-pharmtox-010611-134525
Foster D.J., Conn P.J. Allosteric Modulation of GPCRs: New Insights and Potential Utility for Treatment of Schizophrenia and Other CNS Disorders. Neuron. 94 (3): 431–446. 2017. https://doi.org/10.1016/j.neuron.2017.03.016
Baptissart M., Martinot E., Vega A., Sédes L., Rouaisnel B., de Haze A., Baron S., Schoonjans K., Caira F., Volle D.H. Bile acid-FXRα pathways regulate male sexual maturation in mice. Oncotarget. 7 (15): 19468–19482. 2016. https://doi.org/10.18632/oncotarget.7153
Holota H., Thirouard L., Garcia M., Monrose M., de Haze A., Saru J.P., Caira F., Beaudoin C., Volle D.H. Fxrα gene is a target gene of hCG signaling pathway and represses hCG induced steroidogenesis. J. Steroid Biochem. Mol. Biol. 194: 105460. 2019. https://doi.org/10.1016/j.jsbmb.2019.105460
Holota H., Thirouard L., Monrose M., Garcia M., De Haze A., Saru J.P., Caira F., Beaudoin C., Volle D.H. FXRα modulates leydig cell endocrine function in mouse. Mol. Cell. Endocrinol. 518: 110995. 2020.https://doi.org/10.1016/j.mce.2020.110995
Wang Y., Chen F., Ye L., Zirkin B., Chen H. Steroidogenesis in Leydig cells: effects of aging and environmental factors. Reproduction. 154: 111–122. 2017. https://doi.org/10.1530/REP-17-0064
Kaufman J.M., Lapauw B., Mahmoud A., T’Sjoen G., Huhtaniemi I.T. Aging and the Male Reproductive System. Endocr. Rev. 40: 906–972. 2019. https://doi.org/10.1210/er.2018-00178
Zhou S.J., Zhao M.J., Yang Y.H., Guan D., Li Z.G., Ji Y.D., Zhang B.L., Shang X.J., Xiong C.L., Gu Y.Q. Age-related changes in serum reproductive hormone levels and prevalence of androgen deficiency in Chinese community-dwelling middle-aged and aging men: Two cross-sectional studies in the same population. Medicine. 99: e18605. 2020. https://doi.org/10.1097/MD.0000000000018605
Sokanovic S.J., Janjic M.M., Stojkov N.J., Baburski A.Z., Bjelic M.M., Andric S.A., Kostic T.S. Age related changes of cAMP and MAPK signaling in Leydig cells of Wistar rats. Exp Gerontol. 58: 19–29. 2014. https://doi.org/10.1016/j.exger.2014.07.004
Baburski A.Z., Sokanovic S.J., Andric S.A., Kostic T.S. Aging has the opposite effect on cAMP and cGMP circadian variations in rat Leydig cells. J. Comp. Physiol. 187 (4): 613–623. 2017. https://doi.org/10.1007/s00360-016-1052-7
Aversa A., Duca Y., Condorelli R.A., Calogero A.E., La Vignera S. Androgen Deficiency and Phosphodiesterase Type 5 Expression Changes in Aging Male: Therapeutic Implications. Front Endocrinol (Lausanne). 10: 225. 2019. https://doi.org/10.3389/fendo.2019.00225
Zhao Y., Liu X., Qu Y., Wang L., Geng D., Chen W., Li L., Tian Y., Chang S., Zhao C., Zhao X., Lv P. The roles of p38 MAPK → COX2 and NF-κB → COX2 signal pathways in age-related testosterone reduction. Sci. Rep. 9 (1): 10556. 2019. https://doi.org/10.1038/s41598-019-46794-5
Huang D., Wei W., Xie F., Zhu X., Zheng L., Lv Z. Steroidogenesis decline accompanied with reduced antioxidation and endoplasmic reticulum stress in mice testes during ageing. Andrologia. 50 (1). 2018. https://doi.org/10.1111/and.12816
Zhao H., Ma N., Chen Q., You X., Liu C., Wang T., Yuan D., Zhang C. Decline in testicular function in ageing rats: Changes in the unfolded protein response and mitochondrial apoptotic pathway. Exp. Gerontol. 127: 110721. 2019. https://doi.org/10.1016/j.exger.2019.110721
Veldhuis J.D., Liu P.Y., Takahashi P.Y., Keenan D.M. Dynamic testosterone responses to near-physiological LH pulses are determined by the time pattern of prior intravenous LH infusion. Am. J. Physiol. Endocrinol. Metab. 303: 720–728. 2012. https://doi.org/10.1152/ajpendo.00200.2012
Latronico A.C., Arnhold I.J.P. Gonadotropin resistance. Endocr. Dev. 24: 25–32. 2013. https://doi.org/10.1159/000342496
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


