Журнал эволюционной биохимии и физиологии, 2021, T. 57, № 2, стр. 136-143
ТОПОГРАФИЯ ГАНГЛИОЗНОГО СЛОЯ СЕТЧАТКИ И РЕТИНАЛЬНОЕ РАЗРЕШЕНИЕ У ГРЕБНЕЗУБОГО ДЕЛЬФИНА STENO BREDANENSIS (CETACEA: DELPHINIDAE)
А. М. Масс 1, *, А. Я. Супин 1
1 Институт проблем экологии и эволюции РАН
Москва, Россия
* E-mail: alla-mass@mail.ru
Поступила в редакцию 13.10.2020
После доработки 22.11.2020
Принята к публикации 05.12.2020
Аннотация
На тотальных препаратах сетчатки выполнено морфологическое исследование ганглиозного слоя сетчатки гребнезубого дельфина Steno bredanensis. Составлены карты распределения плотности ганглиозных клеток по поверхности сетчатки. Выявлены две области концентрации ганглиозных клеток: в назальном и темпоральном секторах. Максимальные значения плотности ганглиозных клеток в назальном секторе составили 544 клеток/мм2, в темпоральном – 594 клеток/мм2. Диаметры ганглиозных клеток лежали в пределах от 12 до 50 мкм, в среднем от 20 до 29 мкм в различных областях сетчатки. Для полученных значений плотности ганглиозных клеток ретинальная разрешающая способность составила 11'.
ВВЕДЕНИЕ
Исследования зрительной системы китообразных выявили особенности организации сетчатки глаза, не характерные для большинства наземных млекопитающих. В первую очередь, это касается областей с высокой концентрацией ганглиозных клеток, которые обеспечивают разрешающую способность сетчатки. Форма и положение этих областей могут быть различными у разных видов китообразных; эти различия зависят от условий обитания и систематического положения вида [1].
Данные о топографии ганглиозных клеток, в том числе о форме и расположении зон повышенной концентрации клеток, были получены при исследовании тотальных препаратов сетчатки (wholemounts). Метод исследования ретинальной топографии на тотальных препаратах оказался полезным также для исследования зрения малодоступных видов морских млекопитающих, для которых применение других методов (электрофизиологических, поведенческих) сложно или практически невозможно. Таким способом были получены данные об организации полей зрения у ряда видов китообразных [2–7].
Организация полей зрения существенно различается у разных видов китообразных. Это различие в значительной степени обусловлено оптическими свойствами среды обитания. У представителей нескольких семейств зубатых китов (Odontoceti) [2–6] и некоторых усатых китов (Mysticeti) [7, 8], обитающих в водах с высокой прозрачностью, в поле зрения имеется две области высокого разрешения: в назальном и в темпоральном секторах. Принципиально иная организация поля зрения найдена у представителя семейства Iniidae Inia geoffrensis, обитающего в речных водах с низкой прозрачностью. Помимо низкой плотности ганглиозных клеток, у них обнаружена только одна зона повышенного разрешения в дорзальной части поля зрения [9].
В связи с данными о зависимости полей зрения от свойств среды обитания китообразных, представляет интерес рассмотрение организации поля зрения у тех видов, образ жизни которых сочетает пребывание в водах как высокой, так и низкой прозрачности. Одним из таких видов является гребнезубый дельфин Steno bredanensis Cuvier in Lesson, 1828 (Delphinidae, Odontoceti). Эти дельфины относительно небольшого размера обнаруживаются как в мелких прибрежных водах, так и в глубоких океанических водах тропической и субтропической зон [10]. Зрительная система гребнезубого дельфина практически не изучена. Имеется единственное исследование роговицы глаза (визуальное кератометрическое наблюдение [11]). В литературе нет сведений ни по морфологии глаза, ни по ретинальной организации, ни по разрешающей способности зрительной системы этого вида. Поэтому неизвестно, в какой степени организация поля зрения у гребнезубого дельфина сходна с таковой у зубатых китов, обитающих в прозрачных или малопрозрачных водах. Решение этого вопроса может способствовать пониманию того, в какой степени организация полей зрения у китообразных зависит от систематического положения вида, а в какой – от условий обитания.
Задача данной работы состояла в том, чтобы исследовать морфологию и геометрические параметры глаза, ретинальную топографию и организацию поля зрения, а также ретинальную разрешающую способность сетчатки гребнезубого дельфина S. bredanensis.
МАТЕРИАЛ И МЕТОДИКА
Материал. Материалом для исследования служили два глаза, взятые у одного взрослого дельфина длиной тела 130 см, найденного на побережье в районе острова Фукуи в Южно-Китайском море в 2002 г. во время работы совместной Российско-Вьетнамской экспедиции. Найденное животное было определено как гребнезубый дельфин S. bredanensis Cuvier in Lesson. До исследования материал хранился в 10%-ном буферном формалине, сменяемом ежегодно.
Подготовка материала. Оба глаза найденного животного были использованы для приготовления тотальных препаратов сетчатки (wholemounts). Глаза были фиксированы в 10%-ном буферном формалине. Такая фиксация наиболее приемлема для изготовления тотальных препаратов сетчатки большой площади.
Перед извлечением сетчатки делали наружные обмеры глаза (диаметр и аксиальная длина глазного яблока, размеры роговицы и зрачка). Для извлечения сетчатки удаляли роговицу, хрусталик и стекловидное тело, открывая глазной бокал. Измеряли хрусталик и внутренний диаметр глазного бокала. На сетчатке делали насечки для обозначения ее дорзального и вентрального полюсов, после чего отделяли от пигментного эпителия. На извлеченной сетчатке делали несколько радиальных надрезов, которые позволяли наклеить препарат на плоское предметное стекло. Сетчатку наклеивали ганглиозным слоем вверх и высушивали на воздухе. Препарат окрашивали по методу Ниссля 0.1%-ным раствором крезил-виолета. Степень прокраски контролировали визуально и прекращали, когда прокрашивался поверхностно лежащий ганглиозный слой, без окрашивания глубоких слоев сетчатки. Этим обеспечивалось окрашивание всех поверхностно лежащих ганглиозных клеток, что было важным условием для их подсчета. Окрашенный препарат дегидратировали в последовательности спиртов возрастающей концентрации, просветляли в ксилоле и заключали в заливочную среду Permount (Electron Microscopy Sciences, США). По краям надрезов наблюдали незначительную усадку препарата, возникшую в процессе дегидратации, однако на всей остальной площади фиксация препарата на предметном стекле не страдала.
Исследование препаратов. Распределения ганглиозных клеток в тотальном препарате сетчатки исследовали, используя микроскоп Olympus BX41 (Япония). Объектив микроскопа (×20, не иммерсионный) фокусировали на глубину ганглиозного слоя. Подсчет ганглиозных клеток проводили в пределах этого слоя систематически по всей поверхности сетчатки через 1 мм в квадратах 0.5 × 0.5 мм; границы квадратов устанавливали по окулярной сетке, окуляр ×10. Координаты участков, в которых подсчитывали клетки, задавали координатами столика микроскопа. Как правило, в квадратах площадью 0.25 мм2 насчитывали не менее 20 клеток, а в зонах высокой плотности – до 150 клеток, что мы считали достаточным для картирования с удовлетворительным разрешением. Полученные значения количества клеток в квадратах площадью 0.25 мм2 пересчитывали в плотность клеток (количество на 1 мм2) и для уменьшения разброса данных производили скользящее усреднение в блоках 2 × 2 мм. По этим результатам составляли карты плотности ганглиозных клеток. Для построения карт применяли программы собственной разработки с использованием программной оболочки LabVIEW (National Instruments, США).
Карты распределения ганглиозных клеток использовали также для вычисления общего количества клеток и площади сетчатки. Общее количество клеток определяли как количество клеток во всех квадратах площадью мм2 каждый. Площадь сетчатки определяли как количество квадратов площадью мм2 каждый.
Размеры клеток измеряли в областях сетчатки с разной плотностью клеток: в областях высокой концентрации (назальной и темпоральной) и в областях низкой концентрации (в дорзальном и вентральном секторах). Измерения проводили на цифровых микрофотографиях, сделанных с выбранных участков тотальных препаратов сетчатки (камера Moticam 2300, Китай), c использованием программы Motic Image Plus 2.0 (Hong Kong). Измеряли площади профилей клеток и полученные значения пересчитывали в диаметр равного по площади круга, который принимали за размер тела клетки.
Более подробно методики изготовления и исследования тотальных препаратов сетчатки описаны в ряде публикаций [12–14], в том числе для водных млекопитающих [15, 16].
РЕЗУЛЬТАТЫ
Геометрические характеристики глаза. Глаз гребнезубого дельфина имел свойства, характерные для большинства исследованных видов морских китообразных. Глазное яблоко имело конусовидную форму за счет развитых ретракторных мышц, прикрепленных к заднему сегменту глаза. Глазное яблоко было незначительно уплощено в дорзовентральном направлении: горизонтальный диаметр (26.5 мм) был больше вертикального (24.5 мм). Хрусталик был слабо уплощен в аксиальном направлении: диаметр составлял 8 мм, аксиальная длина 7 мм. Зрачок был вытянут горизонтально и имел размеры 6.5 × 3.4 мм. Верхний край радужки образовывал язычок (оперкулюм) U-образной формы. Хорошо развитый яркий сине-зеленый тапетум покрывал все глазное дно, за исключением небольшой вентральной темнопигментированной области. Склера глаза была толстой, передняя камера мелкой. Роговица слабо овальной формы была уплощена в дорзовентральном направлении: ее горизонтальный диаметр составлял 16.5 мм, вертикальный – 15 мм. Выход глазного нерва находился 1–2 мм дорзальнее оси глазного яблока. Диаметр зрительного нерва составлял 3 мм.
Характеристики ганглиозных клеток. Для идентификации ганглиозных клеток применяли критерии, предложенные в работах, выполненных на других видах наземных [12, 14, 17–20] и морских [5, 15, 16] млекопитающих. В соответствии с этими критериями, ганглиозными считали мультиполярные клетки поверхностного слоя сетчатки со следующими признаками: 1) размер не менее 10 мкм; 2) большое количество цитоплазмы с интенсивно окрашенными глыбками субстанции Ниссля; 3) хорошо видимое светлое ядро с четким ядрышком (рис. 1). Ядро могло располагаться либо в центре клетки, либо эксцентрично.
Рис. 1.
Микрофотографии ганглиозного слоя. (а) В зоне концентрации ганглиозных клеток. (b) В зоне низкой плотности ганглиозных клеток.

Форма ганглиозных клеток была разнообразной. Большинство клеток были круглыми или овальными, иногда с одним четко видимым отростком. Встречались также клетки веретенообразной формы. У очень крупных нейронов были видны места отхождения от сомы клеток одного – двух отростков.
Кроме типичных ганглиозных нейронов ганглиозный слой содержит мелкие клетки с темным крупным ядром и узким ободком цитоплазмы, которые располагались на тех же уровнях, что и ганглиозные нейроны. Такие клетки, согласно критериям, описанным в работах [14, 16–20], считали амакриновыми; их исключали из дальнейшего рассмотрения.
Характерным свойством ганглиозного слоя сетчатки гребнезубого дельфина была низкая плотность ганглиозных клеток: слой составлен редко расположенными нейронами, разделенными большими межклеточными промежутками. Особенно большими были межклеточные промежутки в зонах низкой плотности клеток; в зонах повышенной плотности клеток межклеточные промежутки были несколько меньше, как видно на фрагментах тотальных препаратов, представленных на рис. 1.
Топографическое распределение ганглиозных клеток. Как видно на микрофотографиях ганглиозного слоя (рис. 1a, 1b), плотность ганглиозных клеток в разных областях сетчатки значительно различается. Количественные данные по топографическому распределению плотности ганглиозных клеток получены на обоих имевшихся тотальных препаратах, условно обозначенных ниже как препараты № 1 (левый глаз) и № 2 (правый глаз).
Площади двух препаратов составили 665 и 780 мм2 (разница в 17%), в среднем 722 мм2. Общее количество ганглиозных клеток сетчатки составило 137 тысяч у препарата № 1 и 147 тысяч у препарата № 2 (разница в 7%), в среднем 142 тысячи.
Ганглиозные клетки подсчитывали на всей площади препарата. Если в каком-то квадрате не находили клеток (что было очень редким случаем), на карте ставили «0». На краях радиальных надрезов, где возникала незначительная усадка ткани при дегидратации, не наблюдали повышенной плотности ганглиозных клеток. Это обстоятельство принимали как указание на то, что усадка не оказывала существенного влияния на картирование плотности клеток.
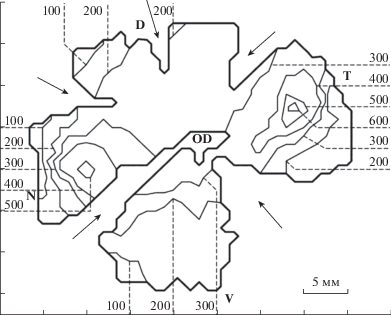
Картирование ганглиозных клеток на обоих препаратах (рис. 2) показало, что сетчатка содержит две зоны повышенной плотности в виде вытянутых овальных областей. На обоих тотальных препаратах области повышенной плотности были сходны по локализации, размеру, форме и ориентации. Одна зона повышенной плотности клеток была расположена в темпоральном квадранте, другая – в назальном квадранте сетчатки. Области максимальной плотности располагались ближе к периферии, чем к центру сетчатки, на расстоянии 12–13 мм от оптического диска. Максимальные плотности клеток в обеих зонах различались незначительно и составили соответственно 544 и 616 клеток/мм2 (различие 13%) у препарата № 1, 543 т 571 клеток/мм2 (различие 5%) у препарата № 2. Средние по двум препаратам значения максимумов плотности составляли 544 и 594 клеток/мм2 (различие 7%) соответственно в назальном и темпоральном квадрантах.
Рис. 2.
Карта распределения плотности ганглиозных клеток в тотальном препарате сетчатки гребнезубого дельфина (левый глаз). Плотности клеток обозначены равноуровневыми линиями, значения которых указаны на сторонах карты. D, V, N, T – соответственно дорзальный, вентральный, назальный и темпоральный полюсы сетчатки, OD – оптический диск. Стрелками указаны радиальные разрезы, сделанные для расправления сетчатки на плоском стекле.
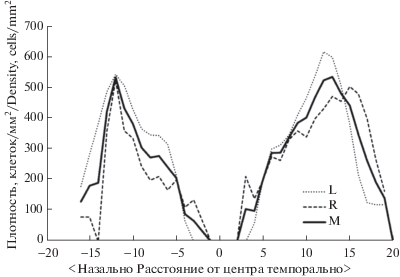
Распределение плотностей ганглиозных клеток на обоих исследованных препаратах демонстрируется профилями распределения плотностей вдоль линии, проходящей через обе зоны повышенной плотности и центр сетчатки (рис. 3). При таком представлении видны два пика повышенной плотности в темпоральном и назальном секторах и значительное снижение плотности между ними.
Рис. 3.
Распределения плотности ганглиозных клеток вдоль линии, проходящей через зоны высокой плотности и центр препарата. L – левый глаз, R – правый глаз, M – средние значения по двум препаратам.
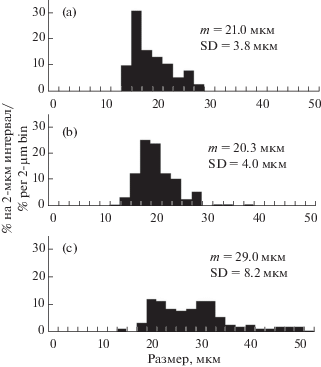
Размеры ганглиозных клеток. На препарате № 1 измерены размеры 440 тел клеток в трех областях сетчатки с различной плотностью ганглиозных клеток. Результаты измерений представлены на рис. 4: а – для темпоральной области высокой плотности, в – для назальной области высокой плотности (в обеих зонах плотность более 500 клеток/мм2) и с – для области низкой плотности на периферии назального сектора (плотность около 100 клеток/мм2). Размеры клеток лежали в пределах от 12 до 50 мкм. В темпоральной и назальной областях размер сомы клеток лежал в пределах от 12 до 28 мкм, в области низкой плотности – от 14 до 50 мкм. Средние размеры в темпоральной и назальной областях были практически одинаковыми и составляли соответственно 20 и 21 мкм. В области низкой плотности средний размер клеток был больше: 29 мкм.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Размеры ганглиозных клеток. Для сетчатки гребнезубого дельфина характерны крупные ганглиозные клетки, разделенные большими межклеточными расстояниями. Крупные ганглиозные клетки были описаны ранее у нескольких видов китов и дельфинов [4, 6–8, 21, 22]. У них основная масса клеток имеет диаметры от 20 до 35 мкм, а отдельные нейроны достигают 60–75 мкм и более. В сетчатке косатки Orcinus orca были обнаружены гигантские ганглиозные клетки размером от 80 до 100 мкм [5]. Таким образом, размеры основной массы ганглиозных нейронов гребнезубого дельфина в основном сходны с размерами клеток в сетчатке большинства других исследованных китообразных, хотя клетки размером более 50 мкм у гребнезубого дельфина не обнаружены.
Количество ганглиозных клеток. Общее количество клеток в сетчатке гребнезубого дельфина (142 тысячи) сопоставимо c таковым у других китообразных: 122 тысячи у кита белухи Delphinapterus leucas [4, 6]; 112–199 тысяч в сетчатке косатки O. orca [5] и ложной косатки Psеudorca crassidens [6]; 220 тысяч у бутылконосого дельфина T. truncatus [2]. Эти значения близки к данным о количестве волокон в зрительном нерве белухи – 137 тысяч [23], бутылконосого дельфина – от 157 до 185 тысяч [22, 24, 25].
Плотность ганглиозных клеток. Для сетчатки гребнезубого дельфина характерна относительно низкая, по сравнению с наземными млекопитающими, плотность ганглиозных клеток. Низкая плотность клеток отмечена и у других представителей китообразных. Максимальная плотность ганглиозных клеток в сетчатке гребнезубого дельфина, выявленная в настоящем исследовании (594 клеток/мм2 в среднем по двум препаратам) сопоставима со значениями 500–700 клеток/мм2 у других видов дельфинов: бутылконосого дельфина T. truncatus [2, 26], дельфина Долла Phocoenoides dalli [27]. Из всех видов китообразных, обитающих в прозрачной морской воде, самая низкая плотность (не более 330 клеток/мм2) найдена в сетчатке косатки O. orca [5].
Таким образом, плотность ганглиозных клеток в сетчатке гребнезубого дельфина сопоставима с таковыми у других зубатых китов. Эта плотность у зубатых китообразных, в том числе у гребнезубого дельфина, на порядок ниже, чем у наземных хищных, у которых она составляет от 7000 до 14 000 клеток/мм2 [14, 28, 29].
Топографическое распределение ганглиозных клеток. Настоящее исследование выявило две области повышенной плотности ганглиозных клеток в сетчатке гребнезубого дельфина. Аналогичная топография ганглиозных клеток с зонами максимальной плотности, локализованными не в центре сетчатки, а на ее периферии, характерна для многих видов китообразных: бутылконосого дельфина T. truncatus [2], обыкновенного дельфина D. delphis [30], дельфина Долла Ph. Dalli [31], ложной косатки P. crassidens [6], белухи D. leucas [4, 6], китайского речного дельфина Lipotes vexillifer и бесперой морской свиньи Nephocaena phocaenoides [32], дельфина тукаши Sotalia fluviatilis [3]. Исключение составляет амазонский речной дельфин Inia geoffrensis, живущий в мутной воде в условиях низкой освещенности. Этот вид имеет лишь одну область повышенной плотности ганглиозных клеток, расположенную в вентральной области сетчатки, проецирующуюся в верхний сектор поля зрения, где освещенность выше [9].
Возможное функциональное значение двух зон повышенной плотности ганглиозных клеток рассматривалось ранее в связи со способностью использовать различные области сетчатки для рассматривания объектов и в воде, и в воздухе [2]. Две области повышенной плотности клеток коррелируют с формой зрачка китообразных, у которых верхний край радужки глаза образует выступ (оперкулюм). При сокращении зрачка оперкулюм выдвигается, так что зрачок приобретает U-образную форму, а при значительном перекрытии зрачок превращается в две щелевидные апертуры, расположенные в темпоральной и назальной его частях [33–35]. Эти апертуры расположены напротив областей повышенной плотности ганглиозных клеток в темпоральной и назальной областях сетчатки. Свет попадает на области повышенной плотности ганглиозных клеток, проходя через периферические области роговицы, затем через щелевидные апертуры зрачка и сферический хрусталик. При высокой освещенности (что характерно для зрения в воздухе) свет попадает на сетчатку через периферическую часть роговицы, которая имеет значительно меньшую кривизну, чем остальная поверхность роговицы. Благодаря меньшей кривизне периферии роговицы уменьшается миопия, в воздухе образуется эмметропичное “оптическое окно” [11, 36, 37]. При этом используется темпоральная зона сетчатки, обеспечивающая фронтальное зрение и, возможно, бинокулярное зрение [38]. При открытом зрачке (при слабой освещенности под водой) свет попадает через расширенный зрачок на все области повышенной плотности, обеспечивая широкое поле монокулярного зрения. Но кривизна роговицы при этом не создает миопии, поскольку коэффициенты преломления перед роговицей (вода) и за ней (жидкость передней камеры глаза) практически одинаковы. Благодаря такому сочетанию оптической системы глаза и организации сетчатки китообразные имеют практически эмметропичное зрение как в воде, так и в воздухе.
Разрешающая способность сетчатки. Разрешающая способность сетчатки может быть определена как среднее угловое расстояние между соседними ганглиозными клетками. Среднее линейное расстояние может быть выведено из данных о плотности ганглиозных клеток простым вычислением:
где L (мм) – расстояние и D (клеток/мм) – плотность. Чтобы перевести линейное расстояние в угловое, необходимо знать расстояние от задней узловой точки оптической системы до сетчатки (постеронодальное расстояние): где α (град) – угловое расстояние между клетками и r (мм) – постеронодальное расстояние. Значение D было получено в результате данного исследования, но постеронодальное расстояние r в данном исследовании не было измерено ввиду ограниченности доступного материала. В качестве первого приближения можно исходить из того, что оптическая система глаза дельфина центрально симметрична, причем центром системы является общая точка центра хрусталика и центра ретинальной полусферы. Поскольку в воде роговица не работает как светопреломляющий элемент, единственным светопреломляющим элементом должен быть почти сферический хрусталик. В этом случае единственная нодальная точка оптической системы совпадает с центром хрусталика, а значит и с центром ретинальной полусферы, а постеронодальное расстояние равно радиусу ретинальной полусферы. При диаметре глазного бокала (среднее значение между вертикальным и горизонтальным диаметрами) 25.5 мм, постеронодальное расстояние может быть принято равным 12.75 мм. Это значение – приблизительная оценка, основанная на ряде допущений, однако оно может быть использовано, чтобы в первом приближении оценить ретинальную разрешающую способность. Подставляя в выражение (2) среднее значение плотности ганглиозных клеток в областях максимальрной их концентрации (594 клеток/мм2) и принятое значение постеронодального расстояния (12.75 мм), получаем: α = 0.18° = 11'. Это значение близко к оценкам ретинального разрешения, полученным у других зубатых китообразных (как семейства Delphinidae, так и других семейств), обитающих в прозрачных океанических водах (табл. 1).Таблица 1.
Ретинальная разрешающая способность некоторых китообразных
| Вид | Ретинальное разрешение в угловых минутах | Ссыл-ки |
|---|---|---|
| Морские дельфины | ||
| Обыкновенный дельфин | 8 | [30] |
| Бутылконосый дельфин | 9 | [2] |
| 8 | [34] | |
| Дельфин Долла | 11.5 | [31] |
| Ложная косатка | 9.3 | [6] |
| Тихоокеанский белобокий дельфин | 11.2 | [6] |
| Белуха | 11.8 | [6] |
| 14.4 | [4] | |
| Косатка | 9.6 | [5] |
| Речные дельфины | ||
| Тукаши | 25 | [3] |
| Амазонский речной дельфин | 40 | [9] |
| Настоящие киты | ||
| Серый кит | 11 | [7] |
| Полосатик Брайда | 6.3* | [8] |
| Горбач | 9.1* | [8] |
| Данное исследование | ||
| Гребнезубый дельфин | 11 | |
Данные ретинального разрешения рассчитанны по плотности ганглиозных клеток для водной среды (преломление света на роговице игнорируется). Данные, отмеченные знаком *, представлены авторами в цикл/град и пересчитаны в угловое разрешение, принимая, что угловое разрешение равно половине цикла, т.е. R = 60/2F, где R – разрешение в угловых минутах и F – разрешение в цикл/град, множитель 60 переводит полученные значения ретинального разрешения из градусов в минуты.
ЗАКЛЮЧЕНИЕ
Топография ганглиозного слоя и разрешающая способность сетчатки гребнезубого дельфина принципиально не отличаются от таковых у других зубатых китообразных, обитающих в океанических водах. Особенности условий обитания этого вида (как прибрежные воды низкой прозрачности, так и океанические воды высокой прозрачности) не отражаются в особенностях организации сетчатки.
Список литературы
Mass A.M., Supin A.Ya. Adaptive features of aquatic mammal’s eye. Anat. Rec. 290: 701–715. 2007.
Mass A.M., Supin A.Ya. Ganglion cells topography of the retina in the bottlenosed dolphin, Tursiops truncatus. Brain, Behav. Evol. 45: 257–265. 1995.
Mass A.M., Supin A.Ya. Retinal topography and visual acuity in the riverine tucuxi, (Sotalia fluviatilis). Marine Mammal Sci. 15: 351–365. 1999.
Mass A.M., Supin A.Ya. Visual field organization and retinal resolution of the beluga, Delphinapterus leucas (Pallas). Aquatic Mammals. 28: 241–250. 2002.
Mass A.M., Supin A.Y., Abramov A.V., Mukhametov L.M., Rozanova E.I. Ocular anatomy, ganglion cell distribution, and retinal resolution of a killer whale (Orcinus orca). Brain Behav. Evol. 81: 1–11. 2013.
Murayama T., Somiya H. Distribution of ganglion cells and object localizing ability in the retina of three cetaceans. Fisheries Sci. 64: 27–30. 1998.
Mass A.M., Supin A.Ya. Ocular anatomy, retinal ganglion cell distribution, and visual resolution in the gray whale, Eschrichtius gibbosus. Aquatic Mammals. 23: 17–28. 1997.
Lisney T.J., Collin S.P. Retinal topography in two species of ballen whale (Cetacea: Mysticety). Brain Behav. Evol. 92: 97–116. 2018.
Mass A.M., Supin A.Ya. Distribution of ganglion cells in the retina of an Amazon river dolphin, Inia geoffrensis. Aquatic Mammals. 15: 49–56. 1989.
West K.L., Mead J.G., White W. Mammalian Sciences Steno bredanensis (Cetacea: Delphinidae). Mammalian Species. 43 (886): 177–189. 2011.
Dral A.D.G. Problems in image-focusing and astigmatism in cetacea – a state of affairs. Aquatic Mammals. 2: 22–28. 1974.
Stone J. The wholemount handbook. A guide to the preparation and analysis of retinal wholemounts. Maitland, Sidney, 1981. 129 pp.
Ullmann J.F.P., Moore B.A., Templ S.E., Fernandez-Juri-cic E., Collin S.P. The retinal wholemount technique: a window to understanding the brain and behaviour. Brain, Behav. Evol.79: 26–44. 2012.
Peichl L. Topography of ganglion cells in the dog and wolf retina. J. Comp. Neurol. 324: 603–620. 1992.
Mass A.M., Supin A.Y. Retinal ganglion cell layer of the Caspian seal Pusa capsica: Topography and localization of the high-resolution area. Brain, Behav. Evol. 76: 144–153. 2010.
Hanke F.D., Peichl L., Dehnhardt G. Retinal ganglion cell topography in juvenile harbor seals (Phoca vitulina). Brain, Behav. Evol. 74: 102–109. 2009.
Hughes A. Population magnitudes and distribution of the major modal classes of cat retinal ganglion cells as estimated from HRP filling and systematic survey of the soma diameter spectra for classical neurons. J. Comp. Neurol. 197: 303–339. 1981.
Wong R.O.L., Wye-Dvorak J., Henry G.H. Morphology and distribution of neurons in the retina ganglion cell layer of the adult Tammar wallaby Macropus eugenii. J. Comp. Neurol. 253: 1–12. 1986.
Wässle H., Hoon C.M., Muller F. Amacrine cells in the ganglion cell layer of the cat retina. J. Comp. Neurol. 265: 391–408. 1987.
Wong R.O.L., Hughes A. The morphology, number and distribution of a large population of confirmed displaced amacrine cells in the adult cat retina. J. Comp. Neurol. 255: 159–177. 1987.
Dawson W.W., Perez J.M. Unusual retinal cells in the dolphin eye. Science. 181: 747–749. 1973.
Dawson W.W., Hawthorne M.N., Jenkins R.L., Goldston R.T. Giant neural system in the inner retina and optic nerve of small whales. J. Comp. Neurol. 205: 1–7. 1982.
Pütter A. Die Augen der Wassersaugetierre. Zool. Jahrb. Abth. Anat. Ontog. Thiere. 17: 99–402. 1903.
Jacobs M.S. Further fiber counts of cetacean cranial nerve. Anat. Rec. 175: 505–506. 1973.
Morgane P.J., Jacobs M.S. Comparative anatomy of the cetacean nervous system. Functional anatomy of marine mammals. Ed. R.J. Harrison, New York, Academic Press, 117–244. 1972.
Dral A.D.G. On the retinal anatomy of Cetacea (mainly Tursiops truncatus). Functional Anatomy of Marine Mammals. Ed. R. J. Harrison. London, Acad. Press. 3: 81–134. 1977.
Murayama T., Fujise Y., Aoki I., Ishii T. Histological characteristics and distribution of ganglion cells in the retina of the Dall’s porpoise and minke whale. In: Marine Mammal Sensory Systems, eds. J.A. Thomas, R.A. Kastelein, A.Ya. Supin, New York: Plenum, 137–145. 1992.
Stone J. The number and distribution of ganglion cells in the cat’s retina. J. Comp. Neurol. 180: 753–772. 1978.
Calderone J.B., Reese B.E., Jacobs G.H. Topography of photoreceptors and retinal ganglion cells in the spotted hyena (Crocuta crocuta). Brain, Behav. Evol. 62: 182–192. 2003.
Dral A.D.G. The retinal ganglion cells of Delphinus delphis and their distribution. Aquatic Mammals. 10: 57–68. 1983.
Murayama T., Somiya H., Aoki I., Ishii T. Retinal ganglion cell size and distribution predict visual capabilities of Dall’s porpoise. Marine Mammal Sci. 11: 136–149. 1995.
Gao A., Zhou K. On the retinal ganglion cells of Neophocoena and Lipotes. Acta Zool. Sin. 33: 316–332. 1987.
Rochon-Duvigneaud A. L’oeil des cétacés. Archives Museum National Histoire Naturelle Paris. 16. 1939.
Herman L.M., Peacock M.F., Yunker M.P., Madsen C.J. Bottlenosed dolphin: Double-slit pupil yields equivalent aerial and under water diurnal acuity. Science. 189: 650–652. 1975.
Dawson W.W., Adams C.K., Barris M.C., Litzkov C.A. Static and kinetic properties of the dolphin pupil. Am. J. Physiol. 237: R301–R305. 1979.
Dral A.D.G. Aquatic and aerial vision in the bottle-nosed dolphin. Neth. J. Sea Res. 5: 510–513. 1972.
Dawson W.W., Schroeder J.P., Sharpe S.N. Corneal surface properties of two marine mammal species. Marine Mammal Sci. 3: 186–197. 1987.
Dawson W.W. The Cetacean Eye. Cetacean Behavior: Mechanisms and Functions. Ed. L.M. Herman. New York. Willey. 53–100. 1980.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии