Журнал эволюционной биохимии и физиологии, 2021, T. 57, № 2, стр. 154-164
ОСОБЕННОСТИ ВОЗДЕЙСТВИЯ ДЕЦИМЕТРОВЫХ ЭЛЕКТРОМАГНИТНЫХ ВОЛН НА АКТИВНОСТЬ ПИРУВАТКИНАЗЫ МОЗГА КРЫС В ОНТОГЕНЕЗЕ
А. М. Рашидова *
Институт физиологии им. академика Абдуллы Караева НАН Азербайджана
Баку, Азербайджан
* E-mail: afag.rashidova@gmail.com
Поступила в редакцию 04.05.2020
После доработки 09.11.2020
Принята к публикации 13.11.2020
Аннотация
Изучено влияние дециметровых микроволн (ЭМИ) на активность одного из ферментов энергообеспечения пируваткиназы (ПК) в структурах мозга 3-, 6- и 24-месячных белых нелинейных крыс. Опытные крысы в течение 10 дней ежедневно по 20 мин подвергались воздействию 10 и 30 мкВт/см2 ЭМИ. Установлено, что активность ПК в корковых и подкорковых структурах головного мозга, различающихся по снабжению кислородом, морфофункциональным и филогенетическим особенностям, по-разному реагирует на воздействие ЭМИ: при 10 мкВт/см2 вызывает повышение, а при 30 мкВт/см2 – снижение ПК-активности в тканях структур головного мозга. В митохондриальной субклеточной фракции структур мозга при 10 мкВт/см2 облучении активность фермента ниже, чем при 30 мкВт/см2. В цитозольной субклеточной фракции структур головного мозга не было выявлено существенных различий в активности ПК в зависимости от степени интенсивности излучения, тогда как эти показатели, взятые отдельно, достоверно различались по сравнению с контролем (p < 0.01; <0.001). Имеются несколько предположений относительно объяснения полученных результатов. Наблюдаемое повышение ПК-активности в изучаемых структурах головного мозга – это процесс метаболической адаптации, направленный на защиту структурной целостности и функциональных компонентов нервных клеток от вредных воздействий излучения. И, наоборот, нехватка энергии, обусловленная падением активности ПК, в свою очередь, вызывает различные вторичные негативные метаболические изменения и окисление свободных радикалов в клетках. Данные показали, что при 10 и 30 мкВт/см2 ЭМИ у крыс эндогенные сигналы направляются от корковых структур к подкорковым, но при этом активность ПК не восстанавливается до контрольных показателей. Предполагается, что под воздействием ЭМИ мозжечок, орбитальная и сенсомоторная кора являются донорами, а лимбическая кора и гипоталамус – акцепторами в системе сигнальной трансдукции.
ВВЕДЕНИЕ
Основным источником энергии, необходимой для деятельности и поддержания структур мозга, являются сопряженные реакции окисления и фосфорилирования, катализируемые комплексом ферментных систем, локализующихся в митохондриях клеток мозга. При этом недостаточно сведений в отношении гликолитических ферментов, в той или иной мере связанных с процессами накопления энергии в клетках мозга. Мозг животных представляет собой гетерогенное образование. Выяснение особенностей динамики изменения и величины активности ферментов энергетического обмена в разных структурах мозга, отличающихся между собой по филогенетическому возрасту, структуре и функции, как в норме, так и после воздействия неблагоприятных факторов среды привлекает внимание исследователей [1, 2].
Пируваткиназа (ПК; КФ 2.7.1.40) – внутриклеточный регуляторный гликолитический фермент генерации АТФ, находящийся практически во всех тканях. Этот фермент в присутствии ионов магния и калия катализирует необратимую реакцию превращения фосфоэнолпирувата в пируват, сопровождающуюся образованием АТФ. Это фосфорилирование не является окислительным процессом. Кроме этого, ПК наряду с фосфофруктокиназой и гексокиназой является основным регулятором гликолитического процесса.
Так как энергетический обмен в головном мозге протекает с высокой интенсивностью, то изменения активности ПК нарушают энергозависимые процессы и могут привести организм к патологическому состоянию. Имеется большое количество данных о влиянии электромагнитного излучения (ЭМИ) на центральную нервную систему (ЦНС), биологические объекты и особенно на организм человека [3–5]. Это связано как с существованием естественных и искусственных источников ЭМИ, так и с их постоянным и растущим внедрением во многие сферы жизнедеятельности человека [3, 6–8]. Исследования биологических эффектов ЭМИ микроволновых диапазонов актуальны и приоритетны: плотность данного частотного диапазона значительно возросла из-за широкого применения предметов первой необходимости (микроволновые печи, мобильные телефоны, компьютеры и т.д.), военных (радиолокационных) и медицинских источников излучения. Интерес к таким исследованиям связан с отсутствием точного механизма действия ЭМИ. Собрано большое количество экспериментальных данных о влиянии и последствиях их воздействия на биологические системы [3, 9]. Раскрытие механизмов повышения резистентности мозга к действию экстремальных факторов продолжает обсуждаться в широких кругах ученых. Актуальной задачей является раскрытие эндогенных защитных механизмов с целью разработки новых способов повышения резистентности мозга к повреждающим воздействиям стресс-факторов [10]. Поскольку энергетический баланс головного мозга на 80% обеспечивается глюкозой, мы попытались проанализировать воздействие ЭМИ на динамику активности одного из основных ферментов гликолиза ПК в структурах головного мозга крыс в различные периоды постнатального онтогенеза. Изменение активности ПК в структурах головного мозга в ответ на воздействие неблагоприятных факторов среды представляет определенный интерес [11, 12].
Обзор литературы показывает, что проблема воздействия ионизирующего и неионизирующего ЭМИ на биологические объекты приобретает все большую актуальность. С учетом важности этой проблемы в представленной работе ставилась цель исследования особенностей воздействия неионизирующих дециметровых электромагнитных волн с плотностью мощностей 10 и 30 мкВт/см2 на активность ПК мозга крыс в онтогенезе в сравнительном аспекте в зависимости от возраста животных, структуры мозга, субклеточного компартмента, а также интенсивности ЭМИ.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты проводились на белых нелинейных крысах-самцах в 3 группах по 54 особи в каждой: 3-месячного (масса 90–110 г), 6-месячного (масса 130–160 г) и 24-месячного (масса 250–270 г) возраста. Группы разделены на 1 контрольную и 2 экспериментальные подгруппы, в каждой по 18 крыс. В специальной камере животные подвергались воздействию ЭМИ с частотой электромагнитных волн 460 МГц с использованием физиотерапевтической установки “Волна-2” (Россия). Опыты проводились на протяжении 10 дней ежедневно в течение 20 мин при 10 и 30 мкВт/см2 интенсивности ЭМИ. Контрольная группа животных, соответствующая тому же возрасту, что и экспериментальная, подвергалась “облучению” под выключенным аппаратом. После 10 дней облучения крыс декапитировали, извлекали головной мозг и на льду идентифицировали структуры мозга: гипоталамус, мозжечок, орбитальную, сенсомоторную и лимбическую кору [13]. Ткани структур головного мозга гомогенизировали в буферной среде, состоящей из 0.2 М трис-HCl буфера (рН 7.4), 1 мМ ЭДТА, 0.25 М сахарозы в соотношении 1:9 и центрифугировали на рефрижераторной центрифуге K-24 (Германия) при 900 g в течение 10 мин. После удаления обрывков ткани супернатант разбавляли в соотношении 1 : 10 раствором 0.32 М сахарозы и центрифугировали в течение 20 мин при 11 000–14 000 g. Далее из супернатанта получали цитозольную субклеточную фракцию (ЦФ) методом дифференциального центрифугирования на ультрацентрифуге “Beckman coulter Optima L-100XP” (Германия) при 100 000 g оборотах в течение 1.5–2.0 ч. Митохондрии после повторного ресуспендирования в 5 мл 0.32 М сахарозы осаждали центрифугированием при 14 000 g в течение 20 мин. Для определения максимальной внутримитохондриальной активности ПК мембраны митохондрий разрушали 1% раствором Тритон Х-100, приготовленном на 0.25 М растворе сахарозы [14]. Все процедуры проводились при температуре 0–4°С. ПК-активность определяли спектрофотометрически на анализаторе скоростей реакции системы “ULTRАLAB-2101” для регистрации активности ферментов (“LKB”, Швеция) при длине волны λ = 340 нм и 25°С с применением ЛДГ в качестве индикаторного фермента окисления NADH [15]. Удельную ферментативную активность ПК считали как µM NADH /1 мин/ мг белка. Общее содержание белка определяли по Брэдфорд, используя 0.01% раствор кумасси бриллиантового синего G‑250, при длине волны λ = 595 нм [16]. Опыты проводили в 6 повторностях. Обработка данных проводилась в программе OriginPro 7.0. Статистическую обработку проводили с использованием пакета анализа программ Statistica. Оценка значимости различий данных между группами проводилась с использованием t-критерия Стьюдента, различия считались достоверными при значениях p < 0.01.
В процессе экспериментов соблюдались правила гуманного обращения с экспериментальными животными, изложенные в директиве Совета Европейского сообщества (86/609/ЕЕС), под наблюдением локального комитета по биоэтике НАН Азербайджана.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Полученные данные в группах молодых (3-месячного возраста), взрослых (6-месячного возраста) и старых (24-месячного возраста) экспериментальных животных показывают достоверные изменения активности ПК в структурах мозга в зависимости от возраста животного, исследуемой структуры, субклеточной фракции и интенсивности воздействия ЭМИ (рис. 1–3).
Рис. 1.
Изменение удельной активности пируваткиназы в тканях структур головного мозга крыс, подвергшихся воздействию ЭМИ интенсивности 10 и 30 мкВт/см2 в онтогенезе (µM NADH /1 мин/ мг белка; М ± m; n = 6; λ = 340, 25°C). Здесь и далее: 1) OC-орбитальная кора, SMC – сенсомоторная кора, LC – лимбическая кора, H-гипоталамус, C – мозжечок; 2) a – 3-месячные крысы, b – 6-месячные крысы, c – 24-месячные крысы; 3) * – p < 0.05; ** – p < 0.01; *** – p < 0.001 – значения достоверности, отражающие различия в активности ПК относительно значения у контрольных крыс соответствующей структуры и возраста.
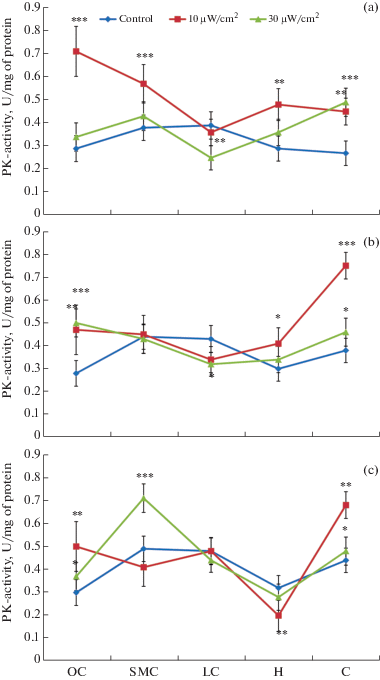
Рис. 2.
Изменение удельной активности пируваткиназы в митохондриях структур головного мозга крыс, подвергшихся воздействию ЭМИ интенсивности 10 и 30 мкВт/см2 (µM NADH /1 мин/мг белка; М ± m; n = 6; λ = 340, 25°C).
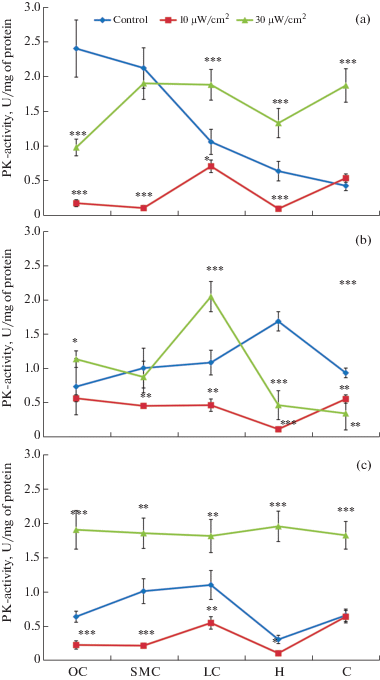
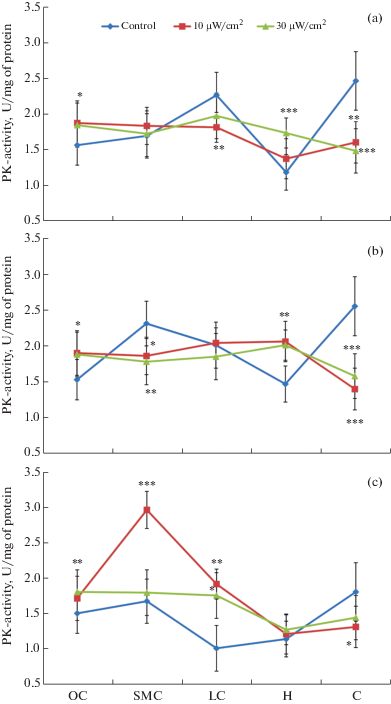
Рис. 3.
Изменение удельной активности пируваткиназы в цитозоле структур головного мозга крыс, подвергшихся воздействию ЭМИ интенсивности 10 и 30 мкВт/см2 (µM NADH /1 мин/ мг белка; М ± m; n = 6; λ = 340, 25°C).
Во всех возрастных группах выявлены следующие изменения: в большинстве случаев в гомогенате тканей структур головного мозга при воздействии излучения интенсивностью в 10 мкВт/см2 активность ПК возрастала по сравнению с контрольной группой крыс в ~2.5 раза (р < 0.001). Причем как у молодых, так и у взрослых особей общая картина динамики активности ПК в тканях структур головного мозга идентична. Лимбическая кора составила исключение, где активность фермента находилась в пределах показателей контроля. В то же время в группе молодых животных, несмотря на некоторое снижение, ПК-активность выше контрольных показателей (p < 0.01). У крыс 24-месячного возраста в некоторых случаях наблюдалась тенденция к снижению активности ПК в структурах мозга до уровня контроля и даже ниже (p < 0.05). Самая высокая активность фермента обнаружена в орбитальной коре 3-месячных крыс (в 2.5 раза выше контроля, p < 0.001), наименьшая – в гипоталамусе 24-месячных крыс (в 1.7 раза ниже контроля, p < 0.01).
Излучение интенсивностью в 30 мкВт/см2 также приводило к различным изменениям ПК-активности в структурах мозга. Причем характер динамики активности фермента различается от такового при излучении интенсивностью в 10 мкВт/см2. А именно, в группе 3-месячных крыс ПК-активность значительно ниже, чем при воздействии излучения в 10 мкВт/см2, но выше контрольных значений, кроме лимбической коры, где наблюдалась гипоактивность фермента (p < 0.01). При сравнении с контрольными показателями, в зависимости от возраста в орбитальной коре у 6-месячных крыс наблюдалось достоверное повышение активности фермента, в то время как у 24-месячных – наблюдалась лишь тенденция к повышению, а у 3-месячных – изменения были недостоверны. В сенсомоторной коре 24-месячных крыс активность фермента достоверно повышалась в 1.2 раза, в то время как в более молодых группах крыс изменения активности фермента недостоверны. В лимбической коре у 3- и 6-месячных крыс различия в показателях наблюдаемой гипоактивности ПК высокодостоверны (p < 0.001), в то время как у 24-месячных – различие в активности ПК недостоверно по сравнению с контролем.
В подкорковых структурах мозга общая картина динамики ПК в возрастных группах идентична: при достоверном изменении активности фермента в группе 3-месячных крыс, с увеличением возраста различия недостоверны. Сравнительный анализ данных показал, что в основном при облучении в 10 мкВт/см2 ПК-активность во всех исследованных тканях структур мозга выше, чем при облучении в 30 мкВт/см2. После экспозиции облучения различными интенсивностями почти во всех возрастных группах лишь в двух структурах мозга – в орбитальной коре и мозжечке – активность фермента была достоверно намного выше контрольного уровня (p < 0.001) (рис. 1).
Исходя из того, что исследования на субклеточном уровне увеличивают интегративную информативность, проведена серия экспериментов с митохондриальной и цитозольной субклеточными фракциями исследуемых структур мозга.
В митохондриальной субклеточной фракции структур мозга на фоне резкого снижения ПК-активности при 10 мкВт /см2 наблюдалась гиперактивность фермента при облучении в 30 мкВт/см2. В частности, при облучении интенсивностью 10 мкВт/см2 у 3- и 24-месячных крыс в корковых структурах и гипоталамусе наблюдалось резкое снижение активности фермента (p < 0.001), в то время, как в мозжечке 3-месячных крыс она повышалась на 25%, а в мозжечке 24-месячных – значения достоверности, отражающие различия в активности ПК относительно значения контрольных крыс соответствующей структуры и возраста недостоверны. У 6-месячных крыс во всех изучаемых структурах мозга, кроме орбитальной коры, выявлено достоверное снижение активности фермента по сравнению с контролем (p < 0.01; < 0.001). В группе 24-месячных крыс при снижении абсолютных показателей разница в общей картине динамики активности фермента во всех структурах мозга, по сравнению с контролем, достоверна (p < 0.01), за исключением мозжечка.
ПК-активность в митохондриальной субклеточной фракции структур мозга крыс при 30 мкВт/см2 облучении намного выше по сравнению с контрольным уровнем (p < 0.001), за исключением орбитальной коры 3-месячных крыс, сенсомоторной коры 3- и 6-месячных крыс, гипоталамуса и мозжечка 6-месячных крыс, где она ниже, чем в контроле. Таким образом, в митохондриальной субклеточной фракции структур мозга ПК-активность при воздействии 30 мкВт/см2 облучения была выше, чем при воздействии 10 мкВт/см2 (рис. 2).
В цитозольной субклеточной фракции структур мозга при излучении в 10 мкВт/см2 распределение активности ПК в зависимости от исследуемой структуры мозга и возраста крыс неравномерное (рис. 3). В частности, в мозжечке крыс всех возрастных групп активность ПК резко снизилась по сравнению с контролем на 35–51% (p < 0.001), тогда как в сенсомоторной и лимбической коре 24-месячных крыс она повысилась почти на 80% (p < 0.001). В остальных структурах наблюдалась тенденция различия в показателях активности ПК по сравнению с таковыми в контроле. Активность ПК в структурах мозга при излучении в 30 мкВт/см2 также выше по сравнению с контрольным уровнем, и в то же время она незначительно отличается от показателей активности фермента, полученных после облучения в 10 мкВт/см2 во всех возрастных группах крыс.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Как гипо-, так и гиперактивность ПК наряду с нарушением энергообеспечения мозга, приводят организм к патологическому состоянию. Предполагается, что изменения в ПК-активности на фоне воздействия ЭМИ различной интенсивности обусловлены включением продуктов распада деятельности ферментов энергоснабжения в клетках и активацией биосинтетических процессов. С другой стороны, известно, что в ответ на воздействие такого фактора, как гипоксия в головном мозге образуется белок НIF-1, который участвует в регуляции транскрипции более чем 60 белков, в том числе и гликолитических ферментов [17]. Этим фактором можно и объяснять изменения в активности ПК под воздействием ЭМИ. При низкоинтенсивном излучении ПК-активность в тканях структур претерпевает более заметные изменения по сравнению с высокоинтенсивным излучением: она достоверно возрастает как по сравнению с контрольным уровнем, так и высокоинтенсивным излучением (р < 0.001). Причем у 3-месячных крыс активность ПК в корковых структурах выше, чем в подкорковых структурах. В то же время у 6- и 24-месячных крыс в мозжечке отмечается высокая активность ПК, что может свидетельствовать о том, что здесь синтез ПК идет более интенсивно. В лимбической коре и гипоталамусе во всех 3 возрастных группах отмечается своеобразное снижение активности ПК. Это объясняется тем, что лимбическая система отвечает за внутренний гомеостаз и снижение в них активности ПК при длительном воздействии ЭМИ (10 дней) также оказывает повреждающий эффект на мозг животных. Можно говорить о направленности сигнала облучения от филогенетически молодых к более древним корковым структурам: от корковых структур → к подкорковым, который ведет к патологии, ухудшению общего состояния, и активность ПК не восстанавливается до контрольных показателей. Предполагается, что под воздействием ЭМИ структуры мозга – орбитальная, сенсомотрная кора и мозжечок являются донорами, а лимбическая кора и гипоталамус – акцепторами в системе сигнальной трансдукции. Это, возможно, связано с тем, что при облучении происходит стереотипная неспецифическая реорганизация метаболизма для поддержания гомеостаза, ингибирование биосинтеза метаболитов пластического обмена и изменения молекулярных механизмов нарушений нервной ткани [18, 19]. Известно, что с увеличением возраста наблюдается повышение свободнорадикального окисления митохондрий, что вызывает снижение энергетического обмена. Дефицит энергии в результате приводит к снижению механизмов адаптации. Полученные результаты подтверждают данные наших прежних исследований по воздействию неблагоприятных факторов среды: пре- и постнатальной гипоксии, а также влияния паров легколетучих фракций сырой нефти на динамику активности ПК в отдельных структурах мозга в онтогенезе [11, 12].
В возрастном аспекте известно, что при снижении энергообеспечения тканей ниже порогового уровня развиваются дегенеративные заболевания, связанные с некоторыми патологическими заболеваниями, а также процессом старения. В то же время, согласно генорегуляторной гипотезе В.В. Фролькиса, возрастные дисфункции регуляции генов могут привести к изменению соотношения синтезируемых белков, экспрессии ранее не обработанных генов, появлению ранее не синтезированных белков и, как следствие, старению клеток [20]. Наши результаты подтверждают эти данные и согласуются с мнением ряда авторов по этому вопросу [21–23].
Клетки содержат как цитоплазматические, так и митохондриальные формы ПК. Анализ полученных данных показывает, что в контрольной группе животных ПК-активность в каждой исследуемой структуре достигает своего максимального значения сначала в цитозольной субклеточной фракции, затем в митохондриальной и ткани в целом. Но при облучении соотношение форм этих ферментов изменяется. Это дает нам основание говорить о способности переключения или “инверсии” активности ПК в субклеточных фракциях тканей структур мозга под воздействием ЭМИ различной интенсивности. То есть, эпигенетически активизируются различные гены ПК, локализованные в различных хромосомах. В этом случае не исключена активация гена Tu M2-PK, вызывающая карциногенез в тканях, которая может привести к летальному исходу, особенно в группах взрослых и старых особей [24, 25]. Это согласуется с работами ученых, в которых было отмечено, что уровень общей антиоксидантной способности был значительно снижен в группах ЭМИ, а уровни общей окислительной способности и индекса окислительного стресса были значительно увеличены в лобной коре, стволе мозга и мозжечке. Это позволило им прийти к заключению, что ЭМИ вызывает в них структурные изменения и ухудшает окислительный стресс и воспалительную систему цитокинов, что может привести к заболеванию, включая потерю функции этих областей и развитие рака [2].
С другой стороны, возможно, неионизирующее облучение, как и гипоксия, позволили организму оптимизировать энергетический обмен за счет появления в клетках митохондрий небольшого размера с пониженным содержанием цитохромов, высокой активностью митохондриальных ферментов, с более низким сродством к своим субстратам и повышенной эффективностью окислительного фосфорилирования [26]. Как следствие, в этом случае активация гликолиза приводит к активации как цитоплазматической, так и митохондриальной ПК [12]. Однако превышение активности митохондриальной формы ПК над цитоплазматической в структурах мозга экспериментальных групп крыс указывает на возрастающие потребности нейрональных клеток в АТФ при специфическом конкретном действии ЭМИ как стресс-фактора [27].
Энергетический обмен в мозге отличается высокой реактивностью и играет важную роль в адаптации функционального состояния в целом. При этом энергетический баланс в мозге преимущественно обеспечивается расщеплением глюкозы [27]. Согласно нашим предыдущим исследованиям дефицит энергии, в свою очередь, вызывает множество вторичных отрицательных метаболических изменений и вызывает окисление свободных радикалов в клетках [12, 28]. Вследствие высокой реакционной способности свободных радикалов многие компоненты клетки становятся мишенью для химических поражений и вызывают более глубокий дефицит энергии в клетке [27, 29]. В этом ракурсе нужно учитывать и роль редокс-гомеостаза в жизнедеятельности клетки, характеризующего определенный баланс между процессами окисления и восстановления и в изучении молекулярных механизмов, участвующих в регуляции редокс-гомеостаза клеток и тканей [30].
Наблюдаемое повышение ПК-активности в изучаемых структурах головного мозга – это процесс метаболической адаптации, направленный на защиту структурной целостности и функциональных компонентов нервных клеток от вредных воздействий ЭМИ. И наоборот, нехватка энергии, в свою очередь, вызывает различные вторичные негативные метаболические изменения и способствует при определенных условиях окислению свободных радикалов в клетках, что, помимо всего, может также ускорить старение организма. Большая вариабельность в показателях активности ПК под воздействием ЭМИ – это нормальное состояние, объясняемое адекватной реакцией мозга на воздействие неблагоприятного фактора. Чередование спада активности ПК с подъемом изменяет оптимальное функционирование нейрональных клеток, и далее самих структур мозга. Снижение активности ПК в лимбической коре и гипоталамусе, включенных в лимбическую систему, говорит о состоянии внутреннего гомеостаза, т.е. мозг усиленно борется за его сохранение, за нормализацию работы редокс-системы. Кроме этого, лимбические структуры участвуют в механизмах памяти; в формировании эпилептической активности, особенно при слабых электромагнитных воздействиях.
В нейрофизиологическом аспекте структуры, в которых активность ПК под воздействием ЭМИ повышается, по своей сути это структуры – доноры, где же снижается – это структуры – акцепторы. Например: от сенсомоторной коры идет компенсаторно-адаптивный сигнал, поддерживающий его внутренний метаболизм и гипоталамус как акцептор, пытается восстановиться и активизировать свои функции. Доноры работают против раздражителя. Определение значимости внешнего раздражителя реализуется в системе ассоциативных структур с участием лимбической системы. Эти два процесса восприятия при организации ответных реакций организма взаимодействуют на элементах интегративно-пусковых систем мозга. К таковым по общепризнанному мнению относятся сенсомоторные отделы коры. Существенная роль сенсомоторной коры в процессах сенсомоторной координации определяется структурно-функциональной организацией связей со специфическими сенсорными и лимбическими структурами мозга, полисенсорными свойствами ее отдельных элементов, их высокой способностью к пластическим перестройкам. На уровне сенсомоторной коры реализуются механизмы согласования сенсорных и моторных элементов поведения, которые осуществляются на выходных элементах СМК, имеющих строгое соответствие между соматическим входом и моторным выходом. Орбитальная кора – функционально более интегративная структура, осуществляющая высшую функцию мозга, а сенсомоторная кора – более ассоциативная структура, отвечающая за сенсорную систему, передает сигнал на моторику и связана с мозжечком. Нейронные импульсы, вызывающие движения, генерируются в коре головного мозга. При повреждении моторной зоны сенсомоторной области нарушается инициирование движений. Структуры мозжечка осуществляют коррекцию движения, но сама программа формируется в коре больших полушарий мозга. При повреждении мозжечка нарушается углеводный, минеральный и белковый обмен, а также процессы энергообразования, терморегуляции и кроветворения. Метаболизм активнее в корковых структурах, так как и кровообращение здесь интенсивнее, максимальная энергия для двигательной системы, биосинтез в корковых структурах идет интенсивнее. В то же время среди различных частей головного мозга наибольшей скоростью обновления белков обладает мозжечок, затем серое вещество больших полушарий, гипоталамус и др.
Таким образом, анализ полученных данных свидетельствует об относительно высокой чувствительности ПК-активности, как маркере, к воздействию ЭМИ на мозг, что, возможно, стимулирует включение компенсаторных и адаптивных механизмов, направленных на нормализацию обмена веществ. Разница в динамике активности ПК в структурах головного мозга, по-видимому, связана с различной степенью поглощения интенсивности ЭМИ тканями этих структур. С другой стороны, реакции адаптации включены, и характер обратной реакции будет связан со степенью стресс-фактора, структурой мозга и с возрастом животного. Это свидетельствует о том, что при воздействии ЭМИ гликолиз, являясь источником энергии для клеток, способствует активизации адаптивно-компенсаторных реакций посредством изменения динамики ферментативных реакций в тканях и клеточных компартментах структур мозга, а также, в зависимости от возраста, может оказывать существенное влияние на биохимический баланс организма в целом. То есть полученные нами экспериментальные данные констатируют факт влияния воздействия ЭМИ на биологические системы, в данном случае, структуры мозга крыс [3, 9].
Митохондриальная ПК может быть важна для поддержания благоприятного для окислительного фосфорилирования содержания внутримитохондриального АДФ и отношения АТФ/АДФ. По мнению ученых, различия окислительно-восстановительного баланса в биологических структурах, количественным выражением которого является эффективный восстановительный потенциал и редокс-буферная емкость, являются общим признаком, характеризующим самые разнообразные процессы структур в организме [31].
ПК по своей сути является релейным ферментом в регуляции энергетического состояния клетки, переключающей синтез АТФ с гликолиза на окислительное фосфорилирование или на лактатный путь ресинтеза АТФ. Учитывая это, можно заключить, что полученные данные позволяют рассматривать изменение активности ПК как детерминанты клеточной реакции в ответ на воздействие ЭМИ, что приводит к временному повышению защиты внутриклеточной энергетики за счет развития адаптивного ответа мозга. В то же время обнаруженные статистически значимые различия в динамике активности ПК указывают на возможности энергосинтетических процессов в зависимости от исследуемого нейронального внутриклеточного компартмента структур головного мозга в онтогенезе. Данное исследование может быть актуальным в решении проблем возрастного энергоснабжения мозга в стрессовых условиях, ведущих к развитию дегенеративных заболеваний, служить основой для коррекции некоторых патологических состояний, а также для выяснения нейрофизиологического механизма реакции организма на воздействие ЭМИ различной интенсивности, с вытекающими отсюда последствиями.
Список литературы
Lipskaya T.Y., Voinova V.V. Mitochondrial nucleoside diphosphate kinase: mode of interaction with the outer mitochondrial membrane and proportion of catalytic activity functionally coupled to oxidative phosphorylation. Biochemistry (Moscow). 73 (3): 321–331. 2008. https://doi.org/10.1134/S0006297908030139
Eser O., Songur A., Aktas C., Karavelioglu E., Caglar V., Aylak F., Ozguner F., Kanter M. The effect of electromagnetic radiation on the rat brain: an experimental study. Turk Neurosurg. 23 (6): 707–715. 2013. https://doi.org/10.5137/1019-5149.JTN.7088-12.2
Григорьев Ю.Г. Мобильный телефон и неблагоприятное влияние на головной мозг пользователя – оценки риска. Рад. биол. радиоэкол. 54 (2): 215–216. 2014. [Grigorev Yu.G. Mobil’nyj telefon i neblagopriyatnoe vliyanie na golovnoj mozg pol’zovatelya – ocenki riska. Rad. Biol. Radioekol. 54 (2): 215–216. 2014. (In Russ)]. https://doi.org/10.7868/S0869803114020052
Krause C.M., Sillanmäki L., Koivisto M. Effects of electromagnetic fields emitted by cellular phones on the electroencephalogram during a visual working memory task. Int. J. Radiat. Biol. 76 (12): 1659–1667. 2000. https://doi.org/10.1080/09553000050201154
Sit’ko S.P. Life as the fourth level of the quantum organization of nature.// Energy and Information Transferin Biological Systems. 293–307. 2003. https://doi.org/10.1142/9789812705181_0014
Хиразова Е.Э., Байжуманов А.А., Трофимова Л.К., Деев Л.И., Маслова М.В., Соколова Н.А., Кудряшова Н.Ю. Влияние электромагнитного излучения GSM-диапазона на некоторые физиологические и биохимические характеристики крыс. Бюлл. эксперим. биол. мед. 153 (6): 816–819. 2012. [Hirazova E.E., Bayzhuma-nov A.A., Trofimova L.K. Maslova M.V., Sokolova N.A., Kudryashova N.Yu. Vliyanie elektromagnitnogo izlucheniya GSM-diapazona na nekotoryie fiziologicheskie i biohimicheskie harakteristiki kryis. Byull. eksperim. biol. med. 153 (6): 816–819. 2012. (In Russ)]. https://doi.org/10.1007/ s10517-012-1833-2
Яшин А.И. Резонансные эффекты во взаимодействии электромагнитных полей с биосистемами. Ч. I. Виды резонансов и их физико-биологические модели. J. Newmed. Technol. 2: 127–143. 2018. [Yashin A.I. Rezonansnyie effektyi vo vzaimodeystvii elektromagnitnyih poley s biosistemami. Ch. I. Vidyirezonansov i ih fiziko-biologicheskie modeli. J. New med. Technol. 2: 127–143. 2018. (In Russ)].https://doi.org/10.24411/2075-4094-2018-16005
Zosangzuali M.Z., Lalramdinpuii M., Ganesh C. J. Impact of radiofrequency radiation on DNA damage and antioxidants in peripheral blood lymphocytes of humans residing in the vicinity of mobile phone base stations. Elektromagn. Biol. and Med. 36 (3): 295–305. 2017. https://doi.org/10.1080/15368378.2017.1350584
Radon K., Parera D., Rose D.-M., Jung D., Vollrath L. No effects of pulsed radio frequency electromagnetic fields on melatonin, cortisol and selected markers of the immune system in man. Bioelectromagnetics. 22 (4): 280–287. 2001. https://doi.org/10.1002/bem.51
Samoilov M.O., Rybnikova E.A. Molecular-Cellular and Hormonal Mechanisms of Induced Tolerance of the Brain to Extreme Environmental Factors. Neuroscience and Behavioral Physiology. 43 (7) : 827–837. 2013. https://doi.org/10.1007/s11055-013-9813-1
Рашидова А.М. Динамика активности ферментов энергообеспечения головного мозга крыс на фоне воздействия стресс-факторов. Ж. Українська товариства генетик тот селекціонер – Вісник Українськое товариство генетик і селекціонер. 17 (1): 16–32. 2019. [Rashidova A.M. Dinamika aktivnosti fermentov energoobespecheniya golovnogo mozga krys na fone vozdejstviya stress-faktorov. ZH. Ukraїns’ka tovaristva genetik tot selekcіoner – Vіsnik Ukraїns’koe tovaristvo genetik і selekcіoner. 17 (1): 16–32. 2019. (In Russ)]. https://doi.org/10.7124/visnyk.utgis.17.1.1197
Rashidova A.M. Effect of pre-/postnatal hypoxia on pyruvate kinase in rat brain. Int. J. Sec. Metabolite. 5 (3): 224–232. 2018. https://doi.org/10.21448/ijsm.450963
Khazipov R., Zaynutdinova D., Ogievetsky E., Valeeva G., Mitrukhina O., Manent J-B., Represa A. Atlas of the Postnatal Rat Brain in Stereotaxic Coordinates Front Neuroanat. 9: 161. 2015. https://doi.org/10.3389/fnana.2015.00161
Chinopoulos C., Zhang S.F., Thomas B., Ten V., Starkov A.A. Isolation and functional assessment of mitochondria from small amounts of mouse brain tissue. Meth. Mol. Biol. 793: 311–324. 2011. https://doi.org/10.1007/978-1-61779-328-8_20
Rashidova A.M., Babazadeh S.N., Mamedkhanova V.V., Abiyeva E.Sh. Dynamics in the enzymes activity in brain of rat exposed to hypoxia. Biotechnologia Acta. 12 (4): 42–49. 2019. https://doi.org/10.15407/biotech12.04.043
Kruger N.J. Bradford method for protein quantitation.The protein Protoкols Handbook, (2-nd ed. Ed. be J.M. Walker, Humana press Inc.). Totowa N.J. 15–21. 2002. https://www.springer.com/gb/book/9781588298805
Semenza G.L. Hypoxia-inducible factors in physiology and medicine. Cell. 148 (3): 399–408. 2012. https://doi.org/10.1016/j.cell.2012.01.021
Reisz J.A., Bansal N., Qian J., Zhao W., Furdui C.M. Effects of Ionizing Radiation on Biological Molecules–Mechanisms of Damage and Emerging Methods of Detection. Antioxid Redox Signal. 21 (2): 260–292. 2014. https://doi.org/10.1089/ars.2013.5489
Рашидова А.М., Гашимова У.Ф. Особенности динамики активности пируваткиназы в цитозоле структур мозга облученных молодых и взрослых крыс. Сб. трудов Междунар. Конф. “Радиоэкология-2017”. Киев. 210–213. 2017. [Rashidova A.M., Gashimova U.F. Osobennosti dinamiki aktivnosti piruvatkinazyi v tsitozole struktur mozga obluchennyih molodyih i vzroslyih kryis. Sb. Tr. Mezhd. Konf. “Radioekologiya-2017”. Kiev. 210–213. 2017. (In Russ)]. https://doi.org/10.7124/visnyk.utgis.17.1.1197
Rashidova A.M., Hashimova U.F., Gadimova Z.M. Study of energy metabolism enzymes and state of cardiovascular system in elderly and senile age patients. J. Adv. Gerontol. 10 (1): 86–93. 2020. https://doi.org/10.1134/s2079057020010130
Titorenko V.I. Molecular and Cellular Mechanisms of Aging and Age-related Disorders. Int. J. Mol. Sci. 19 (7): 2049. 2018https://doi.org/10.3390/ijms19072049
Anisimov V.N., Khavinson V.Kh. Peptide bioregulation of aging: Results and prospects. Biogerontology. 11 (2): 139–49. 2009. https://doi.org/10.1007/s10522-009-9249-8
Malavolta M., Caraceni D., Olivieri F., Antonicelli K. New challenges of geriatric cardiology: from clinical top reclinical research. Geriat. Cardiol. 14 (4): 223–232. 2017. https://doi.org/10.11909/j.issn.1671-5411.2017.04.005
Dabbous H.K., Mohamed Y.A.E., El-Folly R.F., El-Talkawy M.D., Seddik H.E., Johar D., Sarhan M.A. Evaluation of Fecal M2PK as a Diagnostic Marker in Colorectal Cancer. J Gastrointest Cancer. 50 (3): 442–450.2019. https://doi.org/10.1007/s12029-018-0088-1
Huang J.X., Zhou Y., Wang C.H., Yuan W.W., Zhang Zd., Zhang X.F. Tumor M2-pyruvate kinase in stool as a biomarker for diagnosis of colorectal cancer: A meta-analysis. J. Can. Res. Ther. 10 (Suppl S3): 225–228. 2014. https://doi.org/10.4103/0973-1482.145886
Lukyanova L.D. Mitochondria Signaling in Adaptation to Hypoxia. International Journal of Physiology and Pathophysiology. 5 (4): 363–381. 2014. https://doi.org/10.1615/IntJPhysPathophys.v5.i4.90
Pellerin L., Magistretti P.J. How to balance the brain energy budget while spending glucose differently. J. Physiology. 546 (2): 325. 2003. https://doi.org/10.1113/jphysiol.2002.035105
Рашидова А.М., Гашимова У.Ф. Возраст-зависимая активность лактатдегидрогеназы в структурах головного мозга крыс в постнатальном онтогенезе, гипоксированных в плодный период. Ж. эвол. биохим. и физиол. 55 (3): 172–178. 2019. [Rashidova A.M., Hashimova U.F. Vozrast-zavisimaya aktivnost laktatdegidrogenazyi v strukturah golovnogo mozga kryis v postnatalnom ontogeneze, gipoksirovannyih v plodnyiy period. J. Evol. Biochem. Physiol. 55 (3): 172–178. 2019. (In Russ)]. https://doi.org/10.1134/S0044452919030124
Harman D. Free Radical Theory of Aging: An Update Increasing the Functional Life Span. ANNALS of the NY Academy of Sciences, 10–21. 2006. https://doi.org/10.1196/annals.1354.003
Tapio S, Jacob V. Radioadaptive response revisited. Radiat Environ Biophys. 46 (1): 1–12. 2007. https://doi.org/10.1007/s00411-006-0078-8
Martinovich G.G., Martinovich I.V., Cherenkevich S.N., Sauer H. Redox buffer capacity of the cell: theoretical and experimental approach. Cell Biochem Biophys. 58 (2): 75–83. 2010. https://doi.org/10.1007/s12013-010-9090-3
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


