Журнал эволюционной биохимии и физиологии, 2021, T. 57, № 2, стр. 144-153
ВОЗРАСТНЫЕ ОСОБЕННОСТИ ГЕНЕРАЦИИ ЭПИЛЕПТИФОРМНОЙ АКТИВНОСТИ В 4-АМИНОПИРИДИНОВОЙ МОДЕЛИ В СРЕЗАХ МОЗГА КРЫСЫ
Е. Ю. Смирнова 1, 2, 3, *, Д. С. Синяк 2, А. В. Чижов 2, 3, А. В. Зайцев 2
1 Национальный медицинский исследовательский центр им. В.А. Алмазова Минздрава России
Санкт-Петербург, Россия
2 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
3 Физико-технический институт им. А.Ф. Иоффе РАН
Санкт-Петербург, Россия
* E-mail: elena.smirnova@mail.ioffe.ru
Поступила в редакцию 01.09.2020
После доработки 09.11.2020
Принята к публикации 11.11.2020
Аннотация
Известно, что эпилептические приступы (иктальные разряды, длящиеся десятки секунд) легче провоцируются в раннем возрасте, тогда как мозг взрослых более устойчив к этой форме патологической активности. Считается, что бóльшая склонность к возникновению эпилептической активности обусловлена преобладанием возбуждения над торможением в развивающемся мозге. Однако какие конкретно молекулярные и нейрофизиологические механизмы лежат в основе этих возрастных различий – до конца не выяснено. В данной работе мы сравнили иктальную активность, вызванную хемоконвульсантом 4-аминопиридином, в горизонтальных срезах энторинальной коры и гиппокампа 3- и 8-недельных крыс Вистар. У 3-недельных крыс иктальному разряду всегда предшествует легко детектируемая преиктальная активность в виде 3–4-секундных ГАМК-глутаматных событий, а у 8-недельных крыс такие события обычно отсутствуют. Также различается устойчивость генерации иктальных событий по отношению к внешним воздействиям. Генерацию иктальных разрядов в энторинальной коре 8-недельной крысы можно полностью заблокировать и вызвать интериктальную активность (одновременные 1–3-сек пачечные разряды нейронов) с частотой 0.2–0.3 Гц путем частичного ингибирования КСС2-котранспортера или Na+/К+-помпы, а также с помощью низкочастотной электрической стимуляции. Такие же воздействия на срезы мозга 3-недельных животных не приводят к подавлению иктальной активности. Таким образом, наши данные показывают, что иктальные разряды в незрелом мозге оказываются устойчивее к внешним воздействиям, чем в мозге 8-недельных животных. Интериктальная и иктальная формы эпилептиформной активности являются антагонистическими у 8-недельных животных, и появление интериктальной активности полностью прерывает генерацию иктальных разрядов, что может быть одним из противоэпилептических механизмов зрелого мозга.
ВВЕДЕНИЕ
Клинические исследования показывают, что чаще всего судороги впервые возникают в раннем детстве [1]. Также известно, что у 2–4% детей в возрасте от 6 мес до 5 лет при повышении температуры тела могут наблюдаться фебрильные судороги [2]. То есть развивающийся мозг в большей степени склонен к генерации эпилептиформной активности, чем мозг взрослого человека [3]. Причиной этого считают преобладание возбуждения над торможением в нервной ткани, которое может быть обусловлено целым рядом причин. Так, в раннем постнатальном периоде развития уровень экспрессии КСС2-котранспортера составляет всего 5–15% от такового во взрослом мозге, тогда как уровень экспрессии NKCC1, наоборот, значительно понижается с развитием [4–8]. КСС2-котранспортер выводит ионы калия и хлора из клетки, а NKCC1-котранспортер закачивает ионы натрия, калия и хлора в клетку. Поэтому пониженный уровень экспрессии КСС2 и повышенный уровень NKCC1 способствуют повышенному уровню хлорид-ионов в цитоплазме. В таких условиях действие основного тормозного нейромедиатора гамма-аминомасляной кислоты (ГАМК) неэффективно и даже может быть возбуждающим, поскольку потенциал реверсии хлорных ГАМКА-рецепторов становится выше потенциала покоя.
Другое отличие свойств тормозной системы в незрелом мозге обусловлено тем, что ГАМКБ-рецептор-опосредованные постсинаптические события формируются на относительно поздних сроках постнатального развития. Например, такие постсинаптические события регистрируются лишь у крыс старше 22 дней [9, 10]. Постсинаптические ГАМКБ-рецепторы оказывают тормозное и шунтирующие действие на нейрон, поскольку активируют калиевые каналы – внутренние выпрямители (inward rectifier, IR) [11].
Недавнее исследование выявило возрастные различия в экспрессии субъединиц Na+/K+-помпы с помощью иммуноблоттинга [12]. В коре и гиппокампе у взрослой мыши значительно выше уровень экспрессии α1- и α3-субъединиц Na+/K+-помпы по сравнению с 6-м днем постнатального развития. Субъединица α1 экспрессируется в глии и нейронах, α3 – только в нейронах [12, 13].
Целью данной работы стало сравнение характеристик эпилептиформной активности в срезах мозга крыс разного возраста, а также поиск защитных нейрофизиологических механизмов, препятствующих генерации иктального разряда во взрослом мозге.
МЕТОДЫ ИССЛЕДОВАНИЯ
Приготовление переживающих срезов энторинальной коры и гиппокампа
В эксперименте использовали 21-дневных и 8‑недельных крыс Вистар (n = 25 и 18 соответственно). Животных содержали в стандартных условиях (соотношение день/ночь составило 12 ч/12 ч, температура 24 ± 4°С) со свободным доступом к корму и воде. Эксперименты выполняли в соответствии с требованиями Комитета по биоэтике ИЭФБ РАН, разработанными на основе международных рекомендаций European Communities Council Directive 1986 (86/609/EEC).
Метод приготовления горизонтальных срезов энторинальной коры и гиппокампа подробно описан ранее [14]. Кратко: крыс декапитировали, затем быстро извлекали головной мозг и помещали его в охлажденную до 0°С искусственную спинномозговую жидкость (ИСМЖ), аэрируемую газовой смесью 95% O2 + 5% CO2.
Срезы мозга толщиной 350 мкм нарезали на вибротоме Microm HM650V (Thermo Fisher Scientific, США) и помещали в аэрируемую ИСМЖ при 35°С. ИСМЖ содержала следующие компоненты (в мМ): 126 NaCl, 2.5 KCl, 1.25 NaH2PO4, 1 MgSO4, 2 CaCl2, 24 NaHCO3, 10 D-глюкозы.
4-аминопиридиновая модель in vitro
Для вызова эпилептиформной активности использовался хемоконвульсант 4-аминопиридин (4‑АП), который блокирует несколько типов калиевых каналов, наиболее важными из которых являются потенциал-зависимые калиевые каналы [15, 16]. В 4-АП модели периодически наблюдается синхронизованная активность всех нейронов локальной сети на протяжении десятков секунд, что описывается как иктальный разряд и считается аналогом эпилептического припадка в целом мозге. В срезах редко могут возникать более короткие залпы активности нейронов длительностью 1–2 с, которые описываются как интериктальные разряды. В 4-аминопиридиновой модели иктальному разряду часто предшествуют короткие (3–4 с) пачки синхронизованной активности, так называемые преиктальные разряды.
В данной работе эпилептиформную активность вызывали при 30°С эпилептогенным раствором следующего состава (в мМ): 150 NaCl, 3.5 KCl, 1.25 NaH2PO4, 0.25 MgSO4, 2 CaCl2, 24 NaHCO3, 10 D-глюкозы, 0.10 4-АП.
Регистрация электрофизиологических показателей нейронов и динамики внеклеточной концентрации ионов калия
Изготовленные срезы перемещали в перфузируемую камеру, нейроны глубоких слоев энторинальной коры визуализировали с помощью микроскопа Nikon Eclipse FN1 (Nikon, Япония), оснащенного водно-иммерсионным объективом (×40), оптическим блоком для дифференциального контраста и цифровой камерой Grasshopper3 GS3-U3-23S6M-C (FLIR, США). Электрофизиологическую регистрацию проводили с помощью усилителя HEKA EPC-10 USB (HEKA Electronic, Германия) и программного обеспечения PatchMaster v2x90.4 (HEKA Electronic).
Активность сети отслеживали по генерации потенциалов действия или по постсинаптическим токам репрезентативного нейрона глубоких слоев энторинальной коры, используя метод патч-кламп в конфигурации “целая клетка” в режиме фиксации тока или напряжения, соответственно. Для записей в режиме фиксации тока использовался калий-глюконатный раствор следующего состава (в мМ): 135 K-gluconate, 10 NaCl, 5 EGTA, 10 HEPES, 4 ATP-Mg, and 0.3 GTP (pH был доведен до 7.25 с помощью KOH). Для записей в режиме фиксации потенциала использовался цезий-метансульфонатный раствор (в мМ): 127 CsMeS, 10 NaCl, 5 EGTA, 10 HEPES, 6 QX314, 4 ATP-Mg, and 0.3 GTP (pH был доведен до 7.25 с помощью СsOH).
За момент генерации иктального разряда было принято начало тонической спайковой активности пирамидных нейронов, т.е. порог генерации первого спайка тонической фазы. В режиме фиксации потенциала на уровне –27 мВ этому соответствует точка начала первого входящего (возбуждающего) тока.
Тормозные постсинаптические токи (ТПСТ) были зарегистрированы во время преиктальной активности в срезах мозга 3-недельных крыс методом патч-клампа в конфигурации «целая клетка» в режиме фиксации напряжения на уровне –27 мВ. Преиктальная активность была охарактеризована тремя параметрами: продолжительностью преиктальной активности, амплитудой и длительностью первого ТПСТ. Продолжительность преиктальной активности измерялась как временной интервал между временем начала первого ТПСТ и временем начала иктального разряда.
Регистрация внеклеточной концентрации ионов калия
Внеклеточную концентрацию калия регистрировали с помощью калиевых электродов, частично заполненных калиевым ионофором I-coctail A. Метод изготовления электродов и регистрации подробно описан ранее [17]. После записи концентрацию ионов калия рассчитывали по формуле:
[Κ+]0 = 3.5 mM ${{e}^{{\alpha (V(t) - {{V}_{{base}}})}}}$, где коэффициент α = 0.044 был определен при калибровке электродов, Vbase – значение потенциала на калиевом электроде в растворе, V(t) – регистрируемый потенциал на калиевом электроде в срезе.
Фармакология
Все реактивы, использованные в работе, были произведены компанией Sigma-Aldrich (США). Для блокады KCC2-котранспортера использовался ингибитор VU0463271 (10 µM), а нейрональной Na+/K+-помпы – оуабаин (5 µМ).
Статистическая обработка
Анализ первичных электрофизиологических данных производился с использованием программы Clampfit 10.5.2.6 (Molecular Devices, CША). Для статистической обработки данных использовалась среда R-Studio 8.12.175.481 (R-Tools Technology, Канада). Нормальность распределения данных оценивалась по критерию Колмогорова–Смирнова. Эффект действия блокаторов оценивался с помощью однофакторного дисперсионного анализа с последующими апостериорными сравнениями средних значений по тесту Тьюки. Все значения приведены как среднее ± стандартная ошибка среднего.
РЕЗУЛЬТАТЫ
1. Эпилептиформная активность в срезах энторинальной коры и гиппокампа 3-недельной крысы
В срезах мозга 21-дневных крыс стабильная иктальная активность возникала через 10–15 мин после применения эпилептогенного раствора. Интервал между иктальными разрядами составил 484 ± 26 с (число срезов n = 16), средняя продолжительность иктальной активности – 33 ± 4 с. При этом интериктальная активность наблюдалась редко или полностью отсутствовала.
На рис. 1 приведена одновременная запись спайковой активности одного репрезентативного нейрона и постсинаптические токи другого нейрона энторинальной коры во время эпилептиформной активности. Чтобы одновременно отслеживать как тормозные (потенциал реверсии порядка ‒50 мВ), так и возбуждающие (потенциал реверсии порядка +10 мВ) постсинаптические токи, в режиме фиксации потенциала удерживалось значение –27 мВ. Представленная на рисунке репрезентативная запись демонстрирует, что в 3-недельном возрасте иктальному разряду обычно предшествует преиктальная активность в виде одного или нескольких продолжительных (3–4 с) ТПСТ, сопровождающихся также спайковой активностью 75% пирамидных нейронов (118 из 160 наблюдений). Порог генерации потенциалов действия пирамидных нейронов энторинальной коры в клонической фазе иктального разряда составлял –38.2 ± 1.0 мВ (n = 16). Однако во время преиктальных разрядов у 38% (18/47) нейронов наблюдались спайки с низким порогом –56.0 ± 1.1 мВ (рис. 1). Такие же спайки зарегистрированы при локальной активации светом хлорных светоуправляемых каналов GtACR на мембране аксона [18]. Согласно работе [19], низкопороговые спайки наблюдаются в том случае, когда они инициированы дистальнее аксонного холмика. Описаны также интернейроны, которые имеют синаптические входы на аксоны пирамидных нейронов, это аксо-аксональные нейроны или клетки-канделябры [20]. Хотя клетки-канделябры являются ГАМКергическими нейронами, их синаптические входы могут оказаться возбуждающими в условиях локального накопления в аксоне хлорид-ионов. Быстрому локальному накоплению хлорид-ионов также способствует низкий уровень экспрессии KCC2-котранспортера у ювенильных животных [21], особенно в области начального сегмента аксона.
Рис. 1.
Спайковая активность репрезентативного нейрона энторинальной коры 21-дневной крысы в 4-аминопиридиновой (4-АП) модели эпилептиформной активности in vitro. Cлева представлена одновременная запись спайковой активности одного нейрона и постсинаптических токов другого нейрона. Иктальному разряду предшествует преиктальная активность в виде продолжительных тормозных постсинаптических токов (ТПСТ), гиперполяризующих событий при фиксации потенциала на –27 мВ. Справа представлены в увеличенном масштабе потенциалы действия во время преиктальной активности (сверху в красной рамке) и во время клонической фазы иктального разряда (снизу в синей рамке). Пороги генерации первого потенциала действия в паттернах отмечены красной и синей точками соответственно.
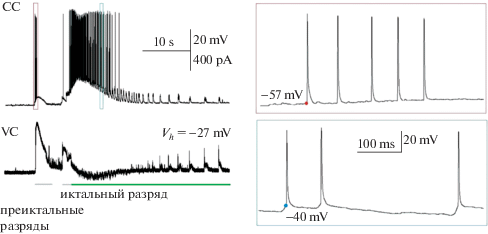
Важной особенностью генерации иктального разряда в срезах мозга 21-дневной крысы в 4-аминопиридиновой модели является продолжительная преиктальная активность, сопровождающаяся ТПСТ, т.е. генерация иктального разряда в незрелом мозге определяется первоначальной синхронной активацией ГАМКергических нейронов.
2. Эпилептиформная активность в срезах мозга 8-недельных крыс
При использовании эпилептогенного раствора в срезах мозга 8-недельной крысы стабильная иктальная активность обычно отсутствовала, чаще устанавливался режим интериктальной активности, когда пачки синхронизованной спайковой активности нейронов продолжительностью менее секунды генерировались с частотой 0.05–0.20 Гц.
Вызвать стабильную иктальную активность в срезе можно было при соблюдении двух условий: 1) отсечении зоны СА3 гиппокампа, которая являлась генератором интериктальной активности; 2) длительном предварительном выдерживании срезов (не менее часа) в ИСМЖ с 0.1 мМ 4-АП. Помещать срезы после порезки сразу в эпилептогенный раствор нежелательно, поскольку это существенно сокращает срок жизни срезов и длительность стабильной генерации иктальной активности.
В режиме иктальной активности у 8-недельных крыс, также как у 3-недельных, между иктальными разрядами редко наблюдались интериктальные разряды, т.е. после прекращения одного иктального разряда срез молчит (рис. 2). Перед генерацией следующего иктального разряда у 8-недельных крыс может возникнуть одна короткая пачка синхронизованной активности (преиктальный разряд). В отличие от 3-недельных животных, она возникала только в 28% (9/32) срезов (рис. 2а). Во время преиктального разряда в половине этих срезов (5/9) также наблюдались низкопороговые спайки (рис. 2в), которые, возможно, свидетельствуют о локальной деполяризации мембраны в аксонах за счет накопления хлорид-ионов. Таким образом, срезы 8-недельных крыс более возбудимы, поскольку в режиме готовности к генерации иктального разряда (в режиме преиктальной активности) находятся короткое время (1–5 с у 8-недельных крыс, 8–50 с у 3-недельных крыс).
Рис. 2.
Эпилептиформная активность в 4-аминопиридиновой модели в срезах энторинальной коры и гиппокампа 8-недельной крысы Вистар. Пример эпилептиформной активности без (а) и при наличии (b) преиктального разряда. Во время преиктальной активности наблюдаются спайки с низким порогом генерации потенциала действия. Cправа приведены примеры спайков в увеличенном масштабе, синей и красной точками, соответственно, отмечены пороги генерации первого в паттерне потенциала действия в тонической фазе иктального разряда и во время преиктального события.
3. Блокада КСС2-котранспортера в срезах мозга 8-недельной крысы прекращает иктальную активность, а в срезах 3-недельной – нет
КСС2-котранспортер отвечает за нормализацию внутриклеточной концентрации хлорид-ионов. Его недостаток приводит к деполяризации потенциала реверсии ГАМКА-рецепторов, тем самым делает неэффективной главную систему торможения нейронов. В ряде работ [22, 23] была выдвинута гипотеза о том, что деполяризующее действие ГАМК, возникающее при неправильном функционировании КСС2-котранспортера, может провоцировать иктальные разряды, кроме того, спайки с низким порогом, которые мы наблюдали во время преиктальной активности, могут свидетельствовать о накоплении хлорид-ионов в нейроне в 4-АП модели. Поэтому мы изучили эффект ингибирования КСС2-котранспортера на эпилептиформную активность, сравнив спайковую активность репрезентативного нейрона до и после добавления в перфузирующий раствор ингибитора КСС2-котранспортера VU0463271 (10 µM).
В срезах гиппокампа и энторинальной коры 3‑недельной крысы ингибитор КСС2-котранспортера VU0463271 (10 µM) не приводил к изменениям свойств эпилептиформной активности (n = 4, рис. 3).
Рис. 3.
Эффект блокады KCC2-котранспортера с помощью VU0463271 (10 µM) в срезах мозга 3-недельных крыс.
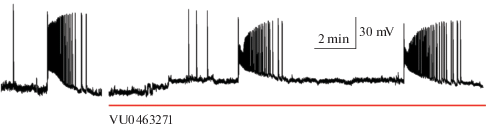
В срезах 8-недельных крыс иктальная активность вызывалась также, как описано в части 2, при этом спустя 5–10 мин после аппликации блокатора KCC2-котранспортера устанавливался режим частой интериктальной активности, при этом мы не наблюдали деполяризации нейрона или изменения внеклеточной концентрации ионов калия (n = 5, рис. 4). На рис. 4 показано, что после генерации очередного иктального разряда, нейронная сеть продолжает генерировать пачечную активность, характерную для клонической фазы.
Рис. 4.
Блокада KCC2-котранспортера с помощью VU0463271 (10 µM) в срезах энторинальной коры и гиппокампа с отсечением зоны CA3 гиппокампа 8-недельных крыс препятствует генерации иктальных разрядов. Эффект продемонстрирован с помощью одновременной регистрации внеклеточной концентрации калия и спайковой активности репрезентативного нейрона глубоких слоев энторинальной коры.
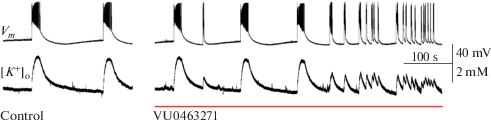
Эта серия экспериментов позволяет сделать вывод, что при блокаде КСС2-котранспортера не может прекратиться клоническая фаза иктального разряда в срезах 8-недельных крыс. Качественное различие в эффектах блокады КСС2-котранспортера у крыс разных возрастов требует дальнейшего исследования.
4. Частичная блокада Na+/K+-помпы в срезах мозга 8-недельных крыс прекращает иктальную активность, а у 3-недельных – нет
Поскольку возбудимость нервной ткани зависит от внеклеточной концентрации ионов калия, то еще одним механизмом, препятствующим эпилептической активности, должно быть изменение активности нейрональной Na+/K+-помпы [24]. Помпа выкачивает ионы натрия и закачивает ионы калия в клетку из внеклеточного пространства. Мы изучили эффект частичной блокады нейрональной Na+/K+-помпы оуабаином (5 µМ) на эпилептиформную активность.
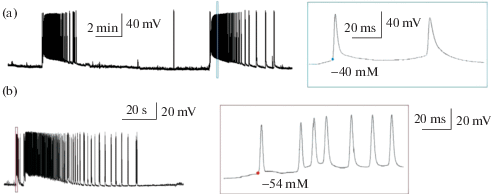
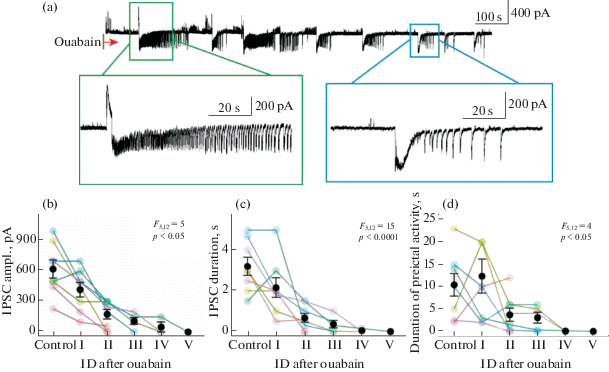
В срезах мозга 3-недельных крыс аппликация оуабаина постепенно уменьшала амплитуду и продолжительность ТПСТ перед иктальным разрядом, а также уменьшала время от начала преиктальной активности до иктальной (однофакторный дисперсионный анализ с повторными измерениями, число срезов n = 8, рис. 5). Таким образом, блокада Na+/K+-помпы приводила к постепенному исчезновению преиктальной активности в срезах энторинальной коры, а также сокращению интервала между иктальными разрядами (однофакторный дисперсионный анализ с повторениями F4, 12 = 25, p < 0.05, n = 6).
Рис. 5.
Эффект частичной блокады Na+/K+-помпы на преиктальную активность в срезах мозга 3-недельных крыс Вистар. (a) Постсинаптические токи репрезентативного нейрона, записанные в режиме фиксации потенциала на уровне –27 мВ в 4-АП модели, записанные с момента добавления в перфузирующий раствор оуабаина (5 µМ). В зеленой рамке приведен в увеличенном масштабе первый иктальный разряд после аппликации оуабаина (I), в синей рамке – седьмой (VII) b–d. Изменение характеристик иктальных разрядов со временем, по оси абсцисс точка Control – контроль, I – первый иктальный разряд после аппликации оуабаина, II – второй и так далее. По оси ординат: амплитуда первого ТПСТ (b), длительность первого ТПСТ (c) и продолжительность преиктальной активности (d). F5,12 – результаты дисперсионного анализа с повторными измерениями.
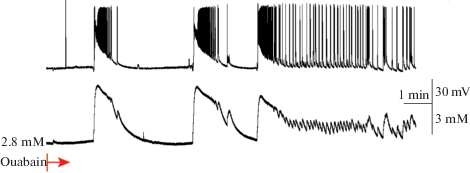
В срезах мозга 8-недельных крыс иктальная активность вызывалась способом, описанным в части 2, при этом оуабаин (5 µМ) приводил к тому, что после генерации очередного иктального разряда нейронная сеть оставалась в клонической фазе и начинала генерировать постоянные интериктальные разряды с частотой 0.2–0.3 Гц (рис. 6, n = 6).
ОБСУЖДЕНИЕ
Cравнение эпилептиформной активности в 4‑АП модели у 3- и 8-недельных крыс показывает, что в зрелом мозге существуют защитные механизмы, препятствующие регулярной генерации иктальных разрядов. В энторинальной коре 8-недельной крысы, в отличие от 3-недельной, иктальная активность легко блокируется, когда поступает входной сигнал из зоны CA3 гиппокампа, или при блокаде катион-хлорного транспортера КСС2 или Na+/K+-помпы. Таким же эффектом обладает низкочастотная электрическая стимуляция [25]. При действии любого из этих факторов устанавливается стабильная интериктальная активность, которая препятствует генерации иктального разряда.
Интериктальная активность подавляет иктальную в зрелом мозге, но не в ювенильном
Антагонистическое действие интериктальной активности на иктальную в зрелом мозге было описано ранее в нескольких работах [26, 27]. H. Swartzwelder и соавт. обнаружили этот эффект в модели эпилептиформной активности in vitro с нулевым магнием в срезах гиппокампа и энторинальной коры взрослых крыс [26], а M. Barbarosie и M. Avoli – в 4-АП модели [27]. Интересно, что на органотипической культуре гиппокампа было выявлено, что гибель нейронов коррелирует с иктальной активностью, но не интериктальной [28]. Таким образом, генерация интериктальной активности в зрелом мозге может рассматриваться как потенциально важный нейропротекторный механизм.
Клинические данные показывают, что незрелый мозг больше склонен к генерации эпилептических приступов, которые сложнее подавляются [1]. Мы недавно показали, что в срезах мозга ювенильных крыс интериктальная активность, генерируемая в зоне CA3 гиппокампа, равно как и низкочастотная стимуляция не препятствуют генерации иктальных разрядов в энторинальной коре. Сами интериктальные разряды сложно вызвать в срезах ювенильных крыс с помощью электрической стимуляции [25]. А если интериктальная активность возникает, то она может провоцировать иктальный разряд и поэтому в этом случае ее часто называют преиктальной активностью [25].
В 4-АП модели различают два типа интериктальной активности: ГАМК-глутаматные, которые возникают из-за рекуррентного взаимодействия интернейронов (деполяризация потенциала реверсии ГАМКА-рецепторов приводит к деполяризующему действию ГАМК), а также глутаматные, которые возникают из-за рекуррентного взаимодействия возбуждающих нейронов [14]. ГАМК-глутаматные события регистрируются в срезах 3‑недельной крысы перед началом иктальной активности, они провоцируют генерацию иктального разряда. Глутаматные разряды более типичны для взрослой крысы. Они регистрируются при сохранении связей энторинальной коры с гиппокампом, при низкочастотной электрической стимуляции, а также генерируются при блокаде КСС2-котранспортера и Na+/K+-помпы. В срезах мозга 8-недельной крысы в 4-АП модели генерация глутаматных интериктальных разрядов препятствует развитию иктального разряда.
Причины высокой готовности к генерации иктального разряда в незрелом мозге
Причины отличий во взаимоотношениях интериктальной и иктальной активности в развивающемся и зрелом мозге, вероятно, обусловлены различиями в экспрессии ряда мембранных белков. Например, до 22-го дня постнатального развития в мозге крыс отсутствуют ГАМКБ-опосредованные постсинаптические события [9, 10], которые обеспечивают длительное следовое торможение. В раннем постнатальном периоде меняется соотношение экспрессии хлорных котранспортеров KCC2 и NKCC1. Уровень экспрессии KСС2 достигает максимального значения лишь к концу второй недели постнатального развития у крыс [4–8]. В этот же период продолжается формирование связей между гиппокампом и энторинальной корой [29].
KСС2-котранспортер
Роль KСС2-котранспортера в генерации и прекращении иктальной активности противоречива. Помимо обнаруженных нами различий в действии ингибитора КСС2 у 3- и 8-недельных крыс, есть данные о том, что при искусственном повышении экспрессии КСС2 фотостимуляция парвальбумин-позитивных интернейронов не способна инициировать иктальный разряд (в отличие от нормального уровня экспрессии КСС2) [30]. Это еще раз доказывает то, что одной из причин генерации иктального разряда в незрелом мозге может являться возбуждающее действие ГАМК вследствие накопления хлорид-ионов из-за недостаточной работы КСС2-котранспортера. Кроме того, у некоторых людей с эпилепсией зарегистрированы мутации гена КСС2 [31, 32]. У таких пациентов из-за ослабленной функции КСС2-котранспортера действительно должен реализовываться сценарий возбуждающего действия ГАМК.
У 3-недельных крыс наблюдаются продолжительные ГАМК-глутаматные события во время преиктальной активности и в клонической фазе иктального разряда. Не исключена роль положительного действия ГАМК из-за повышения концентрации хлорид-ионов в инициации таких событий [33, 34].
Na+/K+-помпа
Последние исследования выявили возрастные различия в экспрессии субъединиц Na+/K+-помпы [12]. В коре и гиппокампе у взрослой мыши значительно выше уровень экспрессии α1- и α3-субъединиц Na+/K+-помпы по сравнению с 6-м днем постнатального развития. Более активная работа Na+/K+-помпы позволяет быстро нормализовать внутриклеточную концентрацию ионов натрия и внеклеточную концентрацию ионов калия, т.e. контролирует возбудимость нейронов. По такому механизму Na+/K+-помпа может защищать зрелый мозг от эпилептической активности. Согласно нашим данным о действии оуабаина, в срезах мозга 3‑недельной крысы ослабление работы Na+/K+-помпы приводит к сокращению преиктальной активности и увеличению частоты иктальных разрядов, т.e. имеет проэпилептический эффект. В срезах мозга 8-недельных крыс при блокаде помпы режим иктальной активности сменяется режимом интериктальной активности.
ГАМКБ рецепторы
Ранее мы выявили возрастные различия в эффекте низкочастотной электрической стимуляции на иктальную активность в срезах мозга крыс в 4‑АП модели [25]. Во время низкочастотной электрической стимуляции в срезах ювенильных крыс наблюдается уменьшение частоты иктальных разрядов, тогда как в срезах взрослых крыс каждый стимул вызывает интериктальный разряд, при этом сама иктальная активность исчезает. Механизм эффекта низкочастотной стимуляции в срезах мозга взрослых животных реализуется посредством активации постсинаптических ГАМКБ-рецепторов [35, 36]. Toprani и Durand [35] показали, что при стимуляции тракта в билатеральных срезах гиппокампа каждый электрический импульс вызывает продолжительную гиперполяризацию нейронов. При блокаде ГАМКБ-рецепторов эта гиперполяризация исчезает, и стимуляция становится неэффективной, что свидетельствует о том, что механизм действия стимуляции реализуется посредством активации постсинаптических ГАМКБ-рецепторов.
В срезах мозга ювенильных животных эффект реализуется посредством активации пресинаптических ГАМКБ-рецепторов [25]. Мы показали, что на эпилептическую активность влияет блокада любого типа синаптических рецепторов: AMPA, NMDA, ГАМКА и ГАМКБ, но только при блокаде ГАМКБ-рецепторов стимуляция становится неэффективной. Ответы нейронов на парную стимуляцию, математическое моделирование, а также эффект блокады обратного захвата глутамата указали на то, что низкочастотная электрическая стимуляция приводит к активации пресинаптических ГАМКБ-рецепторов, за счет чего уменьшается вероятность выброса медиатора, в итоге уменьшается частота иктальных разрядов [25].
Недостаточное развитие постсинаптических ГАМКБ-рецепторов в раннем постнатальном периоде объясняет различие противоэпилептического действия низкочастотной стимуляции у крыс разных возрастов.
Список литературы
Cowan L.D. The epidemiology of the epilepsies in children. Ment. Retard. Dev. Disabil. Res. Rev. 8: 171–181. 2002. https://doi.org/10.1002/mrdd.10035
Студеникин В.М., Шелковский В.И., Балканская С.В. Фебрильные судороги. Практика педиатра. 1: 8–10. 2007. [Studenikin V. M., SHelkovskij V. I., Balkanskaya S.V. Febril’nye sudorogi. Praktika pediatra. 1: 8–10. 2007. (In Russ)].
Hauser W.A. Incidence and Prevalence. Epilepsy: A Comprehensive Textbook / Eds. J. Engel, Jr., T.A. Pedley. Lippincott Raven Publishers, Philadelphia. 47–58. 1997. https://doi.org/10.1007/978-88-470-2903-3_81
Plotkin M.D., Snyder E.Y., Hebert S.C., E. Delpire. Expression of the Na–K–2Cl cotransporter is developmentally regulated in postnatal rat brains: a possible mechanism underlying GABA’s excitatory role in immature brain. J. Neurobiol. 33 (6): 781–795. 1997. https://doi.org/10.1002/(sici)1097-4695(19971120)33:6<781::aid-neu6>3.0.co;2-5
Wang C., Shimizu-Okabe C., Watanabe K., Okabe A., Matsuzaki H., Ogawa T., Mori N., Fukuda A., Sato K. Developmental changes in KCC1, KCC2, and NKCC1 mRNA expressions in the rat brain. Dev. Brain Res. 139 (1): 59–66. 2002. https://doi.org/10.1016/s0165-3806(02)00536-9
Dzhala V.I., Talos D.M., Sdrulla D.A., Brumback A.C., Mathews G.C., Benke T.A., Delpire E., Jensen F.E., Staley K.J. NKCC1 transporter facilitates seizures in the developing brain. Nat. Med. 11 (11): 1205–1213. 2005. https://doi.org/10.1038/nm1301
Khazipov R., Khalilov I., Tyzio R., Morozova E., Ben-Ari Y., Holmes G. L. Developmental changes in GABAergic actions and seizure susceptibility in the rat hippocampus. Europ. J. Neurosci. 19 (3): 590–600. 2004. https://doi.org/10.1111/j.0953-816x.2003.03152.x
Watanabe M., Fukuda A. Development and regulation of chloride homeostasis in the central nervous system. Front Cell Neurosci. 9: 371. 2015. https://doi.org/10.3389/fncel.2015.00371
Lei S., McBain C.J. GABAB receptor modulation of excitatory and inhibitory synaptic transmission onto rat CA3 hippocampal interneurons. J. Physiol. 15 (2): 546: 439–453. 2003. https://doi.org/10.1113/jphysiol.2002.034017
Nurse S., Lacaille J.C. Late maturation of GABA (B) synaptic transmission in area CA1 of the rat hippocampus. Neuropharmacology. 38 (11): 1733e42. 1999. https://doi.org/10.1016/s0028-3908(99)00122-7
Scanziani M. GABA spillover activates postsynaptic GABA (B) receptors to control rhythmic hippocampal activity. Neuron. 25 (3): 673–681. 2000. https://doi.org/10.1016/S0896-6273(00)81069-7
Sundaram S.M., Safina D., Ehrkamp A., Faissner A., Heumann R., Dietzel I.D. Differential expression patterns of sodium potassium ATPase alpha and beta subunit isoforms in mouse brain during postnatal development. Neurochem Int. 128: 163–174. 2019. https://doi.org/10.1016/j.neuint.2019.04.009
Banerjee B., Chaudhury S. Thyroidal regulation of different isoforms of NaKATPase in the primary cultures of neurons derived from fetal rat brain. Life Sci. 71 (14): 1643–1654. 2002. https://doi.org/10.1016/s0024-3205(02)01856-8
Amakhin D.V., Ergina J.L., Chizhov A.V., Zaitsev A.V. Synaptic conductances during interictal discharges in pyramidal neurons of rat entorhinal cortex. Front Cell Neurosci. 10: 233. eCollection. 2016. https://doi.org/10.3389/fncel.2016.00233
Yao J. A., Tseng G.N. Modulation of 4-AP block of a mammalian A-type K channel clone by channel gating and membrane voltage. Biophys. J. 67 (1): 130–142. 1994. https://doi.org/10.1016/S0006-3495(94)80462-X
Choquet D., Korn H. Mechanism of 4-aminopyridine action on voltage-gated potassium channels in lymphocytes. J. Gen. Physiol. 99 (2): 217–240. 1992. https://doi.org/10.1085/jgp.99.2.217
Octeau J.C., Faas G., Mody I., Khakh B.S. Making, Testing, and Using Potassium Ion Selective Microelectrodes in Tissue Slices of Adult Brain. J. Vis. Exp. (135): 57511. 2018. https://doi.org/10.3791/57511
Malyshev A.Y., Roshchin M.V., Smirnova G.R., Dolgikh D.A., Balaban P.M., Ostrovsky M.A. Chloride conducting light activated channel GtACR2 can produce both cessation of firing and generation of action potentials in cortical neurons in response to light. Neurosci. Let. 640: 76–80. 2017.https://doi.org/10.1016/j.neulet.2017.01.026
Yu Y., Shu Y., McCormick D.A. Cortical action potential backpropagation explains spike threshold variability and rapid-onset kinetics. J. Neurosci. 28 (29): 7260–7272. 2008. https://doi.org/10.1523/JNEUROSCI.1613-08.2008
Tai Y., Gallo N.B., Wang M., Yu J. R., Van Aelst L. Axo-axonic Innervation of Neocortical Pyramidal Neurons by GABAergic Chandelier Cells Requires AnkyrinG-Associated L1CAM. Neuron. 102 (2): 358–372.e9. 2019.https://doi.org/10.1016/j.neuron.2019.02.009
Ben–Ari Y., Gaiarsa J.L., Tyzio R., Khazipov R. GABA: A pioneer transmitter that excites immature neurons and generates primitive oscillations. Physiological reviews. 87 (4): 1215–1284. 2007. https://doi.org/10.1152/physrev.00017.2006
Huberfeld G., Wittner L., Clemenceau S., Baulac M., Kaila K., Miles R., Rivera C. Perturbed chloride homeostasis and GABAergic signaling in human temporal lobe epilepsy. J. Neurosci. 27: 9866–9873. 2007. https://doi.org/10.1523/JNEUROSCI.2761-07.2007
Kaila K., Ruusuvuori E., Seja P., Voipio J., Puskarjov M. GABA actions and ionic plasticity in epilepsy. Curr Opin Neurobiol 26: 34–41. 2014. https://doi.org/10.1016/j.conb.2013.11.004
Chizhov A.V., Zefirov A.V., Amakhin D.V., Smirnova E.Y., Zaitsev A.V. Minimal model of interictal and ictal discharges “Epileptor-2”. PLoS Comput Biol. 14 (5): e1006186. 2018. https://doi.org/10.1371/journal.pcbi.1006186
Smirnova E.Y., Chizhov A.V., Zaitsev A.V. Presynaptic GABAB receptors underlie the antiepileptic effect of low-frequency electrical stimulation in the 4-aminopyridine model of epilepsy in brain slices of young rats. Brain Stimul. 13 (5): 1387–1395. 2020. https://doi.org/10.1016/j.brs.2020.07.013
Swartzwelder H.S., Lewis D.V., Anderson W.W., Wilson W.A. Seizure-like events in brain slices: suppression by interictal activity. Brain Res. 410 (2): 362–366. 1987. https://doi.org/10.1016/0006-8993(87)90339-8
Barbarosie M., Avoli M. CA3-driven hippocampal-entorhinal loop controls rather than sustains in vitro limbic seizures. J. Neurosci. 17 (23): 9308–9314. 1997. https://doi.org/10.1523/JNEUROSCI.17-23-09308.1997
Berdichevsky Y., Dzhala V., Mail M., Staley K.J. Interictal spikes, seizures and ictal cell death are not necessary for post-traumatic epileptogenesis in vitro. Neurobiol. Dis. 45 (2): 774–785. 2012. https://doi.org/10.1016/j.nbd.2011.11.001
Jabès A., Lavenex P. B., Amaral D. G., Lavenexs P. Postnatal development of the hippocampal formation: a stereological study in macaque monkeys. The Journal of comparative neurology. 519 (6): 1051–1070. 2011. https://doi.org/10.1002/cne.22549
Magloire V., Cornford J., Lieb A., Kullmann D.M., Pavlov I. KCC2 overexpression prevents the paradoxical seizure-promoting action of somatic inhibition. Nat Commun. 10 (1): 1225. 2019. https://doi.org/10.1038/s41467-019-08933-4
Puskarjov M., Ahmad F., Kaila K., Blaesse P. Activity–dependent cleavage of the K–Cl cotransporter KCC2 mediated by calcium–activated protease calpain. J. Neurosci. 32 (33): 11356–11364. 2019. https://doi.org/10.1523/JNEUROSCI.6265-11.2012
Kahle K.T., Merner N.D., Friedel P., Silayeva L., Liang B., Khanna A., Shang Y., Lachance-Touchette P., Bourassa C., Levert A., Dion P.A., Walcott B., Spiegelman D., Dionne-Laporte A., Hodgkinson A., Awadalla P., Nikbakht H., Majewski J., Cossette P., Deeb T.Z., Moss S.J., Medina I., Rouleau G.A. Genetically encoded impairment of neuronal KCC2 cotransporter function in human idiopathic generalized epilepsy. EMBO Reports. 15 (7): 766–774. 2014. https://doi.org/10.15252/embr.201438840
Ellender T.J., Raimondo J.V., Irkle Lamsa, K.P. Aker-man C.J. Excitatory effects of parvalbumin-expressing interneurons maintain hippocampal epileptiform activity via synchronous afterdischarges. J. Neurosci. 34: 15208–15222. 2014. https://doi.org/10.1523/JNEUROSCI.1747-14.2014
Nardou R., Yamamoto S., Chazal G., Bhar A., Ferrand N., Dulac O., Ben-Ari Y., Khalilov I. Neuronal chloride accumulation and excitatory GABA underlie aggravation of neonatal epileptiform activities by phenobarbital. Brain. 134: 987–1002. 2011. https://doi.org/10.1093/brain/awr041
Toprani S., Durand D. M. Long-lasting hyperpolarization underlies seizure reduction by low frequency deep brain electrical stimulation. J. Physiol. 591 (22): 5765e90. 2013.https://doi.org/10.1113/jphysiol.2013.253757
Kano T., Inaba Y., D’Antuono M., Biagini G., Levesque M., Avoli M. Blockade of in vitro ictogenesis by low-frequency stimulation coincides with increased epileptiform response latency. J. Neurophysiol. 114 (1): 21e8. 2015.https://doi.org/10.1152/jn.00248.2015
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии