Журнал эволюционной биохимии и физиологии, 2021, T. 57, № 2, стр. 172-180
МЕЖСАМЦОВЫЕ ВЗАИМОДЕЙСТВИЯ НА НЕЙТРАЛЬНОЙ ТЕРРИТОРИИ И ПОСЛЕДУЮЩАЯ ДИНАМИКА УРОВНЯ КОРТИКОСТЕРОНА И ТЕСТОСТЕРОНА В КРОВИ У РУЧНЫХ И АГРЕССИВНЫХ СЕРЫХ КРЫС (RATTUS NORVEGICUS)
Р. Г. Гулевич 1, *, С. Г. Шихевич 1, М. Ю. Коношенко 2, Р. В. Кожемякина 1
1 Институт цитологии и генетики РАН
Новосибирск, Россия
2 Институт химической биологии и фундаментальной медицины
Новосибирск, Россия
* E-mail: gulevich@bionet.nsc.ru
Поступила в редакцию 30.11.2020
После доработки 25.12.2020
Принята к публикации 27.12.2020
Аннотация
Ранее у серых крыс (Rattus norvegicus), селекционируемых на отсутствие и усиление агрессивно-оборонительной реакции на человека (или ручное и агрессивное поведение), исследовали стресс-реактивность, в основном, на несоциальные воздействия. Тогда как данные о последствиях социального стресса, вызванного, в частности, взаимодействием с конспецификом, ограничены. Как уже было показано, отбор серых крыс на ручное и агрессивное поведение по отношению к человеку вызывает, соответственно, ослабление или усиление внутривидовой межсамцовой агрессии. Чтобы выяснить, сопровождаются ли различия в агрессивном поведении гормональными сдвигами, исследовали динамику уровня кортикостерона и тестостерона в крови после теста на межсамцовую агрессию у ручных, агрессивных крыс и неселекционированных крыс, которых разводили в виварии в течение 7–8 поколений в качестве контроля. Целью данной работы было исследование влияния отбора по отношению к человеку на агонистические взаимодействия в условиях незнакомой клетки (или на нейтральной территории) и последующую динамику изменения уровней кортикостерона и тестостерона в крови у ручных, агрессивных и неселекционированных крыс.
Показано, что латентный период атаки у ручных самцов более длительный, а продолжительность агрессивного поведения и количество его паттернов, приближаясь к нулевым значениям, существенно меньше, чем у агрессивных и неселекционированных. Агрессивные крысы в условиях теста на нейтральной территории уступают неселекционированным по суммарному времени конфронтаций. Более выраженные проявления агрессивности у неселекционированных крыс по сравнению с агрессивными и ручными животными отмечаются на фоне более высокого базального уровня кортикостерона и повышенной стресс-реактивности в ответ на взаимодействие с незнакомым самцом, в то время как пониженная агрессивность у ручных крыс в тесте на нейтральной территории сопровождается более низким уровнем тестостерона после теста по сравнению с неселекционированными и агрессивными животными.
ВВЕДЕНИЕ
Агрессивное поведение является общим симптомом многих психологических расстройств и психических заболеваний, таких как шизофрения, биполярные расстройства, повышение тревожности и аутизм [1–4]. Среди многих факторов, способствующих развитию агрессии, рассматриваются генетические, средовые (обучение агрессии в детском возрасте или нарушение родительской заботы), онтогенетические, нарушающие развитие центральной нервной системы, гормональные и нейротрансмиттерные дисфункции. Убедительные доказательства наследственной компоненты в проявлении агрессии выявляются при селекции животных на специфические параметры агрессивности [5–7].
В литературе обсуждается участие гипоталамо-гипофизарно-надпочечниковой системы (ГГНС) в регуляции агрессивного поведения [8–11]. В экспериментах на крысах было показано, что введение кортикостерона усиливает проявление агрессивного поведения, а введение метирапона, ингибитора синтеза кортикостерона, наоборот, ослабляет его [8]. По данным Haller (2014) у животных при встрече с незнакомыми субъектами, вызывающей мобилизацию ресурсов для контроля над ситуацией, активируется ГГНС уже на ранних стадиях социального взаимодействия, даже до начала борьбы, и глюкокортикоиды, секретируемые в ответ на встречу, быстро стимулируют агрессивность [11]. У самцов линии крыс, селекционированных на пониженное тревожно-подобное поведение (LAB – low-anxiety-related behavior), в отличие от самцов линии крыс, селекционированных на повышенное тревожно-подобное поведение (HAB – high-anxiety-related behavior), отмечали усиление межсамцовой агрессии, а также повышение базального уровня кортикостерона в крови и уровня АКТГ спустя 15 мин после начала теста резидент–интрудер [6, 10]. Тогда как стресс-реактивность на несоциальное воздействие, вызванное условиями открытого рукава приподнятого крестообразного лабиринта, у крыс линии LAB, наоборот, оказалась ниже, чем у крыс линии HAB [12]. В отличие от крыс этих линий мыши из контрастных по поведению линий, полученных в разных лабораториях по трем селекционным программам на повышенную (SAL, TA и NC900) и пониженную (LAL, TNA и NC 100) агрессивность, существенно не отличались по базальному уровню кортикостерона [13].
Известно, что тестостерон, биосинтез которого осуществляется в клетках Лейдига семенников, оказывает стимулирующее влияние на агрессивное поведение, о чем свидетельствуют, в частности, эффекты кастрации самцов грызунов и последующего введения этого гормона [14, 15]. В то же время согласно гипотезе вызова (challenge) причинно-следственная связь между тестостероном и агрессивностью бывает непродолжительной и возникает только у полигамных, конкурентных видов, когда самцы вынуждены бороться за статус и/или ресурсы, необходимые для воспроизводства [16]. Вместе с тем у самцов крыс линий HAB и LAB, описанных выше и отличающихся по степени агрессивности, уровни тестостерона в крови не отличаются ни в состоянии покоя, ни спустя час после начала теста резидент–интрудер [10]. При этом только у более агрессивных самцов линии LAB спустя час после начала теста резидент–интрудер авторы отмечали увеличение количества с-Fos-позитивных клеток в парвоцеллюлярном районе паравентрикулярного ядра гипоталамуса (PVN), свидетельствующее о нейрональной активации этого района, по сравнению с менее агрессивными самцами линии HAB.
Серые крысы, селекционируемые в течение длительного периода (80 поколений) в Институте цитологии и генетики СО РАН на отсутствие и усиление агрессивно-оборонительной реакции на человека (или ручное и агрессивное поведение), позволяют исследовать генетически-детерминированные особенности межсамцовых взаимодействий и вызванные ими гормональные изменения, что может способствовать пониманию механизмов агрессивного поведения, которое формируется в процессе отбора. Ранее было показано, что у ручных самцов ослабевает агрессивное поведение по отношению к конспецификам в тестах резидент–интрудер и на нейтральной территории (или в незнакомой клетке), а также уровень тревожности, судя по поведению в светло-темной камере и реакции вздрагивания [17–19]. В отличие от теста резидент–интрудер, когда самцы крыс защищают свою собственную территорию, в тесте на нейтральной территории агрессивность самцов крыс проявляется слабее [17, 20]. В ранее опубликованной работе по межсамцовым взаимодействиям крыс на нейтральной территории не было данных по результатам теста у неселекционированных самцов крыс. В одной из последних работ были представлены данные по динамике изменения уровня кортикостерона в крови у ручных, агрессивных и неселекционированных крыс после рестрикционного стресса [21]. Однако оставалось неизвестно, каковы особенности динамики изменения этого гормона у исследуемых крыс после взаимодействия с незнакомым конспецификом. В исследовании межсамцовых взаимодействий в тесте резидент–интрудер данные по уровню кортикостерона в крови приводятся только в одной точке после теста [18]. При этом неселекционированные крысы превосходили агрессивных и ручных крыс по уровню гормона как до, так и после теста. К тому же независимо от поведения у самцов крыс после теста резидент–интрудер уровень кортикостерона в крови повышался по сравнению с базальным уровнем. В ряде исследований, проведенных ранее как на зрелых самцах крыс, так и в процессе онтогенеза, ручные, агрессивные и неселекционированные самцы существенно не отличались по базальному уровню тестостерона в крови [21, 22], но было неясно, как влияет отбор крыс по поведению на уровень тестостерона после межсамцовых взаимодействий.
Предполагалось, что агонистические взаимодействия у неселекционированных самцов крыс в незнакомой клетке могут иметь характерные особенности в отличие от селекционируемых на ручное и агрессивное поведение, и что вектор отбора по поведению может влиять на динамику изменения уровней кортикостерона и тестостерона после межсамцовых взаимодействий.
Целью данной работы было исследование влияния отбора по отношению к человеку на параметры межсамцовых взаимодействий в условиях незнакомой клетки и последующую динамику изменения уровней кортикостерона и тестостерона в крови у ручных, агрессивных и неселекционированных крыс.
МАТЕРИАЛЫ И МЕТОДИКА
Экспериментальные животные
Это исследование проводилось в соответствии с принципами Базельской декларации и рекомендациями Биоэтической комиссии Института цитологии и генетики СО РАН (протокол № 8 от 19 марта 2012 г.). Эксперименты проводили в Центре коллективного пользования (ЦКП) "Виварий конвенциональных животных" ИЦиГ на двухмесячных самцах серых крыс (Rattus norvegicus) весом 270–300 г, которые были получены в результате 80 поколений отбора на отсутствие и усиление агрессивно-оборонительной реакции на человека, далее называемых ручными и агрессивными соответственно. Реакцию крыс оценивали в условных единицах или так называемых баллах поведенческой реакции на руку человека в перчатке в условиях домашней клетки в интервале от +4 до –4 баллов [5, 23]. Во время тестирования в клетке откидывали переднюю стенку, и экспериментатор протягивал руку в перчатке в открытую клетку. Средние популяционные баллы поведения достигали (+)3.45 ± 0.05 у ручных и (–)3.05 ± 0.07 у агрессивных самцов. В качестве контроля использовали неселекционированных самцов 7–8 поколений разведения в условиях вивария. Средний балл поведения у этих животных (–)2.26 ± 0.07 достоверно отличался от баллов у агрессивных и ручных (p < 0.001 в обоих случаях). Животных содержали в металлических клетках (50 × 33 × 20 см) по 4 самца в условиях естественного фотопериода и свободного доступа к воде и пище. За неделю до тестирования самцов крыс рассаживали в клетки по одному. Все тесты проводили с 14:00 до 18:00.
Тест на межсамцовую агрессию в незнакомой клетке
Тест проводили в клетке из прозрачного пластика (40 × 40 × 60 см), разделенной на два равных отсека перегородкой [23]. В эти отсеки одновременно помещали по одному незнакомому самцу из каждой исследуемой линии с равной массой, а затем перегородку убирали. Всего было проведено 18 тестов: 6 – между дикими парами, 6 – между агрессивными парами и 6 – между неагрессивными парами. Поведение самцов регистрировали в течение 5 мин на видеокамеру Panasonic, SDR-H280EE-S (Япония). В дальнейшем видеозаписи обрабатывали с помощью программы, разработанной в лаборатории, позволяющей оценивать число и продолжительность поведенческих паттернов, а именно латентный период первого агрессивного взаимодействия, число и время атак, преследований, ударов задними лапами, вертикальных стоек, опрокидываний на спину, агрессивного груминга, время боковых угрожающих поз [24]. Кроме того, регистрировали время социального поведения, паттернами которого были подходы к партнеру и его обнюхивания, а также позы вытягивания в направлении партнера, но не приближения к нему.
Взятие проб крови и определение уровня гормонов в плазме
Сразу после 5-минутного теста в незнакомой клетке у самцов крыс брали пробы крови из кончика хвоста, а затем их возвращали в домашние клетки. Далее кровь брали через 30 мин, один и два часа после окончания теста. Для определения базального уровня гормонов кровь брали спустя 6 дней после теста. Кровь центрифугировали, полученную плазму замораживали на –20°С до определения уровня гормонов в плазме крови. Уровни кортикостерона и тестостерона определяли иммуноферментным методом с помощью специальных EIA наборов фирмы IDS Ltd UK. Интенсивность окрашивания проб регистрировали на планшетном спектрофотометре Perkin Elmer 1420 Multilabel Counter. В каждой группе было по 9–12 животных, как указано в подписи к рисункам. Часть проб выпали или в процессе определения, или из калибровочной кривой.
Статистическая обработка результатов
Все значения исследуемых параметров представлены в виде средних и ошибок средних (M ± m). Влияние фактора генотипа на поведенческие параметры самцов крыс определяли с помощью однофакторного дисперсионного анализа (ANOVA), а влияние факторов генотипа и межсамцовых конфронтаций на динамику изменения гормонов до и после конфронтаций – с помощью двухфакторного дисперсионного анализа для повторяющихся измерений. Достоверность различий между группами животных оценивали с помощью Kruskal–Wallis и Fisher LSD post hoc тестов.
РЕЗУЛЬТАТЫ
Анализ межсамцовых взаимодействий у самцов крыс в условиях незнакомой клетки показал достоверное влияние фактора генотипа на суммарное время агрессии F2.36 = 26.74, p < 0.001, латентный период атаки F2.36 = 15.09, p < 0.001, число атак F2,36 = 15.61, p < 0.001, вертикальных стоек F2.36 = = 18.18, p < 0.001, боковых поз угрозы F2.36 = 12.72, p < 0.001, поваливаний на спину F2.36 = 7.02, p < 0.05, эпизодов с борьбой F2.36 = 25.09, p < 0.001.
Латентный период атаки был достоверно больше, а время и число всех паттернов агрессивного поведения – достоверно меньше у ручных самцов, чем у агрессивных и неселекционированных (рис. 1). По суммарному времени агрессии агрессивные самцы уступали неселекционированным (p < 0.05).
Рис. 1.
Параметры межсамцовой агрессии у неселекционированных, агрессивных и ручных самцов на нейтральной территории. На верхнем рисунке представлены продолжительность агрессивного, социального поведения и латентный период до первого агрессивного взаимодействия, на нижнем – количество отдельных паттернов агрессивного поведения. *** p < 0.001, ** p < 0.01,* p < 0.05 по сравнению с неселекционированными крысами, хххp < 0.001, ххp < 0.01, хp < 0.05 по сравнению с агрессивными крысами. Значения представлены как M ± SEM, n = 12.

Двухфакторный дисперсионный анализ для повторяющихся измерений показал влияние факторов генотипа (F2.25 = 34.28, p < 0.001) и конфронтаций (F4.100 = 63.38, p < 0.001) на динамику изменения уровня кортикостерона в крови у неселекционированных, агрессивных и ручных самцов крыс, тогда как взаимодействие этих факторов было не достоверно (F8.100 = 1.98, p < 0.06). У крыс всех исследуемых групп уровень кортикостерона в крови достоверно повышался сразу после взаимодействий с незнакомым самцом по сравнению с базальным (p < 0.001 во всех случаях), достигая максимальных значений у диких и ручных спустя 30 мин, а у агрессивных самцов спустя 1 ч после окончания теста (рис. 2). Через 2 ч после теста уровни кортикостерона у крыс всех исследуемых групп становились ниже, чем соответствующие уровни, измеряемые через час (p < 0.001 – для неселекционированных, p < 0.01 – для ручных, p < 0.05 – для агрессивных), но не достигали базальных значений.
Рис. 2.
Уровень кортикостерона в крови у неселекционированных (a), агрессивных (в) и ручных (с) крыс до и после межсамцовых взаимодействий на нейтральной территории. *** p < 0.001, ** p < 0.01 – по сравнению с неселекционированными крысами, xp < 0.05–по сравнению с агрессивными крысами. Значения представлены как M ± SEM, n = 9–12.
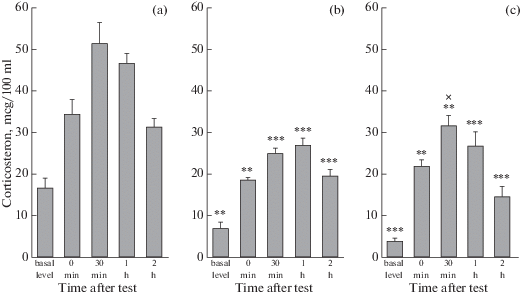
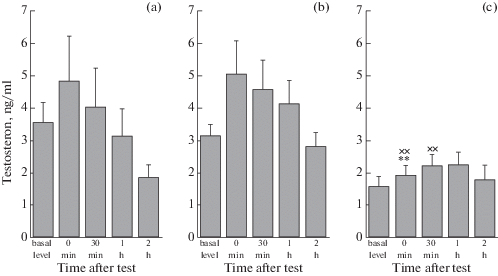
Рис. 3.
Уровень тестостерона в крови у неселекционированных (a), агрессивных (в) и ручных (с) крыс до и после межсамцовых взаимодействий на нейтральной территории. ** p < 0.01 по сравнению с неселекционированными крысами; xxp < 0.01 по сравнению с агрессивными крысами. Значения представлены как M ± SEM, n = 10–12.
У неселекционированных самцов уровень кортикостерона в крови как в состоянии покоя, так и во всех исследуемых точках после теста был выше, чем у агрессивных и ручных животных. Между агрессивными и ручными самцами различия по уровню кортикостерона отмечали только через 30 мин после теста, причем ручные самцы превосходили агрессивных (p < 0.05).
Двухфакторный дисперсионный анализ для повторяющихся измерений показал влияние факторов генотипа (F2.27 =3.41, p < 0.05) и конфронтаций (F4.108 =5.67, p < 0.001) на уровень тестостерона в крови у неселекционированных, агрессивных и ручных самцов крыс, тогда как взаимодействие этих факторов было не достоверно (F8.108 =1.65, p > 0.05). По базальному уровню тестостерона самцы крыс трех генотипов достоверно не отличались, только у ручных отмечалась тенденция к более низкому уровню этого гормона по сравнению с неселекционированными (p = 0.06). Сразу после межсамцовых взаимодействий у ручных крыс уровень гормона становился достоверно ниже, чем у неселекционированных и агрессивных животных (p < 0.01 в обоих случаях), и спустя 30 мин после окончания тестирования оставался более низким по сравнению с агрессивными (p < 0.05). Хотя через 1 ч после теста уровень тестостерона у ручных крыс превышал базальный уровень (p < 0.05), но при этом не отличался от соответствующих уровней гормона у агрессивных и неселекционированных крыс. Через 2 ч после теста только у неселекционированных самцов уровень гормона становился ниже базального уровня (p < 0.05).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Данные по динамике уровня кортикостерона в крови у ручных, агрессивных и неселекционированных крыс после межсамцовых взаимодействий существенно не отличаются от данных, полученных ранее на этих животных после рестрикционного стресса [21]. Хотя на другой селекционной модели было показано, что различия по стресс-рективности у крыс контрастных по уровню тревожности и агрессивности (LAB и HAB) зависят от социальной или несоциальной природы стрессирующего воздействия [10, 12]. Так, стресс-реактивность на самца-конкурента у крыс линии LAB с повышенной агрессивностью выше, чем у крыс линии HAB с пониженной агрессивностью [10], а стресс-реактивность на несоциальные воздействия, наоборот, у LAB самцов ниже, чем у HAB самцов [12]. Из полученных нами результатов следует, что при отборе крыс по реакции на человека стресс-реактивность ручных и агрессивных самцов не зависит от природы стрессирующих воздействий.
Параметры агрессивного поведения крыс на нейтральной территории свидетельствуют о повышенной агрессивности у неселекционированных самцов крыс по сравнению не только с ручными, но и агрессивными крысами. Наблюдаемые нами тенденции к большему числу атак и вертикальных стоек у неселекционированных крыс по сравнению с агрессивными отмечали ранее и в тесте резидент–интрудер [18]. Кроме того, в данном исследовании показано, что конфронтации на нейтральной территории между неселекционированными самцами происходят в течение более продолжительного времени, чем между агрессивными животными (рис. 1), в то время как в тесте резидент–интрудер таких различий не наблюдалось. Возможно, менее выраженное проявление агрессивности на нейтральной территории, чем при защите своей собственной территории в тесте резидент–интрудер, о чем уже упоминалось выше, позволяет выявить различия по времени агрессивных взаимодействий между неселекционированными и агрессивными крысами. Такие различия могут быть также обусловлены критерием отбора по реакции на перчатку, который скорее связан с латентным периодом агрессивного поведения, а не с его продолжительностью.
Исходя из полученных нами данных, более выраженные проявления агрессии у неселекционированных самцов, чем у агрессивных и ручных отмечаются на фоне более высокого базального уровня кортикостерона и повышенной стресс-реактивности, поскольку в течение двух часов после теста уровень кортикостерона в крови у неселекционированных крыс остается более высоким, чем у тех и других (рис. 2). Эти результаты согласуются с данными о том, что введение кортикостерона крысам усиливает агонистические конфронтации, а введение ингибитора синтеза кортикостерона (метирапона), наоборот, – ослабляет [8]. У более агрессивных самцов крыс линии LAB также отмечают повышенные уровни кортикостерона до и после теста резидент–интрудер по сравнению с самцами линии HAB [10]. Хотя в отличие от крыс линии LAB, для неселекционированных крыс характерна не только повышенная агрессивность, но и тревожность, судя по выраженной тенденции к менее продолжительному времени нахождения в центре открытого поля по сравнению с агрессивными и ручными крысами [22].
Наблюдаемые различия между неселекционированными и агрессивными крысами по суммарному времени конфронтаций и уровню кортикостерона в крови позволяют заметить, что отбор на агрессивное поведение по отношению к человеку не компенсирует процесс лабораторизации, происходящий в течение длительного разведения и содержания крыс в условиях вивария.
В отличие от неселекционированных крыс, у которых более выраженная агрессивность сопровождается более высоким базальным уровнем кортикостерона и повышенной стресс-реактивностью относительно ручных и агрессивных крыс, у последних по сравнению с ручными крысами уровень кортикостерона до теста не отличается, а спустя 30 мин после теста становится даже ниже. Ранее после теста резидент–интрудер отмечали отсутствие различий по базальному уровню кортикостерона и стресс-реактивности у ручных и агрессивных крыс после теста резидент–интрудер [18]. Следует заметить, что на ранних этапах отбора уровень кортикостерона как базальный, так и после стресса у агрессивных самцов был достоверно выше, чем у ручных [5, 23], тогда как на более поздних этапах различия по уровню кортикостерона между агрессивными и ручными крысами становились более сглаженными [21, 26]. Можно предполагать, что в процессе отбора на агрессивное поведение подключаются или становятся более значимыми иные механизмы, которые вызывают агрессивность на фоне выровненного или даже пониженного функционирования ГГНС относительно ручных крыс. Отсутствие различий по базальному уровню кортикостерона отмечали также у мышей линий, селекционированных по длительности латентного периода атаки (SAL и LAL) и по частоте атак на социального партнера NC900 и NC100 [12]. Причем у более агрессивных мышей линии NC900 наблюдали повышенную тревожность, а также понижение уровня α(2)-субъединицы ГАМКА рецептора во фронтальной коре и амигдале [27]. Следует отметить, что для агрессивных крыс также характерна повышенная тревожность по сравнению с ручными [19, 28]. Кроме того, в дорзальном гиппокампе у агрессивных крыс методом магнитно-резонансной спектроскопии найдено понижение процента ГАМК от общего содержания нейрометаболитов по сравнению с ручными крысами [29]. Возможно, селекция по реактивности грызунов как на социального партнера, так и на руку человека влияет на систему ГАМК в тех отделах мозга, которые связаны с агрессивностью и тревожностью.
У самцов всех трех групп уровень кортикостерона в крови сразу после 5-минутных взаимодействий с конспецификом на нейтральной территории повышается по сравнению с базальным, что ранее наблюдали и после теста резидент–интрудер [18]. Такое повышение уровня кортикостерона говорит о том, что присутствие рядом незнакомого партнера оказывает стрессирующее влияние на всех самцов, независимо от их поведения, и вызывает конфронтации у неселекционированных и агрессивных, но не у ручных крыс, у которых латентный период агрессии продолжается в течение всего 5-минутного теста и все остальные параметры агрессивного поведения близки к нулевым значениям. Поскольку ранее было показано, что между стресс-ответом и центральными механизмами, участвующими в регуляции агрессивности, существует быстрая положительная обратная связь [9], можно предполагать, что в процессе отбора на ручное поведение такая связь нарушается.
По базальному уровню тестостерона в крови самцы трех исследуемых групп достоверно не отличались, что подтверждает ранее полученные данные [21, 22] и согласуется с результатами исследования на самцах крыс линий LAB и HAB, отличающихся по степени агрессивности [10]. Уровень тестостерона у ручных крыс становится достоверно ниже, чем у агрессивных и неселекционированных животных только после взаимодействий с самцами-конкурентами. Эти результаты согласуются с гипотезой вызова (challenge), согласно которой связь между агрессивностью и уровнем тестостерона появляется в тот период, когда самцы вступают в борьбу за статус или ресурсы, необходимые для воспроизводства [16]. Через 1 ч после теста все различия по уровню тестостерона у самцов из трех исследуемых групп нивелируются. У самцов крыс линий LAB и HAB, проявляющих разную степень агрессивности, уровень тестостерона через 1 ч после начала теста резидент–интрудер также не отличается, но при этом не приводятся данные по уровню этого гормона сразу после теста [10].
Методом иммуногистохимии было показано, что у ручных и агрессивных самцов крыс после теста резидент–интрудер увеличивается число клеток, содержащих транскрипционный фактор c-Fos, являющийся маркером нейрональной активности, в ядре ложа конечной полоски, медиальной миндалине и гипоталамической области атаки по сравнению с контрольными животными [30]. Причем по числу таких клеток в гипоталамической области атаки ручные самцы уступали агрессивным. У клеток из гипоталамической области атаки, относящейся к вентро-латеральным районам вентро-медиального гипоталамуса [31, 32], находят аксоны в других отделах гипоталамуса и, в частности, преоптической области [33], играющей важную роль как в агрессивном, так и половом поведении [34]. К тому же преоптическая область – место локализации Gn-RH нейронов [35], секретирующих гонадотропный рилизинг-гормон, стимулирующий продукцию гонадотропных гормонов в гипофизе, которые в свою очередь повышают синтез тестостерона в семенниках. В связи с этим можно предполагать, что повышенное число c-Fos положительных клеток у агрессивных крыс после межсамцовых взаимодействий в гипоталамической области атаки способствует повышенной активности Gn-RH нейронов в преоптической области гипоталамуса, что и приводит к более высокому уровню тестостерона у этих животных по сравнению с ручными самцами.
Таким образом, у неселекционированных крыс и крыс, селекционированных на усиление агрессивно-оборонительной реакции на человека, агрессивность сопровождается разным уровнем функционирования ГГНС до и после взаимодействия с самцом-конкурентом на нейтральной территории. В то время как ручные самцы крыс отличаются от агрессивных и неселекционированных более низким уровнем тестостерона в крови после взаимодействия с самцом-конкурентом.
Список литературы
Wu Y., Kang R., Yan Y., Gao K., Li Z., Jiang J., Chi X., Xia L. Epidemiology of schizophrenia and risk factors of schizophrenia-associated aggression from 2011 to 2015. J. Intern. Med. Res. 46 (10): 4039–4049. 2018. https://doi.org/10.1177/0300060518786634
Garno J.L., Gunawardane N., Goldberg J.F. Predictors of trait aggression in bipolar disorder. Bipolar Disord. 10 (2): 285–292. 2008. https://doi.org/10.1111/j.1399-5618.2007.00489.x
Neumann I.D., Veenema A.H., Beiderbeck D.I. Aggression and Anxiety: Social Context and Neurobiological Links. Front. Behav. Neurosci. 4: 12. 2010. https://doi.org/10.3389/fnbeh.2010.00012
Mazurek M.O., Kanne S.M., Wodka E.L. Physical aggression in children and adolescents with autism spectrum disorders. Res. Autism. Spectrum. Disorders. 7 (3): 455–465. 2013. https://doi.org/10.1016/j.rasd.2012.11.004
Plyusnina I. and Oskina I. Behavioral and adrenocortical responses to open-field test in rats selected for reduced aggressiveness toward humans. Physiol. Behav. 61: 381–385. 1997. https://doi.org/10.1016/S0031-9384(96)00445-3
Veenema A.H., Neumann I.D. Neurobiological mechanisms of aggression and stress coping: a comparative study in mouse and rat selection lines. Brain. Beha.v Evol. 70 (4): 274–285. 2007. https://doi.org/10.1159/000105491
Takahashi A. and Miczek K. Neurogenetics of aggressive behavior: studies in rodents. Curr. Top. Behav. Neurosci. 17: 3–44. 2014. https://doi.org/10.1007/7854_2013_263
Mikics E., Kruk M.R., Haller J. Genomic and non-genomic effects of glucocorticoids on aggressive behavior in male rats. Psychoneuroendocrinology. 29 (5): 618–635. 2004. https://doi.org/10.1016/S0306-4530(03)00090-8
Kruk M.R., Halasz J., Meelis W., Haller J. Fast positive feedback between the adrenocortical stress response and a brain mechanism involved in aggressive behavior. Behav. Neurosci. 118 (5): 1062–1070. 2004. https://doi.org/10.1037/0735-7044.118.5.1062
Veenema A.H., Torner L., Blume A., Beiderbeck D.I., Neumann I.D. Low inborn anxiety correlates with high intermale aggression: Link to ACTH response and neuronal activation of the hypothalamic paraventricular nucleus. Horm. Behav. 51 (1): 11–19. 2007. https://doi.org/10.1016/j.yhbeh.2006.07.004
Haller J. Neurobiological Bases of Abnormal Aggression and Violent Behaviour. Springer, Vienna. 2014.
Landgraf R., Wigger A., Holsboer F., Neumann I.D. Hyper-reactive hypothalamo–pituitary–adrenocortical axis in rats bred for high anxiety-related behaviour. J. Neuroendocrinol. 11: 405–407. 1999. https://doi.org/10.1046/j.1365-2826.1999.00342.x
Caramaschi D., de Boer S.F., Koolhaas J.M. Is hyper-aggressiveness associated with physiological hypoarousal? A comparative study on mouse lines selected for high and low aggressiveness. Physiol. Behav. 95(4): 591–598. 2008. https://doi.org/10.1016/j.physbeh.2008.08.019
Beeman A.E. The effect of male hormone on aggressive behavior in male mice. Physiol. Zool. 20: 373–405. 1947.
Albert D.J., Walsh M.L., Gorzalka B.B., Siemens Y., Louie H. Testosterone removal in rats results in a decrease in social aggression and a loss of social dominance. Phisiol. Behav. 36 (3): 401–407. 1986. https://doi.org/10.1016/0031-9384(86)90305-7
Wingfield J.C., Lynn S., Soma K.K. Avoiding the ‘costs’ of testosterone: ecological bases of hormone–behavior interactions. Brain. Behav. Evol. 57 (5): 239–251. 2001. https://doi.org/10.1159/000047243
Плюснина И.З., Соловьева М.Ю. Внутривидовая межсамцовая агрессия у ручных и агрессивных серых крыс. Журнал высшей нервной деятельности им. И.П. Павлова. 60(2): 175–183. 2010. [Plyusnina I.Z, Solov’eva M.Y. Intraspecific intermale aggression in tame and aggressive Norway rats. Zh. Vyssh. Nerv. Deiat. im. I.P. Pavlova. 60 (2): 175–183. 2010. (In Rus.)].
Plyusnina I.Z., Solov’eva M.Y., Oskina I.N. Effect of domestication on aggression in gray Norway rats. Behav. Genet. 41 (4): 583–592. 2011. https://doi.org/10.1016/S0031-9384(96)00445-3
Albert F.W., Schepina O., Winter C., Rompler H., Teupser D., Palme R., Ceglarek U., Kratzsch J., Sohr R., Trut L.N., Thiery J., Morgenstern R., Plyusnina I.Z., Schonenberg T., Paabo S. Phenotypic differences in behavior, physiology and neurochemistry between rats selected for tameness and for defensive aggression towards human. Horm. Behav. 53 (3): 413–421. 2008. https://doi.org/10.1016/j.yhbeh.2007.11.010
Toth I. and Neumann I.D. Animal model of social avoidance and social fear. Cell and tissue research. 354(1): 107–118. 2013. https://doi.org/10.1007/s00441-013-1636-4
Прасолова Л.А., Гербек Ю.Э., Гулевич Р.Г., Шихевич С.Г., Коношенко М.Ю., Кожемякина Р.В., Оськина И.Н., Плюснина И.З. Эффекты длительного отбора по поведению на стресс-ответ и активность половой системы самцов серых крыс (Rattus norvegicus). Генетика. 50 (8): 959–966. 2014. [Prasolova L.А., Gerbeck Yu.E., Gulevich R. G., Shikhevich S.G., Konoshenko M.Yu., Kozhemyakina R.V., Oskina I.N., Plyusnina I.Z. The effect of prolonged selection for dehavior on the the stress response and activity of reproductive system of male grey rats (Rattus norvegicus). Russian Journal of Genetics, 50 (8): 846–852. 2014. (In Russ)]. https://doi.org/10.1134/S1022795414080031
Gulevich R.G., Shikhevich S.G., Konoshenko M.Y., Kozhemyakina R.V., Herbeck Y.E., Prasolova L.A., Oskina I.N., Plyusnina I.Z. The influence of social environment in early life on the behavior, stress response, and reproductive system of adult male Norway rats selected for different attitudes to humans. Physiol. Behav. 144: 116–123. 2015. https://doi.org/10.1016/j.physbeh.2015.03.018
Naumenko E.V., Popova N.K., Nikulina E.M., Dygalo N.N., Shshkina G.T., Borodin P.M., Markel A.L. Behavior, adrenocortical activity, and brain monoamines in Norway rats selected for reduced aggressiveness towards man. Pharmacol. Biochem. Behav. 33 (1): 85–91. 1989. https://doi.org/10.1016/0091-3057(89)90434-6
Плюснина И.З., Трут Л.Н., Карпушкеева Н.И., Алехина Т.А. Оськина И.Н. Некоторые поведенческие и физиологические особенности мутации NONAGOUTI у серых крыс при отборе на агрессивность. Журнал высшей нервной деятельности им. И.П. Павлова. 53(6): 730–738. 2003. [Plyusnina I.Z., Trut L.N., Karpushkeeva N.I., Alekhina T.A., Oskina I.N. Some behavioral and physiological characteristics of Nonagouti mutation in gray rats during breeding for aggressiveness. Zh. Vyssh. Nerv. Deiat. im. I.P. Pavlova. 53: 730–738. 2003. (In Russ)].
Оськина И.Н., Гербек Ю.Э., Шихевич С.Г., Плюснина И.З., Гулевич Р.Г. Изменения гипоталамо-гипофизарно-надпочечниковой и иммунной систем при отборе животных на доместикационное поведение. Информационный вестник ВОГиС. 12 (1/2): 39–49. 2008. [Oskina I.N., Herbeck Y.E., Shikhevich S.G., Plyusnina I.Z., Gulevich R.G. Alterations in the hypothalamus-pituitary-adrenal and immune systems during selection of animals for tame behavior. Vestnik VOGiS. 12 (1/2): 39–49. 2008. (In Russ)].
Гербек Ю.Э., Амелькина O.A., Коношенко M.Ю., Шихевич C.Г., Гулевич P.Г., Кожемякина Р.В., Плюснина И.З., Оськина И.Н. Влияние неонатального хэндлинга на поведение и стресс-ответ у крыс, селекционируемых по реакции на человека. Вавиловский журнал генетики и селекции. 20 (2): 145–154. 2016. [Herbeck Y.E., Amelkina O.A., Konoshenko M.Y., Shikhevich S.G., Gulevich R.G., Kozhemyakina R.V., Plyusnina I.Z., Oskina I.N. Effect of neonatal handling on behavior and stress-response in rats selected for reaction towards humans. Russian Journal of genetics: applied research. 7 (1): 71–81. 2017. (In Russ)]. https://doi.org/10.18699/VJ16.144
Nehrenberg D.L., Rodriguiz R.M., Cyr M., Zhang X., Lauder J.M., Gariepy J-L., Wetsel W.C. An anxiety-like phenotype in mice selectively bred for aggression. Behav. Brain. Res. 201 (1): 179–191. 2009. https://doi.org/10.1016/j.bbr.2009.02.010
Kozhemyakina R.V., Shikhevich S.G., Konoshenko M.Yu., Gulevich R.G. Adolescent oxytocin treatment affects resident behavior in aggressive but not tame adult rats. Physiol .Behav. 224: 113046. 2020. https://doi.org/10.1016/j.physbeh.2020.113046
Гулевич Р.Г., Акулов А.Е., Шихевич С.Г., Кожемякина Р.В., Плюснина И.З. Магнитно-резонансная спектроскопия нейрометаболитов в гиппокампе у агрессивных и ручных самцов крыс. Вавиловский журнал генетики и селекции. 19 (4): 432–438. 2015. [Gulevich R.G., Akulov A.E., Shikhevich S.G., Kozhemyakina R.V. Proton magnetic resonance spectroscopy of neurometabolites in the hippocampi of aggressive and tame male rats. Russian Journal of genetics: applied research. 6 (4): 430–436. 2016. (In Russ)]. https://doi.org/10.18699/VJ15.057
Konoshenko M.Y., Timoshenko T.V., Plyusnina I.Z. c-Fos activation and intermale aggression in rats selected for behavior toward humans. Behav Brain Res 2379: 103–106. 2013. https://doi.org/10.1016/j.bbr.2012.09.022
Lin D., Boyle M.P., Dollar P., Lee H., Lein E.S., Perona P. Anderson D.J. Functional identification of an aggression locus in the mouse hypothalamus. Nature. 470 (7333): 221–226. 2011. https://doi.org/10.1038/nature09736
Falkner A.L., Lin D. Recent advances in understanding the role of the hypothalamic circuit during aggression. Front Syst. Neurosci. 8: 168. 2014. https://doi.org/10.3389/fnsys.2014.00168
Yang C.F., Chiang M.C., Gray D.C., Prabhakaran M., Alvarado M., Juntti S.A., Unger E.K., Wells J.A., Shah N.M. Sexually dimorphic neurons in the ventromedial hypothalamus govern mating in both sexes and aggression in males. Cell. 153 (4): 896–909. 2013. https://doi.org/10. 1016/j.cell.2013.04.017
Albert D.J., Walsh M.L., Gorzalka B.B., Mendelson S., Zalys C. Intermale social aggression: suppression by medial preoptic area lesions. Physiol. Behav. 38 (2): 169–173. 1986. https://doi.org/10.1016/0031-9384(86)90151-4
Dees W.L., Hiney J.K., Sower S.A., Yu W.H., McCann S.M. Localization of immunoreactive lamprey gonadotropin-releasing hormone in the rat brain. Peptides. 20 (12): 1503–1511. 1999. https://doi.org/10.1016/S0196-9781(99)00162-X
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


