Журнал эволюционной биохимии и физиологии, 2021, T. 57, № 3, стр. 224-239
ГИПОТАЛАМИЧЕСКИЕ МЕХАНИЗМЫ РЕГУЛЯЦИИ СТАРЕНИЯ
П. М. Маслюков 1, *, А. Д. Ноздрачев 2, 3
1 Ярославский государственный медицинский университет
Ярославль, Россия
2 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
3 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: mpm@ysmu.ru
Поступила в редакцию 19.01.2021
После доработки 16.02.2021
Принята к публикации 17.02.2021
Аннотация
Гипоталамус является важнейшим интегратором функций эндокринной, автономной, соматической нервной системы, участвует в регуляции ритмических процессов и, предположительно, в программировании процессов старения. К числу гипоталамических ядер, ответственных за реализацию программы старения, предположительно относят супрахиазмальное ядро и срединную группу ядер, включая аркуатное, вентромедиальное и дорсомедиальное ядра. Процесс старения в гипоталамусе сопровождается нарушением баланса возбуждение/торможение за счет дисрегуляции ГАМК-ергической системы, уменьшением частоты импульсации нейронов, нарушением обмена кальция, увеличением продукции оксида азота, снижением аутофагии, нарушением процессов внутриклеточного сигналинга, в частности Sirt1, mTOR, NF-κB, AMPK, P53, FoxO. Также важная роль в гипоталамическом старении принадлежит таницитам, что выражается в нарушении их связи с нейронами и барьерной функции. Стволовые клетки гипоталамуса, расположенные преимущественно в области срединной группы ядер, выделяют экзосомальные миРНК, которые также ответственны за антивозрастные эффекты этих клеток. При этом количество самих стволовых гипоталамических клеток и экзосомальных миРНК уменьшается по мере старения.
ВВЕДЕНИЕ
В то время как старость – это состояние, свойственное поздним годам жизни, биологический процесс старения начинается с момента рождения и необратимо продолжается в течение всей жизни. Единого мнения о механизмах, участвующих в процессе старения, не существует. В большинстве случаев теории старения можно разделить на негенетические (эпигенетические), согласно которым причина старения – это структурные изменения клеток и тканей, и генетические, связывающие старение с изменениями в передаче и экспрессии генетической информации. Также выделяют 2 большие группы: стохастические (вероятностные) теории и теории программированного старения [1, 2]. К одной из наиболее известных и глубоко разработанных концепций в геронтологии следует отнести элевационную теорию старения и формирования возрастной патологии у высших организмов, придающей ключевое значение в этих процессах возрастному повышению порога чувствительности гипоталамуса к гомеостатическим сигналам [3]. Уже в XXI веке развитие современных методов исследования, в том числе молекулярно-биологических, генетических, нейрофизиологических, нейрохимических позволило более детально рассмотреть участие гипоталамуса в механизмах старения, что нашло свое отражение в недавних обзорах. В частности, в них делается вывод о том, что ведущей причиной старения в организмах млекопитающих является развитие гипоталамического нейровоспаления, а также уменьшение в гипоталамусе с возрастом стволовых клеток [4, 5].
Тем не менее уже упомянутые обзоры в большей мере касаются молекулярно-клеточных аспектов изменения работы гипоталамических нейронов, в то же время функциональные особенности нейронов гипоталамуса при старении остаются в тени. В настоящем обзоре мы попытались собрать воедино имеющуюся картину морфофункциональных изменений нейронов гипоталамуса и их влияние на процесс старения с учетом последних литературных данных и классических работ.
Краткая характеристика гипоталамических ядер
Гипоталамус – филогенетически старый отдел промежуточного мозга, который играет важную роль в поддержании постоянства внутренней среды и обеспечении интеграции функций автономной нервной, эндокринной, соматической систем. Большинство ядер гипоталамуса имеют плохо очерченные границы и, за малым исключением (супраоптическое и паравентрикулярное ядра), их трудно рассматривать как центры с узкой локализацией специфических функций. Так, например, супрахиазмальное ядро гипоталамуса (СХЯ) является главным генератором околосуточных (циркадианных) ритмов. В контроле метаболизма участвуют такие ядра гипоталамуса, как дугообразное (аркуатное, АРЯ), вентромедиальное (ВМЯ) и дорсомедиальное (ДМЯ), латеральная гипоталамическая область (ЛГ) (рис. 1). Контроль репродукции опосредуется АРЯ, преоптической областью (ПОО), включая медиальное (ПОМ) и передневентральное перивентрикулярное (AVPV) ядра [6, 7]. Туберомамиллярное ядро (ТМЯ) считается главным центром бодрствования, а также участвует в регуляции температуры тела, поведения и биоритмов [8].
Рис. 1.
Схема ядер гипоталамуса в сагиттальной плоскости и их нейрохимические особенности. В большинстве гипоталамических ядер также имеются нейроны, содержащие глутамат и ГАМК (не показаны на схеме). AHN – переднее ядро гипоталамуса; ARC – дугообразное ядро; AVP – аргинин-вазопрессин; BDNF – мозговой нейротрофический фактор; ChAT – холинацетилтрансфераза; CRH – кортикотропин-рилизинг гормон; DMN – дорсомедиальное ядро; GRP – пептид, высвобождающий гастрин; LHA – латеральная гипоталамическая область; МБ – маммиллярное тело; MCH – меланин-концентрирующий гормон; NPY/AgRP – нейропептид Y и пептид родственный агути; PHN– заднее ядро гипоталамуса; POA – преоптическая область; POMC/CART – проопиомеланокортин и транскрипт, регулируемый кокаином и амфетамином; PVN – паравентрикулярное ядро; SCN – супрахиазматическое ядро; СОН – супраоптическое ядро; TH – тирозингидроксилаза; TMN – туберомамиллярное ядро; TRH – тиротропин-рилизинг гормон; VMH – вентромедиальное ядро.
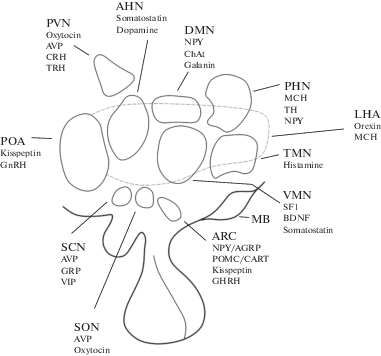
Паравентрикулярное (ПВЯ) и супраоптическое (СОЯ) ядра регулируют различные процессы, в первую очередь стрессорные и адаптационные ответы организма. Клеточный состав ПВЯ неоднороден: оно состоит из крупных, мелких и дистально проецирующихся нейронов. ПВЯ связано с регуляцией реакции организма на стресс, стресс пищевого и социального поведения, лактации, беременности, деятельности щитовидной железы. Нейроны крупноклеточного ядра СОЯ регулируют водно-солевой баланс организма, а также функции щитовидной железы [9, 10].
Морфологические изменения в ядрах гипоталамуса при старении
Старение приводит к неравномерным изменениям нейронов гипоталамуса [11]. В частности, исследования, проведенные на грызунах, показали потерю нейронов в передней гипоталамической области, в ПОМ и ПВЯ [12, 13], в отличие от областей СОЯ, ДМЯ, ВМЯ и ПВЯ [12, 14, 15]. В то же время число нейронов СОЯ и ПВЯ у самцов обезьян при старении возрастало [16]. Имеются противоречивые данные в отношении изменения числа нейронов при старении в дугообразных ядрах, где одни исследователи отмечали снижение числа нейронов [13], а другие – неизменное их число [17].
При старении размеры нейронов ряда гипоталамических ядер увеличиваются, в том числе у POMC нейронов мыши [18], а также нейронов, содержащих кисспептин и нейрокинин В у представителей обоих полов человека [19]. В то же время в СОЯ у крыс средний объем ядер нейросекреторных клеток достоверно снижается при старении как за счет уменьшения относительного количества нейронов с крупными ядрами, так и в связи с появлением большого числа малоактивных нейронов с мелкими ядрами [11].
При этом в нейронах при старении происходят морфофункциональные нарушения в энергообразующих и в белоксинтезирующих цитоплазматических структурах. Накопление в нейронах липофусцина, конечного продукта перекисного окисления липидов, индуцируемого свободными радикалами, можно считать наиболее постоянным и универсальным признаком старения нервной системы. Однако в гипоталамусе выявляются меньшие отложения этого пигмента по сравнению с другими отделами ЦНС [11].
Старение нейронов сопровождается редукцией дендритов. У старых крыс в АРЯ наблюдалось значительное сокращение количества дендритных сегментов, общей длины дендритов, а также плотности ветвления и числа шипиков [17, 20].
Электрическая активность гипоталамических нейронов при старении
Связанные со старением изменения электрофизиологических свойств различны для разных видов, областей мозга и типов нейронов [11]. В отдельных областях частота импульсации может снижаться за счет увеличения длительности следовой гиперполяризации (after hyperpolarization, AHP) [21]. Кроме того, высвобождение Ca2+ из внутриклеточных запасов кальция способствует увеличению амплитуды AHP во время старения [22]. Наконец, возрастные изменения в буферизации или экструзии Ca2+ могут способствовать изменению гомеостаза Ca2+, что приводит к длительному Ca2+ ответу [23]. В дополнение к Ca2+-зависимому запуску AHP, изменения в K+-каналах, которые лежат в основе AHP, могут также изменяться с возрастом [24, 25]. Тем не менее наблюдаются разнонаправленные изменения Ca-связывающих белков при старении, в том числе в гипоталамусе. В нейронах ДМЯ и ВМЯ экспрессия кальбиндина снижается, а кальретинина возрастает у старых самцов и самок крыс [26].
С возрастом в ЦНС наблюдается нарушение баланса возбуждение/торможение за счет дисрегуляции ГАМК-ергической системы. При этом наблюдается уменьшение количества тормозных синаптических контактов, частоты спонтанных ТПСП и амплитуды токов при стимуляции ГАМК-рецепторов [27].
В POMC-содержащих гипоталамических нейронах старых животных наблюдалось уменьшение частоты импульсации, что было связано с повышенной активностью mTOR [28]. В ПОО при старении наблюдается значительное снижение частоты спонтанных спайков гонадотропин-рилизинг гормон (ГнРГ)-выделяющих нейронов, сопровождающееся повышенной вариабельностью активности и уменьшением генерации паттернов [29]. Нейроны старых животных продемонстрировали значительное снижение амплитуды следовой деполяризации (depolarizing afterpotential, DAP) после кратковременного спайкового залпа. Уменьшение DAP после вспышки спайков может привести к более коротким пачкам импульсов, еще меньшим DAP, уменьшенной частоте разрядов и нарушению ритмического рисунка разрядов, что может приводить к нарушению регуляции высвобождения ГнРГ. Эстрадиол существенно ослаблял натриевый ток, лежащий в основе потенциала действия в ГнРГ-позитивных нейронов у молодых, но не у старых мышей in vivo. При этом у старых мышей, в отличие от молодых, эстрадиол не оказывал влияния на DAP в потенциале действия ГнРГ-позитивных нейронов [30]. Таким образом, у старых животных наблюдается ослабление регуляции деятельности гипоталамических нейронов по принципу отрицательной обратной связи, что также подтверждает идеи В.М. Дильмана [3] о возрастном повышении порога чувствительности гипоталамуса к гомеостатическим сигналам.
Супрахиазмальное ядро и ритмические процессы
СХЯ принадлежит главная роль в синхронизации всех ритмов и интеграции информации от периферии для генерации согласованных системных ритмов в организме. Помимо СХЯ, эпифиз также играет роль в синхронизации биологических функций с циклами свет/темнота посредством ритмического синтеза мелатонина и контроля функций гипофиза [31, 32].
По современным представлениям, молекулярный механизм генерации циркадианных временных сигналов складывается из самоподдерживающихся петель транскрипционно-трансляционной обратной связи, когда белки, продуцируемые определенными циркадными генами, негативно регулируют их собственную транскрипцию. В основе модели работы СХЯ лежат два семейства генов: Per1, Per2 и Per3, а также Cry1 и Cry2. Транскрипция этих генов активируется с началом циркадианного дня гетеромерным комплексом, содержащим CLOCK и BMAL1-белки (положительные регуляторы петли), которые управляют экспрессией белков PERIOD (PER) и CRYPTOCHROME (CRY), (отрицательных регуляторов) через регуляторные последовательности энхансерного бокса (E-box). К концу циркадного дня комплексы PER – CRY накапливаются в ядре и начинают подавлять собственную экспрессию. В течение следующей суточной ночи уровни мРНК PER и CRY падают, а существующие комплексы PER – CRY разрушаются. Эта деградация позволяет циклу повторно инициироваться приблизительно через 24 ч после предыдущей инициации транскрипции. Цикл стабилизируется дополнительными петлями, в которых CLOCK и BMAL1 управляют E-box-опосредованной циркадной экспрессией ядерных рецепторов RORα, REV-ERBα (также известных как NR1D1) и REV-ERBβ (также известных как NR1D2), которые, в свою очередь, действуют через последовательности элемента ответа REV (RRE) для активации и подавления транскрипции BMAL1 соответственно. Мутации в генах этих ядерных рецепторов изменяют амплитуду и период ритмов активности [33, 34].
Отдельные нейроны СХЯ в культуре могут поддерживать клеточно-автономные циркадные циклы спонтанных разрядов, внутриклеточной концентрации кальция и экспрессии циркадных генов, управляемые их транскрипционно-трансляционной обратной связью [35]. Однако у диспергированных одиночных клеток ритмы довольно неточны. Напротив, когда связь цепей СХЯ сохраняется в органотипических культурах срезов, эти циклы сильны, тесно синхронизированы и, в отличие от циклов в изолированных нейронах, устойчивы к ослабляющим эффектам генетических делеций некоторых компонентов транскрипционно-трансляционной связи и могут поддерживать циркадные колебания неопределенно долго с удивительной надежностью, устойчивостью и точностью [36].
Ключевым результатом СХЯ в управлении циркадными ритмами являются циклические колебания электрической активности с частотами от 1 до 10 Гц, в условиях in vivo и в культуре [37, 38]. Независимо от того, ведет ли организм обычно ночной или дневной образ жизни, электрическая (и сопутствующая метаболическая) активность в СХЯ выше в течение циркадного дня: колебания электрической активности кодируют дневное время, а не поведенческое состояние. Ежедневные изменения в ритмической активности определяют поведенческие циклы, при этом начало и смещение спонтанной активности у ночных грызунов синхронизируются по фазе с серединой падения и подъема в разрядах нейронного ансамбля СХЯ соответственно [39]. Эта модель верна и для видов, активных днем, за исключением того, что поведенческие последствия противоположны. Эфферентные пути, посредством которых СХЯ связывается с центрами в гипоталамусе и стволе мозга, которые контролируют возбуждение, сон, нейроэндокринный статус и вегетативный статус, выявлены в общих чертах и, вероятно, включают как синаптическое высвобождение ГАМК (от всех нейронов СХЯ) и паракринная секреция нейропептидов (из определенных групп клеток СХЯ) в паттернах, которые отражают электрическую ритмическую активность [34, 37].
Циркадная ритмичность может снижаться с возрастом [40, 41]. Отмечено, что нарушение циркадных ритмов из-за выключения Bmal1 приводит к преждевременному старению у мышей [40]. Профили циркадной транскрипции в стареющих клетках меняются. Однако старение не просто вызывает снижение циркадной ритмичности в экспрессии генов, которые активны в молодом возрасте, а новый набор генов начинает цикл у старых мышей [42]. Тем не менее работа молекулярных циркадных механизмов, в частности, периодическая экспрессия Per2 существенно не изменялась у старых грызунов по сравнению с молодыми [43].
У людей с возрастом наблюдаются аномальные, фрагментированные циклы активности и отдыха, что убедительно свидетельствует о дисфункции ритмического механизма [44]. Подобное возрастное снижение циркадной ритмичности наблюдается у макак-резусов наряду с измененными ритмами мелатонина и снижением качества сна. Эти изменения усугубляются при отсутствии фотопериодического сигнала [45].
Cтарение влияет на гибкость главного циркадного водителя ритма. Наблюдается возрастное снижение синхронизации и амплитуды ритмов электрической активности в нейронах СХЯ [25, 42], частично из-за возрастного снижения экспрессии нейротрансмиттеров, такие как ВИП и ГАМК [46, 47]. Старые серые мышиные лемуры менее чувствительны к изменениям длины дня, чем взрослые животные, что отражает измененные способности адаптации к изменению продолжительности дня [48], при этом старение у них сопровождается изменением циркадных ритмов ВИП и аргинин-вазопрессина в СХЯ, тем самым нарушая синхронизацию нейральных сайтов-мишеней [49]. Однако у самцов макак-резусов не удалось обнаружить очевидного влияния возраста в мРНК и уровнях экспрессии белков основных тактовых генов или генов, связанных с передачей сигналов СХЯ и нейротрансмиссией [50]. Старение меняет ритм внутриклеточных уровней кальция в нейронах СХЯ, с более высокими значениями ночью, по сравнению с днем. Циркадная модуляция активности BK-каналов нарушается из-за снижения BK-токов в ночное время. Этот уменьшенный ток у старых животных уменьшает AHP, деполяризует мембранный потенциал покоя, расширяет потенциал действия и увеличивает внутреннюю концентрацию Ca2+ [25].
Таким образом, имеющиеся данные позволяют предположить, что с возрастом молекулярные часы продолжают нормально функционировать в нейронах СХЯ, тогда как электрическая активность и количество нейротрансмиттеров в нейронной сети СХЯ уменьшаются. Снижение амплитуды эфферентного сигнала из СХЯ снижает его способность управлять периферическими циркадными ритмами, и также может способствовать повышению порога чувствительности гипоталамуса к гомеостатическим сигналам.
Медиобазальный гипоталамический комплекс
ВМЯ и АРЯ в ряде работ рассматриваются как медиобазальный гипоталамус, учитывая их роль в регуляции пищевого и полового поведения. В АРЯ проопиомеланокортиновые (proopiomelanocortin, POMC) нейроны секретируют α-меланоцитстимулирующий гормон (α-МСГ), который действует на меланокортиновые рецепторы MC3R и MC4R. В этих же нейронах выделяется CART (cocaine-amphetamine-regulated transcript – регулируемый кокаином и амфетамином транскрипт). Оба этих гормона обладают анорексигенным действием, т.е. они снижают аппетит и вызывают ощущение сытости. Кроме того, α-МСГ, стимулируя симпатические центры, повышает расход энергии. В аркуатных ядрах также содержатся нейроны, вырабатывающие орексигенные (т.е. стимулирующие аппетит) вещества. В NPY-нейронах выделяется нейропептид Y (NPY), а в AgRP-нейронах – родственный белку Агути пептид (Aguti-related peptide, AgRP). NPY стимулирует пищевое поведение, а AGRP пептид является обратным агонистом рецепторов меланокортинов MC3R и MC4R, являясь, таким образом, антагонистом α-МСГ. Имеются данные о том, что AGRP не только препятствует связыванию пептидов меланокортинового семейства с MCR, но и сам выступает в качестве специфичного агониста МС4R, запуская независимые от G-белков аррестиновые сигнальные каскады, что ведет к активации каскада митогенактивируемых протеинкиназ (МАПК) [51]. Отростки POMC-, NPY- и AgRP-нейронов проецируются в гипоталамические центры, регулирующие потребление пищи – в ЛГ, ДМЯ, ВМЯ и ПВЯ. Кроме того, указанные нейроны оказывают влияние на ядро одиночного пути, в которое поступает сенсорная информация с внутренних органов [52].
В свою очередь на POMC-, NPY- и AgRP-нейронах имеются рецепторы к регуляторным пептидам, вырабатывающимся в различных органах и тканях. В частности, инсулин, а также лептин стимулируют POMC/CART- и тормозят NPY/AgRP-нейроны. Грелин, напротив, стимулирует NPY- и AgRP-нейроны и тормозит POMC/CART [52].
Нейроны, выделяющие соматотропин-рилизинг- гормон (СРГ), расположены в АРЯ, а экспрессирующие соматостатин – в ВМЯ. СРГ стимулирует, а соматостатин ингибирует выделение соматотропного гормона (СТГ) гипофизом. Уровни СТГ и инсулиноподобного фактора роста 1 (IGF-1) в крови являются самыми высокими в подростковом возрасте и постепенно снижаются, становясь едва заметными у пожилых людей [53]. Основываясь на роли СТГ в повышении метаболизма, возрастное снижение СТГ и IGF-1 может способствовать саркопеническому ожирению у пожилых людей. Тем не менее линии трансгенных мышей со сверхэкспрессией СТГ демонстрировали более короткую продолжительность жизни [54]. На сегодняшний день механизм возрастного снижения уровней СТГ и IGF-1 остается неясным. Уровень СРГ в срединном возвышении снижался у старых крыс, тогда как уровень соматостатина в срединном возвышении и уровни СРГ и соматостатина в их соме не изменялись. Примечательно, что соматостатин-индуцированное ингибирование СТГ было сенсибилизировано у старых крыс, что указывает на возможную причину возрастного снижения уровня СТГ в плазме [5].
В дорсомедиальной зоне задней части АРЯ локализована группа нейронов, секретирующих кисспептин. Контроль репродукции в зависимости от уровня метаболизма опосредуется через связи кисспептин-секретирующих нейронов АРЯ с ГнРГ-нейронами ПOM и AVPV ядер гипоталамуса. При этом рост секреции ГнРГ под влиянием инфузии кисспептина в AVPV зависит от времени суток. Эту циркадианную периодичность могут обеспечивать синаптические связи АРЯ и AVPV с вазопрессин-содержащими нейронами СХЯ. Роль кисспептинергических нейронов нейроэндокринного гипоталамуса в метаболическом обеспечении таких энергоемких процессов репродукции, как беременность, роды и лактация подчеркивается экспрессией в нейронах гена рецептора трийодтиронина – TRα [7].
ВМЯ известно своим участием в регуляции сексуального и пищевого поведения, хотя оно также регулирует кровяное давление и болевые пути [55, 56]. Повреждения в ВМЯ изменяют пищевое поведение и связаны с гиперфагией и развитием ожирения [57]. ВМЯ функционирует как датчик насыщения и, как было показано, также реагирует и на гипогликемию, путем ингибирования производства инсулина и стимулирования высвобождения глюкагона и катехоламинов. Внутренние часы ВМЯ играют роль в контроле периферических циркадных ритмов [58].
Считается, что вентролатеральная часть ВМЯ в основном отвечает за половое поведение у самок крыс и связана с присутствием нейронов, которые экспрессируют рецепторы эстрогена [56], в то время как дорсомедиальная часть больше связана с регуляцией аппетита [59]. Экспрессия рецепторов лептина в ВМЯ отражает важность этого ядра в ответ на вызванные лептином изменения пищевого поведения, метаболизма и регулирование баланса энергии [60]. ВМЯ также содержит нейроны, которые отвечают на изменения внеклеточной глюкозы [55].
Стероидогенный фактор 1 (SF-1) представляет собой ядерный рецептор, экспрессируемый в надпочечниках, гонадах, переднем гипофизе и ВМЯ [61]. SF-1 имеет жизненно важное значение не только для развития ВМЯ, но и для его физиологических функций [62]. У мышей, у которых отсутствовал рецептор лептина в SF-1-экспрессирующих нейронах ВМЯ, проявлялись признаки метаболического синдрома, включая ожирение, повышенный уровень инсулина и лептина, нарушение толерантности к глюкозе [59]. Удаление SF-1 в ВМЯ приводило к увеличению уровня инсулина и лептина в крови у молодых и старых мышей, снижение физической активности, нарушение термогенеза, активности бурой жировой ткани [63] вызывало ожирение и аномальное развитие ВМЯ [64], а у людей мутации SF-1 приводили к ожирению и диабету 2-го типа [65]. При старении у самцов и самок крыс в ВМЯ экспрессия SF-1 снижается [66]. Таким образом, SF-1 играет защитную роль против метаболических стрессоров, включая старение и диету с высоким содержанием жиров.
Танициты – высокоспециализированные эпендимные клетки, выстилающие стенку третьего желудочка. Их базальные отростки контактируют не только с нейронами прилежащих ядер гипоталамуса, но и кровеносными сосудами, в том числе с кровеносными сосудами портальной системы гипофиза. Танициты локализованы в области медиабазального гипоталамуса, осуществляют мониторинг и транспорт многих веществ (гормонов, метаболитов, ростовых факторов), участвуют в создании гемато-ликворного и ликворо-энцефалического барьеров, регулируют высвобождение рилизинг-факторов нейросекреторными клетками гипоталамуса. В дополнение к своим барьерным свойствам, танициты обладают способностью определять уровень глюкозы в крови и играют фундаментальную и активную роль в передаче циркулирующих метаболических сигналов к нейронам гипоталамуса, которые контролируют потребление пищи. Более того, предполагается, что в соответствии с их предполагаемым происхождением из радиальных глиальных клеток, танициты наделены свойствами нервных стволовых клеток и могут реагировать на пищевые или репродуктивные сигналы, модулируя гипоталамический нейрогенез. Таким образом, танициты могут составлять важное звено в петле, соединяющей поведение, гормональные изменения, передачу сигналов, активацию центральных нейронов, что в свою очередь меняет поведение [67].
Морфология таницитов изменяется при старении. Хотя общее количество самих клеток не меняется с возрастом, но при этом отмечается потеря их отростков и увеличивается экспрессия белков промежуточных филаментов цитоскелета, например, глиального фибриллярного кислого белка (GFAP). По данным электронной микроскопии, у старых животных нарушается взаимодействие между нервными окончаниями ГнРГ-нейронов и отростками таницитов. Было также показано, что старение изменяет таницитарный барьер до такой степени, что вызывает нарушение структурной целостности гемато-ликворного барьера в срединном возвышении. Поскольку известно, что у старых животных наблюдаются нарушения нейроэндокринного контроля энергетического гомеостаза, в том числе ослабленная реакция на голодание, можно предположить, что изменения в пластичности гематоэнцефалического барьера могут способствовать возникновению возрастных метаболических заболеваний. Танициты, помимо передачи циркулирующих сигналов из крови в спинномозговую жидкость, могут также действовать как «очистители мозга», устраняя избыток токсичных белков, вырабатываемых у пациентов с нейродегенеративными расстройствами, защищая таким образом гипоталамус [67].
Дорсомедиальное гипоталамическоя ядро
ДМЯ содержит глутамат- и ГАМК-ергические нейроны, последние составляют большинство [68]. Было обнаружено, что ГАМК-ергические нейроны в вентральной части ДМЯ, экспрессирующие рецептор лептина, подавляют потребление пищи путем ингибирования нейронов АРЯ, которые экспрессируют AgRP [69]. Кроме того, было показано, что нейроны, экспрессирующие рецептор лептина в дорсальной области ДМЯ, играют роль в контроле расхода энергии и массы тела [70].
ДМЯ является важным ядром для интеграции циркадной информации из СХЯ и периферических органов для модуляции широкого разнообразия поведения и физиологических процессов, участвует в циркадной регуляции приема пищи, питья, секреции кортикостерона, двигательной активности и бодрствования, связанных с СХЯ [71, 72]. ДМЯ получает прямые и косвенные проекции от СХЯ, а также от АРЯ, ВМЯ и ЛГ [73, 74]. Кроме того, аксоны нейронов ДМЯ формируют проекции в регионы, важные для регуляции состояния сон/бодрствования: тормозные ГАМК-ергические проекции к вентролатеральной преоптической области, отвечающей за сон, глутаматергические возбуждающие проекции к центрам пробуждения в голубом пятне и к орексин-содержащим нейронам ЛГ [74]. ДМЯ также дает проекции к паравентрикулярному ядру гипоталамуса, которое регулирует взаимодействие гипоталамуса с автономной нервной системой и эндокринной системой [75].
Предполагается, что ДМЯ является важным циркадным центром в мозге млекопитающих и сам по себе способен поддерживать функцию автономных часов [76]. Галанин-экспрессирующие нейроны в ДМЯ вовлечены в баланс медленноволнового/парадоксального сна посредством различных проекций к ПОО и бледному шару [77]. В соответствии с этой ролью, повреждение ДМЯ у крыс изменяет распределение медленноволновой и парадоксальной фазы сна в циркадном цикле [78]. Экспрессия циркадных генов и маркеры нейрональной активности в ДМЯ также зависят от времени приема пищи, как было подчеркнуто в исследованиях ограниченного кормления на лабораторных грызунах [79]. Таким образом, ДМЯ является вероятным кандидатом на роль анатомического реле для наложения суточного ритма и зависимых от метаболического состояния ответов на классические схемы сна.
Компактная часть ДМЯ содержит самоподдерживающийся автономный циркадный осциллятор, активность которого зависит от потребления пищи. Одна из основных характеристик этой части ДМЯ, которая отличает его от других периферических циркадных осцилляторов, заключается в том, что амплитуда колебаний экспрессии Per1/Per2 была намного выше при ограничении питания, чем при питании ad libitum; в то время как ограничение питания действительно сдвигает фазу других генераторов, не связанных с СХЯ, их амплитуды не отличаются явно между ограниченным и неограниченным питанием [71]. Примечательно, что ДМЯ оказался единственным локусом мозга, отличным от СХЯ, который содержит плотно сгруппированные нейроны, демонстрирующие устойчивые колебания экспрессии Per1 и Per2 в условиях, когда доступность еды ограничена запланированным фиксированным временем, тогда как гены Per диффузно экспрессируются почти во всех отделах ЦНС и периферических тканях. Повреждения нейронов ДМЯ у крыс блокируют бодрствование, повышение двигательной активности и внутренней температуры тела перед приемом пищи [80].
Изменения гипоталамической регуляции тиреоидной оси при старении
Тиротропин-рилизинг-гормон (тиролиберин, ТРГ) в первую очередь известен как центральный регулятор оси гипоталамус–гипофиз–щитовидная железа. ТРГ синтезируется в различных областях мозга и в нескольких ядрах гипоталамуса. У крысы гипофизиотропные нейроны, выделяющие ТРГ, локализуются в медиальной и каудальной зонах, у мыши – в переднемедиальных зонах ПВЯ. ТРГ-содержащие-нервные окончания контактируют с отростками β2 таницитов в срединном возвышении. β2-танициты экспрессируют пироглутамилпептидазу II (PPII), которая специфически разрушает ТРГ, регулируя количество транспортируемого ТРГ [81].
Сигналы окружающей среды, такие как температура или свет, передаются к ТРГ нейронам ПВЯ через афференты, исходящие от ствола мозга или от СХЯ. Лимбическая система, активированная в ответ на стрессово-эмоциональные стимулы, также передает сигналы на ТРГ нейроны ПВЯ. Активность гипофизиотропных ТРГ-ергических нейронов определяется отрицательной обратной связью, осуществляемой гормонами щитовидной железы, нейрональными и гормональными воздействиями, реагирующими на характер питания, и входными сигналами, активируемыми при острой немедленной потребности. Стрессовые ситуации, такие как голодание или ограничение пищи, воспаление, гипо- или гипертиреоз, изменяют активность нейронов и экспрессию ТРГ прямо или косвенно на протяжении комбинированного действия различных эффекторов. В формировании цирканнуальных ритмов изменения массы тела и репродукции, наряду с мелатонином, основная роль принадлежит гормонам тиреотропину и трийодтиронину (Т3) [81].
Однако ТРГ также оказывает множество эффектов на центральную нервную систему, независимо от его активности в оси. С возрастом наблюдается снижение синтеза, экспрессии и активности ТРГ. При этом уменьшение уровня ТРГ может способствовать развитию нейродегенеративных заболеваниях старения, включая болезнь Альцгеймера и болезнь Паркинсона. В дополнение к этому, в большинстве исследований на животных также сообщается о снижении уровня циркулирующего тироксина (Т4) с возрастом. Однако изменения содержания тиротропного гормона (ТТГ) и Т3 с возрастом менее последовательны и, по-видимому, зависят от пола и вида животного. Обнаружено, что с возрастом у самок крыс концентрация Т3 и Т4 уменьшается, в то время как уровень ТТГ оставался неизменным, однако у старых самцов крыс обнаружено снижение мРНК Т4 и ТТГ, но без изменений в сыворотке уровня Т3 [82].
У людей более низкие уровни ТТГ были обнаружены у пожилых людей, хотя не было обнаружено значительных различий в уровнях ТРГ и свободного тироксина в сыворотке крови между молодыми, среднего возраста и пожилыми людьми (Mazzoccoli et al., 2010). Снижение реакции ТТГ на стимуляцию ТРГ наблюдается с возрастом в человеческой популяции, в дополнение к снижению секреции и деградации T4 и снижению синтеза T3 [83].
Регуляция репродуктивных процессов при старении
Аксоны ГнРГ-содержащих нейронов, расположенные в ПОО, проецируются к срединному возвышению и выделяют ГнРГ пульсирующим образом. Деятельность ГнРГ-выделяющих нейронов осуществляется под контролем кисспептина, источником которого являются нейроны, расположенные в АРЯ и AVPV [84, 85]. С возрастом репродуктивные функции, включая фертильность и статус половых гормонов, естественным образом снижаются как у женщин, так и у мужчин. У человека женское репродуктивное старение характеризуется менопаузой, которая включает резкие репродуктивные и эндокринологические сдвиги, в том числе повышение уровня гонадотропинов (лютеинизирующего (ЛГ) и фолликулостимулирующего (ФСГ) гормонов), а также прекращение менструального цикла. Тем не менее уровни эстрадиола существенно не различаются между женщинами в ранней и поздней постменопаузе, однако уровни сывороточного ЛГ, ФСГ значительно снижаются между 50 и 80 годами жизни. Хотя половые ритмы самок грызунов не демонстрируют человеческих дихотомических переходов при репродуктивном старении, они постепенно становятся ациклическими с нарушением выброса гонадотропинов. У старых крыс уровень ЛГ снижается, в то время как уровень ФСГ, так же, как и у женщин в постменопаузе, повышен [85]. Мужчины и самцы грызунов испытывают связанное со старением снижение уровней репродуктивной активности, тестостерона и ГнРГ, при этом в некоторой степени сохраняя свою фертильность, в то же время уровень ЛГ у мужчин при старении повышается [5]. Повышение уровня гонадотропинов в менопаузе связано со снижением чувствительности гонад к ним. Тем не менее важно отметить активность генератора импульсов ГнРГ, что отражается в пульсации ЛГ, заметно снижается у старых самок и самцов. Однако количество нейронов кисспетин-позитивных нейронов уменьшается с возрастом у самок и у самцов крыс, в то время как количество ГнРГ-содержащих нейронов не изменяется, но снижается их активность [84]. В то же время данные относительно содержания ГнРГ у женщин при старении противоречивы. По одним данным, содержание ГнРГ в гипоталамусе у женщин при старении снижается [86], по другим – уровень гипоталамической мРНК ГнРГ в постменопаузе возрастает [87].
Старение и внутриклеточные сигнальные пути гипоталамических нейронов
Одним из важных классов белков, управляющих воздействием мозга на старение, является семейство сиртуинов. Сиртуины являются эволюционно консервативным семейством NAD + -зависимых деацилаз и играют решающую роль в долголетии у различных модельных организмов, включая дрожжей, червей, мух и мышей [88]. Сиртуины взаимодействуют с элементами других путей, которые также способствуют контролю старения, включая insulin–forkhead box protein O (FOXO) и mechanistic target of rapamycin (mTOR) во многих клетках [89, 90]. Гипоталамический SIRT1 влияет на метаболические пути в периферических органах, включая ремоделирование бурой жировой ткани [91], чувствительность к инсулину и системный метаболизм глюкозы и липидов [92]. У старых самцов и самок наблюдалось уменьшение экспрессии Sirt1 в ДМЯ. В ВМЯ экспрессия Sirt1 с возрастом не менялась [93]. Вполне вероятно, что головной мозг через сигнализацию сиртуина является важной частью сети, которая регулирует старение по всему телу.
Многие исследования связывают действие сиртуинов с функцией конкретных нейронов или областей гипоталамуса, таких как АРЯ, ВМЯ, ДМЯ и СХЯ [88, 94]. SIRT1 опосредует центральный циркадный контроль в СХЯ [95]. У самцов и самок трансгенных мышей, избыточно экспрессирующих Sirt1 (мышей BRASTO), средний и максимальный срок жизни повышен. Предполагается, что такое увеличение продолжительности жизни у таких мышей связано со специфической активацией нейронов ДМЯ [96].
Мишенью рапамицина у млекопитающих (mammalian target of rapamycin, mTOR) является серин/треониновая киназа, которая принадлежит к семейству киназ, родственных фосфоинозитид-3-киназе (PI3K), с С-концевым доменом киназы, способным реагировать на изменения в уровни энергии за счет регулирования множественных клеточных процессов, таких как клеточный цикл, рост клеток, выживание и аутофагия. MTOR участвует в двух различных белковых комплексах, mTOR комплекс 1 (mTORC1) и mTOR комплекс 2 (mTORC2), каждый из которых модулируется разными стимулами. mTORC1 ингибируется рапамицином, mTORC2 значительно менее чувствителен к рапамицину. mTORC1 интегрирует гормональные и сигналы внешней среды, включая доступность аминокислот и глюкозы для регулирования ключевых анаболических процессов, включая увеличение синтеза белка и аутофагию. mTORC2 играет роль в организации цитоскелета и является важным эффектором передачи сигналов инсулина/PI3K [97]. Доступность питательных веществ и кислорода приводит к активации пути mTOR, что приводит к анаболическим процессам, таким как биосинтез белков и липидов. Во время истощения энергии нарушение регуляции сигнального пути mTOR может привести к патофизиологическим состояниям, таким как ожирение, сердечно-сосудистые, репродуктивные и нервные расстройства, а также к онкологическим и другим заболеваниям, связанным с нарушениями иммунитета [98].
Хотя и mTORС1, и его основной субстрат S6K1 повсеместно экспрессируются в головном мозге, их активные формы почти ограничены гипоталамусом, а точнее АРЯ, ПВЯ, ВМЯ и СХЯ. После голодания наблюдалась повышенная экспрессия S6K1 в нейронах АРЯ без значительных изменений после введения лептина. В отличие от АРЯ, лептин ингибирует сигнальные пути mTORС1 в ВМЯ [99]. Усиление сигнального пути mTORС1 в нейронах POMC гипоталамуса способствует возрастному ожирению, вызывая сайленсинг этих нейронов из-за усиления регуляции активности KATP-каналов, сопровождаемой ассоциированной со старением экспрессией порообразующей субъединицы Kir6.2. При этом ингибитор mTORС1 рапамицин восстанавливал нейронную возбудимость, а также влиял на морфологию POMC нейронов, уменьшая размер сомы у старых животных [18, 100]. Активация mTORС1 в нейронах POMC путем делеции гена Tsc1 также приводит к увеличению сомы POMC нейронов и уменьшению проекций нейритов в ПВЯ, а хроническая внутрибрюшинная инъекция высоких доз рапамицина восстанавливает проекцию [101]. Активность S6K1 в медиобазальном гипоталамусе напрямую модулируется характером питания, повышаясь при повторном приеме пищи после 24-часового периода голодания, а также при введении лептина [102], что указывает на то, что S6K отвечает на важные пищевые и гормональные сигналы для управления потреблением энергии с обратной связью. Ингибирование AMPK в ВМЯ увеличивает общий термогенез за счет стимуляции бурой жировой ткани посредством симпатической нервной системы [99]. Гипоталамическая активность mTORC2 увеличивается с возрастом у мышей, и генетическое удаление этого комплекса в нейронах гипоталамуса мыши вызывает повышенную жировую массу, нарушенный гомеостаз глюкозы и снижение продолжительности жизни [103].
Факторы транскрипции семейства FOXO вовлечены в метаболизм, долголетие и пролиферацию клеток [104]. FOXO частично регулируется в этих процессах с помощью посттранскрипционных модификаций, включая фосфорилирование и ацетилирование. FOXO1 модулирует потребление пищи, регулируя орексигенные гены Agrp и анорексигенные Pomc в гипоталамусе мышей. В нейронах АРЯ гипоталамуса FOXO1 локализуется в ядрах при голодании и в цитоплазме после приема пищи [105].
Установлено, что старение связано с повышенной активацией семейства FOXO. TNF-α увеличивает активность FOXO1 за счет ингибирования его фосфорилирования. Повышенная активность FOXO1 ингибирует ген gnrh1 и активирует воспалительный путь NF-κB (см далее), тем самым нарушая секрецию ГнРГ. Повышение активности FOXO1 способствует индуцированному TNF-α снижению высвобождения ГнРГ у грызунов [106].
Оксид азота (NO) представляет собой внутри- и межклеточный медиатор, который выполняет различные функции сигнализации [107]. Как у взрослых, так и у новорожденных экспрессия нейрональной NO-синтазы в значительной степени ограничивается областями гипоталамуса, которые участвуют в контроле над функциями организма, такими как энергетический баланс и размножение. NO-ергические нейроны были обнаружены в ДМЯ, ВМЯ, ПВЯ, а также в ЛГ [108, 109].
Высокий уровень активных форм кислорода и пероксинитрита, метаболита NO наблюдается в мозге при старении [110]. Чрезмерный синтез NO ответственен за гибель клеток, в то же время повышенное высвобождение NO может быть защитным механизмом, пытающимся противодействовать апоптозу [111]. NO играет роль в нейродегенеративных заболеваниях, эпилепсии, воспалении и ишемии. Было замечено, что в этих условиях экспрессия и активность нейрональной NO-синтазы возрастают [112]. NO может играть защитную роль во время старения, а нейроны, экспрессирующие nNOS, как сообщается, более устойчивы к нейротоксическим воздействиям [110]. У молодых животных nNOS не определялась в АРЯ, а в ДМЯ и ВМЯ выявлялись нейроны, иммунореактивные к нейрональной NO-синтазе со слабой иммунофлуоресценцией. У старых крыс NO-ергические нейроны появлялись в большом количестве в АРЯ, в ДМЯ и ВМЯ количество нейронов, содержащих нейрональную NO-синтазу, достоверно увеличивалось [109].
Гипоталамическое воспаление и старение
Старый мозг характеризуется повышенным уровнем воспалительных цитокинов, таких как интерлейкин 1β (IL 1β), IL 6 и фактор некроза опухолей (TNF), и сниженным уровнем противовоспалительных цитокинов, таких как IL 10 и IL 4. Несколько воспалительных сигнальных путей в медиобазальном гипоталамусе связаны с развитием ожирения и связанного с ним метаболического метаболического синдрома, в частности с активацией таких сигнальных компонентов, как Toll-подобный рецептор 4 (TLR4), ген 88 первичного ответа миелоидной дифференцировки (MyD88), ядерный фактор каппа B (NF-κB) и ингибитор β-субъединицы киназы ядерного фактора ядра (IKKβ) и c-Jun N-концевая киназа (JNK) [4, 113, 114]. Более поздние исследования дополнительно указали на значительное вовлечение этого гипоталамического микровоспаления в механизмы старения. Ингибирование передачи сигналов NF-κB селективно в медиобазальном гипоталамусе продлевает продолжительность жизни у мышей, тогда как активация передачи сигналов NF-κB селективно сокращает их продолжительность жизни [4, 115].
Недавние исследования показали, что ГАМК-ергические нейроны и нейроны, содержащие нейротрофический мозговой фактор (BDNF) в медиобазальном гипоталамусе, подвержены вызванному астроцитами гипоталамическому микровоспалению, вызванному диетой с повышенным содержанием жиров. В условиях гипоталамического микровоспаления астроциты в медиобазальном гипоталамусе теряют терминальные отростки, что приводит к снижению поглощения астроцитами ГАМК, при этом повышение содержания ГАМК в межклеточной среде ингибирует нейроны, содержащие BDNF [116]. Также существуют обратные отношения: введение вирусного вектора, содержащего ген BDNF в медиобазальный гипоталамус у мышей среднего возраста, снижает экспрессию воспалительных генов в гипоталамусе и связанное со старением метаболическое нарушение регуляции [117]. Интересно, что ГАМКВ рецептор в POMC-содержащих нейронах оказывал протективное действие в отношении гипоталамического воспаления, ожирения и инсулинорезистентности у мышей [118]. Длительное воспаление в гипоталамусе может усиливать глутаматергическую передачу, вызывающую гипертонию, которая также является компонентом метаболического синдрома [119].
NF-κB ингибирует транскрипцию гена ГнРГ у грызунов, опосредуя его возрастное снижение. Интересно, что интрацеребровентрикулярное или подкожное введение ГнРГ у мышей предотвращает возрастное снижение нейрогенеза в гипоталамусе и гиппокампе, восстанавливает мышечную силу, толщину кожи, костную массу и целостность коллагена хвостового сухожилия [114].
Старение и гипоталамическая аутофагия
Аутофагия – это строго контролируемый процесс, который регулирует круговорот клеточных компонентов и поддержание клеточного гомеостаза. Базальная активность аутофагии снижается с возрастом, а нарушение аутофагии вносит вклад в различные фенотипы старения и возрастные заболевания [120]. Кроме того, аутофагии способствовала повышенная экспрессия NPY в нейронах гипоталамуса. Эта NPY-зависимая стимуляция аутофагии опосредована рецепторами NPY Y1 и Y5 через действие путей PI3K, MAPK/ERK и PKA. Экспрессия NPY в гипоталамусе старых мышей снижается [121]. Заметное накопление p62 в нейронах POMC указывает на то, что нейроны POMC проявляют повышенную чувствительность к возрастному снижению аутофагии, что у старых мышей приводит к увеличению уровней препропротеина POMC в гипоталамусе и снижению α-MSH. Кроме того, у старых мышей обнаруживаются сходные дефекты ожирения и липолиза, как у мышей с нокаутом ATG7, о чем свидетельствуют увеличение массы тела, количества жира и снижение содержания свободных жирных кислот в сыворотке крови и глицерина по сравнению с молодыми мышами [5]. Таким образом, аутофагия нейронов POMC важна для поддержания энергетического баланса за счет генерации α-MSH, а снижение аутофагии в POMC способствует метаболическим осложнениям, часто наблюдаемым при старении. Возможно, модуляция гипоталамической аутофагии может дать ключ к разработке новых терапевтических вмешательств для замедления старения.
Гипоталамические стволовые клетки, микроРНК и старение
Сравнительно недавно было убедительно показано, что скорость старения в значительной степени контролируется стволовыми клетками гипоталамуса, частично за счет высвобождения экзосомальных микроРНК (миРНК) [122]. Стволовые клетки преимущественно располагались в области медиобазального гипоталамуса, вблизи стенки третьего желудочка, часть из которых представлена альфа-таницитами. Количество гипоталамических стволовых клеток и экзосомальных миРНК уменьшается даже до наступления старения и продолжает экспоненциально уменьшаться с возрастом, тогда как введение стволовых клеток или экзосом, содержащих миРНК, приводило к замедлению старения [122].
миРНК представляют собой небольшие одноцепочечные некодирующие РНК (длиной 18–25 нуклеотидов), которые являются важными посттранскрипционными регуляторами экспрессии генов. Подавляющее большинство миРНК ингибирует функцию гена на основе частичной комплементарности части одной или нескольких информационных РНК (мРНК), как правило, на сайте в 3'-нетранслируемой области целевой мРНК. Последовательности миРНК и ее сайт связывания не являются строго комплементарными, и это дает возможность каждой миРНК регулировать множество различных транскриптов. Таким образом, миРНК образуют широкие регуляторные сети и создают взаимодействие между различными клеточными путями [123–125]. миРНК участвуют в контроле различных биологических процессов в центральной нервной системе, в том числе в контроле функций гипоталамуса [124].
Профиль экспрессии миРНК в гипоталамусе изменяется после метаболических нарушений. Экспрессия let-7a, miR-9, miR-30e, miR-132, miR-145, miR-200a и miR-218 в гипоталамусе мышей-самцов была изменена после ограничения калорийности или диеты с высоким содержанием жиров [126]. У самцов мышей let-7a, miR-9 и miR-132 представляют собой специфичные для мозга миРНК с высоким уровнем гипоталамической экспрессии [126]. Let-7 участвует в регуляции метаболизма глюкозы и некоторых других метаболических программах [127]. Члены семейства Let-7 миРНК действуют как супрессоры многих генов, участвующих в сигнальном пути инсулина, включая IGF1R, INSR, IRS2, PIK3IP1, AKT2, TSC1 и RICTOR [128]. У мышей сверхэкспрессия lin28a (это РНК-связывающий белок, который избирательно подавляет экспрессию миРНК, включая let-7) в VMH вызывала значительное улучшение метаболизма глюкозы, тогда как подавление Lin28a было противоположным [129]. miR-132 и miR-218 связаны с воспалением в головном мозге [130, 131].
ЗАКЛЮЧЕНИЕ
Таким образом, в гипоталамусе, в отличие от других отделов центральной нервной системы, не наблюдаются однозначно выраженные дегенеративные морфологические изменения. Тем не менее, согласно элевационной теории старения, предложенной Дильманом, с возрастом наблюдается повышение порога чувствительности гипоталамуса к гомеостатическим сигналам. У старых животных наблюдается ослабление регуляции деятельности гипоталамических нейронов по принципу отрицательной обратной связи. Процесс старения в гипоталамусе сопровождается нарушением баланса возбуждение/торможение за счет дисрегуляции ГАМК-ергической и глутаматергической системы, ГАМК-ергическая система оказывает протективное действие в отношении гипоталамического воспаления, ожирения и инсулинорезистентности, а избыточная активация глутаматергической системы при старении может вызывать разнообразные метаболические нарушения.
Старение сопровождается уменьшением частоты импульсации нейронов, нарушением обмена кальция, увеличением продукции оксида азота, нарушением процессов внутриклеточного сигналинга, в частности Sirt1, mTOR, NF-κB, AMPK, P53, PGC1α, FoxOs, а также выделением нейротрансмиттеров, например, ГнРГ, NO, NPY, α-MSH. Также важная роль в гипоталамическом старении принадлежит таницитам, что выражается в нарушении их связи с нейронами и нарушении функции барьеров. Стволовые клетки гипоталамуса, расположенные преимущественно в области срединной группы ядер, выделяют экзосомальные миРНК, которые также ответственны за антивозрастные эффекты этих клеток. При этом количество самих стволовых гипоталамических клеток и экзосомальных миРНК уменьшается по мере старения.
Несмотря на успехи последних лет, связанные с пониманием молекулярных механизмов ритмической активности, в частности работы ведущего пейсмекера – супрахиазматического ядра, а также организации нейронных гипоталамических сетей и взаимодействия нейронов и таницитов гипоталамуса, окончательного понимания механизмов гипоталамического старения к настоящему моменту еще нет. Применение сочетанных методов исследования, включая молекулярно-биологические и генетические поможет, приблизиться к решению этой проблемы.
Список литературы
Анисимов В.Н. (2008) Молекулярные и физиологические механизмы старения: В 2-х т. СПб.: Наука [Anisimov V.N. (2008) Molecular and physiological mechanisms of aging: In 2 volumes. St. Petersburg: Nauka].
Анисимов В.Н., Михальский А.И., Новосельцев В.Н., Романюха А.А., Яшин А.И. (2010) Основные принципы построения многостадийной многоуровневой математической модели старения. Успехи геронтол. 23 (2): 163–167. [Anisimov V.N., Mikhal’skiy A.I., Novoseltsev V.N., Romanyukha A.A., Yashin A.I. (2010) Basic principles of building a multi-stage multi-level mathematical model of aging. Adv. Gerontol. 23 (2): 163–167.]
Дильман В.М. (1981) Большие биологические часы: (Введение в интегральную медицину). – Знание. [Dilman V.M. (1981) Large biological clock: (An introduction to integral medicine). – Znanie].
Cai D., Khor S. (2019) “Hypothalamic Microinflammation” Paradigm in Aging and Metabolic Diseases. Cell Metab 30 (1): 19–35.
Kim K., Choe H.K. (2019) Role of hypothalamus in aging and its underlying cellular mechanisms. Mech. Aging Dev 177: 74–79.
Hill J.W., Elmquist J.K., Elias C.F. (2008) Hypothalamic pathways linking energy balance and reproduction. Am. J. Physiol. Endocrinol Metab 294 (5): E827–832. https://doi.org/10.1152/ajpendo.00670.2007
Dudas B. (Ed.) (2013) Human Hypothalamus: Anatomy, Functions and Disorders. Nova Science Publishers, New York.
Ковальзон В.М., Стрыгин К.Н. (2013) Нейрохимические механизмы регуляции сна и бодрствования: роль блокаторов гистаминовых рецепторов в лечении инсомнии. Эффективная фармакотерапия 12: 8–14. [Kovalzon V.M., Strygin K.N. (2018) Neurochemical mechanisms of sleep and wakefulness regulation: the role of histamine receptor blockers in the treatment of insomnia. Effective Pharmacotherapy 12: 8–14.]
Qin C., Li J., Tang K. (2018) The Paraventricular Nucleus of the Hypothalamus: Development, Function, and Human Diseases. Endocrinology 159 (9): 3458–3472. https://doi.org/10.1210/en.2018-00453
Brown C.H., Ludwig M., Tasker J.G., Stern J.E. (2020) Somato-dendritic vasopressin and oxytocin secretion in endocrine and autonomic regulation. J Neuroendocrinol 32 (6): e12856. https://doi.org/10.1111/jne.12856
Фролькис В.В. (1991) Старение мозга. Л, Наука. [Frolkis V.V. (1991) Aging of the brain. L., Science].
Hsu H.K., Peng M.-T. (1978) Hypothalamic neuron number of the old female rats // Gerontology 24: 434–440.
Sartin J.L., Lamperti A.A. (1985) Neuron numbers in hypothalamic nuclei of young, middle-aged and aged male rats. Experientia 41: 109–111.
Flood D.G., Coleman P.D. (1993) Dendritic regression dissociated from neuronal death but associated with partial deafferentation in aging rat supraoptic nucleus. Neurobiol Aging 14: 575–587.
Madeira M.D., Ferreira-Silva L., Ruela C., Paula-Barbosa M.M. (2001) Differential effects of the aging process on the morphology of the hypothalamic ventromedial nucleus of male and female rats. Neurosci Lett 314 (1–2): 73–76. https://doi.org/10.1016/s0304-3940(01)02294-7
Roberts D.E., Killiany R.J., Rosene D.L. (2012) Neuron Numbers in the Hypothalamus of the Normal Aging Rhesus Monkey: Stability Across the Adult Lifespan and Between the Sexes. J Comp Neurol 520 (6): 1181–1197.
Leal S., Andrade J.P., Paula-Barbosa M.M., Madeira M.D. (1998) Arcuate nucleus of the hypothalamus: effects of age and sex. J Comp Neurol 401 (1): 65–88. https://doi.org/10.1002/(sici)1096-9861(19981109)401:1<65::aid-cne5>3.0.co;2-d
Yang S.B., Tien A.C., Boddupalli G., Xu A.W., Jan Y.N., Jan L.Y. (2012) Rapamycin ameliorates age-dependent obesity associated with increased mTOR signaling in hypothalamic POMC neurons. Neuron 75: 425–436.
Hrabovszky E., Takács S., Göcz B., Skrapits K. (2019) New Perspectives for Anatomical and Molecular Studies of Kisspeptin Neurons in the Aging Human Brain. Neuroendocrinology. 109 (3): 230–241. https://doi.org/10.1159/000496566
Machado-Salas J., Scheibel M.E., Scheibel A.B. (1977) Morphologic changes in the hypothalamus of the old mouse. Exp Neurol 57: 102–111.
Rizzo V., Richman J., Puthanveettil S.V. (2015) Dissecting mechanisms of brain aging by studying the intrinsic excitability of neurons. Front Aging Neurosci 6: 337.https://doi.org/10.3389/fnagi.2014.00337
Kumar A., Foster T.C. (2004) Enhanced long-term potentiation during aging is masked by processes involving intracellular calcium stores. J. Neurophysiol 91: 2437.
Toescu E.C., Verkhratsky A. (2000) Parameters of calcium homeostasis in normal neuronal ageing. J. Anat 197: 563.
Need A.C., Irvine E.E., Giese K.P. (2003) Learning and memory impairments in Kv beta 1.1-null mutants are rescued by environmental enrichment or ageing. Eur J. Neurosci 18. 1640–1644. https://doi.org/10.1046/j.1460-9568.2003.02889.x
Farajnia S., Meijer J.H., Michel S. (2015) Age-related changes in large-conductance calcium-activated potassium channels in mammalian circadian clock neurons. Neurobiol Aging 36 (6): 2176–2183. https://doi.org/10.1016/j.neurobiolaging.2014.12.040
Vishnyakova P.A., Moiseev K.Y., Spirichev A.A., Emanuilov A.I., Nozdrachev A.D., Masliukov P.M. (2020) Expression of calbindin and calretinin in the dorsomedial and ventromedial hypothalamic nuclei during aging. Anat Rec (Hoboken). https://doi.org/10.1002/ar.24536
Rozycka A., Liguz-Lecznar M. (2017) The space where aging acts: focus on the GABAergic synapse. Aging Cell 16 (4): 634–643. https://doi.org/10.1111/acel.12605
Yang S.B., Tien A.C., Boddupalli G., Xu A.W., Jan Y.N., Jan L.Y. (2012) Rapamycin ameliorates age-dependent obesity associated with increased mTOR signaling in hypothalamic POMC neurons. Neuron 75: 425–436.
Wang Y., Garro M., Dantzler H.A., Taylor J.A., Kline D.D., Kuehl-Kovarik M.C. Age affects spontaneous activity and depolarizing afterpotentials in isolated gonadotropin-releasing hormone neurons. Endocrinology 149 (10): 4938–4947. 2008. https://doi.org/10.1210/en.2008-0308
Wang Y., Kuehl-Kovarik M.C. Estradiol directly attenuates sodium currents and depolarizing afterpotentials in isolated gonadotropin-releasing hormone neurons. Brain Res 2012 1436: 81–91. https://doi.org/10.1016/j.brainres.2011.12.013
Pfeffer M., Korf H.W., Wicht H. (2018) Synchronizing effects of melatonin on diurnal and circadian rhythms. Gen Comp Endocrinol 258: 215–221.
Epelbaum J., Terrien J. (2020) Mini-review: Aging of the neuroendocrine system: Insights from nonhuman primate models. Prog Neuropsychopharmacol Biol Psychiatry 100: 109854.https://doi.org/10.1016/j.pnpbp.2019.109854
Takahashi J.S. (2017) Transcriptional architecture of the mammalian circadian clock. Nat Rev Genet 18. 164–179.
Hastings M.H., Maywood E.S., Brancaccio M. (2018) Generation of circadian rhythms in the suprachiasmatic nucleus. Nat Rev Neurosci 19 (8): 453–469. https://doi.org/10.1038/s41583-018-0026-z
Noguchi T., Leise T.L., Kingsbury N.J., Diemer T., Wang L.L., Henson M.A., Welsh D.K. (2017) Calcium Circadian Rhythmicity in the Suprachiasmatic Nucleus: Cell Autonomy and Network Modulation. eNeuro 4 (4): ENEURO.0160-17.2017. https://doi.org/10.1523/ENEURO.0160-17.2017
Patton A.P., Chesham J.E., Hastings M.H. (2016) Combined pharmacological and genetic manipulations unlock unprecedented temporal elasticity and reveal phase- specific modulation of the molecular circadian clock of the mouse suprachiasmatic nucleus. J Neurosci 36: 9326–9341.
Colwell C.S. (2011) Linking neural activity and molecular oscillations in the SCN. Nat Rev Neurosci 12: 553–569.
Meijer J.H., Michel S. (2015) Neurophysiological analysis of the suprachiasmatic nucleus: a challenge at multiple levels. Methods Enzymol 552: 75–102.
Houben T., Coomans C.P., Meijer J.H. (2014) Regulation of circadian and acute activity levels by the murine suprachiasmatic nuclei. PLoS ONE 9: e110172.
Kondratova A.A., Kondratov R.V. (2012) The circadian clock and pathology of the ageing brain. Nat Rev Neurosci 13 (5): 325–335.
Chen C.Y., Logan R.W., Ma T., Lewis D.A., Tseng G.C., Sibille E., McClung C.A. (2016) Effects of aging on circadian patterns of gene expression in the human prefrontal cortex. Proc Natl Acad Sci USA 113 (1): 206–211.
Rijo-Ferreira F., Takahashi J.S. (2019) Genomics of circadian rhythms in health and disease. Genome Med 11 (1): 82. https://doi.org/10.1186/s13073-019-0704-0
Buijink M.R., Olde Engberink A.H.O., Wit C.B., Almog A., Meijer J.H., Rohling J.H.T., Michel S. Aging Affects the Capacity of Photoperiodic Adaptation Downstream from the Central Molecular Clock. J Biol Rhythms 35 (2): 167–179. 2020https://doi.org/10.1177/0748730419900867
Yamaguchi A., Tatsumoto M., Matsumura R., Endo T., Hirata K., Tokuda I., Akashi M. (2018) Normal peripheral circadian phase in the old-old with abnormal circadian behavior. Genes Cells 23 (10): 849–859.
Zhdanova I.V., Masuda K., Quasarano-Kourkoulis C., Rosene D.L., Killiany R.J., Wang S (2011) Aging of intrinsic circadian rhythms and sleep in a diurnal nonhuman primate, Macaca mulatta. J Biol Rhythms 26 (2): 149–159.
Kawakami F., Okamura H., Tamada Y., Maebayashi Y., Fukui K., Ibata Y. (1997) Loss of day-night differences in VIP mRNA levels in the suprachiasmatic nucleus of aged rats. Neurosci Lett 222 (2): 99–102.
Palomba M., Nygård M., Florenzano F., Bertini G., Kristensson K., Bentivoglio M. (2008) Decline of the presynaptic network, including GABAergic terminals, in the aging suprachiasmatic nucleus of the mouse. J Biol Rhythms 23 (3): 220–231.
Aujard F., Cayetanot F., Terrien J., Van Someren E.J. (2007) Attenuated effect of increased daylength on activity rhythm in the old mouse lemur, a non-human primate. Exp Gerontol 42 (11): 1079–1087.
Cayetanot F., Bentivoglio M., Aujard F. (2005) Arginine-vasopressin and vasointestinal polypeptide rhythms in the suprachiasmatic nucleus of the mouse lemur reveal agingrelated alterations of circadian pacemaker neurons in a non-human primate. Eur J Neurosci 22 (4): 902–910.
Eghlidi D.H., Luna S.L., Brown D.I., Garyfallou V.T., Kohama S.G., Urbanski H.F. (2018) Gene expression profiling of the SCN in young and old rhesus macaques. J Mol Endocrinol 61 (2): 57–67. https://doi.org/101530/JME-18-0062
Шпаков А.О., Деркач К.В. (2016) Меланокортиновая сигнальная система гипоталамуса и ее функциональное состояние в условиях сахарного диабета 2-го типа и метаболического синдрома. Рос. физиол. журн. им. И.М. Сеченова 102 (1) 18–40. [Shpakov A.O., Derkach K.V. (2016) Melanocortin signaling system of the hypothalamus and its functional state in conditions of type 2 diabetes mellitus and metabolic syndrome. IM Sechenov Ros Phyziol Zhurn 102 (1): 18–40. (In Russ).]
Romanov R.A., Alpár A., Hökfelt T., Harkany T. Unified Classification of Molecular, Network, and Endocrine Features of Hypothalamic Neurons. Annu Rev Neurosci 42: 1–26.https://doi.org/10.1146/annurev-neuro-070918-050414
Ashpole N.M., Sanders J.E., Hodges E.L., Yan H., Sonntag W.E. Growth hormone, insulin-like growth factor-1 and the aging brain. Exp Gerontol 68: 76–81. 2015.
Bartke A. (2003) Can growth hormone (GH) accelerate aging? Evidence from GH-transgenic mice. Neuroendocrinology 78: 210–216.
Hirschberg P.R., Sarkar P., Teegala S.B., Routh V.H. (2020) Ventromedial hypothalamus glucose-inhibited neurones: A role in glucose and energy homeostasis? J Neuroendocrinol 32 (1): e12773. https://doi.org/10.1111/jne.12773
Kammel L.G., Correa S.M. (2020) Selective sexual differentiation of neurone populations may contribute to sex-specific outputs of the ventromedial nucleus of the hypothalamus. J. Neuroendocrinol 32 (1): e12801. https://doi.org/10.1111/jne.12801
Mobbs C.V., Moreno C.L., Poplawski M. (2013) Metabolic mystery: aging, obesity, diabetes, and the ventromedial hypothalamus. Trends Endocrinol Metab 24 (10): 488–494.
Orozco-Solis R., Aguilar-Arnal L., Murakami M., Peruquetti R., Ramadori G., Coppari R., Sassone-Corsi P. (2016) The Circadian Clock in the Ventromedial Hypothalamus Controls Cyclic Energy Expenditure. Cell Metab 23 (3): 467–478.
Dhillon H., Zigman J.M., Ye C., Lee C.E., McGovern R.A., Tang V., Kenny C.D., Christiansen L.M., White R.D., Edelstein E.A., Coppari R., Balthasar N., Cowley M.A., Chua S. Jr., Elmquist J.K., Lowell B.B. (2006) Leptin directly activates SF1 neurons in the VMH, and this action by leptin is required for normal body-weight homeostasis. Neuron 49 (2): 191–203.
Sohn J.W., Oh Y., Kim K.W., Lee S., Williams K.W., Elmquist J.K. (2016) Leptin and insulin engage specific PI3K subunits in hypothalamic SF1 neurons. Mol Metab J 5 (8): 669–679. https://doi.org/10.1016/j.molmet.2016.06.004
Parker K.L., Schimmer B.P. (1997) Steroidogenic factor 1: a key determinant of endocrine development and function. Endocr Rev 18: 361–377.
Kim K.W., Zhao L., Donato J.Jr., Kohno D., Xu Y., Elias C.F., Lee C., Parker K.L., Elmquist J.K. (2011) Steroidogenic factor 1 directs programs regulating diet-induced thermogenesis and leptin action in the ventral medial hypothalamic nucleus. Proceedings of the National Academy of Sciences of the United States of America 108 (26): 10673–10678. https://doi.org/10.1073/pnas.1102364108
Kinyua A.W., Yang D.J., Chang I., Kim K.W. (2016) Steroidogenic Factor 1 in the Ventromedial Nucleus of the Hypothalamus Regulates Age-Dependent Obesity. PLoS One 11 (9): e0162352. https://doi.org/10.1371/journal.pone.0162352
Majdic G., Young M., Gomez-Sanchez E., Anderson P., Szczepaniak L.S., Dobbins R.L., McGarry J.D., Parker K.L. (2002) Knockout mice lacking steroidogenic factor 1 are a novel genetic model of hypothalamic obesity. Endocrinology 143: 607–614.
Liu W., Liu M., Fan W., Nawata H., Yanase T. The (2006) Gly146Ala variation in human SF-1 gene: its association with insulin resistance and type 2 diabetes in Chinese. Diabetes Res Clin Pract 73: 322–328.
Моисеев К.Ю., Спиричев А.А., Вишнякова П.А., Ноздрачев А.Д., Маслюков П.М. (2020) Изменения экспрессии стероидогенного фактора 1 (SF-1) в нейронах вентромедиального ядра гипоталамуса крысы при старении. Рос. физиол. журн. им. И.М. Сеченова 106 (6): 720–727. [Moiseev K.Yu., Spirichev A.A., Vishnyakova P.A., Nozdrachev A.D., Maslyukov P.M. (2020) Changes in the expression of steroidogenic factor 1 (SF-1) in neurons of the ventromedial nucleus of the rat hypothalamus during aging. IM Sechenov Ros Fiziol J 106 (6): 720–727. (In Russ)].
Prevot V., Dehouck B., Sharif A., Ciofi P., Giacobini P., Clasadonte J. (2018) The Versatile Tanycyte: A Hypothalamic Integrator of Reproduction and Energy Metabolism. Endocr Rev 39 (3): 333–368. https://doi.org/10.1210/er.2017-00235
Vong L., Ye C., Yang Z., Choi B., Chua S. Jr., Lowell B.B. (2011) Leptin action on GABAergic neurons prevents obesity and reduces inhibitory tone to POMC neurons. Neuron 71 (1): 142–154.
Garfield A.S., Shah B.P., Burgess C.R., Li M.M., Li C., Steger J.S., Madara J.C., Campbell J.N., Kroeger D., Scammell T.E., Tannous B.A., Myers M.G.Jr., Andermann M.L., Krashes M.J., Lowell B.B. (2016) Dynamic GABAergic afferent modulation of AgRP neurons. Nat Neurosci 19 (12): 1628–1635.
Rezai-Zadeh K., Yu S., Jiang Y., Laque A., Schwartzenburg C., Morrison C.D., Derbenev A.V., Zsombok A., Münzberg H. (2014) Leptin receptor neurons in the dorsomedial hypothalamus are key regulators of energy expenditure and body weight, but not food intake. Mol Metab 3 (7): 681–693.
Mieda M., Williams S.C., Richardson J.A., Tanaka K., Yanagisawa M. (2006) The dorsomedial hypothalamic nucleus as a putative food-entrainable circadian pacemaker. Proc Natl Acad Sci USA 103 (32): 12150–12155. https://doi.org/10.1073/pnas.0604189103
Northeast R.C., Vyazovskiy V.V., Bechtold D.A. (2020) Eat, sleep, repeat: the role of the circadian system in balancing sleep-wake control with metabolic need. Curr Opin Physiol. 15: 183–191. https://doi.org/10.1016/j.cophys.2020.02.003
Chou T.C., Scammell T.E., Gooley J.J., Gaus S.E., Saper C.B., Lu J. (2003) Critical role of dorsomedial hypothalamic nucleus in a wide range of behavioral circadian rhythms. J Neurosci 23 (33): 10691–10702.
Saper C.B., Lu J., Chou T.C., Gooley J. (2005) The hypothalamic integrator for circadian rhythms. Trends Neurosci. 28 (3): 152–157.
Bechtold D.A., Loudon A.S.I. (2013) Hypothalamic clocks and rhythms in feeding behaviour. Trends Neurosci 36: 74–82.
Guilding C., Hughes A.T.L., Brown T.M., Namvar S., Piggins H.D. (2009) A riot of rhythms: neuronal and glial circadian oscillators in the mediobasal hypothalamus. Mol Brain 2: 28.
Chen K.-S., Xu M., Zhang Z., Chang W.-C., Gaj T., Schaffer D.V., Dan Y. (2018) A hypothalamic switch for REM and non-REM sleep. Neuron 97: 1168–1176. e4.
Aston-Jones G., Chen S., Zhu Y., Oshinsky M.L. (2001) A neural circuit for circadian regulation of arousal. Nat Neurosci 4: 732–738.
Acosta-Galvan G., Yi C.-X., van der Vliet J., Jhamandas J.H., Panula P., Angeles-Castellanos M., del Carmen Basualdo M., Escobar C., Buijs R.M. (2011) Interaction between hypothalamic dorsomedial nucleus and the suprachiasmatic nucleus determines intensity of food anticipatory behavior. Proc Natl Acad Sci USA 108: 5813–5818.
Gooley J.J., Schomer A., Saper C.B. (2006) The dorsomedial hypothalamic nucleus is critical for the expression of food-entrainable circadian rhythms. Nat Neurosci 9 (3): 398–407.
Joseph-Bravo P., Jaimes-Hoy L., Charli J.L. (2016) Advances in TRH signaling. Rev Endocr Metab Disord 17 (4): 545–558. https://doi.org/10.1007/s11154-016-9375-y
Daimon C.M., Chirdon P., Maudsley S., Martin B. The role of Thyrotropin Releasing Hormone in aging and neurodegenerative diseases. Am J Alzheimers Dis (Columbia) 1 (1): 2013. https://doi.org/10.7726/ajad.2013.1003
Roelfsema F., Boelen A., Kalsbeek A., Fliers E. (2017) Regulatory aspects of the human hypothalamus-pituitary-thyroid axis. Best Pract Res Clin Endocrinol Metab 31 (5): 487–503. https://doi.org/10.1016/j.beem.2017.09.004
Kunimura Y., Iwata K., Ishigami A., Ozawa H. (2017) Age-related alterations in hypothalamic kisspeptin, neurokinin B, and dynorphin neurons and in pulsatile LH release in female and male rats. Neurobiol Aging 50: 30–38.
Tsutsumi R., Webster N.J. (2009) GnRH pulsatility, the pituitary response and reproductive dysfunction. Endocr J 56 (6): 729–737. https://doi.org/10.1507/endocrj.k09e-185
Yin W., Gore A.C. (2006) Neuroendocrine control of reproductive aging: roles of GnRH neurons. Reproduction. 131 (3): 403–414. https://doi.org/10.1530/rep.1.00617
Rance N.E. (2009) Menopause and the human hypothalamus: evidence for the role of kisspeptin/neurokinin B neurons in the regulation of estrogen negative feedback. Peptides 30 (1): 111–122. https://doi.org/10.1016/j.peptides.2008.05.016
Satoh A., Imai S.I., Guarente L. (2017) The brain, sirtuins, and ageing. Nat Rev Neurosci 18 (6): 362–374. https://doi.org/10.1038/nrn.2017.42
Hong S., Zhao B., Lombard D.B., Fingar D.C., Inoki K. (2014) Cross-talk between sirtuin and mammalian target of rapamycin complex 1 (mTORC1) signaling in the regulation of S6 kinase 1 (S6K1) phosphorylation. J Biol Chem 289 (19): 13132–13141. https://doi.org/10.1074/jbc.M113.520734
Igarashi M., Guarente L. mTORC1 and SIRT1 Cooperate to Foster Expansion of Gut Adult Stem Cells during Calorie Restriction. Cell. 166 (2): 436–450. 2016. https://doi.org/10.1016/j.cell.2016.05.044
Ramadori G., Fujikawa T., Fukuda M., Anderson J., Morgan D.A., Mostoslavsky R., Stuart R.C., Perello M., Vianna C.R., Nillni E.A., Rahmouni K., Coppari R. (2010) SIRT1 deacetylase in POMC neurons is required for homeostatic defenses against diet-induced obesity. Cell Metab. 12 (1): 78–87. https://doi.org/10.1016/j.cmet.2010.05.010
Al-Massadi O., Quiñones M., Clasadonte J., Hernandez-Bautista R., Romero-Picó A., Folgueira C., Morgan D.A., Kalló I., Heras V., Senra A., Funderburk S.C., Krashes M.J., Souto Y., Fidalgo M., Luquet S., Chee M.J., Imbernon M., Beiroa D., García-Caballero L., Gallego R., Lam B.Y.H., Yeo G., Lopez M., Liposits Z., Rahmouni K., Prevot V., Dieguez C., Nogueiras R. (2019) MCH Regulates SIRT1/FoxO1 and Reduces POMC Neuronal Activity to Induce Hyperphagia, Adiposity, and Glucose Intolerance. Diabetes 68 (12): 2210–2222. https://doi.org/10.2337/db19-0029
Spirichev A.A., Moiseev K.Y., Masliukov P.M. (2020) Sirtuin 1 Expression in the Rat Ventromedial and Dorsomedial Hypothalamic Nuclei during Ageing. Bull Exp Biol Med 169 (5): 698–700. https://doi.org/10.1007/s10517-020-04958-8
Satoh A., Imai S. (2014) Systemic regulation of mammalian ageing and longevity by brain sirtuins. Nat Commun 5: 4211. https://doi.org/10.1038/ncomms5211
Chang H.C., Guarente L. (2013) SIRT1 mediates central circadian control in the SCN by a mechanism that decays with aging. Cell 153 (7): 1448–1460. https://doi.org/10.1016/j.cell.2013.05.027
Satoh A., Brace C.S., Rensing N., Cliften P., Wozniak D.F., Herzog E.D., Yamada K.A., Imai S. (2013) Sirt1 extends life span and delays aging in mice through the regulation of Nk2 homeobox 1 in the DMH and LH. Cell Metab 18 (3): 416–430.
Liu G.Y., Sabatini D.M. (2020) mTOR at the nexus of nutrition, growth, ageing and disease. Nat Rev Mol Cell Biol 21 (4): 183–203. https://doi.org/10.1038/s41580-019-0199-y
Saxton R.A., Sabatini D.M. (2017) mTOR Signaling in Growth, Metabolism, and Disease. Cell 168 (6): 960–976. https://doi.org/10.1016/j.cell.2017.02.004
Martínez de Morentin P.B., Martinez-Sanchez N., Roa J., Ferno J., Nogueiras R., Tena-Sempere M., Dieguez C., Lopez M. (2014) Hypothalamic mTOR: the rookie energy sensor. Curr Mol Med 14 (1): 3–21. https://doi.org/10.2174/1566524013666131118103706
Kim J.G., Horvath T.L. (2012) mTOR signaling fades POMC neurons during aging. Neuron 75: 356–357.
Mori H., Inoki K., Münzberg H., Opland D., Faouzi M., Villanueva E.C., Ikenoue T., Kwiatkowski D., MacDougald O.A., Myers M.G. Jr., Guan K.L. (2009) Critical role for hypothalamic mTOR activity in energy balance. Cell Metab 9 (4): 362–374.
Blouet C., Ono H., Schwartz G.J. (2008) Mediobasal hypothalamic p70 S6 kinase 1 modulates the control of energy homeostasis. Cell Metab 8: 459–467.
Chellappa K., Brinkman J.A., Mukherjee S., Morrison M., Alotaibi M.I., Carbajal K.A., Alhadeff A.L., Perron I.J., Yao R., Purdy C.S., DeFelice D.M., Wakai M.H., Tomasiewicz J., Lin A., Meyer E., Peng Y., Arriola Apelo S.I., Puglielli L., Betley J.N., Paschos G.K., Baur J.A., Lamming D.W. (2019) Hypothalamic mTORC2 is essential for metabolic health and longevity. Aging Cell. 18 (5): e13014.https://doi.org/10.1111/acel.13014
Martins R., Lithgow G.J., Link W. (2016) Long live FOXO: unraveling the role of FOXO proteins in aging and longevity. Aging Cell 15 (2): 196–207. https://doi.org/10.1111/acel.12427
Hong S.H., Lee K.S., Kwak S.J., Kim A.K., Bai H., Jung M.S., Kwon O.Y., Song W.J., Tatar M., Yu K. (2012) Minibrain/Dyrk1a regulates food intake through the Sir2-FOXO-sNPF/NPY pathway in Drosophila and mammals. PLoS Genet 8 (8): e1002857. https://doi.org/10.1371/journal.pgen.1002857
Shi C., Shi R., Guo H. (2020) Tumor necrosis factor α reduces gonadotropin-releasing hormone release through increase of forkhead box protein O1 activity. Neuroreport 31 (6): 473–477. https://doi.org/10.1097/WNR.0000000000001424
Bahadoran Z., Carlström M., Mirmiran P., Ghasemi A. Nitric oxide: to be or not to be an endocrine hormone? Acta Physiol. (Oxf). e13443. 2020. https://doi.org/10.1111/apha.13443
Chachlaki K., Garthwaite J., Prevot V. (2017) The gentle art of saying NO: how nitric oxide gets things done in the hypothalamus. Nat Rev Endocrinol 9: 521–535.
Moiseev K.Y., Vishnyakova P.A., Porseva V.V., Masliukov A.P., Spirichev A.A., Emanuilov A.I., Masliukov P.M. (2020) Changes of nNOS expression in the tuberal hypothalamic nuclei during ageing. Nitric Oxide 100–101: 1–6. https://doi.org/10.1016/j.niox.2020.04.002
Dawson T.M., Dawson V.L. (2018) Nitric oxide signaling in neurodegeneration and cell death. Adv Pharmacol 82: 57–83.
Sen N., Hara M.R., Kornberg M.D., Cascio M.B., Bae B.I., Shahani N., Thomas B., Dawson T.M., Dawson V.L., Snyder S.H., Sawa A (2008) Nitric oxide-induced nuclear GAPDH activates p300/CBP and mediates apoptosis. Nature Cell Biology 10 (7): 866–873.
Carletti F., Gambino G., Rizzo V., Ferraro G., Sardo P. (2015) Cannabinoid and nitric oxide signaling interplay in the modulation of hippocampal hyperexcitability: Study on electrophysiological and behavioral models of temporal lobe epilepsy in the rat. Neuroscience 303: 149–159.
Belgardt B.F., Mauer J., Wunderlich F.T., Ernst M.B., Pal M., Spohn G., Brönneke H.S., Brodesser S., Hampel B., Schauss A.C., Brüning J.C. (2010) Hypothalamic and pituitary c-Jun N-terminal kinase 1 signaling coordinately regulates glucose metabolism. Proc Natl Acad Sci USA 107 (13): 6028–6033. https://doi.org/10.1073/pnas.1001796107
Zhang G., Li J., Purkayastha S., Tang Y., Zhang H., Yin Y., Li B., Liu G., Cai D. (2013) Hypothalamic programming of systemic ageing involving IKK-β, NF-κB and GnRH. Nature 497 (7448): 211–216. https://doi.org/10.1038/nature12143
Zhang X., Zhang G., Zhang H., Karin M., Bai H., Cai D. (2008) Hypothalamic IKKbeta/NF-kappaB and ER stress link overnutrition to energy imbalance and obesity. Cell 135 (1): 61–73. https://doi.org/10.1016/j.cell.2008.07.043
Zhang Y., Reichel J.M., Han C., Zuniga-Hertz J.P., Cai D. (2017) Astrocytic Process Plasticity and IKKβ/NF-κB in Central Control of Blood Glucose, Blood Pressure, and Body Weight. Cell Metab 25 (5): 1091–1102.e4. https://doi.org/10.1016/j.cmet.2017.04.002
McMurphy T., Huang W., Liu X., Siu J.J., Queen N.J., Xiao R., Cao L. (2019) Hypothalamic gene transfer of BDNF promotes healthy aging in mice. Aging Cell 18 (2): e12846. https://doi.org/10.1111/acel.12846
Ito Y., Banno R., Shibata M., Adachi K., Hagimoto S., Hagiwara D., Ozawa Y., Goto M., Suga H., Sugimura Y., Bettler B., Oiso Y., Arima H. (2013) GABA type B receptor signaling in proopiomelanocortin neurons protects against obesity, insulin resistance, and hypothalamic inflammation in male mice on a high-fat diet. J Neurosci 33 (43): 17166–71713. https://doi.org/10.1523/JNEUROSCI.0897-13.2013
Yu B., Cai D. (2017) Neural Programmatic Role of Leptin, TNFα, Melanocortin, and Glutamate in Blood Pressure Regulation vs Obesity-Related Hypertension in Male C57BL/6 Mice. Endocrinology 158 (6): 1766–1775. https://doi.org/10.1210/en.2016-1872
Kaushik S., Arias E., Kwon H., Lopez N.M., Athonvarangkul D., Sahu S., Schwartz G.J., Pessin J.E., Singh R. (2012) Loss of autophagy in hypothalamic POMC neurons impairs lipolysis. EMBO Rep 13 (3): 258–265. https://doi.org/10.1038/embor.2011.260
Aveleira C.A., Botelho M., Carmo-Silva S., Pascoal J.F., Ferreira-Marques M., Nóbrega C., Cortes L., Valero J., Sousa-Ferreira L., Álvaro A.R., Santana M., Kügler S., Pereira de Almeida L., Cavadas C. (2015) Neuropeptide Y stimulates autophagy in hypothalamic neurons. Proc Natl Acad Sci USA 112 (13): E1642–1651. https://doi.org/10.1073/pnas.1416609112
Zhang Y., Kim M.S., Jia B., Yan J., Zuniga-Hertz J.P., Han C., Cai D. (2017) Hypothalamic stem cells control aging speed partly through exosomal miRNAs. Nature 548 (7665): 52–57.https://doi.org/10.1038/nature23282
Ying S.Y., Chang D.C., Miller J.D., Lin S.L. (2006) The microRNA: overview of the RNA gene that modulates gene functions. Methods Mol Biol 342: 1–18. https://doi.org/10.1385/1-59745-123-1:1
Taouis M. (2016) MicroRNAs in the hypothalamus. Best Pract Res Clin Endocrinol Metab 30 (5): 641–651. https://doi.org/10.1016/j.immuni.2009.09.019
Vinnikov I.A., Domanskyi A. (2017) Can we treat neurodegenerative diseases by preventing an age-related decline in microRNA expression? Neural Regen Res 12 (10): 1602–1604. https://doi.org/10.4103/1673-5374.217328
Sangiao-Alvarellos S., Pena-Bello L., Manfredi-Lozano M., Tena-Sempere M., Cordido F. (2014) Perturbation of hypothalamic microRNA expression patterns in male rats after metabolic distress: impact of obesity and conditions of negative energy balance. Endocrinology 155 (5): 1838–1850. https://doi.org/10.1210/en.2013-1770
Jiang S. (2019) A Regulator of Metabolic Reprogramming: MicroRNA Let-7. Transl Oncol 12 (7): 1005–1013. https://doi.org/10.1016/j.tranon.2019.04.013
Dubinsky A.N., Dastidar S.G., Hsu C.L., Zahra R., Djakovic S.N., Duarte S., Esau C.C., Spencer B., Ashe T.D., Fischer K.M., MacKenna D.A., Sopher B.L., Masliah E., Gaasterland T., Chau B.N., Pereira de Almeida L., Morrison B.E., La Spada A.R. (2014) Let-7 coordinately suppresses components of the amino acid sensing pathway to repress mTORC1 and induce autophagy. Cell Metab 20: 626–638. https://doi.org/10.1016/j.cmet.2014.09.001
Kim C.K., Asimes A., Zhang M., Son B.T., Kirk J.A., Pak T.R. (2020) Differential Stability of miR-9–5p and miR-9–3p in the Brain Is Determined by Their Unique Cis- and Trans-Acting Elements eNeuro 7 (3): ENEURO.0094-20.2020.https://doi.org/10.1523/ENEURO.0094-20.2020
Ji Y.F., Wang D., Liu Y.R., Ma X.R., Lu H., Zhang B.A. (2018) MicroRNA-132 attenuates LPS-induced inflammatory injury by targeting TRAF6 in neuronal cell line HT-22. J Cell Biochem 119 (7): 5528–5537. https://doi.org/10.1002/jcb.26720
Li M., Guo Q., Cai H., Wang H., Ma Z., Zhang X. (2020) miR-218 regulates diabetic nephropathy via targeting IKK-β and modulating NK-κB-mediated inflammation. J Cell Physiol 235 (4): 3362–3371. https://doi.org/10.1002/jcp.29224
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


