Журнал эволюционной биохимии и физиологии, 2021, T. 57, № 4, стр. 289-299
ВЛИЯНИЕ ОХЛАЖДЕНИЯ НА ЗАВИСИМОСТЬ ЧАСТОТА–СИЛА, ЭФФЕКТ ПОТЕНЦИАЦИИ ПАУЗОЙ И ЧАСТОТНО-ЗАВИСИМОЕ УСКОРЕНИЕ РЕЛАКСАЦИИ В МИОКАРДЕ МОРСКОЙ СВИНКИ
А. С. Аверин 1, *, Н. М. Захарова 1, С. В. Тарлачков 2, 3
1 Институт биофизики клетки РАН – обособленное подразделение ФИЦ ПНЦБИ РАН
Пущино, Россия
2 Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН, ФИЦ ПНЦБИ РАН
Пущино, Россия
3 Филиал Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
Пущино, Россия
* E-mail: averin.icb@gmail.com
Поступила в редакцию 04.12.2020
После доработки 25.02.2021
Принята к публикации 19.03.2021
Аннотация
Общеизвестно, что глубокая гипотермия приводит к нарушениям в работе сердца вплоть до полной остановки, в то же время гипотермия может предотвращать гипоксические повреждения. При этом значительная часть работ, посвященных глубокой гипотермии, проведена на крысах и мышах, миокард которых значительно отличается от человеческого. В данной работе мы исследовали влияние глубокой гипотермии на ритмоинотропные явления в миокарде морской свинки, который во многом схож с миокардом человека. Проведено исследование зависимости частота–сила, эффекта потенциации паузой и частотно-зависимого ускорения расслабления в диапазоне 0.1–3.0 Гц в папиллярных мышцах правого желудочка морской свинки, при температурах 30, 20 и 10°С. Показано, что при охлаждении до температуры 10°С включительно сохраняется положительная зависимость частота–сила, в формировании которой ведущую роль играет Са2+ ток L-типа, что говорит о том, что данный механизм сохраняет свою функцию даже в условиях глубокой гипотермии. Эффект потенциации паузой сохраняется до 20°С включительно, при дальнейшем охлаждении потенциация сменяется спадом. Данный факт может свидетельствовать о том, что при 10°С нарушается функционирование саркоплазматического ретикулума, что проявляется в инвертировании эффекта потенциации паузой. Эффект частотно-зависимого ускорения кинетики сокращения также сохраняется до 20°С включительно. Это может служить подтверждением того, что проявление данного эффекта в миокарде связано с работой саркоплазматического ретикулума. Таким образом, нами было обнаружено, что среди исследованных нами частотно-зависимых эффектов есть блокируемые глубокой гипотермией (эффект потенциации паузой и частотно-зависимое ускорение расслабления) и устойчивые к данному воздействию (зависимость, частота, сила), что может отражать различия в температурной чувствительности лежащих в их основе Са2+ транспортирующих механизмов.
ВВЕДЕНИЕ
Частота сокращений сердца (ЧСС) является одним из важнейших показателей работы миокарда. Помимо этого, показано, что ЧСС является также важным внутренним регулятором, позволяющим адаптировать производительность сердца согласно потребностям организма. В миокарде большинства млекопитающих рост ЧСС ведет к увеличению силы сокращения (положительный инотропный эффект) [1]. Исключение составляет миокард крыс и мышей, для которых описан двухфазный тип зависимости частота–сила (ЧС) [2, 3]. Особый интерес представляет сердце зимоспящих, способное менять тип зависимости ЧС в различных физиологических состояниях [4–7], и патологический миокард, демонстрирующий отсутствие роста силы сокращения или ее снижение при увеличении частоты стимуляции [8, 9].
Также увеличение ЧСС ведет к ускорению кинетики сокращения (положительный лузитропный эффект) – так называемое частотно-зависимое ускорение релаксации, что позволяет поддерживать нормальную наполняемость желудочков в здоровом миокарде [9, 10].
Еще одним важным показателем работы миокарда является эффект потенциации паузой, который может служить не только качественным показателем содержания Са2+ в саркоплазматическом ретикулуме (СР) [12], но и важным диагностическим признаком [13–15].
Все эти явления в миокарде могут меняться в различном сочетании при развитии патологии [10, 14, 16].
Широко известно кардио-, и нейропротективное влияние умеренной гипотермии как в экспериментальных моделях [17, 18], так и в клинической практике [19]. С другой стороны, более глубокое охлаждение ведет к нежелательным явлениям в миокарде, таким как перегрузка клеток кальцием, рост напряжения покоя, нарушение проводимости, фибрилляция желудочков и др. [20–23].
В качестве объекта исследования нами был выбран миокард морской свинки, который по своим ритмоинотропным характеристикам гораздо ближе к миокарду человека, чем миокард крысы или мыши [1]. Существующие исследования гипотермии миокарда морской свинки и животных, сходных по типу ритмоинотропных отношений, как правило, проводились при одной частоте стимуляции, при этом нижняя граница гипотермии была близка к 20°С [22, 24, 25]. В исследованиях, охватывающих более широкий частотный диапазон, напротив, весьма ограниченными были изменения температуры всего 7°С [26]. Также значительная часть исследований по данной тематике была проведена на крысах или мышах, миокард которых имеет значительные отличия по сравнению с миокардом человека [27, 28]. Таким образом, ритмо-инотропные характеристики миокарда морской свинки в условиях глубокой гипотермии остаются малоисследованными.
Понимание отдельных механизмов устойчивости ткани миокарда к охлаждению и их взаимосвязь могут помочь в дальнейшем для минимизации негативных последствий гипотермии, в первую очередь снижения сократимости. Задачей данного исследования было изучить влияние глубокой гипотермии (10°С) на следующие частотно-зависимые явления в миокарде морской свинки: зависимость частота–сила, эффект потенциации паузой и частотно-зависимое ускорение релаксации.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования проводились (в соответствии с требованиями Европейской конвенции по защите животных 1986, 86/609/EEC) на папиллярных мышцах (ПМ) правого желудочка морских свинок. В экспериментах использовали морских свинок породы Агути (n = 19, самцы, возраст 4–6 недель, вес 200–250 г). Животных содержали в виварии ИБК РАН в стандартных условиях в соответствии с правилами по устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев): в проветриваемых помещениях, исключающих возникновение сквозняков, резких перепадов температур. Световой режим составлял 12 ч света и 12 ч темноты, режим кормления – ad libitum. Температуру воздуха поддерживали в пределах 18–21°C.
Всех морских свинок, отобранных в эксперимент, доставляли в экспериментальное помещение из вивария не менее чем за 1 ч до его начала. Животных предварительно наркотизировали диэтиловым эфиром (Diethylether). Выделенное сердце помещали в раствор Тироде (20°С) следующего состава (мМ): NaCl, 135; KCl, 4; MgCl2, 1; CaCl2, 1.8; NaHCO3, 13.2; NaH2PO4, 1.8; глюкоза, 11; (pH 7.4). Раствор аэрировали газовой смесью: О2(95%) + + СО2 (5%). Выделение ПМ, стимуляцию и измерение амплитуды сокращения в изометрическом режиме проводили по ранее описанной методике [29] при температуре перфузирующего раствора 30 ± 0.1°С. Диаметр папиллярных мышц варьировал от 0.6 до 1.0 мм, а длина – от 1.0 до 3.0 мм. Для исследования их механической активности использовали автоматизированную установку на основе персонального компьютера и плат АЦП-ЦАП (L-Сard 154 и L-Card E14–440). Механическую активность мышц регистрировали с помощью механотрона 6Х–2М. В начале каждого опыта препарат стимулировали прямоугольными импульсами (напряжение 5 В, длительность 5 мс, силой тока, в 2 раза превышающей пороговую) частотой 1 Гц в течение 1 ч для стабилизации силы сокращения.
Зависимость “частота–сила” в изометрическом режиме регистрировали в интервале частот стимуляции от 0.1 до 3.0 Гц. При построении зависимости ЧС величину силы сокращения для каждой из частот стимуляции в исследуемом диапазоне выражали в процентах по отношению к ее величине на частоте стимуляции 1 Гц при 30°С, принимаемой за 100% [5, 7].
Регистрация эффекта паузы. На фоне постоянной стимуляции с заданной частотой, при которой сила сокращения находится на стабильном уровне (базовое сокращение), вносится пауза в стимуляции, что приводит к потенциации первого после паузы сокращения (тестового). Величину эффекта выражали в процентах по отношению к силе сокращения на базовой частоте стимуляции (3 Гц при 30°С и 0.3 Гц для 20 и 10°С). Данные проверяли на нормальность распределения при помощи теста Шапиро–Уилка. Достоверность полученных результатов оценивали с помощью парного теста Стьюдента и однофакторного дисперсионного анализа (one way ANOVA) (по уровню значимости p < 0.05). Данные представлены как средние значения ± стандартная ошибка среднего. Статистический анализ данных проводили с использованием пакета статистических программ Microsoft Excel 2019 и GraphPad Prism 8.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Частота–сила
При температуре 30°С в диапазоне 1–3 Гц наблюдался рост силы сокращения ПМ в 7.5 ± 1.3 раза относительно 1 Гц (рис 1a, 1b). Данный тип зависимости ЧС характерен для здорового миокарда большинства млекопитающих [1] и морских свинок, в частности [30]. При понижении температуры до 20°С происходит рост силы сокращения ПМ, как описано в литературе для миокарда морской свинки [24, 31] и для большого числа других животных: собак [32], кроликов и крыс [25]. С увеличением частоты стимуляции, начиная с 0.4 Гц сила сокращения ПМ увеличивается при переходе к каждой последующей частоте, в итоге увеличиваясь в 5.5 ± 1.1 раза от 0.1 к 1 Гц (рис. 1a, 1c). Помимо этого, как видно из рис. 1, при понижении температуры положительная ветвь зависимости ЧС смещается влево, в область более низких частот, что сходно с результатами, полученными в условиях умеренной гипотермии на крысах [27], мышах [28] и кроликах [26]. При дальнейшем охлаждении до 10°С переход с 0.1 до 0.2 Гц не сопровождается ростом силы сокращения, и лишь при увеличении частоты стимуляции до 0.3 Гц происходит достоверное увеличение силы сокращения в 2.0 ± 0.5 раза от 0.1 к 0.3 Гц (рис. 1a, 1d). Следует отметить, что 5 из 12 ПМ утрачивали способность к сокращению при достижении 10°С (при этом увеличение порога не приводило к восстановлению сокращений). Предполагаем, что причиной подобной неоднородности могут быть индивидуальные особенности миокарда животных, для установления которых необходимы дальнейшие исследования по изучению корреляции между физиологическим ответом ткани на гипотермию и качественным и количественным составом основных белков участвующих в электромеханическом сопряжении в миокарде.
Рис. 1.
Влияние температуры на зависимость частота–сила в папиллярных мышцах правого желудочка морской свинки (n = 12). Кривые зависимости силы сокращения от частоты стимуляции (a). По оси ординат: сила изометрического сокращения по отношению к частоте стимуляции на 1 Гц при 30°С, принимаемой за 1. По оси абсцисс: частота стимуляции, Гц. Данные представлены как средние значения ± ошибка среднего (* – достоверное отличие от начальной частоты для каждой температуры p < 0.05). Оригинальные записи сокращений при температуре 30(b), 20(с) и 10°С (d).
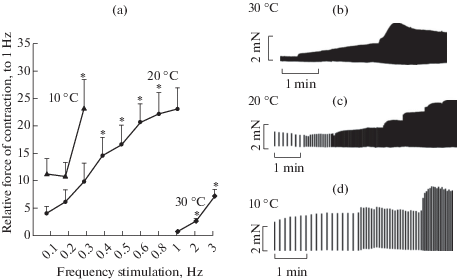
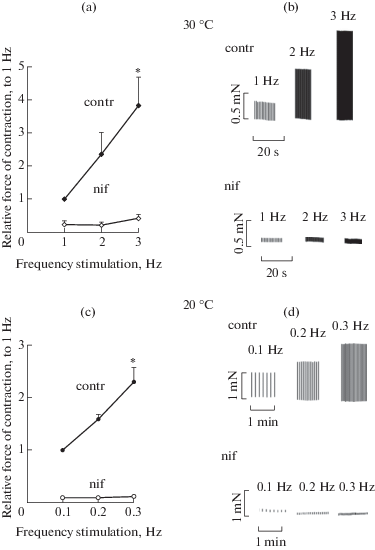
Сохранение положительной зависимости ЧС во всем исследованном диапазоне температур может свидетельствовать о сохранении значительной роли Са2+ тока L-типа в активации сокращения [2]. Для подтверждения этого предположения были проведены опыты с использованием блокатора Са2+ каналов L-типа нифедипином (2 мкМ). Как видно из рис. 2a и 2b при температуре 30°С нифедипин в значительной степени снижает силу сокращений на 77 ± 11% и 89 ± 3% при частоте стимуляции 1 и 3 Гц соответственно, на 20°С (рис. 2c, 2d) это снижение составляет 91 ± 2% и 95 ± 1% при частоте стимуляции 0.1 и 0.3 Гц соответственно. Также предобработка нифедипином препятствует формированию положительной зависимости ЧС при обеих исследованных температурах. В целом полученные данные подтверждают предположение о том, что Са2+ ток L-типа играет ведущую роль в формировании положительной зависимости ЧС при температурах 20 и 30°С. Следует отметить, что по нашим предварительным данным при достаточно низкой температуре такой, как 10°С, может быть существенно замедлено действие блокатора, при этом выход эффекта на плато может занять длительное время, что само может вносить погрешность в получаемые результаты. Также, согласно данным литературы, в таких условиях необходимо использовать значительно более высокие концентрации нифедипина, что может сказаться на селективности его воздействия [33]. Таким образом, необходимо более детальное исследование особенностей эффектов нифедипина на силу сокращения при 10°С и, возможно, поиск более подходящих подходов для блокирования Са2+ тока L-типа.
Существуют два основных источника поступления внеклеточного Са2+ в кардиомиоциты – Са2+ ток L-типа и натрий-кальциевый обменник(NCX). Натрий-кальциевый обменник может напрямую поставлять Са2+ в цитоплазму в обратном режиме, во время потенциала действия [34]. Такому функционированию NCX может способствовать повышенное накопление внутри клетки ионов Na+ под воздействием гипотермии [35] и возрастающей частоты стимуляции [36]. Также NCX способен активировать сокращение миокарда при возобновлении электрической стимуляции в условиях блокирования Са2+ тока L-типа и саркоплазматического ретикулума [37]. Помимо этого рост силы сокращения может происходить в результате того, что активность прямого режима NCX значительно падает [31], давая возможность закачать большее количество Са2+ в СР. Положительный инотропный эффект угнетения прямого режима NCX сопровождается трансформацией зависимости ЧС из положительной в отрицательную [30]. Таким образом, NCX может вносить свой вклад в рост силы сокращения при охлаждении и увеличении частоты стимуляции, но не является основным механизмом, в противном случае это отразилось бы на зависимости ЧС.
Несмотря на то что Са2+ ток L-типа играет ведущую роль в формировании положительной ветви ЧС [2] и роста силы сокращения в ответ на охлаждение [25, 38], ситуация с ним выглядит неоднозначной. В миокарде морской свинки были показаны как снижение Са2+ тока с увеличением частоты стимуляции [39], так и его рост с последующим подавлением [40]. С понижением температуры амплитуда Са2+ тока в кардиомиоцитах кролика снижается, однако замедляется его инактивация и общее количество Са2+, вошедшего в клетку, остается на уровне, близком к исходному [41]. Для миокарда морской свинки также было показано снижение пиковых значений Са2+ тока, которое, однако, не отменяло роста силы сокращения и выброса Са2+ из СР, вызванного гипотермией [24, 42]. Полученные нами данные, с сохранением положительной зависимости ЧС и практически полное ее подавление блокатором Са2+ каналов нифедипином (рис. 2) свидетельствуют в пользу того, что в миокарде морской свинки Са2+ ток сохраняет свое ведущее значение в активации сокращения. Также следует отметить сохранение его частотно-зависимой регуляции, даже в условиях глубокой гипотермии, что проявляется в сохранении положительной зависимости ЧС при 10°С.
Рис. 2.
Влияние нифедипина 2 мкМ на зависимость частота–сила в папиллярных мышцах правого желудочка морской свинки при 30°С, n = 3 (a, b) и 20°С, n = 4 (c, d). По оси ординат: сила изометрического сокращения по отношению к частоте стимуляции на 1 Гц при 30°С и 0.1 Гц при 20°С, принимаемой за 1. По оси абсцисс: частота стимуляции, Гц. Данные представлены как средние значения ± ошибка среднего (* – достоверное отличие от начальной частоты p < 0.05). Оригинальные записи сокращений при температуре 30°С (b), 20°С (d).
Потенциация паузой
При 30°С и частоте стимуляции 3 Гц мы регистрировали эффект потенциации паузой в диапазоне 0.6–1.8 с (рис. 3a, 3b), Начиная с 0.6 с эффект потенциации является достоверным и составляет 33 ± 2%, достигая максимального значения в 60 ± 5% при 1.5 с, незначительно снижаясь при дальнейшем увеличении длительности паузы до 1.8 с (58 ± ± 5%). При 20°С эффект потенциации паузой регистрировали при существенно более низкой частоте стимуляции в 0.3 Гц (рис. 3c, 3d), это связано с тем, что при более высокой частоте в 1 Гц эффект паузы маскировался высоким базовым сокращением, и внесение паузы вызывало снижение тестового сокращения. При частотах выше 1 Гц, из-за более медленной кинетики сокращения, процесс релаксации не успевал произойти полностью, и могли наблюдаться нарушения в работе ПМ, такие как альтернация и рост диастолического напряжения. Достоверная потенциация наблюдалась при длительности паузы 10 с, составляя 28 ± 7%. При дальнейшем увеличении паузы потенциация переходила в спад в 16 ± 15% при 60 с. Дальнейшее охлаждение до 10°С приводило к смене потенциации спадом в ответ на паузу, который увеличивался с ростом длительности, достигая 53 ± 10% относительно базового сокращения при длительности паузы 60 с (рис. 3e, 3f).
Рис. 3.
Влияние температуры на эффект потенциации паузой в папиллярных мышцах правого желудочка морской свинки; при температуре 30(a) и 20(c), n = 12, и при 10°С, n = 6 (e). По оси ординат: сила первого после паузы сокращения в долях от единицы к силе стационарного сокращения на частоте стимуляции на 3 Гц при 30°С, 0.3 Гц 20°С и 0.3 Гц для 10°С, принимаемой за 100%. По оси абсцисс: длительность паузы, с. Данные представлены как средние значения ± ошибка среднего (* – достоверное отличие от силы базового сокращения p < 0.05). Оригинальные записи эффекта паузы при температуре 30(b), 20(d) и 10°С (f).
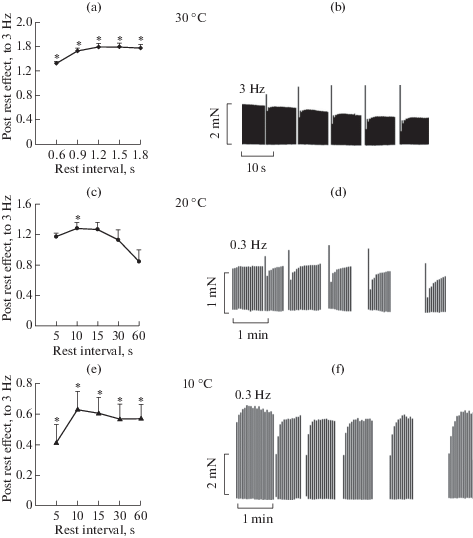
Установлено, что эффект паузы является качественным показателем содержания Са2+ в СР: увеличение амплитуды первого сокращения после паузы коррелирует с увеличением концентрации свободного кальция в цитоплазме, выбрасывающегося из СР при возобновлении стимуляции ПМ [12]. Сходно с данными других авторов, при снижении температуры потенциация паузой проявлялась при более длительных интервалах и меньшей частоте стимуляции [43]. В условиях умеренной гипотермии потенциация паузой в миокарде морской свинки увеличивается [43, 44], при этом крайне мало данных о влиянии глубокой гипотермии (около 10°С), и большая их часть касается гибернирующих животных, имеющих природные адаптации для поддержания нормальной функции миокарда в условиях низкой температуры. Тем не менее даже у этих животных наблюдается снижение эффекта потенциации паузой [4, 45]. Такое снижение может происходить как вследствие повышения утечки Са2+ из СР [46], так и в результате снижения скорости его закачки [47]. В нашей работе впервые на миокарде морской свинки продемонстрирована смена направления эффекта паузы с потенциации на подавление при температуре –10°С.
Частотно-зависимое ускорение релаксации
Как видно из рис. 4a и 4b, на 30°С увеличение частоты стимуляции с 1 до 3 Гц приводило к росту силы сокращения и ускорению его кинетических параметров. Так, время достижения максимума(ВДМ) ускорялось со 144 ± 7 до 110 ± 3 мс, а время полурасслабления (ВР50%) с 80 ± 7 до 55 ± 4 мс. При охлаждении до 20°С наблюдалась схожая картина, при переходе с 0.1 до 1 Гц ВДМ ускорялось с 379 ± 11 до 265 ± 7 мс, а ВР50% с 256 ± 36 до 132 ± ± 11 мс (рис. 4c, 4d). При дальнейшем понижении температуры до 10°С, в ответ на увеличение частоты стимуляции с 0.1 до 0.3 Гц сила сокращения по-прежнему увеличивалась, однако ускорения временных параметров сокращения не происходило, напротив, намечается тенденция к их замедлению. Значение ВДМ составляло с 847 ± 35 до 924 ± ± 46 мс, а ВР50% с 642 ± 48 до 718 ± 45 мс (рис. 4e, 4f). Эти данные хорошо согласуются с общепризнанным фактом, что частотно-зависимое ускорение релаксации является неотъемлемым свойством здорового миокарда вне зависимости от свойственного ему типа ритмоинотропии: двухфазного (мышь и крыса) или полностью положительного, характерного для большинства млекопитающих [48].
Рис. 4.
Влияние температуры на частотно-зависимое ускорение кинетических параметров сокращения в папиллярных мышцах правого желудочка морской свинки (n = 8); ВДМ – время достижения максимума сокращения, ВР 50%-время расслабления до уровня 50% от максимума. По оси ординат: время в мс. По оси абсцисс: частота стимуляции, Гц. Данные представлены как средние значения ± ошибка среднего (* – достоверное отличие от 0.1 Гц p < 0.05). Оригинальные записи сокращений при температуре 30(b), 20(d) и 10°С(f).
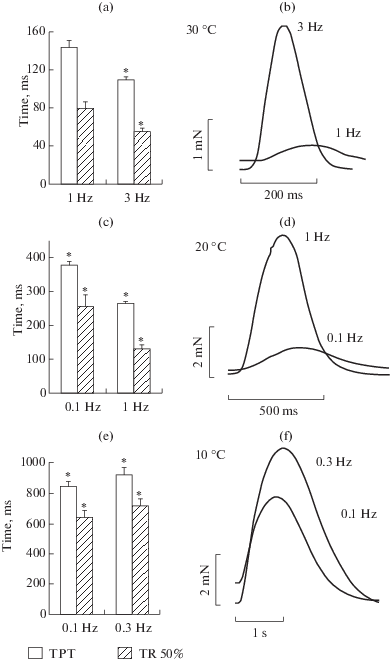
Ранее широко описывался факт того, что при физиологической или повышенной температуре эффект частотно-зависимого ускорения релаксации проявляется слабо, или отсутствует, в то время как умеренная гипотермия способствует более яркому проявлению данного эффекта [26, 27], однако сведения о его поведении в условиях глубокой гипотермии крайне ограничены. В условиях близких к физиологическим при температуре 37–30°С, в формировании частотно-зависимого ускорения релаксации может принимать участие как десенсетизация миофиламентов [11], так и увеличение активности Са2+ АТФазы СР [49], хотя существуют работы, где показано, что главным ограничителем скорости расслабления при физиологических условиях является скорее кинетика взаимодействия миофиламентов с Са2+, нежели СР, и только с понижением температуры активность СР становится ключевым фактором [50]. В то же время необходимо учитывать возможность межвидовых различий, так, подавление СР в миокарде крысы приводило к полному блокированию частотно-зависимого ускорения релаксации [51], в то время как в миокарде морской свинки этого не происходило [52]. В полученных нами данных блокировка частотно-зависимого ускорения релаксации при глубокой гипотермии происходит одновременно с подавлением эффекта паузы, что может служить косвенным доказательством того, что для проявления частотно-зависимого ускорения кинетики необходим нормально функционирующий СР.
ВЫВОДЫ
Впервые было показано, что положительная зависимость ЧС в ПМ морской свинки сохраняется даже в условиях глубокой гипотермии до 10°С включительно, что может свидетельствовать о сохранении значительного вклада внеклеточных источников Са2+, в первую очередь Са2+ тока L-типа, в активацию сокращения. Впервые показано, что при 10°С эффект внесения паузы на фоне постоянной стимуляции вместо потенциации вызывает спад силы первого сокращения после паузы, данный эффект можно трактовать как нарушение способности СР аккумулировать Са2+. Также было показано, что эффект частотно-зависимого ускорения релаксации демонстрирует большую температурную чувствительность и не регистрируется при 10°С, что может быть связано с нарушением функции СР, при этом конкретные механизмы, вызывающие дисфункцию СР, будь - то утечка через РиР или снижение активности Са2+ АТФазы СР, остаются неясными и могут служить дальнейшим объектом исследований.
Список литературы
Endoh M. (2004) Force-frequency relationship in intact mammalian ventricular myocardium: Physiological and pathophysiological relevance. Eur J Pharmacol 500 (1–3): 73–86. https://doi.org/10.1016/j.ejphar.2004.07.013
Stuyvers B., McCulloch A., Guo J., Duff H., ter Keurs H. (2002) Effect of stimulation rate, sarcomere length and Ca(2+) on force generation by mouse cardiac muscle. J Physiol 544 (3): 817–830. https://doi.org/10.1113/jphysiol.2002.024430
Kassiri Z., Myers R., Kaprielian R., Banijamali H., Backx P. (2000) Rate-dependent changes of twitch force duration in rat cardiac trabeculae: A property of the contractile system. J Physiol 524 Pt 1: 221–231. https://doi.org/10.1111/j.1469-7793.2000.t01-3-00221.x
Nakipova O., Zakharova N., Andreeva L., Chumaeva N., Averin A., Kosarskii L., Anufriev A., Lewinski D., Kockskamper J., Pieske B. (2007) The seasonal peculiarities of force-frequency relationships in active ground squirrel Spermophilus undulatus ventricle. Cryobiology 55 (3): 173–181. https://doi.org/10.1016/j.cryobiol.2007.07.001
Zakharova N., Nakipova O., Averin A., Tikhonov K., Solomonov N. (2009) Changes in force-frequency relationships in cardiac papillary muscles of hibernating ground squirrels under cooling. Dokl Biol Sci 424: 21–24. https://doi.org/10.1134/s0012496609010074
Kondo N., Shibata S. (1984) Calcium source for excitation-contraction coupling in myocardium of nonhibernating and hibernating chipmunks. Science 225 (4662): 641–643. https://doi.org/10.1126/science.6740332
Nakipova O., Averin A., Kosarsky L., Ignatiev D. (2019) The Force-Frequency Dependence in the Heart Papillary Muscle of Ground Squirrel as a Reflection of Changes in the Functional State of Animals during the Annual Cycle. BIOPHYSICS 64 (5): 786–792. https://doi.org/10.1134/S0006350919050191
Mulieri L., Hasenfuss G., Leavitt B., Allen P., Alpert N. (1992) Altered myocardial force-frequency relation in human heart failure. Circulation 85 (5): 1743–1750. https://doi.org/10.1161/01.cir.85.5.1743
Silverman D., Rambod M., Lustgarten D., Lobel R., LeWinter M., Meyer M. (2020) Heart Rate-Induced Myocardial Ca2+ Retention and Left Ventricular Volume Loss in Patients With Heart Failure With Preserved Ejection Fraction. J Am Heart Assoc 9 (17): e017215. https://doi.org/10.1161/JAHA.120.017215
Pieske B., Maier L., Bers D., Hasenfuss G. (1999) Ca2+ handling and sarcoplasmic reticulum Ca2+ content in isolated failing and nonfailing human myocardium. Circulation research 85 (1): 38–46. https://doi.org/10.1161/01.res.85.1.38
Lamberts R., Hamdani N., Soekhoe T., Boontje N., Zaremba R., Walker L., Tombe P., van der Velden J., Stienen G. (2007) Frequency-dependent myofilament Ca2+ desensitization in failing rat myocardium. J Physiol 582 (Pt 2): 695–709. https://doi.org/10.1113/jphysiol.2007.134486
Lukas A., Bose R. (1986) Mechanisms of frequency-induced potentiation of contractions in isolated rat atria. Naunyn Schmiedebergs Arch Pharmacol 334 (4): 480–487. https://doi.org/10.1007/BF00569390
Ahlberg S., Hamlen R., Ewert D., Iaizzo P., Mulligan L. (2007) Novel means to monitor cardiac performance: The impact of the force-frequency and force-interval relationships on recirculation fraction and potentiation ratio. Cardiovasc Eng 7 (1): 32–38. https://doi.org/10.1007/s10558-007-9023-y
Schillinger W., Lehnart S., Prestle J., Preuss M., Pieske B., Maier L., Meyer M., Just H., Hasenfuss G. (1998) Influence of SR Ca (2+)-ATPase and Na(+)-Ca(2+)-exchanger on the force-frequency relation. Basic Res Cardiol 93 Suppl 1: 38–45. https://doi.org/10.1007/s003950050208
Kondratieva D., Afanasiev S., Usov V., Popov S. (2017) Rhythmoinotropic Response of Papillary Muscles in Rats with Different Severity of Postinfarction Cardiosclerosis. Bull Exp Biol Med 163 (5): 612–616. https://doi.org/10.1007/s10517-017-3861-4
Kass D. (1998) Force-frequency relation in patients with left ventricular hypertrophy and failure. Basic Res Cardiol 93 Suppl 1: 108–116. https://doi.org/10.1007/s003950050232
Tsai M.-S., Huang C.-H., Yu P.-H., Tsai C.-Y., Chen H.-W., Cheng H.-J., Chang W.-T., Wang T.-D., Chen W.-J. (2015) Prolonged cooling duration mitigates myocardial and cerebral damage in cardiac arrest. Am J Emerg Med 33 (10): 1374–1381. https://doi.org/10.1016/j.ajem.2015.07.030
Yu T., Yang Z., Li H., Ding Y., Huang Z., Li Y. (2015) Short Duration Combined Mild Hypothermia Improves Resuscitation Outcomes in a Porcine Model of Prolonged Cardiac Arrest. Biomed Res Int 2015: 279192. https://doi.org/10.1155/2015/279192
Rittenberger J., Doshi A., Reynolds J. (2015) Postcardiac Arrest Management. Emerg Med Clin North Am 33 (3): 691–712. https://doi.org/10.1016/j.emc.2015.04.011
Liu B., Wang L., Belke D. (1991) Effect of low temperature on the cytosolic free Ca2+ in rat ventricular myocytes. Cell calcium 12 (1): 11–18. https://doi.org/10.1016/0143-4160(91)90080-x
Wang, Wang S.-Q., Cao H.-M., Zhou Z.-Q. (1997) Temperature dependence of the myocardial excitability of ground squirrel and rat. Journal of Thermal Biology 22 (3): 195–199. https://doi.org/10.1016/S0306-4565(97)00010-7
Stowe D., Fujita S., An J., Paulsen R., Varadarajan S., Smart S. (1999) Modulation of myocardial function and Ca2+ sensitivity by moderate hypothermia in guinea pig isolated hearts. The American journal of physiology 277 (6): H2321–H2332. https://doi.org/10.1152/ajpheart.1999.277.6.H2321
Egorov Y., Glukhov A., Efimov I., Rosenshtraukh L. (2012) Hypothermia-induced spatially discordant action potential duration alternans and arrhythmogenesis in nonhibernating versus hibernating mammals. American journal of physiology. Heart and circulatory physiology 303 (8): H1035–H1046. https://doi.org/10.1152/ajpheart.00786.2011
Shutt R., Howlett S. (2008) Hypothermia increases the gain of excitation-contraction coupling in guinea pig ventricular myocytes. American journal of physiology. Cell physiology 295(3):C692–700. https://doi.org/10.1152/ajpcell.00287.2008
Shattock M., Bers D. (1987) Inotropic response to hypothermia and the temperature-dependence of ryanodine action in isolated rabbit and rat ventricular muscle: Implications for excitation-contraction coupling. Circulation research 61 (6): 761–771. https://doi.org/10.1161/01.res.61.6.761
Mattheussen M., Mubagwa K., van Aken H., Wusten R., Boutros A., Flameng W. (1996) Interaction of heart rate and hypothermia on global myocardial contraction of the isolated rabbit heart. Anesthesia and analgesia 82 (5): 975–981. https://doi.org/10.1097/00000539-199605000-00015
Hiranandani N., Varian K., Monasky M., Janssen P. (2006) Frequency-dependent contractile response of isolated cardiac trabeculae under hypo-, normo-, and hyperthermic conditions. Journal of applied physiology (Bethesda, Md.: 1985) 100 (5): 1727–1732. https://doi.org/10.1152/japplphysiol.01244.2005
Redel A., Baumgartner W., Golenhofen K., Drenckhahn D., Golenhofen N. (2002) Mechanical activity and force-frequency relationship of isolated mouse papillary muscle: Effects of extracellular calcium concentration, temperature and contraction type. Pflugers Archiv: European journal of physiology 445 (2): 297–304. https://doi.org/10.1007/s00424-002-0931-9
Nakipova O., Averin A., Evdokimovskii E., Pimenov O., Kosarski L., Ignat’ev D., Anufriev A., Kokoz Y., Reyes S., Terzic A., Alekseev A. (2017) Store-operated Ca2+ entry supports contractile function in hearts of hibernators. PloS one 12 (5): e0177469. https://doi.org/10.1371/journal.pone.0177469
Mubagwa K., Lin W., Sipido K., Bosteels S., Flameng W. (1997) Monensin-induced reversal of positive force-frequency relationship in cardiac muscle: Role of intracellular sodium in rest-dependent potentiation of contraction. J Mol Cell Cardiol 29 (3): 977–989. https://doi.org/10.1006/jmcc.1996.0342
Mackiewicz U., Lewartowski B. (2006) Temperature dependent contribution of Ca2+ transporters to relaxation in cardiac myocytes: Important role of sarcolemmal Ca2+-ATPase. J Physiol Pharmacol 57 (1): 3–15.
Sprung J., Stowe D., Kampine J., Bosnjak Z. (1994) Hypothermia modifies anesthetic effect on contractile force and Ca2+ transients in cardiac Purkinje fibers. The American journal of physiology 267 (2 Pt 2): H725-33. https://doi.org/10.1152/ajpheart.1994.267.2.H725
Piper H., Hütter J., Spieckermann P. (1984) Temperature dependence of nifedipine action. J Mol Cell Cardiol 16 (3): 277–280. https://doi.org/10.1016/s0022-2828(84)80593-3
Bers D., Chen-Izu Y. (2015) Sodium and calcium regulation in cardiac myocytes: From molecules to heart failure and arrhythmia. J Physiol 593 (6): 1327–1329. https://doi.org/10.1113/JP270133
Isenberg G., Trautwein W. (1975) Temperature sensitivity of outward current in cardiac Purkinje fibers. Evidence of electrogenicity of active transport. Pflugers Archiv : European journal of physiology 358 (3): 225–234. https://doi.org/10.1007/BF00587219
Cohen C., Fozzard H., Sheu S. (1982) Increase in intracellular sodium ion activity during stimulation in mammalian cardiac muscle. Circulation research 50 (5): 651–662. https://doi.org/10.1161/01.res.50.5.651
Kuratomi S., Matsuoka S., Sarai N., Powell T., Noma A. (2003) Involvement of Ca2+ buffering and Na+/Ca2+ exchange in the positive staircase of contraction in guinea-pig ventricular myocytes. Pflugers Archiv : European journal of physiology 446 (3): 347–355. https://doi.org/10.1007/s00424-003-1023-1
Wang S., Huang Y., Liu K., Zhou Z. (1997) Dependence of myocardial hypothermia tolerance on sources of activator calcium. Cryobiology 35 (3): 193–200. https://doi.org/10.1006/cryo.1997.2040
Kaspar S., Pelzer D. (1995) Modulation by stimulation rate of basal and cAMP-elevated Ca2+ channel current in guinea pig ventricular cardiomyocytes. J Gen Physiol 106 (2): 175–201. https://doi.org/10.1085/jgp.106.2.175
Bates S., Gurney A. (1999) Use-dependent facilitation and depression of L-type Ca2+ current in guinea-pig ventricular myocytes: Modulation by Ca2+ and isoprenaline. Cardiovasc Res 44 (2): 381–389. https://doi.org/10.1016/s0008-6363(99)00216-3
Puglisi J., Yuan W., Bassani J., Bers D. (1999) Ca(2+) influx through Ca(2+) channels in rabbit ventricular myocytes during action potential clamp: Influence of temperature. Circulation research 85 (6): e7–e16. https://doi.org/10.1161/01.res.85.6.e7
Herve J., Yamaoka K., Twist V., Powell T., Ellory J., Wang L. (1992) Temperature dependence of electrophysiological properties of guinea pig and ground squirrel myocytes. The American journal of physiology 263 (1 Pt 2): R177–R184. https://doi.org/10.1152/ajpregu.1992.263.1.R177
Spencer C., Mörner S., Noble M., Seed W. (1994) Influences of stimulation frequency and temperature on interval-force relationships in guinea-pig papillary muscles. Acta Physiol Scand 150 (1): 11–20. https://doi.org/10.1111/j.1748-1716.1994.tb09654.x
Bjørnstad H., Tande P., Refsum H. (1993) Mechanisms for hypothermia-induced increase in contractile force studied by mechanical restitution and post-rest contractions in guinea-pig papillary muscle. Acta Physiol Scand 148 (3): 253–264. https://doi.org/10.1111/j.1748-1716.1993.tb09556.x
Zhou Z., Liu B., Dryden W., Wang L. (1991) Cardiac mechanical restitution in active and hibernating Richardson’s ground squirrel. The American journal of physiology 260 (2 Pt 2): R353–R358. https://doi.org/10.1152/ajpregu.1991.260.2.R353
Moskvin A., Iaparov B., Ryvkin A., Solovyova O., Markhasin V. (2015) Electron-conformational transformations govern the temperature dependence of the cardiac ryanodine receptor gating. Jetp Lett. 102 (1): 62–68. https://doi.org/10.1134/S002136401513010X
Suko J. (1973) The effect of temperature on Ca 2+ uptake and Ca2+-activated ATP hydrolysis by cardiac sarcoplasmic reticulum. Experientia 29 (4): 396–398. https://doi.org/10.1007/BF01926742
Monasky M., Janssen P. (2009) The positive force-frequency relationship is maintained in absence of sarcoplasmic reticulum function in rabbit, but not in rat myocardium. J Comp Physiol B 179 (4): 469–479. https://doi.org/10.1007/s00360-008-0331-3
Bluhm W., Kranias E., Dillmann W., Meyer M. (2000) Phospholamban: A major determinant of the cardiac force-frequency relationship. American journal of physiology. Heart and circulatory physiology 278 (1): H249–55. https://doi.org/10.1152/ajpheart.2000.278.1.H249
Janssen P., Stull L., Marbán E. (2002) Myofilament properties comprise the rate-limiting step for cardiac relaxation at body temperature in the rat. American journal of physiology. Heart and circulatory physiology 282 (2): H499–507. https://doi.org/10.1152/ajpheart.00595.2001
Valverde C., Mundiña-Weilenmann C., Said M., Ferrero P., Vittone L., Salas M., Palomeque J., Petroff M., Mattiazzi A. (2005) Frequency-dependent acceleration of relaxation in mammalian heart: A property not relying on phospholamban and SERCA2a phosphorylation. J Physiol 562 (Pt 3): 801–813. https://doi.org/10.1113/jphysiol.2004.075432
Yard N., Chiesi M., Ball H. (1994) Effect of cyclopiazonic acid, an inhibitor of sarcoplasmic reticulum Ca(2+)-ATPase, on the frequency-dependence of the contraction-relaxation cycle of the guinea-pig isolated atrium. Br J Pharmacol 113 (3): 1001–1007. https://doi.org/10.1111/j.1476-5381.1994.tb17092.x
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


