Журнал эволюционной биохимии и физиологии, 2021, T. 57, № 4, стр. 320-330
ПОДАВЛЕНИЕ МАЛОНОВЫМ ДИАЛЬДЕГИДОМ И МЕТИЛГЛИОКСАЛЕМ ЭНДОТЕЛИЙ-ЗАВИСИМОЙ ДИЛАТАЦИИ ПОДВЗДОШНОЙ АРТЕРИИ КРЫС, ВЫЗЫВАЕМОЙ УВЕЛИЧЕНИЕМ КРОВОТОКА
В. В. Ермишкин 1, *, Е. В. Лукошкова 1, А. М. Мелькумянц 1
1 Национальный медицинский исследовательский центр кардиологии
Москва, Россия
* E-mail: v.v.erm@mail.ru
Поступила в редакцию 30.12.2020
После доработки 11.02.2021
Принята к публикации 02.04.2021
Аннотация
Артериальные сосуды расширяются при увеличении скорости течения крови. Эта регуляция осуществляется благодаря способности эндотелиоцитов расслаблять гладкие мышцы при увеличении действующего на стенку напряжения сдвига. Ранее мы показали, что уменьшение деформируемости эндотелиоцитов димером глутарового альдегида (DGA) избирательно подавляет опосредуемую эндотелием способность артерий расширяться в ответ на увеличение кровотока. В настоящей работе в острых опытах на анестезированных крысах мы выясняли, обладают ли подобным свойством и продукты оксидативного и карбонильного стресса – малоновый диальдегид (MDA) и метилглиоксаль (MG). С этой целью регистрировали изменения гидравлической проводимости интактной подвздошной артерии, вызываемые увеличением в ней кровотока, до и после воздействия на сосудистую стенку MDA, либо MG, либо DGA. Одновременно, до и после этих воздействий, регистрировали реакцию артерии на внутриартериальное введение ацетилхолина (Ach), дилататорное действие которого опосредуется эндотелием, чтобы убедиться в сохранности функции эндотелия расслаблять гладкие мышцы. В наших экспериментах MDA и DGA избирательно подавляли дилатацию артерии в ответ на ступенчатое увеличение кровотока при сохранении практически неизменного ответа, вызываемого введением ACh. MG при сильно выраженном подавлении дилататорной реакции артерии на увеличение кровотока, как правило, уменьшал и ответ на ACh, но в значительно меньшей степени. Поскольку согласно новым представлениям механосенсором, обеспечивающим восприятие сосудистой стенкой напряжения сдвига, является эндотелиальный гликокаликс, полученные данные позволяют сделать вывод, что конечные продукты перекисного окисления липидов, образующиеся при оксидативном и карбонильном стрессе, повреждая эндотелиальный гликокаликс, могут приводить к дисфункции эндотелия, проявляющейся в утрате артериями способности регулировать гидравлическое сопротивление при изменениях скорости кровотока.
В наше время ни у кого не вызывает сомнений, что обусловленная функцией эндотелия регуляция кровеносных сосудов имеет важнейшее значение для нормального функционирования системы кровообращения. В частности, имеет место эндотелий-зависимое приспособление гидравлического сопротивления сосудов к величине текущего в них кровотока. Это свойство реализуется благодаря механочувствительности эндотелия, т.е. способности эндотелиоцитов реагировать на увеличение действующей на стенку сосуда со стороны текущей крови силы вязкого трения – напряжения сдвига [1, 2]. Механочувствительность эндотелия обеспечивает достижение максимального кровотока при рабочей гиперемии, ослабляет констрикторные реакции, противодействуя тем самым развитию сосудистого спазма, и обеспечивает острую стадию развития коллатерального кровоснабжения при окклюзии магистральных стволов [2, 3]. Само собой разумеется, что повреждение способности эндотелия реагировать на изменения действующего на него со стороны текущей крови напряжения сдвига должно приводить к развитию ряда патологических состояний, таких, например, как спазм артерий, артериальная гипертензия, недостаточное кровоснабжение органов и тканей и т.п.
Первоначально полагали, что механорецептором сосудистой стенки является мембрана эндотелиоцитов, однако последующие исследования показали, что первичным механорецептором являются волокна эндотелиального гликокаликса [4–8]. Именно они, деформируясь под действием напряжения сдвига, передают механический сигнал на клетки эндотелия, которые, в свою очередь, деформируясь, выделяют оксид азота, расслабляющий сосудистые гладкие мышцы.
Еще до этих работ было показано, что величина дилататорного ответа артерий на повышение кровотока зависит от деформируемости эндотелиоцитов: чем выше деформируемость клеток эндотелия, тем в большей мере увеличивается диаметр сосуда в ответ на один и тот же стимул. Этот вывод был сделан на основании результатов опытов, осуществленных как на магистральных артериях кошек, так и на культуре эндотелиальных клеток. В опытах на перфузируемых in situ магистральных артериях кошек реакция на повышение кровотока значительно уменьшалась или полностью исчезала после кратковременного (в течение 30 с) воздействия на интиму артерий 0.01–0.025%-ными растворами димера глутарового альдегида (DGA) [9]. Измерения же, проведенные на культуре клеток эндотелия, показали, что такое воздействие DGA вызывает значительное увеличение жесткости эндотелиальных клеток [10] и, следовательно, уменьшает величину их сдвиговых деформаций, происходящих в ответ на повышение напряжения сдвига на стенке.
Результаты этих опытов позволили заключить, что любое воздействие, повышающее жесткость эндотелиальных клеток, должно вызывать ослабление эндотелий-зависимой дилатации, определяемой чувствительностью сосудистой стенки к напряжению сдвига. Однако использовавшийся в этих исследованиях DGA представляет собой биологический яд и в организме не встречается. В то же время продукты перекисного окисления липидов – малоновый диальдегид (МDA) и метилглиоксаль (MG) сходны по структуре с DGA и, по-видимому, должны также обладать способностью влиять на деформируемость эндотелиального гликокаликса и/или эндотелиоцитов [11]. При этом известно, что при оксидативном и карбонильном стрессе концентрация MDA и MG в крови человека может многократно возрастать от нормальных значений до величин, превосходящих норму на 1–3 порядка [12].
Цель предпринятого нами исследования состояла в том, чтобы выяснить, как влияют MDA и MG на регуляцию гидравлического сопротивления магистральной артерии крыс при изменениях скорости кровотока.
МЕТОДЫ ИССЛЕДОВАНИЯ
Проведено 15 острых опытов на самцах крыс линии Вистар массой 414–562 г, наркотизированных уретаном (1.0–1.2 г/кг, внутрибрюшинно). Исследования проводились в соответствии с Директивой 2010/63/EU Европейского Парламента и Совета Европейского союза по охране животных, используемых в научных целях и рекомендациями Этического комитета НМИЦ кардиологии МЗ РФ. В ходе опыта животные находились на естественном дыхании. Температуру животных поддерживали на уровне 37°С, используя регулируемый термостатируемый столик и верхний ламповый обогрев.
Схема опыта представлена на рис. 1a. Крысам в положении лежа на спине производили трахеотомию для обеспечения нормального дыхания, после чего выделяли из тканей левую и правую бедренные артерии и правую бедренную вену для последующего канюлирования. Выделенные сосуды перевязывали дистально, после чего в левую бедренную артерию вводили длинную (20 мм) полиэтиленовую канюлю, которую продвигали почти до бифуркации аорты. Ее использовали для регистрации артериального давления (BP). Далее, в правую бедренную артерию вблизи пупартовой связки вводили небольшую (5 мм) тонкостенную (60 мкм) металлическую канюлю с наружным диаметром d = 0.72 мм, а в правую бедренную вену – канюлю из полиэтилена наружным диаметром d = 1.3 мм. Перед началом измерений эти канюли подсоединяли к трубкам внешнего контура перфузии, предварительно заполненного раствором Рингера с гепарином (100 МЕ/мл), через вену дополнительно вводили гепарин (1000–1500 МЕ), после чего, плавно ослабляя винтовой зажим, запускали кровь в перфузионный контур.
Рис. 1.
Регистрация реакций подвздошной артерии крысы in vivo.
(a) – подвздошная артерия, перфузируемая кровью под системным артериальным давлением BP. (Артерия не отпрепарована из окружающих тканей: область, незатронутая препаровкой, выделена серым цветом). Кровоток в артерии задается внешним перфузионным контуром, соединяющим бедренную артерию и бедренную вену. (b) – схема измерений. Перепад давлений на артерии ΔPа = Q/σа зависит от величины потока Q и проводимости артерии σа. Перепад давлений на жесткой трубке ΔPс = Q/σс отражает только изменение кровотока, т.к. σс = const. Поток Q, проходящий через артерию и трубку, одинаков. Для оценки гидравлической проводимости сосуда достаточно вычислить отношение перепадов давлений, т.е. σа ~ ΔPс /ΔPа.
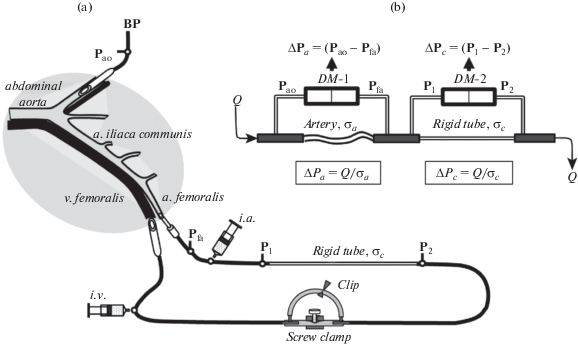
Реакции подвздошной артерии крысы на изменение в ней кровотока и на внутриартериальное введение вазодилататора оценивали, регистрируя изменения гидравлической проводимости этой артерии. Гидравлическая проводимость сосуда есть отношение величины кровотока в нем к величине перепада давлений на его концах. Следовательно, для определения величины проводимости необходимо в каждый момент времени измерять кровоток в артерии и разность давлений на ее концах. Методика измерения проводимости артерии схематично изображена на рис. 1(a и b).
Измерение проводимости подвздошной артерии. Кровь из подвздошной артерии поступает во внешний перфузионный контур и, проходя через жесткую длинную трубку, имеющую гидравлическое сопротивление Rc, а затем через ограничитель потока Q (винтовой зажим на трубке), возвращается в организм по бедренной вене. Для определения кровотока измеряли перепад давлений ΔPc = (P1–P2) на постоянном гидравлическом сопротивлении (жесткой трубке), включенном последовательно с артерией, а разность давлений на концах артерии определяли, регистрируя перепад давлений ΔPa = (Pao–Pfa) на тройниках, установленных на входе и выходе из подвздошной артерии (рис. 1a).
По закону Пуазейля при ламинарном течении жидкости с вязкостью η в трубке кругового сечения длиной L и диаметром d на его концах создается перепад давления ΔP, равный:
где $R = 128\frac{{\eta L}}{{\pi {{d}^{4}}}}$ – гидравлическое сопротивление участка сосуда. Видно, что R обратно пропорционально четвертой степени диаметра сосуда. А так как проводимость σ есть величина, обратная сопротивлению, то она прямо пропорциональна четвертой степени диаметра. Таким образом, даже незначительное увеличение диаметра артерии должно приводить к заметному увеличению ее гидравлической проводимости, что и обеспечивает высокую чувствительность использованного метода.Поскольку артерия и жесткая трубка соединены последовательно (рис. 1b), через них проходит один и тот же поток Q. В этом случае отношение падений давления на этих участках равно отношению их проводимостей: ΔPс/ΔPа = σa/σc. Так как проводимость жесткой трубки σс – величина постоянная, то для оценки гидравлической проводимости сосуда σа достаточно измерить и вычислить отношение перепадов давлений..
Таким образом, разработанная нами методика позволяла измерять проводимость (или гидравлическое сопротивление) протяженного участка артерии крыс, сохраняя саму артерию интактной.
Разность давлений на входе и выходе из подвздошной артерии ΔPa и на концах жесткой трубки ΔPc регистрировали с помощью двух прецизионных дифференциальных манометров APZ 3020 (ООО Пьезус, Россия). Для регистрации системного давления BP (рис. 1a) использовали электроманометр Statham P23AA (Gould Instruments, США). Сигналы от датчиков подавали на входы АЦП NI USB-6009 (National Instruments, США) и записывали в компьютер с частотой оцифровки 1 кГц. Перед обработкой их сначала усредняли за 2-секундный интервал. На мониторе отображались величины проводимости ~ΔPс/ΔPа, кровотока в артерии ~ΔPс и среднего артериального давления BP. Запись и обработку сигналов с выводом исследуемых параметров на экран монитора производили, используя собственное программное обеспечение, разработанное в среде LabView.
Порядок осуществления опытов. После завершения хирургической процедуры к сосудам подключали перфузионный контур и начинали перфузию, устанавливая с помощью винтового зажима кровоток в артерии на уровне 1.5–2.0 мл/мин. После 20‑минутной стабилизации регистрировали ответ артерии на ступенчатое увеличение кровотока (в 2–4 раза). Для этого открывали трубку, шунтирующую сопротивление, задаваемое винтовым зажимом (рис. 1a). Увеличенный кровоток удерживали в течение 20–30 с – до тех пор, пока кривая проводимости не стабилизировалась на новом, более высоком, чем фоновый, уровне. Далее трубку пережимали, возвращая кровоток в артерии к исходному уровню. Воздействие с увеличенным кровотоком повторяли как минимум дважды. Далее дважды вызывали расширение подвздошной артерии, вводя внутриартериально ацетилхолин хлорид (Ach) (Sigma, США). Для этого на 30 с перекрывали кровоток на входе в перфузируемый контур и через тройник ретроградно в артерию медленно (в течение 20 с) вручную вводили 0.5 мл ACh в концентрации 10–6–10–5М.
По окончании этого периода опыта, служившего контролем, в артерию вводили один из альдегидов: DGA (25 мМ), MDA (12–18 мМ) или MG (30–60 мМ), пытаясь повредить эндотелий-зависимые реакции подвздошной артерии. Раствор DGA готовили из водного раствора глутарового альдегида (GA, 25%, Sigma-Aldrich, США), как описано в работе [9]. Раствор MG получали из готового 40%-ного водного раствора MG (Sigma-Aldrich, США). MDA получали методом кислотного гидролиза из 1,1,3,3-тетраэтоксипропана [13], его концентрацию определяли при разбавлении 1:1000 по оптической плотности при 267 нм на спектрофотометре Hitachi 220A (Hitachi Inc., Япония), используя коэффициент экстинкции 31800 л/(моль см). Все альдегиды доводили до необходимой концентрации, добавляя раствор Рингера (в мМ: NaCl 154; KCl 5.6; CaCl2 2,2; Na2HPO4 ⋅ 2H2O 0.4; NaH2PO4 ⋅ 2H2O 0.1). Кислотность растворов альдегидов доводили до pH 7.3–7.8, добавляя NaOH. Альдегиды вводили тем же путем, что и ACh, с помощью инъектора Sage 341A (Sage Instruments, США). Время введения DGA составляло 1 мин, а MDA и MG 7–10 мин. Спустя 30–60 мин повторяли те же реакции, которые осуществляли в контрольном периоде опыта.
Обработка результатов опытов. Эффекты альдегидов на опосредуемые эндотелием реакции артерий, вызываемые механическим (повышение кровотока) и фармакологическим (ACh) стимулами (показаны на рис. 2), оценивали, сравнивая величины реакций до и после введения альдегидов в русло сосуда. Величину реакций, регистрируемых в контрольном периоде опыта, принимали за 100%, а реакции после введения MDA, DGA и MG оценивали в % к величинам соответствующих реакций в контроле для каждого опыта и затем усредняли. Результаты представлены в виде среднего и ошибки среднего (M ± m). Статистическую достоверность различий определяли, используя непараметрические критерии Манна–Уитни для непарных и Вилкоксона для парных сравнений с уровнем значимости p < 0.05. Построение графиков и статистический анализ осуществляли, используя пакет программ GraphPad Prism 5.0 (GraphPad Software, США).
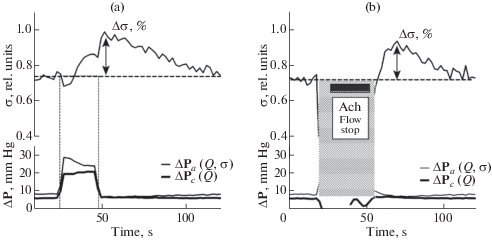
Рис. 2.
Динамика изменений проводимости подвздошной артерии крысы в ответ на ступенчатое увеличение кровотока (a) и на введение ACh в артерию (b). Величину изменения проводимости Δσ оценивали в процентах к уровню проводимости до начала воздействия. Проводимость артерии σ определяли как отношение ΔPc/ΔPа. Во время введения ACh сигналы ΔPc и ΔPа не регистрировали, поскольку кровоток во внешнем контуре был перекрыт.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
На рис. 2a показана типичная запись изменения во времени проводимости подвздошной артерии крысы в ответ на ступенчатое увеличение кровотока. Величина перепада давления на жесткой трубке ΔPc (жирная линия на нижнем графике) отражает изменение кровотока Q в артерии. (Скорости кровотока 1 мл/мин соответствует величина ΔPc ≈ 4 мм рт.ст.). При открывании шунта, естественно, происходило увеличение кровотока как в артерии, так и во всей перфузионной системе, о чем свидетельствовало резкое увеличение как сигнала ΔPc, так и сигнала ΔPа.
Перепад давления на артерии ΔPa тоже сначала быстро рос, достигая максимума, но, задержавшись на нем всего на несколько секунд, начинал плавно уменьшаться, что свидетельствовало об увеличении проводимости артерии. Из верхней записи на рис. 2a видно, что немедленно вслед за увеличением кровотока в артерии ее проводимость несколько уменьшалась. Это объясняется тем, что, согласно законам гидродинамики, при увеличении кровотока во всей магистрали трансмуральное давление в артерии несколько уменьшается, а это, в свою очередь, приводит к пассивному уменьшению диаметра сосуда, а значит и к уменьшению проводимости. Однако это уменьшение проводимости непродолжительно. И спустя 5–7 с после повышения кровотока проводимость подвздошной артерии начинает увеличиваться, что свидетельствует о ее расширении. Это расширение происходит, несмотря на снизившееся растягивающее давление. Особенно отчетливо увеличение проводимости артерии проявляется после восстановления исходного кровотока, когда происходит восстановление первоначального трансмурального давления. Поскольку гидродинамически состояния сосуда до увеличения и сразу после восстановления кровотока были одинаковы (одинаковые растягивающее давление и кровоток), именно эти моменты в наибольшей степени пригодны для оценки степени расширения подвздошной артерии. Кровоток при полном открывании шунта увеличивался в среднем в 3.0 ± 0.2 раза (n = 18), что вызывало увеличение проводимости подвздошной артерии на 43 ± 6%. Поскольку для нас имели значение только изменения проводимости, вызываемые альдегидами, а не абсолютные величины реакции артерии, то далее на всех графиках величины кровотока Q и проводимости σ приводятся в относительных единицах.
На рис. 2b показана реакция той же артерии в ответ на введение в ее русло ACh. Так как кровоток на время введения был пережат, условия измерения величин ΔPc и ΔPа полностью нарушались, этот период исключали из рассмотрения (закрашен серым). Однако сразу после возобновления кровотока можно видеть характерную динамику увеличения проводимости, аналогичную той, что наблюдали в ответ на механический стимул.
Следует подчеркнуть, что анализу подвергали данные только тех опытов, в которых увеличение проводимости подвздошной артерии в контроле в ответ на увеличение кровотока и введение ACh составляло не менее 15%. Только в таких опытах исследовали затем действие альдегидов.
На начальном этапе этой работы в трех опытах для подавления реакции на поток мы использовали DGA, для того чтобы убедиться в том, что результат, получаемый на крысах и при использовании другой методики, соответствует результату, ранее полученному на артериях кошки [9]. Мы выяснили, что вводимый в артерию DGA (25 мМ, 1 мин) также полностью подавляет дилататорные ответы на поток, оставляя практически неизменными реакции, вызываемые Ach (Записи не показаны.)
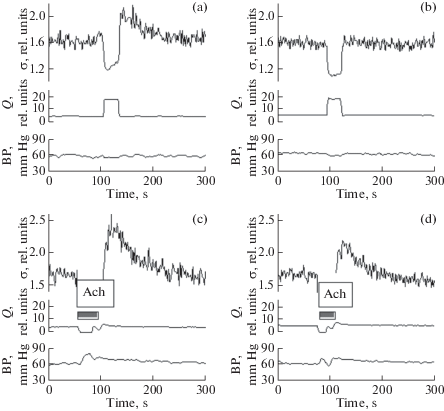
На рис. 3 представлен результат одного из опытов, в котором сопоставлены реакции подвздошной артерии на повышение кровотока и Ach до и после введения в артериальное русло в течение 10 мин MDA (16 мМ). Как видно, в данном опыте MDA полностью устранил реакцию на увеличение потока, тогда как дилататорная реакция, вызванная ACh, при этом практически не изменилась.
Рис. 3.
Влияние MDA на эндотелий-зависимые реакции подвздошной артерии крысы на увеличение кровотока (a, b) и на ACh (c, d).
(a, с) – контроль до, (b, d) – через 30 мин после введения MDA в русло артерии.
В следующей серии опытов исследовали действие на сосуд другого эндогенного альдегида – MG. В 2 из 7 опытов наблюдался эффект, сходный с таковым при действии MDA: расширение, вызываемое повышением кровотока, уменьшалось весьма значительно, тогда как ответ на Ach оставался практически таким же, как в контроле. (Записи не показаны.)
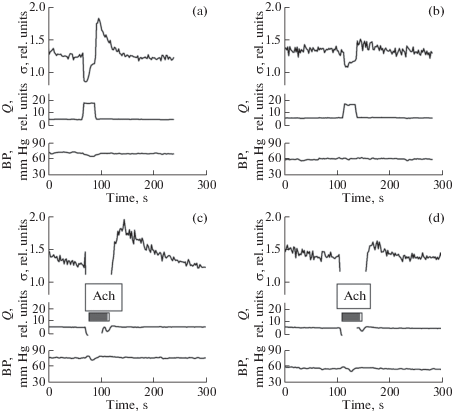
Однако в остальных опытах с MG, выполненных по такому же протоколу, наблюдалось подавление реакций на оба стимула, как на механический, так и химический. Запись реакций одного такого опыта, в котором подавление обеих реакций проявилось достаточно полно, представлена на рис. 4. Слева показаны записанные в контроле значительные по величине реакции на ступеньку кровотока и на ACh, а справа –значительное подавление обоих ответов артерии, наблюдавшееся спустя 60 мин после воздействия MG (30 мМ, 10 мин). Важно отметить, что в течение этих 60 мин реакции и на увеличение кровотока, и на Ach уменьшались постепенно, становясь в конце опыта малозаметными.
Рис. 4.
Неизбирательное ингибирование MG опосредуемой эндотелием реакции артерии на увеличение кровотока (a, b) и на ACh (c, d).
(a, с) – контроль до, (b, d) – через 60 мин после введения MG в русло артерии.
Данные сравнения относительных величин реакций до и после применения каждого из альдегидов по всем опытам собраны в табл. 1 и, кроме того, представлены в виде суммарных графиков на рис. 5.
Таблица 1.
Величины реакций подвздошной артерии крыс (Δσ) в ответ на увеличение кровотока и введение вазодилататора ACh до и после инфузии DGA, MDA или MG в русло артерии (в % от контроля)
| Контроль | DGA | MDA | MG | ||||
|---|---|---|---|---|---|---|---|
| Q↑ | ACh | Q↑ | ACh | Q↑ | ACh | Q↑ | ACh |
| 100.0 | 100.0 | 9.3 | 57.2 | 4.5 | 74.1 | 0.7 | 0.0 |
| 100.0 | 100.0 | 9.6 | 103.1 | 1.6 | 90.6 | 4.8 | 5.1 |
| 100.0 | 100.0 | 20.3 | 102.0 | 20.1 | 94.1 | 5.0 | 10.0 |
| 100.0 | 100.0 | – | – | 21.3 | 152.5 | 13.9 | 30.6 |
| 100.0 | 100.0 | – | – | 3.8 | 220.7 | 4.7 | 22.5 |
| 100.0 | 100.0 | – | – | – | – | 44.0 | 87.2 |
| 100.0 | 100.0 | – | – | – | – | 26.9 | 113.1 |
| M ± SEM | |||||||
| 100.0 | 100.0 | 13.1 | 87.4 | 10.3 | 126.4 | 14.3 | 38.3 |
| ±0.0 | ±0.0 | ±3.6 | ±15.1 | ±4.3 | ±27.1 | ±6.0 | ±16.7 |
Рис. 5.
Влияние MDA (a), DGA (b) и MG (c) на величину реакций подвздошной артерии крысы на ступенчатое увеличение кровотока (Q↑, светлые столбики) и ACh (темные столбики). Величина реакций в контроле принята за 100%. Величины столбиков, соответствующих введениям МDА, DGA и МG характеризуют средние величины реакций, измеренные в % к исходным в каждом опыте. (d) – изменение под действием MG, отношения величин реакции на поток (Q↑) к реакции на Аch. Стрелки указывают направление и величину изменений в каждом опыте. Начальная точка C соответствует отношению величин реакций в контроле до введения MG.
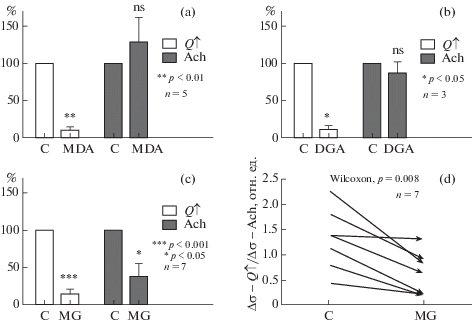
На графиках a, b и c (рис. 5) величины реакций в контроле (столбики C) приняты за 100%. Столбики рядом показывают среднюю (M ± m) величину реакции (Δσ) после введения в русло артерии MDA, DGA и MG (в % к величине Δσ в контроле). Светлые столбики соответствуют реакциям на поток, темные – на ACh. Значимость отличий определяли по критерию Манна-Уитни, сравнивая величины реакций Δσ, полученных в 7 опытах до и после введения соответствующего альдегида.
Представленные в табл. 1 и на рис. 5 результаты опытов показывают, что эффект избирательного действия MDA на механочувствительное звено эндотелий-зависимой реакции сосуда является статистически значимым (p < 0.01) и сильно выраженным – амплитуда остаточных реакций в среднем составила 10 ± 4% исходной величины (график (a)). При этом амплитуда реакций на ACh в среднем не уменьшилась (недостоверное увеличение на 26 ± 27%, p = 0.4). Аналогичное действие оказывал и DGA (график (b)): амплитуда остаточных реакций на увеличение кровотока в среднем составила 13 ± 4% исходной величины, а на ACh незначимо уменьшилась – на 13 ± 15% (p = 0.4).
Усредненные данные по всем 7 опытам с применением MG (рис. 5c) на первый взгляд не позволяют говорить о его избирательном действии в отношении механочувствительного компонента реакций эндотелия. Действительно, MG достоверно подавлял обе реакции: и на увеличение потока (Q↑, p < 0.001) и на ACh (p < 0.05). Однако можно заметить, что оставшаяся после воздействия MG реакция на ACh (38 ± 17%) значительно больше остаточной реакции на поток (14 ± 6%). Чтобы убедиться в достоверности этих отличий, мы определили для каждого из 7 опытов отношение амплитуд (Δσ) реакций на повышение кровотока (Q↑) и на ACh и сравнили величины этого отношения в контроле и после введения MG. Результат показан на диаграмме (рис. 5d), отражающей изменение величин (Δσ–Q↑/ Δσ–ACh) под действием MG для каждого из опытов.
На графике видно, что за единственным исключением все стрелки направлены вниз. Это означает, что во всех опытах, кроме одного, поток-зависимая дилатация артерии в результате действия MG уменьшалась сильнее, чем реакция на ACh. Статистический анализ показывает высокую достоверность различий в вызываемом MG ослаблении ответов на поток и на ACh (p = 0.008 по критерию Вилкоксона).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Общепризнано, что в основе многих заболеваний сердечно-сосудистой системы лежит дисфункция сосудистого эндотелия. Среди заболеваний, вызывающих нарушение нормального функционирования эндотелия, наиболее распространенными являются атеросклероз и сахарный диабет. Развитие патологии эндотелия на ранних этапах этих заболеваний связано с окислительным и карбонильным стрессами, когда при перекисном окислении липидов образуются дикарбонилы, повреждающие клетки эндотелия и подавляющие их способность выполнять свои функции [14].
Одной из основных функций сосудистого эндотелия является его способность реагировать на изменения действующего на стенку со стороны текущей крови напряжения сдвига, благодаря чему происходит приспособление гидравлического сопротивления сосудов к скорости кровотока в них [2]. Однако исследования последних двух десятилетий показали, что возникновению дисфункции эндотелия предшествует повреждение эндотелиального гликокаликса, слоя макромолекул, обращенных в просвет сосуда и производимых эндотелиоцитами. Это “покрытие” эндотелиальных клеток, по структуре напоминающее “кустарник”, состоит из заякоренных в плазмалемме гликозаминогликанов, протеогликанов, гликопротеинов и гликолипидов [5, 15]. Гликокаликс защищает эндотелиальные клетки от повреждающих воздействий, а его повреждение приводит к увеличению проницаемости сосудистой стенки, к быстрому прогрессированию атеросклеротического процесса и к утрате способности регулировать тонус сосудистых гладких мышц при изменениях действующего на стенку напряжения сдвига [15].
В многочисленных исследованиях показано, что основным фактором, вызывающим повреждение гликокаликса и нарушение функции эндотелия при атеросклерозе и сахарном диабете, является окислительный стресс [16–19], при котором в избытке производятся активные формы кислорода, индуцирующие окисление таких субстратов, как липиды и углеводы. В процессе этого свободнорадикального окисления образуются вторичные продукты карбонильной природы, причем в процессе окисления ненасыщенных липидов образуется, главным образом, MDA, а в процессе окисления углеводов образуются гомологи MDA – глиоксаль и MG [19, 20]. Заметим, что все эти соединения являются структурными аналогами глутарового альдегида.
Ранее в опытах на циркуляторно изолированных магистральных артериях кошек мы показали, что DGA избирательно повреждает способность эндотелия регулировать просвет сосудов при изменениях скорости кровотока [9]. Естественно было предполагать, что и образующиеся в процессе оксидативного и карбонильного стресса продукты перекисного окисления липидов – MDA и MG – также способны вызывать дисфункцию эндотелия, лишая его способности регулировать гидравлическое сопротивление сосудов при изменениях действующего на стенку напряжения сдвига.
Опыты, результаты которых приведены в этой статье, подтвердили сделанное предположение. Использовав метод резистографии, что позволило регистрировать изменения гидравлического сопротивления интактной подвздошной артерии крыс, вызываемые повышением в ней кровотока и Ach, мы показали, что MDA подавляет дилататорные ответы на повышение напряжения сдвига, практически не влияя на расширение артерии, вызываемое Ach (рис. 3 и 5). Из этого следует, что MDA, так же как и димер глутарового альдегида, способен селективно повреждать механорецептор эндотелиоцитов, каковым является слой эндотелиального гликокаликса [4, 6–8], не затрагивая при этом способность клеток эндотелия расслаблять гладкие мышцы при действии фармакологических дилататоров.
Менее определенный результат был получен в опытах, в которых на сосудистую стенку воздействовали MG. С одной стороны, действие этого альдегида было сходно с действием DGA и MDA: дилатация, вызываемая механическим стимулом (повышением скорости кровотока), подавлялась в большей степени, чем расширение, вызываемое Ach (рис. 4 и 5). Однако и расширение, вызываемое фармакологическим стимулом, подавлялось весьма существенно. Такой результат заставляет полагать, что либо MG, в отличие от MDA, взаимодействует также с мембранными белками хеморецепторов, включая холинорецептор, что и определяет ослабление ответа на Ach, либо MG не только изменяет жесткость гликокаликса и эндотелиоцитов, но также повреждает и внутриклеточный механизм, приводящий к высвобождению оксида азота или других факторов, расслабляющих гладкие мышцы.
Сравнение действия этих двух альдегидов, имеющих близкие молекулярные массы и являющихся изомерами, позволяет, хотя и с большой осторожностью, высказать предположение о том, что сахарный диабет должен быстрее, чем атеросклероз, приводить к серьезным нарушениям функционирования сердечно-сосудистой системы. Такое предположение уже высказывалось [21] на основе сравнения результатов свободнорадикального окисления липопротеидов низкой плотности глюкозой и MG. В пользу этого предположения свидетельствуют также полученные нами данные, выявившие некоторые различия в действии MG и MDA на эндотелий-зависимые реакции магистральной артерии крыс, что, как мы полагаем, связано с их различной проникающей способностью и с преимущественным действием одного из них извне на мембрану эндотелиоцитов и защищающий их слой гликокаликса, а другого – и на внутриклеточный биохимический механизм, который обеспечивает, в конечном итоге, расслабление гладких мышц. Поднятые вопросы, очевидно, весьма важны и нуждаются в дальнейшем исследовании.
Подводя итог, можно сказать, что альдегиды, образующиеся при свободнорадикальном окислении липидов и углеводов – MDA и MG, в целом действуют на сосудистый эндотелий сходным образом: они повышают жесткость гликокаликса и/или эндотелиоцитов, подавляя, таким образом, дилататорную реакцию, вызываемую механическим стимулом – повышением кровотока. При этом степень селективности такого подавления выше у MDA, это позволяет предполагать, что образующийся в избытке при гипергликемии MG, нарушая способность эндотелиоцитов расслаблять гладкие мышцы при действии на стенку сосуда не только механического, но и фармакологических стимулов, вызывает более серьезную, чем MDA, дисфункцию эндотелия.
Список литературы
Melkumyants A.M., Balashov S.A., Khayutin V.M. (1989) Endothelium-dependent control of arterial diameter by blood viscosity. Cardiovasc Res 23 (9): 741–747. https://doi.org/10.1093/cvr/23.9.741
Мелькумянц А.М., Балашов С.А. (2005) Механочувствительность артериального эндотелия. М. Триада. [Melkumyants A.M., Balashov S.A. (2005) Mechanochuvstvitel’nost’ arterial’nogo endoteliya [Mechanosensitivity of arterial endothelium]. Moscow. Triada. (in Russ)].
Melkumyants A.M., Balashov S.A., Kartamyshev S.P. (1994) Anticonstrictor effect of endothelium sensitivity to shear stress. Pflug Arch 427: 264–269. https://doi.org/10.1007/BF00374533
Barakat A.I. (2001) A model for shear stress-induced deformation of a flow sensor on the surface of vascular endothelial cells. J Theor Biol 210: 221–236. https://doi.org/10.1006/jtbi.2001.2290
Weinbaum S., Zhang X., Han Y., Vink H., Cowin S.C. (2003) Mechanotransduction and flow across the endothelial glycocalyx. Proc Natl Acad Sci USA 100: 7988–7995. https://doi.org/10.1073/pnas.1332808100
Pahakis M.Y., Kosky J.R., Tarbell J.M. (2007) The role of endothelial glycocalyx components in mechanotrasduction of fluid shear stress. Biochem Biophys Res Commun 355 (1): 228–233. https://doi.org/10.1016/j.bbrc.2007.01.137
Florian J.A., Kosky J.A., Ainslie K., Pang Z., Dull R.O., Tarbell J.M. (2003) Heparan sulfate proteoglycan is a mechanosensor on endothelial cells. Circ Res 93: 136–142. https://doi.org/10.1161/01.RES.0000101744.47866.D5
Мелькумянц А.М., Балашов С.А., Гончар И.В. (2017) Влияние повреждения эндотелиального гликокаликса на способность артерий регулировать свой просвет при изменениях скорости кровотока. Рос физиол журн им. И.М. Сеченова. 103 (12): 1370–1376. [Melkumyants A.M., Balashov S.A., Gonchar I.V. (2017) The influence of endothelial glycocalyx injury on the ability of arteries to control their lumen in accordance to changes in blood flow. Russ J Physiol 103 (12): 1370–1376. (In Russ)].
Mel’kumyants A.M., Balashov S.A., Smieshko V., Khayutin V.M. (1986) Selective blocking of arterial sensitivity to blood flow rate by glutaraldehyde. Bull Exp Biol Med 101: 568–570. https://doi.org/10.1007/BF00835862
Мелькумянц А.М., Балашов С.А. (1999) Роль деформируемости эндотелиальных клеток в реакциях артерий на изменения напряжения сдвига. Рос физиол журн им. И.М. Сеченова. 85: 910–917. [Melkumyants A.M., Balashov S.A. (1999) The role of deformability of endothelial cells in the arterial response to shear stress. Russ J Physiol 85: 910–917. (In Russ)].
Kumskova E.M., Antonova O.A., Balashov S.A., Tikhaze A.K., Melkumyants A.M., Lankin V.Z. (2014) Malonyldialdehyde and glyoxal act differently on low-density lipoproteins and endotheliocytes. Mol Cell Biochem 396 (1–2): 79–85. https://doi.org/10.1007/s11010-014-2144-x
Меньщикова Е.Б., Ланкин В.З., Зенков Н.К., Бондарь И.А., Круговых Н.Ф., Труфакин Н.А. (2006) Окислительный стресс. Прооксиданты и антиоксиданты. М. Слово. [Men’schikova E.B., Lankin V.Z., Zenkov N.K., Bondar’ I.A., Krugovykh N.F., Trufakin N.A. (2006) Oksidativnyi stress. Prooksidanty i antioksidanty [Oxidative stress. Prooxidants and antioxidants]. Moscow. Slovo. (In Russ)].
Requena J.R., Fu M.X., Ahmed M.U., Jenkins A.J., Lyons T.J., Baynes J.W., Thorpe S.R. (1997) Quantification of malondialdehyde and 4-hydroxynonenal adducts to lysine residues in native and oxidized human low-density lipoprotein. Biochem J 322 (1): 317–325. https://doi.org/10.1042/bj3220317
Lankin V.Z., Tikhaze A.K. (2003) Atherosclerosis as a free radical pathology and antioxidative therapy of this disease. In: Tomasi A., Ezben T., Skulachev V.P. (eds). Free radicals, nitric oxide, and inflammation: molecular, biochemical, and clinical aspects. IOS Press, NATO Science Series, Amsterdam 344: 218–231.
Мелькумянц А.М. (2012) О роли эндотелиального гликокаликса в механогенной регуляции сопротивления артериальных сосудов. Успехи физиол наук. 43 (4): 45–58. [Melkumyants A.M. (2012) About the role of endothelial glycocalyx in mechanogenic regulation of arterial vascular resistance. Usp Fiziol Nauk 43 (4): 45–58. (In Russ)].
Lankin V.Z., Tikhaze A.K., Kapel’ko V.I., Shepel’kova G.S., Shumaev K.B., Panasenko O.M., Konovalova G.G., Belenkov Y.N. (2007) Mechanisms of oxidative modification of low density lipoproteins under conditions of oxidative and carbonyl stress. Biochemistry (Mosc) 72 (10): 1081–1090. https://doi.org/10.1134/S0006297907100069
Steinberg D., Witztum J.L. (2010) Oxidized low-density lipoprotein and atherosclerosis. Arterioscler Thromb Vasc Biol 30 (12): 2311–2316. https://doi.org/10.1161/ATVBAHA.108.179697
Lankin V.Z., Tikhaze A.K., Konovalova G.G., Kumskova E.M., Shumaev K.B. (2010) Aldehyde-dependent modification of low density lipoproteins. In: Rathbound J.E. (ed) Handbook of lipoprotein research. NOVA Sci Publish Inc, New York 85–107.
Lankin V.Z., Konovalova G.G., Tikhaze A.K., Nedosugova L.V. (2011) The influence of glucose on free radical peroxidation of low density lipoproteins in vitro and in vivo. Biochemistry (Mosc.). Suppl. Series B: Biomedical Chemistry 5: 284–292. https://doi.org/10.1134/S1990750811030061
Donato H. (1981) Lipid peroxidation, cross-linking reactions, and aging. In: Sohal RS (ed). Age pigments. Elsevier, Amsterdam 63–81.
Lankin V.Z., Konovalova G.G., Tikhaze A.K., Shumaev K.B., Kumskova E.M., Viigmaa M. (2014) The initiation of free radical peroxidation of low-density lipoproteins by glucose and its metabolite methylglyoxal: a common molecular mechanism of vascular wall injury in atherosclerosis and diabetes. Mol Cell Biochem 395 (1–2): 241–252. https://doi.org/10.1007/s11010-014-2131-2
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


