Журнал эволюционной биохимии и физиологии, 2021, T. 57, № 4, стр. 331-343
ВЛИЯНИЕ ОБОГАЩЕННОЙ СРЕДЫ И СОЦИАЛЬНОЙ ИЗОЛЯЦИИ НА УСЛОВНОРЕФЛЕКТОРНЫЙ СТРАХ У КРЫС, ПЕРЕНЕСШИХ РАННИЙ ПРОВОСПАЛИТЕЛЬНЫЙ СТРЕСС
И. В. Павлова 1, *, Н. Д. Брошевицкая 1
1 Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
* E-mail: pavlovfml@mail.ru
Поступила в редакцию 20.01.2021
После доработки 16.02.2021
Принята к публикации 02.04.2021
Аннотация
У крыс, подвергнутых раннему провоспалительному стрессу (введение липополисахарида (ЛПС) на 3‑й и 5-й день после рождения в дозе 50 мкг/кг), исследовали влияние содержания в условиях социальной изоляции или обогащенной среды в возрасте с 1.5 до 4 мес на выработку и угашение условнорефлекторного страха. Тестирование через 24 ч после обучения показало, что после социальной изоляции у самцов и самок ухудшалась выработка условнорефлекторного страха, что проявилось в уменьшении времени замирания. Наибольшую чувствительность к социальной изоляции показали крысы с ранним провоспалительным стрессом, у которых снижалось время замирания как на сигнал, так и контекст. Предполагается, что уменьшение страха связано с дефицитом памяти. Обогащение среды снижало время замирания, но в меньшей степени, чем социальная изоляция, при этом уменьшался страх только на контекст. Угашение страха у самцов ЛПС-группы ускорялось после социальной изоляции и обогащения среды по сравнению с животными этой группы, содержащимися в стандартных условиях. Полученные результаты свидетельствуют, что после раннего провоспалительного стресса взрослые животные были более уязвимы к изменениям условий содержания.
Известно, что вмешательства в нормальное развитие в раннем онтогенезе создают предрасположенность к появлению психопатологии, которая может проявиться при новом вмешательстве в дальнейшей жизни (“втором ударе”) [1–3]. У людей обнаружена тесная связь ранних негативных влияний с развитием целого ряда психоневрологических заболеваний, таких как депрессия, тревожные расстройства, посттравматический синдром, аутизм и др. [4, 5]. Выявлены существенные половые различия в частоте проявления этих заболеваний [6].
Базовой причиной для многих перечисленных расстройств является нейровоспаление, которое может возникать под влиянием раннего стресса [5]. В экспериментах на животных наиболее часто используется модель нейровоспаления, вызванная инъекцией бактериального липополисахарида (ЛПС). ЛПС является составным компонентом внешней части мембраны грамотрицательных бактерий, и его введение приводит к высвобождению большого числа эндогенных провоспалительных медиаторов (цитокины, хемокины и др.) через TLR4*MD-2 комплекс [7].
В литературе имеются сведения о том, что ранний провоспалительный стресс может оказывать влияние на оборонительное поведение взрослых животных. Провоспалительный стресс мог приводить к ослаблению условнорефлекторного страха на контекст, проявляющегося в виде замирания [8–10], или, наоборот, увеличению его выражения у взрослых крыс-самцов после введения ЛПС в раннем онтогенезе [11, 12]. В других работах не было обнаружено влияния введения ЛПС на 14-й день от рождения на выработку условнорефлекторного страха на контекст или на сигнал у взрослых крыс, но наблюдался дефицит в угашении классического оборонительного рефлекса [13]. После провоспалительного стресса имелись нарушения при обучении в бассейне Морриса [14], в обучении распознаванию нового объекта [9, 10] и при выработке активного избегания [12, 15]. Проведенные нами ранее эксперименты [12] показали, что ранний провоспалительный стресс вызывал изменения в оборонительном поведении взрослых крыс, которые зависели от пола животного. У самцов с ранним введением ЛПС условнорефлекторный страх на контекст после выработки классического оборонительного условного рефлекса и рефлекса пассивного избегания проявлялся в большей степени, а его угашение было затруднено по сравнению с контрольными животными. У самок с ранним введением ЛПС не наблюдалось значительных изменений в проявлении страха, однако угашение классического рефлекса облегчалось.
Возникает вопрос о том, как скажутся последствия раннего стресса на обучение взрослых животных при столкновении с различными дополнительными воздействиями, как негативными стрессирующими, так и благоприятными. Можно ли ослабить последствия провоспалительного стресса путем содержания животных в особых условиях?
В экспериментах на животных широко используют такое стрессирующее воздействие, как социальная изоляция. Начатая в раннем подростковом возрасте, социальная изоляция увеличивает тревожное и депрессивно-подобное поведение взрослых животных [16–20]. Кроме того, социальная изоляция приводит к нарушению когнитивных способностей у животных. У изолянтов возникали трудности при обучении поиску скрытой платформы в водном лабиринте [21–23]. У изолянтов была нарушена выработка условнорефлекторного страха, проявляющегося в виде замирания [21, 24, 25], и выработка условного рефлекса пассивного избегания [22]. В качестве причины нарушения обучения рассматривается дефицит памяти [21, 23, 26–29].
С другой стороны, обогащение среды обитания путем добавления в клетку различных предметов для лазанья, игры, зарывания, физических упражнений оказывает положительное действие, уменьшает тревожное и депрессивно-подобное поведение [18, 30–32]. Обогащение среды приводило к более быстрому обучению мышей в пространственных задачах в водном лабиринте [21, 33]. Обогащение среды у самок мышей замедляло угашение условнорефлекторного страха в виде замирания на звук [33]. Обогащение среды могло не влиять на условнорефлекторное замирание при классическом оборонительном рефлексе и на рефлекс активного избегания [34] или, наоборот, усиливать замирание [25].
Можно было ожидать, что социальная изоляция и обогащение среды окажут разнонаправленное действие на оборонительное поведение животных. Предполагалось, что крысы группы ЛПС будут наиболее уязвимы к стрессирующему воздействию, а содержание в обогащенной среде будет способно компенсировать негативное влияние раннего провоспалительного стресса. Целью нашей работы было исследовать влияние социальной изоляции и обогащения среды на условнорефлекторный страх у крыс в норме и после раннего провоспалительного стресса. В задачу работы входила, во-первых, подготовка экспериментальных групп животных, которая включала введение бактериального липополисахарида (группа ЛПС, 50 мкг/кг), либо физиологического раствора (группа ФИЗ, контроль) крысятам на 3-й и 5-й день от рождения и содержание животных с 1.5 до 4 мес в различных условиях (социальная изоляция, обогащение среды, стандартные условия). Во-вторых, необходимо было сопоставить выработку, проявление и угашение условнорефлекторного страха на звук у взрослых животных при разных условий содержания в группах ФИЗ и ЛПС. В-третьих, необходимо было сопоставить влияние раннего провоспалительного стресса и разных условий содержания на самцов и самок.
МЕТОДЫ ИССЛЕДОВАНИЯ
Объект исследования. В опытах было использовано 143 крысы линии Вистар в возрасте от 3.5 до 4 мес (76 самцов и 67 самок). Крысята (15 пометов) были выведены в виварии Института высшей нервной деятельности и нейрофизиологии РАН от родителей, полученных из филиала “Столбовая” ФГБУН НЦБМТ ФМБА, Россия. Схема эксперимента представлена на рис. 1.
Рис. 1.
Схема эксперимента и разделение крыс на группы. PND – постнатальные дни. SAL/LPS – введение физиологического раствора или ЛПС. EE – содержание в обогащенной среде, ST – в стандартных условиях содержания, SI – в социальной изоляции. L – обучение, Т1 и T2 – тесты 1 и 2, E1, 2 – угашение 1 и 2.
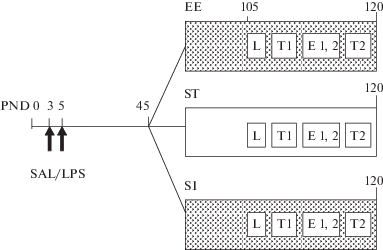
На 3-й и 5-й день от рождения у половины крысят из помета вызывали провоспалительный стресс путем введения ЛПС в дозе 50 мкг/кг в объеме 10 мкл/г (группа ЛПС, всего 65 крысят). Во время этой процедуры крысята отлучались от матери на 15–20 мин. Они взвешивались на электронных весах с точностью до 0.01 г и получали подкожную инъекцию ЛПС в холку с помощью инсулинового шприца. Крысята группы ЛПС дополнительно метились с помощью подкожного введения у основания хвоста 10 мкл черной краски, используемой для татуировок у людей. Другой группе крысят из помета в этом же возрасте подкожно вводили физиологический раствор в объеме 10 мкл/г (группа ФИЗ, контроль, всего 78 крысят). При разделении пометов старались уравнять число самцов и самок в группах ЛПС и ФИЗ. Разделение пометов делалось с целью ослабить влияние генетического фактора на результаты экспериментов. В возрасте 25 дней крысят отлучали от матери и формировали клетки таким образом, что в одной клетке содержались крысы одного пола из 2–3 пометов из одной группы (либо ЛПС, либо ФИЗ). В дальнейшем животных содержали в виварии при обычном 12-часовом световом режиме в свободном доступе к воде и стандартному корму. В экспериментах соблюдали принципы гуманности, изложенные в директивах Европейского Сообщества (2010/63/ЕU) и положения Института высшей нервной деятельности и нейрофизиологии РАН о работе с экспериментальными животными.
Создание различных условий содержания крыс. В возрасте 45 дней каждую группу крыс делили на три группы в зависимости от условий содержания, которые оставались неизменными до конца экспериментов (до 4 мес, рис. 1). Одна группа крыс содержалась в стандартных условиях по 3–5 животных в клетке (группа СТАНД). Вторая группа помещалась в обогащенную среду (группа ОС), которая создавалась в коробке размером 51 × 40.5 × × 30 см, где находились лесенки, беличье колесо, материал для зарывания, трубки. Параллельно с исследованием обогащенной среды крысы проходили хендлирование. В обогащенную среду крыс помещали на 20 мин через день. Третья группа крыс подвергалась социальной изоляции (группа СИ). При социальной изоляции крысы содержались поодиночке в клетках размером 30 × 30 × 17.5 см. Таким образом, в работе анализировали поведение 6 групп крыс: ФИЗ + СТАНД (46 крыс), ЛПС + + СТАНД (34 крысы), ФИЗ + ОС (18 крыс), ЛПС + + ОС (16 крыс), ФИЗ + СИ (14 крыс), ЛПС + СИ (15 крыс).
Выработка, тестирование и угашение классического условного оборонительного рефлекса (fear conditioning). Для выработки классического павловского условного оборонительного рефлекса использовали камеру Startle and Fear Combined System производства PanLab Harvard apparatus (Испания, 2000). Эксперименты начинали у крыс в возрасте 3.5 мес (рис. 1). При обучении после 120-секундного периода обследования камеры животным давали 3 сочетания звука (30 с, 80 дБ, 2000 Гц) и электрокожного болевого раздражения (2 с, 0.8 мА, задержка 28 с от начала действия звука) с 40–50-секундными межсигнальными интервалами, после чего следовал период последействия в 40 с. Затем через 24 ч после обучения проводили тестирование условнорефлекторного страха (тест 1), который оценивали по времени замирания. При тестировании животных помещали в тот же контекст на 120 с, после чего предъявляли звук в течение 120 с (80 дБ, 2000 Гц), далее следовал период последействия в 120 с. Далее в двух опытах проводили угашение условнорефлекторного страха, при этом давали по 10 изолированных звуковых стимулов (30 с, 80 дБ, 2000 Гц) без электрокожных раздражений с 20-секундными межсигнальными интервалами. После процедуры угашения тестировали сохранность рефлекса (тест 2).
Во всех опытах поведение крыс анализировали до (реакции на контекст), во время (на контекст и сигнальный раздражитель) и после действия звука (последействие). Замирание – периоды неподвижности длительностью не менее 2 с, когда можно наблюдать только дыхательные движения животного. Замирание определяли по записи механограммы пола камеры с помощью амплитудного и временного порогов. Амплитудный порог зависел от массы тела крысы, коэффициента усиления и выставлялся таким образом, чтобы отсечь интервалы с активным движением животного. Обработка проводилась с помощью стандартной программы, прилагающейся к установке фирмы Panlab. Программа позволяла детектировать эпизоды замирания, определять их длительность и рассчитывать процент времени замирания от времени регистрации. Кроме того, для оценки уровня эмоционального напряжения у крыс подсчитывали число дефекаций и уринаций.
Статистическая обработка данных. Для вторичной обработки результатов использовали стандартную программу STATISTICA 8.0. Распределение исследованных параметров было проверено на нормальность по критерию Колмогорова–Смирнова (Basic Statistics, раздел Descriptive Statistics). Если анализируемый параметр удовлетворял данному критерию, то при сравнении групп крыс использовали дисперсионный анализ ANOVA, раздел factorial ANOVA. При post-hoc анализе применяли критерий Newman–Keuls test. Различия считали статистически значимыми при р < 0.05, отмечали наличие тенденции при 0.05 < р <0.1. Во всех экспериментах анализировали влияние факторов ПОЛ, ГРУППА, УСЛОВИЯ СОДЕРЖАНИЯ, в некоторых случаях также анализировали влияние фактора ИНТЕРВАЛ ВРЕМЕНИ. При отсутствии нормальности распределения поведенческих параметров использовали Kruskal–Wallis test, с последующим сравнением групп с помощью Multiple Comparisons (Nonparametric Statistics), а также Mann Whitney U test. Данные на рисунках представлены в виде средних значений ± ошибки средних.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Рис. 2.
Влияние различных условий содержания крыс на выработку условнорефлекторного страха. ST – группа крыс со стандартными условиями содержания, EE – группа крыс с обогащением среды, SI – группа крыс с социальной изоляцией. SAL – группа с введением физиологического раствора в раннем онтогенезе, LPS – группа с введением ЛПС. По оси абсцисс на (a) и (b) –интервалы времени (Before – до начала сочетаний, S1, S2, S3 – во время 1-го, 2-го, 3-го звука, ISI1, ISI2 – 1-й и 2-й межсигнальный интервал, After – после сочетаний), на (c) – группы крыс. По оси ординат – на (a) и (b) – процент времени замирания, на (c) – число уринаций. n – число крыс в группе. * – статистически значимые отличия в группе крыс, содержащейся в измененных условиях, по сравнению с группой в стандартных условиях (р < 0.05, на (a) и (b) – post hoc анализ, Factorial ANOVA, на (c) –Kruskal–Wallis test, Multiple comparison). + – различие между крысами, содержащимися в ОС и СИ.
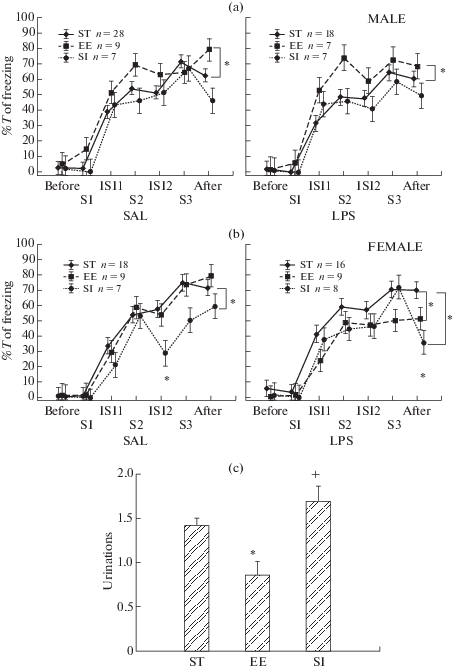
Влияние различных условий содержания на выработку условнорефлекторного страха. Анализ с помощью Factorial ANOVA динамики обучения крыс выявил влияние факторов ИНТЕРВАЛ ВРЕМЕНИ (F6.914 = 171.6, p = 0.000), УСЛОВИЯ СОДЕРЖАНИЯ (F2.914 = 171.6, p = 0.000), ПОЛ (F1.914 = 4.3, p = 0.038), а также взаимодействие факторов УСЛОВИЯ СОДЕРЖАНИЯ × ПОЛ (F2.914 = 11.0, p = 0.000). Учитывая наличие такого взаимодействия, в дальнейшем рассматривали отдельно влияние условий содержание на крыс разного пола. Post hoc анализ показал (рис. 2a), что у самцов обогащение среды приводило в целом к большему (р < < 0.05) времени замирания как в группе ФИЗ + ОС, так и ЛПС + ОС по сравнению с группами ФИЗ + + СТАНД и ЛПС + СТАНД соответственно. Наибольшие различия наблюдались после ОС при действии 2-го звука, т.е. крысы группы ФИЗ + ОС и ЛПС + ОС быстрее обучились и замирали больше уже после первого сочетания звука с болевым раздражением. Социальная изоляция не оказывала влияния на время замирания у самцов. У самок, наоборот, социальная изоляция приводила к уменьшению в целом времени замирания в группах ФИЗ + СИ и ЛПС + + СИ по сравнению с группами ФИЗ + СТАНД и ЛПС + СТАНД соответственно. Статистически значимые различия наблюдались только в отдельных интервалах времени (рис. 2b). Кроме того, у самок группы ЛПС обогащение среды оказывало такое же влияние, как социальная изоляция, вызывая уменьшение времени замирания в группе ЛПС + ОС по сравнению с группой ЛПС + СТАНД. Обогащение среды приводило к снижению числа уринаций по сравнению со стандартными условиями содержания (рис. 2c) (Kruskal–Wallis test Н (2, n = 170) = 14.79, p = 0.001, Multiple Comparisons, p = = 0.008) и по сравнению с социальной изоляцией (Multiple Comparisons, p = 0.002).
Таким образом, социальная изоляция затрудняла обучение у самок, а обогащение среды, наоборот, ускоряло обучение у самцов.
Влияние различных условий содержания на проявление условнорефлекторного страха в тесте 1. На процент времени замирания в тесте 1 оказывали влияние факторы ИНТЕРВАЛ ВРЕМЕНИ (F2.393 = = 97.29, p = 0.000), УСЛОВИЯ СОДЕРЖАНИЯ (F2.393 = 5.46, p = 0.000), ГРУППА (F1.393 = 3.96, p = = 0.047), ПОЛ (F1.393 = 4.01, p = 0.046), также наблюдалось взаимодействие факторов УСЛОВИЯ СОДЕРЖАНИЯ × ГРУППА × ПОЛ (F2.393 = 3.11, p = = 0.046). Post hoc анализ в целом по всему тесту показал (рис. 3a), что в группах как ФИЗ, так и ОС или СИ приводила к уменьшению времени замирания по сравнению с животными в стандартных условиях, причем после социальной изоляции снижение было более выраженным у самцов в группах ФИЗ и ЛПС, а также у самок в группе ЛПС. Подробный анализ по интервалам времени (рис. 3b, c), показал, что ОС по сравнению со стандартными условиями приводила к статистически значимому снижению времени замирания только в интервале до (самцы группы ЛПС) или после действия звука (самки группы ФИЗ), т.е. при исследовании контекста. СИ у групп ЛПС вызывала существенные изменения, происходило снижение времени замирания как при действии звука, так и в интервалах до и после действия (рис. 3b, c). СИ у групп ФИЗ вызывала меньшие изменения, в основном в интервале после действия звука.
Рис. 3.
Влияние различных условий содержания крыс на проявление условнорефлекторного страха в тесте 1. (a) – суммарные данные по времени замирания по всему тесту, (b) и (c) – по различным интервалам времени в тесте, (d) – число уринаций за опыт, E – число дефекаций. ST – группа крыс в стандартных условиях содержания, EE – группа крыс с обогащением среды, SI – группа крыс с социальной изоляцией. По оси абсцисс на (b) и (c) – различные интервалы времени, Before – до действия звука, Sound – во время, After – после звука. По оси ординат на (a–c) – процент времени замирания, Т – время. * – статистически значимые различия в ЕЕ или SI группе по сравнению с ST группой (р < 0.05, на (a–c) – post hoc анализ, Factorial ANOVA, на (d) – Kruskal–Wallis test, Multiple comparison), + – различие между крысами, содержащимися в EE и SI.
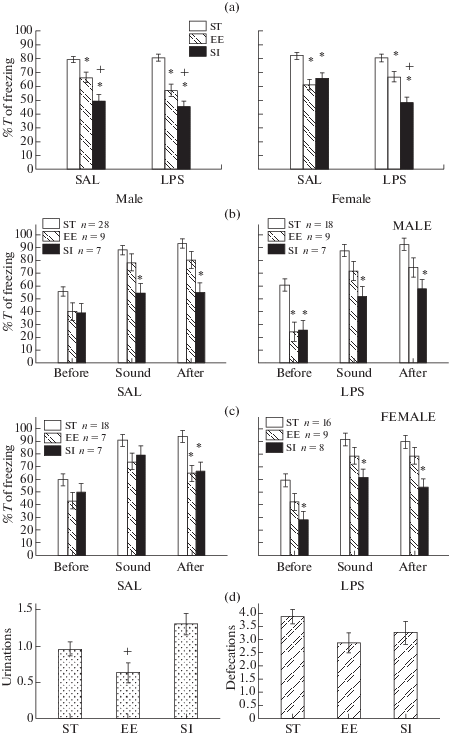
Изменение условий содержания не влияло на число дефекаций (рис. 3e, Kruskal–Wallis test Н (2, n = 170) = 2.96, p = 0.227). Число уринаций увеличивалось у крыс после СИ по сравнению с ОС (рис. 3d, Kruskal–Wallis test Н (2, n = 170) = 12.09, p = 0.002, Multiple Comparisons, p = 0.004) и по сравнению со стандартными условиями (на уровне тенденции, Multiple Comparisons, p = 0.065). Это свидетельствовало о том, что СИ увеличивала вегетативную реактивность.
Таким образом, тест 1 показал, что после СИ крысы хуже выработали условнорефлекторный страх, проявляющийся в виде замирания. Наибольшую чувствительность к СИ показали крысы с ранним провоспалительным стрессом, у которых уменьшилось проявление страха как на сигнал, так и на контекст. ОС также уменьшало проявление страха в виде замирания, но в меньшей степени, чем СИ, при этом уменьшался страх только на контекст.
Влияние различных условий содержания на угашение условнорефлекторного страха. После двух сеансов угашения был проведен тест 2, результаты которого представлены на рис. 4а. На процент времени замирания в тесте 2 оказывали влияние факторы ИНТЕРВАЛ ВРЕМЕНИ (F2.39 = 19.25, p = = 0.000), УСЛОВИЯ СОДЕРЖАНИЯ (F2.393 = 26.94, p = 0.000), ПОЛ (F1.393 = 21.26, p = 0.000), наблюдалось взаимодействие факторов УСЛОВИЯ СОДЕРЖАНИЯ × ПОЛ (F2.393 = 4.92, p = 0.008). Post hoc анализ показал (рис. 4а), что в целом по тесту как в группе ФИЗ, так и в группе ЛПС самцы замирали значительно меньше после обогащения среды и социальной изоляции, чем самцы, содержащиеся в стандартных условиях. У самок в стандартных условиях угашение было более эффективным, чем у самцов, что согласуется с данными, полученными ранее [12]. Обогащение среды и социальная изоляция у самок вызывали уменьшение времени замирания в тесте 2 по сравнению с животными в нормальных условиях, но менее выраженное, чем у самцов.
Рис. 4.
Влияние различных условий содержания крыс на угашение условнорефлекторного страха. По оси абсцисс на a и b – группы крыс (SAL – группа с введением физиологического раствора в раннем онтогенезе, LPS –группа с введением ЛПС), на c и d – интервалы времени (Before – до действия звука, Sound – во время, After – после действия звука). По оси ординат – на a – % времени замирания в тесте 2, Т – время, на b–d – (Т замирания в тесте 2)/(Т замирания в тесте 1) × 100%. * – статистически значимые отличия по сравнению с ST группой (р < 0.05, post hoc анализ, Factorial ANOVA). $ – различие между самцами и самками в аналогичных группах.
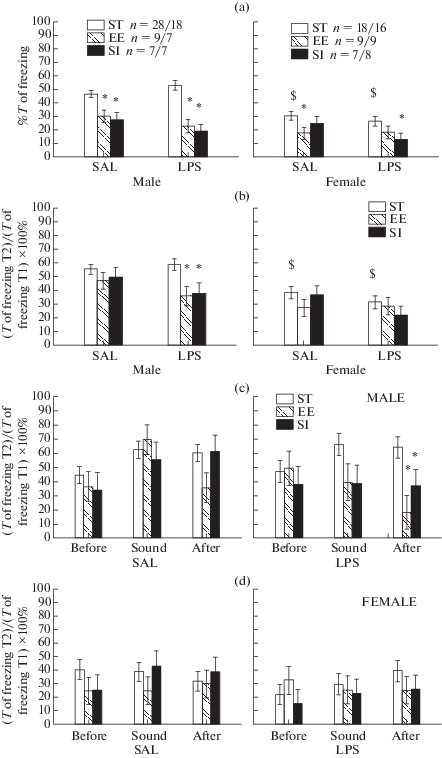
Таким образом, у крыс после социальной изоляции и обогащения среды условнорефлекторный страх угашался быстрее, чем у животных, содержащихся в стандартных условиях. Возникает вопрос, более быстрое угашение связано с тем, что замирание у этих крыс было изначально меньше по времени (данные по тесту 1), или социальная изоляция и обогащение среды влияли на сам процесс угашения? Для ответа на этот вопрос для каждой группы крыс сравнивали соотношение времени замирания в тесте 2 и тесте 1 по формуле (Т замирания в тесте 2)/(Т замирания в тесте 1) × 100%, результаты такого анализа представлены на рис. 3b–d. На такое соотношение времени замирания в разных тестах (рис. 4b) оказывали влияние фактор УСЛОВИЯ СОДЕРЖАНИЯ (F2.393 = 7.93, p = 0.000), ГРУППА (F1.393 = 4.92, p = 0.027) и ПОЛ (F2.393 = 37.34, p = = 0.000).
Post hoc анализ показал, что у самок угашение рефлекса проходило быстрее, чем у самцов в стандартных условиях содержания. В группе ФИЗ у самцов и самок, а также в группе ЛПС у самок обогащение среды и социальная изоляция не оказывали влияние на угашение рефлекса по сравнению со стандартными условиями содержания (рис. 4b). У самцов в группе ЛПС угашение проходило быстрее после обогащения среды и социальной изоляции по сравнению со стандартными условиями содержания. Подробный анализ по интервалам (рис. 4c, d) показал, что самцы группы ЛПС быстрее угашают страх при измененных условиях содержания на контекст после действия звука, в ответ на звуковой сигнал угашение ускорялось незначительно (на уровне тенденции). Таким образом, у самцов группы ЛПС содержание в ОС или СИ способствовало более быстрому угашению условнорефлекторного страха на контекст.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В нашей работе было показано существенное уменьшение уровня замирания в тесте 1 у крыс после социальной изоляции по сравнению с животными, содержащимися в стандартных условиях. Причем время замирания могло уменьшаться как на контекст, так и на звуковой сигнал. В литературе также имеются сведения о том, что социальная изоляция приводит к нарушению когнитивных способностей у животных. У изолянтов была нарушена выработка условнорефлекторного страха, в тесте через 24 ч после обучения животные меньше замирали только на контекст [25, 35, 36], на контекст и сигнал [21, 24, 27, 28], или только на сигнал [26]. В то же время у мышей после 2-недельной социальной изоляции показано увеличение замирания в последействии звука при тестировании условнорефлекторного страха на звук и увеличении реактивности на ток [37]. У изолянтов нарушалась выработка условного рефлекса пассивного избегания [22], все крысы заходили в опасный отсек на следующий день после выработки. У изолянтов возникали трудности при обучении поиску скрытой платформы в водном лабиринте Морриса [21–23, 38].
Закономерно возникает вопрос о причинах такого нарушения обучения. В наших экспериментах при обучении в первый день время замирания у самцов не отличалось в группах СИ и СТАНД, это говорит о том, что животные после СИ были способны реагировать замиранием на болевые стимулы. В литературе есть данные о появлении гиперлокомоции у крыс после СИ [39]. Однако проведенные ранее нами тестирования этих же крыс в открытом поле и приподнятом крестообразном лабиринте не выявили увеличения двигательной активности после СИ, в отдельных группах наблюдалось даже ее снижение [20]. Уменьшение времени замирания в тесте 1, по-видимому, не может быть связано с увеличением двигательной активности крыс. Известно, что разные условия содержания не влияли на болевую чувствительность мышей в тесте на горячей пластинке [21, 24], это свидетельствует о том, что нарушения обучения не были связаны с изменениями болевой чувствительности и уменьшением силы подкрепления. Наиболее вероятной причиной нарушения замирания в тесте 1 является дефицит памяти, и в литературе есть подтверждение данному предположению. В большинстве работ показано, что после СИ страдает долговременная, а не кратковременная память. Так, например, после СИ нарушалась долговременная память в тесте после выработки условнорефлекторного страха [27], в то время как кратковременная рабочая память не страдала в Y-образном лабиринте и в тесте при распознавании новых объектов. Крысы после стресса социальной нестабильности, в котором животные подвергались социальной изоляции и смене партнера по клетке, показали дефицит долговременной памяти, но не кратковременной при обучении в бассейне Морриса и в тесте на пространственное расположение объектов [40]. Считают, что после СИ возникает нарушение процессов консолидации памяти, а не ее приобретения в модели выработки условнорефлекторного страха. В специальных опытах было показано нарушение под влиянием социальной изоляции консолидации памяти о страхе, при этом у животных нарушалась память через 24 ч или 4 дня после обучения, но оставалась неизменной через 90 мин и 4 ч после выработки рефлекса [28]. Относительно механизмов нарушения консолидации памяти у изолянтов имеются отдельные сведения. У изолянтов был понижен уровень экспрессии гена Egr-1 (“ответ раннего роста”), но не Egr-2 в цитозольных фракциях гиппокампа и коры по сравнению с контрольными животными [28]. У изолянтов по сравнению с контролем был понижен уровень фосфорилирования сигнальных белков в гиппокампе, связанных с синаптической пластичностью, субъединицы NR1 NMDA-рецептора, кальмодулин-зависимой киназы II. Считают, что дисфункция Egr-1 и нейросигнальной системы приводит к дефициту консолидации памяти о страхе. Имеются данные об уменьшении после СИ экспрессии субъединиц NMDA- и AMPA-рецепторов, включенных в синаптическую пластичность [19]. Длительная СИ также вызывала ослабление длительной посттетанической потенциации нейронов поля СА1 гиппокампа [41]. При этом в гиппокампе уменьшалась экспрессия протеина PSD-95 (postsynaptic density protein-95) и глутаматных рецепторов (GluA1, NR1 и NR2B) без изменений высвобождения внеклеточного глутамата и экспрессии NR2A- и GABAA-рецепторов. Это свидетельствует о том, что СИ в раннем возрасте нарушает постсинаптические функции и изменяет взаимодействие между AMPA- и NMDA-рецепторами, что оказывает влияние на память и обучение [41]. В механизмах возникновения поведенческих изменений после длительной социальной изоляции большую роль играет также увеличенная экспрессия нейропептида тахикинина 2 (Tac2) и нейрокинина В (NkB), которая была обнаружена в дорзомедиальном гипоталамусе, центральном ядре миндалины, dBNST, дорзальном гиппокампе и передней цингулярной коре [37]. Системное или локальное введение в структуры мозга антагониста рецепторов нейрокинина (осанетанта) предотвращало поведенческие эффекты от социальной изоляции.
Обогащение среды приводило на стадии обучения к увеличению времени замирания у самцов по сравнению с животными, содержащимися в стандартных условиях. Наибольшие различия наблюдались уже при действии второго звукового сигнала, что можно объяснить более быстрым обучением крыс после обогащения среды. Подтверждают это предположение данные литературы об улучшении памяти и ускорении обучения после обогащения среды. Так, например, обогащение среды длительностью 3 нед улучшало память как об аверсивных стимулах при выработке рефлекса пассивного избегания, так и о нейтральных объектах в тесте распознавания объектов [42]. Обогащение среды ускоряло выработку рефлекса активного избегания за счет увеличения числа реакций избегания и уменьшения реакций избавления [34]. Обогащение среды приводило к более быстрому обучению мышей в пространственных задачах в водном лабиринте Морриса [21, 33].
В тесте 1 через 24 ч крысы, содержащиеся в обогащенной среде, по сравнению с животными в стандартных условиях меньше времени замирали в ответ на контекст, но не на стимул. В литературе имеются противоречивые данные о влиянии обогащенной среды на проявление условнорефлекторного страха. С одной стороны, обогащение среды усиливало замирание на контекст в тесте при классическом оборонительном рефлексе [25], с другой стороны, обогащение среды приводило к уменьшению ответа на условные стимулы, ассоциируемые с болевым раздражением, что приводило к уменьшению способности дифференцировать сигнал и контекст [43]. Проведенное нами ранее тестирование крыс в открытом поле показало, что обогащение среды вызывало некоторое усиление двигательной активности и исследовательского поведения [20]. В литературе имеются сведения о снижении уровня тревожности после обогащения среды [18, 30–32]. Кроме того, показано наличие положительных корреляционных связей между уровнем тревожности крыс и замиранием на контекст при выработке условнорефлекторного страха [44]. Можно предположить, что снижение уровня замирания в ответ на контекст после обогащения среды может быть связано с увеличением двигательной активности и уменьшением тревожности.
Проведенный специальный анализ процентного соотношения времени замирания в тесте 2 после угашения и в тесте 1 после выработки рефлекса показал, что содержание в условиях изоляции или в обогащенной среде ускорило угашение рефлекса только в группе ЛПС у самцов, во всех других группах крыс содержание в измененных условиях не сказалось на скорости угашения. Ранее у самцов группы ЛПС, содержащихся в стандартных условиях, условнорефлекторный страх угашался хуже, чем в группе ФИЗ [12]. Имеющиеся немногочисленные данные по влиянию разных условий содержания на угашение страха отличаются от полученных нами результатов. Социальная изоляция могла тормозить угашение условнорефлекторного страха на звук [23] и нарушать снижение амплитуды стартл-рефлекса после угашения страха [45]. Длительный комбинированный стресс (ограничение движения, вынужденное плавание, социальная изоляция) приводил к нарушениям угашения условнорефлекторного страха у крыс [46]. Обогащение среды у самок мышей также замедляло угашение условнорефлекторного страха на звук в виде замирания [33]. Возможно, полученные нами данные связаны с нарушениями памяти у самцов группы ЛПС под влиянием измененных условий содержания.
Необходимо отметить, что у животных группы ЛПС наблюдались наибольшие изменения в оборонительном поведении при содержании в социальной изоляции, это касалось результатов тестирования самцов и самок в тесте 1 и только самцов в тесте 2. Ранее нами было показано, что содержание в социальной изоляции оказывало наибольшее влияние на тревожно-депрессивное поведение крыс группы ЛПС [20]. В литературе представлено немного работ, в которых бы создавался двойной стресс – провоспалительный и социальной изоляции. Например, в работе [2], как и в наших опытах, крысы линии Вистар получали на 3-й и 5-й дни жизни инъекции ЛПС (50 мкг/кг) или физиологического раствора. В возрасте 85 дней часть животных получала в течение трех дней ограничительный стресс (30 мин) и СИ. Крысы группы ЛПС, получавшие в зрелом возрасте комбинированный стресс, проявляли тревожное поведение в большей степени, чем контрольные животные, что авторы рассматривают как подтверждение гипотезы “двойного удара”. Это происходило, на наш взгляд, потому, что провоспалительный ЛПС-стресс в раннем возрасте вызывает сенситизацию гипоталамо-гипофизарно-надпочечниковой и иммунной систем, из-за чего реакция на второй стресс оказывается более сильной, чем в случае одиночного стресса [2, 12]. СИ сама по себе способна приводить к увеличению провоспалительных цитокинов в крови [47]. В двух других работах введение ЛПС использовали в качестве второго стресса в комбинации с СИ, которая служила первым стрессом [48, 49]. При этом СИ длительностью в 2–4 нед усиливала эффекты “болезненного состояния”, вызываемого интоксикацией ЛПС или введением poly I:C, а также увеличивала уровни кортикостерона и провоспалительных цитокинов IL-6, IL-1бета, фактора некроза опухоли альфа, т.е. также наблюдалась синергия двух эффектов.
ВЫВОДЫ
1. Тестирование через 24 ч после выработки классического оборонительного условного рефлекса показало, что после социальной изоляции у самцов и самок ухудшилась выработка условнорефлекторного страха, проявляющегося в виде замирания. Наибольшую чувствительность к социальной изоляции показали крысы с ранним провоспалительным стрессом, у которых уменьшилось проявление страха как на сигнал, так и контекст.
2. Обогащение среды уменьшало проявление страха в виде замирания, но в меньшей степени, чем социальная изоляция, при этом уменьшался страх только на контекст.
3. Угашение страха у самцов группы ЛПС ускорялось после социальной изоляции и обогащения среды по сравнению с животными этой группы, содержащимися в стандартных условиях.
4. После раннего провоспалительного стресса взрослые животные были более уязвимы к изменениям условий содержания.
Список литературы
Maynard T.M., Sikich L., Lieberman J.A., Lamantia S. (2001) Neural development, cell–cell signaling, and the ‘‘Two-Hit’’ hypothesis of schizophrenia. Schizophr Bull 27: 457–476. https://doi.org/10.1093/oxfordjournals.schbul.a006887
Walker A.K.[REMOVED HYPERLINK FIELD], Nakamura T., Byrne R.J., Sundresan Naicker, Tynan R.J., Hunter M., Hodgson D.M. (2009) Neonatal lipopolysaccharide and adult stress exposure predisposes rats to anxiety-like behaviour and blunted corticosterone responses: implications for the double-hit hypothesis. Psychoneuroendocrinology 34: 1515–1525. https://doi.org/10.1016/j.psyneuen.2009.05.010
Lahiri D.K., Maloney B., Zawia N.H. (2009) The LEARn model: an epigenetic explanation for idiopathic neurobiological diseases. Mol Psychiatry 14: 992–1003. https://doi.org/10.1038/mp.2009.82
Custódio C.S., Mello B.S.F., Filho A.J.M.C., de Carvalho Lima C.N., Cordeiro R.C., Miyajima F., Réus G.Z., Vasconcelos S.M.M., Barichello T., Quevedo J., de Oliveira A.C., de Lucena D.F., Macedo D.S. (2018) Neonatal immune challenge with lipopolysaccharide triggers long-lasting sex- and age related behavioral and immune/neurotrophic alterations in mice: relevance to autism spectrum disorders. Mol Neurobiol 55: 3775–3788. https://doi.org/10.1007/s12035-017-0616-1
Григорьян Г.А., Дыгало Н.Н., Гехт А.Б., Степаничев М.Ю., Гуляева Н.В. (2014) Молекулярно-клеточные механизмы депрессии. Роль глюкокортикоидов, цитокинов и нейротрофических факторов в генезе депрессивных расстройств. Успехи физиол наук 44: 3–20. [Grigoryan G.A., Dygalo N.N., Geht A.B., Stepani-chev M.Yu., Gulyaeva N.V. (2014) Molecularcellular mechanisms of depression. The role of glucocorticoids, cytokines, and neurotrophic factors in the genesis of depressive disorders. Success fiziol sci 44: 3–20. (In Russ)].
Parker G.1., Brotchie H. (2010) Gender differences in depression. Int Rev Psychiatry 22: 429–36. https://doi.org/10.3109/09540261.2010.492391
Alexander C., Rietschel E.T. (2001) Bacterial lipopolysaccharides and innate immunity. J Endotoxin Res 7: 167–202. PMID: 11581570
Bilbo S.D., Rudy J.W., Watkins L.R., Maier S.F. (2006) A behavioural characterization of neonatal infection-facilitated memory impairment in adult rats. Behav Brain Res 169: 39–47. https://doi.org/10.1016/j.bbr.2005.12.002
Tchessalova D., Tronson N.C. (2019) Memory deficits in males and females long after subchronic immune challenge. Neurobiol Learn Mem 158: 60–72. https://doi.org/10.1016/j.nlm.2019.01.003
Osborne B.F., Caulfield J.I., Solomotis S.A., Schwarz J.M. (2017) Neonatal infection produces significant changes in immune function with no associated learning deficits in juvenile rats. Dev Neurobiol 77: 1221–1236. https://doi.org/10.1002/dneu.22512
Tishkina A., Stepanichev M., Kudryashova I., Freiman S., Onufriev M., Lazareva N., Gulyaeva N. (2016) Neonatal proinflammatory challenge in male Wistar rats: Effects on behavior, synaptic plasticity, and adrenocortical stress response. Behav Brain Res 304: 1–10. https://doi.org/10.1016/j.bbr.2016.02.001
Брошевицкая Н.Д., Павлова И.В., Зайченко М.И., Онуфриев М.В., Моисеева Ю.В., Григорьян Г.А. (2020) Половые различия в оборонительном поведении взрослых крыс в ответ на ранний нейровоспалительный стресс. Журн высш нерв деят 70: 261–278. [Broshevitskaya N.D., Pavlova I.V., Zaichenko M.I., Onufriev M.V., Moiseeva Yu.V., Grigoryan G.A. (2020) The Sex Differences in Defensive Behavior of Adult Rats in Response to Early Neuroinflammatory Stress. Zh Vyssh Nerv Deiat 70: 261–278. (In Russ)]. https://doi.org/10.31857/S0044467720020057
Doenni V.M., Song C.M., Hill M.N., Pittman Q.J. (2017) Early-life inflammation with LPS delays fear extinction in adult rodents. Brain Behav Immun 63: 176–185. https://doi.org/10.1016/j.bbi.2016.11.022
Harre E.M., Galic M.A., Mouihate A., Noorbakhsh F., Pittman Q.J. (2008) Neonatal inflammation produces selective behavioral deficits and alters N-metyl-D-aspartate receptor subunit mRNA in the adult rat brain. Eur J Neurosci 27: 644–653. https://doi.org/10.1111/j.1460-9568.2008.06031.x
Kohman R.A., Tarr A.J., Sparkman N.L., Bogale T.M., Boehm G.W. (2008) Neonatal endotoxin exposure impairs avoidance learning and attenuates endotoxin-induced sickness behavior and central IL-1beta gene transcription in adulthood. Behav Brain Res 194: 25–31. https://doi.org/10.1016/j.bbr.2008.06.018
Lukkes J.L., Watt M.J., Lowry C.A., Forster G.L. (2009) Consequences of post-weaning social isolation on anxiety behavior and related neural circuits in rodents. Front Behav Neurosci 3: 18. https://doi.org/10.3389/neuro.08.018.2009
Zhang Y., Zu X., Luo W., Yang H., Luo G., Zhang M. (2012) Social isolation produces anxiety-like behaviors and changes PSD-95 levels in the forebrain. Neurosci Lett 514: 27–30. https://doi.org/10.1016/j.neulet.2012.02.043
Guarnieri L.O., Pereira-Caxeta A.R., Medeiros D.C., Aquino N.S.S., Szawka R.E., Mendes E.M.A., Moraes M.F.D., Pereira G.S. (2020) Pro-neurogenic effect of fluoxetine in the olfactory bulb is concomitant to improvements in social memory and depressive-like behavior of socially isolated mice. Transl Psychiatry 10: 33. https://doi.org/10.1038/s41398-020-0701-5
Wang H.T., Huang F.L., Hu Z.L., Zhang W.J., Qiao X.Q., Huang Y.Q., Dai R.P., Li F., Li C.Q. (2017) Early-life social isolation-induced depressive-like behavior in rats results in microglial activation and neuronal histone methylation that are mitigated by minocycline. Neurotox Res 31: 505–520. https://doi.org/10.1007/s12640-016-9696-3
Павлова И.В., Брошевицкая Н.Д., Зайченко М.И., Григорьян Г.А. (2021) Влияние социальной изоляции и обогащенной среды на тревожно-депрессивное поведение крыс в норме и после раннего провоспалительного стресса. Журн высш нерв деят 71 (5): 655–667. [Pavlova I.V., Broshevitskaya N.D., Zaichenko M.I., Grigoryan G.A. (2021) The Influence of Social Isolation and Enriched Environment on Anxious and Depressive-like Behavior of Rats in Norm and After the Early Proinflammatory Stress. Zh Vyssh Nerv Deiat 71 (5): 655–667. (In Russ)].
Kulesskaya N., Rauvala H., Voikar V. (2011) Evaluation of social and physical enrichment in modulation of behavioural phenotype in C57BL/6J female mice. PLoS One 6: e24755. https://doi.org/10.1371/journal.pone.0024755
Krupina N.A., Shirenova S.D., Khlebnikova N.N. (2020) Prolonged social isolation, started early in life, impairs cognitive abilities in rats depending on sex. Brain Sci 10: 799. https://doi.org/10.3390/brainsci10110799
Hori M., Yamada K., Ohnishi J., Sakamoto S., Furuie H., Murakami K., Ichitani Y. (2014) Tickling during adolescence alters fear-related and cognitive behaviors in rats after prolonged isolation. Physiol Behav 131: 62–67. https://doi.org/10.1016/j.physbeh.2014.04.008
Võikar V., Polus A., Vasar E., Rauvala H. (2005) Long-term individual housing in C57BL/6J and DBA/2 mice: assessment of behavioral consequences. Genes Brain Behav 4: 240–252. https://doi.org/10.1111/j.1601-183X.2004.00106.x
Mora-Gallegos A., Fornaguera J. (2019) The effects of environmental enrichment and social isolation and their reversion on anxiety and fear conditioning. Behav Processes 158: 59–69. https://doi.org/10.1016/j.beproc.2018.10.022
Badowska D.M., Brzozka M.M., Chowdhury A., Malzahn D., Rossner M.J. (2015) Data calibration and reduction allows to visualize behavioural profiles of psychosocial influences in mice towards clinical domains. Eur Arch Psychiatry Clin Neurosci 165: 483–496. https://doi.org/10.1007/s00406-014-0532-6
Ouchi H., Ono K., Murakami Y., Matsumoto K. (2013) Social isolation induces deficit of latent learning performance in mice: a putative animal model of attention deficit/hyperactivity disorder. Behav Brain Res 238: 146–153. https://doi.org/10.1016/j.bbr.2012.10.029
Okada R., Marsumoto K., Tsushima R., Fujiwara H., Tsuneyama K. (2014) Social isolation stress-induced fear memory deficit is mediated by down-regulated neuro-signaling system and Egr-1 expression in the brain. Neurochem Res 39: 875–882. https://doi.org/10.1007/s11064-014-1283-5
Matsumoto K., Fujiwara H., Araki R., Yabe T. (2019) Post-weaning social isolation of mice: a putative animal model of developmental disorders. J Pharmacol Sci 141: 111–118. https://doi.org/10.1016/j.jphs.2019.10.002
Mileva G.R., Bielajew C. (2015) Environmental manipulation affects depressive-like behaviours in female Wistar-Kyoto rats. Behav Brain Res 293: 208–216. https://doi.org/10.1016/j.bbr.2015.07.035
Grippo A.J., Ihm E., Wardwell J., McNeal N., Scotti M.A., Moenk D.A., Chandler D.L., LaRocca M.A., Preihs K (2014) The effects of environmental enrichment on depressive and anxiety-relevant behaviors in socially isolated prairie voles. Psychosom Med 76: 277–284. https://doi.org/10.1097/PSY.0000000000000052
Brenes J.C., Fornaguera J., Sequeira-Cordero A. (2020) Environmental enrichment and physical exercise attenuate the depressive-like effects induced by social isolation stress in rats. Front Pharmacol 11: 804. https://doi.org/10.3389/fphar.2020.00804
Pietropaolo S., Feldon J., Alleca E., Cirulli F., Yee BK (2006) The role of voluntary exercise in enriched rearing: a behavioral analysis. Behav Neurosci 4: 787–803. https://doi.org/10.1037/0735-7044.120.4.787
Pietropaolo S., Feldon J., Yee B.K. (2014) Environmental enrichment eliminates the anxiety phenotypes in a triple transgenic mouse model of Alzheimer’s disease. Cogn Affect Behav Neurosci 14: 996–1008. https://doi.org/10.3758/s13415-014-0253-3
Weiss I.C., Pryce C.R., Jongen-Relo A.L., Nanz-Bahr N.I., Feldon J. (2004) Effect of social isolation on stress-related behavioural and neuroendocrine state in the rat. Behav Brain Res 152: 279–295. https://doi.org/10.1016/j.bbr.2003.10.015
Hsiao Y.H., Kuo J.R., Chen S.H., Gean P.W. (2012) Amelioration of social isolation-triggered onset of early Alzheimer’s desease-related cognitive deficit by N-acetylcysteine in a transgenic mouse model. Neurobiol Dis 45: 1111–1120. https://doi.org/10.1016/j.nbd.2011.12.031
Zelikowsky M., Hui M., Karigo T., Gradinaru V., Deverman B.E., Anderson D.J. (2018) The neuropeptide Tac2 controls a distributed brain state induced by chronic social isolation stress. Cell 173: 1265–1279. https://doi.org/10.1016/j.cell.2018.03.037
Hellemans K.G., Benge L.C., Olmstead M.C. (2004) Adolescent enrichment partially reverses the social isolation syndrome. Dev Brain Res 150: 103–15. https://doi.org/10.1016/j.devbrainres.2004.03.003
Heidbreder C.A., Weiss I.C., Domeney A.M., Pryce C., Homberg J., Hedou G., Feldon J., Moran M.C., Nelson P. (2000) Behavioral, neurochemical and endocrinological characterization of the early social isolation syndrome. Neuroscience 100: 749–68. https://doi.org/10.1016/s0306-4522(00)00336-5
Green M.R., McCormick C.M. (2013) Effects of social instability stress in adolescence on Long-Term, Not short-term, spatial memory performance. Behav Brain Res 256: 165–171. https://doi.org/10.1016/j.bbr.2013.08.011
Wang B., Wu Q., Lei L., Sun H., Michael N., Zhang X., Wang Y., Zhang Y., Ge B., Wu X., Wang Y., Xin Y., Zhao J., Li S. (2019) Long-term social isolation inhibits autophagy activation, induces postsynaptic dysfunctions and impairs spatial memory. Exp Neurol 311: 213–224. https://doi.org/10.1016/j.expneurol.2018.09.009
Leger M., Paizanis E., Dzahini K., Quiedeville A., Bouet V., Cassel J.C., Freret T., Schumann-Bard P., Boulouard M. (2015) Environmental enrichment duration differentially affects behavior and neuroplasticity in adult mice. Cereb Cortex 25: 4048–4061. https://doi.org/10.1093/cercor/bhu119
Walasek G., Wesierska M., Werka T. (2002) Effects of social rearing conditions on conditioned suppression in rats. Acta Neurobiol Exp (Wars) 62: 25–31. PMID: 12004570
Павлова И.В., Рысакова М.П. (2015) Проявление тревожности крыс Вистар при выработке условнорефлекторного страха. Журн высш нерв деят 65: 719–735. [Pavlova I.V., Rysakova M.P. (2015) The manifestation of the anxiety during fear conditioning in Wistar rats. Zh Vyssh Nerv Deiat 65: 720–734. (In Russ)]. https://doi.org/10.7868/S0044467715050123
Skelly M.J., Chapell A.E., Carter E., Weiner J.L. (2015) Adolescent social isolation increases anxiety-like behavior and ethanol intake and impairs fear extinction in adulthood: possible role of disrupted noradrenergic signaling. Neuropharmacology 97: 149–159. https://doi.org/10.1016/j.neuropharm.2015.05.025
Noble L.J., Gonzalez I.J., Meruva V.B., Callahan K.A., Belfort B.D., Ramanathan K.R., Meyers E., Kilgard M.P., Rennaker R.L., McIntyre C.K. (2017) Effects of vagus nerve stimulation on extinction of conditioned fear and post-traumatic stress disorder symptoms in rats. Transl Psychiatry 7: e1217. https://doi.org/10.1038/tp.2017.191
Alshammari T.K., Alghamdi H., Alkhader L.F., Alqahtani Q., Alrasheed N.M., Yacoub H., Alnaem N., AlNakiyah M., Alshammari M.A. (2020) Analysis of the molecular and behavioral effects of acute social isolation on rats. Behav Brain Res 377: 112191. https://doi.org/10.1016/j.bbr.2019.112191
Gibb J., Hayley S., Gandhi R., Poulter M.O., Anisman H. (2008) Synergistic and additive actions of a psychosocial stressor and endotoxin challenge: Circulating and brain cytokines, plasma corticosterone and behavioral changes in mice. Brain Behav Immun 22: 573–589. https://doi.org/10.1016/j.bbi.2007.12.001
Gandhi R., Hayley S., Gibb J., Merali Z., Anisman H. (2007) Influence of poly I:C on sickness behaviors, plasma cytokines, corticosterone and central monoamine activity: moderation by social stressors. Brain Behav Immun 21: 477–489. https://doi.org/10.1016/j.bbi.2006.12.005
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


