Журнал эволюционной биохимии и физиологии, 2021, T. 57, № 5, стр. 363-372
СРАВНИТЕЛЬНЫЙ АНАЛИЗ ВЫЯВЛЕНИЯ МИКРОГЛИИ У МЛЕКОПИТАЮЩИХ И ЧЕЛОВЕКА С ИСПОЛЬЗОВАНИЕМ МАРКИРОВАНИЯ ПУРИНЕРГИЧЕСКИХ РЕЦЕПТОРОВ P2Y12
Д. Э. Коржевский 1, Д. Л. Цыба 1, О. В. Кирик 1, О. С. Алексеева 1, 2, *
1 Федеральное государственное бюджетное научное учреждение “Институт экспериментальной медицины”
Санкт-Петербург, Россия
2 Федеральное государственное бюджетное учреждение науки Институт эволюционной физиологии и биохимии
им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
* E-mail: osa72@inbox.ru
Поступила в редакцию 01.03.2021
После доработки 15.04.2021
Принята к публикации 19.04.2021
Аннотация
Проблема выбора адекватного метода выявления микроглии актуальна для современных нейрофизиологических и междисциплинарных исследований в связи с отсутствием универсальных подходов, позволяющих визуализировать эту популяцию клеток в препаратах головного мозга человека и лабораторных животных. В настоящем исследовании изучалась возможность использования пуринергического рецептора P2Y12 в качестве маркера для сравнительного анализа микроглии у человека и нескольких неродственных видов животных (кролик, крыса, мышь, суслик). Для исследования применялись антитела к рекомбинантному пептиду, соответствующему 303–342 аминокислотам P2Y12 рецептора человека. Показано, что наилучшие результаты выявления микроглии были характерны для человека, кролика и крысы. У суслика и мыши, помимо выявляемой микроглии, обнаруживалась неспецифическая реакция со стороны других клеток, отрицательное влияние которой на качество получаемых изображений можно уменьшить, используя средства конфокальной микроскопии. Во всех исследованных случаях отмечалось отсутствие иммунопозитивных макрофагов и клеток амебоидной микроглии, что свидетельствует о перспективности использования P2Y12 как высокоселективного маркера покоящейся микроглии. В рамках настоящего исследования впервые была проведена визуализация микроглии головного мозга кролика и суслика с использованием антител против пуринергического рецептора P2Y12.
В последние годы в нейрофизиологических, биохимических и молекулярно-биологических исследованиях все чаще используются методы иммуногистохимии [1–9], которые, при условии их правильного применения, позволяют получать важные сведения об изменениях функционального статуса клеток нервной системы. В связи с высокой сложностью методов иммуногистохимии и особенностями иммунологических подходов, используемых для визуализации белковых маркеров, при проведении иммуногистохимических реакций нередко возникают проблемы, связанные со специфичностью используемых реагентов [10–12], которые не всегда могут быть определены с учетом результатов общепринятых контрольных процедур [13–15]. Не является редкостью и несоответствие заявленных производителем характеристик антител их действительным свойствам [12, 16]. Особую важность для сравнительных физиологических и эволюционных исследований представляет проблема видовой специфичности антигенных маркеров, которые в ряде случаев для таковых исследований оказываются непригодны, либо имеют ограничения, которые невозможно выявить, ориентируясь лишь на данные, предоставляемые производителем реактивов [12, 17]. В частности, не указывается весь перечень видов животных, на материале которых возможно использование данных антител. И если информацию о давно известных маркерах можно восполнить, изучая литературные источники, то относительно новые маркеры и антитела требуют тщательного изучения их пригодности для решения конкретных исследовательских задач. В качестве примера подобного подхода можно привести анализ использования одного продукта из общедоступной линейки антител к введенному в исследовательскую практику в 1996 г. микроглиальному маркеру Iba-1 [18]. В результате проведенного исследования было установлено, что один вариант первичных антител позволяет получать сопоставимые результаты при исследовании микроглии у мыши, крысы, кролика и человека [19], хотя в информации производителя содержится указание только на человека и крысу.
В 2003 г. были получены первые данные о присутствии пуринергического рецептора P2Y12 на мембране клеток микроглии [20]. К настоящему моменту опубликовано около 150 научных статей, в которых использованы различные антитела к этому маркеру, но ни в одной из них не проводилось детального исследования видоспецифичности антител, демонстрирующего возможность их использования для межвидового сравнительного анализа микроглии. В связи с тем, что P2Y12 не экспрессируется другими клетками головного мозга, кроме микроглиальных [21], и является маркером функционального состояния клетки [22, 23], его использование в сравнительных физиологических и биохимических исследованиях представляется перспективным.
В последние годы наблюдается увеличение числа исследований, в которых клетки микроглии выявляют с использованием антител к белку P2Y12 [24–28]. Используются различные антитела к данному белку при изучении мозга лабораторных животных и человека, однако до настоящего времени сравнительная оценка возможностей селективного выявления микроглиоцитов у различных видов млекопитающих и человека с использованием маркера P2Y12 не проводилась.
В связи с вышеизложенным целью данной работы стало изучение возможности использования антител к рецептору P2Y12 в качестве маркера отростчатой микроглии головного мозга человека и животных (кролика, суслика, крысы и мыши) с использованием различных иммуноцитохимических подходов.
МАТЕРИАЛЫ И МЕТОДЫ
Материалом для исследования послужили срезы коры большого мозга человека и головной мозг половозрелых самцов ряда млекопитающих: крыс линии Wistar, сусликов вида Spermophilus pygmaeus, мышей линии C57BL/6 и кроликов породы Шиншилла (n = 3 в каждой группе). Все манипуляции с животными осуществляли в соответствии с Правилами проведения работ с использованием экспериментальных животных (Приложение к приказу МЗ СССР № 755 от 12.08.1977 г.). Материал головного мозга человека получен из архива отдела общей и частной морфологии ФГБНУ “ИЭМ”, созданного в соответствии с заключением ЛЭК ФГБНУ “ИЭМ” от 11.12.2009 г. Исследование лабораторных животных (мыши, крысы, кролики) проводили в соответствии с заключением локального этического комитета ФГБНУ “ИЭМ” от 25.04.2019 г. Исследование сусликов проводили в соответствии с заключением комиссии по биоэтике ИЭФБ РАН (протокол № 2/2020 от 27.02.2020 г.).
Головной мозг фиксировали в цинк-этанол-формальдегиде [29], обезвоживали и заливали в парафин по общепринятой методике. Морфологическому исследованию подвергали серийные фронтальные срезы мозга толщиной 5 мкм, приготовленные на ротационном микротоме Leica RM2125RT (Leica, Германия). После депарафинирования, регидратации и теплового демаскирования срезы использовали для иммуногистохимического исследования.
Выявление рецепторов P2Y12 производили с помощью кроличьих поликлональных антител (Novus Biologicals, США). Для разведения антител (1:500–1:3000) использовали разбавитель антител (Dako/Agilent, США). Используемые антитела были получены при иммунизации животных рекомбинантным белком с аминокислотной последовательностью KSFRNSLISMLKCPNSATSLSQDNRKKEQDGGDPNEETPM, соответствующей 303–342 аминокислотам P2Y12 рецептора человека, что следует из указаний производителя антител и проверки аминокислотной последовательности с использованием сервиса RefSeq [30]. Для выявления связавшихся с антигеном первичных антител использовали набор Reveal Polyvalent HRP DAB Detection System (Spring Bioscience, США). Пероксидазную метку выявляли с помощью диаминобензидинового хромогена (DAB+; Dako/Agilent, США). После проведения иммуноцитохимических реакций часть срезов подкрашивали гематоксилином либо альциановым синим. В качестве контролей использовали срезы, которые обрабатывались аналогичным образом, за исключением одного этапа, на котором вместо разведенных разбавителем первичных антител на препараты наносили только разбавитель антител.
Для конфокальной лазерной микроскопии в качестве вторичных антител для выявления рецепторов P2Y12 использовали набор Reveal Polyvalent HRP DAB Detection System (Spring Bioscience, США) и анти-HRP Fab-фрагменты иммуноглобулинов козы, конъюгированные с флуорохромом RRX (Jackson ImmunoResearch, США), максимум флуоресценции которого соответствует длине волны λem = 590 нм.
Анализ препаратов в проходящем свете и фотосъемку выполняли с использованием микроскопа Leica DM750 и фотокамеры ICC50 (Leica, Германия). Препараты, подготовленные для флуоресцентного исследования, изучали с использованием конфокального лазерного микроскопа LSM800 (Carl Zeiss, Германия). При проведении сравнительного анализа интенсивности реакции параметры захвата изображения настраивались по самой яркой реакции на препаратах головного мозга человека и не менялись в течение всего эксперимента. Обработку полученных изображений и построение графиков интенсивности флуоресценции проводили в программе Zen-2012 (Carl Zeiss, Германия). Анализ и сравнение аминокислотных последовательностей проводили с помощью онлайн инструмента BLAST [31] и алгоритма множественного выравнивания MUSCLE [32] в программе MegaX [33].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
В результате постановки иммуногистохимических реакций, проводимых в одинаковых условиях, у всех видов исследуемых животных и человека была обнаружена специфическая иммунореактивность, которая демонстрировала присутствие в нервной ткани коры большого мозга отростчатых клеток, имеющих типичное строение рамифицированной (отростчатой) микроглии. Наиболее интенсивная реакция была получена на препаратах коры большого мозга человека (рис. 1а). Продукт реакции равномерно распределялся в теле клетки, в отростках наблюдались его небольшие скопления. Фоновая реакция была минимальной. Содержимое кровеносных сосудов было иммунонегативным. Клеток, которые можно было бы отнести к амебоидной микроглии и периваскулярным макрофагам, выявлено не было.
Рис. 1.
Микроглия коры большого мозга: a – человека, b – крысы, c – кролика, d – суслика, e – мыши. Стрелка указывает на иммунопозитивный кровеносный сосуд. Иммуноцитохимическая реакция на P2Y12, визуализация с помощью хромогена DAB+. Масштабный отрезок равен 20 мкм.
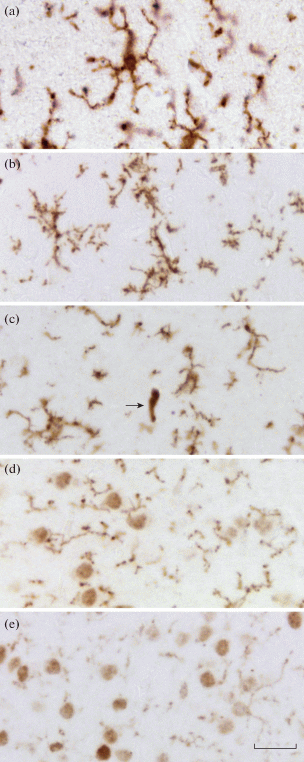
На препаратах мозга крысы (рис. 1b) интенсивность иммуногистохимической реакции была достаточно высокой для проведения анализа структуры клеток микроглии, но слабее, чем у человека. Хорошо прослеживалось сложное ветвление отростков. Тела клеток редко попадали в плоскость среза. При этом отмечались следующие особенности – слабая реакция в перинуклеарной области и ее отсутствие в ядрах клеток. При использовании больших увеличений микроскопа отмечалась кластеризация рецептора P2Y12 в области плазмалеммы. Содержимое сосудов было иммунонегативным.
На препаратах головного мозга кролика (рис. 1c) реакция была интенсивной, но несколько слабее, чем у микроглии мозга человека и близкой к ней (по интенсивности реакции) микроглии мозга крысы. Хорошо визуализировались отростки микроглиоцитов. Продукт иммуногистохимической реакции был распределен равномерно. От более толстых отростков отходили многочисленные тонкие и короткие отростки. Хорошо просматривался периметр тела клеток. Ядра клеток были иммунонегативными. Помимо микроглиоцитов, в препаратах коры головного мозга кролика иммунореактивным было бесструктурное содержимое кровеносных сосудов (см. рис. 1c). При изучении крупных сосудов, содержащих эритроциты, наблюдалась преимущественная реакция внеэритроцитарных компонентов содержимого кровеносных сосудов (сыворотка крови).
В препаратах головного мозга суслика (рис. 1d) интенсивность иммуногистохимической реакции в целом была слабее. При этом положительная реакция обнаруживалась не только в отростках микроглиоцитов, но и в ядрах отдельных нейронов. Указанные особенности затрудняли возможность оценки протяженности и ветвления отростков. Тела клеток микроглии визуализировались неотчетливо. Реакция в просвете кровеносных сосудов мозга отсутствовала.
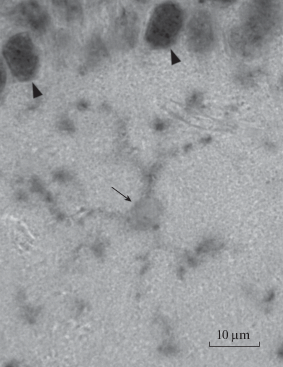
Наименьшая интенсивность реакции со стороны микроглии была характерна для препаратов головного мозга мыши (рис. 1e). Микроглия визуализировалась неотчетливо. Ее отростки имели вид тонких ниточек и точек. При этом ярко окрашивались ядра и тела других клеток, преимущественно нейронов (рис. 2). Содержимое сосудов не окрашивалось. Во всех изученных случаях клетки амебоидной микроглии и периваскулярные макрофаги не выявлялись.
Рис. 2.
Гиппокамп мыши. Стрелка указывает на область ядра микроглиоцита. Головки стрелок указывают на иммунопозитивные ядра пирамидных нейронов области CA1 гиппокампа. Иммуноцитохимическая реакция на P2Y12, визуализация с помощью хромогена DAB+, без подкраски.
При конфокальной лазерной микроскопии препаратов, полученных с помощью разведения первичных антител 1 : 1000, максимальная интенсивность флуоресценции (при одинаковых параметрах захвата изображения и одинаковых условиях постановки реакции) наблюдалась в препаратах мозга человека (рис. 3b, 3d) и кролика (рис. 3a, 3c). При этом микроглия в срезах головного мозга крысы, суслика и мыши не визуализировалась. Использование более продолжительного теплового демаскирования антигенов в течение 25 мин вместо 22 и повышение в 2 раза концентрации первичных антител позволили получить хорошо детектируемую реакцию микроглии головного мозга крысы и суслика при стандартных настройках конфокального микроскопа. Микроглия головного мозга мыши выявлялась только при двукратном увеличении мощности лазера, используемого для возбуждения флуоресценции (рис. 4). Таким образом, только при использовании приемов, усиливающих чувствительность методики, появлялась возможность анализировать микроглию на препаратах головного мозга крысы, суслика и мыши. Фоновая флуоресценция на препаратах мозга мыши была выше, чем на срезах мозга крысы и суслика (рис. 4). Ее уровень может быть откорректирован при помощи настроек микроскопа, в частности, увеличением параметра “Pixel Time”, который характеризует продолжительность экспозиции.
Рис. 3.
Неокортекс кролика (a, c) и человека (b, d). На рисунках (c, d) приведены графики интенсивности флуоресценции в отростках микроглиоцитов. Конфокальная лазерная микроскопия. Иммуноцитохимическая реакция на P2Y12, визуализация с помощью флуорохрома RRX.

Рис. 4.
Стриатум крысы (a), гиппокамп суслика (b) и мыши (c, d). Конфокальная лазерная микроскопия. Иммуноцитохимическая реакция на P2Y12, визуализация с помощью флуорохрома RRX. Области объекта в случае (c) и (d) идентичны. Для (d) параметр захвата изображения “Pixel Time” в 8 раз больше, чем для (c).

ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Анализ данных иммунопероксидазной реакции показал, что в одинаковых условиях (см. рис. 1), наиболее яркая окраска микроглии при использовании антител к рецептору P2Y12 наблюдалась в коре большого мозга человека, что вполне ожидаемо, поскольку для получения антител был использован пептид, полностью соответствующий фрагменту последовательности белка P2Y12 человека. Для получения более точной информации об аффинности связывания антител было проведено иммунофлуоресцентное исследование, поскольку оптическая плотность DAB-продукта не всегда может быть оценена количественно [34]. Визуальный анализ и построение графиков интенсивности иммунофлуоресцентной реакции в отростках микроглиоцитов (рис. 3 c, d) подтвердили предположение о пониженной степени связывания данных первичных антител с белком P2Y12 у всех исследуемых животных в сравнении с человеком (см. pис. 3, 4). Использование стандартных иммунофлуоресцентных методик дало возможность выявить P2Y12-иммунопозитивную микроглию только у человека и кролика (см. pис. 3). У крысы, мыши и суслика микроглия в этих условиях не визуализировалась. Усиление чувствительности реакции и повышение мощности возбуждающего лазера конфокального микроскопа позволили выявить микроглию у суслика, мыши и крысы (см. рис. 4). В результате данных экспериментов было установлено, что высокая интенсивность иммуногистохимической реакции у человека позволяет эффективно использовать антитела к P2Y12 в большем разведении (1 : 2000), чем при использовании их для визуализации микроглии у исследованных животных (1 : 500–1 : 1000).
Для оценки гомологии белка P2Y12 в ряду исследуемых объектов было произведено выравнивание аминокислотных последовательностей белка P2Y12 человека и исследуемых животных либо близкородственных видов, доступных в базе данных RefSeq [30]. В международных базах отсутствуют данные о белке P2Y12 исследованного нами малого суслика (Spermophilus pygmaeus), но имеются сведения о последовательности белка у родственного ему тринадцатиполосого суслика (Ictidomys tridecemlineatus). Анализ полученного выравнивания показал, что данный белок обладает достаточно высокой консервативностью среди исследуемых млекопитающих и человека. Тем не менее наблюдаются отличия в аминокислотных последовательностях, в том числе, затрагивающие иммуногенный участок. Наиболее близким по аминокислотному составу белком P2Y12 по сравнению с человеческим обладает кролик, наименее сходным – суслик, в то время как крыса и мышь занимают промежуточное положение (рис. 5).
Рис. 5.
Аминокислотные последовательности C-концевого (иммуногенного) фрагмента пуринергического рецептора P2Y12 человека, исследуемых млекопитающих и родственных им видов, попарное сравнение: a – человек и кролик, b – человек и крыса, c – человек и мышь, d – человек и суслик. Треугольниками показаны позиции с отличающимися аминокислотами. Однобуквенные обозначения аминокислот соответствуют общепринятым.

Сопоставление аминокислотной последовательности фрагментов белка, соответствующих иммуногенному пептиду, демонстрируют несколько иные результаты. При попарном сравнении аминокислотных последовательностей концевых фрагментов пуринергического рецептора P2Y12, соответствующих иммуногенному участку, схожесть для человека и кролика (Oryctolagus cuniculus) составила 82.5%, для человека и мыши (Mus musculus) – 70%, для человека и суслика (Ictidomys tridecemlineatus) – 67.5%, для человека и крысы (Rattus norvegicus) – 65%.
Попарный анализ аминокислотных замен позволил выделить участок из 4 аминокислот (рис. 5), в пределах которого наблюдается высокая схожесть между последовательностями, принадлежащими человеку и кролику. Причем в последовательности кролика в 18-й позиции от конца молекулы аспарагиновая кислота (D) заменена на схожую по физико-химическим свойствам отрицательно заряженную глутаминовую кислоту (E), в то время как у других млекопитающих в этой позиции находятся незаряженные аминокислоты: аланин (A), треонин (T) и глицин (G). Вероятно, наличие в 18-й от конца позиции отрицательно заряженной аминокислоты может быть существенным для формирования соответствующих антигенных эпитопов, распознаваемых исследуемыми поликлональными антителами [35].
Исходя из степени схожести последовательностей и анализа результатов иммуногистохимических реакций, можно предположить, что на связывание данных антител с P2Y12-рецепторами влияет не только сходство с иммуногенным пептидом, но и качественный характер аминокислотных замен.
Результаты анализа аминокислотных последовательностей в целом соотносятся с данными иммуноцитохимического исследования. Исключение составляет белок P2Y12 у мыши, который, исходя из аминокислотного состава, должен бы реагировать с использованными антителами не хуже, чем аналогичный белок у крысы. Существенно более слабая иммунореактивность исследуемого белка у данного вида лабораторных животных может быть связана с наличием других белков со сходными антигенными эпитопами, которые содержатся в нейронах головного мозга и конкурируют с белком P2Y12 за связывание с первичными антителами. Положительная реакция со стороны ядер нервных клеток у мыши (см. pис. 2) может указывать на существование подобных белков, поскольку присутствие в кариоплазме пуринергических рецепторов, для которых типична мембранная локализация, маловероятно. Идентификация локализованного в ядре белка, который отсутствует у человека, крысы и кролика, требует дальнейших исследований.
Обращает на себя внимание факт положительной реакции содержимого кровеносных сосудов у одного из исследованных видов животных – кролика. Данную реакцию нельзя считать специфической, поскольку она присутствует и в контрольных препаратах (негативный контроль без первичных антител). Выявление компонентов сыворотки в кровеносных сосудах у кролика объясняется используемыми вторичными реагентами. Поскольку первичные антитела являются по своему происхождению кроличьими, то при их выявлении собственные иммуноглобулины кролика, которые в интактном головном мозге можно обнаружить только в составе сыворотки крови в кровеносных сосудах, связываются со вторичными антителами и способствуют неспецифической окраске содержимого кровеносных сосудов. Аналогичные проблемы отмечаются и в других случаях, когда объект исследования и антитела имеют одну видовую принадлежность [17, 36].
Важным фактом, который был установлен в рамках проведенного исследования, является отсутствие метки в периваскулярных макрофагах и клетках, подобных амебоидной микроглии. Это наблюдение подтверждает имеющуюся информацию о том, что рецептор P2Y12, в отличие от белка Iba-1, являющегося неселективным маркером микроглии и макрофагов, присутствует только в клетках неактивированной (отростчатой) микроглии и не характерен для макрофагов [21, 23, 37].
Таким образом, реакция на P2Y12 с использованием поликлональных антител против рекомбинантного пептида, соответствующего 303–342 аминокислотам P2Y12 человека, может успешно применяться при сравнительном изучении микроглии у таких неродственных видов, как человек, кролик и крыса. Использование методов конфокальной лазерной микроскопии позволяет решить ряд проблем, связанных со слабой иммунореактивностью микроглии и присутствием неспецифической фоновой реакции при изучении препаратов головного мозга суслика и мыши. Отсутствие иммунопозитивных макрофагов и клеток амебоидной микроглии как у изученных животных, так и у человека свидетельствует о перспективности использования P2Y12 как высокоселективного маркера покоящейся микроглии. В рамках настоящего исследования впервые была проведена визуализация микроглии головного мозга кролика и суслика с использованием антител против пуринергического рецептора P2Y12. Полученные результаты являются основой для проведения сравнительных исследований реакций микроглии при моделировании заболеваний человека с использованием различных видов лабораторных животных.
Список литературы
Greer K, Basso EKG, Kelly C, Cash A, Kowalski E, Cerna S, Ocampo CT, Wang X, Theus MH (2020) Abrogation of atypical neurogenesis and vascular-derived EphA4 prevents repeated mild TBI-induced learning and memory impairments. Sci Rep 10 (1): 15374. https://doi.org/10.1038/s41598-020-72380-1
Nazarian S, Abdolmaleki Z, Torfeh A, Shirazi Beheshtiha SH (2020) Mesenchymal stem cells with modafinil (gold nanoparticles) significantly improves neurological deficits in rats after middle cerebral artery occlusion. Exp Brain Res 238 (11): 2589–2601. https://doi.org/10.1007/s00221-020-05913-9
Deb BK, Chakraborty P, Gopurappilly R, Hasan G (2020) SEPT7 regulates Ca2+ entry through Orai channels in human neural progenitor cells and neurons. Cell Calcium 90: 102252. https://doi.org/10.1016/j.ceca.2020.102252
Bielefeld P, Abbink MR, Davidson AR, Reijner N, Abiega O, Lucassen PJ, Korosi A, Fitzsimons CP (2021) Early life stress decreases cell proliferation and the number of putative adult neural stem cells in the adult hypothalamus. Stress 24 (2): 189–195. https://doi.org/10.1080/10253890.2021.1879787
Lorenzen K, Mathy NW, Whiteford ER, Eischeid A, Chen J, Behrens M, Chen XM, Shibata A (2021) Microglia induce neurogenic protein expression in primary cortical cells by stimulating PI3K/AKT intracellular signaling in vitro. Mol Biol Rep 48 (1): 563–584. https://doi.org/10.1007/s11033-020-06092-0
Ping S, Qiu X, Kyle M, Zhao LR (2021) Brain-derived CCR5 Contributes to Neuroprotection and Brain Repair after Experimental Stroke. Aging Dis 12 (1): 72–92. https://doi.org/10.14336/AD.2020.0406
Wei H, Zhou W, Hu G, Shi C (2021) Induction of mesenchymal stem cell‑like transformation in rat primary glial cells using hypoxia, mild hypothermia and growth factors. Mol Med Rep 23 (2): 1. https://doi.org/10.3892/mmr.2020.11760
Sibarov DA, Bolshakov AE, Abushik PA, Krivoi II, Antonov SM (2012) Na+,K+-ATPase functionally interacts with the plasma membrane Na+,Ca2+ exchanger to prevent Ca2+ overload and neuronal apoptosis in excitotoxic stress. J Pharmacol Exp Ther 343 (3): 596–607. https://doi.org/10.1124/jpet.112.198341
Samoilov M, Churilova A, Gluschenko T, Vetrovoy O, Dyuzhikova N, Rybnikova E (2016) Acetylation of histones in neocortex and hippocampus of rats exposed to different modes of hypobaric hypoxia: Implications for brain hypoxic injury and tolerance. Acta Histochem 118 (2): 80–89. https://doi.org/10.1016/j.acthis.2015.11.008
Daneshtalab N, Doré JJ, Smeda JS (2010) Troubleshooting tissue specificity and antibody selection: Procedures in immunohistochemical studies. J Pharmacol Toxicol Methods 61(2): 127–135. https://doi.org/10.1016/j.vascn.2009.12.002
Weller MG (2016) Quality Issues of Research Antibodies. Analytical chemistry insights 11: 21–27. https://doi.org/10.4137/ACI.S31614
Bordeaux J, Welsh A, Agarwal S, Killiam E, Baquero M, Hanna J, Anagnostou V, Rimm D (2010) Antibody validation. BioTechniques 48 (3): 197–209. https://doi.org/10.2144/000113382
Gown AM (2016) Diagnostic Immunohistochemistry: What Can Go Wrong and How to Prevent. It. Archives of pathology & laboratory medicine 140 (9): 893–898. https://doi.org/10.5858/arpa.2016-0119-RA
Holmseth S, Zhou Y, Follin-Arbelet VV, Lehre KP, Bergles DE, Danbolt NC (2012) Specificity controls for immunocytochemistry: the antigen preadsorption test can lead to inaccurate assessment of antibody specificity. J Histochem Cytochem 60 (3): 174–187. https://doi.org/10.1369/0022155411434828
Nuovo G (2016) False-positive results in diagnostic immunohistochemistry are related to horseradish peroxidase conjugates in commercially available assays. Ann Diagnost Pathol 25: 54–59. https://doi.org/10.1016/j.anndiagpath.2016.09.010
Korzhevskii DÉ, Otellin VA, Grigorev IP, Petrova ES, Gilerovich EG, Zinkova NN (2008) Immunocytochemical detection of neuronal NO synthase in rat brain cells. Neurosci Behav Physiol 38 (8): 835–838. https://doi.org/10.1007/s11055-008-9063-9
Ward JM, Rehg JE (2014) Rodent Immunohistochemistry: Pitfalls and Troubleshooting. Veterinary Pathology 51 (1): 88–101. https://doi.org/10.1177/0300985813503571
Imai Y, Ibata I, Ito D, Ohsawa K, Kohsaka S (1996) A novel gene Iba1 in the major histocompatibility complex class III region encoding an EF hand protein expressed in a monocytic lineage. Biochem Biophys Res Commun 224 (3): 855–862. https://doi.org/10.1006/bbrc.1996.1112
Korzhevskii DE, Kirik OV, Sukhorukova EG (2015) Immunocytochemistry of Microglial Cells. In: Merighi A., Lossi L. (eds) Immunocytochemistry and Related Techniques. Neuromethods. Humana Press. New York. 101: 209–224. https://doi.org/10.1007/978-1-4939-2313-7_12
Sasaki Y, Hoshi M, Akazawa C, Nakamura Y, Tsuzuki H, Inoue K, Kohsaka S (2003) Selective expression of Gi/o-coupled ATP receptor P2Y12 in microglia in rat brain. Glia 44 (3): 242–250. https://doi.org/10.1002/glia.10293
Mildner A, Huang H, Radke J, Stenzel W, Priller J (2017) P2Y12 receptor is expressed on human microglia under physiological conditions throughout development and is sensitive to neuroinflammatory diseases. Glia 65 (2): 375–387. https://doi.org/10.1002/glia.23097
Koizumi S, Ohsawa K, Inoue K, Kohsaka S (2013) Purinergic receptors in microglia: functional modal shifts of microglia mediated by P2 and P1 receptors. Glia 61 (1): 47–54. https://doi.org/10.1002/glia.22358
Haynes SE, Hollopeter G, Yang G, Kurpius D, Dailey ME, Gan WB, Julius D (2006) The P2Y12 receptor regulates microglial activation by extracellular nucleotides. Nat Neurosci 9 (12): 1512–1519. https://doi.org/10.1038/nn1805
Yu T, Zhang X, Shi H, Tian J, Sun L, Hu X, Cui W, Du D (2019) P2Y12 regulates microglia activation and excitatory synaptic transmission in spinal lamina II neurons during neuropathic pain in rodents. Cell Death Dis 10 (3): 165. https://doi.org/10.1038/s41419-019-1425-4
Chen Z, Zhong D, Li G (2019) The role of microglia in viral encephalitis: a review. J Neuroinflammation 16 (1): 76. https://doi.org/10.1186/s12974-019-1443-2
Cserép C, Pósfai B, Lénárt N, Fekete R, László ZI, Lele Z, Orsolits B, Molnár G, Heindl S, Schwarcz AD, Ujvári K, Környei Z, Tóth K, Szabadits E, Sperlágh B, Baranyi M, Csiba L, Hortobágyi T, Maglóczky Z, Martinecz B, Szabó G, Erdélyi F, Szipőcs R, Tamkun MM, Gesierich B, Duering M, Katona I, Liesz A, Tamás G, Dénes Á (2020) Microglia monitor and protect neuronal function through specialized somatic purinergic junctions. Science 367 (6477): 528–537. https://doi.org/10.1126/science.aax6752
Tuan LH, Lee LJ (2019) Microglia-mediated synaptic pruning is impaired in sleep-deprived adolescent mice. Neurobiol Dis 130: 104517. https://doi.org/10.1016/j.nbd.2019.104517
Peng J, Liu Y, Umpierre AD, Xie M, Tian DS, Ri-chardson JR, Wu LJ (2019) Microglial P2Y12 receptor regulates ventral hippocampal CA1 neuronal excitability and innate fear in mice. Mol Brain 12 (1): 71. https://doi.org/10.1186/s13041-019-0492-x
Korzhevskii DE, Sukhorukova EG, Kirik OV, Grigorev IP (2015) Immunohistochemical demonstration of specific antigens in the human brain fixed in zinc-ethanol-formaldehyde. Eur. J Histochem 59 (3): 233–237. https://doi.org/10.4081/ejh.2015.2530
O'Leary NA, Wright MW, Brister JR, Ciufo S, Haddad D, McVeigh R, Rajput B, Robbertse B, Smith-White B et al. (2015) Reference sequence (RefSeq) database at NCBI: current status, taxonomic expansion, and functional annotation. Nucleic Acids Res 44 (D1): D733–D745. https://doi.org/10.1093/nar/gkv1189
Altschul SF, Gish W, Miller W, Myers EW, Lipman DJ (1990) Basic local alignment search tool. J. Mol. Biol. 215 (3): 403–410. https://doi.org/10.1016/S0022-2836(05)80360-2
Edgar RC (2004) MUSCLE: multiple sequence alignment with high accuracy and high throughput. Nucleic Acids Res. 32 (5): 1792–1797. https://doi.org/10.1093/nar/gkh340.29
Kumar S, Stecher G, Li M, Knyaz C, Tamura K (2018) MEGA X: Molecular Evolutionary Genetics Analysis across computing platforms. Mol Biol Evol 35 (6): 1547–1549. https://doi.org/10.1093/molbev/msy096
Bishop DP, Cole N, Zhang T, Doble PA, Hare DJ (2018) A guide to integrating immunohistochemistry and chemical imaging. Chem Soc Rev 47 (11): 3770–3787. https://doi.org/10.1039/c7cs00610a
Ladner RC (2007) Mapping the epitopes of antibodies. Biotechnol. Genet Eng Rev 24: 1–30. https://doi.org/10.1080/02648725.2007.10648092
Fritschy JM (2008) Is my antibody-staining specific? How to deal with pitfalls of immunohistochemistry. Eur J Neurosci 28 (12): 2365–2370. https://doi.org/10.1111/j.1460-9568.2008.06552.x
Ramírez AI, de Hoz R, Fernández-Albarral JA, Salobrar-Garcia E, Rojas B, Valiente-Soriano FJ, Avilés-Trigueros M, Villegas-Pérez MP, Vidal-Sanz M, Tri-viño A, Ramírez JM, Salazar JJ (2020) Time course of bilateral microglial activation in a mouse model of laser-induced glaucoma. Sci Rep 10 (1): 4890. https://doi.org/10.1038/s41598-020-61848-9
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


