Журнал эволюционной биохимии и физиологии, 2021, T. 57, № 5, стр. 411-419
ЭКСПРЕССИЯ МАРКЕРОВ НЕЙРОВОСПАЛЕНИЯ И АПОПТОЗА В ВИСОЧНОЙ ДОЛЕ ГОЛОВНОГО МОЗГА У ПАЦИЕНТОВ С ФАРМАКОРЕЗИСТЕНТНОЙ ЭПИЛЕПСИЕЙ
А. В. Литовченко 1, 2, *, Ю. М. Забродская 2, 3, Д. А. Ситовская 3, Л. К. Хужахметова 4, В. Г. Нездоровина 3, Е. Д. Бажанова 1, 2, 5
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
2 Научно-клинический центр токсикологии им. акад. С.Н. Голикова
Федерального медико-биологического агентства России
Санкт-Петербург, Россия
3 Российский научно-исследовательский нейрохирургический институт им. проф. А.Л. Поленова – филиал ФГБУ “НМИЦ им. В.А. Алмазова” Минздрава России
Санкт-Петербург, Россия
4 Астраханский государственный медицинский университет Минздрава РФ
Астрахань, Россия
5 Астраханский государственный университет
Астрахань, Россия
* E-mail: anastasiya_litovchenkos@list.ru
Поступила в редакцию 29.03.2021
После доработки 03.06.2021
Принята к публикации 04.06.2021
Аннотация
Современные стратегии лечения эпилепсии основаны главным образом на нормализации взаимодействия возбуждающей и тормозной системы, что оказывается не эффективным у пациентов с фармакорезистентной формой эпилепсии. Нейровоспалительные процессы в эпилептическом очаге и в его перифокальной зоне могут быть причиной развития апоптоза, а также могут играть роль в формировании лекарственной устойчивости. В биоптатах серого и белого вещества височной доли головного мозга пациентов с фармакорезистентной эпилепсией, полученных интраоперационно, с помощью иммуноблоттинга было проанализировано содержание про- и антиапоптотических белков (p-NF-kB, TNF-, p53, αFAS, caspase-3, caspase-9). В коре и белом веществе перифокальной зоны выявлено повышенное содержание проапоптотических белков на фоне дисбаланса белков путей выживания. При этом, вероятно, активация апоптоза по внешнему пути происходит в перифокальной зоне, тогда как в эпилептическом очаге присутствуют белки, характерные для активации протективных путей. Активное нейровоспаление в эпилептическом очаге и перифокальной зоне височной доли может способствовать развитию резистентности к противоэпилептическим препаратам и прогрессированию нейродегенерации у таких пациентов.
ВВЕДЕНИЕ
Каждый год в мире выявляется около 2 млн. новых случаев эпилепсии. При этом Международной противоэпилептической лигой (International League Against Epilepsy-ILAE) установлено, что риск смерти молодого пациента с эпилепсией выше в 4 раза по сравнению со среднепопуляционными показателями в этой же возрастной группе [1]. Частота встречаемости фармакорезистентной эпилепсии (ФРЭ), требующей хирургического лечения, составляет 30% от общего числа больных. По данным исследователей, доля фармакорезистентных форм оставалась неизменной на протяжении последних 30 лет, несмотря на появление новых противоэпилептических препаратов с принципиально различными механизмами действия [2]. Устойчивые к медикаментозному лечению формы эпилепсии характеризуются быстрым прогрессированием и существенно снижают как качество жизни пациента, так и его работоспособность [3]. При очаговой ФРЭ показано хирургическое лечение, которое кроме того, что является травматичным, только в 60% случаев приводит к положительному результату, из которых еще в 20% снижается количество приступов, в – 20% наблюдается повторная манифестация заболевания [4]. Эти данные подтверждают острую необходимость в поиске новых патогенетических механизмов эпилепсии.
Эпилептогенез – это динамический процесс, который постепенно изменяет возбудимость нейронов, устанавливает критические взаимосвязи и требует сложных структурных изменений до того, как произойдет первый спонтанный припадок [5]. Эти изменения могут включать нейродегенерацию, нейрогенез, глиоз, аксональное повреждение, дендритную пластичность, повреждение гематоэнцефалического барьера, рекрутирование воспалительных клеток в мозговую ткань, реорганизацию внеклеточного матрикса и реорганизацию молекулярного функционирования отдельных нейрональных клеток [6].
Молекулярные механизмы, приводящие к изменению фармакочувствительности нейронов к современным препаратам, до сих пор неизвестны. Предполагается, что снижение числа потенциалзависимых каналов, выявленное как при экспериментальной эпилепсии, так и у пациентов, может быть клеточным механизмом фармакорезистентности при хронической эпилепсии [7]. Ключевым механизмом повреждения потенциалзависимых каналов, а также гибели нейронов в контексте развития фармакоустойчивых форм эпилепсии может оказаться нейровоспаление, наличие которого показано у больных с другими нейродегенеративными заболеваниями (болезнью Альцгеймера, Паркинсона, Гентингтона, Пика и т.д.) [8]. Использование в доклинических испытаниях нестероидных противовоспалительных препаратов (НПВП) в качестве средств, способствующих уменьшению конвульсионной активности, не уменьшало долю крыс, у которых развилась эпилепсия, но лечение НПВП уменьшало частоту и продолжительность приступов, снижало активацию микроглии и инфильтрацию лейкоцитами, подавляло окислительный стресс и высвобождение цитокинов, а также способствовало снижению нейродегенерации [9].
Нейровоспаление и апоптоз нервных клеток могут играть существенную роль в патогенезе эпилепсии. Последние данные подтверждают активный процесс гибели нейронов головного мозга при височной форме этого заболевания [10]. Например, у грызунов была показана повышенная экспрессия в мозге провоспалительных цитокинов интерлейкина (IL-1β) и фактора некроза опухоли (TNF-α), приводящая к нейровоспалительному процессу в модели фокальной церебральной ишемии [11]. В мозге в состав клеточных постоянных структур входят сразу несколько так называемых рецепторов смерти, таких как TNFR1, FAS и DR4, которые, при взаимодействии с TNF-α и FAS-L, активируют внешнерецепторный путь апоптоза [12]. Рецепторный механизм апоптоза при эпилепсии ранее был подтвержден косвенно введением нейтрализующих TNF-α антител, оказавшим нейропротективный эффект in vitro [13].
Некоторые исследования сообщают о связи нуклеарного фактора NF-kB, основного регулятора воспаления, с эпилепсией у животных [14]. NF-kB состоит из двух субъединиц, его наиболее распространенной формой является гетеродимер p65 и p50, который обычно существует в цитоплазме в ингибированной белком IkB форме. Стимуляция поверхностных клеточных рецепторов такими факторами, как окислительный стресс, цитокинами или патогенами вызывает активацию комплекса IkB. Протеасомная деградация IkB приводит к высвобождению и транслокации димеров NF-kB в ядро, где он способствует транскрипции генов-мишеней для противодействия окислительному стрессу и повреждению клеток [15]. Недавние исследования подтвердили активацию NF-kB в большинстве типов клеток, включая нейроны, астроциты, микроглию и олигодендроциты [16]. In vitro в культивируемых нейронах была обнаружена активация NF-kB под воздействием глутамата и β-амилоида. In vivo подобную картину наблюдали в условиях экспериментального аутоиммунного энцефаломиелита, ишемии головного мозга, а также болезни Альцгеймера [17]. Таким образом, NF-kB играет важную роль сигнального пути в центральной нервной системе, выполняющего функцию активации каскадов выживания в ответ на повреждение нейронов.
В противовес активации путей выживания нервные клетки могут подвергаться апоптозу в ответ на внешние воздействия. Активация апоптоза может происходить по внешнему (рецепторному) и митохондриальному пути. И если протекание апоптоза по митохондриальному пути часто связано с оксидативным стрессом клетки, то внешний путь активируется в результате повреждения или клеточного иммунного ответа [18]. В качестве субстрата клеточного иммунитета в головном мозге может выступать микроглия, активация которой приводит к секреции провоспалительных факторов в нервной ткани и вызывает нейровоспаление и апоптоз [19].
Цель работы – выявление молекулярных механизмов патогенеза фармакорезистентной эпилепсии (ФРЭ) у человека. В задачи работы входило выявление возможной роли TNF-α и NF-kB-зависимых сигнальных путей в экспрессии апоптоз-ассоциированных молекул (р53, caspase-9 и -3) в нервной ткани височной доли пациентов с ФРЭ.
МЕТОДЫ ИССЛЕДОВАНИЯ
Все пациенты, включенные в данное исследование, наблюдались в клинике Российского научно-исследовательского нейрохирургического института им. проф. А.Л. Поленова – филиала НМИЦ им. В.А. Алмазова города Санкт-Петербург в 2013–2020 г. В течение этого периода были проведены обследование и хирургическое лечение 24 пациентов (средний возраст 27.75 ± 2.46; 9 женщин, 15 мужчин) с установленным диагнозом по МКБ10 “G40.2 Височно-долевая фокальная эпилепсия структурной этиологии с частыми полиморфными приступами, фармакорезистентное течение”. Добавление этих пациентов в наше исследование происходило последовательно, критериями включения для них являлись эпилептическая активность преимущественно в височной доле головного мозга, подтвержденная при проведении инвазивного ЭЭГ-мониторинга, а также достаточность материала, полученного при оперативном вмешательстве (например, выполненная блок-резекция височной доли головного мозга) при имеющемся от пациента информированном согласии на взятие, транспортировку, хранение и исследование биоптатов. В случае недостаточного количества биологического материала (при выполнении стереотаксического вмешательства или выраженной фрагментации материала), при наличии новообразований или инфекции головного мозга, а также при выявленных аутоиммунных заболеваниях или иммунодефицитных состояниях в анамнезе, данные пациенты не включались в наше исследование. У этих пациентов согласно поставленному диагнозу и данным ЭЭГ была проведена переднемедиальная темпоральная резекция под электрофизиологическим контролем. Зона эпилептического очага определялась с использованием МРТ по программе “Эпилепсия”, ПЭТ-КТ и инвазивного ЭЭГ-мониторинга. При проведении инвазивного ЭЭГ-мониторинга устанавливается вовлеченность извилины в эпилептический процесс. При проведении хирургического вмешательства под контролем электрокортикографии уточняется зона эпилептиформной активности, фиксируется в протоколе оперативного вмешательства, выполняется блок-резекция передних отделов височной доли. После поступления нефиксированного материала в патологоанатомическое отделение производятся анатомическая ориентировка удаленного фрагмента вещества головного мозга, его измерение и фотофиксация. Согласно протоколу оперативного вмешательства, устанавливается зона эпилептического очага, по которой производится перпендикулярный столу разрез, формируется пластинка толщиной 0.2 см. Из зоны пораженной извилины головного мозга для исследования берутся фрагменты коры и подлежащего белого вещества непосредственно из эпилептического очага, а также из перифокальной зоны этого очага, маркируются, замораживаются.
В качестве группы сравнения выступали 6 пациентов, сопоставимые с исследуемой группой по полу и возрасту, прооперированные в связи с черепно-мозговой травмой (средний возраст 28.75 ± ± 3.73; 2 женщины, 4 мужчины) и включенные в эту группу при условии отсутствия эпилептического синдрома в анамнезе, патологии нервной системы (опухолей, инфарктов мозга, кровоизлияний, инфекций) и аутоиммунных заболеваний или иммунодефицитных состояний. Пациенты данной группы поступали в стационар для проведения реконструктивных вмешательств (пластика дефекта костей свода черепа, иссечение спаек в зоне глио-мезодермального рубца) в отдаленном периоде перенесенной травмы (0.5–1 год). Пациенты с острой черепно-мозговой травмой в исследование не входили. Все полученные образцы коры и белого вещества, полученные при оперативном вмешательстве, хранились при температуре –80°С.
Из исследуемых биоптатов максимально быстро и при низких температурах отбирался фрагмент массой от 0.03 г до 0.05 г, к фрагменту добавлялся лизатный буфер в соотношении 1:10, смешанный ex tempore с ингибиторами протеаз (ProteaseInhibitorCocktail, Sigma-Aldrich) и фосфатаз (PhosSTOP, Sigma-Aldrich), затем образец гомогенизировали. Полученный гомогенат отстаивали на холоде в течение 30 мин, затем центрифугировали 15 мин при температуре 4°C с относительным центробежным ускорением 12 000 g. По окончании центрифугирования отбирали полученный супернатант, смешивали с буферным раствором Лэммли и инкубировали в течение 5 мин при 95°С.
Исследовали уровень белков NF-kB p65 (phospho S536) (1:500); FAS (1 : 1000); p53 (1 : 250); TNF alpha (1 : 1000); STAT1 (1 : 1000); сaspase-9 (1 : 1000) (Abcam, USA); сaspase-3 (1 : 1000), tubulin (1 : 1000) (CellSignalling, USA) с помощью иммуноблоттинга. Инкубацию в первичных антителах проводили при температуре 4°C в течение 8–12 ч при постоянном перемешивании. Для проведения реакции хемилюминесценции после инкубации во вторичных антителах использовали ECL (SuperSignal WestDura Extended Duration Substrate, ThermoScientific). Реакцию оценивали с помощью гель-документирующей системы ChemiDoc (BioRad) с последующей денситометрией полученных блотов в программе “ImageJ”. Статистическую обработку данных проводили с помощью пакета программ “GraphPad Prism 8.0.1”. Значимость различий для количественных переменных между несвязанными группами оценивалась по критерию Краскела–Уоллиса. Различия считались статистически значимыми при p < 0.05.
Для проведения иммуногистохимического (ИГХ) анализа экспрессии белков апоптоза дополнительно после операции височной блок-резекции извлеченный биоптат височной доли фиксировали в забуференном нейтральном формалине 10% (pH 7.4), заливали в парафин по общепринятой методике и готовили фронтальные срезы мозга толщиной 6–7 мкм. В качестве группы сравнения использовался аутопсийный материал от 5 умерших (3 мужчин, 2 женщин) без эпилепсии в возрасте от 40 до 67 лет (средний возраст 54 ± 7.25), умерших в результате травмы и не имеющих в анамнезе неврологических данных. Посмертная задержка до вскрытия составляла от 7 до 12 часов (в среднем 8.65 ± 2.2).
Демаскировку белков проводили в цитратном буфере при 95° в течение 20 мин, ИГХ реакцию проводили с использованием кроличьих поликлональных антител к caspase-3 (1 : 250) (Cell Signalling, USA), срезы инкубировали в первичных антителах в течение 12 ч при комнатной температуре. Инкубацию срезов во вторичных антителах осуществляли в течение 1 ч при комнатной температуре, затем выдерживали в Streptavidin−Peroxidase Polymer, Ultrasensitive (Sigma-Aldrich, USA). Для визуализации использовали хромоген DAB (Sigma-Aldrich, USA). После проведения ИГХ реакции срезы докрашивали гематоксилином Гилла, заключали в синтетическую заливочную среду Bio Mount HM (BIO-OPTICA Milano, Италия). Оценка результата реакции проводилась путем подсчета количества окрашенных ядер (%) на 100 клеток в 10 полях зрения в каждом случае.
Работа проведена на основе принципов добровольности и конфиденциальности, все процедуры выполнены в соответствии с Федеральным законом “Об основах охраны здоровья граждан в Российской Федерации” от 21.11.2011 № 323-ФЗ. Проведение исследования соответствуют этическим стандартам, получены разрешение этического комитета института и информированное согласие от каждого пациента (Выписка из протокола заседания № 0305–2016 ЛЭК от 16.05.2016). Исследование проводилось в рамках оказания высокотехнологической помощи и одобрено этическим комитетом НМИЦ им. В.А. Алмазова.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ОБСУЖДЕНИЕ
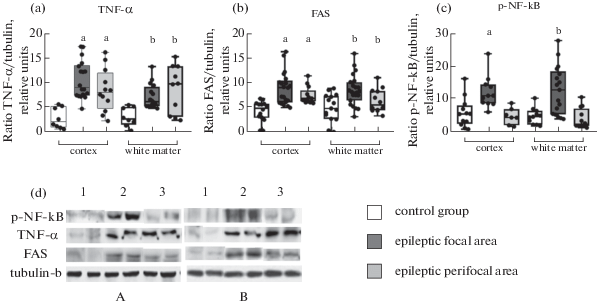
Наши результаты показали наличие нейровоспаления и апоптоза в тканях головного мозга. A. Rana и A.E. Musto [20] описывают, что у пациентов, госпитализированных с судорожным синдромом, выявлено повышение уровня провоспалительного фактора TNF-α в спинномозговой жидкости и крови, кроме того, показано, что экспрессия TNF-α повышается в гиппокампе у крыс после судорог. Однако сравнение содержания этого белка непосредственно в коре и белом веществе эпилептического очага и перифокальной зоны височной доли у человека с содержанием TNF-α в коре и в белом веществе здоровых живых людей ранее не было изучено. Известно, что провоспалительный цитокин TNF-α высвобождается в мозге из активированных микроглии и астроцитов [21]. Во взятых нами образцах выявлено повышенное содержание TNF-α в эпилептическом очаге и в перифокальной зоне коры и белого вещества височной доли головного мозга (рис. 1). Аналогично наблюдалась усиленная экспрессия рецептора FAS в эпилептическом очаге серого и белого вещества височной доли по сравнению со значениями контрольной группы. В перифокальной зоне экспрессия FAS была увеличена только в коре, в белом веществе наблюдалась тенденция к росту. В исследованиях других авторов у пациентов с височной эпилепсией отмечено повышение уровня рецептора к TNF-α - TNFR1, а также FAS-ассоциированного белка с доменом смерти (FADD) [22]. Обнаруженное нами высокое содержание TNF-α в биоптатах коры и белого вещества височной доли на фоне повышенной экспрессии рецептора к FAS-L может свидетельствовать об активации иммунных клеток в мозге больных ФРЭ, а также о протекании апоптоза по внешнему пути непосредственно в очаге в коре и в белом веществе. В перифокальной зоне, вероятно, данные процессы тоже протекают, но менее интенсивно. TNF-α, связываясь с соответствующим рецептором (TNFR1), активирует TNFR-ассоциированный домен белка TRADD, тогда как FAS-L взаимодействуют с FAS-ассоциированным доменом белка FADD [23]. В результате включения TNF-α адаптера TRADD возможна активация конкурентных параллельных путей подавления клеточной гибели, вызванных фосфорилированием белка-ингибитора, с которым связан NF-kВ. Это явление может объяснять данные о различном влиянии TNF-α на апоптоз. При этом система FAS/FAS-L не инициирует иных параллельных путей, кроме апоптоза [24].
Рис. 1.
Содержание TNF-α (a), FAS (b), p-NF-kB (c) в коре и в белом веществе височной коры головного мозга. Лизаты биоптатов коры и белого вещества височной доли человека, исследованные на 10% полиакриламидном геле методом иммуноблоттинга (d). a – различия в содержании белка в коре по сравнению с контрольной группой, статистически значимы при p < 0.05; b – различия в содержании белка в белом веществе по сравнению с контрольной группой, статистически значимы при p < 0.05; с – различия в содержании белка в коре перифокальной зоны по сравнению с эпилептическим очагом, статистически значимы при p < 0.05; d – различия в содержании белка в белом веществе перифокальной зоны по сравнению с эпилептическим очагом, статистически значимы при p < 0.05.
Транскрипционный фактор NF-kB регулирует экспрессию антиапоптотических белков [14]. Деградация комплекса NF-kB с IkB под влиянием TRADD позволяет изоформе NF-kB р65 транслоцироваться в ядро, где она регулирует транскрипцию широкого спектра генов, отвечающих за синтез таких белков, как Bcl-2, IL-6, IL-8 и VEGF, участвующих в выживании клеток [25]. Строение р65 включает в себя С-концевой домен, состоящий из 30 аминокислот, которые составляют наиболее важный участок трансактивации NF-kB, фосфорилирование сайта S536 ведет к ускорению транскрипции генов выживания, либо может быть путем альтернативной активации NF-kB пути вне регуляции IkB [26].
В наших образцах в эпилептическом очаге в коре и в белом веществе наблюдался рост содержания фосфорилированной по S536 формы NF-kB, при этом в перифокальной зоне содержание этого белка оставалось на том же уровне, что и у пациентов без эпилепсии. Существенное содержание фосфорилированной формы NF-kB непосредственно в эпилептическом очаге может говорить об активации транскрипции провоспалительных и антиапоптотических генов в клетках под воздействием TNF-α, что, как следствие, часто приводит по большей части не к гибели клеток, а к их выживанию. Однако выявленное нами высокое содержание TNF-α в очаге может указывать на наличие предполагаемого нами нейровоспаления при ФРЭ. В перифокальной зоне при такой же относительной концентрации TNF-α можно предположить, что не происходит запуска параллельного пути выживания, так как разницы в содержании фосфорилированной формы NF-kB между контрольной группой и группой с ФРЭ не выявлено, из чего мы можем сделать вывод, что в перифокальной зоне на фоне имеющегося нейровоспаления развитие процесса апоптоза не сдерживается протективными путями.
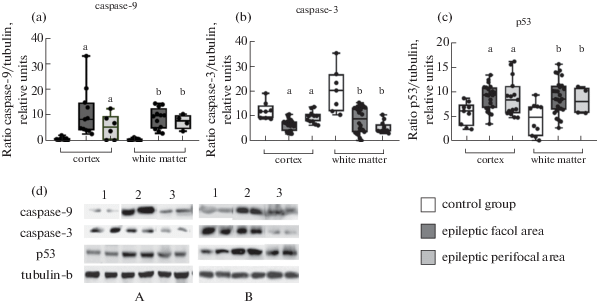
Выявленная нами повышенная экспрессия рецептора FAS в очаге коры и белого вещества и в перифокальной зоне коры может быть вызвана транскрипцией гена р53. Запускающий транскрипцию этого гена белок р53 в цитоплазме находится в латентном состоянии и может быть активирован не только в ответ на повреждение ДНК, но и в результате действия окислительного стресса, патогенных или цитотоксических агентов [27]. Инициация апоптоза через активацию р53 происходит несколькими путями, один из которых индуцирует мРНК FAS и перемещение синтезированного FAS на поверхность клетки [28]. Кроме того, р53 действует непосредственно на внешнюю мембрану митохондрий, проникая внутрь, где взаимодействует с Bcl-2 или Bak, что приводит к высвобождению цитохрома С и активации caspase-3 [18]. В нашем исследовании при эпилепсии отмечено увеличение содержания белка p53 в области эпилептического очага и в перифокальной зоне в височной коре и в белом веществе (рис. 2), что может быть одной из причин роста FAS на мембране клеток, тем самым стимулируя развитие апоптоза под действием внешних факторов. При этом воздействие p53 на митохондрии выступает дополнительным фактором активации каспаз и гибели клеток.
Рис. 2.
Содержание caspase-9 (a), caspase-3 (b), p53 (c) в коре и в белом веществе височной коры головного мозга. Лизаты биоптатов коры и белого вещества височной доли человека, исследованные на 10% полиакриламидном геле методом иммуноблоттинга (d). a – различия в содержании белка в коре по сравнению с контрольной группой, статистически значимы при p < 0.05; b – различия в содержании белка в белом веществе по сравнению с контрольной группой, статистически значимы при p < 0.05; с – различия в содержании белка в коре перифокальной зоны по сравнению с эпилептическим очагом, статистически значимы при p < 0.05; d – различия в содержании белка в белом веществе перифокальной зоны по сравнению с эпилептическим очагом, статистически значимы при p < 0.05.
В результате воздействия р53 с мембраной поврежденной митохондрии и высвобождения цитохрома С происходит формирование специфического комплекса – апоптосомы, в состав которой входит белок APAF-1 (апоптотический протеазаактивирующий фактор), сам цитохром С и procaspase-9. Слияние этих белков в апоптосому приводит к активации caspase-9. Caspase-9, в свою очередь, вызывает активацию эффекторных каспаз, в том числе caspase-3, которая высвобождает связанную ДНКазу, разрушающую хроматин [23].
В исследуемых образцах серого вещества из эпилептического очага выявлено высокое содержание инициаторной caspase-9 по сравнению с образцами, взятыми от группы контроля, при этом содержание caspase-3 у тех же пациентов снижено (рис. 2). В перифокальной зоне серого вещества содержание caspase-9 и caspase-3 подчиняется той же тенденции, но менее выражено. В очаге и в перифокальной зоне белого вещества наблюдается та же картина. Сниженное содержание эффекторной caspase-3 в сочетании с одновременным повышением caspase-9 может быть вызвано возможным появлением расщепленной формы c-caspase-3, что косвенно может говорить об активации апоптоза по митохондриальному пути [10]. В ранее проведенном нами исследовании теми же методами мы выявили повышенное содержание caspase-8 в эпилептическом очаге и в перифокальной зоне коры пациентов с ФРЭ [29], что свидетельствует об активации апоптотических сигнальных путей. В эксперименте на крысах было показано, что ингибиторы caspase-8 редуцируют протеазную активность caspase-3 и -9, в то время как применение ингибиторов caspase-9 при височной эпилепсии незначительно влияет на активность эффекторной caspase-3 [22]. Таким образом, можно заключить, что при височной эпилепсии преобладает внешнерецепторный путь апоптоза. На активацию митохондриального пути при височной эпилепсии указывают другие эксперименты, в которых показано наличие в наружной мембране митохондрий проапоптотического белка Вах после начала припадка [10, 20]. В свою очередь, митохондриальная дисфункция является одним из ключевых механизмов патогенеза нейродегенерации [22].
Исходя из полученных нами данных, можно выдвинуть предположение, что процессы апоптоза в перифокальной зоне возбуждения протекают более интенсивно, так как повышенного содержания белков протективного NF-kB-каскада в перифокальной зоне не было замечено, следовательно, предполагается, что активации путей выживания не произошло в достаточной степени. При этом перифокальная зона также подвержена действию воспалительных факторов, как и очаг. Вовлеченность перифокальных участков в воспалительные процессы, а также недостаточность протективных механизмов могут являться одними из факторов развития резистентности эпилепсии.
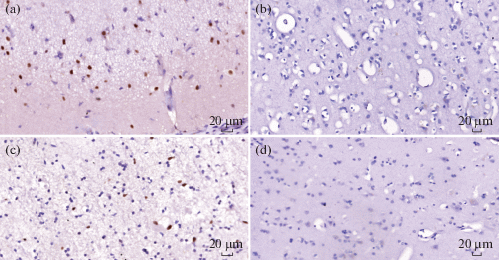
Для установления клеточной специфичности экспрессии проапоптотических белков было проведено ИГХ исследование биоптатов, полученных после височной блок-резекции. При ИГХ во всех случаях у больных с ФРЭ наблюдается положительная ядерная экспрессия сaspase-3 не только в нейронах, но и в глиальных клетках коры и белого вещества головного мозга. В коре глиоциты имеют высокую интенсивность ядерного окрашивания, их распределение носит диффузный характер во всех слоях коры, преимущественно в молекулярном слое (рис. 3а). Среднее относительное количество позитивных глиальных клеток с положительной реакцией на мечение антителами к caspase-3 в коре у пациентов с ФРЭ составило 23.65 ± 0.82%. В белом веществе ядерная экспрессия caspase-3 выражена умеренно, среднее относительное количество окрашенных ядер глиальных клеток в белом веществе несколько ниже, чем в коре, и составило 17.45 ± 0.54% (рис. 3с). В контрольной группе экспрессия сaspase-3 в белом веществе не была выявлена (рис. 3d), в коре наблюдались единичные окрашенные клетки, чаще всего в области цитоплазмы, ядерной экспрессии сaspase-3 выявлено не было (рис. 3b). Таким образом, обнаруженная экспрессия caspase-3 в глиоцитах коры и белого вещества в эпилептическом очаге височной доли может быть показателем вовлеченности глии в апоптотические процессы.
Рис. 3.
Иммуногистохимическая реакция на выявление caspase-3 в коре эпилептического очага височной доли пациента с ФРЭ (a) и в коре пациента без эпилепсии (b); в прилежащем к эпилептическому очагу белом веществе пациента с ФРЭ (с) по сравнению с контрольным образцом белого вещества (d). Визуализация с помощью DAB (коричневое окрашивание), докраска гематоксилином Гилла. Увеличение ×400.
Ранее проведенные исследования пациентов с ФРЭ и эксперименты на животных свидетельствуют о повышении экспрессии проапоптотических белков в гиппокампе [18, 20]. В нашей работе мы провели разделение изучаемой области на эпилептический очаг и перифокальную зону. Результаты показали, что в эпиочаге у пациентов с височной ФРЭ наблюдаются повышенная экспрессия протективного p-NF-kB в очаге возбуждения, значительный рост содержания caspase-9 на фоне высокого содержания провоспалительного TNF-α и экспрессии рецептора FAS под влиянием p53. Можно сделать вывод, что в этой зоне протекает процесс нейровоспаления, приводящий к апоптозу по внешнему (рецепторному) и митохондриальному пути, среди которых внешний преобладает. В перифокальной зоне также наблюдалась экспрессия проапоптотических белков, но менее интенсивно, при этом в данной области не отмечена активация протекторных механизмов по NF-kB пути. Таким образом, активное нейровоспаление в эпилептическом очаге и перифокальной зоне височной доли, а также дисбаланс антиапоптотической системы в перифокальной области способствуют прогрессированию дегенерации в очаге гипервозбудимости и прогрессированию эпилептической энцефалопатии, и могут быть причиной развития терапевтической резистентности.
Список литературы
Громов СА, Сивакова НА (2019) Современные аспекты разрешения эпилепсии. Эпилепсия и пароксизмальные состояния 11: 21–26. [Gromov S.A., Sivakova N.A. (2019) Resolved epilepsy: an updated insight. Epilepsiya i paroksizmal’nye sostoyaniya / Epilepsy and paroxysmal conditions 11: 21–26 (In Russ)]. https://doi.org/10.17749/2077-8333.2019.11.1.21-26
Chen Z, Brodie MJ, Liew D, Kwan P (2018) Treatment outcomes in patients with newly diagnosed epilepsy treated with established and new antiepileptic drugs: A 30-year longitudinal cohort study. JAMA Neurology 75: 279–286. https://doi.org/10.1001/jamaneurol.2017.3949
Lotfinia M, Maloumeh EN, Asaadi S, Omidbeigi M, Sharifi G, Asadi B (2019) Health-related quality of life after epilepsy surgery: A prospective, controlled follow-up on the Iranian population. Scientific reports 9: 7875. https://doi.org//10.1038/s41598-019-44442-6
Hader WJ, Tellez-Zenteno J, Metcalfe A, Hernandez-Ronquillo L, Wiebe S, Kwon C-S, Jette N (2013) Complications of epilepsy surgery: A systematic review of focal surgical resections and invasive EEG monitoring. Epilepsia 54: 840–847. https://doi.org/10.1111/epi.12161
Younus I, Reddy DS (2017) Epigenetic interventions for epileptogenesis: A new frontier for curing epilepsy. Pharmacology & Therapeutics 177: 108–122. https://doi.org/10.1016/j.pharmthera.2017.03.002
Sharma S, Puttachary S, Thippeswamy T (2019) Glial source of nitric oxide in epileptogenesis: A target for disease modification in epilepsy. Journal of neuroscience research 97: 1363–1377. https://doi.org//10.1002/jnr.24205
Zavala-Tecuapetla C, Cuellar-Herrera M, Luna-Munguia H (2020) Insights into Potential Targets for Therapeutic Intervention in Epilepsy. International journal of molecular sciences 21: 8573. https://doi.org/10.3390/ijms21228573
Löscher W, Friedman A (2020) Structural, Molecular, and Functional Alterations of the Blood-Brain Barrier during Epileptogenesis and Epilepsy: A Cause, Consequence, or Both? International journal of molecular sciences 21: 591. https://doi.org/10.3390/ijms21020591
Aronica E, Bauer S, Bozzi Y, Caleo M, Dingledine R, Gorter JA, Henshall DC, Kaufer D, Koh S, Löscher W, Louboutin JP, Mishto M, Norwood BA, Palma E, Poulter MO, Terrone G, Vezzani A, Kaminski RM (2017) Neuroinflammatory targets and treatments for epilepsy validated in experimental models. Epilepsia 58: 27–38. https://doi.org/10.1111/epi.13783
Соколова ТВ, Забродская ЮМ, Парамонова НМ, Доброгорская ЛН, Куралбаев АК, Касумов ВР, Ситовская ДА (2017) Апоптоз клеток головного мозга в эпилептических очагах при фармакорезистентной височной эпилепсии. Трансляционная медицина 4: 22–33. [Sokolova TV, Zabrodskaya YM, Paramono-va NM, Dobrogorskaya LN, Kuralbaev AK, Kasu-mov VR, Sitovskaya DА (2017) Apoptosis of brain cells in epileptic focus at phapmacresistant temporal lobe epilepsy. Translational Medicine 4: 22–33. (In Russ.)]. https://doi.org/10.18705/2311-4495-2017-4-6-22-33
Fuller OK, Whitham M, Mathivanan S, Febbraio MA (2020) The Protective Effect of Exercise in Neurodegenerative Diseases: The Potential Role of Extracellular Vesicles. Cells 9: 2182. https://doi.org/10.3390/cells9102182
Yamanaka G, Morichi S, Takamatsu T, Watanabe Y, Suzuki S, Ishida Y, Oana S, Yamazaki T, Takata F, Kawashima H (2021) Links between Immune Cells from the Periphery and the Brain in the Pathogenesis of Epilepsy: A Narrative Review. International journal of molecular sciences 22: 4395. https://doi.org/10.3390/ijms22094395
Sah E, Krishnamurthy S, Ahmidouch MY, Gillispie GJ, Milligan C, Orr ME (2021) The Cellular Senescence Stress Response in Post-Mitotic Brain Cells: Cell Survival at the Expense of Tissue Degeneration. Life 11: 229. https://doi.org/10.3390/life11030229
Spanoghe J, Larsen LE, Craey E, Manzella S, Van Dycke A, Boon P, Raedt R (2020) The Signaling Pathways Involved in the Anticonvulsive Effects of the Adenosine A1 Receptor. International journal of molecular sciences 22: 320. https://doi.org/10.3390/ijms22010320
Bacher S, Meier-Soelch J, Kracht M, Schmitz ML (2021) Regulation of Transcription Factor NF-κB in Its Natural Habitat: The Nucleus. Cells. 10: 753. https://doi.org/10.3390/cells10040753
Jung YJ, Tweedie D, Scerba MT, Kim DS, Palmas MF, Pisanu A, Carta A.R., Greig N.H. (2021) Repurposing Immunomodulatory Imide Drugs (IMiDs) in Neuropsychiatric and Neurodegenerative Disorders. Front Neurosci. 15: 656921. https://doi.org/10.3389/fnins.2021.656921
Li G, Yamasaki R, Fang M, Masaki K, Ochi H, Matsushita T, Kira JI (2018) Novel disease-modifying anti-rheumatic drug iguratimod suppresses chronic experimental autoimmune encephalomyelitis by down-regulating activation of macrophages/microglia through an NF-κB pathway. Sci Rep. 8: 1933. https://doi.org/0.1038/s41598-018-20390-5
Mao X-Y, Zhou H-H, Jin W-L (2019) Redox-Related Neuronal Death and Crosstalk as Drug Targets: Focus on Epilepsy. Frontiers in Neuroscience 13: 512. https://doi.org/10.3389/fnins.2019.00512
Benusa SD, Lafrenaye AD (2020) Microglial process convergence on axonal segments in health and disease. Neuroimmunol Neuroinflamm. 7: 23–39. https://doi.org/10.20517/2347-8659.2019.28
Rana A, Musto AE (2018) The role of inflammation in the development of epilepsy. Journal of Neuroinflammation 15: 144. https://doi.org/10.1186/s12974-018-1192-7
Mancini A, Ghiglieri V, Parnetti L, Calabresi P, Di Filippo M (2021) Neuro-Immune Cross-Talk in the Striatum: From Basal Ganglia Physiology to Circuit Dysfunction. Front Immunology 12: 644294. https://doi.org/10.3389/fimmu.2021.644294
Rocha NKR, Themoteo R, Brentani H, Forlenza OV, De Paula VJR (2020) Neuronal-Glial Interaction in a Triple-Transgenic Mouse Model of Alzheimer’s Disease: Gene Ontology and Lithium Pathways. Front Neurosci. 14: 579984. https://doi.org/10.3389/fnins.2020.579984
Zheng P, Chen Q, Tian X, Qian N, Chai P, Liu B, Hu J, Blackstone C, Zhu D, Teng J, Chen, J (2018) DNA damage triggers tubular endoplasmic reticulum extension to promote apoptosis by facilitating ER-mitochondria signaling. Cell Research 28: 833–854. https://doi.org/10.1038/s41422-018-0065-z
Pérez-Figueroa E, Álvarez-Carrasco P, Ortega E, Maldonado-Bernal C (2021) Neutrophils: Many Ways to Die. Front Immunology 12: 631821. https://doi.org/10.3389/fimmu.2021.631821
Yu H, Lin L, Zhang Z, Zhang H, Hu H (2020) Targeting NF-κB pathway for the therapy of diseases: mechanism and clinical study. Signal Transduct Target Therapy 5: 209. https://doi.org/10.1038/s41392-020-00312-6
Liang J, Luan Y, Lu B, Zhang H, Luo YN, Ge P (2014) Protection of ischemic postconditioning against neuronal apoptosis induced by transient focal ischemia is associated with attenuation of NF-κB/p65 activation. PLoS One 9: e96734. https://doi.org/10.1371/journal.pone.0096734
Aubrey BJ, Kelly GL, Janic A, Herold MJ, Strasser A (2017) How does p53 induce apoptosis and how does this relate to p53-mediated tumour suppression? Cell Death and Differentiation 25: 104–113. https://doi.org/10.1038/cdd.2017.169
Simabuco FM, Morale MG, Pavan ICB, Morelli AP, Silva FR, Tamura RE (2018) p53 and metabolism: from mechanism to therapeutics. Oncotarget 9: 23780–23823. https://doi.org/10.18632/oncotarget.25267
Sazhina TA, Sitovskaya DA, Zabrodskaya YM, Bazhanova ED (2020) Functional Imbalance of Glutamate- and GABAergic Neuronal Systems in the Pathogenesis of Focal Drug-Resistant Epilepsy in Humans. Bulletin of Experimental Biology and Medicine 168: 519–522. https://doi.org/10.1007/s10517-020-04747-3
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


