Журнал эволюционной биохимии и физиологии, 2021, T. 57, № 5, стр. 430-441
ПРОФИЛАКТИЧЕСКОЕ ВВЕДЕНИЕ БЕЛКА ТЕПЛОВОГО ШОКА HSP70 ОСЛАБЛЯЕТ ЛИХОРАДОЧНУЮ РЕАКЦИЮ ПРИ ЭНДОТОКСЕМИИ У ГОЛУБЕЙ (COLUMBA LIVIA) И КРЫС
К. В. Лапшина 1, *, И. В. Гужова 2, И. В. Екимова 1
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
2 Институт цитологии РАН
Санкт-Петербург, Россия
* E-mail: ksenia.lapshina@gmail.com
Поступила в редакцию 28.04.2021
После доработки 17.06.2021
Принята к публикации 23.06.2021
Аннотация
Известно, что стресс-индуцибельный белок теплового шока 70 кДа (Heat shock protein 70, Hsp70) способен оказывать защитный эффект при эндотоксемии и сепсисе благодаря способности взаимодействовать с рецепторами иммунокомпетентных клеток и модулировать иммунный ответ. Однако остается не известным, способен ли Hsp70 ослабить лихорадочную реакцию, характерную для эндотоксемии. Нами было выполнено сравнительно-физиологическое исследование, в ходе которого у голубей и крыс с предварительно вживленными электродами и термисторами для регистрации показателей терморегуляции (температуры мозга, периферической вазомоторной реакции, сократительной активности мышц) были изучены эффекты профилактического введения рекомбинантного Hsp70 человека (HSPA1A) при эндотоксемии, вызванной введением липополисахарида (ЛПС), а также проанализировано изменение числа лейкоцитов у крыс в тех же условиях. Установлено, что профилактическое введение Hsp70 уменьшает величину ЛПС-индуцированного лихорадочного ответа у голубей и крыс и ускоряет нормализацию числа лейкоцитов в крови у крыс. Полученные данные свидетельствуют об универсальности физиологических механизмов реализации защитных свойств Hsp70 у данных представителей теплокровных животных.
Эндотоксемия – состояние, вызываемое увеличением уровня эндотоксина грамотрицательных бактерий липополисахарида (ЛПС) в крови. В первую очередь ЛПС влияет на функции иммунокомпетентных клеток и клеток эндотелия сосудов, приводя к активации иммунной системы, усилению синтеза провоспалительных цитокинов, развитию фебрильной реакции (лихорадки), изменениям в функционировании нервной, эндокринной и др. систем организма [1–3]. Лихорадка является древним защитно-приспособительным механизмом, характерным для эктотермных и эндотермных позвоночных, и направленным на обеспечение оптимальных условий для функционирования иммунной системы и элиминации патогена [2, 4]. У эктотермных животных при развитии иммунного ответа наблюдается поведенческая лихорадка – для повышения температуры тела они стараются выбирать более теплое место [2, 4]. У эндотермных животных (млекопитающих и птиц) регулируемое повышение температуры тела при действии ЛПС или других патогенов происходит благодаря ограничению теплоотдачи за счет периферической вазоконстрикции и усилению сократительного и несократительного термогенеза [5–8]. Следует отметить, что при изучении изменений терморегуляции при эндотоксемии и других состояниях, сопровождаемых лихорадкой, основное внимание уделяется оценке температуры тела, тогда как изучению температуры мозга (Тм) посвящено существенно меньше исследований. Ряд данных литературы свидетельствует о том, что повышение Тм при гипертермии и ЛПС-индуцированной эндотоксемии может усиливать проницаемость гемато-энцефалического барьера, влиять на активность нейронов и метаболизм головного мозга, способствовать усилению продукции бета-амилоида [9–13]. Предполагается, что повышение Тм является особенно критичным для пациентов с черепно-мозговыми травмами, ишемическими и геморрагическими инсультами, маленьких детей со склонностью к фебрильным судорогам [14, 15]. Такой сценарий может быть опасен и для септических пациентов при развитии хронической фебрильной реакции, например, при повышении в крови количества ЛПС и наличии бактериемии, или при развитии “цитокинового шторма” и вирусного сепсиса, наблюдающегося в тяжелых случаях при заражении SARS-coV-2 [16, 17].
Имеющиеся данные литературы свидетельствуют о том, что ЛПС-индуцированная эндотоксемия вызывает у представителей различных групп животных (млекопитающих, птиц, рыб, иглокожих) усиление экспрессии стресс-индуцируемого белка теплового шока с молекулярной массой 70 кДа (Heat shock proteins, HSP70) в различных тканях [18–22]. Hsp70 относится к эволюционно-древней системе шаперонов, оказывающей защитный эффект на клеточном и организменном уровнях при действии различных стрессорных факторов и характеризующейся чрезвычайно консервативной структурой [23]. Известно, что Hsp70 способен выходить в системный кровоток и модулировать активность иммунокомпетентных клеток, однако механизмы его взаимодействия с различными типами клеток до сих пор окончательно не изучены. Считалось, что внеклеточный Hsp70, получивший название “шаперокин”, может выполнять функцию “сигнала опасности” за счет взаимодействия с различными рецепторами моноцитов/макрофагов, дендритных клеток и нейтрофилов (Toll-подобными рецепторами (Toll-like receptors, TLR 2,4), CD91, CD40, Lox-1 и др.), вызывая выработку провоспалительных цитокинов и NO, а также участвуя в презентации антигена [24–27]. Внутривенное введение экзогенного Hsp70 способствует уменьшению смертности при сепсисе, корректирует некоторые показатели гемодинамики и свертываемости, нормализует уровень билирубина и креатинина, в экспериментах in vitro снижает продукцию NO макрофагами, уменьшает продукцию активных форм кислорода и частично нормализует апоптоз нейтрофилов в модели эндотоксинового сепсиса [28–31]. Приведенные выше данные свидетельствуют о способности экзогенного Hsp70 влиять на показатели иммунного ответа и оказывать защитный эффект в моделях сепсиса, однако не позволяют сделать вывод о том, происходит ли при этом коррекция характерных для действия ЛПС изменений температуры тела, периферической вазомоторной реакции, сократительного термогенеза. Исследований, направленных на изучение влияния экзогенного Hsp70 на показатели терморегуляции при лихорадочной реакции, до сих пор не проводилось. Ранее было показано, что экзогенный Hsp70, введенный в ликворную систему головного мозга, способен вызывать снижение Тм, сократительного термогенеза и частоты сердечных сокращений у голубей в контрольных условиях [32, 33]. Эти изменения были сопряжены с увеличением длительности эпизодов и общего времени медленного сна, обладающего антистрессовой функцией. Эти данные явились обоснованием для исследования эффектов экзогенного Hsp70 на терморегуляторные показатели лихорадочного ответа и показатели системного воспаления (лейкоцитоз) в модели эндотоксемии у представителей животных класса птиц (голуби Columba Livia) и млекопитающих (крысы популяции Вистар).
Проведение сравнительно-физиологического исследования эффектов Hsp70 при эндотоксемии позволит выяснить вклад стресс-индуцируемого белка Hsp70 в механизмы регуляции лихорадочного ответа при эндотоксемии, а также выявить общие и специфические закономерности в проявлении возможных защитных эффектов Hsp70 при действии бактериальных эндотоксинов.
Задачей данного исследования явилось проведение сравнительного анализа эффектов экзогенного Hsp70 на показатели лихорадочной реакции (Тм, периферическую вазомоторную реакцию, сократительную активность мышц (САМ), и число лейкоцитов) при ЛПС-индуцированной эндотоксемии у голубей Columba Livia и крыс популяции Вистар.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Животные. Электрофизиологические опыты выполнены на взрослых голубях Columba livia обоего пола и массой 350–420 г и самцах крыс популяции Вистар массой 280–320 г. Исследование числа лейкоцитов выполнено на самцах крыс популяции Вистар той же массы и возраста. Животных, предназначенных для проведения электрофизиологических экспериментов, за 7–10 дней до хирургической операции помещали в изолированную от звуковых и световых раздражителей экспериментальную камеру для адаптации к условиям содержания (фотопериоду (свет–темнота 12 : 12 ч) и температурному режиму (23 ± 1°С). Во время эксперимента животные находились в прозрачной клетке из органического стекла. Распределение голубей в экспериментальные группы происходило с помощью простой рандомизации. Распределение крыс осуществлялось на основе стратифицированной рандомизации с использованием теста “открытое поле” и оценки реакции на хэндлинг. В ходе тестирования были отобраны и распределены по экспериментальным группам животные, продемонстрировавшие высокую исследовательскую активность и низкую тревожность.
Для голубей неактивной фазой суток является темная, а для крыс – светлая. Эксперименты на голубях начинали за 4 ч до наступления темной фазы суток, на крысах – в начале светлой фазы суток. Крыс, предназначенных для изучения числа лейкоцитов, содержали в виварии при температуре 23 ± 1°С. Вода и пища были доступны без ограничений. Все манипуляции с животными проводили в соответствии с требованиями Базельской декларации и протокола, утвержденного этическим комитетом ИЭФБ РАН, находящимся в соответствии с национальными и международными требованиями.
Препараты. Для индукции эндотоксемии у голубей и крыс применяли эндотоксин ЛПС (Escherichia Coli 0111:B4, Sigma Aldrich, USA). ЛПС растворяли в апирогенном 0.9% изотоническом физиологическом растворе (физ. р-ре) и вводили внутривенно (в/в) в дозе 100 мкг/кг и в объеме не более 0.2 мл.
Очищенный рекомбинантный белок теплового шока Hsp70 (HSPA1A) человека был получен из экстракта E. coli, трансформированных плазмидой pMSHsp70. Hsp70 выделяли методом ионно-обменной хроматографии с применением DEAE-Sepharose (GE Healthcare) с последующей АТФ-аффинной хроматографией с применением АТФ-агарозы (Sigma, США). Далее при помощи геля полимиксина-В (Sigma, США) удаляли примесь бактериального эндотоксина ЛПС. Оценку количества ЛПС в растворе очищенного белка проводили с помощью теста LALA E-Toxate (Sigma Aldrich, США). Конечный раствор белка Hsp70 содержал менее 0.5 EU/мг ЛПС [34, 35]. Полученный препарат растворяли в физ. р-ре и вводили животным (в/в) за 15 мин до введения ЛПС или контрольного раствора в дозе 85 мкг/кг и в объеме не более 0.1 мл.
Для исключения влияния на результаты экспериментов примеси контаминантов в препарате Hsp70, основным из которых является ЛПС, была выполнена серия опытов с применением термоденатурированного Hsp70 (Hsp70ден) в той же дозе. Для этого Hsp70 нагревали на водяной бане до 100оС в течение 5 мин.
В качестве контрольного раствора животным вводили физ. р-р, использовавшийся как растворитель для препаратов ЛПС, Hsp70 и Hsp70ден. Физ. р-р вводили в объеме 0.1 и 0.2 мл в качестве контроля к Hsp70 и ЛПС соответственно.
Дизайн эксперимента. Для того чтобы изучить и сравнить влияние Hsp70 на ЛПС-индуцированные изменения показателей терморегуляции, на голубях (n = 6) и крысах (n = 6) были выполнены следующие серии исследований с внутривенным (в/в) введением препаратов в вышеуказанных дозах:
1) контрольная группа, введение (в/в) физ. р-ра дважды с интервалом 15 мин;
2) введение физ. р-ра (в/в) за 15 мин до ЛПС (в/в);
3) введение Hsp70 (в/в) за 15 мин до физ. р-ра (в/в);
4) введение Hsp70 (в/в) за 15 мин до ЛПС (в/в).
Для того чтобы исключить влияние остаточной контаминации (ЛПС) в препарате Hsp70 на физиологические показатели при эндотоксемии, на другой группе голубей (n = 5) и крыс (n = 5) было выполнены серии экспериментов с применением Hsp70ден в той же дозе.
Для изучения числа лейкоцитов у крыс брали кровь из хвостовой вены через 1 ч и через 5 ч после введения контрольных растворов, препаратов Hsp70, ЛПС или профилактического введения препаратов Hsp70 до ЛПС. Препараты вводили в той же дозировке и в том же объеме, как и в случае изучения электрофизиологических показателей.
Данная серия экспериментов включала следующие группы:
1) контрольная группа, введение (в/в) физ. р-ра дважды с интервалом 15 мин (n = 8);
2) введение физ. р-ра (в/в) за 15 мин до ЛПС (n = 8);
3) введение Hsp70 (в/в) за 15 мин до физ. р-ра (n = 8);
4)введение Hsp70 (в/в) за 15 минут до ЛПС (в/в) (n = 8);
5) введение Hsp70ден (в/в) за 15 мин до физ. р-ра (n = 6);
6) введение Hsp70ден (в/в) за 15 минут до ЛПС (в/в) (n = 6).
Хирургические манипуляции. Хирургические операции проводили под общим наркозом с использованием золетил-100 (tiletamine hydrochloride and zolazepam; Virbac, Carros, France). Голубям вводили 55 мг/кг внутримышечно, крысам – 85 мг/кг.
Изменения Тм и температуры кожных покровов (Ткп) оценивали с помощью минитермисторов (BetaTherm cat 2K7 MCD1, диаметром 0.46 мм, сопротивлением 1.5 кОм, США). Минитермистор, предназначенный для измерения Тм, у голубей устанавливали над областью гипоталамуса согласно координатам: 9 мм ростральнее нулевой точки, 2 мм латерально от средней линии и 6 мм ниже поверхности черепа [36]. Крысам минитермистор вживляли по следующим координатам: 0.5 мм каудальнее брегмы, 2.5 мм латерально от средней линии и 5 мм ниже поверхности черепа [37]. Минитермистор для регистрации Тм и у голубей, и у крыс закрепляли на поверхности черепа с помощью самоотвердевающей пластмассы “Акродент” (Стома, Украина). Минитермисторы, регистрирующие Ткп (для оценки периферической вазомоторной реакции), фиксировали на неоперенной части ноги у голубей и в основании хвоста у крыс. Для регистрации электромиограммы (ЭМГ) вживляли крючкообразные позолоченные электроды в грудную мышцу голубям и в шейную мышцу крысам. Провода от минитермисторов и электродов проводились под кожей до места прикрепления разъема. У голубей все провода от вживленных электродов и минитермисторов протягивались под кожей и подключались к микросхеме – “рюкзачку” (15 г), надетому на спину голубю. У крыс разъемы для подключения кабеля устанавливали на голове и фиксировали с помощью “Акродент”. Провода от электродов, регистрирующих ЭМГ и Ткп, также проводили под кожей и подключали к общему разъему. Сигналы от “рюкзачка” или разъема на голове переключались на кабель, идущий к предварительному усилителю, и затем через блок аналоговой обработки и оцифровки поступали на компьютер для архивирования и обработки. Наличие подвижного коммутатора предотвращало перекручивание проводов и позволяло животным свободно передвигаться. Эксперименты начинали после полного восстановления животных после операции (через 12–14 дней).
Обработка сигнала. Регистрацию комплекса электрофизиологических данных у голубей проводили в течение 24 ч, у крыс – в течение 12 ч. Для регистрации и анализа электрофизиологических параметров использовали оригинальную компьютерную систему SASR–8800 (США) [38]. Первичное усиление сигналов (в 100 раз) осуществлялось в предусилителе. Далее сигналы поступали в блок аналоговой обработки для дальнейшего усиления. Для этого использовался аналого-цифровой преобразователь с 8 аналоговыми входами, диапазоном входного напряжения ±5 В, уровнем шумов – 0.01%. Микрокомпьютер отбирал каждый сигнал 120 раз в секунду с помощью моделирующей системы АЦП емкостью 12 бит. Полномасштабный диапазон для электродов был равен ±1 мВ. Частотный диапазон для ЭМГ составлял 60–1000 Гц, сигналы ЭМГ усреднялись таким образом, чтобы выдавать 10 измерений в секунду. Все полученные средние величины сохранялись как двоичные целые числа с определенным знаком и с разрешением 0.25 мВ. [38]. Экспериментальная установка и компьютерные программы позволяли измерять температуры с точностью до 0.01 С. Повышение точности измерения температуры определялось тщательным построением калибровочной кривой. Калибровка термисторов производилась в широком диапазоне температур и каждая из температурных точек получалась путем усреднения 10 измерений за секунду.
Обработку электрофизиологических данных проводили с помощью комплекса программ, разработанных ранее сотрудником университета Таллахасси (США) D. Ross [38] и сотрудником ИЭФБ РАН А.Л. Зиминым. В наших экспериментах вычислялась средняя Тм и Ткп за 30 мин. Для оценки уровня САМ производилась обработка ЭМГ, амплитуда которой пропорциональна степени напряжения мышцы и расстоянию между отводящими электродами. С помощью программного обеспечения вычислялась средняя интегрированная ЭМГ грудной мышцы за 1 ч.
Подсчет числа лейкоцитов. Определение суммарного пула циркулирующих в крови лейкоцитов осуществляли с использованием стандартной методики подсчета в камере Горяева. Для визуализации ядер лейкоцитов применяли 3% раствор уксусной кислоты, окрашенной метиленовым синим. Для подсчета числа лейкоцитов кровь разводили в 10 раз.
Методы статистической обработки результатов. Для статистической обработки данных и подготовки иллюстраций применяли программу GraphPad Prizm 8. Для проверки нормальности распределения использовали критерий Шапиро–Уилка. Анализ изменений Тм, Ткп и САМ проводили с помощью дисперсионного анализа с повторными измерениями RM (repeated measures)-ANOVA. Для обработки числа лейкоцитов применяли one-way ANOVA для независимых выборок (с использованием post-hoc анализа с помощью критерия Тьюки). Данные на рисунках представлены как среднее ± стандартная ошибка среднего (M ± SEM).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Влияние Hsp70 на показатели терморегуляции при эндотоксемии у голубей и крыс
Проведенное исследование показало, что внутривенное введение препарата Hsp70 ни у голубей, ни у крыс не вызывало изменений Тм, периферической вазомоторной реакции и САМ по сравнению с контролем (рис. 1).
Рис. 1.
Влияние препарата Hsp70 на показатели терморегуляции при эндотоксемии у голубей (a–c) и крыс (d–f). На рисунках (a), (b), (d) и (f) представлены изменения температуры мозга (Tbr) и температуры кожных покровов (Tsk). По оси ординат представлены значения температур мозга и кожных покровов в контроле (saline+saline), при введении Hsp70 (Hsp70 + saline), ЛПС (saline + LPS) и при профилактическом введении Hsp70 до начала эндотоксемии (Hsp70 + + LPS), по оси абсцисс – время в часах. Для (a) F(3,20)=19.20, p < 0.0001; (b) F(3,20) = 3.855, p = 0.0251; (d) F(3,20) = = 7.398, p = 0.0016; (e) F(3,20) = 5855, p = 0.0026. На рисунках (с) и (f) представлено изменение уровня сократительной активности (CMA) у голубей и крыс при тех же воздействиях относительно контрольного уровня. Для (c) F(2,15) = 314.3, p < 0.0001; для (f) F(2,15) = 334.3, p < 0.0001. ap < 0.05 достоверность отличий эффектов ЛПС по сравнению с контролем; bp < 0.05 достоверность отличий эффектов профилактического введения Hsp70 до ЛПС по сравнению с контролем; cp<0.05 достоверность отличий эффектов ЛПС по сравнению с действием профилактического введения Hsp70 до ЛПС .
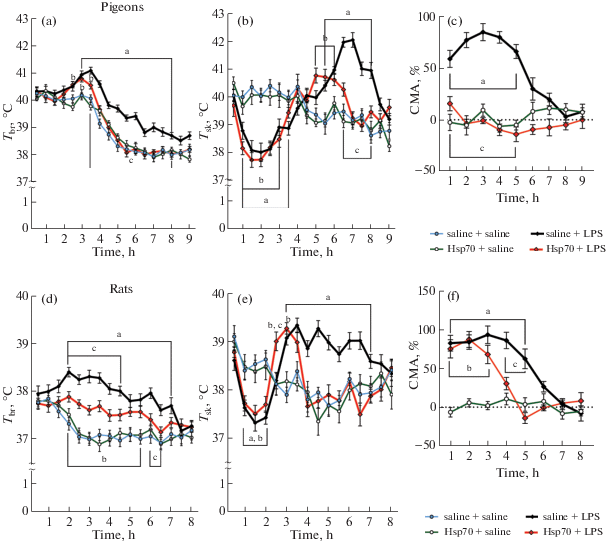
Введение ЛПС вызывало у голубей развитие лихорадки, что проявлялось повышением Тм по сравнению с контролем в период с 3-го по 8-й ч в среднем на 1.00 ± 0.10°С (р < 0.05) (рис. 1a). В течение первых 3.5 ч выявлено снижение Tкп в среднем на 1.7 ± ± 0.2°С (р < 0.05), свидетельствовавшее о развитии вазоконстрикции, приводящей к ограничению теплоотдачи и способствующей повышению Тм (рис. 1b). Через 5.5 ч после введения ЛПС происходило повышение Ткн в среднем на 1.9 ± 0.2°С (р < 0.05), что свидетельствовало о том, что вазоконстрикция сменялась на вазодилатацию, способствующую усилению теплоотдачи. Кроме того, повышение Тм при эндотоксемии сопровождалось увеличением САМ в среднем на 73% (р < 0.05) по сравнению с контрольным уровнем, что свидетельствовало об усилении теплопродукции (рис. 1с).
В конце активной фазы суток Тм у крыс в среднем на 2 °С ниже, чем у голубей (рис. 1 d). При введении ЛПС у крыс повышение Тм (в среднем на 1.1 ± 0.08°С (р < 0.05)) начиналось на 1 ч раньше, чем у голубей, и сохранялось в течение последующих 5 ч (рис. 1d). Повышение Тм сопровождалось схожим по динамике изменением Ткп, однако период развития вазоконстрикции у крыс был менее продолжительным, чем у голубей (в течение 2-го часа), а период вазодилатации – наоборот, более длительным (с 3-го по 7-й час) (рис. 1e). Как и у голубей, у крыс при действии ЛПС наблюдалось усиление САМ на 82% (р < 0.05), способствовавшее повышению теплопродукции (рис. 1f).
Профилактическое введение Hsp70 голубям ослабляло ЛПС-индуцированную лихорадку – повышение Тм в среднем 0.52 ± 0.06°С (р < 0.05)) наблюдалось лишь в течение 1 ч (рис. 1a). Применение Hsp70 не предотвращало развитие периферической вазоконстрикции у голубей, но приводило к сокращению продолжительности периода вазодилатации (рис. 1b). Кроме того, Hsp70 полностью устранял ЛПС-индуцируемое усиление САМ, что могло способствовать уменьшению теплопродукции и выраженности лихорадочной реакции (рис. 1c).
У крыс профилактическое применение Hsp70 в условиях эндотоксемии приводило к уменьшению величины повышения температуры мозга с 1.1 ± 0.08°С (р < 0.05) до 0.56 ± 0.05°С (р < 0.05) (рис. 1d), однако период повышения Тм у крыс сохранялся на 2.5 ч дольше, чем у голубей (рис. 1d). Применение Hsp70 не устраняло развитие характерной для действия ЛПС периферической вазоконстрикции, однако продолжительность периода вазодилатации уменьшалась (рис. 1e). У крыс, в отличие от голубей, применение Hsp70 не предотвращало развитие ЛПС-индуцируемого усиления САМ, но способствовало сокращению периода повышения этого показателя по сравнению с действием одного ЛПС (рис. 1f).
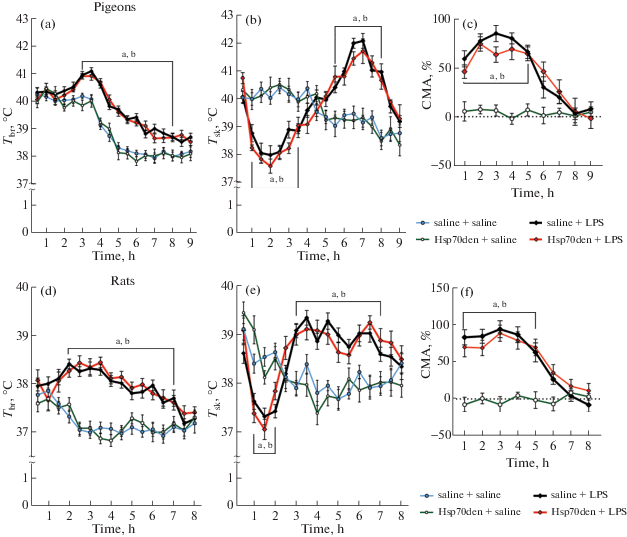
Несмотря на то что препарат Hsp70 после выделения проходил очистку от эндотоксина с помощью полимиксина-B, необходимо было выполнить проверку на наличие остаточной примеси ЛПС, которая могла бы повлиять на результат экспериментов. Известно, что ЛПС устойчив к действию высоких температур, и для исключения возможности его влияния на результат исследования была выполнена дополнительная серия опытов с применением препарата Hsp70ден. Данный препарат был подвергнут нагреванию, которое вызывало денатурацию и потерю активности Hsp70, но не влияло бы на свойства возможной примеси ЛПС. Выполненные нами эксперименты показали, что введение (в/в) Hsp70ден не оказывало влияния на характерные для эндотоксемии изменения показателей терморегуляции (рис. 2f). Эти данные свидетельствуют о том, что ослабление лихорадки у голубей и крыс при профилактическом введении Hsp70 являлось собственным эффектом препарата.
Рис. 2.
Влияние Hsp70ден на показатели терморегуляции при эндотоксемии у голубей (a–c) и крыс (d–f). На рисунках (a), (b), (d) и (e) представлены изменения температуры мозга (Tbr) и температуры кожных покровов (Tsk). По оси ординат представлены значения температур мозга и кожных покровов в контроле (saline+saline), при введении термоденатурированного Hsp70 (Hsp70den+saline), ЛПС (saline+LPS) и при профилактическом введении термоденатурированного Hsp70 до начала эндотоксемии (Hsp70den+LPS). По оси абсцисс – время в часах. Для (a) F(3,16)=18.14, p < 0.0001; (b) F(3,16) = 8.42, p = 0.0014; (d) F(3,16) = 10.32, p = 0.0005; (e) F(3,16) = 8.44, p = 0.0014. На рисунках (с) и (f) представлено изменение уровня сократительной активности (CMA) у голубей и крыс при тех же воздействиях относительно контрольного уровня. Для (c) F(2,12)=210.1, p < 0.0001; (f) F(2,12)=323.9, p < 0.0001. ap < 0.05 достоверность отличий эффектов ЛПС по сравнению с контролем; bp<0.05 достоверность отличий эффектов профилактического введения термоденатурированного Hsp70 до ЛПС по сравнению с контролем.
Влияние Hsp70 на число лейкоцитов при эндотоксемии у крыс
Многочисленные исследования свидетельствуют о способности Hsp70 модулировать функционирование иммунокомпетентных клеток, однако в наших экспериментах было показано, что внутривенное введение экзогенного Hsp70 не вызывает значимых изменений числа лейкоцитов ни через 1 ч, ни через 5 ч после инъекции (рис. 3a). Введение ЛПС вызывало у крыс увеличение количества лейкоцитов на 56% и 58% через 1 ч и через 5 ч соответственно (рис. 3a). При профилактическом введении Hsp70 через 1 ч наблюдалось уменьшение числа лейкоцитов по сравнению с действием одного ЛПС. Через 5 ч значения этого показателя достигали контрольного уровня (рис. 3a).
Рис. 3.
Влияние Hsp70 и Hsp70ден на число лейкоцитов у крыс через 1 ч и через 5 ч после начала эндотоксемии. На рис. (a) представлены изменения числа лейкоцитов в контроле (saline+saline), при введении Hsp70 (Hsp70+saline), ЛПС (saline+LPS) и при профилактическом введении Hsp70 до начала эндотоксемии (Hsp70+LPS), на рисунке (b) – в контроле (saline+saline), при введении термоденатурированного Hsp70 (Hsp70den+saline), ЛПС (saline+LPS) и при профилактическом введении термоденатурированного Hsp70 до начала эндотоксемии (Hsp70den+LPS). На рисунке (а) F(3,28) = 38.4, p < 0.0001 (через 1 ч), F(3,28) = 70.11, p < 0.0001 (через 5 ч), на рисунке (b) F(3,26) = 48.2, p < 0.0001 (через 1 ч), F(3,26) = 50.1, p < 0.0001 (через 5 ч). ap < 0.05 – достоверность отличий эффектов ЛПС по сравнению с контролем; bp < 0.05 – достоверность отличий эффектов профилактического введения Hsp70 или Hsp70den до ЛПС по сравнению с контролем; cp < 0.05 – достоверность отличий эффектов ЛПС по сравнению с действием профилактического введения Hsp70 или Hsp70den до ЛПС.
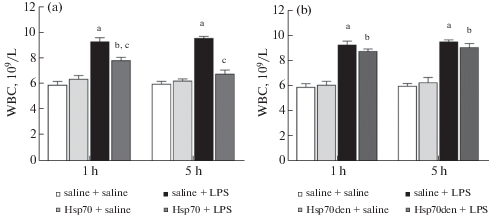
Наши эксперименты показали, что применение препарата Hsp70ден не вызывало изменения числа лейкоцитов, а введение Hsp70ден до индукции эндотоксемии не корректировало характерный для действия ЛПС лейкоцитоз (рис. 3b). Эти данные подтверждают, что обнаруженная нами способность Hsp70 ослаблять ЛПС-индуцированный лейкоцитоз является собственным свойством экзогенного Hsp70.
ОБСУЖДЕНИЕ
Эндотоксин ЛПС является широко применяемым препаратом для создания модели эндотоксемии и изучения изменений различных показателей терморегуляции. Проведенное нами исследование показало, что введение ЛПС и у голубей, и у крыс вызывало повышение Тм, сопровождавшееся развитием вазоконстрикции и повышением уровня САМ. Вазоконстрикция является периферической сосудистой реакцией, направленной на ограничение теплоотдачи, и способствующей повышению Тм. Усиление САМ при эндотоксемии является механизмом, направленным на увеличение теплопродукции и способствует повышению температуры тела [6, 8]. Последующее развитие вазодилатации, наблюдаемое и у голубей, и у крыс, по-видимому, могло являться механизмом, ограничивающим дальнейшее повышение Тм. Таким образом, в нашем исследовании развитие эндотоксемии у голубей и крыс характеризовалось схожими изменениями показателей терморегуляции, что свидетельствует об общности терморегуляторных механизмов реакции на эндотоксин у голубей и крыс. Отличия в реакции голубей и крыс на ЛПС состояли в том, что у крыс фебрильный ответ развивался раньше, чем у голубей. Кроме того, период повышения Тм, а также периоды вазоконстрикции и вазодилатации имели различную продолжительность.
В нашем исследовании впервые выполнено сравнительно-физиологическое исследование влияния экзогенного Hsp70 на развитие лихорадочной реакции у представителей двух классов позвоночных животных. Наши эксперименты показали, что у голубей введение Hsp70 уменьшало прирост Тм и значительно ускоряло возвращение температуры мозга к контрольным значениям. У крыс, в отличие от голубей, Hsp70 ослаблял величину лихорадочного ответа, но повышение Тм сохранялось дольше, чем у голубей. И у голубей, и у крыс сохранялась периферическая вазоконстрикция, однако следующая за ней фаза вазодилатации была менее выражена, что, вероятно, может быть связано с ослаблением интенсивности фебрильной реакции. О более выраженном антипиретическом эффекте применения Hsp70 у голубей свидетельствует также и отсутствие прироста САМ, вероятно, способствовавшее уменьшению теплопродукции. В отличие от голубей, у крыс повышение САМ сохранялось в течение 3 ч после введения ЛПС. Однако восстановление этого показателя до контрольных значений происходило раньше, чем при действии одного ЛПС, и, вероятно, могло способствовать уменьшению теплопродукции и снижению Тм. Можно предположить, что для получения более выраженного антипиретического эффекта при ЛПС-индуцированной эндотоксемии у крыс требуется применение более высокой дозы Hsp70.
В нашем исследовании было установлено, что введение ЛПС приводило к развитию лейкоцитоза у крыс. Увеличение числа лейкоцитов является одним из маркеров воспалительного процесса [39]. Уже через 1 ч после профилактического введения Hsp70 мы наблюдали снижение числа лейкоцитов, а через 5 ч – нормализацию этого показателя. Вероятно, уменьшение рекрутирования лейкоцитов при профилактическом введении Hsp70 может свидетельствовать о противовоспалительных свойствах белка Hsp70. Таким образом, полученные нами данные свидетельствуют о способности Hsp70 корректировать терморегуляторные показатели ЛПС-индуцированной лихорадочной реакции и воспалительную реакцию у голубей и крыс.
Известно, что основными участниками запуска лихорадки при эндотоксемии являются провоспалительные цитокины IL-1β, IL-6, TNF-α, а также основной медиатор – простагландин Е2 (PGE2) [6, 40]. Однако вопрос о точных механизмах передачи провоспалительного сигнала ЛПС у птиц остается открытым, так как основная масса исследований, посвященных этому вопросу, выполнена на млекопитающих. Предполагается, что у птиц, в отличие от млекопитающих, более важную роль в запуске лихорадки играет IL-6, и, вероятно, менее выражено участие PGE2 [41]. Показано, что экзогенный Hsp70 может взаимодействовать с рецепторными комплексами мембран иммунокомпетентных клеток (CD11b/CD18, TLR2 и TLR4) и модулировать их активность. Это приводит к снижению продукции активных форм кислорода, TNF-α, IL-6, экспрессии мРНК TLR4 и IL-1β [42–45]. Есть данные, что противовоспалительный эффект Hsp70 может быть также обусловлен индукцией противовоспалительного цитокина IL-10 [46]. В опытах in vivo было обнаружено, что профилактическое введение Hsp70 способствует повышению выживаемости животных при введении высоких доз ЛПС, корректирует ряд гемодинамических показателей и биохимических параметров крови (концентрации билирубина, креатинина и др.) [28–31]. Совокупность этих данных позволяет предполагать, что профилактически введенный Hsp70 может конкурировать с ЛПС за связывание с TLR2 и TLR4, блокируя при этом активацию провоспалительного каскада с участием фактора NF-κB. В пользу этого предположения свидетельствуют данные о том, что терапевтическое (после введения высокой дозы ЛПС) применение Hsp70 не устраняло развитие тахикардии и не снижало уровень смертности [28]. Известно, что одним из ключевых участников запуска фебрильной реакции является PGE2, продуцируемый периферическими макрофагами [6]. Вероятно, способность Hsp70 взаимодействовать с этими клетками приводит к снижению продукции PGE2 и ослаблению лихорадочного ответа.
Следует отметить, что приведенные выше сведения о защитных эффектах экзогенного Hsp70 были получены с использованием культур клеток и лабораторных млекопитающих (мышей и крыс). У птиц были обнаружены те же типы иммунокомпетентных клеток, наличие CD11b рецепторов и основные медиаторы воспаления (IL-6, IL-1β, TNF-α, PGE2) [47, 48]. Вероятно, антипиретический эффект Hsp70 у голубей и крыс мог реализовываться за счет схожих механизмов и являться результатом влияния на функционирование иммунокомпетентных клеток и продукцию провоспалительных цитокинов. Существует мнение, что птицы более устойчивы к действию ЛПС, чем представители млекопитающих. Комплекс TLR4 обнаружен и у птиц, и у млекопитающих, однако у птиц не было обнаружено липополисахарид-связывающего белка и свободной формы рецептора СD14, участвующих в передаче сигнала у млекопитающих, а также TLR4-опосредованного сигнального каскада, обеспечивающего продукцию интерферонов [49, 50]. Возможно, с этой особенностью может быть связан и более выраженный антипиретический эффект Hsp70 у голубей.
Таким образом, проведенное исследование показало, что введение Hsp70 уменьшает величину лихорадочного ответа при действии ЛПС у голубей и крыс, а также способствует нормализации числа лейкоцитов в крови у крыс. Эти результаты свидетельствуют о способности Hsp70 ослаблять системную воспалительную реакцию. Можно предположить, что механизмы реализации противовоспалительного действия Hsp70 при эндотоксемии являются общими для представителей млекопитающих и птиц. Полученные данные могут являться фундаментальным обоснованием для дальнейших исследований в этом направлении с целью оценки терапевтического потенциала экзогенного Hsp70 при эндотоксемии и сепсисе, что будет иметь важное значение для разработки новых подходов к лечению этих состояний.
Список литературы
Roth J, Blatteis CM (2014) Mechanisms of fever production and lysis: lessons from experimental LPS fever. Compr Physiol 4:1563–604. https://doi.org/10.1002/cphy.c130033
Evans SS, Repasky EA, Fisher DT (2015) Fever and the thermal regulation of immunity: the immune system feels the heat. Nat Rev Immunol 15:335–349. https://doi.org/10.1038/nri3843
Dickson K, Lehmann C (2019) Inflammatory response to different toxins in experimental sepsis models. Int J Mol Sci 20:4341. https://doi.org/10.3390/ijms20184341
Kluger MJ, Kozak W, Conn C, Leon L, Soszynski D (1996) The adaptive value of fever. Infect Dis Clin North Am 10:1–20. https://doi.org/10.1016/S0891-5520(05)70282-8
Lapshina KV, Ekimova IV (2010) Effects of sleep deprivation on measures of the febrile reaction and the recovery of somatovisceral functions and sleep in endotoxemia. Neurosci. Behav Physiol 40: 381–388. https://doi.org/10.1007/s11055-010-9268-6
Nakamura K (2011) Central circuitries for body temperature regulation and fever. Am J Physiol – Regul Integr Comp Physiol 301: 1207–1228. https://doi.org/10.1152/ajpregu.00109.2011
Gray DA, Marais M, Maloney SK (2013) A review of the physiology of fever in birds. J Comp Physiol B Biochem Syst Environ Physiol 183:297–312. https://doi.org/10.1007/s00360-012-0718-z
Garami A, Steiner AA, Romanovsky AA (2018) Fever and hypothermia in systemic inflammation. In: Handbook of Clinical Neurology. Elsevier B 157:565–597. https://doi.org/10.1016/B978-0-444-64074-1.00034-3
Sundgren-Andersson AK, Östlund P, Bartfai T (1998) Simultaneous measurement of brain and core temperature in the rat during fever, hyperthermia, hypothermia and sleep. Neuroimmunomodulation 5: 241–247. https://doi.org/10.1159/000026344
Ekimova IV (2003) Changes in the metabolic activity of neurons in the anterior hypothalamic nuclei in rats during hyperthermia, fever, and hypothermia. Neurosci Behav Physiol 33:455–460. https://doi.org/10.1023/A:1023459100213
Kiyatkin EA, Sharma HS (2009) Permeability of the blood–brain barrier depends on brain temperature. Neuroscience 161: 926–939. https://doi.org/10.1016/j.neuroscience.2009.04.004
Gotoh M, Nagasaka K, Nakata M, Takashima I, Yamamoto S (2020) Brain temperature alters contributions of excitatory and inhibitory inputs to evoked field potentials in the rat frontal cortex. Front Cell Neurosci 14: 593027. https://doi.org/10.3389/fncel.2020.593027
Noorani AA, Yamashita H, Gao Y, Islam S, Sun Y, Nakamura T, Enomoto H, Zou K, Michikawa M (2020) High temperature promotes amyloid β-protein production and γ-secretase complex formation via Hsp90. J Biol Chem 295:18010–18022. https://doi.org/10.1074/jbc.RA120.013845
Dubé CM, Brewster AL, Baram TZ (2009) Febrile seizures: mechanisms and relationship to epilepsy. Brain Dev 31: 366–371. https://doi.org/10.1016/j.braindev.2008.11.010
Walter EJ, Carraretto M (2016) The neurological and cognitive consequences of hyperthermia. Crit Care 20:199. https://doi.org/10.1186/s13054-016-1376-4
Li H, Liu L, Zhang D, Xu J, Dai H, Tang N, Su X, Cao B (2020) SARS-CoV-2 and viral sepsis: observations and hypotheses. Lancet 395:1517–1520. https://doi.org/10.1016/S0140-6736(20)30920-X
Liu E, Lewis K, Al-Saffar H, Krall CM, Singh A, Kulchitsky VA, Corrigan JJ, Simons CT, Petersen SR, Musteata FM, Bakshi CS, Romanovsky AA, Sellati TJ, Steiner AA (2012) Naturally occurring hypothermia is more advantageous than fever in severe forms of lipopolysaccharide- and Escherichia coli-induced systemic inflammation. Am J Physiol – Regul Integr Comp Physiol 302:1372–1383. https://doi.org/10.1152/ajpregu.00023.2012
Zhang YH, Takahashi K, Jiang GZ (1994) In vivo production of heat shock protein in mouse peritoneal macrophages by administration of lipopolysaccharide. Infect Immun 62(10): 4140–4144. https://doi.org/10.1128/IAI.62.10.4140-4144.1994
Meng X, Brown JM, AL, Nordeen SK, Franklin W, Harken AH, Banerjee A (1996) Endotoxin induces cardiac HSP70 and resistance to endotoxemic myocardial depression in rats. Am J Physiol 271:1316–1324. https://doi.org/10.1152/ajpcell.1996.271.4.C1316
Sarson AJ, Read LR, Haghighi HR, Lambourne MD, Brisbin JT, Zhou H, Sharif S (2007) Construction of a microarray specific to the chicken immune system: profiling gene expression in B cells after lipopolysaccharide stimulation. Can J Vet Res 71:108–118.
Zhang A, Zhou X, Wang X, Zhou H. (2011) Characterization of two heat shock proteins (Hsp70/Hsc70) from grass carp (Ctenopharyngodon idella): evidence for their differential gene expression, protein synthesis and secretion in LPS-challenged peripheral blood lymphocytes. Comp Biochem Physiol B Biochem Mol Biol 159:109–114. https://doi.org/10.1016/j.cbpb.2011.02.009
Chiaramonte M, Inguglia L, Vazzana M, Deidun A, Arizza V (2019) Stress and immune response to bacterial LPS in the sea urchin Paracentrotus lividus (Lamarck, 1816). Fish Shellfish Immunol 92:384–394. https://doi.org/10.1016/j.fsi.2019.06.017
Daugaard M, Rohde M, Jaattela M (2007) The heat shock protein 70 family: Highly homologous proteins with overlapping and distinct functions. FEBS Lett 581:3702–3710 https://doi.org/10.1016/j.febslet.2007.05.039
Rosenzweig R, Nillegoda NB, Mayer MP, Bukau B (2019) The Hsp70 chaperone network. Nat Rev Mol Cell Biol 20: 665–680. https://doi.org/10.1038/s41580-019-0133-3
Calderwood SK, Murshid A, Prince T (2009) The shock of aging: molecular chaperones and the heat shock response in longevity and aging-a mini-review. Gerontology 55:550–558. https://doi.org/10.1159/000225957
Srivastava P (2002) Interaction of heat shock proteins with peptides and antigen presenting cells: chaperoning of the innate and adaptive immune responses. Annu Rev Immunol 20:395–425. https://doi.org/10.1146/annurev.immunol.20.100301.064801
Asea A (2008) Heat shock proteins and toll-like receptors. Handb Exp Pharmacol. (183):111–127.
Kustanova GA, Murashev AN, Karpov VL, Margulis BA, Guzhova IV, Prokhorenko IR, Grachev SV, Evgen’ev MB (2006) Exogenous heat shock protein 70 mediates sepsis manifestations and decreases the mortality rate in rats. Cell Stress Chaperones 11: 276–286. https://doi.org/10.1379/csc-195r.1
Yurinskaya MM, Vinokurov MG, Zatsepina OG, Garbuz DG, Guzhova IV, Rozhkova EA, Suslikov AV, Karpov VL, Evgen’ev MB (2009) Exogenous heat shock proteins (HSP70) significantly inhibit endotoxin-induced activation of human neutrophils. Dokl Biol Sci 426:298–301. https://doi.org/10.1134/s0012496609030326
Rozhkova EA, Yurinskaya MM, Zatsepina OG, Garbuz DG, Karpov VL, Surkov S, Murashev AN, Ostrov VF, Margulis BA, Evgen’ev MB, Vinokurov MG (2010) Exogenous mammalian extracellular HSP70 reduces endotoxin manifestations at the cellular and organism levels. Ann N Y Acad Sci 94–107. https://doi.org/10.1111/j.1749-6632.2009.05375.x
Ostrov VF, Slashcheva GA, Zharmukhamedova TIu, Garbuz DG, Evgen’ev MB, Murashev AN (2010) Effect of the recombinant human heat shock protein HSP70 on the biochemical properties of blood in a model of endotoxic shock in rats. Bioorg Khim 36:337–342. https://doi.org/10.1134/s1068162010030052
Pastukhov YF, Ekimova IV, Hudik KA, Guzhova I.V. (2005) Lipopolysaccharide-free 70-kDa heat shock protein has hypothermic and somnogenic effects. Dokl Biol Sci 402:167–170. https://doi.org/10.1007/s10630-005-0077-y
Пастухов ЮФ, Худик КА, Екимова ИВ (2010) Шапероны в регуляции и восстановлении физиологических функций. Российский физиологический журнал им. ИМ Сеченова. 96:708–725. [Pastuhov YuF, Hudik KA, Ekimova IV (2010) Shaperony v regulyacii i vosstanovlenii fiziologicheskih funkcij. Ros fiziol zh im IM Sechenova. 96:708–725. (In Russ)].
Shevtsov MA, Nikolaev BP, Yakovleva LY, Dobrodumov AV, Dayneko AS, Shmonin AA, Vlasov TD, Melnikova EV, Vilisov AD, Guzhova IV, Ischenko AM, Mikhrina AL, Galibin OV, Yakovenko IV, Margulis BA (2014) Neurotherapeutic activity of the recombinant heat shock protein Hsp70 in a model of focal cerebral ischemia in rats. Drug Des Devel Ther 8:639–650. https://doi.org/10.2147/DDDT.S62024
Ekimova IV, Plaksina DV, Pastukhov YF, Lapshina KV, Lazarev VF, Mikhaylova ER, Polonik SG, Pani B, Margulis BA, Guzhova IV, Nudler E (2018) New HSF1 inducer as a therapeutic agent in a rodent model of Parkinson’s disease. Exp Neurol 306:199–208. https://doi.org/10.1016/j.expneurol.2018.04.012
Karten HJ, Hodos W (1967) A stereotaxic atlas of the brain of the pigeon (Columba livia). Johns Hopkins Press. Baltimore. Maryland.
Paxinos G, Watson C (2007) The rat brain in stereotaxic coordinates. 6th Edition. San Diego: Academic Press.
Rashotte M, Pastukhov IuF, Poliakov E, Henderson R (1998) Vigilance states and body temperature during the circadian cycle in fed and fasted pigeons (Columba livia). Am J Physiol 275:1690–1702. https://doi.org/10.1152/ajpregu.1998.275.5.R1690
Ronco C, Piccinni P, Rosner MH (eds) (2010) Endotoxemia and endotoxin shock: disease, diagnosis and therapy. Contrib. Nephrol. Basel. Karger. (167): 1424.
Krueger JM, Opp MR (2016) Sleep and microbes. Int Rev Neurobiol 131:207–225. https://doi.org/10.1016/bs.irn.2016.07.003
Grabbe N, Kaspers B, Ott D, Murgott J, Gerstberger R, Roth J (2020) Neurons and astrocytes of the chicken hypothalamus directly respond to lipopolysaccharide and chicken interleukin-6. J Comp Physiol B 190:75–85. https://doi.org/10.1007/s00360-019-01249-1
Antonova OY, Yurinskaya MM, Evgen’ev MB, Vinokurov MG (2013) The role of the TLR-dependent signaling pathway in the mechanism of phagocyte protection by exogenous heat shock protein HSP70 from the endotoxin action. Dokl Biol Sci 452:305–309. https://doi.org/10.1134/S0012496613050037
Vinokurov M, Ostrov V, Yurinskaya M, Garbuz D, Murashev A, Antonova O, Evgen’ev M (2012) Recombinant human Hsp70 protects against lipoteichoic acid-induced inflammation manifestations at the cellular and organismal levels. Cell Stress Chaperones. 17:89–101. https://doi.org/. 2012.https://doi.org/10.1007/s12192-011-0288-0
Ferat-Osorio E, Sánchez-Anaya A, Gutiírrez-Mendoza M, Boscó-Gárate I, Wong-Baeza I, Pastelin-Palacios R, Pedraza-Alva G, Bonifaz LC, Cortйs-Reynosa P, Pйrez-Salazar E, Arriaga-Pizano L, Lypez-Macías C, Rosenstein Y, Isibasi A (2014) Heat shock protein 70 down-regulates the production of toll-like receptor-induced pro-inflammatory cytokines by a heat shock factor-1/constitutive heat shock element-binding factor-dependent mechanism. Inflamm (Lond) 11:19. https://doi.org/10.1186/1476-9255-11-19
Yurinskaya MM, Kochetkova OYu, Shabarchina LI, Antonova OYu, Suslikov AV, Evgen’ev MB (2017) Encapsulated Hsp70 decreases endotoxin-induced production of ROS and TNFα in human phagocytes. Cell Stress Chaperones 22:163–171. https://doi.org/10.1007/s12192-016-0743-z
Borges TJ, Lopes RL, Pinho NG, Machado FD, Souza AP, Bonorino C (2013) Extracellular Hsp70 inhibits pro-inflammatory cytokine production by IL-10 driven down-regulation of C/EBPβ and C/EBPδ. Int J Hyperthermia 29:455–463. https://doi.org/10.3109/02656736.2013.798037
Qureshi MA, Heggen CL, Hussain I (2000) Avian macrophage: effector functions in health and disease. Dev Comp Immunol 24:103–119. 2000. https://doi.org/10.1016/s0145-305x(99)00067-1
Rohde F., Schusser B., Hron T., Farkašová H., Plachý J., Härtle S., Hejnar J., Elleder D., Kaspers B. (2018) Characterization of chicken tumor necrosis factor-α, a long missed cytokine in birds. Front Immunol 9:605. https://doi.org/10.3389/fimmu.2018.00605
Brownlie R., Allan B. (2011) Avian toll-like receptors. Cell Tissue Res 343:121–130. https://doi.org/10.1007/s00441-010-1026-0
Keestra A.M., de Zoete M.R., Bouwman L.I., Vaezirad M.M., van Putten J.P. (2013) Unique features of chicken Toll-like receptors. Dev Comp Immunol 41:316–323. https://doi.org/10.1016/j.dci.2013.04.009
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


