Журнал эволюционной биохимии и физиологии, 2021, T. 57, № 5, стр. 442-450
ФАГОЦИТАРНАЯ АКТИВНОСТЬ АСТРОЦИТОВ МОЗГА КРЫСЫ В ПЕРВИЧНОЙ КУЛЬТУРЕ РЕГУЛИРУЕТСЯ ИНСУЛИНОМ И ГАНГЛИОЗИДОМ GM1
Т. В. Соколова 1, *, М. П. Рычкова 1, Н. Е. Басова 1, Д. С. Васильев 1, Н. Ф. Аврова 1, М. Г. Ефимова 1, **
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: sokolt1956@mail.ru
** E-mail: yefimova3@gmail.com
Поступила в редакцию 07.05.2021
После доработки 23.06.2021
Принята к публикации 25.06.2021
Аннотация
Полное и своевременное удаление апоптотических клеток и их фрагментов является жизненно важным для поддержания гомеостаза во всех тканях организма в норме и при патологических состояниях. Поскольку удаление апоптотических субстратов осуществляется клетками, обладающими фагоцитарной активностью, вопрос о регуляции последней представляет значительный интерес. В настоящей работе исследовали влияние двух биологически активных молекул – инсулина и ганглиозида GM1 на фагоцитарную активность астроцитов мозга крысы в первичной культуре. Показано, что инкубация клеток с 1 мкМ инсулином приводила к достоверному снижению фагоцитарной активности астроцитов (до 58.5% к контролю), а с 10 мкМ ганглиозидом GM1, напротив, вызывала повышение фагоцитарной активности клеток (133.4% к контролю). Предварительная инкубация астроцитов мозга с ганглиозидом GM1 полностью блокировала ингибиторный эффект инсулина. Результаты проведенного исследования могут быть использованы при выработке новых стратегий лечения нейродегенеративных заболеваний, сопровождающихся появлением субстратов апоптотического типа.
Апоптоз является жизненно важным процессом, который реализуется во всех тканях организма в норме и при патологических состояниях [1]. Апоптотические субстраты, формирующиеся в результате нормальной жизнедеятельности клеток разных органов, немедленно удаляются специфическими клетками, обладающими фагоцитарной активностью. Своевременное и полное удаление апоптотических субстратов необходимо для поддержания тканевого гомеостаза, а также для того, чтобы исключить возникновение аутоиммунных реакций в ответ на внутриклеточные антигены, высвобождающиеся из поврежденных и/или апоптотических клеток [2].
Фагоцитоз апоптотических субстратов является комплексным рецептор-опосредованным процессом, при котором координированное взаимодействие специфических рецепторов плазматической мембраны клетки-фагоцита запускает сигнальные механизмы, обеспечивающие поглощение и дальнейшее расщепление субстратов лизосомальным аппаратом клетки [3]. Таким образом, связывание, поглощение и расщепление явля.тся основными стадиями фагоцитоза, которые в дальнейшем будут именоваться 1-, 2- и 3-й стадиями соответственно. При этом реализация одной из этих стадий процесса не влечет за собой автоматическую реализацию последующей из них.
Фагоцитарная функция в ЦНС осуществляется двумя типами клеток: микроглиальными и астроглиальными клетками. Первые из них являются клетками гематопоэтического происхождения и относятся к числу профессиональных фагоцитов, тогда как вторые являются непрофессиональными фагоцитами [4]. Астроциты – это наиболее многочисленные клетки нейроглии, количество которых достигает 40% от общей популяции клеток головного мозга [5]. Эти клетки обеспечивают условия для генерации и передачи нервных импульсов, способствуя поддержанию и реализации синаптической функции, участвуют в формировании гематоэнцефалического барьера, осуществляют опорную, трофическую, секреторную и фагоцитарную функции. Астроциты контролируют не только образование и функции синапсов, но и их устранение в развивающемся и зрелом мозге [6]. При патологических состояниях различной этиологии (нейродегенеративные болезни, ишемия, старение, травматическое и радиационное повреждение мозга) удаление апоптотических субстратов и дегенеративного миелина астроцитами приобретает особое значение [5].
Как известно на текущий момент, фагоцитарная активность астроцитов опосредуется двумя рецепторными белками плазматической мембраны: MEGF10 (Multiple EGF-Like Domains 10) и рецепторной тирозинкиназой MERTK (Mer proto-oncogene Tyrosine Kinase) [7]. Белки MEGF10 и MERTK принимают участие в удалении синапсов, а также поврежденных и/или апоптотических нейронов, образующихся при старении и/или патологических состояниях ЦНС [5]. Кроме этого, рецептору MERTK отводят ключевую роль в процессе фагоцитоза миелиновых обломков, образующихся в ходе естественных процессов обновления миелина [8].
В предварительных исследованиях нашей лаборатории был детально изучен процесс фагоцитоза апоптотических субстратов различного типа астроцитами мозга крысы в первичной культуре, изучены кинетические характеристики этого процесса и показано, что фагоцитоз апоптотических субстратов приводит к увеличению пролиферативной активности астроцитов мозга.
Как известно, пролиферация астроглии является отягощающим фактором при развитии патологических состояний ЦНС, сопровождающихся дегенеративными изменениями и гибелью нервных клеток. Накопление астроцитов в местах локального повреждения способствует развитию астроглиоза, т.e. процессу замещения мертвых нейронов клетками астроглии. В связи с этими данными вопрос о способах оптимизации фагоцитарной активности астроцитов (как в сторону ее увеличения, так и в сторону ее уменьшения) является принципиально важным для выработки стратегий коррекции патологического процесса в зависимости от стадии его развития.
В нашей лаборатории в течение последних лет исследуются нейропротекторные эффекты ряда природных биомолекул, а именно ганглиозидов и инсулина при окислительном стрессе и ряде неблагоприятных воздействий на организм in vivo и in vitro [9]. Поскольку удаление апоптотических субстратов является жизненно важным фактором, влияющим на выживание ЦНС в неблагоприятных условиях, представлялось значимым выяснение вопроса о возможности этих соединений регулировать фагоцитарную функцию астроцитов.
Ганглиозиды – сложные гликосфинголипиды клеточных мембран – являются неотъемлемым компонентом мозга, при этом в нашей лаборатории показано, что у млекопитающих их относительное количество достигает 2.5 мг на 1 г ткани мозга (GM1) [10]. При этом известно, что при дегенеративных и травматических повреждениях мозга происходит высвобождение ганглиозида GM1 в межклеточное пространство, что позволяет полагать возможность его взаимодействия с различными клетками мозга, включая астроциты. Кроме этого, в нашей лаборатории было установлено, что ганглиозид GM1 вызывает многократную активацию фагоцитарной активности профессиональных фагоцитов макрофагов [11].
Мозг является инсулин-зависимым органом, и различные способы введения инсулина (интрацеребровентрикулярное, интраназальное, системное) способствуют изменению пищевого поведения и снижению веса у экспериментальных животных и человека [12]. Рецепторы инсулина выявлены как на нейрональных, так и на глиальных клетках мозга, включая астроциты [13, 14]. Астроциты являются активными компонентами, вовлеченными в метаболизм инсулина в ЦНС. При этом астроциты не только экспрессируют рецептор инсулина и инсулин-деградирующий фермент [13, 15], но и сами являются инсулин-секретирующими клетками мозга [16], что указывает на важность инсулинового сигналинга для обеспечения нормального функционирования этих клеток.
В то же время в доступной литературе мы не обнаружили данных о влиянии инсулина на фагоцитарную активность астроцитов мозга. Отсутствует также информация о возможном модулирующем эффекте ганглиозидов. Поэтому целью настоящего исследования явилось выяснение вопроса о том, как влияют инсулин и ганглиозид GM1 на фагоцитарную активность астроцитов мозга в культуре клеток.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Первичная культура астроглии
Исследования проводили на первичной культуре клеток астроглии, которую выделяли из мозга новорожденных крыс по методу [17]. Клетки культивировали в среде DMEM (Биолот, Россия), содержащей 10% инактивированной фетальной сыворотки теленка (Биолот, Россия) и антибиотики (пенициллин G 50 Ед/мл и стрептомицин 50 мкг/мл, Биолот Россия) на чашках Петри (Ø3.5 cм, Orange scientific), в течение 7–9 дней при 37°С и 5% СО2 до достижения 75% конфлюентности. О жизнеспособности клеток судили по окрашиванию Trypan Blue (Биолот, Россия), способному проникать через поврежденные клеточные мембраны.
Модель индуцированного фагоцитоза
В качестве апоптотического субстрата фагоцитоза использовали фракцию наружных сегментов палочек (НСП) сетчатки крысы, которую выделяли по модифицированному методу [18]. Конъюгацию препаратов НСП с флуоресцеин-изотиоцианатом (FITC, Merck, Германия) осуществляли, как ранее нами было описано [18]. Клетки промывали фосфатно-солевым раствором, рН 7.4 (PBS), после чего инкубировали в среде DMEM, содержащей 2% инактивированной фетальной сыворотки теленка и добавляли субстраты фагоцитоза в соотношении 1:10 (клетка/субстрат фагоцитоза; подсчет клеток и фрагментов НСП проводили с использованием камеры Фукса–Розенталя).
Обработка клеток модуляторами фагоцитарной активности
При анализе влияния инсулина на процесс фагоцитоза клетки инкубировали с 1 мкм инсулина (Sigma) в течение 1 ч, после чего добавляли конъюгат FITC-НСП. При исследовании влияния ганглиозида GM1 на процесс фагоцитоза клетки инкубировали в течение 24 ч с препаратом GM1 в конечной концентрации 0.1 мкм, 1 мкм и 10 мкм, после чего добавляли конъюгат FITC-НСП. Ганглиозид GM1 выделяли из полученного по методу Фолча [19] экстракта липидов мозга быка как это описано ранее [20].
При исследовании совместного действия инсулина и ганглиозида GM1 клетки инкубировали в течение 24 ч с препаратом GM1 в конечной концентрации 0.1 мкм, 1 мкм и 10 мкм, после чего добавляли инсулин в концентрации 1 мкм и выдерживали клетки в течение 1 часа. Далее добавляли конъюгат FITC-НСП.
Анализ фагоцитарной активности
После окончания инкубации с НСП излишки субстрата отмывали охлажденным PBS и проводили фиксацию клеток в течение 3–5 мин в 4% растворе параформальдегида, приготовленного на PBS. После промывки препаратов раствором PBS проводили окраску ядер 0.001% раствором Hoechst 33258/PBS (Serva, Германия). Результаты опытов оценивали с помощью флуоресцентного микроскопа Zeiss Imager.A1, Axio (Германия), оснащенного цифровой камерой AxioCamMRc (Zeiss, Германия). Для оценки фагоцитарной активности применяли программное обеспечение ImageJ (NIH, США); при этом производили подсчет количества ядер клеток (синее окрашивание) и относительную площадь, занимаемую субстратом фагоцитоза (зеленое окрашивание). О фагоцитарной активности клеток судили на основании оценки эффективности реализации 1-й и 2-й стадий фагоцитоза. Количественную оценку процесса распознавания и связывания субстрата с астроцитом (1-я стадия фагоцитоза) осуществляли в условных единицах, рассчитывая отношение площади флуоресцентного субстрата к количеству ядер в препарате. Морфологическим критерием для оценки поглощения субстрата астроцитами (2-я стадия фагоцитоза) служило наличие флуоресцентной метки FITC в перинуклеарной области клетки, где реализуется взаимодействие окрашенных красителем фрагментов НСП с лизосомами (рассчитывали отношение числа клеток с флуоресцентным субстратом в перинуклеарной области к количеству клеток в препарате). Для количественного анализа клетки фотографировали; при этом для каждой точки в эксперименте использовали 2 параллельных стекла. На каждом стекле проводили фотофиксацию 15 случайно выбранных полей, содержащих до 1500 клеток. Всего было проведено 3 независимых эксперимента. Статистическую обработку результатов осуществляли на основании однофакторного дисперсионного анализа (ANOVA), применяя тест для множественных сравнений Бонферрони и используя программу GraphPad Prism (San Diego, США). Данные представлены в виде среднего значения ± ошибка среднего (M±SEM).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Инкубация с ганглиозидом GM1 приводит к возрастанию фагоцитарной активности астроцитов мозга крысы в первичной культуре
В первой серии опытов нами была проведена оценка фагоцитарной активности астроцитов в присутствии ганглиозида GM1. В качестве субстрата фагоцитоза мы использовали препараты НСП крысы, которые являются субстратом апоптотического типа [21]. В предыдущих исследованиях нами было показано, что препараты НСП эффективно распознаются и поглощаются астроцитами мозга крысы. При этом кинетические параметры фагоцитоза НСП сопоставимы с таковыми, характерными для захвата и поглощения апоптотических нейронов. Результаты опытов приведены на рис. 1 и в табл. 1. Как следует из данных рис. 1а, 1а', в контрольных пробах флуоресцентный сигнал присутствовал как на периферии клеток, так и в перинуклеарной области, что свидетельствует о реализации как 1-й, так и 2-й стадии фагоцитоза.
Рис. 1.
Фагоцитарная активность астроцитов мозга крысы в первичной культуре при различных условиях инкубации с инсулином и/или ганглиозидом GM1. (a, a') – контрольные препараты астроцитов мозга после инкубации с конъюгатом НСП-FITC в течение 3 ч. (a') получен с помощью наслоения на панель (a) снимка клеток в проходящем свете для визуализации их контура. (b, b') – препараты астроцитов мозга, прошедшие предварительную 24-часовую инкубацию с 10 мкм ганглиозида GM1, и далее проинкубированных с конъюгатом НСП- FITC в течение 3-х часов. (b') получен с помощью наслоения на панель (b) снимка клеток в проходящем свете для визуализации их контура. (c, c') – препараты астроцитов мозга крысы, подвергнутых предварительной 1-часовой инкубации с 1 мкМ инсулина, и далее проинкубированных с конъюгатом НСП-FITC в течение 3 ч. (c') получен с помощью наслоения на панель (c) снимка клеток в проходящем свете для визуализации их контура. (d, d') – препараты астроцитов мозга крысы, подвергнутых предварительной 24-часовой инкубации с 10 мкМ ганглиозида GM1, далее проинкубированных в течение 1 ч с 1 мкМ инсулина, после чего проинкубированных с конъюгатом НСП-FITC в течение 3 ч. (d') получен с помощью наслоения на панель (d) снимка клеток в проходящем свете для визуализации их контура. На всех рисунках стрелками отмечены субстраты в перинуклеарной области (2 стадия фагоцитоза), а звездочками отмечены субстраты, связанные с плазматической мембраной (1 стадия фагоцитоза).
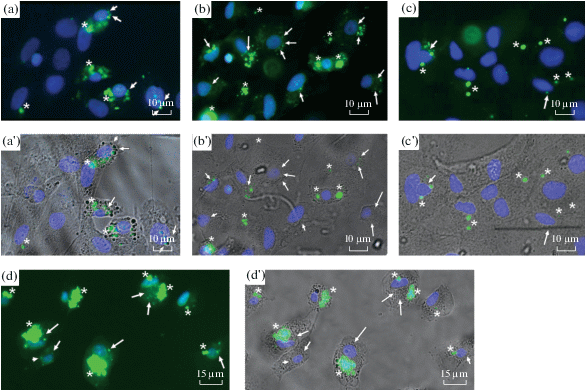
Таблица 1.
Оценка эффективности 1-й стадии фагоцитоза (связывание субстрата) астроцитами мозга крысы в первичной культуре при различных условиях инкубации клеток с инсулином и ганглиозидом GM1
| Проба | Эффективность 1-й стадии фагоцитоза (в условных единицах) | % к контролю |
|---|---|---|
| контроль | 198.2 ± 18.4 | 100 |
| Инсулин 1 мкМ | 207.4 ± 25.6 | 104.7 |
| GM1 0.1 мкМ | 242.4 ± 33.9 | 122.3 |
| GM1 1 мкМ | 334.3 ± 49.4 (*) | 168.7 |
| GM1 10 мкМ | 328.8 ± 34.7 (*) | 165.9 |
| GM1 0.1 мкМ + инсулин 1 мкМ | 234.3 ± 30.2 | 118.3 |
| GM1 1 мкМ + инсулин 1 мкМ | 327.0 ± 53.6 (*) | 165.0 |
| GM1 10 мкМ + инсулин 1 мкМ | 339.9 ± 51.4 (*) | 171.6 |
На рис. 1b, b' и в табл. 2 приведены результаты опытов по оценке фагоцитарной активности астроцитов мозга крысы в присутствии ганглиозида GM1. Мы проанализировали эффект различных концентраций ганглиозида GM1 в пределах от 0.1 до 10 мкм. Из приведенных данных следует, что в результате инкубации астроцитов с ганглиозидом GM1 общее количество флуоресцентного субстрата достоверно возрастает по сравнению с контролем при концентрации GM1 от 1 до 10 мкм (табл. 1). Количественная оценка числа астроцитов, содержащих флуоресцентный субстрат в перинуклеарной области, также выявила достоверное увеличение по сравнению с контролем (19.2 ± 2.7 и 19.5 ± 2.4 против 14.6 ± 1.5, или 131.5% и 133.6% от контроля соответственно), (рис. 1b, b', табл. 2). Эти данные свидетельствуют о том, что воздействие ганглиозида GM1 стимулирует как процесс связывания (1-я стадия фагоцитоза), так и процесс поглощения субстрата астроцитом (2-я стадия фагоцитоза).
Таблица 2.
Оценка эффективности 2-й стадии фагоцитоза (поглощения субстрата) астроцитами мозга крысы в первичной культуре при различных условиях инкубации клеток с инсулином и ганглиозидом GM1.
| Проба | Эффективность 2-й стадии фагоцитоза | % к контролю |
|---|---|---|
| контроль | 14.7 ± 1.5 | 100 |
| инсулин 1 мкМ | 8.6 ± 1.2 (**) | 58.5 |
| GM1 0.1 мкМ | 12.6 ± 1.8 | 86.2 |
| GM1 1 мкМ | 19.2 ± 2.7 (**) | 131.1 |
| GM1 10 мкМ | 19.5 ± 2.4(**) | 133.4 |
| GM1 0.1 мкМ + инсулин 1 мкМ | 13.8 ± 2.0 | 93.9 |
| GM1 1 мкМ + инсулин 1 мкМ | 15.4 ± 1.7 | 105.1 |
| GM1 10 мкМ + инсулин 1 мкМ | 26.6 ± 2.4 (**) | 181.3 |
Инкубация с инсулином приводит к снижению фагоцитарной активности астроцитов мозга крысы в первичной культуре
В результате инкубации астроцитов с инсулином общее количество флуоресцентной метки достоверно не отличалось от таковой, характерной для контроля (рис. 1c, c', табл. 1, табл. 2). Однако количество флуоресцентной метки в перинуклеарной области клеток, прошедших прединкубацию с инсулином, было достоверно снижено (до 58.5% от контроля), что свидетельствует о замедлении реализации 2-й стадии фагоцитоза (рис. 1, табл. 2). Действительно, флуоресцентный субстрат преимущественно был локализован на периферии астроцитов, в ассоциации с плазматической мембраной клеток. Таким образом, в отношении непрофессиональных фагоцитов мозга инсулин явился мощным ингибитором фагоцитарной активности этих клеток.
Поскольку в нашей лаборатории проводятся работы по изучению комбинированного действия инсулина и ганглиозида GM1, в следующей серии опытов мы изучили вопрос о совместном влиянии этих природных биологически активных молекул на фагоцитарную активность астроцитов.
Совместная инкубация астроцитов мозга крысы с ганглиозидом GM1 и инсулином увеличивает фагоцитарную активность клеток
На рис. 1d, d' приведены результаты типичного опыта, из которого следует, что применение ганглиозида GM1 приводит к резкому возрастанию флуоресцентного сигнала в пробах. Действительно, при концентрациях ганглиозида GM1 1 и 10 мкм достоверно возрастало не только количество связанного субстрата (табл. 1), но также и количество поглощенного субстрата, локализованного в перинуклеарной области астроцитов (рис. 1d, табл. 2). Расчет фагоцитарной активности показал, что совместная инкубация астроцитов с ганглиозидом GM1 блокирует ингибирующий эффект инсулина на фагоцитарную активность клеток. При этом при концентрации GM1 1 мкм ингибирующий эффект инсулина не проявлялся, а соответствующее значение количества поглощенного субстрата достигало значений, характерных для контрольных образцов (15.4 ± 1.78 против 14.6 ± 1.5). Примечательно, что при концентрации GM1 10 мкм количество поглощенного субстрата (2-я стадия фагоцитоза) астроцитами мозга двукратно превышало контрольные значения (26.6 ± 2.4 против 14.6 ± 1.5).
ОБСУЖДЕНИЕ
Согласно последним данным нашей лаборатории при экспериментальной ишемии у крыс in vivo совместное введение инсулина и ганглиозида GM1 давало однонаправленный нейропротекторный эффект. Эти данные хорошо согласуются с результатами настоящего исследования in vitro, при котором совместное действие этих биологически активных компонентов превышало стимулирующий эффект ганглиозида GM1 на фагоцитарную активность астроцитов.
Согласно данным, полученным в настоящей работе, ганглиозид GM1 в концентрации 1 и 10 мкм обладает хорошо выраженной способностью достоверно увеличивать фагоцитарную активность астроцитов при использовании в качестве апоптотического субстрата НСП сетчатки крыс. При этом GM1 увеличивал эффективность как 1-й, так и 2-й стадии фагоцитоза (связывание и поглощение, соответственно). Такого рода эффекты ганглиозида GM1 показаны нами впервые. Примечательно, что ганглиозид GM1 является наиболее стабильным из 4-х основных ганглиозидов мозга, которые обладают сходным нейропротекторным действием и, как правило, сходной функциональной активностью [22]. Поэтому можно полагать, что основные ганглиозиды мозга, по-видимому, обладают способностью активировать процессы фагоцитоза клетками астроглии, что показано нами на примере GM1.
Впервые установленная нами способность ганглиозидов активировать процессы фагоцитоза апоптотических субстратов астроцитами мозга может быть очень ценной для выработки новых стратегий лечения различных патологических состояний, связанных с разрушением нейронов, и, возможно, других клеток мозга. Разрушение клеток в ЦНС характерно для ишемических, травматических и других поражений мозга, в том числе и для нейродегенеративных заболеваний. Известно, что при разрушении нейронов мозга в межклеточное пространство высвобождаются ганглиозиды, содержание которых в мозгу является значительным [10]. Ранее нами было установлено, что вещества из разрушенных клеток мозга первоначально накапливаются в сосудистом сплетении, а далее постепенно из нее выводятся через спинномозговую жидкость. Действительно, показано, что у детей с менингоэнцефалитами (исследования post-mortem) содержание ганглиозидов в сосудистом сплетении мозга выше, чем в ткани мозга [23]. Таким образом, если при разрушении нейронов и других клеток мозга содержание ганглиозидов в спинномозговой жидкости существенно возрастает, то они могли бы активировать процессы фагоцитоза апоптотических нейронов астроцитами мозга, оказывая, таким образом, нейропротекторный эффект на жизнеспособные нейроны мозга.
Хотя к настоящему времени механизм действия GM1 на фагоцитарную активность астроцитов мозга неясен, представляют особый интерес данные о влиянии ганглиозидов на рецепторные тирозинкиназы, к числу которых также относится фагоцитарный рецептор MERTK. Кроме того, известно, что ганглиозиды могут проявлять свое действие через тирозинкиназный Тrk-А рецептор, активируя при этом PI3K-Akt1-mTOR сигнальный путь [24, 25]. Как известно, активация mTOR приводит к ингибированию аутофагии [26]. В случае непрофессиональных фагоцитов между процессами аутофагии и фагоцитоза имеется обратная зависимость, т.е. активация аутофагии может повлечь за собой снижение фагоцитарной активности. Полагают, что этот эффект обусловлен конкуренцией обоих процессов за использование лизосом, которые завершают процесс расщепления субстратов фагоцитоза и/или аутофагии в клетках [27–29].
Кроме этого, благоприятный эффект ганглиозидов in vitro на фагоцитарную активность астроцитов может быть усилен при их совместном воздействии с инсулином, что подтверждает данные нашей лаборатории, полученные в условиях in vivo. В наших исследованиях инсулин оказывал ингибирующее воздействие на фагоцитоз апоптотических субстратов астроцитами мозга. Молекулярный механизм, лежащий в основе этого эффекта, требует дополнительного исследования, а данные, обнаруженные нами в доступной литературе, немногочисленны. Например, сходные результаты были получены на примере непрофессиональных фагоцитов эпителиальных клеток бронхоальвеолярного эпителия [30]. Для объяснения этого феномена авторы уделяют особое внимание АКТ-киназе в регуляции фагоцитарной активности непрофессиональных фагоцитов эпителиальных клеток бронхоальвеолярного эпителия [30].
С другой стороны, известно, что в большинстве случаев ганглиозиды локализуются в мембранных микродоменах, известных как липидные рафты, в сочетании с другими сфинголипидами и холестерином [31]. Взаимодействие липидных рафтов с мембранными белками играет важную роль в клеточных процессах, таких как сигнальная трансдукция цитокинов, адгезия, внутриклеточный транспорт и др. [32]. Недавно показано, что на плазматической мембране эндотелиальных клеток аорты, которые также можно рассматривать как непрофессиональные фагоциты [33], ганглиозид GM1 колокализован с рецептором инсулина, а нарушение нормального стехиометрического взаимоотношения инсулиновый рецептор/GM1 (в сторону увеличения GM1) приводит к блокаде инсулинового сигналинга [34]. Примечательно, что в астроцитах мозга ганглиозид GM1 детектируется в незначительных количествах [35], однако экзогенно добавленный ганглиозид GM1 легко встраивается в плазматическую мембрану астроцитов, приводя к модификации мембранных микродоменов [36] и к изменению клеточного ответа на ряд стимулов [37]. В этом плане полученные нами данные об отмене ингибирующего эффекта инсулина в астроцитах, прошедших предварительную инкубацию с ганглиозидом GM1, хорошо согласуются с данными литературы.
ЗАКЛЮЧЕНИЕ
В тканях, ограниченных от общего кровотока гематическими барьерами, удаление апоптотических субстратов, образующихся в процессе их нормальной жизнедеятельности, реализуется за счет локальных клеток, проявляющих фагоцитарную активность. Благодаря этим клеткам поддерживается тканевой гомеостаз и исключается возможность развития аутоиммунных реакций, которые могут появиться в ответ на выход внутриклеточных компонентов из поврежденных или погибающих клеток. В настоящей работе мы впервые приводим данные о двух природных модуляторах, проявляющих совместный стимулирующий эффект на фагоцитарную активность непрофессиональных фагоцитов мозга – астроглиальных клеток.
Список литературы
Singh R, Letai A, Sarosiek K (2019) Regulation of apoptosis in health and disease: the balancing act of BCL-2 family proteins. Nat Rev Mol Cell Biol 20:175–193. https://doi.org/10.1038/s41580-018-0089-8
Itoh M, Yano A, Li X, Miyamoto K, Takeuchi Y (1999) Limited uptake of foreign materials by resident macrophages in murine ovarian tissues. J Reprod Immunol 43:55–66. https://doi.org/10.1016/S0165-0378(99)00004-2
Yefimova MG, Messaddeq N, Meunier AC, Cantereau A, Jegou B, Bourmeyster N (2018) Phagocytosis by Sertoli Cells: Analysis of Main Phagocytosis Steps by Confocal and Electron Microscopy. Methods Mol Biol 1748: 85–101. https://doi.org/10.1007/978-1-4939-7698-0_8
Rabinovitch M (1995) Professional and non-professional phagocytes: an introduction. Trends Cell Biol 5:85–7. https://doi.org/10.1016/s0962-8924(00)88955-2
Jung YJ, Chung WS (2018) Phagocytic Roles of Glial Cells in Healthy and Diseased Brains. Biomol Ther (Seoul) 26: 350–357. https://doi.org/10.4062/biomolther.2017.133
Lee JH, Kim JY, Noh S, Lee H, Lee SY, Mun JY, Park H, Chung WS (2021) Astrocytes phagocytose adult hippocampal synapses for circuit homeostasis. Nature 590:612–617. https://doi.org/10.1038/s41586-020-03060-3
Cahoy JD, Emery B, Kaushal A, Foo LC, Zamanian JL, Christopherson KS, Xing Y, Lubischer JL, Krieg PA, Krupenko SA, Thompson WJ, Barres BA (2008) A transcriptome database for astrocytes, neurons, and oligodendrocytes: a new resource for understanding brain development and function. J Neurosci 28:264–278. https://doi.org/10.1523/JNEUROSCI.4178-07.2008
Healy LM, Perron G, Won SY, Michell-Robinson MA, Rezk A, Ludwin SK, Moore CS, Hall JA, Bar-Or A, Antel JP (2016) MerTK Is a Functional Regulator of Myelin Phagocytosis by Human Myeloid Cells. J Immunol 196:3375–3384. https://doi.org/10.4049/jimmunol.1502562
Sukhov IB, Lebedeva MF, Zakharova IO, Derkach KV, Bayunova LV, Zorina II, Avrova NF, Shpakov AO (2020) Intranasal Administration of Insulin and Gangliosides Improves Spatial Memory in Rats with Neonatal Type 2 Diabetes Mellitus. Bull Exp Biol Med 168:317–320. https://doi.org/10.1007/s10517-020-04699-8
Avrova NF (1971) Brain ganglioside patterns of vertebrates. J Neurochem 18:667–674. https://doi.org/10.1111/j.1471-4159.1971.tb11996.x
Avrova NF, Zakharova IO, Tyurin VA, Tyurina YY, Gamaley IA, Schepetkin IA (2002) Different metabolic effects of ganglioside GM1 in brain synaptosomes and phagocytic cells. Neurochem Res 7-8:751–519. https://doi.org/10.1023/a:1020296605444
Florant GL, Singer L, Scheurink AJ, Park CR, Richardson RD, Woods SC (1991) Intraventricular insulin reduces food intake and body weight of marmots during the summer feeding period. Physiol Behav 49:335–338. https://doi.org/10.1016/0031-9384(91)90053-q
Gralle M (2017) The neuronal insulin receptor in its environment. J Neurochem 140:359–367.https://doi.org/10.1111/jnc.13909
Fernandez AM, Navarrete M, Davila JC, Garcia-Caceres C, Palenzuela R, de Martin Esteban SR, Mostany R, Tschöp M, Gutierrez A, Torres Aleman I (2019) The Insulin Receptor in Astrocytes is Involved in the Entrance of Circulating Insulin into the Brain. BioRxiv 720813. https://doi.org/10.1101/720813
Son SM, Cha MY, Choi H, Kang S, Choi H, Lee MS, Park SA, Mook-Jung I (2016) Insulin-degrading enzyme secretion from astrocytes is mediated by an autophagy-based unconventional secretory pathway in Alzheimer disease. Autophagy 12:784–800. https://doi.org/10.1080/15548627.2016.1159375
Takano K, Koarashi K, Kawabe K, Itakura M, Nakajima H, Moriyama M, Nakamura Y (2018) Insulin expression in cultured astrocytes and the decrease by amyloid β. Neurochem Int 19:171–18. https://doi.org/10.1016/j.neuint.2017.10.017
Hamprecht B, Löffler F (1985) Primary glial cultures as a model for studying hormone action. Methods Enzymol 109:341–345. https://doi.org/10.1016/0076-6879(85)09097-8
Yefimova MG, Messaddeq N, Harnois T, Meunier AC, Clarhaut J, Noblanc A, Weickert JL, Cantereau A, Philippe M, Bourmeyster N, Benzakour O (2013) A chimerical phagocytosis model reveals the recruitment by Sertoli cells of autophagy for the degradation of ingested illegitimate substrates. Autophagy 9: 653–666. https://doi.org/10.4161/auto.23839
Folch J, Lees M, Sloan-Stanley GH (1957) A simple method for isolation and purification of total lipids from animal tissue. J Biol Chem 226:497—509. PMID:13428781
Tyurin VA, Tyurina YY, Avrova NF (1992) Ganglioside-dependent factor, inhibiting lipid peroxidation in rat brain synaptosomes. Neurochem Int 20: 401—407. https://doi.org/10.1016/0197-0186(92)90055-v
Feng W, Yasumura D, Matthes MT, LaVail MM, Vollrath D (2002) Mertk triggers uptake of photoreceptor outer segments during phagocytosis by cultured retinal pigment epithelial cells. J Biol Chem 277:17016–17022. https://doi.org/10.1074/jbc.M107876200
Avrova NF, Victorov IV, Tyurin VA, Zakharova IO, Sokolova TV, Andreeva NA, Stelmaschuk EV, Tyurina YY, Gonchar VS (1998) Inhibition of glutamate-induced intensification of free radical reactions by gangliosides: possible role in their protective effect in rat cerebellar granule cells and brain synaptosomes. Neurochem Res 23:945–952 https://doi.org/10.1023/a:1021076220411
Karpova OB, Zinserling VA, Avrova NF (1992) Study of brain and vascular plexus gangliosides in meningoencephalitis of various etiology. Neurochem Int 20:365–370. https://doi.org/10.1016/0197-0186(92)90051-r
Duchemin AM, Ren Q, Mo L, Neff NH, Hadjiconstantinou M (2002) GM1 ganglioside induces phosphorylation and activation of Trk and Erk in brain. J Neurochem 81:696–707. https://doi.org/10.1046/j.1471-4159.2002.00831.x
Duchemin AM, Ren Q, Neff NH, Hadjiconstantinou M (2008) GM1-induced activation of phosphatidylinositol 3-kinase: involvement of Trk receptors. J Neurochem 104:1466–1477. https://doi.org/10.1111/j.1471-4159.2007.05088.x
Neufeld TP (2010) TOR-dependent control of autophagy: biting the hand that feeds. Curr Opin Cell Biol 22:157–168. https://doi.org/10.1016/j.ceb.2009.11.005
Muniz-Feliciano L, Doggett TA, Zhou Z, Ferguson TA (2017) RUBCN/rubicon and EGFR regulate lysosomal degradative processes in the retinal pigment epithelium (RPE) of the eye. Autophagy13:2072–2085. https://doi.org/10.1080/15548627.2017.1380124
Kim JY, Zhao H, Martinez J, Doggett TA, Kolesnikov AV, Tang PH, Ablonczy Z, Chan CC, Zhou Z, Green DR, Ferguson TA (2013) Noncanonical autophagy promotes the visual cycle. Cell 154:365–376. https://doi.org/10.1016/j.cell.2013.06.012
Yefimova MG, Lefevre C, Bashamboo A, Eozenou C, Burel A, Lavault MT, Meunier AC, Pimentel C, Veau S, Neyroud AS, Jaillard S, Jégou B, Bourmeyster N, Ravel C (2020) Granulosa cells provide elimination of apoptotic oocytes through unconventional autophagy-assisted phagocytosis. Hum Reprod 35:1346–1362. https://doi.org/10.1093/humrep/deaa097
Chang D, Feng J, Liu H, Liu W, Sharma L, Dela Cruz CS (2020) Differential effects of the Akt pathway on the internalization of Klebsiella by lung epithelium and macrophages. Innate Immun 26:618–626. https://doi.org/10.1177/1753425920942582
Sonnino S, Aureli M, Mauri L, Ciampa MG, Prinetti A (2015) Membrane lipid domains in the nervous system. Front Biosci (Landmark Ed) 20:280–302. https://doi.org/10.2741/4309
Head BP, Patel HH, Insel PA (2014) Interaction of membrane/lipid rafts with the cytoskeleton: impact on signaling and function: membrane/lipid rafts, mediators of cytoskeletal arrangement and cell signaling. Biochim Biophys Acta 1838:532–545. https://doi.org/10.1016/j.bbamem.2013.07.018
Rengarajan M, Hayer A, Theriot JA (2016) Endothelial Cells Use a Formin-Dependent Phagocytosis-Like Process to Internalize the Bacterium Listeria monocytogenes. PLoS Pathog 12:e1005603. https://doi.org/10.1371/journal.ppat.1005603
Sasaki N, Itakura Y, Toyoda M (2017) Ganglioside GM1 contributes to extracellular/intracellular regulation of insulin resistance, impairment of insulin signaling and down-stream eNOS activation, in human aortic endothelial cells after short- or long-term exposure to TNFα. Oncotarget 9:5562–5577. https://doi.org/10.18632/oncotarget.23726
Asou H, Hirano S, Uyemura K (1989) Ganglioside composition of astrocytes. Cell Struct Funct 14:561–568. https://doi.org/10.1247/csf.14.56
Masco D, Flott B, Seifert W (1989) Astrocytes in cell culture incorporate GM1 ganglioside. Glia 2:231–240. https://doi.org/10.1002/glia.440020404
Sasaki N, Itakura Y, Toyoda M (2015) Ganglioside GM1 Contributes to the State of Insulin Resistance in Senescent Human Arterial Endothelial Cells. J Biol Chem 290:25475–25486. https://doi.org/10.1074/jbc.M115.684274
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


