Журнал эволюционной биохимии и физиологии, 2021, T. 57, № 6, стр. 494-499
УЛЬТРАСТРУКТУРА ЯДРЫШЕК НЕЙРОНОВ СЕНСОМОТОРНОЙ ОБЛАСТИ НЕОКОРТЕКСА КРЫС В НЕОНАТАЛЬНЫЙ ПЕРИОД ПОСЛЕ ВОЗДЕЙСТВИЯ ПЕРИНАТАЛЬНОЙ ГИПОКСИИ И ФАРМАКОЛОГИЧЕСКОЙ КОРРЕКЦИИ
В. А. Отеллин 1, *, Л. И. Хожай 1, Т. Т. Шишко 1, Е. А. Вершинина 1
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: v.otellin@mail.ru
Поступила в редакцию 05.04.2021
После доработки 28.05.2021
Принята к публикации 06.06.2021
Аннотация
Вопросы становления головного мозга во время раннего постнатального периода и воздействия в это время перинатальной гипоксии, которая может приводить к развитию нейропсихичесой патологии, относятся к числу актуальных медицинских и социальных проблем. Известно, что ядрышки нейронов неокортекса осуществляют биосинтез субъединиц рибосом и участвуют в различных морфогенетических процессах. При изучении воздействия перинатальной гипоксии на развивающийся головной мозг (на модели энцефалопатии новорожденных) выявлены изменения в ультраструктурной организации ядрышек нейронов неокортекса и численного соотношения их типов. У контрольных животных по мере развития в неонатальный период имеет место увеличение числа ядрышек как гранулярного, так и ретикулярного типов, что может быть связано с процессингом рРНК. Появление к концу неонатального периода скоплений гранул – субъединиц рибосом возле ядерной мембраны ядра – может быть связано с дифференцировкой нервных клеток и формированием шероховатого эндоплазматического ретикулума. В настоящей работе установлен факт изменения численного соотношения гранулярного и ретикулярного типов ядрышек в ядрах нейронов после воздействия перинатальной гипоксии по сравнению с контрольными значениями. Полученные результаты дают основание предполагать, что ядрышки ядер нейронов неокортекса являются мишенью воздействия перинатальной гипоксии, т.е. звеном в патогенезе этого заболевания. Применение фенибута (ноотропного препарата, производного ГАМК) после воздействия гипоксии выявило его влияние на численное соотношение разных типов ядрышек, которое не отличалось от контрольных величин. Вероятно, фенибут может оказывать нейропротекторный эффект, воздействуя на ультраструктурную организацию ядрышек ядер нейронов неокортекса.
ВВЕДЕНИЕ
В настоящем исследовании мы сосредоточили внимание на периоде новорожденности, когда активно протекают процессы адаптации к новым условиям существования (изменение типов дыхания и питания, воздействие изменившейся температуры, гравитации). В это время реализуются запрограммированные гистогенетические процессы пролиферации, миграции и дифференцировки всех структурных элементов нервной ткани. Происходит становление и упорядочение слоев неокортекса, активно протекают синаптогенез и ангиогенез. В это время, как свидетельствуют многочисленные данные литературы и подтверждающие их наши собственные наблюдения, головной мозг отличается высокой чувствительностью к воздействию неблагоприятных факторов среды [1]. Среди них существенное место принадлежит часто встречающейся гипоксии-ишемии, которая приводит к развитию энцефалопатии новорожденных и ее проявлениям в виде нервно-психических заболеваний и расстройств на всех этапах последующего онтогенеза. Отдаленные последствия перинатальной патологии обусловливают основные неврологические нарушения – задержку моторного, психического, речевого развития, расстройства процессов памяти, внимания, эмоций, сна, и занимают первое место среди всех заболеваний нервной системы в детском возрасте.
В последние годы при изучении механизмов перинатальных повреждений головного мозга и ряда других внутренних органов получило распространение представление о стрессе эндоплазматического ретикулума (СЭР). Эта реакция инициируется ишемией, воспалением и воздействиями других неблагоприятных факторов, что приводит к нарушению основных физиологических функций данной органеллы. К их числу, как известно, относятся процессы сворачивания белков (фолдинг белков), внутриклеточное хранение Са2+ и синтез ненасыщенных жирных кислот, стеринов и фосфолипидов. Нарушение даже одной из этих функций может привести к “напряжению эндоплазматического ретикулума”, его стрессу за счет накопления в нем недавно синтезированных неспирализованных протеинов [1–3]. При этом мы не нашли данных в отношении реакций ядрышек ядер нейронов на перинатальную гипоксию [4–6]. Поэтому представляется актуальным исследование участия ядрышек в ответных реакциях развивающегося мозга на воздействие гипоксии, что может расширить знания и в отношении патогенеза эцефалопатий новорожденных.
Задачей настоящего исследования явилось изучение ультраструктурных характеристик ядрышек ядер нейронов сенсомоторной области неокортекса крыс в ранний (П5) и поздний (П10) неонатальный периоды после воздействия перинатальной гипоксии и последующего применения фенибута (препарата, производного ГАМК) (данное фундаментальное исследование ориентировано на нужды клиники).
МАТЕРИАЛЫ И МЕТОДИКА
В литературе господствует обоснованное мнение о том, что для моделирования энцефалопатий новорожденных наиболее пригодны грызуны. В данной работе использованы новорожденные крысы линии Wistar, полученные из питомника Института физиологии им. И.П. Павлова РАН.
Воздействие гипоксии. Воздействие гипоксии на мозг новорожденных крыс осуществляли на 2-е постнатальные сутки. Эти животные помещались на 1 ч в камеру с проточной газовой смесью, содержащей: кислорода – 7.8%; углекислого газа – 0.4% и азота – 91.8%, при температуре – 21.3–23.0°С и нормальном общем давлении. В работе было использовано 3 группы животных: 1 экспериментальная группа – крысы, подвергавшиеся в барокамере воздействию гипоксии; 2 экспериментальная группа – крысы, получавшие после воздействия гипоксии фенибут; 3 контрольная группа – интактные животные того же возраста. Каждая группа содержала по 8 крыс.
Средство фармакологической коррекции. Фенибут (ноотропный препарат, синтезированный на основе ГАМК и зарегистрированный в РФ как лекарственное средство) вводили подкожно в терапевтической дозе 15 мг/кг в течение 10 дней после воздействия гипоксии.
Электронномикроскопический метод. Для ультраструктурного исследования фрагменты сенсомоторной области неокортекса крыс на 5-е и 10-е постнатальные сутки (П5 и П10) фиксировали в 2.5% растворе глютаральдегида на 0.1 М фосфатном буфере (ph 7.4) c добавлением сахарозы, дополнительно фиксировали 2% раствором тетроксида осмия и заключали в эпон. Из блоков делали полутонкие срезы и ориентировали блок на Ш-1У слои, где присутствуют нормохромные пирамидные нейроны. Ультратонкие срезы получали на ультратоме LKB-III, которые помещали на сетки и контрастировали 1.5% раствором уранилацетата и цитратом свинца. Ультратонкие срезы анализировали под электронным микроскопом фирмы Tecnai G2 Spirit (FEI, Германия) при ускоряющем напряжении 70 кВ.
Методы статистической обработки. Анализ данных проводили на изображениях, полученных при исследовании материала под электронным микроскопом. Для статистческого анализа данных в каждой группе из 8 животных: контрольная группа, воздействие гипокси, воздействие гипоксии и применение фенибута, было взято по 100 изображений, на основании которых были рассчитаны проценты присутствия в ядрах ядрышек гранулярного и ретикулярного типов. Сравнение частоты присутствия того или другого типа ядрышек проводились с использованием критерия χ2 . Поскольку сумма частот ядрышек гранулярного и ретикулярного типов равна 100%, то результаты, полученные при сравнении частот встречаемости ядрышек гранулярного типа и ретикулярного типа, полностью совпадают.
РЕЗУЛЬТАТЫ
Исследование контрольных животных. У контрольных крыс в неонатальный период в ядрах пирамидных нейронов сенсомоторной области неокортекса выявлены разные типы ядрышек, основными из которых являются гранулярный и ретикулярный, отличающиеся различным соотношением гранулярного и фибриллярного компонента.
На П5 (в ранний неонатальный период) у контрольных крыс в ядрах большинства нейронов определяется 2, изредка 3 эксцентрично расположенных ядрышка, как правило, прилежащих к кариолемме, и состоящих из гранулярного компонента (ГК). Такие ядрышки представляют гранулярный тип и составляют 72% от общего числа ядрышек, присутствующих в ядрах исследованных нейронов. У таких ядрышек слабо выражен плотный фибриллярный компонент (ПФК), в них присутствует небольшое число (2–4) нуклеолярных лакун. На этом сроке исследования в ядрах нейронов выявлены и ядрышки, представляющие ретикулярный тип (их 25%). Они содержат, в основном, плотный фибриллярный компонент (ПФК) (рис. 1) .
Рис. 1.
Соматосенсорная область неокортекса крысы на П5. Ультраструктурная организация ядрышка гранулярного типа. Контроль. Ув.30 000 (масштабная линейка = 1 мкм). DFC – dense fibrillary component \ плотный фибриллярный компонент; FC – fibrillary centre\фибриллярный центр.

В ядрах нейронов встречаются ядрышки, содержащие как гранулярный, так и фибриллярный компоненты в равном количестве. Таких ядрышек мало, 3% от общего числа исследованных ядрышек, при этом между ядрышком и кариолеммой ядра, как правило, присутствуют скопления субъединиц рибосом и фрагменты гетерохроматина, ассоциированного с ядрышком. Полученные данные согласуются с наблюдениями других авторов [5, 7].
На П10 (в поздний неонатальный период) у контрольных животных размер ядрышек увеличивается, они могут занимать как центральное положение, так и прилежать к ядерной оболочке. По сравнению с П5 возрастает количество ядрышек ретикулярного типа (до 35%), в них увеличиваются доля фибриллярного компонента и число мелких фибриллярных центров (ФЦ) (рис. 2а). В зоне ПФК появляется грануллярный компонент (скопление субъединиц рибосом). Следует отметить более высокую степень дифференцировки перикариона нейронов по сравнению с П5, наблюдаются начальные этапы формирования шероховатого эндоплазматического ретикулума.
Рис. 2.
Соматосенсорная область неокортекса крысы на П10. (а) – ультраструктурная организация ядрышка фибриллярного типа. Контроль. Ув. 40 000 (масштабная линейка = 1 мкм); (b) – ядрышко фибриллярного типа с увеличенным плотным фибриллярным компонентом и возросшим числом мелких фибриллярных центров. Ув.40 000 (масштабная линейка = 1 мкм). GC – granular cоmponent\гранулярный компонент; DFC – dense fibrillary component\плотный фибриллярный компонент; FC – fibrillary centre\фибриллярный центр.

Исследование животных после воздействия гипоксии. На П5 под воздействием гипоксии изменяются как положение ядрышек в ядре, так и соотношение в них ультраструктурных компонентов. Увеличивается число нейронов, в которых ядрышки располагаются по периферии ядра в непосредственной близости от ядерной мембраны, ее пор и расширенного перинуклеарного пространства. Соотношение типов ядрышек составляет 40% гранулярного типа и 60% ретикулярного, χ2(1, N = 100) = = 25.06, p < 0.001 (по сравнению с контролем). В ядрышках последнего типа возрастает доля светлых крупных фибриллярных центров (рис. 2b). Одновременно увеличивается число некрупных ядрышек с мелкими фибриллярными центрами, окруженными ПФК (рис. 3а). Во всех ядрышках имеет место выраженное увеличение гранулярного компонента.
Рис. 3.
Соматосенсорная область неокортекса крыс на П5 и П10 после воздействия перинатальной гипоксии. (а) – ядрышки фибриллярного типа с увеличенным числом мелких фибриллярных центров и тесно прилежащих к расширенному перинуклеарному пространству; уменьшение числа гранул – субъединиц рибосом (П5). Увеличение 60 000 (масштабная линейка = 1 мкм); (b) – ядрышки фибриллярного типа, преобладающие в ядре; концентрация гранулярного материала у перинуклеарного пространства (П10). Увеличение 60 000 (масштабная линейка = 1 мкм). GC – granular cоmponent\гранулярный компонент; DFC – dense fibrillary component\плотный фибриллярный компонент; FC – fibrillary centre\фибриллярный центр. LFC – little fibrillary centre\мелкий фибриллярный центр.

На П10 (к концу неонатального периода) у животных, перенесших перинатальную гипоксию, изменяется численное соотношение типов ядрышек: ядрышки гранулярного типа составляют 45%, а ретикулярного 55% χ2(1, N = 100) = 8.08, p = 0.005, (при этом 75% из них содержит крупные ФЦ, а 25% – мелкие ФЦ, что не отмечалось в контроле, рис. 3b).
Отмеченные изменения ультраструктурной организации ядрышек после воздействич гипоксии сочетаются с описанной нами ранее в аналогичных экспериментах задержкой дифференцировки нейронов [8]. Об этом говорят слабое развитие цитоплазмы и ее малый объем, практически полное отсутствие признаков усложнения шероховатого и гладкого эндоплазматического ретикулумов.
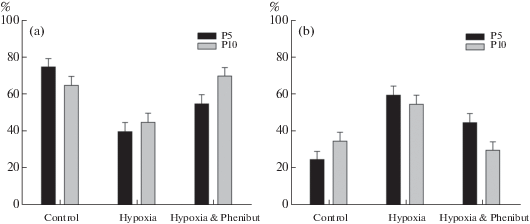
Применение фенибута. В экспериментах с использованием фенибута (препарата, производного ГАМК) выявило его влияние на численное соотношение разных типов ядрышек в ядрах нейронов после воздействия гипоксии. Так, на П5 после воздействия гипоксии и введения фенибута типы ядрышек распределялись следующим образом: гранулярный тип составлял 55%, а ретикулярный 45%, χ2(1, N = 100) = 4.5, p = 0.034, т.е. по сравнению с животными, пережившими только воздействие гипоксии, число ядрышек гранулярного типа возрастало, а ретикулярного типа снижалось. Вероятно, фенибут может оказывать влияние на структурную организацию ядрышек (хотя отличие от контроля все еще остается значимым: χ2(1, N = 100) = 8.79, p = 0.003). На П10 эксперимента результат оказался разительным: после введения препарата число типов ядрышек практически не отличалось от контрольных величин (70% ядрышек гранулярного типа и 30% ретикулярного типа против соответственно 65% и 35%,) и на высоком уровне значимости отличалось от чисто гипоксического воздействия, χ2(1, N = 100) = 12.79, p = 0.001. При этом различия между процентом ядрышек гранулярного типа на П5 и П10 после воздействия гипоксии с использованием препарата значимы: χ2(1, N = 100) = 4.8, p = = 0.028 (рис. 4). Это позволяет предполагать, что фенибут может обладать нейропротекторным свойством.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На нашем материале, касающемся возрастной динамики, и в экспериментах с воздействием перинатальной гипоксии проявляется высокая динамичность ультраструктур ядрышек изучавшихся неокортикальных нейронов, в результате чего изменяются частота встречаемости и соотношение типов ядрышек. К настоящему времени иммуноцитологами и биохимиками получены данные, позволяющие судить о функциональной роли отдельных ультраструктур ядрышек разных типов. Так, отмеченное нами изменение количества гранулярного компонента на протяжении неонатального периода, концентрация гранулярного компонента у ядерной мембраны и ее пор могут рассматриваться как начальный этап транспорта субъединиц рибосом в цитоплазму нейронов [6], где они будут участвовать в дифференцировке нейронов. Интересно, что в течение неонатального периода возрастает число ядрышек ретикулярного типа, содержащих, в основном, плотный фибриллярный компонент (ПФК), состоящий из тонких плотно упакованных фибрилл высокой электронной плотности. Здесь выявлены белки, участвующие в этапах процессинга рРНК, и рибонуклеопротеиновые комплексы, содержащие малые ядрышковые РНК [5, 9]. Появление же на П10 скопления субъединиц рибосом может быть связано с развитием процесса дифференцировки нервных клеток, когда в их цитоплазме начинает формироваться шероховаый эндоплазматический ретикулум.
В настоящей работе установлен факт изменения соотношения типов ядрышек после воздействия перинатальной гипоксии. Поскольку наши эксперименты проведены на модели энцефалопатии новорожденных, есть основание полагать, что и ядрышки ядер нейронов неокортекса являются мишенью воздействия гипоксии, т.е. в патогенез энцефалопатий вовлечены и ядрышки нейронов. Увеличение числа ядрышек ретикулярного типа после воздействия гипоксии, в которых возрастает число крупных и мелких фибриллярных центров, предполагает нарушение процессов транскрипции генов рРНК [9, 10]. Что касается интерпретации факта положительного влияния фенибута на изменение численного соотношения типов ядрышек после воздействия гипоксии, возвращая его к контрольным значениям, то она на настоящем этапе исследования затруднительна, и может быть сведена только к предположению о нейропротективном свойстве фенибута в неонатальный период развития [11, 12].
Список литературы
Дедов И.И., Смирнова О.М., Горелышев А.С. (2012) Стресс эндоплазматического ретикулума: цитологический сценарий патогенеза заболеваний человека. Проблемы эндокринологии 5: 57–65. [Dedov I.I., Smirnova O.M., Gorelyshev A.S. (2012) Stress of endoplasmic reticulum: scenario of pathogenesis of human diseases. Problemy endocrinologii 5: 57–65. (In Russ)].
Diaz H.S., Andrade D.C., Toledo C. (2020) Inhhibicion of brainstem endoplasmic reticulum stress rescues cardiorespiratory disfunction in high output heart failure. Hypertension 14: 12016056. https://doi.org/10.1161/ Hypertension HA 120.16056
Osman A., El-Gamal H., Pasha M., Zeidan A., Korashy H.M., Abdelsalam S.S., Hasan M., Benameur T., Agouni A. (2020) Endoplasmic reticulum (ER) stress- generated extracellural vesicles self-perpetuate ER stress and mediate endothelial cell disfunction independenly of cell survival. Front Cardiovasc Med 10: 7:584791. https://doi.org/10.3389/fcvm.2020.584791
Hernandez-Verdun D., Roussel P., Thiry M., Sirri V., Lafontaine D.L.J. (2010) The nucleolus: structure/function relationship in RNA metabolism. Wiley Interdiscip Rev RNA 1: 3: 415–431. https://doi.org/10.1002/wrna.39
Németh A., Grummt I. (2018) Dynamic regulation of nucleolar architecture Curr Opin Cell Biol 52: 105–111. https://doi.org/10.1016/j.ceb.2018.02.013)
Latonen L. (2019) Phase-to-phase with nucleoli – stress responses, protein aggregation and novel roles of RNA. Front Cell Neurosci 13: 151: 1–10. https://doi.org/3389/fncel.2019.00151)
Зиматкин С.М., Заерко А.В., Федина Е.М. (2020) Ядрышки в развивающихся гистаминергических нейронах мозга крысы Морфология 158: 4–5: 07–13 [Zimatkin S.M., Zaerko A.V., Fedina E.M. (2020) Nucleoli in devtloping histaminergic neurons of the rat brain Morphology 158:4-5: 7–13 (in Russ)].
Отеллин В.А., Хожай Л.И., Ватаева Л.А., Шишко Т.Т. (2011) Отдаленные последствия воздействия гипоксии в перинатальный период развития на структурно-функциональные характеристики мозга у крыс. Рос физиол журнал им. И.М. Сеченова 97 (10): 1092–1100. [Otellin V.A., Khozhai L.I., Vataeva L.A., Shishko T.T. (2011) Long-term effects of exposure to hypoxia in perinatal development on structural and functional characteristics of the brain in rats. Russ J Physiol 97 (10): 1092–1100. (In Russ)].
Otellin V.A., Khozhai L.I., Vataeva L.A. (2012) Effect of hypoxia in early perinatal ontogenesis on behavior and structural characteristics of the rat brain J Evol Biochem Physiol. 48: 467–473.
Hernandez-Verdun D. (2011) Structural organization of the nucleolus as a consequence of the dynamics of ribosome biogenesis. The nucleolus (in Protein Reviews) 15: 1: 3–28. https://doi.org/10.1007/978-1-4614-0514-6_1
Villacís L., Mei S., Ferguson L., Hein N., Amee G. Hannan K. (2018) New Roles for the Nucleolus in Health and Disease. Rev Bioessays 40: 5: e1700233. https://doi.org/10.1002/bies.201700233
Отеллин В.А., Хожай Л.И., Шишко Т.Т., Тюренков И.Н. (2016) Отдаленные последствия перинатальной гипоксии и их возможная фармакологическая коррекция: реакции нервных клеток и синапсов неокортекса. Морфология 150: 6: 7–12. [Otellin V.A., Khozhai L.I., Shishko T.T., Tyurenkov I.N. (2016) Remote consequences of perinatal hypoxia and their posssible pharmacological correction: reactions of neocortical nerve cells and synapses. Morphlogy 150: 6: 7–12. (In Russ)].
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии