Журнал эволюционной биохимии и физиологии, 2021, T. 57, № 6, стр. 469-474
ВЛИЯНИЕ ВАЗОПРЕССИНА НА КОЛЛАГЕНАЗНУЮ АКТИВНОСТЬ КЛЕТОК ПАПИЛЛЯРНОЙ ЗОНЫ ПОЧЕК КРЫС
С. Г. Дзгоев *
Институт биомедицинских исследований Владикавказского Научного центра Российской академии наук
г. Владикавказ, Россия
* E-mail: stanislavdzgoev@yandex.ru
Поступила в редакцию 14.05.2021
После доработки 20.06.2021
Принята к публикации 21.06.2021
Аннотация
Для того чтобы выяснить, могут ли матриксные металлопротеиназы участвовать в реализации антидиуретического эффекта вазопрессина, методом зимографии исследовано влияние гормона на желатиназную активность клеток почечного сосочка крыс линии Вистар. Показано, что добавление гормона к суспензии клеток почечного сосочка вызывало увеличение желатиназной активности белков с молекулярной массой 52, 57 и 89 кДа. Данный эффект имитировался V2-агонистом вазопрессина десмопрессином. Вазопрессин, но не десмопрессин, вызывал увеличение секреции клетками почечного сосочка 57 и 89 кДа-белка в среду инкубации. Обсуждается роль матриксных металлопротеиназ в увеличении водной проницаемости межклеточного матрикса почечного сосочка под влиянием вазопрессина.
ВВЕДЕНИЕ
Состояние межклеточного матрикса почечной медуллы может оказывать существенное влияние на транспорт воды из собирательных трубок нефронов в кровеносные сосуды, создавая сопротивление осмотическому току жидкости. Как известно, главным гормоном, обеспечивающим реабсорбцию воды в почках млекопитающих и человека, является вазопрессин [1, 2]. Гормон, связываясь с V2-рецепторами, запускает процесс встраивания в мембраны клеток собирательных трубок нефронов аквапорины, в результате чего вода поступает из просвета собирательных трубок в межклеточное пространство почечной медуллы, а затем с током крови возвращается в организм [3]. Помимо увеличения водной проницаемости стенки собирательных трубок вазопрессин стимулирует деполимеризацию основного компонента межклеточного матрикса – гиалуроновой кислоты [4]. Этот эффект гормона связан с регуляцией ферментов почечной медуллы, участвующих в синтезе и распаде гиалуроновой кислоты [5, 6]. Помимо гиалуроновой кислоты еще одним важнейшим компонентом, формирующим структуру соединительной ткани, являются коллагеновые белки, центральную роль в обмене которых играют коллагеназы – матриксные металлопротеиназы (ММП), относящиеся к семейству внеклеточных протеиназ. Известно, что ММП участвуют в процессах нормального развития и ремоделирования внеклеточного матрикса, эмбриогенезе, репарации тканей, неоангиогенезе, а также в ряде почечных и других патологий [7]. В нашем недавнем исследовании было обнаружено, что коллагеназы могут оказывать дозозависимое влияние на гиалуронидазную активность почечного сосочка крыс, и было высказано предположение, что увеличение водной проницаемости межклеточного матрикса между собирательными трубками и кровеносными сосудами под регулирующим влиянием вазопрессина осуществляется за счет не только деполимеризации гиалуроновой кислоты, но и деградации коллагеновых волокон [8]. В этой связи представляло интерес выяснить, может ли вазопрессин влиять на активность коллагеназ клеток почечного сосочка.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты проводили на самцах крыс линии Вистар массой 250–300 г, которые содержались на стандартной диете в условиях вивария. Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и рекомендациям биоэтического комитета Института биомедицинских исследований Владикавказского Научного центра Российской академии наук. В одном эксперименте использовали одну-две крысы, которых декапитировали, извлекали почки, выделяли сосочковые зоны и измельчали их до кусочков объемом 1–3 мм3. Затем измельченные кусочки помещали в буфер ( pH 7.4), содержащий 135 мМ NaCl, 5 мМ KCl, 1 мМ CaCl2, 1.2 мМ MgSO4, 2 мМ NaH2PO4, 10 мМ глюкозу, 10 мМ трис-HCl (“Serva”, Германия), 10 мМ HEPES (“Serva”, Германия), и использовали для получения клеток почечного сосочка по описанному нами ранее методу, но с некоторыми изменениями [9]. Измельченные кусочки почечных сосочков, находящиеся в охлажденном буфере объемом 2 мл, помещали в устройство, состоящее из двух шприцов объемом 5 мл, соединенных друг с другом через иглу с внутренним диаметром 0.5 мм, и дезинтегрировали, прогоняя буфер с кусочками ткани из одного шприца в другой. Обычно 8–10 раз было достаточно для образования однородной суспензии. Затем суспензию фильтровали через капроновый фильтр с диаметром пор 0.2 мм и центрифугировали 5 мин при 100 g и 4°С. Полученный осадок переосаждали 3 раза в 1 мл буфера. Осадок, состоящий из клеточных конгломератов и канальцевых фрагментов, ресуспендировали в буфере до концентрации 3–5 мг/мл. Аликвоты по 50 мкл суспензии разносили в 3 пробирки с физраствором (контроль), аргинин-вазопрессином (10–7 М, AVP, “Sigma” США), десмопрессином (10–7 М, dDAVP, “Sigma” США) и инкубировали 60 мин при 37°С. После инкубации пробирки центрифугировали 5 мин при 200 g, надосадочную жидкость отбирали и переносили в другие пробирки, а к осадку добавляли по 50 мкл буфера. Затем во все пробирки добавляли эквивалентный объем буфера (рН 7.5), содержащего 20 мМ Трис-HCl, 4%‑й додецилсульфат натрия (“Serva”, Германия), и оставляли при комнатной температуре, как минимум, на один час. После чего образцы исследовали при помощи зимографии.
Зимография. Электрофоретическое разделение белков проводили в полиакриламидном геле с сополимеризованным желатином (1 мг/мл). Диск-электрофорез белков проводили в системе Лэммли в присутствии додецилсульфата натрия, но без редуцирующего агента [10]. Концентрация поли-акриламида верхнего и разделяющего геля была 4% и 7.5%. Электрофорез проводили при 150 В (20–25 мА) и температуре 4°С в течение 70–90 мин. После электрофореза гель инкубировали с неионным детергентом Тритоном Х–100 (2.5%) при комнатной температуре в течение 80 минут. Затем гель промывали в буфере, содержащем 20 мМ Трис-НCl, 5 мМ CаCl2, рН 7.5 и инкубировали в этом же буфере в течение 18–24 ч при температуре 37°С. Для выявления областей, свободных от желатина, гель сначала инкубировали 1–2 часа при комнатной температуре в растворе (25% этанол, 10% уксусная кислота), содержащем белковый краситель кумасси бриллиантовый синий R-250 (0.1%). Затем гель открашивали этим же раствором, только без красителя. Определение молекулярной массы белков, обладающих желатиназной активностью, делали, сканируя окрашенный гель на денситометре GS-900 с программным обеспечением Image Lab (“Bio-Rad”, США). В качестве стандартов для определения молекулярной массы белков применялся набор рекомбинантных белков (“Bio-Rad”, США).
Реактивы, у которых не указаны фирмы и страна-производитель, были отечественного производства и имели градацию не ниже “чда”.
Концентрацию белка определяли по методу М. Брэдфорд [11].
Статистическую обработку полученных данных проводили с использованием однофакторного дисперсионного анализа (ANOVA) в программе STATISTICA. Анализ выборок на нормальность распределения проводили методом Шапиро-Уилка. Достоверность отличий между группами оценивали по критерию Ньюмена-Кейлса. Данные выражали как средние значения ± ошибка среднего (M±m).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Как видно из рис. 1, в клетках почечного сосочка крыс линии Вистар наиболее четко выявлялись 4 белковые зоны с молекулярной массой 52, 57, 89 и 250 кДа, обладающие желатиназной активностью. При этом максимальная желатиназная активность была характерна для двух белков с молекулярной массой 57 и 89 кДа.
Рис. 1.
Зимограмма клеток почечного сосочка в присутствии вазопрессина (AVP) и десмопрессина (dDAVP). Справа указаны молекулярные массы белков, проявляющих желатиназную активность. Желатиназные спектры, показанные на рисунке, являются результатом одного из 7 отдельных экспериментов.
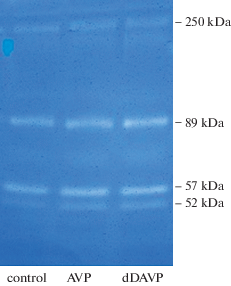
Добавление в среду инкубации клеток вазопрессина в концентрации 10–7 М вызывало рост желатиназной активности в клетках. Использование данной концентрации гормона было обусловлено тем, что в предварительных экспериментах было установлено, что данный эффект гормона начинал проявляться с концентрации 10–9 М и усиливался по мере увеличения концентрации вазопрессина вплоть до 10–7–10–6 М. Несмотря на то что при получении клеточной суспензии не использовали какие-либо гидролитические ферменты, способные повредить мембранные рецепторы вазопрессина, тем не менее, очевидно, что механическая дезинтеграция канальцевых структур нефронов и компонентов межклеточного матрикса также снижает реактивность клеток на физиологические концентрации гормона.
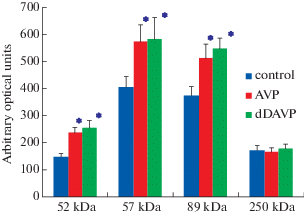
В присутствии вазопрессина желатиназная активность белков с молекулярной массой 52, 57 и 89 кДа возрастала, в среднем, на 25–45% (рис. 2). Данный эффект гормона имитировался V2-агонистом вазопрессина десмопрессином.
Рис. 2.
Желатиназная активность белков клеток почечного сосочка в присутствии вазопрессина (AVP) и десмопрессина (dDAVP). Результаты, представленные на рисунке, являются средними значениями 7 отдельных экспериментов. Звездочками указана достоверность отличий при р < 0.05 по сравнению с контролем.
Для того, чтобы выяснить, какие белки, обладающие желатиназной активностью, могут секретировать клетки почечного сосочка, а также установить, влияют ли на этот процесс вазопрессин и его V2-агонист десмопрессин, после инкубации с реагентами и осаждения клеток, надосадочную жидкость от каждого образца анализировали при помощи желатиновой зимографии, как это описано в “Материалах и методах”.
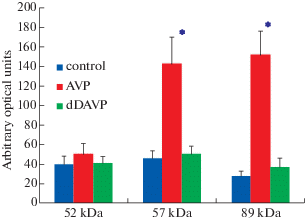
Как видно на рис. 3, в отсутствие гормона среда инкубации клеток почечного сосочка содержала две наиболее четко выраженные белковые зоны в районе 52 и 57 кДа, проявляющие желатиназную активность. Также минорная желатиназная активность прослеживалась в районе 89 кДа, а также вверху геля. В присутствии вазопрессина желатиназная активность белков с молекулярной массой 57 и 89 кДа возрастала в несколько раз по сравнению с контролем, в то время как десмопрессин не оказывал никакого влияния на активность желатиназ (рис. 4).
Рис. 3.
Зимограмма среды инкубации клеток почечного сосочка в присутствии вазопрессина (AVP) и десмопрессина (dDAVP). Справа указаны молекулярные массы белков, проявляющих желатиназную активность. Желатиназные спектры, показанные на рисунке, являются результатом одного из 7 отдельных экспериментов.

Рис. 4.
Желатиназная активность среды инкубации клеток почечного сосочка в присутствии вазопрессина (AVP) и десмопрессина (dDAVP). Результаты, представленные на рисунке, являются средними значениями 7 отдельных экспериментов. Звездочками указана достоверность отличий при р <0.05 по сравнению с контролем.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Центральную роль в обмене коллагеновых белков выполняют внеклеточные протеиназы, относящиеся к семейству матриксных металлопротеиназ. Они синтезируются разными типами клеток, включая клетки соединительной ткани и эпителиальные клетки. На сегодняшний день известно около 30 ММП, на основании субстратной специфичности и гомологии которых они подразделяются на шесть групп: коллагеназы, желатиназы, стромелизины, матрилизины, ММП мембранного типа и другие ММП [12]. Следует отметить, что гидролизовать желатин способны не только желатиназы, но и некоторые представители других групп ММП [13].
Как видно из результатов данной работы, клетки папиллярной зоны почек крыс содержали ряд белков, способных гидролизовать желатин. Вазопрессин вызывал рост желатиназной активности 52, 57 и 89 кДа-белков на 25–45%. Этот эффект имитировался V2-агонистом десмопрессином, что доказывает участие V2-рецепторов в регуляции активности этих белков. В почках различные отделы нефрона и собирательные трубки содержат как V1, так и V2-рецепторы вазопрессина. V2-рецепторы располагаются, главным образом, в дистальных отделах нефронов и собирательных трубках. Кроме того, V1а-рецепторы находятся в кровеносных сосудах и клетках соединительной ткани почечной медуллы [14, 15]. Если учесть, что почечная папилла, в основном, состоит из собирательных трубок [16], в которых присутствуют V2-рецепторы вазопрессина, а интерстициальные клетки содержат только V1а-рецепторы, то рост желатиназной активности под влиянием гормона, продемонстрированный в данном исследовании, может происходить в клетках собирательных трубок. Но, с другой стороны, увеличение секреции клетками почечного сосочка гидролизующих желатин белков наблюдалось только в присутствии вазопрессина, но не десмопрессина. Это указывает на то, что в этом процессе участвуют V1-рецепторы вазопрессина, которые присутствуют и в интерстициальных клетках.
Полученные нами результаты согласуются с имеющимися в литературе единичными данными, предполагающими особую физиологическую роль желатиназ в собирательных трубках нефронов. На культуре главных клеток собирательных трубок нефронов кроликов авторами было продемонстрировано, что добавление вазопрессина в среду инкубации клеток подавляло секрецию желатиназы Б, не оказывая никакого влияния на желатиназу А [17]. В настоящем исследовании вазопрессин, наоборот, вызывал рост секреции 57 и 89 кДа-белков, обладающих желатиназной активностью. Данное противоречие можно объяснить как видовыми особенностями, так и тем, что интерстициальные клетки, окружающие собирательные трубки в интактной папилле, могут сами при участии V1-рецепторов вазопрессина секретировать желатиназы, а также оказывать модулирующее влияние на синтез и секрецию собирательными трубками желатиназ. Кроме того, следует отметить, что папиллярные собирательные трубки состоят из клеток, структурно и функционально отличающихся от главных клеток, расположенных в верхней части собирательных трубок [18].
Желатиназы являются одной из групп матриксных металлопротеиназ, включающих два фермента: ММП-2 (желатиназа-А) и ММП-9 (желатиназа-Б). Экспрессия желатиназы А и Б, наряду с другими металлопротеиназами, продемонстрирована для разных отделов нефронов млекопитающих [19]. Субстратом желатиназ являются желатин, коллаген IV типа и целый ряд других интерстициальных белков. Как и все ММП, желатиназы секретируются в межклеточный матрикс в латентной форме, где затем активируются за счет ограниченного протеолиза [7].
Согласно разным литературным источникам молекулярная масса ММП-2 и ММП-9 в латентной форме у крыс находится в районе 68 и 90–95 кДа, а в активированной – в районе 57–62 и 82–88 кДа соответственно [17, 20, 21]. Выявленные в данном исследовании белки с молекулярной массой 57 и 52 кДа могут представлять ММП-2 в латентной и активированной форме. Хотя нельзя исключить и того, что это могут быть стромелизины ММП-3 и ММП-10, с молекулярной массой в районе 54 и 62 кДа, субстратом которых также является желатин [13]. К какой группе ММП относятся белки с молекулярной массой 52 и 57 кДа, точно можно будет выяснить в исследованиях с использованием соответствующих антител.
Что касается белка с молекулярной массой в районе 89 кДа, то он, очевидно, представляет собой ММП-9, секреция которого клетками почечного сосочка, также как и секреция 57 кДа-белка, значительно возрастала под влиянием вазопрессина.
Полученные результаты демонстрируют, что вазопрессин может оказывать регулирующее влияние на желатиназную активность клеток почечного сосочка и вызывать секрецию белков, обладающих желатиназной активностью, в межклеточное пространство. Насколько важен данный этап в молекулярном механизме действия гормона, можно будет определить после того, как будет выяснено, какие ММП регулируются вазопрессином. Что, в свою очередь, даст возможность в экспериментах in vivo c использованием соответствующих ингибиторов ММП оценить работу почек при реализации антидиуретического эффекта гормона.
Список литературы
Ivanova L.N. (2012) Vasopressin: molecular mechanisms of its antidiuretic effect. Neuroscience and Behavioral Physiology 42 (7): 661–677.https://doi.org/10.1007/s11055-012-9618-7
Bankir L., Bichet D.G., Morgenthaler N.G. (2017) Vasopressin: physiology, assessment and osmosensation. J Intern Med 282 (4): 284–297. https://doi.org/10.1111/joim.12645
Su W., Cao R., Zhang X.Y., Guan Y. (2020) Aquaporins in the kidney: physiology and pathophysiology. Am J Physiol Renal Physiol 318 (1): F193–F203. https://doi.org/10.1152/ajprenal.00304.2019
Stridh S., Palm F., Takahashi T., Ikegami-Kawai M., Friederich-Persson M., Hansell P. (2017) Hyaluronan Production by Renomedullary Interstitial Cells: Influence of Endothelin, Angiotensin II and Vasopressin. Int. J. Mol. Sci 18 (12): 2701. https://doi.org/10.3390/ijms18122701
Ginetzinsky A.G. (1958) Role of hyaluronidase in the re-absorption of water in renal tubules: the mechanism of action of the antidiuretic hormone. Nature 182: 1218–1219. https://doi.org/10.1038/1821218a0
Ivanova L.N., Babina A.V., Baturina G.S., Katkova L.E. (2017) The effect of vasopressin on the expression of genes of key enzymes of the interstitial hyaluronan turnover and concentration ability in WAG rat kidneys. Russian Journal of Genetics: Applied Research 7 (3): 249–257. https://doi.org/10.1134/S2079059717030066
Tan R.J. and Liu Y. (2012) Matrix metalloproteinases in kidney homeostasis and diseases. Am J Physiol Renal Physiol 302 (11): F1351–F1361. https://doi.org/10.1152/ajprenal.00037
Дзгоев С.Г. (2020) Влияние коллагеназы на активность гиалуронидазы 1-го типа в почечном сосочке и сыворотке крови белых крыс. Рос физиол журн им И.М. Сеченова 106 (1):78–83. [Dzgoev S.G. (2020) Effect of Collagenase on Type 1 Hyaluronidase Activity in Renal Papilla and Serum of White Rats. Russ J Physiol 106 (1): 78–83. (In Russ)]. https://doi.org/10.31857/S0869813920010057
Дзгоев С.Г. (2019) Активность гиалуронидазы 1-го типа в клетках собирательных трубок и интерстиция папиллярной зоны почек крыс. Рос физиол журн им ИМ Сеченова 105 (3): 295–302. [Dzgoev S.G. (2019) Hyaluronidase activity of the 1-st type in the cells of the collecting ducts and interstitium of the papillary zone of rat kidney. Russ J Physiol 105 (3): 295–302. (In Russ)]. https://doi.org/10.1134/S0869813919030038
Laemmli U.K. (1970) Cleavage of Structural Proteins During the Assembly of the Head of Bacteriophage T4. Nature 277:680–685. https://doi.org/10.1038/227680a0
Bradford M.M. (1976) A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem 72: 248–254. https://doi.org/10.1006/abio.1976.9999
Kapoor C., Vaidya S., Wadhwan V., Hitesh K.G., Pathak A. (2016) Seesaw of matrix metalloproteinases (MMPs). Journal of cancer research and therapeutics 12: 28–35. https://doi.org/10.4103/0973-1482.157337
Garcia-Fernandez N., Jacobs-Cachá C., Mora-Gutiérrez J.M., Vergara A., Orbe J., and Soler M.J. (2020) Matrix Metalloproteinases in Diabetic Kidney Disease. J Clin Med 9: 472. https://doi.org/10.3390/jcm9020472
Natochin Y.V., Golosova D.V. (2020) Vasopressin receptors subtypes and renal sodium transport. Vitamins & Hormones 113: 239–258. https://doi.org/10.1016/bs.vh.2019.08.013
Zhuo J.L. (2000) Renomedullary interstitial cells: a target for endocrine and paracrine actions of vasoactive peptides in the renal medulla. Clin Exp Pharmacol Physiol 27 (7): 465–473. https://doi.org/10.1046/j.1440-1681.2000.03277.x
Pannabecker T.L., Dantzler W.H., Layton H.E., and Layton A.T. (2008) Role of three-dimensional architecture in the urine concentrating mechanism of the rat renal inner medulla. Am J Physiol Renal Physiol 295: F1271–F1285. https://doi.org/10.1152/ajprenal.90252.2008
Piedagnel R., Murphy G., Ronco P.M., and Lelongt B. (1999) Matrix Metalloproteinase 2 (MMP2) and MMP9 Are Produced by Kidney Collecting Duct Principal Cells but Are Differentially Regulated by SV40 Large-T, Arginine Vasopressin, and Epidermal Growth Factor. J Biol Chem 274 (3): 1614–1620. https://doi.org/10.1074/jbc.274.3.1614
Christensen E.I., Wagner C.A., Kaissling B. (2012) Uriniferous tubule: structural and functional organization. Compr Physiol 2: 805–861. https://doi.org/10.1002/cphy.c100073
Ailenberg M. and Silverman M. (1996) Cellular activation of mesangial gelatinase A by cytochalasin D is accompanied by enhanced mRNA expression of both gelatinase A and its membrane-associated gelatinase A activator (MT-MMP). Biochem J 313 (Pt3): 879–884. https://doi.org/10.1042/bj3130879
Cui N., Hu M., Khalil R.A. (2017) Chapter One-Biochemical and Biological Attributes of Matrix Metalloproteinases. Prog Mol Biol and Transl Sci 147: 1–73. https://doi.org/10.1016/bs.pmbts.2017.02.005
Catania J.M., Chen G., and Parrish A.R. (2007) Role of matrix metalloproteinases in renal pathophysiologies. Am J Physiol Renal Physiol 292 (3): F905–F911. https://doi.org/10.1152/ajprenal.00421.2006.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


