Журнал эволюционной биохимии и физиологии, 2021, T. 57, № 6, стр. 453-468
МЕТАБОЛИЧЕСКАЯ ПЛАСТИЧНОСТЬ АСТРОЦИТОВ
Я. В. Горина 1, 2, *, А. Б. Салмина 1, 2, 3, А. И. Ерофеев 1, Чжао Цань 1, А. В. Большакова 1, П. М. Балабан 1, 4, И. Б. Безпрозванный 1, 5, О. Л. Власова 1
1 Лаборатория молекулярной нейродегенерации, Санкт-Петербургский политехнический университет Петра Великого
Санкт-Петербург, Россия
2 Научно-исследовательский институт молекулярной медицины и патобиохимии,
Красноярский государственный медицинский университет им. профессора В.Ф. Войно-Ясенецкого
Красноярск, Россия
3 Научный центр неврологии
Москва, Россия
4 Институт высшей нервной деятельности
Москва, Россия
5 Отделение физиологии юго-западного медицинского центра Техасского университета
Даллас, США
* E-mail: yana_20@bk.ru
Поступила в редакцию 13.07.2021
После доработки 11.08.2021
Принята к публикации 12.08.2021
Аннотация
Астроциты являются наиболее многочисленными глиальными клетками центральной нервной системы, расположенными между микрососудистой сетью головного мозга и синапсами нейронов, тем самым опосредуя поглощение питательных веществ из системного кровотока. Кроме того, астроциты, благодаря своему уникальному анатомическому расположению, обладают высокой ферментативной способностью к гликолизу, гликогенезу и метаболизму липидов, обеспечивая нейроны необходимыми питательными веществами в качестве источника энергии, что указывает о ключевой роли астроцитов в метаболизме мозга. Следовательно, нарушение функций астроглии может привести к развитию нейродегенеративных заболеваний, при которых метаболические нарушения ускоряют повреждение нейронов. Принимая во внимание важную роль астроцитов в регуляции гомеостаза головного мозга и наличие тесной метаболической взаимосвязи с нейронами, в этом обзоре мы рассматриваем пластичность энергетического метаболизма астроцитов в физиологических условиях и ее влияние на функции мозга при развитии нейродегенеративных заболеваний. При этом понимание механизма, лежащего в основе метаболической пластичности астроцитов, даст возможность определить новые потенциальные диагностические биомаркеры и терапевтические мишени для коррекции нейродегенерации и возрастных дисфункций головного мозга.
Функция головного мозга зависит от сложных метаболических взаимодействий между различными типами нервных клеток, при этом астроциты и нейроны образуют комплекс, так называемые “симбиотические отношения” не только для поддержания нейрональных функций, но и метаболизма мозга в целом. За последнее десятилетие были выявлены ранее неожиданные функции астроцитов, во многом благодаря разработке новых инструментов, позволяющих их выборочное изучение in situ. Данные научные открытия дополняют большое количество доказательств, демонстрирующих, что астроциты играют центральную роль в гомеостазе головного мозга. Действительно, активность нейронов вызывает высвобождение вазоактивных веществ астроцитами, в частности, простагландинов, тем самым обеспечивая динамическую связь церебрального кровообращения с локальной потребностью в энергии [1–3].
На метаболическом уровне согласно модели “астроцит-нейрон-лактатного челнока”, астроциты реагируют на глутаматергическую активацию, увеличивая скорость поглощения глюкозы и высвобождения лактата во внеклеточное пространство, что, в свою очередь, используется нейронами для поддержания энергетических потребностей [4, 5]. Также стоит отметить, что астроциты выполняют и другие гомеостатические функции, включая защиту от окислительного стресса, поддержание ионного гомеостаза, хранение энергии в виде гликогена, регенерацию тканей, модуляцию синаптической активности посредством высвобождения глиотрансмиттеров, формирование и ремоделирование синапсов [6–8].
Интересен и тот установленный факт, что астроциты помимо выше перечисленных функций, играют ранее неизвестную роль в регуляции продолжительности и глубины сна [9], консолидации памяти [10] и в регулировании дыхания [11].
В дополнение к этому, астроциты выделяют ряд веществ, а именно, аполипопротеин Е и холестерин [12], аскорбиновую кислоту [13], цитокины [14], глутатион [15], лактат [16], нейротрофические факторы и факторы роста [17], тромбоспондины [18], которые поддерживают функцию и жизнеспособность нейронов.
Важно отметить, что все эти процессы требуют затраты значительного количества энергии и зависят от связанных с энергией метаболических путей, тем самым указывая на существование прямой взаимосвязи между функциональной способностью астроцитов, энергией и метаболизмом.
Интересен и тот установленный факт, что астроциты представляют собой гетерогенную популяцию клеток [19], которые имеют ряд существенных функциональных различий в зависимости от области мозга и стадии его развития, а также экспрессии различных рецепторов, переносчиков, ионных каналов и других белков [20]. Это подразумевает существование уникальной способности астроцитов в зависимости от типа участвовать в различных метаболических/гомеостатических функциях головного мозга.
Учитывая ключевую роль астроцитов в регуляции гомеостаза головного мозга и существование в этом контексте важного метаболического взаимодействия между нейронами и астроцитами, интересным для понимания является то, как метаболическая пластичность астроцитов влияет на функции мозга в физиологических условиях и при развитии нейродегенеративного заболевания.
ЭНЕРГЕТИЧЕСКИЕ ПОТРЕБНОСТИ КЛЕТОК ГОЛОВНОГО МОЗГА
Головной мозг человека является тем уникальным органом, которому для согласованной и эффективной работы необходимо потребление значительного количества энергии. Поступление достаточного количества энергии особенно необходимо для надлежащего функционирования нейронов [21].
Ранее считалось, что более крупный головной мозг имеет более крупные нейроны, которые индивидуально потребляют больше энергии и, следовательно, окружены большим количеством глиальных клеток. Вопреки ожидаемому, было установлено, что средняя метаболическая активность нейрона среди шести видов грызунов и приматов (включая человека) относительно стабильна с незначительными вариациями, которые не коррелируют с размером и плотностью нейронов, а также размером головного мозга [22].
Важно отметить тот установленный факт, что большая часть этой энергии расходуется синапсами, поскольку изменение постсинаптического потенциала находится в прямой зависимости от наличия устойчивых ионных градиентов, в частности, высокого градиента Na+, который в свою очередь поддерживается активностью Na+/K+-АТФазы. Сохранение высокого градиента концентрации Na+ на клеточной мембране регулирует концентрацию других ионов, таких как Ca2+, Mg2+, H+, ${\text{HCO}}_{3}^{ - }$ и Cl–, которые транспортируются или обмениваются с Na+ для поддержания их физиологических уровней в клетках (или вне клеток). Высокая потребность в энергии является следствием большого количества нейронов, каждый из которых может иметь сотни или тысячи синапсов для передачи десятка или сотни нервных импульсов в секунду в заданный момент времени.
Как известно, вместе с эндотелиальными клетками и перицитами астроциты образуют гематоэнцефалический барьер (ГЭБ) – структуру, через которую осуществляется транспорт различных молекул и питательных веществ, а именно, глюкозы посредством переносчика GLUT [23], монокарбоксилатов (L-лактата) за счет монокарбоксилатных транспортеров (MCT) [24] и жирных кислот через транслоказу жирных кислот [25]. Эти молекулы играют решающую роль в обмене энергетическими субстратами между кровью и паренхимой головного мозга. Таким образом, потребление энергии нейронами, которая необходима для поддержания электрических сигналов, стабильности внутриклеточной концентрации ионов и цикличности синаптических пузырьков, обеспечивается астроцитами [26].
Также необходимо отметить и тот факт, что далеко не каждая клетка головного мозга может быть обеспечена достаточным количеством энергии напрямую через капилляры [27].
Кроме того, необходимо учитывать, что между двумя кровеносными капиллярами может быть 3–6 слоев клеток, что требует других путей снабжения клеток энергией, в частности, “паренхиматозной диффузией”. Однако данный процесс отличается значительной продолжительностью, чтобы обеспечить клетки достаточным количеством энергии. Как показал микроанатомический анализ, кровеносные капилляры, по которым доставляется глюкоза, в значительной степени покрыты отростками астроцитов [27], концевые расширения которых обеспечивают быстрое поглощение глюкозы. Фактически, в то время как концентрация глюкозы в кровеносных капиллярах составляет 3–6 мМ, в паренхиме головного мозга она может быть всего 0.5–1 мМ [28], это указывает на то, что значительное количество глюкозы предположительно поглощается астроцитами, прежде чем она попадает в паренхиму головного мозга. Поскольку глюкоза, эффективно поглощаемая облегченной диффузией, быстро фосфорилируется в клетках, всегда существует высокий градиент глюкозы в клетках, даже при внеклеточной концентрации 1 мМ и ниже. Это подразумевает, что нейроны, находящиеся на расстоянии десятков микрон от следующего кровеносного сосуда, могут поглощать глюкозу в значительных количествах. При этом важно отметить, что анатомическая особенность астроцитов, которые, как считается, требуют гораздо меньше энергии для физиологического функционирования, чем нейроны, может указывать об астроцит-нейрональном взаимодействии для поддержки энергоснабжения нейронов в условиях высокой потребности в энергии [29]. Это подразумевает, что астроциты передают часть энергетического материала, к которому они имеют исключительно прямой доступ, к нейронам и, следовательно, играют роль медиаторов для дополнительного снабжения нейронов энергией [26].
Таким образом, относительно эффективная обработка энергии головным мозгом зависит от метаболической пластичности астроцитов и типа нейроглиальных клеток, анатомически расположенных между нейронами и сложным разветвлением церебральных сосудов [30–32]. Следовательно, астроциты являются промежуточными структурными звеньями между кровеносными сосудами и нейронами, которые доставляют глюкозу из крови к нейронам, при этом выступая в качестве основных энергоемких элементов головного мозга. Поэтому вполне вероятно, возрастные или связанные с развитием заболевания, структурно-функциональные изменения астроцитов могут не только негативно повлиять на гомеостаз головного мозга, но и способствовать прогрессированию заболевания [33–35].
ЭВОЛЮЦИЯ МЕТАБОЛИЗМА ГОЛОВНОГО МОЗГА
Согласно выдвинутому предположению, высокие энергетические затраты на развитие человеческого мозга объясняются наличием такой отличительной черты человека от других приматов, как исключительно медленный и длительный рост до взрослого возраста. Для объяснения столь продолжительного жизненного этапа, который предшествует взрослому возрасту, были предложены ряд гипотез, исходя из которых головной мозг затрачивает дополнительное количество энергии и времени на процессы обучения и развитие мозга в течение жизни [36, 37]. Другие гипотезы были сосредоточены на энергетических компромиссах и рассматривали замедленный рост как компенсацию высоких энергетических потребностей мозга [38, 39], предполагая, что с точки зрения развития периоды наиболее медленного роста тела совпадают с пиковыми метаболическими потребностями мозга.
Так, установлено [40], что скорость поглощения глюкозы человеческим мозгом как в абсолютном выражении, так и по отношению к метаболическим расходам организма, достигает пика не при рождении, когда размер мозга по отношению к телу наибольший, а в детском возрасте, когда синаптическая пластичность и связанные с ней метаболические процессы максимальны, при этом потребность мозга в глюкозе обратно пропорциональна росту тела от младенчества до полового созревания. Эти результаты подтверждают гипотезу о том, что необычно высокие затраты на развитие человеческого мозга требуют компенсирующего замедления роста детского тела.
Наряду с указанными гипотезами было выдвинуто предположение, согласно которому человеческий род в процессе эволюции приобрел высокую скорость метаболизма, тем самым обеспечивая энергией больший мозг (по сравнению с другими приматами), а также высокую репродуктивную способность. В ходе одного исследования по проверке данной гипотезы [41] установлено, что общий расход энергии у человека превышал таковой у шимпанзе, горилл и орангутангов примерно на 400, 635 и 820 ккал/день соответственно, что в значительной степени связано с более высокой скоростью основного обмена у человека, тем самым указывая на повышенную метаболическую активность организма, которая, наряду с изменениями в распределении энергии, сыграла решающую роль в эволюции размера человеческого мозга и истории жизни.
Согласно недавно проведенному исследованию [42] специфический для человека ген ARHGAP11B, преимущественно экспрессирующийся в нейрональных клетках-предшественниках неокортекса плода человека, увеличивает количество и пролиферацию клеток-предшественников за счет активации глутаминолиза в митохондриях, что дает основание полагать, что ген ARHGAP11B может быть вовлечен в рост неокортекса человека в процессе эволюции.
Примечательно и то, что между головным мозгом человека и шимпанзе могут существовать важные метаболические различия, специфичные для конкретных типов клеток, а именно, нейрональных клеток-предшественников, астроцитов и нейронов [43]. Так, установлена значительная межвидовая дифференциальная экспрессия во всех трех типах клеток с наибольшей степенью различий в астроцитах. При этом существенные различия между видами для указанных типов клеток были выявлены в клеточном дыхании, в трансмембранном транспорте глюкозы и лактата, а также использовании пирувата, что демонстрирует предполагаемый специфический для клеточного типа механизм, с помощью которого астроциты могут вносить существенный вклад в адаптивную метаболическую способность человеческого мозга, а также дает основание полагать о возможном значительном вкладе астроцитов в эволюцию метаболизма глюкозы в головном мозге [43].
Важно отметить, что астроциты, являющиеся ключевыми нейроглиальными клетками, поддерживающими гомеостаз в ЦНС, эволюционировали посредством специализации и диверсификации функций. Астроглиальные клетки интегрируются в нейронные сети через синапсы, при этом наличие у них специфической морфологической и функциональной пластичности способствует реализации процессов обучения памяти. Однако при невропатологии имеют место реактивный астроглиоз и дегенерация астроцитов, что в свою очередь может в значительной степени определять патологическое прогрессирование заболевания [44].
ЭНЕРГЕТИЧЕСКИЙ МЕТАБОЛИЗМ В КЛЕТКАХ ГОЛОВНОГО МОЗГА
Как известно, глюкоза является тем обязательным источником энергии, который критически важен для реализации многих функций головного мозга, включая производство АТФ, синтез нейромедиаторов, нейромодуляторов, и структурных компонентов клетки, а также регуляцию окислительного стресса [45]. При этом механизм доставки глюкозы и ее метаболитов в паренхиму головного мозга все еще остается не до конца выясненным. Экспериментально определенное соотношение потребления глюкозы и кислорода в состоянии покоя предполагает неполное окисление глюкозы за счет значительного производства липидов и аминокислот из глюкозы, а также экскреции неокисленного метаболита, в частности, L-лактата [46]. Неполное окисление глюкозы и накопление L-лактата в процессе нейрональной активности [47] указывает на преобладание гликолиза над окислительным метаболизмом. Относительно высокая гликолитическая способность ткани головного мозга может быть обусловлена активностью астроцитов [48], при которой процесс гликолиза проявляет большую ферментативную способность, чем окислительный метаболизм [48], в то время как гликолиз нейронов весьма ограничен [49]. Важно отметить и то, что астроцитарный гликолиз выраженно усиливается за счет нейротрансмиттеров – глутамата и норадреналина [50].
Следовательно, согласно гипотезе “астроцитарно-нейронального лактатного челнока” L-лактат в основном продуцируется астроцитами, а затем передается посредством MCT к нейронам, где он превращается в пируват для производства аэробной энергии в митохондриях (рис. 1) [51]. При этом предполагается, что согласованные действия между астроцитами и нейронами в контексте астроцитарно-нейронального лактатного челнока может иметь важное значение для реализации когнитивных функций, тогда как энергетическая рассогласованность, напротив, способствовать развитию когнитивных нарушений [52].
Рис. 1.
Модель астроцитарно-нейронального лактатного челнока.
GLUT1, GLUT3 – переносчики глюкозы; LDH5 – изоформы 5-лактатдегидрогеназы; MCT1, MCT2, MCT4 – монокарбоксилатные транспортеры; LDH1 – изоформа 1-лактатдегидрогеназы.
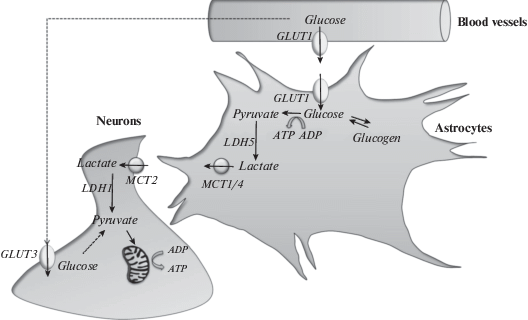
Стоит отметить и тот важный момент, что гипотеза “астроцитарно-нейронального лактатного челнока”, хотя и подкреплена многочисленными доказательствами, по-прежнему остается весьма противоречивой [53, 54]. Так, согласно результатам нескольких исследований при стимуляции в нейронах также может протекать весьма активный гликолиз и даже экскреция лактата [55, 56]. Следует также иметь в виду, что при разных метаболических условиях может реализовываться та или иная стратегия, касающаяся транспорта глюкозы и лактата в нейронах и астроцитах, а также между ними. Это прямо указывает на то, что “астроцитарно-нейрональный лактатный челнок” может быть только одним из нескольких способов удовлетворения энергетических потребностей нервных клеток [57].
Деятельность головного мозга в физиологических условиях находится в прямой зависимости от активного поступления глюкозы из крови, а также в процессе распада гликогена, локализованного в основном в астроцитах. Так, установлено, что содержание гликогена в культивируемых астроцитах в значительной мере возрастает при инкубации с глутаматом [58], в то время как ингибирование гликогенолиза подавляет поглощение глутамата [59] и ионов калия [60]. Кроме того, в отсутствие глюкозы астроцитарный гликоген может расщепляться до лактата, который в свою очередь транспортируется к аксонам в качестве источника энергии для повышения их активности [61]. Таким образом, гликоген астроцитов, вероятно, может повысить выживаемость и функциональную активность нейронов головного мозга в условиях ограничения глюкозы. Это дает основание предполагать, что истощение астроцитарного гликогена способствует снижению активности мозга, ведущее к когнитивной дисфункции и нейродегенерации [62].
Стоит отметить и тот факт, что в астроцитах протекает липидный обмен, при этом липиды, продуцируемые астроцитами, доставляются к нейронам и олигодендроцитам в качестве компонентов синаптических и миелиновых мембран [63, 64]. Примечательно, что регуляция окислительного метаболизма липидов находится в прямой зависимости от слаженного взаимодействия между астроцитами и нейронами [64]. Кетоновые тела, вырабатываемые печенью во время голодания или у пациентов с диабетом, транспортируются в головной мозг посредством МСТ, где используются как энергетический субстрат [65]. Также было продемонстрировано, что активация церебрального метаболизма альтернативных субстратов (кетонов) на фоне выраженного нарушения метаболизма глюкозы при черепно-мозговых травмах оказывает выраженное нейропротекторное действие [66, 67], что дает основание использовать это в клинической практике в качестве кетогенной диеты при эпилепсии и травмах головного мозга.
Установлено, что при ишемии in vitro астроциты за счет AMP-активированной протеинкиназы (AMPK) увеличивают продукцию кетоновых тел, которые в свою очередь выступают в качестве энергетического субстрата (вместо L-лактата) нейронам для осуществления цикла трикарбоновых кислот [68].
Энергетический метаболизм астроцитов регулируется рядом физиологических и патологических факторов, включая гормоны, нейротрансмиттеры, цитокины, активные формы кислорода, ионы, кислород и питательные вещества, при этом способность к метаболической адаптации у астроцитов влияет на активность нейронов за счет обмена метаболитами между астроцитами и нейронами.
МЕТАБОЛИЗМ ГЛИКОГЕНА В АСТРОЦИТАХ
Глюкоза является основным и обязательным источником энергии для всех клеток головного мозга, поскольку это единственный субстрат, который присутствует в системном кровотоке, быстро транспортируется через гематоэнцефалический барьер и концентрация которого регулируется гормонами. Считается, что астроциты характеризуются низкой потребностью в энергии и соответственно имеют незначительную скорость производства АТФ. Itoh и соавт. [69] сообщили о чрезвычайно низкой скорости окислительного метаболизма в культуре астроцитов in vitro, это может быть связано с использованием очень высокой концентрации глюкозы в культуральной среде, что в свою очередь снижает окислительную способность примерно на 50% [70]. Напротив, результаты исследования метаболизма головного мозга in situ в условиях покоя с помощью ЯМР-спектроскопии показали, что окислительный метаболизм в кортикальных астроцитах составляет около 30% от общего потребления кислорода тканями в коре головного мозга [71]. Это дает возможность предположить, что относительный вклад астроцитов в потребление цереброкортикального кислорода соответствует относительному объему астроцитов в коре головного мозга.
Как известно, астроциты и нейроны метаболизируют глюкозу через гликолитический, пентозный шунт и окислительные пути, при этом только астроциты обладают способностью накапливать глюкозу в виде гликогена [72]. Постоянная концентрация астроцитарного гликогена, определяемая динамическим равновесием между синтезом и гликогенолизом [73], относительно низка по сравнению с таковой в скелетных мышцах и печени. Однако он вносит существенный важный вклад в функциональную активность нейронов [74]. Стоит отметить, что в условиях гипогликемии распад гликогена в астроцитах может поддерживать нейрональную активность [74]. В дополнение к этому гликогенолизу способствует недостаток энергетических субстратов [75], а также повышенная нейрональная активность, как в случае депривации сна, во время которой содержание гликогена значительно снижается [76]. Следовательно, гликоген может являться кратковременным энергетическим буфером, который существенно сокращает временные потребности в энергии, при этом не играя роль в устойчивом обеспечении энергией [77].
Кроме того, был идентифицирован ряд нейроактивных молекул, а именно, аденозин, норадреналин и некоторые цитокины, регулирующие экспрессию ключевых генов, участвующих в метаболизме астроцитарного гликогена, в частности, PTG (protein targeting to glycogen) [50, 78]. При этом воздействие вышеупомянутых трансмиттеров приводило к циклической AMP-зависимой индукции экспрессии фактора транскрипции C /EBP, гликогенсинтазы и PTG. Также было показано, что экспрессия генов, связанных с метаболизмом гликогена в головном мозге, изменяется на протяжении цикла сна-бодрствования или отдыха-активности, и с учетом почти избирательной локализации гликогена именно в астроцитах, эти клетки вполне могут участвовать в регуляции сна [79].
Необходимо отметить, что норадреналин – нейроактивная молекула, высвобождаемая из норадренергических нейронов голубого пятна, связывается с α- и β-адренергическими рецепторами, которые экспрессируются в клетках головного мозга, включая астроциты [80]. Это вызывает увеличение уровня цитоплазматических вторичных мессенджеров, в частности, ионов Ca2+ и цАМФ, которые в свою очередь запускают ряд клеточных процессов, включая транскрипцию генов [81], морфологическое изменение формы клеток [82] и аэробный гликолиз [83].
Также установлено, что β-адренергические рецепторы астроцитов участвуют через изменения формы астроцитов в формировании памяти – процессе, требующем значительных затрат энергии [84]. Действительно, для консолидации памяти у мышей необходим гликогенолиз [85]. Кроме того, консолидация памяти, от краткосрочной до долгосрочной, требует высвобождения нейронального норадреналина [86]. При этом астроциты, которые хранят энергию в виде гликогена, после активации норадреналина генерируют метаболиты, включая L-лактат, действующие как источник энергии для активных нейронов [87], а также координируют соседние астроциты для дальнейшего усиления аэробного гликолиза астроцитов [83].
Учитывая тот факт, что нейродегенерация сопровождается нарушением норадренергических нейронов, вклад астроцитов в прогрессирование заболевания может быть весьма значительным, что в свою очередь коррелирует со снижением норадреналина [88].
МЕТАБОЛИЗМ ЛАКТАТА В АСТРОЦИТАХ
Как показали исследования ex vivo и in vivo, во время нейрональной активности циркулирующая глюкоза поглощается преимущественно астроцитами, в которых за счет аэробного гликолиза образуется лактат [89], передающийся в нейроны с помощью специфических транспортеров MCT [90].
С помощью методов, позволяющих визуализировать функции головного мозга (МРТ и ПЭТ), продемонстрировано, что во время нейрональной активации происходит усиление аэробного гликолиза с последующим производством лактата [91].
Интересен и тот недавно установленный факт [92], что циркулирующий в кровотоке лактат является одним из основных субстратов цикла трикарбоновых кислот и источником энергии для большинства тканей, тогда как первоначально предполагалось преобразование его из глюкозы в астроцитах и использование только нейронами.
Долгое время считалась, что лактат, синтезируемый в результате астроцитарного гликолиза, может выступать только в качестве источника энергии для нейронов [93]. Однако согласно данным ряда недавно проведенных исследований, лактат может являться сигнальной молекулой для реализации пластичности нейронов. Действительно, по результатам нескольких поведенческих тестов перенос лактата от астроцитов к нейронам необходим для консолидации памяти [94, 95], что согласуется с индукцией лактатом нескольких генов пластичности в нейронах, таких как Arc, c-fos и zif 268 [96, 97]. При этом данный эффект лактата опосредуется модуляцией активности рецептора NMDA и нижестоящим сигнальным каскадом Erk1/2 [98].
Более того, выявлена роль астроцитарного лактата в обработке информации, необходимой для обучения и памяти, а именно, в CA1 области гиппокампа, участвующей в обучении, зафиксировано выраженное увеличение внеклеточного уровня лактата, который используется в качестве источника энергии для нейронов [99].
Примечательно, что лактат оказывает и пролиферативное действие на нейрональные клетки-предшественники гиппокампа in vitro, тем самым регулируя нейрогенез в гиппокампе [100].
Как известно, источником лактата в головном мозге, помимо глюкозы, является гликоген [101], который локализован исключительно в астроцитах и активируется ограниченным числом нейротрансмиттеров, таких как вазоактивный кишечный пептид [102] и норадреналин [103], что является еще одним показательным примером метаболического взаимодействия нейронов и глии. Кроме того, в недавнем исследовании [104] была продемонстрирована роль гликогенолиза с участием норадреналина в пластичности нейронов и консолидации памяти. При этом норадренергические рецепторы астроцитов принимают непосредственное участие в высвобождении лактата из астроцитов в процессе обучения, что в свою очередь необходимо для поддержания молекулярных изменений в нейронах и формирования долговременной памяти в гиппокампе.
В другом исследовании [105] влияние лактата на пластичность и консолидацию памяти оценивали путем фармакологического блокирования гликогенолиза с помощью внутригиппокампальных инъекций ингибитора гликогенфосфорилазы – 1,4-дидезокси-1,4-имино-D-арабинитола, который вызывал амнезию после процесса обучения, что нивелировалось действием лактата. Аналогичные наблюдения были выявлены и в ряде других исследований с участием префронтальной коры и базолатерального миндалевидного тела [94, 95].
Примечательно и то, что блокирование экспрессии MCT приводило к ингибированию переноса лактата от астроцитов к нейронам, тем самым способствуя развитию амнезии, тогда как введение лактата выраженно снижало негативное влияние амнезии, вызванной ингибированием специфичных для астроцитов MCT1 и 4, но не блокированием нейрон-специфического транспортера MCT2 [106]. Такой положительный эффект от введения лактата в полной мере согласуется с данными, согласно которым лактат индуцирует экспрессию генов пластичности в нейронах [98].
Стоит отметить, что долговременная потенциация, которая обычно считается электрофизиологическим механизмом, лежащим в основе формирования памяти, также нарушается под действием 1,4-дидезокси-1,4-имино-D-арабинитола, однако внутригиппокампальное введение лактата нивелирует данный негативный эффект [106].
Важен и тот недавно установленный факт, что лактат, продуцируемый астроцитами, оказывает положительное влияние на динамические процессы в синапсах, такие как изменения поверхности, объема и плотности, которые, как известно, лежат в основе пластичности и памяти [107].
МЕТАБОЛИЗМ ЖИРНЫХ КИСЛОТ В АСТРОЦИТАХ
Астроциты являются единственным типом нервных клеток, в которых активно осуществляется β-окисление жирных кислот [108], при этом генерируя около 20% от общего количества энергии, необходимой для функционирования головного мозга [109]. Важно и то, что скорость β-окисления четко регулируется AMPK – белком, обеспечивающим согласованную регуляцию многих путей энергетического метаболизма [110]. Интересно, что AMPK может быть активирована 5-аминоимидазол-4-карбоксамид-рибонуклеотидом [111] и метформином [112], что дает возможность использовать это в качестве фармакологической коррекции при нарушении активации или экспрессии АМРК. Также активированный AMPK кетогенез в астроцитах стимулируется как в условиях гипоксии [111], так и при гипогликемии [113].
Астроциты также используют жирные кислоты в качестве предшественников для синтеза кетоновых тел, которые в свою очередь используются нейронами в качестве источника энергии в определенных условиях (рис. 2) [114].
Рис. 2.
Метаболизм жирных кислот в астроцитах.
GLUT1 – переносчик глюкозы; LDH5 – изоформа 5 лактатдегидрогеназы; MCT1 – монокарбоксилатный транспортер; CPT1 – карнитин-пальмитоилтрансфераза 1; ACS – ацил-CoA-синтаза; TCA – цикл трикарбоновых кислот (цикл Кребса); ADP – aденозиндифосфат; ATP – aденозинтрифосфат.
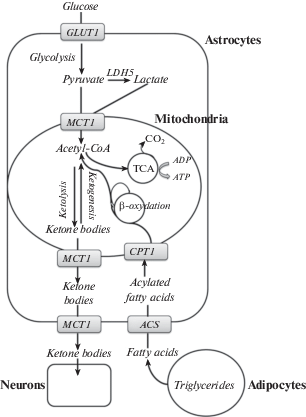
Действительно, способность эффективно использовать альтернативные субстраты, помимо глюкозы, может повысить устойчивость и сохранить функциональные способности головного мозга в условиях дефицита глюкозы, ингибирования гликолиза и пируватдегидрогеназного комплекса [115], а также при ишемии [116]. Как известно, окисление кетоновых тел и жирных кислот производит ацетил-КоА, ФАДH2 и НАДН, H+, которые могут напрямую включаться в цикл трикарбоновых кислот и митохондриальную цепь переноса электронов, минуя гликолиз и пируватдегидрогеназный комплекс. При этом окисление кетоновых тел может быть более эффективным, чем гликолиз, поскольку осуществляется в результате протекания 3 быстрых реакций в митохондриях, тогда как гликолиз требует протекания 10 цитоплазматических реакций и поглощения митохондриями НАДН, H+, пирувата, лактата [117], а также АТФ, что в условиях нарушения энергетического метаболизма весьма проблематично [118].
Необходимо отметить, что транспорт кетоновых тел через ГЭБ зависит от переносчика и в отличие от транспорта глюкозы не увеличивается в условиях нейрональной активности, а напрямую зависит от концентрации кетоновых тел в кровотоке [119]. МСТ, являющиеся одними из известных идентифицированных транспортеров кетоновых тел, распределены по всему головному мозгу [120]. Как показало исследование на грызунах, экспрессия MCT между различными типами нервных клеток выраженно отличается, при этом изоформа MCT1 локализуется в ГЭБ на эндотелиальных клетках и астроглии, MCT4 в астроглии, а MCT2 в нейронах [120].
Примечательно, что транспортная способность кетоновых тел через ГЭБ у грызунов повышается при голодании [121], что также наблюдается и у человека [122]. Это может быть обусловлено повышенной экспрессией MCT, которое обнаруживается у грызунов как после кетогенной диеты [123, 124], так и после физических упражнений [125].
Кроме того, в ходе одного из исследований [126] установлено, что цилиарный нейротрофический фактор (CNTF) активирует окисление жирных кислот в астроцитах как in vitro, так и in vivo. Вместе с тем CNTF увеличивает астроцитарную экспрессию MCT1, SCOT и BDH – трех ключевых транспортеров кетоновых тел, это указывает на то, что CNTF-активированные астроциты действительно используют кетоновые тела и жирные кислоты в качестве альтернативных энергетических субстратов. Необходимо отметить и тот установленный факт, что активация астроцитов с помощью CNTF откладывает свой отпечаток на реорганизацию их метаболического профиля. Так, астроциты, активированные CNTF, были полностью устойчивы к продолжительному токсическому воздействию пальмитата in vitro, что свидетельствует о защитном действии CNTF за счет уже существующего ремоделирования метаболического статуса астроцитов.
Важно отметить, что наиболее активное высвобождение свободных жирных кислот из фосфолипидов в плазматической мембране происходит как при острых патологических состояниях, таких как травма мозга и ишемия, так и при хронических нейродегенеративных заболеваниях, в частности, болезни Альцгеймера [127, 128]. Данные патологические состояния сопровождаются выраженными метаболическими нарушениями и, как следствие, активацией атроцитов [129], что, по-видимому, является эффективным адаптационным ответом в условиях дефицита энергии и накопления токсичных метаболитов.
МЕТАБОЛИЧЕСКАЯ ПЛАСТИЧНОСТЬ АСТРОЦИТОВ ПРИ НЕЙРОДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЯХ
По результатам одного из исследований было высказано предположение, что метаболическая дисфункция астроцитов является тем пусковым фактором, который провоцирует отложение бета-амилоида [130]. Несмотря на то что формирование амилоидных бляшек в основном обусловлено снижением клиренса бета-амилоида, интенсивной продукцией олигомеров бета-амилоида за счет нарушения метаболической регуляции уровней β- и γ-секретазы [131], а также аберрантной посттрансляционной модификацией белка-предшественника бета-амилоида (APP) [132], было продемонстрировано, что воздействие бета-амилоида на культивируемые астроциты не только изменяет поглощение ими глюкозы, но и ее последующий метаболизм параллельно с повышением высвобождения гидропероксида и глутатиона [133]. Нейровоспаление, которое, как правило, отчетливо наблюдается при прогрессировании болезни Альцгеймера, может изменять метаболизм астроцитов, вызывая повышенное высвобождение глутамата и АТФ через полуканалы коннексина 43, что в свою очередь может приводить к активации микроглии и дисфункции нейронов [134].
Интересно, что несмотря на воспаление как острую реакцию клеток, участвующих в астроглиозе, уменьшение хронического нейровоспаления агонистом рецепторов, активируемых пролифератором пероксисом (PPAR), может представлять собой одну из стратегий защиты нейрональных клеток, пораженных нейродегенеративными заболеваниями. Кроме того, хорошо известны метаболические свойства PPAR, в частности, PPARγ стимулирует поглощение глюкозы и глутамата, а также высвобождение лактата, тем самым защищая нейроны от депривации глюкозы и эксайтотоксичности. Аналогичным образом PPARα индуцирует β-окисление жирных кислот при развитии нарушения метаболизма глюкозы. При этом основным продуктом данного процесса являются кетоновые тела, которые экспортируются в нейроны для снабжения энергией [135].
Необходимо отметить, что пораженные области головного мозга при болезни Паркинсона, в частности, черная субстанция, содержат относительно меньшее количество астроцитов, чем другие области мозга, что делает дофаминергические нейроны потенциально более чувствительными к метаболическим и энергетическим нарушениям [136]. При этом было продемонстрировано, что депривация глюкозы [137], а также повышенное поступление лактата способствуют накоплению и олигомеризации α-синуклеина [138], это указывает на существенный вклад астроцитарной метаболической дисфункции в патогенез болезни Паркинсона. Более того, в астроцитах, выделенных из ткани головного мозга животных с экспериментальной моделью болезни Паркинсона, экспрессирующих мутантный α-синуклеин, выявлены как функциональные нарушения, так и выраженные морфологические повреждения митохондрий, что в свою очередь обусловливает низкую способность астроцитов обеспечивать дифференцировку нейронов [139]. Кроме того, установлено, что экспрессия мутантного α-синуклеина A53T в астроцитах приводит к подавлению регуляции транспортеров глутамата и коррелирует с развитием реактивного астроглиоза [140].
Важен и тот момент, что в контексте лечения болезни Паркинсона астроциты, как известно, превращают L-DOPA в дофамин [141], при этом в полосатом теле астроциты выступают в качестве хранилища для L-DOPA [142], это может указывать на то, что метаболические и энергетические нарушения в астроцитах не только способствуют развитию болезни Паркинсона, но и в значительной мере снижают эффективность лечения заболевания.
Ряд исследований указывает на вклад астроцитов в патогенез болезни Хантингтона. Так, у мышей с моделью болезни Хантингтона снижение высвобождения астроцитарной ГАМК с помощью транспортера GAT-3 вызывает заметное нарушение синаптической пластичности нейронов в полосатом теле [143]. В дополнение к этому у астроцитов выявлена способность усиливать Ca2+-зависимое высвобождение внеклеточного глутамата, что коррелирует с повышением биосинтеза глутамата за счет увеличения уровня специфического для астроцитов митохондриального фермента пируваткарбоксилазы, что, в конечном итоге, может способствовать развитию эксайтотоксичности по мере прогрессирования болезни Хантингтона [144].
Экспериментальные данные, полученные в ходе исследования животных с моделью бокового амиотрофического склероза, экспрессирующих мутантную супероксиддисмутазу-1 (SOD1), указывают на наличие выраженных нарушений регуляции метаболизма пурина, пиримидина, лизина и глицерофосфолипидов в астроцитах, совместно культивируемых с нейронами. Более того, воздействие глутамата вызывало значительные патологические метаболические изменения в астроцитах и ассоциировалось со снижением уровня лактата, тем самым ингибируя его транспорт из астроцитов к нейронам [145]. Важно и то, что эти результаты коррелировали с данными анализа спинномозговой жидкости пациентов с боковым амиотрофическим склерозом [146], у которых к тому же наблюдались нарушения метаболических функций митохондрий в астроцитах [147]. Последнее было выявлено и у экспериментальных животных уже на ранней стадии заболевания, что дает основание полагать о ключевой роли астроцитарных метаболических нарушений в патогенезе бокового амиотрофического склероза [148].
В целом это демонстрирует, что метаболическая дисфункция астроцитов и связанные с ней изменения в экспрессии генов играют центральную роль в патогенезе нейродегенеративных заболеваний, а идентификация молекул-мишеней в астроцитах может служить для разработки эффективной терапии, чтобы предотвратить или замедлить прогрессирование заболевания.
ЗАКЛЮЧЕНИЕ
Астроциты играют центральную роль в нейрометаболическом взаимодействии, основанном на таком ключевом механизме, как аэробный гликолиз, продукты которого вносят существенный вклад в удовлетворение энергетических потребностей нейронов в процессе нейротрансмиссии. При этом метаболическое взаимодействие нейронов и глии может претерпевать пластические адаптации, сопряженные с синаптической пластичностью.
Нормальная деятельность головного мозга находится в прямой зависимости от метаболической пластичности астроцитов, и даже небольшое ее нарушение может вызвать значительное снижение функций мозга. Поэтому детальное изучение ключевых клеточных и молекулярных факторов энергетического метаболизма головного мозга чрезвычайно важно не только для понимания основных механизмов физиологии мозга, но и патофизиологических механизмов различных неврологических и психических расстройств. Кроме того, учитывая решающую роль астроцитов в гомеостазе мозга, эти клетки представляют собой интересную терапевтическую мишень при лечении нейродегенеративных заболеваний.
Список литературы
Jakovcevic D., Harder D.R. (2007) Role of astrocytes in matching blood flow to neuronal activity. Curr Top Dev Biol 79:75–97. https://doi.org/10.1016/S0070-2153(06)79004-4
Marina N., Christie I.N., Korsak A., Doronin M., Brazhe A., Hosford P.S., Wells J.A., Sheikhbahaei S., Humoud I., Paton J.F.R., Lythgoe M.F., Semyanov A., Kasparov S., Gourine A.V. (2020) Astrocytes monitor cerebral perfusion and control systemic circulation to maintain brain blood flow. Nat Commun 11: 131. https://doi.org/10.1038/s41467-019-13956-y
Kim K.J., Iddings J.A., Stern J.E., Blanco V.M., Croom D., Kirov S.A., Filosa J.A. (2015) Astrocyte Contributions to Flow/Pressure-Evoked Parenchymal Arteriole Vasoconstriction. J Neurosci 35: 8245–8257. https://doi.org/10.1523/JNEUROSCI.4486-14.2015
Magistretti P.J. (2011) Neuron-glia metabolic coupling and plasticity. Exp Physiol 96: 407–410. https://doi.org/10.1113/expphysiol.2010.053157
Ioannou M.S., Jackson J., Sheu S.-H., Chang C.-L., Weigel A.V., Liu H., Pasolli H.A., Xu C.S., Pang S., Matthies D., Hess H.F., Lippincott-Schwartz J., Liu Z. (2019) Neuron-Astrocyte Metabolic Coupling Protects against Activity-Induced Fatty Acid Toxicity. Cell 177: 1522–1535.e14. https://doi.org/10.1016/j.cell.2019.04.001
(2009) The role of astroglia in neuroprotection. Dialogues Clin Neurosci 11: 281–295. https://doi.org/10.31887/DCNS.2009.11.3/mbelanger
Paixão S., Klein R. (2010) Neuron–astrocyte communication and synaptic plasticity. Current Opin Neurobiol 20: 466–473. https://doi.org/10.1016/j.conb.2010.04.008
Papouin T., Dunphy J., Tolman M., Foley J.C., Haydon P.G. (2017) Astrocytic control of synaptic function. Phil Trans R Soc B 372: 20160154. https://doi.org/10.1098/rstb.2016.0154
Vaidyanathan T.V., Collard M., Yokoyama S., Reitman M.E., Poskanzer K.E. (2021) Cortical astrocytes independently regulate sleep depth and duration via separate GPCR pathways. eLife 10: e63329. https://doi.org/10.7554/eLife.63329
Santello M., Toni N., Volterra A. (2019) Astrocyte function from information processing to cognition and cognitive impairment. Nat Neurosci 22: 154–166. https://doi.org/10.1038/s41593-018-0325-8
Gourine A.V., Kasymov V., Marina N., Tang F., Figueiredo M.F., Lane S., Teschemacher A.G., Spyer K.M., Deisseroth K., Kasparov S. (2010) Astrocytes Control Breathing Through pH-Dependent Release of ATP. Science 329: 571–575. https://doi.org/10.1126/science.1190721
Pfrieger F.W., Ungerer N. (2011) Cholesterol metabolism in neurons and astrocytes. Progr Lipid Res 50:357–371. https://doi.org/10.1016/j.plipres.2011.06.002
García-Krauss A., Ferrada L., Astuya A., Salazar K., Cisternas P., Martínez F., Ramírez E., Nualart F. (2016) Dehydroascorbic Acid Promotes Cell Death in Neurons Under Oxidative Stress: a Protective Role for Astrocytes. Mol Neurobiol 53:5847–5863. https://doi.org/10.1007/s12035-015-9497-3
Velasco-Estevez M., Rolle S.O., Mampay M., Dev K.K., Sheridan G.K. (2020) Piezo1 regulates calcium oscillations and cytokine release from astrocytes. Glia 68: 145–160. https://doi.org/10.1002/glia.23709
Mahan V. (2019) Neurointegrity and europhysiology: astrocyte, glutamate, and carbon monoxide interactions. Med Gas Res 9: 0. https://doi.org/10.4103/2045-9912.254639
Alberini C.M., Cruz E., Descalzi G., Bessières B., Gao V. (2018) Astrocyte glycogen and lactate: New insights into learning and memory mechanisms. Glia 66: 1244–1262. https://doi.org/10.1002/glia.23250
Bali P., Banik A., Nehru B., Anand A. (2019) Neurotrophic Factors Mediated Activation of Astrocytes Ameliorate Memory Loss by Amyloid Clearance after Transplantation of Lineage Negative Stem Cells. Mol Neurobiol 56: 8420–8434. https://doi.org/10.1007/s12035-019-01680-z
Christopherson K.S., Ullian E.M., Stokes C.C.A., Mullowney C.E., Hell J.W., Agah A., Lawler J., Mosher D.F., Bornstein P., Barres B.A. (2005) Thrombospondins Are Astrocyte-Secreted Proteins that Promote CNS Synaptogenesis. Cell 120: 421–433. https://doi.org/10.1016/j.cell.2004.12.020
Bayraktar O.A., Fuentealba L.C., Alvarez-Buylla A., Rowitch D.H. (2015) Astrocyte Development and Heterogeneity. Cold Spring Harb Perspect Biol 7: a020362. https://doi.org/10.1101/cshperspect.a020362
Zhou B., Zuo Y., Jiang R. (2019) Astrocyte morphology: Diversity, plasticity, and role in neurological diseases. CNS Neurosci Ther 25: 665–673. https://doi.org/10.1111/cns.13123
Waterson M.J., Horvath T.L. (2015) Neuronal Regulation of Energy Homeostasis: Beyond the Hypothalamus and Feeding. Cell Metabolism 22: 962–970. https://doi.org/10.1016/j.cmet.2015.09.026
Herculano-Houzel S. (2011) Scaling of Brain Metabolism with a Fixed Energy Budget per Neuron: Implications for Neuronal Activity, Plasticity and Evolution. PLoS ONE 6: e17514. https://doi.org/10.1371/journal.pone.0017514
Arluison M., Quignon M., Nguyen P., Thorens B., Leloup C., Penicaud L. (2004) Distribution and anatomical localization of the glucose transporter 2 (GLUT2) in the adult rat brain–an immunohistochemical study. J Chem Neuroanat 28: 117–136. https://doi.org/10.1016/j.jchemneu.2004.05.009
Moreira T.J., Pierre K., Maekawa F., Repond C., Cebere A., Liljequist S., Pellerin L. (2009) Enhanced Cerebral Expression of MCT1 and MCT2 in a Rat Ischemia Model Occurs in Activated Microglial Cells. J Cereb Blood Flow Metab 29: 1273–1283. https://doi.org/10.1038/jcbfm.2009.50
Coraci I.S., Husemann J., Berman J.W., Hulette C., Dufour J.H., Campanella G.K., Luster A.D., Silverstein S.C., El Khoury J.B. (2002) CD36, a Class B Scavenger Receptor, Is Expressed on Microglia in Alzheimer’s Disease Brains and Can Mediate Production of Reactive Oxygen Species in Response to β-Amyloid Fibrils. Am J Pathol 160: 101–112. https://doi.org/10.1016/S0002-9440(10)64354-4
Bélanger M., Allaman I., Magistretti P.J. (2011) Brain Energy Metabolism: Focus on Astrocyte-Neuron Metabolic Cooperation. Cell Metabolism 14: 724–738. https://doi.org/10.1016/j.cmet.2011.08.016
Mathiisen T.M., Lehre K.P., Danbolt N.C., Ottersen O.P. (2010) The perivascular astroglial sheath provides a complete covering of the brain microvessels: An electron microscopic 3D reconstruction. Glia 58: 1094–1103. https://doi.org/10.1002/glia.20990
Dienel G.A. (2019) Brain Glucose Metabolism: Integration of Energetics with Function. Physiol Rev 99: 949–1045. https://doi.org/10.1152/physrev.00062.2017
Sonnay S., Poirot J., Just N., Clerc A.-C., Gruetter R., Rainer G., Duarte J.M.N. (2018) Astrocytic and neuronal oxidative metabolism are coupled to the rate of glutamate-glutamine cycle in the tree shrew visual cortex. Glia 66: 477–491. https://doi.org/10.1002/glia.23259
Kubotera H., Ikeshima-Kataoka H., Hatashita Y., Allegra Mascaro A.L., Pavone F.S., Inoue T. (2019) Astrocytic endfeet re-cover blood vessels after removal by laser ablation. Sci Rep 9: 1263. https://doi.org/10.1038/s41598-018-37419-4
Pascual O., Ben Achour S., Rostaing P., Triller A., Bessis A. (2012) Microglia activation triggers astrocyte-mediated modulation of excitatory neurotransmission. Proc Natl Acad Sci U S A 109: E197–E205. https://doi.org/10.1073/pnas.1111098109
Chen S.-H., Oyarzabal E.A., Sung Y.-F., Chu C.-H., Wang Q., Chen S.-L., Lu R.-B., Hong J.-S. (2015) Microglial regulation of immunological and neuroprotective functions of astroglia: Microglia Regulate Astroglia in Inflammation. Glia 63: 118–131. https://doi.org/10.1002/glia.22738
Anderson K.M., Collins M.A., Kong R., Fang K., Li J., He T., Chekroud A.M., Yeo B.T.T., Holmes A.J. (2020) Convergent molecular, cellular, and cortical neuroimaging signatures of major depressive disorder. Proc Natl Acad Sci U S A 117: 25138–25149. https://doi.org/10.1073/pnas.2008004117
di Domenico A., Carola G., Calatayud C., Pons-Espinal M., Muñoz J.P., Richaud-Patin Y., Fernandez-Carasa I., Gut M., Faella A., Parameswaran J., Soriano J., Ferrer I., Tolosa E., Zorzano A., Cuervo A.M., Raya A., Consiglio A. (2019) Patient-Specific iPSC-Derived Astrocytes Contribute to Non-Cell-Autonomous Neurodegeneration in Parkinson’s Disease. Stem Cell Rep 12: 213–229. https://doi.org/10.1016/j.stemcr.2018.12.011
Chung W.-S., Verghese P.B., Chakraborty C., Joung J., Hyman B.T., Ulrich J.D., Holtzman D.M., Barres B.A. (2016) Novel allele-dependent role for APOE in controlling the rate of synapse pruning by astrocytes. Proc Natl Acad Sci U S A 113: 10186–10191. https://doi.org/10.1073/pnas.1609896113
Gurven M., Walker R. (2006) Energetic demand of multiple dependents and the evolution of slow human growth. Proc R Soc B 273: 835–841. https://doi.org/10.1098/rspb.2005.3380
Bock J., Sellen D.W. (2002) Childhood and the evolution of the human life course: An introduction. Hum Nat 13: 153–159. https://doi.org/10.1007/s12110-002-1006-5
Navarrete A., van Schaik C.P., Isler K. (2011) Energetics and the evolution of human brain size. Nature 480: 91–93. https://doi.org/10.1038/nature10629
Schuppli C., Isler K., van Schaik C.P. (2012) How to explain the unusually late age at skill competence among humans. J Human Evolut 63: 843–850. https://doi.org/10.1016/j.jhevol.2012.08.009
Kuzawa C.W., Chugani H.T., Grossman L.I., Lipovich L., Muzik O., Hof P.R., Wildman D.E., Sherwood C.C., Leonard W.R., Lange N. (2014) Metabolic costs and evolutionary implications of human brain development. Proc Natl Acad Sci U S A 111: 13010–13015. https://doi.org/10.1073/pnas.1323099111
Pontzer H., Brown M.H., Raichlen D.A., Dunsworth H., Hare B., Walker K., Luke A., Dugas L.R., Durazo-Arvizu R., Schoeller D., Plange-Rhule J., Bovet P., Forrester T.E., Lambert E.V., Thompson M.E., Shumaker R.W., Ross S.R. (2016) Metabolic acceleration and the evolution of human brain size and life history. Nature 533: 390–392. https://doi.org/10.1038/nature17654
Namba T., Dóczi J., Pinson A., Xing L., Kalebic N., Wilsch-Bräuninger M., Long K.R., Vaid S., Lauer J., Bogdanova A., Borgonovo B., Shevchenko A., Keller P., Drechsel D., Kurzchalia T., Wimberger P., Chinopoulos C., Huttner W.B. (2020) Human-Specific ARHGAP11B Acts in Mitochondria to Expand Neocortical Progenitors by Glutaminolysis. Neuron 105: 867–881.e9. https://doi.org/10.1016/j.neuron.2019.11.027
Zintel T.M., Pizzollo J., Claypool C.G., Babbitt C.C. (2020) Astrocytes drive divergent metabolic gene expression in humans and chimpanzees. Evolut Biol. https://doi.org/10.1101/2020.11.09.374835
Verkhratsky A., Nedergaard M. (2016) The homeostatic astroglia emerges from evolutionary specialization of neural cells. Phil Trans R Soc B 371: 20150428. https://doi.org/10.1098/rstb.2015.0428
Dienel G.A., Rothman D.L. (2019) Glycogenolysis in Cerebral Cortex During Sensory Stimulation, Acute Hypoglycemia, and Exercise: Impact on Astrocytic Energetics, Aerobic Glycolysis, and Astrocyte-Neuron Interactions. In: DiNuzzo M, Schousboe A (eds) Brain Glycogen Metabolism. Springer Int Publ, Cham 209–267.
Falkowska A., Gutowska I., Goschorska M., Nowacki P., Chlubek D., Baranowska-Bosiacka I. (2015) Energy Metabolism of the Brain, Including the Cooperation between Astrocytes and Neurons, Especially in the Context of Glycogen Metabolism. IJMS 16: 25959–25981. https://doi.org/10.3390/ijms161125939
Li B., Freeman R.D. (2015) Neurometabolic coupling between neural activity, glucose, and lactate in activated visual cortex. J Neurochem 135: 742–754. https://doi.org/10.1111/jnc.13143
Goyal M.S., Hawrylycz M., Miller J.A., Snyder A.Z., Raichle M.E. (2014) Aerobic Glycolysis in the Human Brain Is Associated with Development and Neotenous Gene Expression. Cell Metabolism 19: 49–57. https://doi.org/10.1016/j.cmet.2013.11.020
Almeida A., Moncada S., Bolaños J.P. (2004) Nitric oxide switches on glycolysis through the AMP protein kinase and 6-phosphofructo-2-kinase pathway. Nat Cell Biol 6: 45–51. https://doi.org/10.1038/ncb1080
Allaman I., Pellerin L., Magistretti P.J. (2000) Protein targeting to glycogen mRNA expression is stimulated by noradrenaline in mouse cortical astrocytes. Glia 30: 382–391.
Drulis-Fajdasz D., Gizak A., Wójtowicz T., Wiśniewski J.R., Rakus D. (2018) Aging-associated changes in hippocampal glycogen metabolism in mice. Evidence for and against astrocyte-to-neuron lactate shuttle. Glia 66: 1481–1495. https://doi.org/10.1002/glia.23319
Gómez-Gonzalo M., Martin-Fernandez M., Martínez-Murillo R., Mederos S., Hernández-Vivanco A., Jamison S., Fernandez A.P., Serrano J., Calero P., Futch H.S., Corpas R., Sanfeliu C., Perea G., Araque A. (2017) Neuron-astrocyte signaling is preserved in the aging brain: Neuron-Astrocyte Signaling in Aging Brain. Glia 65: 569–580. https://doi.org/10.1002/glia.23112
Yellen G. (2018) Fueling thought: Management of glycolysis and oxidative phosphorylation in neuronal metabolism. J Cell Biol 217: 2235–2246. https://doi.org/10.1083/jcb.201803152
Patel A.B., Lai J.C.K., Chowdhury G.M.I., Hyder F., Rothman D.L., Shulman R.G., Behar K.L. (2014) Direct evidence for activity-dependent glucose phosphorylation in neurons with implications for the astrocyte-to-neuron lactate shuttle. Proc Natl Acad Sci U S A 111: 5385–5390. https://doi.org/10.1073/pnas.1403576111
Díaz-García C.M., Mongeon R., Lahmann C., Koveal D., Zucker H., Yellen G. (2017) Neuronal Stimulation Triggers Neuronal Glycolysis and Not Lactate Uptake. Cell Metabol 26: 361–374. https://doi.org/10.1016/j.cmet.2017.06.021
Ivanov A.I., Malkov A.E., Waseem T., Mukhtarov M., Buldakova S., Gubkina O., Zilberter M., Zilberter Y. (2014) Glycolysis and Oxidative Phosphorylation in Neurons and Astrocytes during Network Activity in Hippocampal Slices. J Cereb Blood Flow Metab 34: 397–407. https://doi.org/10.1038/jcbfm.2013.222
Tang B.L. (2018) Brain activity-induced neuronal glucose uptake/glycolysis: Is the lactate shuttle not required? Brain Res Bull 137: 225–228. https://doi.org/10.1016/j.brainresbull.2017.12.010
Swanson R.A., Yu A.C.H., Chan P.H., Sharp F.R. (1990) Glutamate Increases Glycogen Content and Reduces Glucose Utilization in Primary Astrocyte Culture. J Neurochem 54: 490–496. https://doi.org/10.1111/j.1471-4159.1990.tb01898.x
Sickmann H.M., Walls A.B., Schousboe A., Bouman S.D., Waagepetersen H.S. (2009) Functional significance of brain glycogen in sustaining glutamatergic neurotransmission. J Neurochem 109: 80–86. https://doi.org/10.1111/j.1471-4159.2009.05915.x
Xu J., Song D., Xue Z., Gu L., Hertz L., Peng L. (2013) Requirement of Glycogenolysis for Uptake of Increased Extracellular K+ in Astrocytes: Potential Implications for K+ Homeostasis and Glycogen Usage in Brain. Neurochem Res 38: 472–485. https://doi.org/10.1007/s11064-012-0938-3
Tekkök S.B., Brown A.M., Westenbroek R., Pellerin L., Ransom B.R. (2005) Transfer of glycogen-derived lactate from astrocytes to axons via specific monocarboxylate transporters supports mouse optic nerve activity. J Neurosci Res 81: 644–652. https://doi.org/10.1002/jnr.20573
Bak L.K., Walls A.B., Schousboe A., Waagepetersen H.S. (2018) Astrocytic glycogen metabolism in the healthy and diseased brain. J Biol Chem 293: 7108–7116. https://doi.org/10.1074/jbc.R117.803239
van Deijk A.-L.F., Camargo N., Timmerman J., Heistek T., Brouwers J.F., Mogavero F., Mansvelder H.D., Smit A.B., Verheijen M.H.G. (2017) Astrocyte lipid metabolism is critical for synapse development and function in vivo. Glia 65: 670–682. https://doi.org/10.1002/glia.23120
Camargo N., Goudriaan A., van Deijk A.-L.F., Otte W.M., Brouwers J.F., Lodder H., Gutmann D.H., Nave K.-A., Dijkhuizen R.M., Mansvelder H.D., Chrast R., Smit A.B., Verheijen M.H.G. (2017) Oligodendroglial myelination requires astrocyte-derived lipids. PLoS Biol 15:e1002605. https://doi.org/10.1371/journal.pbio.1002605
Martin P.M., Gopal E., Ananth S., Zhuang L., Itagaki S., Prasad B.M., Smith S.B., Prasad P.D., Ganapathy V. (2006) Identity of SMCT1 (SLC5A8) as a neuron-specific Na+-coupled transporter for active uptake of l-lactate and ketone bodies in the brain. J Neurochem 98: 279–288. https://doi.org/10.1111/j.1471-4159.2006.03878.x
Brunner B., Rauch E., Ari C., D’Agostino D.P., Kovács Z. (2021) Enhancement of Ketone Supplements-Evoked Effect on Absence Epileptic Activity by Co-Administration of Uridine in Wistar Albino jGlaxo Riswijk Rats. Nutrients 13: 234. https://doi.org/10.3390/nu13010234
Deng-Bryant Y., Prins M.L., Hovda D.A., Harris N.G. (2011) Ketogenic Diet Prevents Alterations in Brain Metabolism in Young but not Adult Rats after Traumatic Brain Injury. J Neurotrauma 28: 1813–1825. https://doi.org/10.1089/neu.2011.1822
Takahashi S., Iizumi T., Mashima K., Abe T., Suzuki N. (2014) Roles and Regulation of Ketogenesis in Cultured Astroglia and Neurons Under Hypoxia and Hypoglycemia. ASN Neuro 6: 175909141455099. https://doi.org/10.1177/1759091414550997
Itoh Y., Esaki T., Shimoji K., Cook M., Law M.J., Kaufman E., Sokoloff L. (2003) Dichloroacetate effects on glucose and lactate oxidation by neurons and astroglia in vitro and on glucose utilization by brain in vivo. Proc Natl Acad Sci U S A 100: 4879–4884. https://doi.org/10.1073/pnas.0831078100
Abe T., Takahashi S., Suzuki N. (2006) Oxidative Metabolism in Cultured Rat Astroglia: Effects of Reducing the Glucose Concentration in the Culture Medium and of D-Aspartate or Potassium Stimulation. J Cereb Blood Flow Metab 26: 153–160. https://doi.org/10.1038/sj.jcbfm.9600175
Lebon V., Petersen K.F., Cline G.W., Shen J., Mason G.F., Dufour S., Behar K.L., Shulman G.I., Rothman D.L. (2002) Astroglial Contribution to Brain Energy Metabolism in Humans Revealed by 13 C Nuclear Magnetic Resonance Spectroscopy: Elucidation of the Dominant Pathway for Neurotransmitter Glutamate Repletion and Measurement of Astrocytic Oxidative Metabolism. J Neurosci 22: 1523–1531. https://doi.org/10.1523/JNEUROSCI.22-05-01523.2002
Takado Y., Knott G., Humbel B.M., Escrig S., Masoodi M., Meibom A., Comment A. (2015) Imaging liver and brain glycogen metabolism at the nanometer scale. Nanomedicine: Nanotechnology, Biology and Medicine 11: 239–245. https://doi.org/10.1016/j.nano.2014.09.007
Walls A.B., Heimbürger C.M., Bouman S.D., Schousboe A., Waagepetersen H.S. (2009) Robust glycogen shunt activity in astrocytes: Effects of glutamatergic and adrenergic agents. Neuroscience 158: 284–292. https://doi.org/10.1016/j.neuroscience.2008.09.058
Suh S.W., Bergher J.P., Anderson C.M., Treadway J.L., Fosgerau K., Swanson R.A. (2007) Astrocyte Glycogen Sustains Neuronal Activity during Hypoglycemia: Studies with the Glycogen Phosphorylase Inhibitor CP-316,819 ([ R – R *, S *]-5-Chloro- N -[2-hydroxy-3-(methoxymethylamino)-3-oxo-1-(phenylmethyl)propyl]-1 H -indole-2-carboxamide). J Pharmacol Exp Ther 321: 45–50. https://doi.org/10.1124/jpet.106.115550
Choi I.-Y., Seaquist E.R., Gruetter R. (2003) Effect of hypoglycemia on brain glycogen metabolism in vivo. J Neurosci Res 72: 25–32. https://doi.org/10.1002/jnr.10574
Kong J., Shepel P.N., Holden C.P., Mackiewicz M., Pack A.I., Geiger J.D. (2002) Brain Glycogen Decreases with Increased Periods of Wakefulness: Implications for Homeostatic Drive to Sleep. J Neurosci 22: 5581–5587. https://doi.org/10.1523/JNEUROSCI.22-13-05581.2002
Brown A.M., Tekkök S.B., Ransom B.R. (2003) Glycogen Regulation and Functional Role in Mouse White Matter. J Physiol 549: 501–512. https://doi.org/10.1113/jphysiol.2003.042416
Cardinaux J.R., Allaman I., Magistretti P.J. (2000) Pro-inflammatory cytokines induce the transcription factors C/EBPbeta and C/EBPdelta in astrocytes. Glia 29: 91–97.
Petit J.-M., Tobler I., Allaman I., Borbély A.A., Ma-gistretti P.J. (2002) Sleep deprivation modulates brain mRNAs encoding genes of glycogen metabolism: Sleep and brain glycogen metabolism. Eur J Neurosci 16: 1163–1167. https://doi.org/10.1046/j.1460-9568.2002.02145.x
Wahis J., Holt M.G. (2021) Astrocytes, Noradrenaline, α1-Adrenoreceptors, and Neuromodulation: Evidence and Unanswered Questions. Front Cell Neurosci 15:645691. https://doi.org/10.3389/fncel.2021.645691
Hertz L., Lovatt D., Goldman S.A., Nedergaard M. (2010) Adrenoceptors in brain: Cellular gene expression and effects on astrocytic metabolism and [Ca2+]i. Neurochem Int 57: 411–420. https://doi.org/10.1016/j.neuint.2010.03.019
Vardjan N., Horvat A., Anderson J.E., Yu D., Croom D., Zeng X., Lužnik Z., Kreft M., Teng Y.D., Kirov S.A., Zorec R. (2016) Adrenergic activation attenuates astrocyte swelling induced by hypotonicity and neurotrauma: Adrenergic Activation Reduces Astrocyte Swelling. Glia 64 (6): 1034–1049. https://doi.org/10.1002/glia.22981
Vardjan N., Chowdhury H.H., Horvat A., Velebit J., Malnar M., Muhič M, Kreft M, Krivec ŠG, Bobnar ST, Miš K, Pirkmajer S, Offermanns S, Henriksen G, Storm-Mathisen J, Bergersen LH, Zorec R (2018) Enhancement of Astroglial Aerobic Glycolysis by Extracellular Lactate-Mediated Increase in cAMP. Front Mol Neurosci 11:148. https://doi.org/10.3389/fnmol.2018.00148
Chalermpalanupap T., Schroeder J.P., Rorabaugh J.M., Liles L.C., Lah J.J., Levey A.I., Weinshenker D. (2018) Locus Coeruleus Ablation Exacerbates Cognitive Deficits, Neuropathology, and Lethality in P301S Tau Transgenic Mice. J Neurosci 38: 74–92. https://doi.org/10.1523/JNEUROSCI.1483-17.2017
Harris R.A., Lone A., Lim H., Martinez F., Frame A.K., Scholl T.J., Cumming RC (2019) Aerobic Glycolysis Is Required for Spatial Memory Acquisition But Not Memory Retrieval in Mice. eNeuro 6: ENEURO.0389-18.2019. https://doi.org/10.1523/ENEURO.0389-18.2019
Gibbs M.E., Hutchinson D.S., Summers R.J. (2010) Noradrenaline release in the locus coeruleus modulates memory formation and consolidation; roles for α- and β-adrenergic receptors. Neuroscience 170: 1209–1222. https://doi.org/10.1016/j.neuroscience.2010.07.052
Rothman D.L., Dienel G.A. (2019) Development of a Model to Test Whether Glycogenolysis Can Support Astrocytic Energy Demands of Na+, K+-ATPase and Glutamate-Glutamine Cycling, Sparing an Equivalent Amount of Glucose for Neurons. In: DiNuzzo M, Schousboe A (eds) Brain Glycogen Metabolism. Springer Int Publ, Cham 385–433.
Bolton C.J., Tam J.W. (2020) Differential Involvement of the Locus Coeruleus in Early- and Late-Onset Alzheimer’s Disease: A Potential Mechanism of Clinical Differences? Neurology. https://doi.org/10.1101/2020.11.01.20224139
Chuquet J., Quilichini P., Nimchinsky E.A., Buzsaki G. (2010) Predominant Enhancement of Glucose Uptake in Astrocytes versus Neurons during Activation of the Somatosensory Cortex. J Neurosci 30: 15298–15303. https://doi.org/10.1523/JNEUROSCI.0762-10.2010
Wang Q., Hu Y., Wan J., Dong B., Sun J. (2019) Lactate: A Novel Signaling Molecule in Synaptic Plasticity and Drug Addiction. BioEssays 41: 1900008. https://doi.org/10.1002/bies.201900008
Magistretti P.J., Allaman I. (2015) A Cellular Perspective on Brain Energy Metabolism and Functional Imaging. Neuron 86: 883–901. https://doi.org/10.1016/j.neuron.2015.03.035
Hui S., Ghergurovich J.M., Morscher R.J., Jang C., Teng X., Lu W., Esparza L.A., Reya T., Le Zhan, Yanxiang Guo J., White E., Rabinowitz J.D. (2017) Glucose feeds the TCA cycle via circulating lactate. Nature 551: 115–118. https://doi.org/10.1038/nature24057
DiNuzzo M., Giove F., Maraviglia B., Mangia S. (2017) Computational Flux Balance Analysis Predicts that Stimulation of Energy Metabolism in Astrocytes and their Metabolic Interactions with Neurons Depend on Uptake of K+ Rather than Glutamate. Neurochem Res 42: 202–216. https://doi.org/10.1007/s11064-016-2048-0
Boury-Jamot B., Carrard A., Martin J.L., Halfon O., Magistretti P.J., Boutrel B. (2016) Disrupting astrocyte–neuron lactate transfer persistently reduces conditioned responses to cocaine. Mol Psychiatry 21: 1070–1076. https://doi.org/10.1038/mp.2015.157
Newman L.A., Korol D.L., Gold P.E. (2011) Lactate Produced by Glycogenolysis in Astrocytes Regulates Memory Processing. PLoS ONE 6: e28427. https://doi.org/10.1371/journal.pone.0028427
Margineanu M.B., Mahmood H., Fiumelli H., Magistretti P.J. (2018) L-Lactate Regulates the Expression of Synaptic Plasticity and Neuroprotection Genes in Cortical Neurons: A Transcriptome Analysis. Front Mol Neurosci 11: 375. https://doi.org/10.3389/fnmol.2018.00375
Herrera-López G., Griego E., Galván E.J. (2020) Lactate induces synapse-specific potentiation on CA3 pyramidal cells of rat hippocampus. PLoS ONE 15: e0242309. https://doi.org/10.1371/journal.pone.0242309
Yang J., Ruchti E., Petit J.-M., Jourdain P., Grenningloh G., Allaman I., Magistretti P.J. (2014) Lactate promotes plasticity gene expression by potentiating NMDA signaling in neurons. Proc Natl Acad Sci U S A 111: 12228–12233. https://doi.org/10.1073/pnas.1322912111
Newman L.A., Scavuzzo C.J., Gold P.E., Korol D.L. (2017) Training-induced elevations in extracellular lactate in hippocampus and striatum: Dissociations by cognitive strategy and type of reward. Neurobiol Learning and Memory 137: 142–153. https://doi.org/10.1016/j.nlm.2016.12.001
Pötzsch A., Zocher S., Bernas S.N., Leiter O., Rünker A.E., Kempermann G. (2021) L-lactate exerts a pro-proliferative effect on adult hippocampal precursor cells in vitro. Science 24: 102126. https://doi.org/10.1016/j.isci.2021.102126
Ruchti E., Roach P.J., DePaoli-Roach A.A., Magistretti P.J., Allaman I. (2016) Protein targeting to glycogen is a master regulator of glycogen synthesis in astrocytes. IBRO Reports 1: 46–53. https://doi.org/10.1016/j.ibror.2016.10.002
Magistretti P.J., Dietl M.M., Hof P.R., Martin J.-L., Palacios J.M., Schaad N., Schorderet M. (1988) Vasoactive Intestinal Peptide as a Mediator of Intercellular Communication in the Cerebral Cortex. Release, Receptors, Actions, and Interactions with Norepinephrine. Ann NY Acad Sci 527: 110–129. https://doi.org/10.1111/j.1749-6632.1988.tb26977.x
Coggan J.S., Keller D., Calì C., Lehväslaiho H., Markram H., Schürmann F., Magistretti P.J. (2018) Norepinephrine stimulates glycogenolysis in astrocytes to fuel neurons with lactate. PLoS Comput Biol 14: e1006392. https://doi.org/10.1371/journal.pcbi.1006392
Gao V., Suzuki A., Magistretti P.J., Lengacher S., Po-llonini G., Steinman M.Q., Alberini C.M. (2016) Astrocytic β 2 -adrenergic receptors mediate hippocampal long-term memory consolidation. Proc Natl Acad Sci U S A 113: 8526–8531. https://doi.org/10.1073/pnas.1605063113
Walls A.B., Sickmann H.M., Brown A., Bouman S.D., Ransom B., Schousboe A., Waagepetersen H.S. (2008) Characterization of 1,4-dideoxy-1,4-imino-d-arabinitol (DAB) as an inhibitor of brain glycogen shunt activity. J Neurochem 105: 1462–1470. https://doi.org/10.1111/j.1471-4159.2008.05250.x
Suzuki A., Stern S.A., Bozdagi O., Huntley G.W., Walker R.H., Magistretti P.J., Alberini C.M. (2011) Astrocyte-Neuron Lactate Transport Is Required for Long-Term Memory Formation. Cell 144: 810–823. https://doi.org/10.1016/j.cell.2011.02.018
Vezzoli E., Calì C., De Roo M., Ponzoni L., Sogne E., Gagnon N., Francolini M., Braida D., Sala M., Muller D., Falqui A., Magistretti P.J. (2020) Ultrastructural Evidence for a Role of Astrocytes and Glycogen-Derived Lactate in Learning-Dependent Synaptic Stabilization. Cerebr Cortex 30: 2114–2127. https://doi.org/10.1093/cercor/bhz226
Edmond J., Robbins R.A., Bergstrom J.D., Cole R.A., de Vellis J. (1987) Capacity for substrate utilization in oxidative metabolism by neurons, astrocytes, and oligodendrocytes from developing brain in primary culture. J Neurosci Res 18: 551–561. https://doi.org/10.1002/jnr.490180407
Ebert D., Haller R.G., Walton M.E. (2003) Energy Contribution of Octanoate to Intact Rat Brain Metabolism Measured by 13 C Nuclear Magnetic Resonance Spectroscopy. J Neurosci 23: 5928–5935. https://doi.org/10.1523/JNEUROSCI.23-13-05928.2003
Hardie D.G. (2008) AMPK: a key regulator of energy balance in the single cell and the whole organism. Int J Obes 32: S7–S12. https://doi.org/10.1038/ijo.2008.116
Blázquez C., Woods A., De Ceballos M.L., Carling D., Guzmán M. (2002) The AMP-Activated Protein Kinase Is Involved in the Regulation of Ketone Body Production by Astrocytes. J Neurochem 73: 1674–1682. https://doi.org/10.1046/j.1471-4159.1999.731674.x
Westhaus A., Blumrich E.M., Dringen R. (2017) The Antidiabetic Drug Metformin Stimulates Glycolytic Lactate Production in Cultured Primary Rat Astrocytes. Neurochem Res 42: 294–305. https://doi.org/10.1007/s11064-015-1733-8
Takahashi S. (2020) Metabolic compartmentalization between astroglia and neurons in physiological and pathophysiological conditions of the neurovascular unit. Neuropathology 40: 121–137. https://doi.org/10.1111/neup.12639
Le Foll C., Levin B.E. (2016) Fatty acid-induced astrocyte ketone production and the control of food intake. Am J Physiol Regulat, Integrativ and Compar Physiol 310: R1186–R1192. https://doi.org/10.1152/ajpregu.00113.2016
Youssef F.F. (2015) Ketone bodies attenuate excitotoxic cell injury in the rat hippocampal slice under conditions of reduced glucose availability. Neurol Res 37: 211–216. https://doi.org/10.1179/1743132814Y.0000000430
Prins M.L. (2008) Cerebral Metabolic Adaptation and Ketone Metabolism after Brain Injury. J Cereb Blood Flow Metab 28: 1–16. https://doi.org/10.1038/sj.jcbfm.9600543
Samoilova M., Weisspapir M., Abdelmalik P., Velumian A.A., Carlen P.L. (2010) Chronic in vitro ketosis is neuroprotective but not anti-convulsant. J Neurochem 113: 826–835. https://doi.org/10.1111/j.1471-4159.2010.06645.x
Błaszczyk J.W. (2020) Energy Metabolism Decline in the Aging Brain–Pathogenesis of Neurodegenerative Disorders. Metabolites 10: 450. https://doi.org/10.3390/metabo10110450
Cunnane S.C., Courchesne-Loyer A., Vandenberghe C., St-Pierre V., Fortier M., Hennebelle M., Croteau E., Bocti C., Fulop T., Castellano C.-A. (2016) Can Ketones Help Rescue Brain Fuel Supply in Later Life? Implications for Cognitive Health during Aging and the Treatment of Alzheimer’s Disease. Front Mol Neurosci 9. https://doi.org/10.3389/fnmol.2016.00053
Pellerin L., Halestrap A.P., Pierre K. (2005) Cellular and subcellular distribution of monocarboxylate transporters in cultured brain cells and in the adult brain. J Neurosci Res 79: 55–64. https://doi.org/10.1002/jnr.20307
Hawkins R.A., Mans A.M., Davis D.W. (1986) Regional ketone body utilization by rat brain in starvation and diabetes. Am J Physiol Endocrinol Metabol 250: E169–E178. https://doi.org/10.1152/ajpendo.1986.250.2.E169
Pan J.W., Telang F.W., Lee J.H., De Graaf R.A., Rothman D.L., Stein DT, Hetherington HP (2008) Measurement of β-hydroxybutyrate in acute hyperketonemia in human brain: Cerebral BHB in acute hyperketonemia. J Neurochem 79: 539–544. https://doi.org/10.1046/j.1471-4159.2001.00575.x
Hargrave S.L., Davidson T.L., Lee T.-J., Kinzig K.P. (2015) Brain and behavioral perturbations in rats following Western diet access. Appetite 93: 35–43. https://doi.org/10.1016/j.appet.2015.03.037
Leino R.L., Gerhart D.Z., Duelli R., Enerson B.E., Drewes L.R. (2001) Diet-induced ketosis increases monocarboxylate transporter (MCT1) levels in rat brain. Neurochem Int 38: 519–527. https://doi.org/10.1016/S0197-0186(00)00102-9
Takimoto M., Hamada T. (2014) Acute exercise increases brain region-specific expression of MCT1, MCT2, MCT4, GLUT1, and COX IV proteins. J Appl Physiol 116: 1238–1250. https://doi.org/10.1152/japplphysiol.01288.2013
Escartin C., Pierre K., Colin A., Brouillet E., Delzescaux T., Guillermier M., Dhenain M., Deglon N., Hantraye P., Pellerin L., Bonvento G. (2007) Activation of Astrocytes by CNTF Induces Metabolic Plasticity and Increases Resistance to Metabolic Insults. J Neurosci 27: 7094–7104. https://doi.org/10.1523/JNEUROSCI.0174-07.2007
Phillis J.W., O’Regan M.H. (2004) A potentially critical role of phospholipases in central nervous system ischemic, traumatic, and neurodegenerative disorders. Brain Res Rev 44: 13–47. https://doi.org/10.1016/j.brainresrev.2003.10.002
Sun G.Y., Xu J., Jensen M.D., Simonyi A. (2004) Phospholipase A2 in the central nervous system. J Lipid Res 45: 205–213. https://doi.org/10.1194/jlr.R300016-JLR200
Dhillon V.S., Fenech M. (2014) Mutations that affect mitochondrial functions and their association with neurodegenerative diseases. Mutation Res/Rev in Mutation Res 759: 1–13. https://doi.org/10.1016/j.mrrev.2013.09.001
Yan L.-J., Xiao M., Chen R., Cai Z. (2013) Metabolic Dysfunction of Astrocyte: An Initiating Factor in Beta-amyloid Pathology? Aging Neurodegener 1: 7–14.
Nadler Y., Alexandrovich A., Grigoriadis N., Hartmann T., Rao K.S.J., Shohami E., Stein R. (2008) Increased expression of the γ-secretase components presenilin-1 and nicastrin in activated astrocytes and microglia following traumatic brain injury. Glia 56: 552–567. https://doi.org/10.1002/glia.20638
Perdivara I., Petrovich R., Allinquant B., Deterding L.J., Tomer K.B., Przybylski M. (2009) Elucidation of O-Glycosylation Structures of the β-Amyloid Precursor Protein by Liquid Chromatography−Mass Spectrometry Using Electron Transfer Dissociation and Collision Induced Dissociation. J Proteome Res 8: 631–642. https://doi.org/10.1021/pr800758g
Allaman I., Gavillet M., Belanger M., Laroche T., Viertl D., Lashuel H.A., Magistretti P.J. (2010) Amyloid- Aggregates Cause Alterations of Astrocytic Metabolic Phenotype: Impact on Neuronal Viability. J Neurosci 30: 3326–3338. https://doi.org/10.1523/JNEUROSCI.5098-09.2010
Yin X., Feng L., Ma D., Yin P., Wang X., Hou S., Hao Y., Zhang J., Xin M., Feng J. (2018) Roles of astrocytic connexin-43, hemichannels, and gap junctions in oxygen-glucose deprivation/reperfusion injury induced neuroinflammation and the possible regulatory mechanisms of salvianolic acid B and carbenoxolone. J Neuroinflammat 15: 97. https://doi.org/10.1186/s12974-018-1127-3
Iglesias J., Morales L., Barreto G.E. (2017) Metabolic and Inflammatory Adaptation of Reactive Astrocytes: Role of PPARs. Mol Neurobiol 54: 2518–2538. https://doi.org/10.1007/s12035-016-9833-2
Zecca L., Wilms H., Geick S., Claasen J.-H., Brandenburg L.-O., Holzknecht C., Panizza M.L., Zucca F.A., Deuschl G., Sievers J., Lucius R. (2008) Human neuromelanin induces neuroinflammation and neurodegeneration in the rat substantia nigra: implications for Parkinson’s disease. Acta Neuropathol 116: 47–55. https://doi.org/10.1007/s00401-008-0361-7
Bellucci A., Collo G., Sarnico I., Battistin L., Missale C., Spano P. (2008) Alpha-synuclein aggregation and cell death triggered by energy deprivation and dopamine overload are counteracted by D2 D3 receptor activation. J Neurochem 106: 560–577. https://doi.org/10.1111/j.1471-4159.2008.05406.x
Jiang P., Gan M., Ebrahim A.S., Castanedes-Casey M., Dickson D.W., Yen S.-H.C. (2013) Adenosine monophosphate-activated protein kinase overactivation leads to accumulation of α-synuclein oligomers and decrease of neurites. Neurobiol Aging 34: 1504–1515. https://doi.org/10.1016/j.neurobiolaging.2012.11.001
Schmidt S., Linnartz B., Mendritzki S., Sczepan T., Lubbert M., Stichel C.C., Lubbert H. (2011) Genetic mouse models for Parkinson’s disease display severe pathology in glial cell mitochondria. Human Mol Genetics 20: 1197–1211. https://doi.org/10.1093/hmg/ddq564
Gu X.-L., Long C.-X., Sun L., Xie C., Lin X., Cai H. (2010) Astrocytic expression of Parkinson’s disease-related A53T α-synuclein causes neurodegeneration in mice. Mol Brain 3: 12. https://doi.org/10.1186/1756-6606-3-12
Tsai M.J., Lee E.H. (1996) Characterization of L-DOPA transport in cultured rat and mouse astrocytes. J Neurosci Res 43: 490–495. https://doi.org/10.1002/(SICI)1097-4547(19960215)43:4<490::AID-JNR10>3.0.CO;2-6
Asanuma M., Miyazaki I., Murakami S., Diaz-Corrales F.J., Ogawa N. (2014) Striatal Astrocytes Act as a Reservoir for L-DOPA. PLoS ONE 9: e106362. https://doi.org/10.1371/journal.pone.0106362
Wójtowicz A.M., Dvorzhak A., Semtner M., Grantyn R. (2013) Reduced tonic inhibition in striatal output neurons from Huntington mice due to loss of astrocytic GABA release through GAT-3. Front Neural Circuits 7. https://doi.org/10.3389/fncir.2013.00188
Lee W., Reyes R.C., Gottipati M.K., Lewis K., Lesort M., Parpura V., Gray M. (2013) Enhanced Ca2+-dependent glutamate release from astrocytes of the BACHD Huntington’s disease mouse model. Neurobiol Disease 58: 192–199. https://doi.org/10.1016/j.nbd.2013.06.002
Madji Hounoum B., Mavel S., Coque E., Patin F., Vourc’h P., Marouillat S., Nadal-Desbarats L., Emond P., Corcia P., Andres C.R., Raoul C., Blasco H. (2017) Wildtype motoneurons, ALS-Linked SOD1 mutation and glutamate profoundly modify astrocyte metabolism and lactate shuttling: Astrocyte Metabolism in ALS-Associated Conditions. Glia 65: 592–605. https://doi.org/10.1002/glia.23114
Mitropoulos K., Katsila T., Patrinos G.P., Pampalakis G. (2018) Multi-Omics for Biomarker Discovery and Target Validation in Biofluids for Amyotrophic Lateral Sclerosis Diagnosis. OMICS: J Integr Biol 22: 52–64. https://doi.org/10.1089/omi.2017.0183
Cistaro A., Valentini M.C., Chiò A., Nobili F., Calvo A., Moglia C., Montuschi A., Morbelli S., Salmaso D., Fania P., Carrara G., Pagani M. (2012) Brain hypermetabolism in amyotrophic lateral sclerosis: a FDG PET study in ALS of spinal and bulbar onset. Eur J Nucl Med Mol Imaging 39: 251–259. https://doi.org/10.1007/s00259-011-1979-6
Ferraiuolo L., Higginbottom A., Heath P.R., Barber S., Greenald D., Kirby J., Shaw P.J. (2011) Dysregulation of astrocyte–motoneuron cross-talk in mutant superoxide dismutase 1-related amyotrophic lateral sclerosis. Brain 134: 2627–2641. https://doi.org/10.1093/brain/awr193
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


