Журнал эволюционной биохимии и физиологии, 2021, T. 57, № 6, стр. 519-531
ВЛИЯНИЕ ПОСЛЕДСТВИЙ ГИПОКСИЧЕСКИХ ВОЗДЕЙСТВИЙ В РАЗНЫЕ ПЕРИОДЫ ЭМБРИОГЕНЕЗА, НА ЭЛЕКТРИЧЕСКУЮ АКТИВНОСТЬ СЛУХОВОЙ КОРЫ В ПЕРВЫЙ МЕСЯЦ ПОСТНАТАЛЬНОГО РАЗВИТИЯ КРОЛИКОВ
А. Г. Гусейнов *
Институт физиологии им. А.И. Караева НАН Азербайджана
Баку, Азербайджан
* E-mail: guseynov_alipanah@mail.ru
Поступила в редакцию 22.11.2020
После доработки 16.04.2021
Принята к публикации 19.07.2021
Аннотация
У 20- и 30-дневных крольчат, подвергнутых гипоксии в разные периоды внутриутробной жизни, исследован спектральный состав ЭКоГ слуховой коры. Недостаток кислорода в зародышевый (E1–8), предплодный (E8–18) и плодный периоды (E18–28) пренатального развития по-разному влияет на формирование спектра ЭКоГ слуховой коры крольчат. Эти различия в основном выражаются степенью увеличения количества медленных волн в электрической активности слуховой коры. Как у 20-, так и 30‑дневных крольчат, подвергнутых гипоксии в зародышевый период эмбриогенеза, спектральные показатели ЭКоГ отклоняются от нормы незначительно, тогда как гипоксия на двух более поздних сроках эмбриогенеза приводила к более выраженным, но сходным изменениям спектральных показателей. Исходя из этих данных, можно предположить, что клетки, формирующие нервные структуры, генерирующие электрическую активность слуховой коры кролика, более чувствительны к недостатку кислорода в предплодный и плодный периоды эмбриогенеза, по сравнению с зародышевым периодом внутриутробной жизни.
В литературе, на основании электрофизиологических исследований, считается, что на ранних этапах онтогенеза чем моложе организм, тем его нервная система более устойчива к кислородной недостаточности [1, 2]. Так, в срезах мозга 4-, 7- и 10-дневных и взрослых крыс постсинаптические потенциалы нейронов исчезают, соответственно, через 22, 9, 6 и 4 мин после начала аноксии [2]. Однако, имеются данные, которые не согласуются с этим общепринятым представлением. По мнению некоторых авторов, реакция нервной системы на кислородное голодание в пренатальном онтогенезе и период новорожденности исследовано недостаточно, и представление о высокой устойчивости развивающейся нервной системы к гипоксии основывается на исследованиях, проведенных, в основном, в более поздние периоды онтогенеза [3, 4]. Обнаружено, что несмотря на то, что электрическая активность развивающегося мозга, по сравнению со взрослым, меньше подавляется под воздействием гипоксии, незрелые нервные структуры, в частности, нейроны, больше подвержены гипоксическим повреждениям [4]. Также имеются электрофизиологические данные, указывающие на то, что в течение первого месяца жизни чувствительность нервной системы крольчат к кислородному голоданию повышается [3].
Реакция нервной системы на гипоксию изменяется также в течение эмбриогенеза. Известны данные о том, что у 25-дневных плодов кролика, по сравнению с 20-дневными, гипоксия, вызванная пережатием пуповины, вызывает более выраженные изменения в ЭЭГ [5].
Структурные изменения, как в развивающейся, так и зрелой нервной системе, могут проявляться сразу или отсроченно, через 1–3 сут, неделю или больше времени после воздействия гипоксии. Подобная закономерность обнаруживается во всех структурах нервной системы [6, 7]. Поэтому для определения устойчивости развивающейся нервной системы к недостатку кислорода значительный интерес представляют те электрофизиологические исследования, которые проведены не сразу после воздействия гипоксии, а в более поздние периоды онтогенеза. Так, было показано, что у 28‑дневных плодов кролика, испытавших кислородное голодание в предплодный период внутриутробной жизни, в ЭКоГ сенсомоторной коры обнаруживаются очень сильные изменения, в то время как после гипоксии в плодный период в корковой активности изменения почти отсутствуют [8]. В спектре ЭЭГ лимбической и зрительной коры крольчат разного возраста после кислородного голодания в зародышевый, предплодный и плодный периоды внутриутробной жизни также обнаружены изменения разного характера [9, 10]. Однако из-за неоднозначности этих изменений не представляется возможным определение периода пренатальной жизни, когда нервная система проявляет наибольшую чувствительность к недостатку кислорода.
Учитывая вышеизложенное, в настоящей работе электрофизиологическими методами исследовано изменение восприимчивости нервной системы к гипоксии в разные периоды внутриутробной жизни. С этой целью проведен анализ ЭКоГ крольчат разного возраста после воздействия гипоксии в разные периоды пренатального развития. Объектом исследования выбрана слуховая кора, которая, по сравнению с другими сенсорными корковыми областями, отличается более поздним морфофункциональным развитием в онтогенезе [11].
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования проводились на 20- и 30-дневных крольчатах породы Шиншилла. Все исследования проводили в соответствии с принципами Базельской декларации и рекомендациями биоэтического комитета организации ARRIVE [15].
В обеих возрастных группах электрофизиологические исследования проводились на 4 группах крольчат. Одна группа животных служила контролем. Крольчата первой экспериментальной группы подвергались воздействию гипоксии в течение всего зародышевого периода (с 1-го по 8-е сутки), второй – в течение предплодного периода (с 8-го по 18-е сутки), а третьей – в течение плодного периода (с 18-го по 28-е сутки) пренатальной жизни (классификация пренатального онтогенеза по Шмитду [12]). В контрольной и экспериментальных группах использовались 17, 14, 16 и 17 крольчат, соответственно, 20-дневного возраста, и 17, 14, 15 и 16 крольчат 30-дневного возраста. Для создания гипоксического состояния у плодов по методу Б.М. Хватовой (“Способы определения степени тяжести гипоксии”. Авт. св. №. 2986388.1983) беременная крольчиха каждый день помещалась в прозрачную специально вентилируемую камеру объемом 0.12 м3, куда в течение 20 мин подавалась смесь газов – кислорода (5%) и азота (95%). В камере содержание диоксида углерода не превышало 0.1%. Перед родами беременные крольчихи пересаживались в клетку, приспособленную для ухода за потомством. До электрофизиологических исследований крольчата содержались вместе матерью.
Исследоване электрокортикограммы (ЭКоГ) слуховой коры проводилось в обоих полушариях. Координаты слуховой коры определяли по картам коры головного мозга кролика [13, 14]. Перед регистрацией электрической активности коры мозга животных наркотизировали внутривенным введением раствора этаминала–натрия в дозе 40 мг/кг веса животного. Для регистрации электрической активности обнажали участок слуховой коры мозга площадью 0.5 см2. ЭКоГ регистрировали с поверхности слуховой коры посредством игольчатых электродов, референтный электрод фиксировали в носовой пазухе. ЭКоГ записывали на 8-канальном электроэнцефалографе “Медикор” (Венгрия) и на компьютере “Нейрон Спектр 2” (Россия). Фильтры усилителя электроэнцефалографа устанавливались в диапазоне 0.1–70 Гц. Регистрация с каждой области продолжалась в течение 20 мин. Животных по окончании опытов усыпляли раствором этаминала-натрия.
Спектральный анализ ЭКоГ проводился с помощью компьютера “Нейрон Спектр 2”. Исследованы стандартные волны δ-, θ-, α-, β1- и β2-диапазонов. Эпохи анализа для каждого животного составляли 30 с.
Статистическую обработку полученных данных проводили на компьютере “Нейрон Спектр 2” c помощью пакета программ Excel. Статистическую достоверность различия средних значений спектральных показателей оценивали с помощью критерия Фишера (F-критерий). Данные считались достоверными при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Проведенный анализ показывает, что в спектре ЭКоГ 20-дневных крольчат преобладают быстрые волны. Однако ЭКоГ отличается очень высоким содержанием медленной активности – 25.4%. В медленном спектре δ-активность, по сравнению с доминирующей θ-активностью, индекс которой равняется – 14.1 ± 1.3%, представлена несколько меньше – 11.3 ± 1.5%. Быстрые волны β1- и β2-диапазона имеют наибольшие индексы в спектре электрической активности – 19.5 ± 2.2% и 40.7 ± 4.2%. α-активность занимает 14.4 ± 1.7% спектра (рис. 1, 2).
Рис. 1.
ЭКоГ слуховой коры 20-дневных крольчат: a – контроль, b – после гипоксии в зародышевый (E1–8), c – предплодный (E8–18) и d – плодный периоды эмбриогенеза (E18–28). Калибровка: 100 мкВ, 1 с.
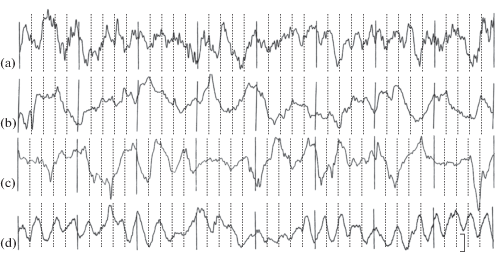
Рис. 2.
Спектральный состав ЭКоГ слуховой коры 20-дневных крольчат: a – контроль (n = 17), b – после гипоксии в зародышевый (E1–8, n = 14), c – предплодный (E8–18, n = 16) и d – плодный период эмбриогенеза (E18–28, n = = 17). * – (p < 0.05), **– (p < 0.01).
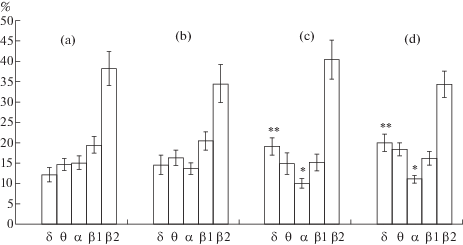
После перенесенной гипоксии в зародышевый период эмбриогенеза в спектре усиливается выраженность медленной активности. Прирост в количестве δ- и θ-волн равен 21–23%. Вместе эти волны занимают 30.9% спектра, что на 21% больше, чем в норме. Удельный вес всех быстрых волн фоновой активности уменьшается.
Анализ ЭКоГ слуховой коры крольчат, испытавших дефицит кислорода в предплодный период эмбриогенеза, показывает, что в ее спектре резко возрастает доля медленных δ- и θ-волн и составляет 33.9% (p < 0.05). Этот показатель на 33% больше, чем в норме. При этом прирост медленных волн, в основном, связан с δ-активностью, которая становится доминирующей в медленном спектре (p < 0.01). Резко – в 1.5 раза – уменьшается количество волн α-диапазона (p < 0.05). Более умеренно ослабляется β-активность. Если индекс β2-волн, по сравнению с контролем, меньше на 12%, то ослабление β1-активности очень незначительное (рис. 1, 2).
После гипоксического воздействия в плодный период эмбриональной жизни электрическая активность слуховой коры также характеризируется сильно измененным спектром. Доля низкочастотных δ- и θ-волн в спектре резко – на треть – возрастает и достигает 33.6% (p < 0.05). Как и в предыдущей экспериментальной группе, δ-активность (p < 0.01) становится преобладающей в медленном спектре, а индекс θ-волн незначительно отличается от контроля. В той или иной степени ослабляется активность всех быстрых волн. Если количество колебаний α-диапазона уменьшается на 40% (p < 0.05), то изменение спектральных показателей β1- и β2-волн менее выражено (рис. 1, 2).
Обобщая эти данные, можно заключить, что у 20-дневных крольчат после гипоксии в последние периоды внутриутробной жизни, по сравнению с первым (зародышевым), в спектре ЭКоГ слуховой коры изменения выражены сильнее. Если в первой экспериментальной группе прирост медленных волн спектра равен 21%, то в следующих экспериментальных группах увеличивается ровно на треть.
У контрольных 30-дневных крольчат спектральный состав и общая картина ЭКоГ во многом напоминают таковую у предыдущего возраста. Анализ показывает, что в спектре ЭКоГ 30-дневных крольчат медленные волны занимают 26.9% спектра. В медленном спектре δ- и θ-волны представлены неравномерно, с некоторым преобладанием последних. Индекс δ- и θ-активности, соответственно, равен 12.2 ± 1.8 и 14.7 ± 1.5%. В быстром спектре меньше всех представлены волны α-диапазона – 15.1 ± 1.7%. Спектральный индекс β2‑волн ровно в два раза превышает таковой β1-волн, они, соответственно, занимают 38.4 ± 4.1 и 19.6 ± 2.1% спектра ЭКоГ (рис. 3, 4).
Рис. 3.
ЭКоГ слуховой коры 30-дневных крольчат: a – контроль, b – после гипоксии в зародышевый (E1–8), c – предплодный (E8–18) и d – плодный периоды эмбриогенеза (E18–28). Калибровка: 100 мкВ, 1 с.
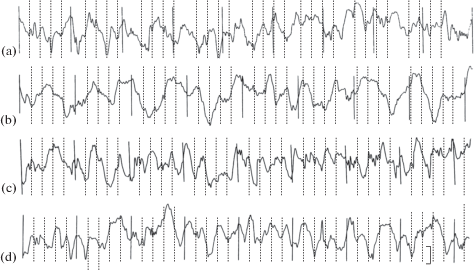
Рис. 4.
Спектральный состав ЭКоГ слуховой коры 30-дневных крольчат: a – контроль (n = 17), b – после гипоксии в зародышевый (E1–8, n = 14), c – предплодный (E8–18, n = 15) и d – плодный период эмбриогенеза (E18–28, n = 16). * – (p < 0.05), ** – (p < 0.01).
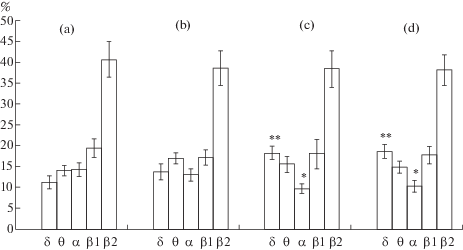
У крольчат этого возраста, перенесших кислородное голодание в зародышевый период эмбриогенеза, спектральный состав несколько отклоняется от нормы. Прежде всего происходит сдвиг в соотношении медленных и быстрых волн в спектре в сторону первых. Выраженность медленных волн на 15% больше, чем в контроле, и они занимают 31.1% спектра. Увеличение индекса медленных волн связано как с δ-, так и θ-активностью. Как и в норме, в спектре θ-активность представлена чуть больше, чем δ-активность. Незначительно изменяется индекс волн быстрого спектра, удельный вес волн α- и β2-диапазона меньше, а β1-диапазона больше, чем в норме.
Анализ спектрального состава фоновой активности слуховой коры 30-дневных крольчат после перенесенного кислородного голодания в предплодный период внутриутробной жизни показал, что суммарное количество медленных δ- и θ‑волн, по сравнению с контролем, увеличивается на 27% (p < 0.05) и равняется 34.2%. Увеличение активности медленных колебаний происходит за счет δ-волн (p < 0.01), а выраженность θ-волн почти не меняется. Тем самым δ-частота становится доминирующей в медленном спектре. На 50% ослабляется α-активность (p < 0.05), изменение показателей остальных быстрых волн менее заметное. Индекс активности β1 – уменьшается, β2-волн – увеличивается (рис. 3, 4).
ЭКоГ 30-дневных крольчат после кислородного голодания в плодный период пренатальной жизни также отличается сильно измененными спектральными показателями. В спектре удельный вес медленных волн достоверно возрастает до 38.4% (p < 0.05) (повышение на 42.5% по сравнению с контролем). Усиление выраженности медленного спектра связано как с δ-, так и θ-волнами. При этом в медленном спектре преобладает δ-активность, прирост которой, по сравнению с θ-активностью, в два раза больше (p < 0.01). Одновременно в спектре уменьшается количество всех быстрых волн. Больше всех – примерно на 30% – изменяется количество волн α-диапазона (p < < 0.05). Менее выражено ослабление β1- и β2-активности (рис 3, 4).
У 30-дневных крольчат спектральные показатели ЭКоГ слуховой коры после кислородного голодания в предплодный и плодный периоды пренатального развития, по сравнению с зародышевым периодом, больше отклоняются от нормы. Соответственно в трех экспериментальных группах медленные волны спектра увеличиваются на 15, 27 и 42.5%. В последних экспериментальных группах удельный вес медленного спектра ЭКоГ, соответственно, составляет 34.2 и 38.4%. Однако, различия между ними являются статистически не достоверными.
Обобщая вышеизложенные данные, можно заключить, что гипоксия в зародышевый, предплодный и плодный периоды пренатального развития по-разному влияет на формирование спектра ЭКоГ слуховой коры крольчат. Эти различия в основном выражаются степенью увеличения количества медленных волн в электрической активности.
В спектре ЭКоГ слуховой коры 20- и 30-дневных крольчат, имеющих почти идентичный состав, недостаток кислорода в зародышевый период пренатального развития приводит к минимальным изменениям, в то время как гипоксия на более поздних сроках эмбриогенеза приводит к более заметным и почти одинаковым изменениям спектральных показателей ЭКоГ.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для понимания влияния гипоксии на электрическую активность коры головного мозга в пренатальном онтогенезе необходимо рассмотреть основные этапы ее развития в течение данного периода. Нервная трубка у кролика формируется на 9-й день [16], а корковая пластина на 12–14-е дни или 16-й день внутриутробной жизни [17]. По всему неокортексу нейроны появляются с 15-го дня [18]. С 18–19-го дня начинается стратификация коры мозга, и на 20-й день на ней ясно выделяются 2 комплекса слоев – верхний более густонаселенный и нижний – бедный элементами [17, 20]. На 22-й день внутриутробной жизни в неокортексе формируется зачаток II–IV слоев [20], и появляются первые афференты [21]. С этого периода начинается интенсивная дифференцировка нейронов неокортекса [22]. На 24–25 день пренатальной жизни в неокортексе, в основном, заканчивается процесс нейрогенеза [19, 23]. Одновременно нижние корковые слои приобретают четкие границы [17, 23]. К концу пренатальной жизни большинство нейронов нижних слоев коры мозга дифференцируются [17, 24]. К моменту рождения неокортекс кролика характеризуется ясно различимыми слоями, с дифференцированными нейронами, развитым нейропилем, сформированными афферентными и эфферентными связями и представляет собой высокодифференцированную и дееспособную структуру [17, 24, 25].
В наших предыдущих работах подобные исследования проводились на 28-дневных плодах кролика и 10-дневных крольчатах [26]. На основании этих, а также представленных в настоящей статье данных можно определить возрастные особенности изменений ЭКоГ слуховой коры крольчат после гипоксии в разные периоды внутриутробной жизни. У 28-дневных плодов кролика и 10-дневных крольчат гипоксия в предплодный и плодный периоды эмбриогенеза приводит к более выраженным и почти одинаковым изменениям спектрального состава суммарной активности по сравнению с гипоксией в зародышевый период. Исходя из этих данных, можно предположить, что нервные структуры, генерирующие электрическую активность слуховой коры кролика в последние два периода внутриутробной жизни, проявляют более высокую чувствительность к недостатку кислорода.
Сравнительный анализ также показывает, что до 20-го дня постнатальной жизни во всех экспериментальных группах чем старше возраст животных, тем сильнее спектральные показатели ЭКоГ у гипоксических животных отличаются от контроля.
На основании исследований, проведенных на контрольных животных разного возраста, также можно установить закономерности формирования фоновой активности слуховой коры кролика в онтогенезе. Спектральные показатели слуховой коры формируются уже к 10-му дню постнатальной жизни, и по мере дальнейшего развития они почти не изменяются. У кролика подкорковые структуры в начале постнатального онтогенеза почти завершают свое развитие [17]. По мнению большинства авторов, к концу 1-го месяца жизни цитоархитектоническое развитие коры мозга кролика заканчивается [17, 27], плотность синапсов становится почти дефинитивной [28]. В коре мозга миелинизируется значительная часть нервных волокон [29]. На основании этих данных можно утверждать, что к этому периоду нервная система кролика в общих чертах формируется. Следовательно, спектр фоновой активности слуховой коры становится дефинитивным еще до завершения формирования нервной системы.
В последние годы обнаружено, что в течение эмбриогенеза чувствительность к гипоксии коры мозга, подкоркового белого и серого вещества мозга и ряда других структур нервной системы изменяется [6, 30, 31]. Учитывая роль подкоркового белого и серого вещества мозга в генезе ЭЭГ [32, 33], можно предположить, что кислородная недостаточность в разные периоды эмбриогенеза по-разному влияет на морфофункциональное состояние не только коры, но и подкорковых структур мозга, что выражается в различиях спектральных характеристик ЭКоГ, регистрируемых в разные периоды постнатального развития.
Гипоксия в относительно ранние периоды эмбриональной жизни приводит к существенным изменениям в коре мозга и подкорковом белом веществе в постнатальный период [6, 31]. Этот период для коры мозга является критическим, так как в это время закладываются ее базисные элементы [6]. Основной причиной высокой восприимчивости подкоркового белого вещества к гипоксии является появление предшественников олигодендроцитов [31, 34].
К концу эмбриональной жизни эти структуры приобретают относительную устойчивость к недостатку кислорода, а подкорковое серое вещество, наоборот, становится восприимчивым к ее действию [6, 30, 31]. У эмбриона человека этот период охватывает последний триместр беременности [30].
Увеличение чувствительности серого вещества, а точнее подкорковых ядер, к гипоксии к концу эмбриогенеза связывают с нехваткой энергии из-за усиления их активности [35]. Однако в исследованиях, проведенных на плодах овцы, обнаружено, что в позднем эмбриогенезе, по сравнению с его ранними периодами, с ослаблением способности к поддержанию кровяного давления и мембранных функций нейронов, подкорковые ядра становятся более восприимчивыми к гипоксии [36].
Известно, что в раннем эмбриогенезе выделяют два критических периода, когда развивающийся организм наиболее восприимчив к неблагоприятным воздействиям. Первый, предшествующий имплантации, и второй – формированию зачатков органов, когда неблагоприятные факторы могут способствовать возникновению различных пороков [37]. У кролика эти критические периоды почти соответствуют зародышевому периоду внутриутробной жизни [16]. Тем не менее в наших исследованиях в нервной системе крольчат наблюдаются менее выраженные изменения, вызванные кислородным голоданием в зародышевый период эмбриогенеза. Возможно, относительная устойчивость развивающейся нервной системы к дефициту кислорода в течение зародышевого периода пренатальной жизни связана с более низкими потребностями в кислороде делящихся клеток эмбриона в указанный период [38].
Предполагается, что гибель нейронов при кислородном голодании также опосредована их синаптической активностью. В исследованиях, проведенных в культуре гиппокампальных нейронов, аноксия, вызванная цианидом, не влияет на недифференцированные нейроны, а дифференцированные погибают [39]. Показано, что в коре мозга гибель ГАМК-ергических нейронов в свою очередь вызывает гибель нейронов, связанных с ними посредством синаптической передачи [40]. Следовательно, нельзя исключать, что в ранние периоды эмбриогенеза отсутствие синаптических связей у нейронов является одной из причин их относительной устойчивости к воздействию гипоксии.
У кролика предплодный период эмбриональной жизни характеризуется интенсивными процессами органогенеза [16]. Нарушение этих процессов под воздействием гипоксии, несомненно, отражается в структурах нервной системы. В указанный период кора мозга и подкорковое белое вещество проявляют высокую чувствительность к нехватке кислорода [30, 31]. Можно предположить, что эти структурные нарушения являются основными причинами сильного изменения ЭКоГ под влиянием гипоксии в течение предплодного периода внутриутробной жизни.
Несмотря на то что к концу эмбриональной жизни наблюдается снижение восприимчивости коры мозга и подкоркового белого вещества к недостатку кислорода [6, 30, 31], а также формируются защитные антигипоксические реакции головного мозга [41], в наших исследованиях электрическая активность слуховой коры резко реагирует на гипоксию в поздние периоды эмбриогенеза. Возможно, это связано с тем, что в начале плодного периода пренатальной жизни кролика этот участок коры мозга и подкорковое белое вещество все еще сохраняют высокую чувствительность к гипоксии [6, 30, 31]. Также в исследованиях, проведенных на кроликах, обнаружено, что с появлением новых предшественников олигодендроцитов подкорковое белое вещество мозга к концу эмбриональной жизни снова может приобретать восприимчивость к гипоксии [31]. Повреждение серого вещества подкорковых структур мозга при дефиците кислорода в плодный период пренатальной жизни также может играть существенную роль в изменении спектра ЭКоГ. Высокую чувствительность нервной системы к гипоксии в плодный период эмбриогенеза также можно объяснить усилением ее функциональной активности, что приводит к завышенным энергетическим затратам.
Поведенческие исследования также указывают на то, что кислородная недостаточность в конце внутриутробной жизни вызывает сильные функциональные нарушения в нервной системе. Показано, что у крыс воздействие гипоксии в период преимущественной генерации и миграции нейробластов (Е14) является значимым как для физиологического развития и становления двигательного поведения животных, так и для реализации когнитивных функций мозга. В то время как к концу эмбриональной жизни период когда в мозге преобладают процессы созревания и дифференцировки (Е18), является более важным для осуществления когнитивных функций. [42].
Как уже было упомянуто, до 20-го дня постнатальной жизни во всех экспериментальных группах, с возрастом изменения электрической активности слуховой коры крольчат становятся более выраженными. Несомненно, эти изменения отражают отсроченные морфофункциональные изменения в нервной системе как в коре мозга, так и в других структурах, играющих роль в генерации суммарной корковой активности.
Известно, что нервная система способна к восстановлению после гипоксических повреждений. Breen и соавт. предполагают, что в пренатальном периоде эта способность выше, чем в зрелом мозге [43]. Чем раньше произведена гипоксия, или же чем старше возраст анализируемого животного, тем больше времени отведено для восстановления нервной системы. Однако с появлением отсроченных морфофункциональных изменений однозначно оценить роль восстановительных процессов в нервной системе в изменениях электрической активности коры мозга пока не представляется возможным.
Ввиду того, что в настоящее время о генезе волн спектра ЭЭГ известно недостаточно, выявление точных механизмов его изменения под воздействием гипоксии, в частности, усиление выраженности медленных волн, не представляется возможным.
По мнению Steriade, Amzica и соавт. , как медленные, так и быстрые волны ЭЭГ генерируются единой таламокортикальной системой [44, 45]. Другие же считают, что только быстрые волны ЭЭГ отражают активацию коры мозга таламусом. Генез медленных δ- и θ-волн связывается с активацией коры мозга глубинными подкорковыми структурами и лимбической системой, соответственно [46, 47]. Предполагается также, что волны дельта-диапазона формируются благодаря синхронной активности коры мозга и подкорковых структур [48]. Следовательно, увеличение медленных волн в спектре под влиянием гипоксии, соответственно, можно объяснить изменениями в таламокортикальной системе, или подкорковых структурах и лимбической системе, или же одновременно в высших и подкорковых структурах мозга.
Для понимания механизмов влияния гипоксии на ЭЭГ прежде всего необходимо выяснение ее нейрональных механизмов. В настоящее время об этих механизмах известно очень мало и не во всех случаях можно обнаружить корреляцию между импульсной активностью корковых нейронов и характером ЭЭГ.
Существует мнение, что при ослаблении импульсной активности корковых нейронов усиливается выраженность медленных волн в ЭЭГ [49, 50]. Результаты многих исследований подтверждают это предположение. У крыс при гипоксии начальная активация ЭЭГ по времени совпадает с усилением фоновой импульсации корковых нейронов, и по мере ее подавления увеличивается выраженность медленных волн [51]. При постсинаптической депрессии импульсной активности корковых нейронов редуцируются высокие частоты спектра ЭЭГ [52]. Обнаружено, что при активации таламокортикальных нейронов в результате деполяризации их мембраны в ЭЭГ генерируются более высокие частоты [53]. На основании этих данных можно предположить, что увеличение количества медленных волн в ЭЭГ при гипоксии связано с ослаблением импульсной активности корковых нейронов, и наоборот [54].
Возможно, в условиях кислородной недостаточности ослабление разрядной активности корковых нейронов в результате их истощения или повреждения является одной из основных причин усиления выраженности медленных волн в спектре ЭЭГ. У плодов овцы исчезновение высокочастотных волн в ЭЭГ при асфиксии ассоциируется с острым повреждением корковых нейронов [55].
Под влиянием гипоксии мембрана у большинства нейронов деполяризируется [56–58], у других, в том числе и центральных – гиперполяризируется [50, 56, 57]. Эти изменения, соответственно, приводят к усилению [56–58] или ослаблению вплоть до полного исчезновения импульсной активности нейронов [50, 56, 57]. При этом надо учитывать, что эти исследования, в основном, проведены in vitro.
Существует мнение, что обменные процессы в нейронах играют значительную роль в генезе суммарной активности коры мозга или вовсе определяют ее характер [59–61]. Обнаружено, что ослабление обмена веществ в коре мозга приводит к появлению в ЭЭГ медленных ритмов [60]. Несмотря на то что роль биохимических процессов в происхождении ЭЭГ окончательно не выяснена, нельзя исключить их влияние на электрическую активность коры мозга при нехватке кислорода.
При гипоксии обычно работа сердца независимо от возраста ослабляется и при этом церебральное кровообращение усиливается. Однако это не компенсирует недостаток кислорода [62, 63]. В результате отмечается нарушение обмена веществ в нервной системе. Существует точка зрения, что ослабление работы сердца приводит к увеличению выраженности низкокочастотных волн ЭЭГ, и наоборот [64, 65]. Однако подобную связь не обнаруживают [66, 67]. По мнению Hellström-Westas и Rosén, изменения в сердечно-сосудистой системе при гипоксии отражаются на показателях ЭЭГ только у взрослых [64].
Предположительно спектральные изменения в ЭЭГ под воздействием гипоксии могут быть связаны с ее повреждающим и неповреждающим действием на нервную систему. У новорожденных детей, перенесших нехватку кислорода, структурные изменения в нервной системе обнаруживаются и в том случае, когда ЭЭГ остается нормальной [68]. На основании этих данных нельзя исключить роль гипоксического повреждения нервных структур в каких-либо заметных изменениях суммарной электрической активности коры мозга. Вполне возможно, что в спектральных показателях ЭЭГ отражаются не только морфофункциональные изменения в коре мозга и других структурах нервной системы, но и в уровне обмена веществ которой в значительной мере связана с работой сердечно-сосудистой системы. Можно предположить, что если эти изменения в ЭЭГ при регистрации непосредственно после воздействия гипоксии обратимы, то при отсроченной регистрации – необратимы.
При кислородном голодании, как обычно, в ЭЭГ усиливается выраженность медленных волн, что предположительно связано с подавлением разрядной деятельности корковых нейронов. В результате проведенного анализа предполагается, что эти изменения носят не случайный, а целенаправленный характер. В условиях гипоксии генерация ЭЭГ регулируется модулирующими и пейсмекерными нейронами, а также активацией эндогенных механизмов самих корковых нейронов. Модулирующие и пейсмекерные нейроны, в основном управляемые внутриклеточными механизмами, формируют систему, способную воздействовать на активность нейронов коры и других структур мозга при гипоксии. Нейроны, как возбуждающие, так и тормозные, формирующие систему, расположены во всех отделах нервной системы, но в основном сосредоточены в ее центре – в филогенетически древних подкорковых структурах. Восходящими и нисходящими прямыми или опосредованными путями они имеют связи со всеми структурами нервной системы, начиная от центра до периферии [54].
Это предположение основывается на следующих данных. Известно, что внутриклеточные механизмы способны существенно влиять или же контролировать генерацию нейронами нервного импульса [69, 70] и их ритмическую активность [69, 71, 72]. Тем самым они могут играть значительную роль в генерации разных волн и ритмов ЭЭГ [69, 70].
Внутриклеточные механизмы электрическую активность нейронов регулируют также при нехватке кислорода [50, 73, 74]. Обнаружено, что изменение проводимости мембранных каналов нейронов может наступать сразу же после воздействия гипоксии, когда еще не нарушено их энергетическое обеспечение [73, 74]. При аноксии у нейронов блуждающего нерва активация К+-каналов мембраны не зависит от уровня АТФ [50]. На основании этих данных можно предположить, что сдвиг в мембранном потенциале нейрона, в частности, ее гиперполяризация при кислородном голодании также может наступать под влиянием внутриклеточных механизмов.
Известно, что некоторые корковые нейроны, по сравнению с другими, играют более значительную роль в генезе ЭЭГ [75, 76]. В коре мозга крысы небольшое количество нейронов обеспечивает появление θ-ритма, веретен и волн arousal и сильно влияет на остроту ЭЭГ [75]. Благодаря активности принципиальных нейронов коры мозга, объединенных посредством аксональных щелевых контактов, генерируются очень быстрые осцилляции ЭЭГ [76].
Предполагается, что гипотетические пейсмекерные нейроны подкорковых структур способны воздействовать на активность корковых нейронов [45, 48, 77]. Ослабление этих влияний на нейроны коры мозга при гипоксии является одной из причин дезорганизации стандартного медленного комплекса ЭЭГ [48]. Пейсмекерные нейроны также формируют нисходящие пути, которые модулируют активность сенсорных путей и рецепторов [78].
В условиях гипоксии система модулирующих и пейсмекерных нейронов регулирует активность корковых нейронов посредством синаптических контактов и несинаптических сигналов, а также активацией эндогенных механизмов нейронов. По мере развития гипоксии, благодаря воздействию этих нейронов и эндогенных механизмов, разрядная деятельность нейронов угнетается, тем самым предотвращается их повреждение или гибель. Этот процесс отражается на ЭЭГ усилением выраженности медленных волн и генерацией медленных ритмов.
Ослабление активности модулирующих и пейсмекерных нейронов подкорковых структур в результате морфофункциональных нарушений приводит к усилению возбудимости центральных нейронов, и возможно, является одним из механизмов развития патологической активности в ЭЭГ. На это указывают данные о том, что у новорожденных острота ЭЭГ ассоциируется с повреждением базальных ганглиев, таламуса, подкоркового белого вещества, internal сapsule, но только не с корой мозга [79].
Предположительно регуляция генерации ЭЭГ модулирующими и пейсмекерными нейронами осуществляется как при патологических, так и нормальных условиях. Следовательно, генерация ЭЭГ не является случайным процессом, а частично или полностью контролируется самим мозгом [54].
Список литературы
Bickler P., Hansen B. (1998) Hypoxia–tolerant neonatal CA1 neurons: relationship of survival to evoked glutamate release and glutamate receptor–mediated calcium changes in hippocampal slices. Brain Res Dev Brain Res 106 (1–2): 57–69.
Kawai S., Yonetani M., Nakamura H., Orada Y. (1989) Effects of deprivation of oxygen and glucose on the neural activity and the level of high energy phosphates in the hippocampal slices of immature and adult rat. Dev Brain res 48 (1): 11–18.
Мехтиев А.А., Ибрагимли И.Г., Гусейнов А.Г. (2015) Влияние гипоксии, проведенное в разные периоды онтогенеза на биоэлектрическую активность мозга крольчат. Известия Национальной Академии Наук Азербайджана 70: 98–103. [Mekhtiev A.A., Ibragimli I.G., Guseynov A.G. (2015) Vliyanie gipoksii provedennoe v raznye periody ontogeneza na bioelektricheskuyu aktivnost mozga krolchat. Izvestiya Natsionalnoy Akademii Nauk Azerbaydzhana 70: 98–103. (In Russ.)].
Lafemina M., Sheldon R., Ferriero D. (2006) Acute hypoxia–ischemia results in hydrogen peroxide accumulation in neonatal but not adult mouse brain. Pediatr Res 59: 680–683. https://doi.org/10.1203/01.pdr.0000214891.35363.6a
Тагиев Ш.К., Джангиров П.Л., Мамедов Х.Б. (1982) Фоновая биоэлектрическая активность мозга кроликов разных возрастных сроков. Журн высш нерв деят 32(3): 560–562. [Tagiev Sh.K., Dzhangirov P.L., Mamedov Kh.B. (1982) Fonovaya bioelektricheskaya artivnost mozga krolikov raznykh vozrastnykh srokov. Zhurn vyssh nerv. deiat 32 (3): 560–562. (In Russ.)].
Васильев Д.С., Туманова Н.Л., Журавин И.А. (2008) Структурные изменения в нервной ткани новой коры в онтогенезе крыс после гипоксии на разных сроках эмбриогенеза. Журн эвол биохим и физиол 44 (3): 258–267. [Vasilev D.S., Tumanova N.L., Zhuravin I.A. (2008) Strukturnye izmeneniya v nervnoy tkani novoi kory v ontogeneze krys posle gipoksii na raznykh srokakh embriogeneza. J evol biochem physiol 44 (3): 258–267. (In Russ.)].
Tanaka H., Amamiya S., Takahashi S., Suzuki N., Araki A., Ohinata J., Fujieda K. (2010) Effect of neonatal hypoxia on the development of intraspinal serotonergic fibers in relation to spinal motoneurons Brain Dev 32: 268–274.
Гусейнов А.Г., Мамедов Х.Б. (2012) Влияние гипоксии в разные периоды пренатального онтогенеза на электрокортикограмму плодов кролика. Рос физиол журн им ИМ Сеченова 98 (10): 1250–1257. [Guseynov A.G., Mamedov Kh.B. (2012) Vliyanie gipoksii v raznye periody prenatalnogo ontogeneza na elektrokortikogrammu plodov krolika. Russ J Physiol 98 (10): 1250–1257. (In Russ.)].
Абдулкеримова С.Л., Мамедов Х.Б., Гусейнов А.Г. (2008) Влияние пренатальной гипоксии на функциональное развитие зрительной коры крольчат. Проблемы физиологии и биохимии 26: 1–10. [Abdulkerimova S.L., Mamedov Kh.B., Guseynov A.G. (2008) Vliyaniye prenatalnoy gipoksii na funktsionalnoe razvitiye zritelnoy kory krolchat. Problemy fiziologii i biokhimii 26: 1–10. (In Russ.)].
Газиев А.Г., Рагимли В.М., Мамедов Х.Б., Абдулкеримова С.Л. (2007). Послойный анализ биоэлектрической активности зрительной коры мозга 30–ти дневных крольчат. Проблемы физиологии и биохимии 25: 145–153. [Gaziyev A.G., Ragimli V.M., Mamedov Kh.B., Abdulkerimova S.L. (2007) Posloynyi analiz bioelektricheskoi aktivnosti zritelnoi kory mozga 30–ti dnevnykh krolchat. Problemy fiziologii i biokhimii 25: 145–153. (In Russ.)].
Клявина М.П., Малышева В.В. (1979) Реакции нейронов слуховой коры в онтогенезе у кролика. Нейрональные механизмы развивающегося мозга. М. Наука. 159–171. [Klyavina M.P., Malysheva V.V. (1979) Reaktsii neyronov slukhovoi kory v ontogeneze u krolika. Neyronalnye mekhanizmy razvivayushchegosya mozga. M. Nauka 159–171. (In Russ.)].
Шмитд Г.А. (1951) Эмбриология животных. Общая эмбриология. ч 1. М. Советская наука. [Shmitd G.A. (1951) Embriologiya zhivotnykh. Obshchaya embriologiya (Embryology of animals. General embryology). ch. 1 M. Sovetskaya nauka. (In Russ.)].
Блинков С.М., Бразовская Ф.А., Пуцилло М.В. (1973) Атлас мозга кролика. М. Медицина. [Blinkov S.M., Brazovskaya F.A., Putsillo M.B. (1973) Atlas mozga krolika. M. Meditsina. (In Russ.)].
Робинер И.С. (1959) О локализации кожного анализатора в коре и зрительном бугре кролика и кошки. Развитие центральной нервной системы. М. Наука. 1959. 205–225. [Robiner I.S. (1959) O lokalizatsii kozhnogo analizatora v kore i zritelnom bugre krolika i koshki. Razvitie tsentralnoi nervnoi sistemy. M. Nauka. 205–225. (In Russ.)].
Kilkenny C., Browne W.J., Cuthill I.C., Emerson M., Altman D.G. (2010) Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLoS Biol 8: e1000412.
Дыбан А.П., Пучков В.Ф., Баранов В.С. (1975) Лабораторные млекопитающие: мышь, крыса, кролик, хомячок. Проблемы биологии развития. Объекты биологии развития. М Наука 505–566. [Dyban A.P., Puchkov V.F., Baranov V.S. (1975) Laboratornye mlekopitayushchie: mysh, krysa, khomyachok. Problemy biologii razvitiya. Obekty biologii razvitiya. (Laboratory mammals: mouse, rat, rabbit, hamster. Problems of developmental biology. Objects of developmental biology). Moscow. Nauka. 505–566. (In Russ.)].
Троицкая С.А. (1953) Пренатальный онтогенез коркового конца двигательного анализатора у кролика. Архив анат гистол и эмбриол 30 (1): 21–31. [Troitskaya S.A. (1953) Prenatalnyi ontogenez korkovogo kontsa dvigatelnogo analizatora u krolika. Arkhiv anat gistol i embroil 30 (1): 21–31 (In Russ.)].
Stensaas L.J. (1967) The bevelopment of hippocampal and dorsolateral pallial regions of the cerebral hemisphere in fetal rabbits: II. Twenty millimeter stage, neuroblast morphology. J Com Neurol 129: 71–81. https://doi.org/10.1002/cne.901290106
Fernandez V., Bravo H. (1974) Autoradiographic study of development of the cerebral cortex in the rabbit. Brain Behav a evol 9 (5): 317–333.
Пенцик А.С. (1940) Онтогенетическое развитие биоэлектрической деятельности и клеточного строения мозговой коры. Тр инст мозга М. 5: 273–293. [Pentsik A.S. (1940) Ontogeneticheskoe razvitie bioelektricheskoi deyatelnosti i kletochnogo stroeniya mozgovoi kory. Tr inst mozga M. 5: 273–293. (In Russ.)].
Белова Т.И. (1971) О закономерностях онтогенетического созревания нервной системы млекопитающих. Успехи физиол. наук 2 (2): 68–104. [Belova T.I. (1971) O zakonomernostyakh ontogeneticheskogo sozrevaniya nervnoi sistemy. Uspekhi fiziol nauk 2 (2): 68–104 (In Russ.)].
Stensaas L.J. (1967) The development of hippocampal and dorsolateral pallial regions of the cerebral hemisphere in fetal rabbits. III. Twenty–nine millimeter stage, marginal lamina. J Comp Neurol 130: 149–162.
Максимова Е.В. (1990) Онтогенез коры больших полушарий. М. Наука. [Maksimova E.V. (1990) Ontogenez kory bolshikh polusharii. M. Nauka. (In Russ.)].
Stensaas L.J. (1968) The development of hippocampal and dorsolateral pallial regions of the cerebral hemisphere in fetal rabbits. VI. Ninety millimeter stage, cortical differentiation. J Comp Neurol 132: 93–108. https://doi.org/10.1002/cne.901320105
Гусейнов А.Г. (2003) Структурная организация неокортекса кролика в пренатальном онтогенезе. Успехи физиол наук 34 (3): 64–75. [Guseynov A.G. (2003) Strukturnaya organizatsiya neokorteksa krolika v prenatalnom ontogeneze. Uspekhi fiziol nauk 34 (3): 64–75. (In Russ.)].
Гусейнов А.Г. (2018) Влияние гипоксии на электрическую активность мозга крольчат разного возраста. Труды института зоологии 36 (1): 143–152. [Guseynov A.G. (2018) Vliyanie gipoksii na elektricheskuyu aktivnost mozga krolchat raznogo vozrasta. Trudy instituta zoologii 36 (1): 143–152. (In Russ.)].
Окс С. (1969) Основы нейрофизиологии. М. Мир. 1969. [Ochs S. (1965) Elements of neurophysiology. Sidney Hardcover].
Vrensen G., De Groot D. (1978) Neuronal and synaptic development in the cerebral cortex of the rabbits. Biological aspects of learning, memory formation and ontogeny of the CNS 1 (5): 383–391.
Дмитриева Н.И. (1965) Миелинизация центрального слухового пути в постнатальном онтогенезе у кролика. Журн эвол биох и физиол 1 (5): 159–165. [Dmitrieva N.I. (1965) Mielinizatsiya tsentralnogo slukhovogo puti v postnatalnom ontogeneze u krolika. Zh Evol Biokhim Fiziol.1 (5): 159–165. (In Russ.)].
Johnston M. (2001) Excitotoxicity in neonatal hypoxia. Mental retardation and developmental disabilities research reviews 7: 229–234. https://doi.org/10.1002/mrdd.1032
Buser J., Segovia K., Dean J., Nelson K., Beardsley D., Xi Gong, Ning Ling Luo, Ren J., Ying Wan, Riddle A., McClure M.M. (2010) Timing of appearance of late oligodendrocyte progenitors coincides with enhanced susceptibility of preterm rabbit cerebral white matter to hypoxia–ischemia J Cereb Blood Flow Metab 30: 1053–1065. https://doi.org/10.1038/jcbfm.2009.286
Babiloni C., Frisoni G., Steriade M., Bresciani L., Binetti G., Del Percio C., Geroldi C., Miniussi C., Nobili F., Rodriguez G., Zappasodi F., Carfagna T., Rossini P. (2006) Frontal white matter volume and delta EEG sources negatively correlate in awake subjects with mild cognitive impairment and Alzheimer’s disease. Clin Neurophysiol 117: 1113–1129. https://doi.org/10.1016/j.clinph.2006.01.020
Hellstróm-Westas L., Rosen I. (2005) Electroencephalography and brain damage in preterm infants. Early Human Dev 81: 255–261. https://doi.org/10.1016/j.earlhumdev.2005.01.006
Riddle A., Luo N., Manese M., Beardsley D., Green L., Rorvik D., Kelly K., Barlow C., Kelly J., Hohimer A., Back S. (2006) Spatial heterogeneity in oligodendrocyte lineage maturation and not cerebral blood flow predicts fetal ovine periventricular white matter injury. J. Neurosci Neuroscience 26: 3045–3055.
Billiards S., Pierson C., Haynes R., Folkerth D., Kinney C. (2006) Is the late preterm infant more vulnerable to gray matter injury than the term infant? Clin Perinatol 33: 915–933. https://doi.org/10.1016/j.clp.2006.10.003
Mallard E., Williams C., Johnston B., Gluckman P. (1994) Increased vulnerability to neuronal damage after umbilical cord occlusion in fetal sheep with advancing gestation. Am J Obstet Gynecol 170: 206–214.
Светлов П.Г. (1978) Физиология (механика) развития. т. 1. Процессы морфогенеза на клеточном и организменном уровне. Л. Наука. [Svetlov P.G. (1978) Fiziologiya (mekhanika) razvitiya t. 1. Protsessy morfogeneza na kletochnom i organizmennom urovne. (Physiology (mechanics) of development. vol. 1. The processes of morphogenesis at the cellular and organismal level). L. Nauka. (In Russ.)].
Webster W., Abela D. (2007) The effect of hypoxia in development. Birth Defects Res. C Embryo Today 81: 215–228.https://doi.org/10.1002/bdrc.20102
Rothman S. (1983) Synaptic activity mediates death of hypoxic neurons. Science 220:536–537.https://doi.org/10.1126/science.6836300
Gerstein M., Huleihel M., Mane R., Stilman M., Ka-shtuzk I., Hallak M., Golan H. (2005) Remodeling of hippocampal GABAergic system in adult offspring after maternal hypoxia and magnesium sulfate load: Immunohistochemical study. Exp Neurol 196(1):18–29.
Отеллин В.А., Коржевский Д.Э., Неокесарийский А.А., Григорьев И.П., Гилерович Е.Г., Косткин В.Б., Хожай Л.К. (2004) Последствия пренатального воздействия гипоксии на развивающийся мозг. Медицинский академический журнал 4: 38–45. [OItellin V.A., Korzhevskii D.E., Neokesariiskii A.A., Grigoryev I.P., Gilerovich E.G., Kostkin V.B., Khozhai L.K. (2004) Posledstviya prenatalnogo vozdeystviya gipoksii na razvivayushchiisya mozg. Meditsinskii akademicheskii zhurnal 4: 38–45. (In Russ.)].
Дубровская Н.М., Журавин И.А. (2008) Онтогенетические особенности поведения крыс, перенесших гипоксию на 14-е или 18-е сутки эмбриогенеза. Журн высш нервн деят 58 (6): 718–727. 2008. [Dubrovskaya N.M., Zhuravin I.A. (2008) Ontogeneticheskie osobennosti krys, perenesshikh gipoksiyu na 14–e ili 18‑e sutki embriogeneza. Zh. Vyssh. Nervn. Deyat 58 (6): 718–727. (In Russ.)]..
Breen S, Rees S, Walker D (1997) Identification of brainstem neurons responding to hypoxia in fetal and newborn sheep. Brain Res 748:107–121.
Amzica F., Steriade M. (2000) Integration of low–frequency sleep oscillations in corticothalamic networks. Acta Neurobiol. Exp 60: 229–245. https://doi.org/10.1016/j.tins.2005.03.007
Steriade M. (2005) Sleep, epilepsy and thalamic reticular inhibitory neurons. Trends Neurosci 28:317–324. https://doi.org/10.1016/j.tins.2005.03.007
Robinson D. (1999) The technical, neurological and psychological significance of 'alpha', 'delta' and 'theta' waves confounded in EEG evoked potentials: a study of peak latencies. Clin Neurophysiol 110: 1427–1434.
Vinogradova O. (1995) Expression, control, and probable functional significance of the neuronal theta–rhythm. Prog Neurobiol 45: 523–583.
Ginsburg D., Pasternak E., Gurvitch A. (1977) Correlation analysis of delta activity generated in cerebral hypoxia. Clin Neurophysiol 42: 445–455.
Cobb S., Buhl E., Halasy K., Paulsen O., Somogyi P. (1995) Synchronization of neuronal activity in hippocampus by individual GABA–ergic interneurons. Nature 378: 75–78. https://doi.org/10.1038/378075a0
Müller M., Brockhaus J., Ballanyi K. (2002) ATP–independent anoxic activation of ATP–sensitive K+ channels in dorsal vagal neurons of juvenile mice in situ. Neurosci 109: 313–328.
Akopyan N., Baklavadzhyan O., Karapetyan M. (1984) Effects of acute hypoxia on the EEG and impulse activity of the neurons of various brain structures in rats. Neurosci Behav Physiol 5: 405–411. https://doi.org/10.1007/BF01184611
Urrestarazu E., Jirsch J., LeVan P., Hall J., Avoli M., Dubeau F., Gotman J. (2006) High–frequency intracerebral EEG activity (100–500 Hz) following interictal spikes. Epilepsia 47: 1465–1476.
Hughes S., Crunelli V. (2007) Just a phase they’re going through: The complex interaction of intrinsic high–threshold bursting and gap junctions in the generation of thalamic α– and θ–rhythms. Inter. J Psychophysiol 64: 3–17. https://doi.org/10.1016/j.ijpsycho.2006.08.004
Гусейнов А.Г. (2017) Механизмы влияния гипоксии на суммарную активность коры головного мозга. Рос физиол журн им ИМ Сеченова 103 (11):1209–1224. [Guseynov A.G. (2017) Mekhanizmy vliyaniya gipoksii na summarnuyu aktivnost kory golovnogo mozga. Russ J Physiol 103 (11):1209–1224. (In Russ.)].
Keogh M., Drury P., Bennet L., Davidson J., Mathai S., Gunn E., Booth L., Gunn A. (2012) Limited predictive value of early changes in EEG spectral power for neural injury after asphyxia in preterm fetal sheep. Pediatric Res 71: 345–353. https://doi.org/10.1038/pr.2011.80
Ballanyi K. (2004) Protective role of neuronal KATP channels in brain hypoxia. J Exp Biol 207: 3201–3212. https://doi.org/10.1242/jeb.01106
Krnjevic K. (1999) Early effects of hypoxia on brain cell function. Croat Med J 40:375–380.
Nolan P., Waldrop T. (1996) Ventrolateral medullary neurons show age–dependent depolarizations to hypoxia in vitro. Dev Brain Res 91: 111–120.
Majkova T., Lukashev S., Piradov M., Danilova M. (2006) Central synaptic neurotransmission: universal self–regulation theory. Lik Sprava (1–2): 12–18.
Moosmann M., Ritter P., Krastel I., Thees S., Blankenburg F., Taskin B., Obrig H., Villringer A. (2003) Correlates of alpha rhythm in function magnetic resonance imaging and near infrared spectroscopy. Neuroimage 20: 45–158.
Xiong Z., Saggau P., Stringer J. (2000) Activity–dependent intracellular acidification correlates with the duration of seizure activity. Neurosci 20: 1290–1296.
Bishai J., Blood A., Hunter C., Longo L., Power G. (2003) Fetal lamb cerebral blood flow (CBF) and oxygen tensions during hypoxia: a comparison of laser Doppler and microsphere measurements of CBF. J Physiol 546: 869–878. https://doi.org/10.1113/jphysiol.2002.025270
Blood A., Hunter C., Power G. (2003) Adenosine mediates decreased cerebral metabolic rate and increased cerebral blood flow during acute moderate hypoxia in the near–term fetal sheep. J Physiol 553: 935–945. https://doi.org/10.1113/jphysiol.2003.047928
Hellström-Westas L., Rosén I. (2005) Electroencephalography and brain damage in preterm infants. Early Human Dev 81: 255–261. https://doi.org/10.1016/j.earlhumdev.2005.01.006
Kilner J., Mattout J., Henson R., Friston K. (2005) Hemodynamic correlates of EEG: A heuristic. Neuroimage 28: 280–286. https://doi.org/10.1016/j.neuroimage.2005.06.008
Lindauer U., Gethmann J., Kühla M., Kohl-Bareis M., Dirnag U. (2003) Neuronal activity–induced changes of local cerebral microvascular blood oxygenation in the rat: effect of systemic hyperoxia or hypoxia. Brain Res 975: 135–140.
van de Bor M., Meinesz J., Benders M., Steendijk P., Cardozo R., van Bel F. (1999) Electrocortical brain activity during hypoxia and hypotension in anesthetized newborn lambs. Early Human Dev 55: 237–245.
Foran A., Cinnante C., Groves A., Azzopardi D., Rutherford M., Cowan F. (2009) Patterns of brain injury and outcome in term neonates presenting with postnatal collapse. Arch Dis Child Fetal Neonatal Ed 94 (3): 168–77. https://doi.org/10.1136/adc.2008.140301
Jun Lian, Jianwei Shuai, Durand D (2004) Control of phase synchronization of neuronal activity in the rat hippocampus. J Neural Eng 1: 46–54.
Lytton W., Destexhe A., Sejnowski T. (1996) Control of slow oscillations in the thalamocortical neuron: a computer model. Neurosci 70: 673–684.
Karameh F., Dahleh M., Brown E., Massaquoi S. (2006) Modeling the contribution of lamina 5 neuronal and network dynamics to low frequency EEG phenomena. Biol Cybern 95: 289–310.
Ros T., Munneke M., Ruge D., Gruzelier J., Rothwell J. (2010) Endogenous control of waking brain rhythms induces neuroplasticity in humans. Eur J Neurosci 31: 770–778. https://doi.org/10.1111/j.1460-9568.2010.07100.x
Fujimura N., Tanaka E., Yamamoto S., Shigemori M., Higashi H. (1997) Contribution of ATP–sensitive potassium channels to hypoxic hyperpolarization in rat hippocampal CA1 neurons in vitro. J Neurophysiol 77: 378–385. https://doi.org/10.1152/jn.1997.77.1.378
Jiang C., Haddad G. (1993) Short periods of hypoxia activate a K+ current in central neurons. Brain Res 614: 352–356. https://doi.org/10.1016/0006-8993(93)91055-w
Kitazoe Y., Hiraoka N., Ueta H., Ogura H., Yamamoto K., Seto K., Saito H. (1983) Theoretical analysis on relationship between the neural activity and the EEG. J Theoret Biol 104: 667–683.
Traub R., Whittington M., Buhl E., Le Beau F., Bibbig A., Boyd S., Cross H., Baldeweg T. (2001) A possible role for gap junctions in generation of very fast EEG oscillations preceding the onset of, and perhaps initiating, seizures. Epilepsia 42 (2): 153–170.
Thomas E., Wyatt R. (1995) A computational model of spindle oscillations. Mathematics and Computers in Simulation 40:35–69.
Dubner R., Ren K. (1999) Endogenous mechanisms of sensory modulation. Pain 82:45–53. 1999. https://doi.org/10.1016/S0304-3959(99)00137-2
Briatore E., Ferrari F., Pomero G., Boghi A., Gozzoli L., Micciolo R., Espa G., Calzolari S. (2013) EEG findings in cooled asphyxiated newborns and correlation with site and severity of brain damage. Brain Dev 35: 420–426. https://doi.org/10.1016/j.pedneo.2018.03.010
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


