Журнал эволюционной биохимии и физиологии, 2021, T. 57, № 6, стр. 500-509
ЭЛЕКТРИЧЕСКАЯ АКТИВНОСТЬ ИДЕНТИФИЦИРОВАННЫХ НЕЙРОНОВ ЦНС МОЛЛЮСКА LYMNAEA STAGNALIS В УСЛОВИЯХ ОСТРОЙ ГИПЕРГЛИКЕМИИ
А. В. Сидоров 1, *, В. Н. Шаденко 1, 2
1 Белорусский государственный университет
Минск, Беларусь
2 Республиканский научно-практический центр психического здоровья
Минск, Беларусь
* E-mail: sidorov@bsu.by
Поступила в редакцию 20.07.2021
После доработки 20.08.2021
Принята к публикации 25.08.2021
Аннотация
Изучены быстрые реакции ключевых интернейронов в составе дыхательной (RPeD1), локомоторной (LPeD1) и кардиорегуляторной (VD1/RPaD2) сетей центральных нервных ганглиев моллюска Lymnaea stagnalis при действии D-глюкозы (1 и 10 мМ). В условиях выраженной гипергликемии (10 мМ) отмечены усиление частоты импульсации VD1/RPaD2 и ее снижение в отношении LPeD1, наблюдаемые уже на первой минуте после воздействия, при неизменности указанного показателя для RPeD1. Добавление в среду инкубации глюкозы в меньших концентрациях (1 мМ) не приводит к статистически достоверным изменениям показателей электрической активности для всех исследованных нейронов. Наблюдаемые эффекты не связаны в возрастанием содержания активных форм кислорода (АФК) в цитоплазме, поскольку использование флуоресцентного зонда (2',7'-дихлородигидрофлуоресцеин диацетата) не выявило их накопление в суспензии клеток нервных ганглиев в ответ на действие глюкозы (10 мМ) в краткосрочном (5 мин) периоде по сравнению с контрольными условиями. Анализ формы потенциала действия в условиях гипергликемии (глюкоза, 10 мМ), для высокочувствительных к действию глюкозы нейронов (VD1/RPaD2), выявил возрастание скорости деполяризации мембраны для достижения порогового потенциала на фоне неизменности других фаз спайка. Предполагается, что эффекты глюкозы в отношении частотных характеристик исследованных центральных нейронов Lymnaea обусловлены модификацией (интенсификацией) работы электрогенного Na+-глюкозного котранспортера и зависят от функциональной принадлежности клеток.
ВВЕДЕНИЕ
Способность к детектированию содержания глюкозы в окружающем клетку пространстве является характерным свойствам целого ряда центральных нейронов позвоночных [1, 2] и беспозвоночных [3, 4] животных. Наличие таких структур обеспечивает эффективную работу функциональной системы, направленную на поддержание постоянного уровня глюкозы во внутренней среде организма [5], что в целом характерно для позвоночных, и/или инициирует определенные поведенческие ответы, преимущественно связанные с пищедобычей, как это отмечено для ряда беспозвоночных, включая моллюсков [4]. В этой связи глюкозу можно рассматривать в качестве сигнальной молекулы, диффузно распространяющейся во внутренней среде организма (кровь/гемолимфа, интерстициальная жидкость) и обеспечивающей неспецифические экстрасинаптические эффекты в отношении целого комплекса нервных клеток, как это характерно для факторов объемной передачи сигнала [6]. Однако неясно, будет ли действие глюкозы в отношении различных, исходно неспециализированных для ее рецепции нейронов в составе разных нейронных сетей ЦНС, универсальным, т.е. всегда однонаправленным (например, деполяризация и усиление импульсации при гипергликемии) или следует ожидать разнонаправленный характер реакции, в зависимости, например, от функциональной принадлежности или нейромедиаторной специфичности нервной клетки.
В центральных нервных ганглиях моллюска Lymnaea stagnalis насчитывается ряд крупных (диаметр сомы ~100 мкм) идентифицированных нейронов, отличающихся друг от друга как в функциональном (входят в состав нейронных сетей вовлеченных в регуляцию разных форм поведения), так и химическом (содержат разные нейромедиаторы) плане, что делает данный организм одним из модельных объектов в нейробиологических исследованиях [7]. Чувствительные к глюкозе центральные нейроны Lymnaea сосредоточены преимущественно в пределах буккальных ганглиев, нейронные сети которых определяют работу центрального генератора пищевого ритма и пищедобычу в целом [8, 9]. Изоляция этих нервных узлов от центрального кольца ганглиев представляет собой элементарную методическую процедуру (перерезка церебробуккальной коннективы). В свою очередь это позволяет оценить ответы клеток, не входящих в состав пищевой нейронной сети, на действие метаболических сигналов, практически в “чистом” виде (ряд модуляторных нейронов пищевой сети, например, гигантские клетки церебральных узлов (cerebral giant cells, CGC) входят в состав центрального кольца ганглиев).
Различные эффекты глюкозы в отношении нервных клеток могут быть реализованы за счет возрастания внутриклеточной концентрации активных форм кислорода (АФК) как следствие интенсификации процессов окислительного фосфорилирования в электронтранспортной цепи митохондрий [10] в ответ на увеличения уровня сахаров, т.е. энергетических субстратов в цитоплазме нейронов. Концентрация глюкозы в гемолимфе Lymnaea, в зависимости от степени выраженности пищевой доминанты, может возрастать многократно – с исходных 57 (голодные особи) до 760 (сытые особи) мг/мл [11]. С другой стороны, умеренная по длительности (часы) гипергликемия, сопровождаемая последующей нормализацией глюкозного гомеостаза, равно как и другие стрессовые воздействия, например, голодание, приводят к изменению антиоксидантного статуса нервной ткани [12], а модуляторное действие АФК в отношении идентифицированных нейронов как пищевой, так и кардиореспираторной [13, 14] нейронных сетей Lymnaea stagnalis хорошо известно. Тем не менее возможность внутриклеточного (внутринейронного) накопления АФК уже в течение первых минут после увеличения концентрации глюкозы в интерстиции, что может лежать в основе быстрых (минуты) нейротропных эффектов глюкозы, остается невыясненной.
Отмеченное выше и определило цель данной работы, заключающуюся в оценке быстрых эффектов возрастания уровня глюкозы во внеклеточном пространстве на показатели электрической активности функционально различных, непищевых нейронов ЦНС Lymnaea stagnalis, выяснение возможного механизма их обусловливающих.
МЕТОДЫ ИССЛЕДОВАНИЯ
Животные. Моллюски, прудовик обыкновенный (Lymnaea stagnalis L.), были собраны в мелких проточных водоемах (мелиоративные и водоотводные каналы). В лаборатории их содержали в аквариумах, на каждую особь приходилось не менее 1 л воды, при температуре 20 ± 1°С. Смену воды проводили каждую неделю. Пищей служили листья салата (питание ad libitum). В экспериментах использовали животных одинакового размерного класса – высота раковины 3.5 ± 0.4 см, масса – 3.5 ± 0.5 г.
Электрофизиология. Спонтанную электрическую активность идентифицированных нейронов оценивали в составе препарата изолированной ЦНС (кольцо центральных ганглиев, без буккальных узлов). Для размягчения периневральной оболочки и облегченного проникновения микроэлектродов в нейроны препараты предварительно обрабатывали раствором проназы (Protease E, type XIV, Sigma, США) – 1 мг/мл в течение 5 мин при 20°С. Электрическую активность нейронов регистрировали после промывки обработанного препарата свежим физиологическим раствором в течение 30 мин. Препараты ЦНС помещали в нормальный физиологический раствор Рингера (концентрация указана в ммолях): NaCl – 44.0; KCl – 1.7; CaCl2 – 4.0; MgCl2 ⋅ 6 H2O – 1.5; HEPES – 10.0, pH 7.6 ± 0.03. Внутриклеточную регистрацию электрических параметров нейронов осуществляли с помощью Ag/AgCl-электродов, используя усилитель МС-01М (Линтех, Беларусь). Микропипетки заполняли 2.5 молярным раствором KCl (сопротивление микроэлектрода 10–20 МΩ). В качестве индифферентного электрода использовали хлорированную серебряную проволоку.
Для каждого препарата (нейрона) осуществляли запись электрической активности в контрольных условиях (не менее 2-х мин после стабилизации мембранного потенциала и частоты генерации потенциала действия после введения микроэлектрода в клетку) и непосредственно после добавления глюкозы (на протяжении последующих 2 мин). Свежеприготовленный (на основе Рингера) раствор D-глюкозы (ч.д.а., “Анализ Х”, Беларусь) наносили на поверхность препарата ЦНС – ее конечная концентрация в термостатируемой (20 ± 0.5°С) экспериментальной камере составляла 1 и 10 мМ соответственно. Для записи и последующего анализа электрических сигналов использовали специальные возможности программы электронного осциллографа InputWin [15].
Нейроны идентифицировали по размеру, расположению в пределах ЦНС, цвету, паттерну спонтанной активности. Действие глюкозы на препарат ЦНС оценивали по влиянию, оказываемому на ряд индикаторных клеток разных ганглиев. Работа выполнена на гигантских (giant) вставочных нейронах педальных ганглиев – дофаминергическом RPeD1 и серотонинергическом LPeD1, а также пептид-содержащих, электрически связанных клетках висцерального и правого париетального ганглиев VD1/RPaD2, интегрированных в состав, как минимум, нескольких нейронных сетей, включая локомоторную и кардиореспираторную (расположение и карты, базовые характеристики, принципы номенклатуры и особенности идентификации представлены, например, в 16). Регистрация электрической активности от нейронов, находящихся в составе цельной ЦНС, т.е. в условиях сохранения взаимосвязей в пределах нейронной сети (в отличие от изолированных, выделением в культуру или посредством модификации синаптической передачи, клеток), позволяет оценить действие глюкозы в зависимости от функциональной принадлежности нейрона – сетевые генераторы ритма, определяющие реализацию моторных форм поведения животного, это комплекс совместно работающих структур [8]. Кроме того, “удачной” особенностью выбранных клеток является тот факт, что паттерн их электрической активности может служить дополнительным индикатором, позволяющим оценить эффекты глюкозы в ЦНС – регулярные (regular) разряды, как правило, характеризуют собственную ритмику нейрона, в то время как нерегулярная (irregular) активность преимущественно связана с синаптическими влияниями (входами), которые получает данная клетка [16].
Накопление АФК в нейронах. В изолированной ЦНС при помощи пинцетов разрывали соединительнотканную оболочку ганглиев, механически высвобождая содержащиеся в них нейроны, получая суспензию клеток в физиологическом растворе Рингера объемом 200 мкл (для одной ЦНС/пробы). Для оценки накопления АФК в цитоплазме использовали флуоресцентный краситель: 2',7'-дихлородигидрофлуоресцеин диацетат (DCFDA, максимумы λex – 501, λem – 525 нм, Sigma–Aldrich) в конечной концентрации 10 мкМ. Зонд добавляли непосредственно к суспензии клеток, выдерживая их в темноте, в течение 1 ч. По окончании инкубации, клетки осаждали центрифугированием (6000 об/мин, 5 мин), физиологический раствор с содержащимся в нем зондом удаляли, а клетки ресуспензировали свежим раствором Рингера. Процедуру отмывки клеток от следов зонда повторяли дважды.
Подготовленные пробы (по 8 для каждой экспериментальной серии) объемом 225 мкл располагали в отдельных лунках 24-луночного планшетах. Оценку интенсивности флуоресценции проводили до (0 мин) и после экспериментального воздействия (на 5 мин). К клеткам опытной группы добавляли 25 мкл 100 мМ раствора глюкозы (итоговая концентрация в лунке – 10 мМ), а к клеткам контрольной группы – равновеликое количество нормального раствора Рингера. В качестве дополнительного (позитивного) контроля использовали пероксид водорода (1 мМ, конечная концентрация), вносимого в суспензию клеток, к которым предварительно были добавлены FeSO4 ⋅ 7 Н2О и ЭДТА (оба в конечной концентрации 10 мкМ), гарантированно инициирующего образование АФК (прежде всего гидроксильного радикала).
Флуоресценцию (возбуждение 501 нм, эмиссия 529 нм) образующегося продукта измеряли посредством планшетного флуориметра Cary Eclipse (Agilent Technologies, USA) при трехкратной повторности каждого измерения (в дальнейшем использовали одно среднеарифметическое значение). Усредненную интенсивность флуоресценции лунок, содержащих контрольные клетки (на 0 мин), принимали за 100%.
Статистический анализ. Экспериментальные данные обрабатывали общепринятыми методами медико-биологической статистики, с использованием возможностей программы Statistica 6.0. Нормальность распределения для каждого ряда экспериментальных данных предварительно оценивали при помощи W-теста Шапиро–Уилка. В случае подтверждения нормальности распределения показателей для всех сравниваемых групп использовали параметрические методы оценки – t-критерий Стьюдента для зависимых пар, представляя данные в виде среднее ± ошибка среднего. Если нормальность распределения не была подтверждена для всех экспериментальных групп, использовали непараметрические методы оценки и сравнения полученных результатов – тест Вилкоксона (Wilcoxon matched pairs test) или критерий Фридмана (χ2) для дисперсионного анализа по однофакторной схеме (Fridman ANOVA) при сравнении двух или нескольких зависимых выборок соответственно, представляя данные в виде – медиана (нижний; верхний квартили). Число наблюдений (n) указано отдельно для каждой анализируемой выборки. Достоверными считались данные при уровне значимости (p), равном или меньшем 0.05.
Соблюдение этических стандартов. Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены. Настоящая статья не содержит результатов каких-либо исследований с участием людей в качестве объектов исследований.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Электрическая активность нейронов. Добавление глюкозы (конечная концентрация 1 мМ) не приводит к статистически достоверному изменению показателей спонтанной электрической активности (частота, уровень потенциала покоя) в краткосрочном, в течение первой и второй минут после возрастания содержания глюкозы в омывающем препарат физиологическом растворе Рингера, периоде ни для одного из исследованных нейронов. В частности, в отношении частоты генерации потенциала действия были определены следующе значения χ2 (Fridman ANOVA): 0.51 (p = 0.99), 1.88 (p = 0.87) и 4.52 (p = 0.48) для RPeD1, LPeD1 и пары VD1/RPaD2 соответственно.
Увеличение содержания глюкозы во внеклеточном растворе до 10 мМ, напротив, приводит к выраженной модификации электрических характеристик изученных клеток сразу после добавления указанного вещества (рис. 1 и 2).
Рис. 1.
Частота генерации потенциалов действия (spike frequency) в идентифицированных нейронах Lymnaea stagnalis в условиях быстроразвивающейся гипергликемии. Указаны значения исследованных показателей (медиана, числа над столбиками), интерквартильный размах (планки погрешностей) и количество исследованных нейронов (n) для клетки каждого типа. Момент добавления глюкозы (Glucose, 10 мМ) отмечен стрелкой. Для всех нейронов указано значение χ2 (Fridman ANOVA) и уровня значимости p. Статистически достоверные различия (p < 0.05, Wilcoxon matched pairs test) по сравнению с контрольными условиями (0–30 или 31–60 с) дополнительно отмечены астериском (*) и решеткой (#) соответственно.
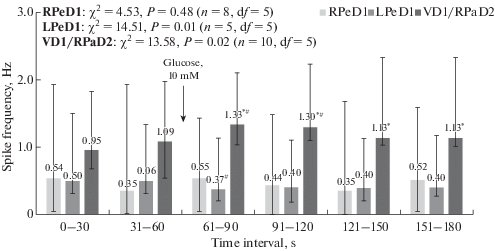
Рис. 2.
Спонтанная электрическая активность идентифицированных нейронов Lymnaea stagnalis в условиях гипергликемии (глюкоза, конечная концентрация 10 мМ).
a – дофаминергический нейрон RPeD1, b – серотонинергический нейрон LPeD1, c – пептид-содержащий нейрон RPaD2. Для каждого нейрона: верхняя линия записи – контрольные условия, средняя – на первой, нижняя – на второй минуте после добавления глюкозы (один и тот же нейрон). Калибровка: по времени – 1 с, по амплитуде – 25, 35, 60 мВ для а, б, в соответственно.
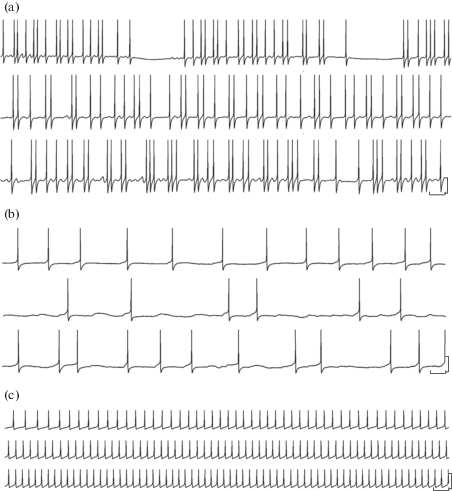
Так, в отношении дофамин-содержащего нейрона RPeD1 речь идет о слабовыраженной гиперполяризации его мембраны (на 5.4 ± 0.8 мВ, n = 8), уже на первой минуте после аппликации глюкозы, сохраняющейся на отмеченном уровне и в дальнейшем, т.е. на 2-й минуте. Тем не менее статистически достоверных изменений частоты генерации спонтанных потенциалов действия по сравнению с начальными (контрольными) условиями не было выявлено ни для одного изученного временного диапазона (рис. 1, 2а). Отдельно можно отметить некоторую трансформацию паттерна электрической активности данного нейрона – с фазической, когда группы спайков разделены выраженными временны́ми промежутками безимпульсной активности, на тоническую, при которой потенциалы действия следуют друг за другом непрерывно (сравни верхнюю линию записи со средней и нижней на рис. 2а).
Для серотонин-содержащей клетки LPeD1 отмечена неизменность значения мембранного потенциала при гипергликемии для всего изученного временного интервала. Тем не менее в отношении частоты спонтанной импульсации установлено ее статистически достоверное уменьшение, наиболее выраженное (в 1.35 раза) непосредственно, в первые 30 с, после добавления глюкозы к препарату изолированной ЦНС (рис. 1, 2b). Изменения паттерна электрической активности также отмечено не было.
Прогрессивная деполяризация в ответ на возрастание уровня глюкозы характерна для пары электрически связанных, пептид-содержащих нейронов VD1/RPaD2. Для клетки VD1 уже на первой минуте после добавления глюкозы ее величина составила 5.6 ± 0.6 мВ (n = 6) от контрольного значения, достигая 10.8 ± 0.8 мВ (n = 6) на второй минуте эксперимента. В отношении нейрона VD1/RPaD2 колебания мембранного потенциала были не столь выражены – 4.2 ± 0.6 и 8.8 ± 0.9 мВ (n = 6) для 1-й и 2-й минут наблюдения соответственно, сохраняя тем самым тенденцию, отмеченную для VD1. Частота генерации потенциала действия в указанных клетках увеличивалась уже на первой минуте после аппликации глюкозы в 1.2 раза по сравнению с исходной для контрольных условий, сохраняясь на достигнутом уровне и в последующем (рис. 1, 2c). Как и в случае с LPeD1, трансформации паттерна спонтанной электрической активности VD1/RPaD2 отмечено не было – импульсация клеток носила отчетливый тонический характер.
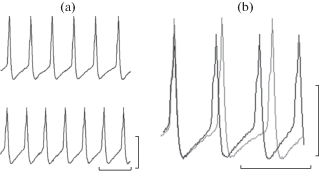
Дополнительно проведенный анализ формы спайка в пейсмейкерном нейроне VD1, как наиболее чувствительной к действию глюкозы клетки среди исследованных нейронов, показал, что в условиях гипергликемии увеличивается скорость медленной деполяризации мембраны (возрастает наклон кривой, отражающей изменение мембранного потенциала при развитии потенциала действия, рис. 3b), уменьшая время достижения порогового потенциала, предопределяя тем самым усиление импульсной активности клетки (рис. 3a). В отношении временны́х показателей других фаз спайка (фаз де- и реполяризации, следовой гиперполяризации) выраженных изменений выявлено не было.
Рис. 3.
Спонтанная электрическая активность нейрона VD1 Lymnaea stagnalis в норме и в условиях гипергликемии (глюкоза, конечная концентрация 10 мМ).
a – фрагмент регистрации, b – при наложении потенциалов действия друг на друга (выравнивание по уровню потенциала покоя мембраны).
Для a: верхняя линия записи – контрольные условия, нижняя – после добавления глюкозы (на 2-й минуте). Для b: серая линия – контрольные условия, темная – после добавления глюкозы. Калибровка: по времени – 1 с, по амплитуде – 50 мВ.
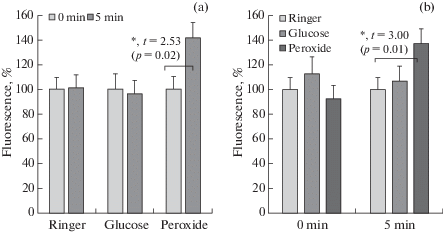
Анализ накопления АФК в нейронах. Использование флуоресцентного зонда позволило оценить возможность генерации АФК в изолированных клетках нервных ганглиев Lymnaea в первые минуты после создания условий гипергликемии. Добавление к суспензии клеток глюкозы (10 мМ, конечная концентрация) не приводит к возрастанию интенсивности флуоресценции даже по прошествии 5 мин после начала действия вещества, полностью повторяя реакцию клеток в контрольных условиях (рис. 4). В то же время искусственная инициация окислительных процессов посредством добавления к клеточной суспензии пероксида водорода (положительный контроль) незамедлительно, уже к 5-й минуте, приводит к ~40% увеличению интенсивности флуоресценции, подтверждая тем самым накопление АФК в цитозоле.
Рис. 4.
Флуоресценция (Fluorescence) в суспензии изолированных клеток нервных ганглиев Lymnaea stagnalis.
a – флуоресценция в начальный момент времени (0 min) принята за 100% (для каждой серии отдельно), b – флуоресценция в контрольной группе принята за 100% (для каждого временно́го интервала (0 или 5 мин) отдельно).
“Ringer” – контроль (нормальный физиологический раствор Рингера), “Glucose” – экспериментальные условия (глюкоза, конечная концентрация 10 мМ), “Peroxide” – положительный контроль (пероксида водорода, конечная концентрация 1 мМ).
Данные представлены в виде среднее арифметическое ± ошибка среднего. Число проб (n) – 8 для каждой серии эксперимента. Статистически достоверные различия (t-критерий Стьюдента для зависимых (a) или независимых (b) групп данных) отмечены астериском (*), дополнительно указана величина уровня значимости p.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные данные подтверждают способность ряда крупных центральных интернейронов Lymnaea выступать в качестве, как минимум, индикаторных клеток, отражающих быструю рецепцию глюкозы (при возрастании ее уровня во внеклеточной среде) в ЦНС. Наиболее существенные сдвиги частоты импульсации отмечены в отношении пары пептидсодержащих (более 10 форм) нейронов VD1/RPaD2, интегрированных в кардиореспираторную нейронную сеть [17, 18], – их отростки обнаружены, в том числе, в предсердии прудовика, некоторые из пептидов имеют сходство с кардиостимулирующим α1-пептидом Aplysia [19], а в условиях гипергликемии наблюдается увеличение частоты сердечных сокращений у Lymnaea [20]. Нейрон VD1 является ведущим в этой паре (обладает пейсмейкерными свойствами, в отличие от связанного с ним посредством электрического синапса RPaD2 [21]), поэтому эффекты глюкозы, очевидно, обусловленны преимущественным действием в отношении его мембраны, что косвенно подтверждается большей степенью изменения его потенциала покоя по сравнению с RPaD2. Важно подчеркнуть, что неизменность паттерна работы данных клеток (тонический характер, т.е. отсутствие выраженных синаптических входов) как в контрольных, так и экспериментальных условиях, указывает на то, что наблюдаемые эффекты обусловлены внутренними (собственными) перестройками их мембран, а не индуцированы сторонними нейронами сети вследствие модификации синаптической передачи. Модуляция в работе сердечной мышцы чрезвычайно значима в плане формирования гидроскелета моллюска, во многом определяя движения его тела, в том числе и локомоцию, выраженно изменяющихся в ходе пищедобычи. В этой связи отмеченное снижение скорости локомоции прудовика при движении по пищевому субстрату и в сытом состоянии [22] хорошо коррелирует с наблюдаемым снижением частоты генерации потенциалов действия в серотонин-содержащем нейроне LPeD1, регулирующим активность локомоторной сети Lymnaea [23]. Схожий эффект подавления спайковой активности, наблюдаемый в течение первых минут после приложения глюкозы (250 µг/мл, т.е. 1.39 мМ), отмечен и для изолированных мотонейронов локомоторной сети (серотонинергические клетки PeA-кластера), хотя для этих же клеток в составе цельной ЦНС эффект был выражен слабее [24].
Напомним, что описываемые нами влияния обнаружены в препаратах изолированной ЦНС, не содержащей буккальных ганглиев. С этих позиций, глюкоза может обладать сигнальными свойствами, реализуя корригирующие влияния в отношении центральных нейронов как агент объемной передачи сигнала, дополняя истинные синаптические влияния (входы) со стороны глюкозо-чувствительных клеток буккальных ганглиев и/или их возможных аналогов из состава центрального кольца ганглиев. При этом некоторые из структур в составе ЦНС оказываются относительно нечувствительны к такому воздействию – дофаминсодержащий нейрон RPeD1, как ключевой элемент центрального генератора респираторного ритма [25], – быстрой (в течение минут) модификации (интенсификации или терминации) легочного дыхания в ходе пищедобычи не наблюдается.
Гиперполяризация мембраны, выявленная в отношении этой клетки при действии глюкозы, может быть связана с модификацией функций ионных каналов плазмалеммы, во многом определяющих характер поглощения глюкозы, по крайней мере в отношении интестинальных клеток кишки [26]. Как правило, речь идет о катион-проводящих путях переноса (Na+, K+, Ca2+) через мембрану, а единственным катионом, усиление трансмембранного переноса которого может привести к гиперполяризации мембраны, является ион калия. Тем не менее в отношении нервных клеток как позвоночных [27], так и беспозвоночных [28], возрастание содержания глюкозы в интерстиции ассоциируется с инактивацией АТФ-чувствительных К+-каналов, приводящей скорее к деполяризации мембраны. В этой связи, отмеченный нами эффект в отношении мембранного потенциала RPeD1, вероятно, следует отнести за счет модификации (предположительно, ослаблению) синаптических входов к указанной клетке, – как известно, нейрон RPeD1 интегрирует сигналы со стороны других нейронов, или их групп, расположенных в пределах центрального кольца ганглиев ЦНС Lymnaea [16]. В пользу этого говорит трансформация паттерна его электрической активности (фазический характер, отражающий, как правило, наличие синаптических входов, сменяется на тонический), а также тот факт, что гиперполяризация мембраны RPeD1 выявлена при использовании безкальциевого/высокомагниевого раствора, т.е. в случае блокады химической синаптической передачи в ЦНС Lymnaea [29].
Содержание глюкозы в гемолимфе Lymnaea во многом определяется характером питания животного – возрастание уровня глюкозы является стимулом для последующего ускорения процессов роста и размножения [30]. Согласно данным работ середины 70-х годов XX века базальный уровень глюкозы в гемолимфе Lymnaea относительно невелик – 30 мкг/мл (т.е. 0.16 мМ), что в целом подтверждается и нашими данными [12]. С этих позиций отсутствие эффектов глюкозы в концентрации 1 мМ, т.е. большей базальной почти на порядок, выглядит несколько удивительным. Однако стоит указать на тот факт, что исходный уровень глюкозы в гемолимфе определяется, в том числе, и характером пищи, – высокоуглеводная пища “легко” повышает его до 86 мкг/мл (0.48 мМ), т.е. колебания содержания глюкозы в пределах 1 мМ не являются чем-то особенным, в сравнении с уже отмеченным скачком до 760 мкг/мл (4.22 мМ) у сытых особей [11]. Будет уместным предположить, что кратковременное пиковое содержание глюкозы во внутренней среде Lymnaea вполне может достигать уровня около 10 мМ, т.е. обнаруженные нами эффекты вполне физиологичны.
Несмотря на интенсификацию окислительных процессов, сопровождающую поглощение глюкозы, нами не обнаружено быстрого, лавинообразного, возрастания уровня АФК в цитоплазме клеток нервных ганглиев прудовика. Это может свидетельствовать как об относительно медленном накоплении АФК, вызываемых утилизацией “дополнительной” глюкозы, так и о развитой системе внутриклеточной антиокислительной защиты в нейронах (многие из них содержат ретиноиды [31]), способной купировать резкое возрастание свободно-радикального фона внутри клеток, по крайней мере в начальном периоде после воздействия.
Возрастание скорости медленной деполяризации, отмеченной при анализе формы спайка в VD1, говорит о модификации (увеличении) Na+-проводимости мембраны, вероятно, как следствие интенсификации работы электрогенного Na+-глюкозного котранспорта, как это отмечено в отношении нейроэндокринных светло-зеленых клеток (light-green cells, LGC) церебральных ганглиев [32]. Увеличение уровня глюкозы (максимальный эффект наблюдался при 5 мМ) приводит к деполяризации и усилению импульсации этих клеток, сопровождаемой выбросом “коктейля” разнообразных нейропептидов, в том числе инсулин-подобных (molluscan insulin-related peptide, MIP), определяющих реализацию метаболических процессов на уровне ЦНС и всего организма [33, 34]. Нормализация содержания глюкозы, по крайней мере в отношении ее пиковых значений, фактически десенситизирует нейроны, делая возможным реализацию нового цикла реакций, инициируемых резким увеличением уровня данного метаболита в гемолимфе.
ЗАКЛЮЧЕНИЕ
Резкое увеличение внеклеточного уровня глюкозы вызывает модификацию показателей электрической активности идентифицированных вставочных нейронов Lymnaea stagnalis в зависимости от их функциональной принадлежности. Наиболее чувствительными клетками, реагирующими на повышение уровня глюкозы в окружающем ЦНС пространстве, оказываются пептидергические кардиорегуляторные нейроны VD1/RPaD2 и серотонинсодержащие клетки (LPeD1) локомоторной сети, в то время как дофаминергические нейроны центрального генератора дыхательного ритма (RPeD1) практически не изменяют свои электрические характеристики. Это может указывать за способность глюкозы, как фактора объемной передачи, выступать в роли быстрого метаболического сигнала, определяющего поведение нейронных сетей мозга моллюска и реализацию ее эффектов на уровне целого организма.
Список литературы
Steinbusch L., Labouèbe G., Thorens B. (2015) Brain glucose sensing in homeostatic and hedonic regulation. Trends Endocrinol Metab 26: 455–466. https://doi.org/10.1016/j.tem.2015.06.005
Koekkoek L.L., Mul J.D., la Fleur S.E. (2017) Glucose-sensing in the reward system. Front. Neurosci. 11: 716. https://doi.org/10.3389/fnins.2017.00716
Dus M., Lai J.S., Gunapala K.M., Min S., Tayler T.D., Hergarden A.C., Geraud E., Joseph C.M., Suh G.S. (2015) Nutrient sensor in the brain directs the action of the brain-gut axis in Drosophila. Neuron 87: 139–151. https://doi.org/10.1016/j.neuron.2015.05.032
Mita K., Okuta A., Okada R., Hatakeyama D., Otsuka E., Yamagishi M., Morikawa M., Naganuma Y., Fujito Y., Dyakonova V., Lukowiak K., Ito E. (2014) What are the elements of motivation for acquisition of conditioned taste aversion? Neurobiol Learn Mem 107: 1–12. https://doi.org/10.1016/j.nlm.2013.10.013
López-Gambero A.J., Martínez F., Salazar K., Cifuentes M., Nualart F. (2019) Brain glucose-sensing mechanism and energy homeostasis. Mol Neurobiol 56: 769–796. https://doi.org/10.1007/s12035-018-1099-4
Lee C.Y. Dallérac G., Ezan P., Anderova M., Rouach N. (2016) Glucose tightly controls morphological and functional properties of astrocytes. Front Aging Neurosci 8: 82. https://doi.org/10.3389/fnagi.2016.00082
Fodor I., Hussein A.A., Benjamin P.R., Koene J.M., Pirger Z. (2020) The unlimited potential of the great pond snail, Lymnaea stagnalis. Elife 9: e56962. https://doi.org/10.7554/eLife.56962
Benjamin P.R. (2012) Distributed network organization underlying feeding behavior in the mollusk Lymnaea. Neural Syst Circuits 2: 4. https://doi.org/10.1186/2042-1001-2-4
Alania M., Dyakonova V., Sakharov D.A. (2004) Hyperpolarization by glucose of feeding-related neurons in snail. Acta Biol Hung 55: 195–200. https://doi.org/10.1556/ABiol.55.2004.1-4.24
Poprac P., Jomova K., Simunkova M., Kollar V., Rhodes C.J., Valko M. (2017) Targeting free radicals in oxidative stress-related human diseases. Trends Pharmacol Sci 38: 592–607. https://doi.org/10.1016/j.tips.2017.04.005
Scheerboom J.E.M., Hemminga M.A., Doderer A. (1978) The effects of a change of diet on consumption and assimilation and on the haemolymph-glucose concentration of the pond snail Lymnaea stagnalis (L) Proc Kon Ned Akad Wet, Ser C 81: 335–346.
Сидоров А.В., Маслова Г.Т. (2009) Система антиокислительной защиты в центральных нервных ганглиях моллюска Lymnaea stagnalis. Вести НАН Беларуси. Сер. биол. наук. 2: 90–94. [Sidorov A.V., Maslova G.T. (2009) Antioxidant defense in the central nervous ganglions of mollusk Lymnaea. Proc Nat Acad Sci of Belarus. Biol Series. 1: 91–95. (In Russ)].
Moghadam H.F., Winlow W., Moroz L.L. (1995) Effects of hydrogen peroxide and nitric oxide (NO) on neuronal discharges and intracellular calcium concentration in the molluscan CNS. Acta Biol Hung 46: 145–153.
Sidorov A.V. (2012) Effect of hydrogen peroxide on electrical coupling between identified Lymnaea neurons. Invert Neurosci 12: 63–68. https://doi.org/10.1007/s10158-012-0128-7
Солтанов В.В., Бурко В.Е. (2005) Компьютерные программы обработки электрофизиологических данных. Новости мед.-биол. наук 1: 91–95. [Soltanov V.V., Burko V.E. (2005) Computer programs for electrophysiological data-processing. News of Biomed Sci 1: 91–95. (In Russ)].
Benjamin P.R., Winlow W. (1981) The distribution of three wide-acting synaptic inputs to identified neurones in the isolated brain of Lymnaea stagnalis (L.) Comp Biochem Physiol 70A: 293–307.
Kerkhoven R.M., Croll R.P., Van Minnen J., Bogerd J., Ramkema M.D., Lodder H., Boer H.H. (1991) Axonal mapping of the giant peptidergic neurons VD1 and RPD2 located in the CNS of the pond snail Lymnaea stagnalis, with particular reference to the innervation of the auricle of the heart. Brain Res 565: 8–16. https://doi.org/10.1016/0006-8993(91)91730-o
Kodirov S.A. (2011) The neuronal control of cardiac functions in Molluscs. Comp Biochem Physiol A Mol Integr Physiol 160: 102–116. https://doi.org/10.1016/j.cbpa.2011.06.014
Buck L.B., Bigelow J.M., Axel R. (1987) Alternative splicing in individual Aplysia neurons generates neuropeptide diversity. Cell 5: 127–133. https://doi.org/10.1016/0092-8674(87)90017-1
Сидоров А.В.., Шаденко В.Н.., Казакевич В.Б. (2019) Реакции идентифицированных кардиорегуляторных нейронов ЦНС моллюска Lymnaea stagnalis в условиях гипергликемии и при действии инсулина. Журн Белорус гос ун-та Биология 3: 49–58. [Sidorov A.V., Shadenko V.N., Kazakevich V.B. (2019) Responces of identified cardioregulatory neurons within CNS of mollusc Lymnaea stagnalis at hyperglycemia and insulin action. Journal of the Belarusian State University. Biology 3: 49–58. (In Russ)]https://doi.org/10.33581/2521-1722-2019-3-49-58
Wildering W.C., van der Roest M., de Vlieger T.A., Janse C. (1991) Age-related changes in junctional and non-junctional conductances in two electrically coupled peptidergic neurons of the mollusc Lymnaea stagnalis. Brain Res 547: 89–98. https://doi.org/10.1016/0006-8993(91)90578-j
Sidorov A.V. (2006) Coordination of locomotor activity of mollusc Lymnaea stagnalis at nutrition: role of the internal medium acid-base balance (pH). J Evol Biochem Physiol 42: 43–48.
Vorontsov D.D., Tsyganov V.V., Sakharov D.A. (2004) Phasic coordination between locomotor and respiratory rhythms in Lymnaea. Real behavior and computer simulation. Acta Biol Hung 55: 233–227. https://doi.org/10.1556/ABiol.55.2004.1-4.28
Dyakonova V., Hernádi L., Ito E., Dyakonova T., Zakharov I., Sakharov D. (2015) The activity of isolated snail neurons controlling locomotion is affected by glucose. Biophysics (Nagoya-shi) 11: 55–60. https://doi.org/10.2142/biophysics.11.55
Lukowiak K., Martens K., Orr M., Parvez K., Rosenegger D., Sangha S. (2006) Modulation of aerial respiratory behaviour in a pond snail. Respir Physiol Neurobiol 154: 61–72. https://doi.org/10.1016/j.resp.2006.02.009
Chen L., Tuo B., Dong H. (2016) Regulation of intestinal glucose absorption by ion channels and transporters. Nutrients 8: 43. https://doi.org/10.3390/nu8010043
Huang C.W., Huang C.C., Cheng J.T., Tsai J.J., Wu S.N. (2007) Glucose and hippocampal neuronal excitability: role of ATP-sensitive potassium channels. J Neurosci Res 85: 1468–1477. https://doi.org/10.1002/jnr.21284
Inoue I., Tsutsui I., Brown E.R. (1997) K+ accumulation and K+ conductance inactivation during action potential trains in giant axons of the squid Sepioteuthis. J Physiol 500(Pt 2): 355–366. https://doi.org/10.1113/jphysiol.1997.sp022026
ЭльРахал А., Сидоров А.В. (2015) Взаимосвязь между показателями легочного дыхания и электрическими характеристиками идентифицированного нейрона респираторной сети моллюска Lymnaea stagnalis. Новости мед.-биол. наук 11 (1): 5–8. [Elrahal A., Sidorov A.V. (2015) Correlation between lung respiration and electrical properties of identified neuron within respiratory network in mollusc Lymnaea stagnalis. News of Biomed Sci 11 (1): 5–8. (In Russ)].
Veldhuijzen J.P. (1974) Effects of different kinds of food, starvation and restart of feeding on the haemolymph-glucose of the pond snail Lymnaea stagnalis. Neth J Zool. 25: 89–102. https://doi.org/10.1163/002829675X00146
Dmetrichuk J.M., Carlone R.L., Jones T.R., Vesprini N.D, Spencer G.E. (2008) Detection of endogenous retinoids in the molluscan CNS and characterization of the trophic and tropic actions of 9-cis retinoic acid on isolated neurons. J Neurosci 28: 13014–13024. https://doi.org/10.1523/JNEUROSCI.3192-08.2008
Kits K.S., Bobeldijk R.C., Crest M., Lodder J.C. (1991) Glucose-induced excitation in molluscan central neurons producing insulin-related peptides. Pflügers Archiv: European Journal of Physiology 417: 597–604. https://doi.org/10.1007/bf00372957
Geraerts W.P. (1992) Neurohormonal control of growth and carbohydrate metabolism by the light green cells in Lymnaea stagnalis. Gen Comp Endocrinol 86: 433–44. https://doi.org/10.1016/0016-6480(92)90068-u
Li K.W., Geraerts W.P., van Loenhout H., Joosse J. (1992) Biosynthesis and axonal transport of multiple molluscan insulin-related peptides by the neuroendocrine light green cells of Lymnaea stagnalis. Gen Comp Endocrinol 87: 79–86. https://doi.org/10.1016/0016-6480(92)90152-a
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


