Журнал эволюционной биохимии и физиологии, 2022, T. 58, № 3, стр. 240-254
ФУНКЦИОНАЛЬНАЯ РОЛЬ НОНАПЕПТИДЕРГИЧЕСКОЙ ПРЕОПТИКО-ГИПОФИЗАРНОЙ НЕЙРОСЕКРЕТОРНОЙ СИСТЕМЫ РЫБ В НЕРЕСТОВЫХ МИГРАЦИЯХ
П. Е. Гарлов 1, В. В. Кузик 2, *
1 Санкт-Петербургский государственный аграрный университет
Санкт-Петербург, Россия
2 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: kuzikvv@mail.ru
Поступила в редакцию 03.02.2022
После доработки 25.03.2022
Принята к публикации 15.04.2022
- EDN: NOPISI
- DOI: 10.31857/S0044452922030081
Аннотация
На основе результатов эколого-гистофизиологических исследований с применением световой микроскопии, включая иммуногистохимию, электронную микроскопию с количественной морфометрией результатов, обнаружено участие преоптико-гипофизарной нейросекреторной системы (гипоталамо-гипофизарной нейросекреторной системы, ГГНС) в инициировании миграционных процессов, подтвердив, таким образом, гипотезу проф. Н.Л. Гербильского и А.Л. Поленова о природе “миграционного импульса”. Впервые, в начале миграционного процесса у генетически отдаленных видов, но экологически сходных анадромых форм мигрантов (осетровых и лососевых) с различным сезоном размножения: весенненерестующих русского осетра, севрюги и осенненерестующей горбуши установлена активация синтеза нейросекреторных продуктов в перикарионах нейросекреторных клеток (НСК) и их транспорт в нейрогипофиз, где они аккумулируются. Одновременно показано выведение нейросекреторных продуктов из НСК в ликвор III желудочка мозга. Таким образом, ГГНС оказывает комплексный синхронный эффект, который заключается: 1) в нейротропном воздействии нонапептидных нейрогормонов на поведенческие центры центральной нервной системы (ЦНС), вызывающее доминантное состояние возбуждения ЦНС, соответствующее “миграционному импульсу”, 2) в нарушении адаптированного уровня осморегуляции морского “нагульного” периода онтогенеза и 3) в прекращении известного антигонадотропного действия нонапептидных нейрогормонов, что способствует переходу организма на энергозатратный энергетический тип метаболизма. Сопоставительный анализ собственных и литературных данных подтверждает общность этого метаболического механизма у рыб, что позволяет его рассматривать как важнейшую филогенетическую адаптацию типа ароморфоза, направленную на достижение биологического прогресса вида. В последующих навигационных механизмах хоминга, широко освещенных в мировой литературе, ведущую роль выполняют люлиберинергические центры гипоталамуса. Экологическое многообразие этих механизмов популяционного уровня и наличие стрэинга у рыб позволяет рассматривать их как специализации микроэволюционного происхождения. Последующий анализ функции ГГНС в процессах миграции и нереста позволит установить основной принцип интеграции процессов этого этапа онтогенеза, важнейшего для существования вида.
Изучение процессов становления и функционирования гипоталамо-гипофизарной нейросекреторной системы (ГГНС) у рыб представляет большой интерес в плане понимания эволюционного развития нейросекреторной регуляции в ряду позвоночных. Именно у рыб наиболее ярко представлены анцестральные для всего ряда позвоночных признаки, а также четко выражены адаптивные реакции, характерные для пойкилотермных животных, определяющие большое разнообразие экологических форм, способствующих достижению биологического прогресса вида [1–3]. По многим морфогенетическим признакам: по типу дробления яйца, характеру формирования аденогипофиза, структуре нейросекреторных центров и др. осетровые рыбы наиболее близки к основному стволу эволюционного древа позвоночных [4]. Изучение механизмов нейроэндокринной регуляции размножения рыб ограничивалось лишь анализом влияния нейроэндокринного комплекса на тропные функции аденогипофиза и на эндокринную и генеративную функции гонад в процессе нереста [5–8], однако размножение у проходных рыб включает в себя нерестовые миграции и нерест. Исследование функциональной роли ГГНС имеет особое значение в связи с многофункциональной ролью нонапептидных нейрогормонов в адаптациях организма позвоночных к воздействию стресса, особенно в период размножения [9]. Предполагалось исходно, что у костистых рыб ведущую роль в определении миграционного поведения выполняют нонапептидные нейрогормоны ‒ аргинин-8-вазотоцин и изотоцин [4]. В начале нерестовой миграции, перед сменой среды обитания, у первично моноцикличных форм ‒ анадромных миног и катадромных угрей, а также у скатывающихся смолтов лосося исходно были установлены изменения в осмотической и ионной регуляции [10, 11]. Однако повышение функциональной активности ГГНС в период миграций было установлено только после смены среды обитания в связи с изменением солености [9, 12], либо с сезонными изменениями температур [13]. Поскольку во всех предшествующих исследованиях не были использованы количественные методы оценки функциональной активности ГГНС, либо изучен только один из ее отделов, степень участия системы в репродуктивных процессах не была определена. Однако большинством авторов была отмечена обратная зависимость в содержании нейросекреторного материала в центральном и дистальном отделах ГГНС в преоптическом ядре и в нейрогипофизе у рыб в период нерестовых миграций и в сезон размножения. В преоптическом ядре наблюдалось опустошение нейросекреторных клеток (НСК) от нейросекреторного материала, а в нейрогипофизе отмечалось его значительное накопление. Лишь незначительное уменьшение его в гигантских нейросекреторных терминалях − телах Герринга (до 50 мкм) в нейрогипофизе, было отмечено у осетровых во время нерестовых миграций в различные сезоны [14]. Такж некоторое снижение содержания нейросекреторного материала в разных отделах ГГНС было отмечено у скатывающихся смолтов атлантического лосося. Однако четких закономерностей изменения функционального состояния ГГНС в период миграций рыб не было обнаружено, и вопрос о природе “миграционного импульса” до настоящего времени остается открытым [14]. Поэтому в качестве единственного ведущего механизма осуществления миграции рыб принято рассматривать чисто навигационные процессы: воздействия геомагнитных полей на рецепторные системы организма [15, 16] и обонятельного импринтинга и хоминга [7, 17, 18].
Участие ГГНС в осуществлении процесса нереста было установлено на промысловых видах осетровых и костистых рыб благодаря применению эколого-гистофизиологического подхода, который заключается в анализе участия клеточных и тканевых структур в становлении и реализации филогенетических видовых адаптаций в онтогенезе [3, 4, 14]. Эколого-гистофизиологический подход или метод в эволюционной морфологии позволяет вскрыть механизмы важнейших биологических явлений и процессов и, намечая пути к их управлению, выяснять функциональные механизмы микроэволюционного процесса. Рассматривая их как результат “эксперимента, поставленного самой природой”, этот подход позволил нам успешно применить в работе также и метод сопоставительного анализа (“cross-analysis” из области оценки новизны изобретений) [3].
Цель нашего исследования заключалась в выяснении функциональной роли ГГНС в осуществлении нерестовой миграции рыб. Основной задачей исследования явилось определение степени участия ГГНС в процессе анадромной миграции на основе применения эколого-гистофизиологического подхода.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования выполнены согласно дизайну, одобренному Этическим комитетом Института эволюционной физиологии и биохимии РАН, European Communities council Directive 1986 (2010/63/EEC), согласно правилам, изложенным в “Guide for the Care and Use of Laboratory Animals”. При планировании и проведении исследований на животных соблюдены “принципы 3R” Replacement (использование альтернативных методов), Redaction (минимизация количества животных в исследованиях), Refinement (минимизация факторов безосновательного стрессирования (боль, дискомфорт и др.) животных до, во время и после проведения исследований.
Состояние ГГНС изучено у половозрелых производителей проходных анадромных рыб из неводных уловов: весенненерестующих русского осетра Acipenser gueldenstaedtii Brandt (Linne, 1833), севрюги А. stellatus (Pallas, 1771) из низовьев Волги и осенненерестующей моноцикличной горбуши Oncorhynchus gorbuscha (Walbaum, 1792) из низовьев и нерестилищ рек Найбы и Умбы (Южный Сахалин, Кольский полуостров). Для светооптических исследований использовано 17 самок осетра и севрюги и 23 особи горбуши обоего пола. На электронномикроскопическом уровне изучено 9 самок осетра и севрюги и 12 особей горбуши обоего пола.
Для световой микроскопии ткань мозга с гипофизом фиксировали в жидкости Буэна и заключали в парафин. Депарафинизированные гистологические срезы толщиной 5–6 мкм окрашивали паральдегид-фуксином (ПАФ) по методике Гомори-Габа с докраской азаном по Гейденгайну [19]. Степень функциональной активности ГГНС определяли морфометрическими количественными методиками оценки степени содержания нейросекреторного материала в перикарионах НСК и в нейросекреторных терминалях их аксонов (в преоптическом ядре и в нейрогипофизе). На анализаторах микроизображений “Морфоквант” и “Видеотест” проводили цитоспектрофотометрию гистологических препаратов с использованием программы “Видеотест”.
Иммуногистохимические исследования выполнены с целью установления эргичности НСК. Иммуногистохимический метод с использованием немеченых антител и иммуногистохимические реакции проводили по общепринятой методике [20]. Депарафинизированные срезы промывали в нескольких порциях PBSS и PBS с 0.1% TRITON X‑100 (PBST). Затем проводили 30-минутную блокировку эндогенной пероксидазы 0.3%-ным раствором перекиси водорода на PBST. После нескольких промывок в PBST была проведена блокировка неспецифического связывания при комнатной температуре в течение 1 ч в 5%-ном блокирующем растворе, содержащем 2% бычьего сывороточного альбумина и 3% нормальной сыворотки козы, разведенные на PBST. Затем при 4°С в течение 48 ч были проведены инкубации с первичными антителами к вазотоцину (кролик, 1:1000, Sigma, США) и изотоцину (кролик, 1:1000, Sigma, США). После инкубации и тщательной промывки в PBST в течение 1 ч срезы инкубировали при комнатной температуре во вторичных антителах (овца-против-кролика, конъюгированная с биотином 1:300; VectorLabs., Великобритания).
После промывки в PBS срезы на 1 ч при комнатной температуре помещали в раствор стрептовидин-пероксидазы (BioLegend, США), разведенной на РBS 1:700. Во всех случаях для визуализации пероксидазы использовали 0.05%-ный раствор диаминобензидина с 0.3%-ной перекисью водорода на PBS. Далее стекла подвергали стандартной гистологической обработке, заключали в прозрачную среду (Bio–Optika, Италия) и высушивали. Специфичность окраски проверяли с помощью негативного контроля (без первичных антител). Позитивным контролем считали выявление белков в структурах, ранее описанных в литературе.
Электронно микроскопическое исследование проведено на материале (область преоптического ядра гипоталамического отдела головного мозга), фиксированном в глютаральдегиде (по Сабатини), осмии (по Колфилду) и заключенном в аралдит и эпон [21]. Ультратонкие срезы (50–70 нм) контрастировали в уранилацетате и цитрате свинца по Рейнольдсу. Проводили анализ процентного соотношения НСК, находящихся в различных фазах их секреторного цикла и экструзионного цикла нейросекреторных терминалей аксонов [9]. Результаты представлены в виде таблиц, гистограмм и схем.
Для конструктивного исследования механизмов участия ГГНС в осуществлении этапов размножения проходных рыб, представленных в формализованной графической форме, использован метод сопоставительного анализа [14].
Статистический анализ гистоморфологических и иммуногистохимических исследований ГГНС осетровых и горбуши проводили с помощью дисперсионного анализа (ANOVA) и последующего апостериорного анализа межгрупповых различий по критерию Тьюки. Результаты исследований представлены как среднее ± стандартная ошибка, данные по количественной морфометрии структур и ультраструктур ГГНС обработаны статистически с использованием пакета программ Microsoft Excel.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
У объектов нашего исследования ‒ русского осетра, севрюги и горбуши представлены основные типы строения ГГНС рыб (рис. 1). В ГГНС осетровых в отличие от костистых рыб четко выражен передний нейрогипофиз или проксимальная нейросекреторная контактная область, гомологичная срединному возвышению наземных позвоночных [9]. В ней осуществляется гипоталамическая регуляция тропных функций аденогипофиза транс-аденогипофизарным путем (рис. 1а: II), по которому нонапептидергические нейрогормоны через сеть портальных сосудов поступают в аденогипофиз. В нейрогипофизе осетровых, имеющем трубчатое строение, наиболее выражены аксо-вазальные нейросекреторные контакты с капиллярами общего кровотока, по которым нонапептидные нейрогормоны поступают к висцеральным органам-мишеням пара-аденогипофизарным путем (рис. 1а: III) и участвуют в регуляции вегетативных функций организма [14]. Наиболее древние, менее развитые, аксо-вентрикулярные контакты тел Герринга с полостями гипофизарных бухт (recessus hypophyseus как продолжение recessus infundibulum) осуществляют транспорт нонапептидных нейрогормонов в спинномозговую жидкость (ликвор) транс-вентрикулярным путем (рис. 1а: I), откуда нейрогормоны воздействуют на центры поведения в ЦНС [23].
Рис. 1.
Схемы локализации нонапептидергических НСК из преоптического ядра (NPo) и люлиберинергических НСК (LH-RH, мелкие черные кружки) нейросекреторных центров в гипоталамусе рыб и пути выведения нонапептидергических нейрогормонов у осетровых (a) и у костистых рыб (b): I. Транс-вентрикулярный путь: нейротропный эффект нонапептидных нейрогормонов, II. Транс-аденогипофизарный путь: аденогипофизотропный эффект нонапептидных нейрогормонов, III. Пара-аденогипофизарный путь: висцеротропный эффект нонапептидных нейрогормонов.
Обозначения: Npo − Nucleus preopticus (преоптическое ядро), малые черные кружки – люлиберинергические (LH-RH) НСК, OVLT – Organum vasculosum laminae terminalis, сосудистый орган концевой пластинки, NLt – Nucleus Lateralis tuberis, латеральное ядро серого бугра гипоталамуса, Nt – Nucleus tuberis, туберальное ядро, S.V. – Saccus Vasculosus, сосудистый мешок.
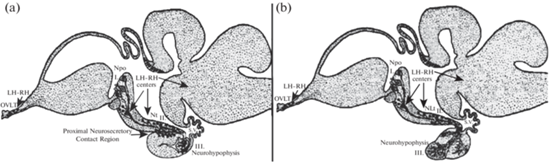
У горбуши, как и у большинства костистых рыб, корни нейрогипофиза пронизывают все три отдела гипофиза (про-, мезо и мета-аденогипофиз) [3, 24]. В мета-аденогипофизе нейросекреторные терминали образуют непрямые аксо-вазальные контакты, формируя здесь компактную нейропромежуточную долю гипофиза (рис. 1b).
Характерные морфологические особенности строения ГГНС у осетровых согласуются с представлением об их близости к основному стволу эволюционного древа позвоночных. Наличие в нейрогипофизе прямых аксо-вентрикулярных нейросекреторных контактов с полостями гипофизарных бухт, откуда нонапептидные нейрогормоны поступают в ликвор мозга, свидетельствует о нейротропном пути их влияния на ЦНС [18]. Таким образом, нонапептидные нейрогормоны вызывают нейротропный эффект (в областях сомато-, дендро- и аксо-вентрикулярных нейросекретных контактов), аденогипофизотропный (в зонах аксо-аденарных контактов) и висцеротропный (в области аксо-вазальных контактов).
У осетра и у горбуши в начале нерестовой миграции отмечены повышение секреторной активности НСК, гипертрофия (активация) нейроглии и сосудов в области преоптического ядра. Большинство НСК в наиболее дифференцированной дорзальной крупноклеточной части преоптического ядра представлены гипертрофированными активными “светлыми” формами в секреторных фазах “выведения” и “опустошения” от нейросекреторного материала (рис. 2а).
Рис. 2.
Перикарионы НСК из преоптического ядра горбуши (a–с) и нейросекреторные терминали в нейрогипофизе осетра (d) в период миграций и размножения: a–с ‒ в начале нерестовой речной миграции в преоптическом ядре преобладают активные светлые НСК, b ‒ вазотоцинергические НСК контактируют с полостью III желудочка мозга, c – оформление нейросекреторных гранул в комплексе Гольджи НСК, d ‒ разрушение фрагмента тела Герринга вблизи реснички (киноцилии) и выход мелкозернистого содержимого в полость гипофизарной бухты (стрелки). Световая микроскопия: а ‒ окраска паральдегид-фуксин по Гомори-Габу, b ‒ иммуноцитохимическая реакция на выявление вазотоцинергических НСК (ок. ×10, об. ×20). Электронная микроскопия: c, d.

Иммуноцитохимическим исследованием морфофункционального состояния преоптического ядра горбуши было выявлено значительное преобладание вазотоцинергических НСК (рис. 2b, черные стрелки) по сравнению с изотоцинергическими НСК (светлые стрелки). В симметричных частях преоптического ядра многие вазотоцинергические НСК тесно примыкают к полости III желудочка мозга, где их апикальные поверхности тесно контактируют с ликвором, формируя сеть сомато-вентрикулярных и дендро-вентрикулярных контактов. Контакты, образованные изотоцинергическими НСК, малочисленны по сравнению с численностью вазотоцинергических НСК контактов, их примерное соотношение составляет 1:5. На электронно микроскопическом уровне в комплексе Гольджи в большинстве нонапептидергических-НСК наблюдаются картины массового формирования элементарных нейросекреторных гранул и направления их в дендриты и аксоны, что указывает на активацию транспорта синтезируемых нонапептидных нейрогормонов (рис. 2b). Анализ процентного соотношения нонапептидных-НСК в разных фазах секреторой активности (рис. 3a) показал, что 51% из них находятся в функциональном состоянии высокой секреторной активности (фазы 2, 4) и к началу нереста их количество достигает 80% (табл. 1).
Рис. 3.
Схема секреторного цикла НСК в дорзальной части преоптического ядра (a) и экструзионного цикла нейросекреторных терминалей в нейрогипофизе рыб (b) [14]. Фазы секреторного цикла: I типа НСК: 1 – низкая или умеренная активность, 2 – высокая активность, 3 – депонирование нейросекреторного материала, 4 – гиперактивность, 5 – репарация органоидов, 6 – массовая деградация органоидов; II типа НСК: 7 – покой или глубокое торможение функций; III типа НСК: 8 – дегенерация (у горбуши не выявлено). Фазы экструзионного цикла нейросекреторных терминалей: 1 – депонирование элементарных нейросекреторных гранул; 2 – начало выведения нейрогормонов; 3 – активное выведение нейрогормонов; 4 – истощение после выведения нейрогормонов; 5 – накопление нейросекреторных гранул; 6 − переполнение полиморфными секреторными гранулами – темные нейросекреторные терминали. Прерывистыми стрелками соединены перикарионы НСК с терминалями их аксонов.
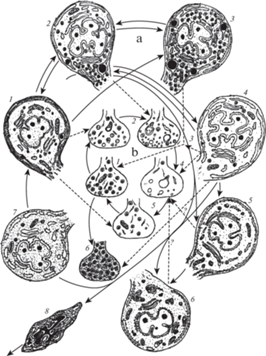
Таблица 1.
Морфометрическая характеристика НСК из преоптического ядра горбуши в процессе нерестовой миграции и к началу нереста
| Количественные соотношения НСК в различных функциональных состояниях и фазах секреторного цикла в дорзальной части преоптического ядра (%) и степень гиперемии области преоптического ядра * | |||||
|---|---|---|---|---|---|
| Стадии зрелости гонад (IV, V) | |||||
| Световая микроскопия (n = 23) | Электронная микроскопия (n = 12) | ||||
| Функциональные состояния НСК (% соотношения НСК в 4-х фазах активности (фазы активации: 3, 4) |
IV Нерестовая миграция (в низовье реки) | V В начале нереста (на нерестилище) | Фазы секреторного цикла НСК | IV Нерестовая миграция | V В начале нереста |
| 1. Покой (умеренное содержание нейросекреторного материала) | 8.2 ± 1.7 | 5.8 ± 1.8 | 1. Низкая или умеренная активность | 8 ± 0.8 | 3 ± 0.2 |
| 2. Накопление нейросекреторного материала | 34.6 ± 8.0 | 12.8 ± 5.4 | 2. Высокая активность | 42 ± 5.4 | 59 ± 8.5 |
| 3. Выведение нейросекреторного материала | 45.8 ± 9.4 | 57.7 ± 3.1 | 3. Депонирование нейросекреторного материала | 30 ± 4.9 | 10 ± 4.0 |
| 4. Опустошение от нейросекреторного материала (гиперактивация) | 11.4 ± 4.7 | 23.8 ± 7.3 | 4. Гиперактивность | 9 ± 1.9 | 21 ± 3.5 |
| Ширина просвета сосудов (степень гиперемии ПЯ, мкм) | 7.6 ± 0.6 | 8.7 ± 0.9 | 5. Репарация органоидов | 4 ± 0.8 | 1 ± 0.2 |
| 6. Массовая деградация органоидов | – | – | |||
| 7. Покой или глубокое торможение функций | 7 ± 1.2 | 6 ± 1.3 | |||
В начале речной миграции при активном синтезе нейросекреторных продуктов и их выведении из перикарионов НСК, в нейрогипофизе у всех изученных видов рыб происходит массовая аккумуляция нейросекреторного материала (рис. 4, табл. 2).
Рис. 4.
Состояние нейрогипофиза севрюги (a), осетра (b) и горбуши (c, d) в начале речной нерестовой миграции (IV стадия зрелости гонад) характеризуется накоплением нейросекреторного материала. На светооптическом уровне (a, c) в корнях нейрогипофиза наблюдаются скопления гомори-положительного нейросекреторного материала, капилляры спавшиеся (окраска паральдегид фуксин + азан по Гейденгайну (ок. ×10, об. ×20). На электронно микроскопическом уровне (b, d) в нейросекреторных терминалях преобладают элементарные нейросекреторные гранулы, содержание остаточных гранул и синаптических пузырьков минимально. Темные нейросекреторные терминали, переполненные полиморфными нейросекреторными гранулами (тип 6), наблюдаются вблизи перикапиллярного пространства (d).
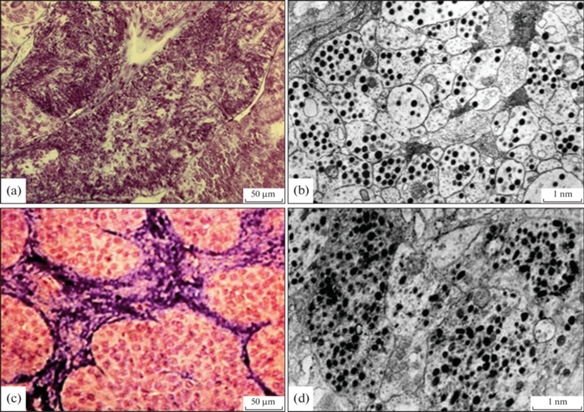
Таблица 2.
Характеристики структур дистальных отделов нейрогипофиза горбуши в процессе нерестовой миграции и в начале нереста
| Содержание нейросекреторного материала в нейрогипофизе, количественные соотношения нейросекреторных терминалей в различных фазах экструзионного цикла (рис. 3b), степень активности питуицитов и степень гиперемии нейрогипофиза | |||||||
|---|---|---|---|---|---|---|---|
| Стадии зрелости гонад (IV, V) | |||||||
| Световая микроскопия (n = 23) | Электронная микроскопия (n = 12)* | ||||||
| Содержание нейросекреторного материала в нейрогипофизе, состояние его структур | IV Нерестовая миграция (в низовье реки) | V В начале нереста | Фазы экструзионного цикла нейросекреторных терминалей (%) | IV Нерестовая миграция | V В начале нереста | ||
| А1 | А2 | А1 | А2 | ||||
| Нейросекреторный материал (баллы): ♀ | 4.0 ± 0.12 | 2.4 ± 0.26 | 1. Депонирование нейросекреторных гранул | 17 ± 2.35 | 7 ± 0.53 | 7 ± 2.86 | 2 ± 1.05 |
| Нейросекреторный материал (баллы): ♂ | 3.8 ± 0.13 | 2.8 ± 0.28 | 2. Начало выведения нонапептидных нейрогормонов | 58 ± 4.62 | 70 ± 1.45 | 54 ± 3.97 | 45 ± 1.70 |
| ♀+♂ (среднее, баллы) | 3.9 ± 0.09 | 2.6 ± 0.18 | 3. Активное выведение нонапептидных нейрогормонов | 20 ± 3.58 | 20 ± 1.94 | 33 ± 8.44 | 47 ± 2.87 |
| Диаметр ядер питуицитов (мкм) | 4.73 ± 0.10 | 6.24 ± 0.17 | 4. Истощение после выведения нонапептидных нейрогормонов | 4 ± 1.20 | 2 ± 0.38 | 4 ± 1.56 | 6 ± 0.17 |
| Ширина просвета капилляров (мкм) | 15.94 ± 0.45 | 16.64 ± 1.51 | 5. Накопление нейросекреторных гранул | 1 ± 0.18 | 1 ± 0.22 | 2 ± 1.31 | – |
* Нонапептидергические нейросекреторные терминали вида А1 с наиболее крупными нейросекреторными гранулами (160–250 нм) являются носителями изотоцина, а вида А2 (с гранулами 110–160 нм) – вазотоцина (рис. 2c, 2d; 4b, 4d).
Как следует из табл. 2, все клеточно-тканевые элементы нейрогипофиза: нейросекреторные терминали, синусоидные капилляры и питуициты находятся в неактивном функциональном состоянии, однонаправлено свидетельствующем о низком уровне выведения нонапептидных нейрогормонов в общий кровоток (рис. 4).
На ультраструктурном уровне у проходных осетровых рыб в области аксо-вентрикулярных нейросекреторных контактов выявляются картины распада нейросекреторных гранул, разрушение фрагмента тела Герринга по типу макроапокриновой секреции и выход мелкозернистого продукта в полость гипофизарных бухт, что свидетельствует о выведении нейросекреторного продукта в спинномозговую жидкость (рис. 1a, 2d: стрелки). В период активной речной нерестовой миграции транспорт нейросекреторного материала заметно выражен в преоптико-гипофизарном нейросекреторном тракте у горбуши, по результатам цитоспектрофотометрии уровень его содержания в аксонах достигает 0.24 ± 0.05 (ед. оптической плотности) по сравнению с его последующим снижением до 0.15 ± 0.06 на нерестилищах (V стадия зрелости гонад).
Таким образом, впервые установлено, что в начале нерестовой миграции в ГГНС происходит активный синтез, транспорт и выведение нонапептидных нейрогормонов в полость III желудочка мозга трансвентрикулярным путем, что может свидетельствовать о возможности нейротропного действия нонапептидных нейрогормонов на ЦНС (на рис. 1a, 1b, 2a–2d). Динамика синтетической активности вазотоцин- и изотоцинергических НСК из преоптического ядра впервые была показана в начале нерестовой миграции и перед нерестом у производителей кеты [25]. У самок в начале речного периода нерестовой миграции уровень синтеза и вазотоцина и изотоцина в НСК из преоптического ядра был значительно выше, чем перед нерестом [26]. У самцов в начале речного периода нерестовой миграции уровень синтеза и иммунореактивности изотоцина в ростровентральной части преоптического ядра был ниже, чем непосредственно перед нерестом, но заметных изменений в активности синтеза вазотоцина отмечено не было [17]. В НСК из преоптического ядра было показано снижение уровня синтеза вазотоцина только у самок кеты в реке по сравнению с предустьевым морским пространством (авандельтой), при отсутствии изменений уровня синтеза изотоцина [27]. Однако морфофункциональное состояние нейрогипофиза в этих работах не рассматривалось, и поэтому механизмы участия нонапептидных нейрогормонов в миграциях остались неясны. Аккумуляция нейросекреторного материала в нейрогипофизе в период нерестовой миграции осетра, севрюги и горбуши указывает на значительное замедление процессов выведения нонапептидных нейрогормонов в кровоток и, как следствие, ослабление висцеротротропной активности ГГНС, обеспечивающей регуляцию водно-солевого обмена [28, 29] (рис. 4, табл. 2).
Для выяснения функциональной роли ГГНС в миграции рыб применен метод формализованного количественного сопоставительного анализа, который позволил установить принцип структурной и функциональной организации центров интеграции биологических систем – “триады равновесной системы” [3]. Результаты сопоставления данных, полученных в настоящей работе, с основными литературными данными позволили представить динамику изменений функционального состояния ГГНС на различных этапах онтогенеза проходных рыб [3, 7, 12, 26–29]. Состояния функциональной активности ГГНС четко проявляются либо в обратной зависимости содержания нейросекреторного материала в перикарионах НСК и в нейрогипофизе (рис. 2a, 4), либо в опустошении нейрогипофиза от нейросекреторного материала (рис. 1a, 1b III, табл. 2). Таким образом, можно выделить 2 основных морфофункциональных состояния ГГНС, обеспечивающих регуляцию процессов размножения представленных видов рыб:
1. Состояние нейротропной активности ГГНС, исключающее висцеротропное действие нонапептидных нейрогормонов на органы-мишени. Характеризуется опустошением НСК из преоптического ядра от нейросекреторного материала (процессы транспорта и выведения нонапептидных нейрогормонов в ликвор III желудочка мозга соответствуют процессу активного синтеза нейросекреторного материала в перикарионах НСК). Происходит накопление (аккумуляция) нейросекреторного материала в нейрогипофизе.
2. Состояние висцеротропной активности ГГНС отражает активное действие нонапептидных нейрогормонов на висцеральные органы-мишени. Такая активация функции ГГНС на уровне организма характеризуется опустошением нейрогипофиза от нейросекреторного материала, происходит активное выведение нейросекреторных продуктов из нейрогипофиза в общий кровоток (рис. 1: III).
Показано, что исходным определяющим (детерминирующим) звеном, общим для разных сезонов миграций, является состояние нейротропной активности ГГНС. Ведущим морфофункциональным механизмом такого состояния ГГНС в начале миграций является продолжительная активация синтеза нейросекреторных продуктов в НСК из преоптического ядра и их транспорт в ликвор мозга. Транспорт осуществляется: 1) из апикальной части перикарионов НСК в области их сомато-вентрикулярных нейросекреторных контактов (рис. 1: I, 2b), 2) в нейрогипофизе из тел Герринга в области аксо-вентрикулярных нейросекреторных контактов (рис. 2d), 3) из дендритов НСК в области дендро-вентрикулярных нейросекреторных контактов.
В начале речного периода нерестовой миграции в нейрогипофизе из терминалей аксонов нонапептидные нейрогормоны выводятся только трансвентрикулярным путем (рис. 1: I). Это может свидетельствовать о “переключении” воздействия нонапептидных нейрогормонов с висцеротропного на нейротропное, эволюционно более древнее воздействие на ЦНС (на рис 1: с III на I) [23]. Показано, что вазотоцин и в меньшей степени изотоцин в виде “нерестового рефлекса” вызывают эффект возбуждения ЦНС у костистых рыб в момент нереста [11, 30–32]. Нонапептидные нейрогормоны активно воздействуют на центры регуляции поведения лимбической системы мозга, расположенные в амигдальных и гиппокампальных областях [11, 31–36]. Рецепторы вазотоцина (у Teleostei и Tetrapods) обнаружены в отделах мозга, ответственных за проявления социальных и сексуальных форм поведения, включая некоторые “критические области”, обозначенные как “cеть социального поведения” или “социальная сеть принятия решений” (“Social Behavior Network”, “Social Decision-Making Network”) (26, 31–33]. Общей основой этих разнообразных нейротропных эффектов воздействия нонапептидных нейрогормонов, по-видимому, является доминирующее состояние возбуждения ЦНС [36–38].
Синхронный (с нейротропным) эффект нарушения участия нонапептидных нейрогормонов в обеспечении нормального (для среды нагула), длительно адаптированного уровня водно-солевого баланса организма является второй важной частью комплексного механизма миграционного импульса. Важную роль в механизме изменения водно-солевого гомеостаза (с гипоосмотического типа осморегуляции на гиперосмотический) в период анадромных нерестовых миграций выполняет вазотоцин [10, 11, 42]. Экспериментально установлена температурная зависимость осмотически индуцированной активации синтеза вазотоцина в НСК из преоптического ядра у кеты в морской период нерестовой миграции [43]. В процессе нерестовых миграций и нереста у проходных рыб, особенно у лососевых, в связи с изменениями солености внешней среды происходит оводнение мышц, свидетельствующее о нарушении механизмов водно-солевого обмена [10, 17, 42]. Установлено также наличие двух различных рецепторов (типа V1) на хлорид-секретирующих клетках респираторного эпителия жабр костистых рыб, и сделано заключение об участии вазотоцина и изотоцина в регуляции ионного баланса организма через жаберный кровоток [44–46]. Таким образом, физиологическим стимулом, определяющим необходимость смены среды обитания, оказывается вызванный ГГНС двойной синхронный эффект, который заключается в инициировании стойкого возбуждения “поведенческих” центров ЦНС в форме “миграционного импульса” и в нарушении длительно адаптированного водно-минерального обмена − “нагульного” гипотонического типа осморегуляции и ионного баланса.
Третьим синхронным эффектом, вызванным снижением висцеротропной активности ГГНС в период нерестовой миграции рыб, является прекращение антигонадотропного действия нонапептидных нейрогормонов. Это действие у костистых рыб осуществляется путем: 1) прямого ингибирования секреции гонадолиберина или люлиберина при синергизме нонапептидных нейрогормонов с дофамином, 2) стимуляции секреции адренокортикотропина в аденогипофизе (при синергизме с кортиколиберином), 3) путем тормозящего влияния на эндокринные и генеративные функции гонад, т.е. на всех уровнях гипоталамо-гипофизарно-гонадной оси нейроэндокринных взаимоотношений [5, 11, 33, 47]. В некоторых гонадолиберинергических НСК из вентральной мелкоклеточной части преоптического ядра у костистых рыб показано наличие двух форм гонадолиберина (лосося и цыпленка) и установлено, что они модулируют электрическую активность вазотоцинергических НСК [5, 48, 49]. Предполагается, что секреторная активность нонапептидных НСК и взаимодействие нонапептидных нейрогормонов (преимущественно вазотоцина) с тропными гормонами аденогипофиза обеспечивают сложные механизмы их влияния на репродуктивные процессы, стресс и “метаболические регуляторные пути” [6, 11]. Более того, многолетними сравнительными испытаниями эффективности гонадостимулирующего действия препаратов гипофиза и его изолированных передней и задней долей на половое созревание самок осетра, севрюги и ротана-головешки (Perccottus glenii) было установлено, что нонапептидные нейрогормоны в дозах, близких к физиологическим, тормозят, либо нарушают процесс овуляции, а их повышенные и запредельные дозы вызывают четкий антигонадотропный эффект. При этом длительная задержка процессов овуляции и резорбции половых продуктов производителей рыб в солоноватой среде “критической” солености (4–8‰) при нерестовых температурах также является эффектом повышенного содержания нонапептидных нейрогормонов в крови. Таким образом, ГГНС одновременно с пусковым нейротропным действием нонапептидных нейрогормонов в форме “миграционного импульса” участвует в запуске активации функций всех звеньев гипоталамо-гипофизарно-гонадной оси нейроэндокринных взаимоотношений.
Вазотоцин- и изотоцинергические рецепторы (типа V1) выявлены во многих органах рыб: гипофизе, почке, печени, яичнике, жабрах, сердце, мышцах, селезенке, боковой линии, мочевом пузыре, кишечнике [34, 41, 50]. Вазотоцин может напрямую участвовать в регуляции углеводного обмена, поскольку в гепатоцитах рыб имеются его рецепторы (V1), и было установлено, что нонапептидные нейрогормоны стимулируют гликогенолиз в печени форели и угря [11, 51]. Поэтому мы предполагаем, что именно этот (третий) метаболический эффект, генерализованный и пролонгированный, является ведущим физиологическим механизмом смены пластического “нагульного” обмена на энергетический репродукционный: миграционный и нерестовый [52].
Дальнейшие навигационные механизмы миграций обеспечиваются тесным взаимодействием ГГНС и люлиберинергических нейросекреторных центров, и ведущее значение каждого из них динамично меняется соответственно их функциональной роли в разные периоды этапа размножения [33, 53]. При этом эффект доминантного состояния возбуждения ЦНС “миграционный импульс” возможно и является триггером, включающим филогенетические навигационные механизмы видоспецифического воздействия геомагнитных полей на рецепторные системы и ЦНС, которые еще мало изучены [7, 15, 16]. В осуществлении чисто навигационных процессов: “ольфакторных” импринтинга и хоминга основную роль выполняют люлиберинергические (или гонадолиберинергические) нейросекреторные формации [5, 54, 55] (рис. 1). У рыб они представлены диффузными мелкоклеточными нейросекреторными скоплениями, которые локализованы вблизи обонятельных и зрительных структур мозга [24, 56] (рис. 1b): 1) – в ганглии терминального нерва между обонятельными луковицами и передним мозгом (Nucleus olfactorius) вблизи сосудистого органа концевой пластинки (СОКП, organum vasculosum laminae terminalis) ‒ “NOR”; 2) – в переднем перивентрикулярном ядре (N. anterior periventricularis) в преоптической области ‒ “NAP”; 3) – в области латерального ядра серого бугра гипоталамуса, в его передней части (N. lateralis tuberis anterior) ‒ “NLT”, а также в области покрышки среднего мозга (tegmentum) у костистых рыб ‒ “T”. Дифференцированное участие люлиберина установлено в разные периоды развития и размножения позвоночных [46, 58, 59]. Предполагается, что уже при переходе на активное питание у личинок рыб (кижуча и осетра) формируется импринтинг [7, 57]. Различия в динамике синтетической активности люлиберинергических НСК выявлены у мигрирующих на нерест нерки и кеты. Усиление синтеза в НСК из области обонятельного нерва (в NOR) происходит во время миграции рыб в низовьях рек, а смещение пика активности синтеза в преоптическую область ( NAP) наблюдается в период нереста на нерестилищах [7, 55]. Установлено, что в соответствии с биологической значимостью хемо- и фоторецепции гонадолиберин, синтезированный НСК в области обонятельного нерва, участвует в “навигационных” процессах импринтинга и хоминга, а синтезированный в преоптической области обеспечивает процессы полового созревания и нереста (III–V стадии зрелости гонад).
Таким образом, нонапептидергическая ГГНС выполняет ключевую роль в детерминации миграционного (социального) поведения, вызывая физиологический эффект, инициирующий нерестовые миграции рыб в форме “миграционного импульса”. Этот комплексный генерализованный и пролонгированный (“целенаправленный”) эффект – нейротропный, висцеротропный и метаболический – заключается в синхронном возбуждении поведенческих центров ЦНС, нарушении длительно адаптированного “нагульного” типа осмотической и ионной регуляции и перевода организма на энергетический, энергозатратный обмен путем снижения или прекращения антигонадотропного действия нонапептидных нейрогормонов. Причем доминантное состояние возбуждения ЦНС определяет последующие специализированные навигационные механизмы хоминга, геомагнитной и ольфакторной природы.
Одна из ведущих функций ГГНС заключается в генерализованном и пролонгированном действии ее нонапептидных нейрогормонов на органы-мишени, на которые они в малых дозах оказывают стимулирующее действие, а в больших ‒ тормозящее [9]. Физиологически дозированная секреция нонапептидных нейрогормонов и их функционально дифференцированные, специализированные пути выведения определяют их альтернативные влияния ‒ нейротропное и висцеротропное, особенно метаболическое, генерализованное и пролонгированное [3, 11]. Таким образом, функциональная роль ГГНС в осуществлении процесса миграции рыб заключается в инициировании (запуске стартовых) миграционных механизмов в форме “миграционного импульса”, комплексным синхронным эффектом возбуждения поведенческих центров в ЦНС, изменением осмотического равновесия, сменой пластического обмена на энергетический. В детерминации специализированных навигационных форм миграционного поведения важную роль играет сочетание поведенческих эффектов нонапептидных нейрогормонов, люлиберина, половых гормонов и комплекса энергозатратных нейротропных процессов, составляющих “сексуальную доминанту” [9]. Весь указанный механизм является основной причиной прогрессивного снижения степени эврибионтности проходных рыб в процессе нерестовых миграций и нереста как формы проявления биогенетического закона [4, 14].
Следует подчеркнуть, что важнейшие защитно-приспособительные реакции организма в целом направлены на сохранение постоянства его внутренней среды и в этом механизме функциональная роль ГГНС в поддержании водно-солевого гомеостаза имеет важнейшее значение. В эволюционно-морфологическом и эколого-физиологическом аспектах изучения миграционных механизмов особую важность имеют результаты опытов с “критической” соленостью 4–8‰ как пороговой среды важнейшего филогенетического значения. Критическая соленость является границей для созревания гамет морских и пресноводных организмов и, разделяя эти фауны, она определяет пределы физиологической устойчивости, важнейшие пороги, границы и градиенты их взаимоотношений с внешней средой [60]. Анализ состояния ГГНС у производителей рыб в этой среде, пороговой при миграциях, показал ее умеренную активацию, что в результате стимулирующего влияния малых количеств нонапептидергических нейрогормонов на функциональную активность эндокринных желез, вызывает эустресс с целым рядом положительных биостимулирующих эффектов.
ЗАКЛЮЧЕНИЕ
Таким образом, ГГНС в миграции рыб выполняет ведущую роль в качестве центрального нейроэндокринного звена механизма реверсии метаболизма − переводе организма с пластического типа обмена на энергетический. На основе применения метода “перекрестного” сопоставления экологически сходных, но генетически отдаленных форм (и наоборот), для выявления микро- и макроэволюционных механизмов и сопоставительного анализа собственных и литературных данных мы установили общность этого пускового адаптационного механизма у осетровых и лососевых. Его генерализованное действие имеет пролонгированный характер и выполняет детерминирующую роль в осуществлении процесса миграции рыб. Это позволяет рассматривать его как важнейшую филогенетическую адаптацию на уровне ароморфоза, направленную на достижение биологического прогресса вида [4]. Следствием этого основного механизма является последующий навигационный механизм хоминга высокой популяционной пластичности и, с учетом наличия стрэинга у проходных рыб, его можно рассматривать как специализацию микроэволюционного происхождения. Ведущий механизм участия ГГНС в осуществлении нерестовых миграций рыб представлен на рис. 5.
Рис. 5.
Основные пути нейроэндокринной регуляции процесса нерестовой миграции и принцип участия гипоталамо-гипофизарной нейросекреторной системы в инициировании размножения рыб. Пути выведения нонапептидных нейрогормонов:
I ‒ трансвентрикулярный путь (нейротропный эффект), II ‒ трансаденогипофизарный путь (аденогипофизотропный эффект ), III ‒ парааденогипофизарный путь: (висцеротропный эффект ). Обозначения: NPo ‒ преоптическое ядро, CNS ‒ центральная нервная система, NP-NH ‒ нонапептидные нейрогормоны.
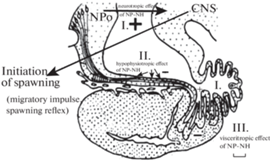
Таким образом, участие ГГНС в инициировании и регуляции миграционных процессов подтверждает гипотезу профессоров Н.Л. Гербильского и А.Л. Поленова о природе “миграционного импульса”.
Основной механизм участия и функциональная роль ГГНС в осуществлении размножения рыб как важнейшего для вида этапа онтогенеза могут быть раскрыты на основе эколого-гистофизиологического анализа ее участия также и в процессе нереста. Последующее обобщение результатов позволит представить их эволюционную значимость, определить перспективы и пути управления всеми этапами размножения и, в итоге, разработать их конкретные биотехнологические решения как завершение полносистемного исследования.
Список литературы
Blazquez M, Bosma PT, Frazer EJ, Van Look KJW, Trudeau VL (1998) Fish as models for the neuroendocrine regulation of reproduction and growth. Compar Biochem Physiol 119: 345–364. https://doi.org/10.1016/S0742-8413(98)00023-1
Bolis CL, Piccolella M, Dalla Valle AZ, Rankin JC (2001) Fish as model in pharmacological and biological research. Pharmacol Res 44: 265–280. https://doi.org/10.1006/phrs.2001.0845
Garlov PE (2005) Plasticity of nonapeptidergic neurosecretory cells in fish hypothalamus and neurohypophysis. Int Rev Cytol 245: 123–170. https://doi.org/10.1016/S0074-7696(05)45005-6
Гербильский НЛ (1965) Биологическое значение и функциональная детерминация миграционного поведения рыб. В сб Биологическое значение и функциональная детерминация миграционного поведения животных. Наука 23–32. [Gerbilsky NL (1965) Biological significance and functional determination of migratory behavior of fish. In Biological significance and functional determination of fish migratory behavior. Nauka 23–32. (In Russ). https://www.alib.ru/au-/nm-biologicheskoe_znachenie_funkcionalnmnnaya_determinaciya_migr
Zohar Y, Muñoz-Cueto JA, Elizur A, Kah O (2010) Neuroendocrinology of reproduction in teleost fish. Gen Comp Endocrinol 165 (3): 438–455. https://doi.org/10.1016/j.ygcen.2009.04.017
Zohar Y (2020) Fish reproductive biology – Reflecting on five decades of fundamental and translational research. Gen Comp Endocrinol 300: 113544. https://doi.org/10.1016/j.ygcen.2020 113544
Ueda H (2012) Physiological mechanisms of imprinting and homing migration in Pacific salmon Oncorhynchus spp. J Fish Biol 81 (2): 543–558. https://doi.org/10.1111/j.1095-8649.2012.03354.x
Blanco AM (2020) Hypothalamic- and pituitary-derived growth and reproductive hormones and the control of energy balance in fish. Gen Comp Endocrinol 287: 113322. https://doi.org/10.1016/j.ygcen.2019.113322
Поленов АЛ, Константинова МС, Гарлов ПЕ (1993) Гипоталамо-гипофизарный нейроэндокринный комплекс. Основы современной физиологии (нейроэндокринология). Наука кн. 1 ч. 1: 139–187. [Polenov AL, Konstantinova MS, Garlov PE (1993) Hypothalamic-hypophysial neuroendocrine complex. Fundamentals of modern physiology (neuroendocrinology)]. Nauka K1 C 1: 139–187. (In Russ).
Warne JM, Harding KE, Balment RJ (2002) Neurohypophysial hormones and renal function in fish and mammals. Comp Biochem Physiol B Biochem Mol Biol 132: 231–237. https://doi.org/10.1016/S1096-4959(01)00527-9
Balment RJ, Lu W, Weybourne E, Warne JM (2006) Arginine vasotocin a key hormone in fish physiology and behaviour: a review with insights from mammalian models. Gen Compar Endocr 147(1): 9–16. https://doi.org/10.1016j.ygcen.2005.12.022
Яковлева ИВ (2000) Нейроэндокринологические аспекты раннего онтогенеза круглоротых и рыб. СПб. ООО Петрополис. [Yakovleva IV (2000) Neuroendocrinological aspects of early ontogenesis of cyclostomata and fish. SPb. OOO Petropolis. (In Russ)]. https://www.libex.ru/detail/book444313.html
Баранникова ИА (1975) Функциональные основы миграций рыб. Наука. СПб. [Barannikova IA (1975) Functional bases of fish migrations. Nauka. Spb]. (In Russ)].
Гарлов ПЕ, Кузик ВВ (2008) Нейроэндокринная регуляция размножения рыб. Аграф. CПб. [Garlov PE, Kuzik VV (2008) Neuroendocrine regulation of fish reproduction. Agraf. SPb. (In Russ)].
Lohmann KJ, Putman NF, Lohmann CM (2008) Geomagnetic imprinting: A unifying hypothesis of long-distance natal homing in salmon and sea turtles. Proc Natl Acad Sci U S A 105 (49):19096–19101. https://doi.or/10.1073/pnas.0801859105
Putman NF, Jenkins ES, Michielsens CG, Noakes DL (2014) Geomagnetic imprinting predicts spatio-temporal variation in homing migration of pink and sockeye salmon. J Royal Soc Interf 11 (99): 1–10. https://doi.org/10.1098/rsif.2014.0542
Makino K, Onuma TA, Kitahashi T, Ando H, Ban M, Urano A (2007) Expression of hormone genes and osmoregulation in homing chum salmon: a minireview. Gen Comp Endocr 152 (2): 304–309. https://doi.org/10.1016/j.ygcen.2007.01.010
Ueda H (2019) Sensory mechanisms of natal stream imprinting and homing in Oncorhynchus spp. J Fish Biol 95: 293–303. https://doi.org/10.1111/jfb.13775
Микодина ЕВ, Седова МА, Чмилевский ДА, Микулин АЕ, Пьянова СВ, Полуэктова ОГ (2009) Гистология для ихтиологов. Опыт и советы ВНИРО: 112. [Mikodina EV, Sedova MA, Chmilevsky DA, Mikulin AE, Pyanova SV, Poluektova OG (2009) Histology for ichthyologists. Experience and advice. VNIRO: 112. (In Russ)].
Хериет ЭР, Гаттер КС (1999) Молекулярная клиническая диагностика. М. Мир. 20–65. [Heriot ER, Gutter KS (1999) Molecular clinical diagnostics. M. Mir. 20–65. (In Russ)].
Миронов АА, Комиссарчик ЯЮ, Миронов ВА (1994) Методы электронной микроскопии в биологии и медицине. Наука. [Mironov AA, Komissarchik YYu, Mironov VA (1994) Methods of electron microscopy in biology and medicine. Nauka. (In Russ)].
Griffiths (2004) The Use of ElectronMiccroscopy in Cell Biology. MCB: 68.
Polenov AL, Garlov PE (1971) The hypothalamo-hypophysial system in Acipenseridae. I. Ultrastructural organization of large neurosecretory terminals (Herring bodies) and axoventricular contacts. Z Zellforsch 116: 349–374.
Parhar IS, Satoshi O, Tomohiro H, Yasuo S (2003) Single-Cell Real-Time Quantitative Polymerase Chain Reaction of Immunofluorescently Identified Neurons of Gonadotropin-Releasing Hormone Subtypes in Cichlid Fish. Endocrinology 144 (8): 3297–3300. https://doi.org/10.1210/en.2003-0386
Ota Y, Ando H, Ban M, Urano A (1996) Sexually different expression of neurohypophysial hormone genes in the preoptic nucleus of pre-spawning chum salmon. Zool Sci 13 (4): 593–601. https://doi.org/10.2108/zsj.13.593
Urano A, Ando H (2003) Quantitative analyses of the levels of hormonal mRNAs in the salmon neuroendocrine system. Aquatic Genomics. Springer. Tokyo. 225–235. https://doi.org/10.1007/978-4-431-65938-9_20
Hiraoka S, Ando H, Ban M, Ueda H, Urano A (1997) Changes in expression of neurohypophysial hormone genes during spawning migration in chum salmon, Oncorhynchus keta. J Mol Endocrinol 18: 49–55. https://doi.org/10.1677/jme.0.0180049
Гарлов ПЕ, Поленов АЛ (1996) Функциональная цитоморфология преоптико-гипофизарной нейросекреторной системы рыб. Цитология 38 (3): 275–299. [Garlov PE, Polenov AL (1996) Functional cytomorphology of the preoptico-hypophysial neurosecretory system of fish. Cytology 38 (3): 275–299. (In Russ)]. https://elibrary.ru/item.asp?id=14933591
Polenov AL, Pavlovich M, Garlov PE (1972) Preoptic Nucleus and Neurohypophysis in Sturgeons (Acipenser güldenstädti Brandt) at Different stages of their Life Cycle and in experiments. Gen Compar Endocrinol 18: 617. https://doi.org/10.1016/0016-6480(72)90040-8
Goodson JL, Bass AH (2001) Social behavior functions and related anatomical characteristics of vasotocin/vasopressin systems in vertebrates. Brain Res Rev 35: 246–265. https://doi.org/10.1016/S0165-0173(01)00043-1
Godwin J, Thompson R (2012) Nonapeptides and social behavior in fishes. Horm Behav 61: 230–238. https://doi.org/10.1016/j.yhbeh.2011.12.016
Munakata A, Kobayashi M (2010) Endocrine control of sexual behavior in teleost fish. Gen Comp Endocrinol 165(3):456–468. https :// doi: PMID: 19393660https://doi.org/10.1016/j.ygcen.2009.04.011
Foran CM, Bass AH (1999) Preoptic GnRH and AVT: axes for sexual plasticity in teleost fish. Gen Comp Endocrinol 116: 141–152. https://doi.org/10.1006/gcen.1999.7357
Gozdowska M, Kleszczyñska A, Sokołowska E, Kulczykowska E (2006) Arginine vasotocin (AVT) and isotocin (IT) in fish brain: diurnal and seasonal variations. Comp Biochem Physiol 143: 330–334. https://doi.org/10.1016/j.cbpb.2005.12.004
Maximino C, Lima MG, Oliveira KR, Batista E de J, Herculano AM (2013) “Limbic associative” and “autonomic” amygdala in teleosts: a review of the evidence. J Chem Neuroanat 48–49: 1–13. https://doi.org/10.1016/j.jchemneu.2012.10.001
Rodriguez-Santiago M, Nguyen J, Winton LS, Weite-kamp CA, Hofmann HA (2017) Arginine Vasotocin Preprohormone Is Expressed in Surprising Regions of the Teleost Forebrain. Front Endocrinol (Lausanne) 14(8):195. https://doi.org/10.3389/fendo.2017.00195
Almeida O, Oliveira RF (2015) Social Status and Arginine Vasotocin Neuronal Phenotypes in a Cichlid Fish. Brain Behav Evol 85(3):203–213. https://doi.org/10.1159/000381251
Greenwood AK, Wark AR, Fernald RD, Hofmann HA (2008) Expression of arginine vasotocin in distinct preoptic regions is associated with dominant and subordinate behaviour in an African cichlid fish. Proc Biol Sci 275(1649):2393–2402. https://doi.org/10.1098/rspb.2008.0622
Newman SW (1999) The medial extended amygdala in male reproductive behavior. A node in the mammalian social behavior network. Ann NY Acad Sci 877: 242–257. https://doi.org/10.1111/j.1749-6632.1999.tb09271.x
Lema SC (2010) Identification of multiple vasotocin receptor cDNAs in teleost fish: sequences, phylogenetic analysis, sites of expression, and regulation in the hypothalamus and gill in response to hyperosmotic challenge. Mol Cell Endocrinol 321(2): 215–230. https://doi.org/10.1016/j.mce.2010.02.015
O’Connell LA, Hofmann HA (2012) Evolution of a vertebrate social decision-making network. Science 336(6085): 1154–1157. https://doi.org/10.1126/science.1218889
Kulczykowska E (2007) Arginine vasotocin and isotocin: towards their role in fish osmoregulation. Fish Osmoregulation (Enfield, NH: Sci Publ): 151–176. https://doi.org/10.1201/9780429063909-6
Saito D, Ota Y, Hiraoka S, Hyodo S, Ando H, an Urano K (2001) Effect of Oceanographic Environments on Sexual Maturation, Salinity Tolerance, and Vasotocin Gene Expression in Homing Chum Salmon. Zool Sci 18 (3): 389–396. https://doi.org/10.2108/zsj.18.389
Olson KR (2002) Gill circulation: regulation of perfusion distribution and metabolism of regulatory molecules. J Exp Zool 293: 320–335. https://doi.org/10.1002/jez.10126
Marshall WS (2003) Rapid regulation of NaCl secretion by estuarine teleost fish: coping strategies for short-duration fresh water exposures. Biochim Biophys Acta (BBA)—Biomembranes 1618: 95–105. https://doi.org/10.1016/j.bbamem.2003.10.015
Guibbolini ME, Avella M (2003) Neurohypophysial hormone regulation of Cl- secretion: evidence for V receptors in sea bass gill respiratory cells in culture. J Endocrinol 176(1): 111–119. https://doi.org/10.1677/joe.0.1760111
Pierantoni R, Cobellis G, Meccariello R, Fasano S (2002) Evolutionari aspects of cellular communication in the vertebrate hypothalamo-hypophysio-gonadal axis. Internat Rev Cytol 218: 69–141. https://doi.org/10.1016/s0074-7696(02)18012-0
Saito D, Hasegava Y, Urano K (2003) Gonadotropin-releasing hormone modulate electrical activity of vasotocin and isotocin neurons in the brain of rainbow trout. Neurosci Lett 351: 107–110. https://doi.org/10.1016/j.neulet.2003.08.017
Hasunuma I, Toyoda F, Okada R, Yamamoto K, Kadono Y, Kikuyama S (2013) Roles of arginine vasotocin receptors in the brain and pituitary of submammalian vertebrate. Int Rev Cell Mol Biol 304: 191–225. https://doi.org/10.1016/B978-0-12-407696-9.00004-X
Gozdowska M, Ślebioda M, Kulczykowska E (2013) Neuropeptides isotocin and arginine vasotocin in urophysis of three fish species. Fish Physiol Biochem 39: 863–869. https://link.springer.com/article/10.1007%2Fs10695-012-9746-6
Guibbolini ME, Pierson PM, Lahlou B (2000) Neurohypophysial hormone receptors and second messengers in trout hepatocytes. J Endocrinol 167: 137–144. https://doi.org/10.1677/joe.0.1670137
Shahjahan Md, Kitahashi T, Parhar IS (2014) Central pathways integrating metabolism and reproduction in teleosts. Front Endocrinol (Lausanne) 5:36. https://doi.org/10.3389/fendo.2014.00036
Rose JD, Moore FL (2002) Behavioral neuroendocrinology of vasotocin and vasopressin and the sensorimotor processing hypothesis. Neuroendocrinology 23: 317–341. https://doi.org/10.1016/S0091-3022(02)00004-3
Soma KK, Francis RC, Wingfield JC, Fernald RD (1996) Androgen regulation of hypothalamic neurons containing gonadotropin-releasing hormone in a cichlid fish – integration with social cues. Horm Behav 30 (3): 216–226. https://doi.org/10.1006/hbeh.1996.0026
Kudo H, Hyodo S, Ueda H, Hiroi O, Aida K, Urano A, Yamauchi K (1996) Cytophysiology of gonadotropin-releasing-hormone neurons in chum salmon (Oncorhynchus keta) forebrain before and after upstream migration. Cell Tiss Res 284 (2): 261–267. https://doi.org/10.1007/s004410050586
Anglade J, Landbergen T, Kah O (1993) Origin of the pituitary innervation in the goldfish. Cell Tissue Res 273 (2): 345–355. https://pubmed.ncbi.nlm.nih.gov/23885385
Ueda H (2011) Physiological mechanism of homing migration in Pacific salmon from behavioral to molecular biological approaches. Gen Comp Endocrinol 170(2):222–232. https://doi.org/10.1016/j.ygcen.2010.02.003
Onuma TA, Makino K, Ando H, Ban M, Fukuwaka MA, Azumaya T, Urano A (2010) Expression of GnRH genes is elevated in discrete brain loci of chum salmon before initiation of homing behavior and during spawning migration. Gen Comp Endocrinol 168(3): 356–368. https://doi.org/10.1016/j.ygcen.2010.05.001
Boiko NE (2003) Hexachloran and oil contaminations alters memorisation of odors in sturgeon, Acipenser güldenstädtii Brandt. J Envir Protect Ecol 4 (1): 134–140.
Хлебович ВВ (1974) Критическая соленость биологических процессов. Наука. [Khlebovich VV (1974) Critical salinity of biological processes. Nauka. (In Russ)].
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


