Журнал эволюционной биохимии и физиологии, 2022, T. 58, № 6, стр. 567-579
СИНХРОНИЗИРОВАННАЯ АКТИВНОСТЬ ОКСИДОРЕДУКТАЗ В ОТДЕЛАХ МОЗГА И КАМЕРАХ СЕРДЦА Scorpaena porcus Linnaeus, 1758 ПРИ ОСТРОЙ ГИПОКСИИ
Е. Э. Колесникова 1, *, И. В. Головина 1, А. А. Солдатов 1, Т. В. Гаврюсева 1
1 Институт биологии южных морей им. А.О. Ковалевского РАН
Севастополь, Россия
* E-mail: dr-kolesnikova@mail.ru
Поступила в редакцию 07.07.2022
После доработки 14.09.2022
Принята к публикации 27.09.2022
- EDN: EZQTSR
- DOI: 10.31857/S0044452922060055
Аннотация
Проведено сравнение активности оксидоредуктаз энергетического метаболизма – малатдегидрогеназы (МДГ, 1.1.1.37) и лактатдегидрогеназы (ЛДГ, 1.1.1.27) в отделах мозга – продолговатом мозге (ПМ) и переднем, промежуточном, среднем мозге (СППМ) и камерах сердца – предсердии и желудочке черноморской скорпены в условиях острой гипоксии (0.9–1.2 мг O2 л–1, 90 мин). В мозге и сердце активность МДГ была существенно выше ЛДГ (р < 0.05), что характерно для оксифильных тканей. Активность МДГ ПМ и предсердия оказалась выше таковой в СППМ и желудочке соответственно. При острой гипоксии отмечались специфические сдвиги энергетического метаболизма в структурах мозга и сердца в виде двух паттернов изменения активности оксидоредуктаз. При гипоксии в ПМ и предсердии активность МДГ существенно уменьшалась (р < 0.05). В СППМ и желудочке сердца отмечалась выраженная активация ЛДГ (р < 0.05). Предполагается, что сходство метаболических реакций ПМ и предсердия определяется функционированием встроенных в них механизмов генерации респираторного и сердечного ритма, связанных с регулируемыми цАМФ (производным АТФ) HCN-каналами. При нормоксии интенсивные электрические осцилляции ПМ и предсердия требуют высоких энергозатрат, которые обеспечиваются за счет аэробного гликолиза; при гипоксии падение синтеза АТФ способствует инактивации HCN-каналов и переключению дыхательной и сердечной функции в выгодный для выживания скорпены режим супрессии. При кислородном голодании переход к анаэробному гликолизу в СППМ и желудочке сердца скорпены обеспечивает прежде всего сохранение их целостности.
Состояние кислородной недостаточности или гипоксии (кислородного голодания) нередко возникает в результате воздействия на организм различных факторов и сопутствует многим заболеваниям человека [1], включая ишемические поражения сердца, головного мозга, формирование полиорганной недостаточности при ДВС–синдроме (синдром диссеминированного внутрисосудистого свертывания) и другие [2]. Распространенность гипоксии при патологических состояниях вынуждает искать пути преодоления кислородной недостаточности путем изучения особенностей синтеза АТФ в различных органах и тканях при снижении РО2.
В частности, одним из таких путей борьбы с гипоксией является поиск маркеров устойчивости к кислородному голоданию, что предполагает филогенетический подход к изучению адаптационных механизмов в систематических группах позвоночных с разным происхождением. Сравнительные филогенетические исследования при подходе pars pro toto вносят значительный вклад в понимание функционирования отдельных органов [1]. В последнее время костистые рыбы представляют собой выдающуюся модель для биологических исследований, поскольку являются обитателями подверженных эпизодам выраженной гипоксии водных экосистем и обладают определенной степенью устойчивости к кислородному голоданию. Одно из наиболее разительных различий между животными, толерантными к гипоксии, и животными, не переносящими гипоксию, заключается в способности последних поддерживать энергетический статус мозга и сердца в условиях ограниченного запаса энергии. Устойчивые к гипоксии позвоночные животные становятся уникальным объектом исследования и источником информации о механизмах выживания при кислородном голодании; подобную информацию невозможно получить при моделировании гипоксических состояний различного генеза у млекопитающих, которые не обладают такой степенью приспособления к гипоксии/аноксии [3, 4]. Несмотря на очевидные фундаментальные различия между костистыми рыбами и человеком, существует высокий уровень генетической консервации базовых физиологических механизмов [5]. Следовательно, данные о механизмах, обеспечивающих устойчивость к дефициту кислорода в разных таксономических группах животных, могут оказаться чрезвычайно полезными при разработке новых методов лечения заболеваний, связанных с фактором гипоксии [1, 6].
Оксидоредуктазы – малатдегидрогеназа (MDH, L-малат: NAD-оксидоредуктаза, EC 1.1.1.37) и лактатдегидрогеназа (LDH, L-лактат: NAD-оксидоредуктаза, EC 1.1.1.27) принимают непосредственное участие в производстве энергии, регулируют окислительно-восстановительный потенциал клеток и служат маркерами окислительной и гликолитической емкости энергетического обмена. Любое изменение гидрохимических характеристик водной среды обитания, в первую очередь PwO2, вызывает сдвиги между аэробными и анаэробными путями энергетических метаболических процессов, в которых участвуют оксидоредуктазы. Реакции гликолиза, которые обеспечивают оксидоредуктазы, являются неотъемлемой частью механизмов адаптации к гипоксии, а также составляют О2-зависимую ферментную систему энергетического метаболизма, используемую для проведения исследований [7].
Черноморский морской ерш (скорпена) – бентосный, использующий стратегию “sit-and-wait” хищник-засадчик, который характеризуется особой толерантностью к ряду стрессорных факторов, включая дефицит кислорода. Скорпена способна переживать гипоксию с нижней границей 0.35 мг О2/л в течение 4 ч [8] и условия аноксии в течение 20–30 мин [9]. Поскольку выживание рыб в водной среде с достаточно низким PwO2 напрямую связано с поддержанием метаболической и функциональной активности жизненно важных органов – головного мозга и сердца, особый интерес представляет выяснение особенностей биохимической стратегии энергетического метаболизма мозга и сердца устойчивой к гипоксии скорпены. Испытывающие повышенную потребность в O2 отдельные структуры мозга и сердца костистых рыб существенно различаются по происхождению, цитоархитектонике и специфике кровоснабжения (артериального или венозного), что может проявляться в их метаболической активности.
Ранее нами уже описывались особенности энергетических процессов мозга и сердца скорпены при гипоксии [10, 11]. Поскольку существует представление о подобии энергетического обмена тканей мозга и сердца костистых рыб [12, 13], то целью настоящего исследования было сопоставление активности оксидоредуктаз в отделах мозга и сердца скорпены в условиях острой гипоксии.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование проводилось в соответствии с принципами Базельской декларации и рекомендациями комитета по этике Института биологии южных морей им. А.О. Ковалевского РАН (протокол № 28 от 15.02.2018).
Объектом исследования послужили взрослые особи морского ерша Scorpaena porcus Linnaeus, 1758 (Scorpaenidae) в летний период (16 экз., длина тела – 12–17 см, масса тела – 70–130 г). Рыбу отлавливали в июле–августе ставным неводом и доставляли в лабораторию в пластиковых баках (объем 60 л) с аэрацией. Для снятия стресса после транспортировки ершей содержали одну неделю в проточном аквариуме, в работе использовали только подвижных и активно питающихся особей.
Эксперименты проводили в специально разработанной камере при температуре воды 21 ± 0.5°С [7]. Рыб содержали при концентрации кислорода в воде 5.6–6.7 мг O2 л–1 (нормоксия). После адаптации к этим условиям (24 ч) концентрацию кислорода в воде снижали в течение 15–20 мин до 0.9‒1.2 мг O2 л–1 путем прокачивания азота. Экспозиция особей к условиям гипоксии составляла 90 мин, содержание кислорода в воде контролировали с помощью оксиметра ELWRO PRL T N5221 (Польша).
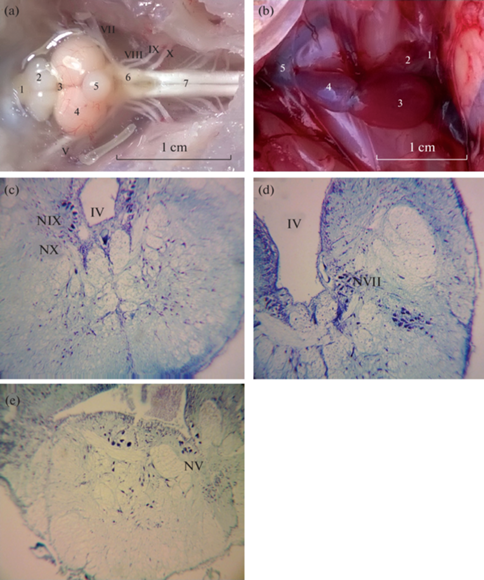
По окончанию эксперимента сразу после декапитации рыб выделяли образцы тканей мозга в виде продолговатого мозга (ПМ) и передних отделов – среднего, промежуточного, переднего мозга (СППМ) массой 0.030 ± 0.002 и 0.107 ± 0.011 г соответственно (рис. 1а). Сердце скорпены разделяли на предсердие (0.061 ± 0.012 г) и желудочек (0.143 ± ± 0.012 г) (рис. 1b). Препарирование тканей, гомогенизацию и центрифугирование проводили при охлаждении (0 ± 4°С). Полученные ткани до биохимических анализов хранили при температуре –80°С в морозильной камере (Farma 900 Series, Termo Scientific, США).
Рис. 1.
Мозг и сердце Scorpaena porcus. a – общий вид мозга (дорсальная поверхность): 1 – обонятельная луковица, 2 – передний мозг, 3 – промежуточный мозг, 4 – средний мозг, 5 – мозжечок, 6 – продолговатый мозг, 7 – спинной мозг. Черепно-мозговые нервы: V – тройничный нерв, VII – лицевой нерв, VIII – слуховой нерв, IX – языкоглоточный нерв, X – блуждающий нерв. b – общий вид сердца: 1 – венозный синус, 2 – предсердие; 3 – желудочек; 4 – луковица аорты, 5 – брюшная аорта. c, d, e – ядра черепно-мозговых нервов продолговатого мозга скорпены (окраска по Нисслю): NIX – языкоглоточного (IX) нерва, NX – блуждающего (X) нерва, NVII – лицевого (VII) нерва, NV – тройничного (V) нерва. IV – четвертый желудочек мозга.
Активность ЛДГ и МДГ измеряли спектрофотометрически (СФ-2000 ОКБ “Спектр”, Россия) в кварцевой кювете c ходом луча 10 мм, объемом 3 мл при длине волны 340 нм по скорости окисления восстановленной формы кофермента НАДН, используя в качестве среды выделения 0.2 М Трис-HCl буфер, рН 7.5 [14]. Реакцию начинали внесением экстракта и снимали отсчеты через 30 с в течение 2–3 мин. Субстратом для определения активности ЛДГ служил пируват, для МДГ – оксалоацетат. Активность МДГ и ЛДГ определяли при температуре инкубации реакционной смеси 25°C. Удельную активность ферментов выражали в мкмолях НАДН мин–1 мг–1 белка супернатанта. Содержание белка определяли микробиуретовым методом, экстинкцию измеряли при длине волны 330 нм. В качестве стандарта для построения калибровочной кривой использовали препарат кристаллического сывороточного альбумина. Результаты представлены как M ± m, достоверность различий средних оценивали по t-критерию Стьюдента, различия считали значимыми при p < 0.05. Статистическую обработку и графическое оформление полученной информации проводили при помощи стандартного программного обеспечения Microsoft Excel.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Нормоксия. Максимальная активность МДГ была зафиксирована в ПМ, что было на 39% выше ее активности в СППМ, однако различия не были статистически достоверны (рис. 2). Активность ЛДГ в отделах мозга была практически одинакова (2.3 vs 2.8 мкмоль НАДН2 мин–1 мг–1 белка) и ниже по сравнению с МДГ в 3.5 раза в ПМ (p < 0.05) и в 1.7 раза – в СППМ (p > 0.05). Отмечалась тенденция к большей величине индекса МДГ/ЛДГ в ПМ (рис. 3).
Рис. 2.
Активность оксидоредуктаз в отделах мозга и камерах сердца Scorpaena porcus. Светлые столбики – нормоксия, темные столбики – гипоксия; 1 – активность МДГ; 2 – активность ЛДГ; MB – продолговатый мозг; FDMB – передние отделы мозга (передний, промежуточный, средний мозг; Atrium – предсердие; Ventricle – желудочек. Различия достоверны, р < 0.05: * нормоксия vs. гипоксия; Δ – активность МДГ vs. активность ЛДГ; ▲ – МВ vs. FDMB; # – предсердие vs. желудочек.

Рис. 3.
Индекс МДГ/ЛДГ в отделах мозга и камерах сердца Scorpaena porcus. Обозначения как на рис. 2.
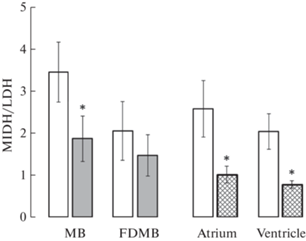
В предсердии скорпены зарегистрирована самая высокая активность МДГ, что на 28% выше, чем в желудочке сердца. Вместе с тем найденные различия не имели статистической значимости (рис. 2). Существенных различий между отделами миокарда по активности ЛДГ (2.5 vs 2.3 мкмоль НАДН2 мин–1 мг–1 белка) и величине индекса МДГ/ЛДГ (2.57 vs 2.03) не выявлено (рис. 3).
Гипоксия. Активность МДГ в ПМ снизилась в 1.6 раза (p < 0.05), в СППМ – в 1.5 раза (рис. 2). Одновременно активность ЛДГ имела некоторую тенденцию к увеличению в ПМ и вдвое возросла в СППМ (p < 0.05). Индекс МДГ/ЛДГ уменьшился в 1.8–1.4 раза относительно нормоксических показателей в ПМ (p < 0.05) и СППМ соответственно (рис. 3).
Острая гипоксия вызвала снижение активности МДГ в предсердии в 2.4 раза (p < 0.05), активность ЛДГ сохранилась на прежнем уровне, в результате индекс МДГ/ЛДГ уменьшился в 2.5 раза (p < 0.05) (рис. 3).
Напротив, в желудочке сердца активность МДГ незначительно снизилась, в то время как активность ЛДГ достоверно увеличилась в 2.2 раза (p < < 0.05) (рис. 2). Таким образом, активность ЛДГ в желудочке вдвое превысила таковую в предсердии (p < 0.05). Величина индекса МДГ/ЛДГ в желудочке уменьшилась в 2.6 раза (p < 0.05) (рис. 3).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Как упоминалось выше, ткани мозга и сердца рыб имеют сходный энергетический потенциал, позволяющий синхронизировать интенсивность их аэробного и анаэробного метаболизма [12, 13]. Безусловно, уровень активности оксидоредуктаз мозга и сердца скорпены в целом определялся рамками парадигмы синхронизации метаболизма двух жизненно важных органов. Вместе с тем оказалось, что разные компартменты этих органов отличались своеобразными чертами производства энергии.
Как известно, мозг костистых рыб состоит из последовательно расположенных структур, типичных для большинства позвоночных [15, 16] – переднего, промежуточного, среднего (СППМ), заднего (включает мозжечок; в отличие от птиц и млекопитающих у костистых рыб нет моста) и продолговатого мозга (ПМ). ПМ обеспечивает базовые кардиореспираторные рефлексы (моторные ядра VII, IX, X ЧМН, рис. 1b, c, e). Составляющие СППМ структуры включают центры обоняния, зрения, слуха и осуществляют интегрирование и регуляцию функций организма, обеспечивают обучение, координируют сложные движения.
Организация ЦНС описывается эволюционной, сегментарной, онтогенетической, эмбриологической, геномной моделями [17], которые подразумевают определенную гетерогенность мозга. Как известно, морфогенез мозга осуществляется согласно обширной генетической программе, включающей подпрограмму регионализации мозга [18]. В эмбриональном периоде в зачатке ЦНС – нервной трубке – у хордовых [19], включая костистых рыб [20], отмечается дополнительно поперечно-сегментированная организация. При такой форме организации вся нервная трубка делится продольно и поперечно на множество более мелких доменов, в которых большое количество регулирующих развитие мозга генов, включая многие гомеобокс-гены (НОХ гены), ограниченно экспрессируются по региональному шаблону [20]. Такая архитектура мозга с элементами региональной организации по целому ряду признаков позволяет считать этот орган сложным гетерогенным образованием, что может проявляться в особенностях энергетического метаболизма функциональных локусов и структур.
Все изученные нами структуры мозга скорпены в целом характеризовались достаточно близким уровнем активности МДГ, которая была существенно выше активности ЛДГ, что согласуется с полученными ранее результатами [10, 11]. Преобладание активности МДГ над ЛДГ является характерной чертой оксифильных тканей [21]. Вместе с тем повышенная активность МДГ в ПМ по сравнению с СППМ может указывать на степень интенсивности его энергетического метаболизма. ПМ содержит элементы механизма генерации респираторного ритма (respiratory rhythm generator, RRG. RRG состоит из двух взаимодействующих осцилляторов – полоски нейронов, представленной моторными ядрами лицевого (VII), языкоглоточного (IX) и блуждающего (X) ЧМН [22], и паратригеминальной респираторной группой (pTRG), связанной с ядром тройничного (V) ЧМН [23, 24]. RRG формирует эфферентные респираторные команды к мышцам черепа, челюстей, жаберных дуг, сокращение которых обеспечивает всасывание и проталкивание воды через буккальную полость и жаберный аппарат рыб. Кажется очевидным, что интенсивные осцилляции нейронов RRG могут нуждаться в более существенных энергозатратах по сравнению со структурами СППМ.
Следует отметить, что все изучаемые образцы мозга скорпены характеризовались практически одинаковым уровнем активности ЛДГ. Причем активность ЛДГ тканей мозга по своей величине была близка к активности ЛДГ белых мышц скорпены [25], энергообеспечение сокращений которых осуществляется за счет образуемой преимущественно анаэробным путем АТФ [26]. Аналогичное сходство свойств изоформ ЛДГ мозга и мышц с высоким сродством к пирувату было найдено у устойчивой к дефициту кислорода цихласомы Cichlasoma amazonarum, что позволяет ей выживать в условиях среды с хронической гипоксией [27], обеспечивая различные паттерны “оборонительной стратегии” тканей мозга.
Величина активности ЛДГ в структурах мозга скорпены свидетельствует об адаптированности к условиям ограниченного доступа к кислороду (так называемая “анаэробизация” [11]) путей энергетического метаболизма и отражает определенный потенциал адаптационных механизмов, направленный на немедленную компенсацию дефицита энергии даже при незначительном изменении РwО2. Признаки подобного приспособления мозга скорпены могут быть напрямую связаны с исходно ограниченным кровоснабжением мозга костистых рыб (менее 1% общего кровотока) [28]. Данный факт более чем скромного кровоснабжения также может сближать энергетический метаболизм мозга рыб с белыми мышцами, обладающими низкой плотностью капиллярной сети и, как следствие, значительными диффузионными расстояниями [25, 29], что заставляет их создавать запасы гликогена [30]. Высокие концентрации гликогена в глиальных клетках в качестве ближайшего источника глюкозы считают характерной чертой зачастую испытывающих периоды гипогликемии либо ишемии видов [31]. В частности, наличие депонированного гликогена позволяют мозгу карася увеличить свою устойчивость к дефициту кислорода приблизительно в 150 раз [32]. Таким образом, “анаэробизация” мозга костистых рыб, включая скорпену, по сравнению с высшими позвоночными является приспособительным механизмом оксифильного мозга в водной среде с ограниченной доступностью кислорода. Вместе с тем, по-видимому, отдельные компартменты мозга скорпены могут характеризоваться разной степенью “оксифильности” и уязвимости к кислородному голоданию, которая определяется целым набором факторов.
Несмотря на характерную для малоподвижных придонных видов рыб “аваскулированную/венозную” разновидность сердца, не предполагающую артериального коронарного кровоснабжения [33], сердце скорпены обладает сходными с мозгом значениями активности оксидоредуктаз в виде более высокой активности МДГ vs. ЛДГ [10]. Одновременно при общем подобии энергетического метаболизма мозга и сердца, камеры последнего – предсердие и желудочек - также имели свои отличительные черты.
Сердце позвоночных является эволюционно “старым” органом [30, 34]. Как известно, оно представляет собой сильно модифицированный мышечный сосуд, состоящий из многочисленных клеточных линий [34, 35]. В процессе эмбриогенеза “сигнальные” молекулы ретиноевой кислоты устанавливают предсердную “идентичность” заднего конца сердечной трубки [36], тем самым передавая информацию о позиционировании трубки по переднезадней оси к генам, вызывающим специфическое развитие данной камеры. Развитие и формирование сердца как органа регулируется основным набором эволюционно консервативных факторов транскрипции (NK2, MEF2, GATA, Tbx, Hand), которые контролируют “судьбу” клеток сердца, экспрессию кодирующих сократительные белки генов и морфогенез сердечных структур [35]. Эволюция сердца обусловливает его неоднородность [37], которая проявляется электрической и механической гетерогенностью, нарастающей по мере усложнения конструкции сердца и предусматривающей многообразие механизмов реагирования на различные стимулы.
Так же как в мозге особенностью камер сердца скорпены оказалась различная интенсивность активности МДГ при одинаковой активности ЛДГ [10]. С одной стороны, несмотря на ведущую функциональную роль желудочка активность МДГ в нем была заметно ниже таковой в предсердии. Такого рода тренд активности МДГ желудочка, по-видимому, с одной стороны, может быть обусловлен его специфической цитоархитектоникой и связанным с ней исключительно венозным кровоснабжением. У костистых рыб предсердие отличается относительно тонкой трабекулированной стенкой по сравнению с толстой стенкой желудочка, включающей большое количество межтрабекулярных пространств (трабекулярных полостей, лакун) [38]. Подобная сложная организация миокарда позволяет каждой отдельной лакуне функционировать по принципу “много маленьких сердец” в границах “большого” желудочка [39], что предполагает высокую вариабельность РvО2 либо наличие отрицательного градиента РvO2 по мере удаления от основного просвета камеры до конечных участков лакун при замедлении кровотока. Девиации РvO2 могут оказать влияние на “предпочтение” активности отдельных оксидоредуктаз в поддержании эффективного энергетического метаболизма отделов сердца. В случае скорпены снижение значимости МДГ, по-видимому, обусловлено ограниченной доступностью кислорода в венозной крови, перфузирующей сложный лакунарный рельеф внутренней поверхности желудочка. С другой стороны, более высокая аэробная активность предсердия может определяться наличием в его стенках структур проводящей системы, которые обеспечивают автоматию сердца – синоатриального узла (sinoatrial node, SA-узла) и клеток-пейсмейкеров атриовентрикулярной области [40]; функционирование водителей ритма проводящей системы также сопровождается интенсивными электрическими осцилляциями.
В сердце костистых рыб отмечаются дополнительные адаптационные механизмы. Оксифильное per se сердце костистых рыб обладает высокими запасами гликогена, занимая второе место по объему его накоплений после печени и превышая данный показатель для тканей мозга [41], что обеспечивает резерв адаптации миокарда к анаэробным условиям подобно мозгу. Один из самых высоких резервов гликогена в миокарде был найден у европейского керчака Myoxocephalus scorpius (Scorpaenidae) [41], что может быть косвенно связано с кровоснабжением миокарда исключительно венозной кровью. Было установлено, что благодаря таким запасам гликогена сердце устойчивого к гипоксии карася Carassius carassius при относительно высокой активности ЛДГ способно эффективно поддерживать необходимый уровень анаэробного метаболизма даже в близких к аноксии условиях, используя огромные запаса гликогена [4].
При бесспорном различии в эмбриональном происхождении и характере кровоснабжения (артериальное vs. венозное) активность оксидоредуктаз тканей мозга и сердца скорпены обладает несомненным сходством. Опираясь на показатели активности МДГ и ЛДГ, нами были выделены своего рода метаболические “пары” в виде ПМ – предсердия и передних отделов мозга (СППМ) – желудочка. Последняя пара образований характеризовалась более низкой интенсивностью аэробного метаболизма. Несмотря на имеющееся сходство энергетического метаболизма обоих оксифильных, достаточно высоко адаптированных к кислородному голоданию органов в целом, существует заметное неравенство интенсивности аэробного метаболизма (активности МДГ) относительно функциональных компартментов внутри самих органов, которое связано с электрическими процессами.
Как известно, снижение PO2 сопровождается падением синтеза АТФ. Толерантные к гипоксии позвоночные животные используют одновременно две разные стратегии защиты от потери запасов АТФ в виде увеличения гликолитического потока (эффект Пастера) и снижения скорости потребления АТФ (метаболическая депрессия). Первоначальный этап энергетической адаптации к гипоксии проявляется в способности значительно увеличить скорость выработки “гликолитического” АТФ [3, 43]. У рыб воздействие гипоксии обычно вызывает активацию уровня субстратного фосфорилирования посредством гликолиза, сопровождаемого ростом активности ЛДГ и снижением аэробного метаболизма [44, 45].
Нами было установлено, что экспозиция к гипоксии сопровождалась специфическими сдвигами энергетического метаболизма в отдельных структурах мозга и сердца скорпены, отражавшимися двумя наиболее яркими паттернами “поведения” оксидоредуктаз – существенным падением активности МДГ при слабом изменении активности ЛДГ (в ПМ и предсердии) и повышением активности ЛДГ при уменьшении активности МДГ (в СППМ и желудочке сердца).
Схожий уровень активности оксидоредуктаз ПМ и предсердия при снижении PwO2 – падение активности МДГ при статистически незначимой величине изменения активности ЛДГ может предполагать подавление метаболизма и функциональной активности этих образований. Известно, что сокращения сердца и дыхательная активность рыб связаны тесными временны́ми взаимоотношениями в виде кардиореспираторного сопряжения (cardiorespiratory coupling, CRC) и синхронизации (cardiorespiratory synchronization, CRS), достигая соотношения 1: 1 [46, 47]. CRC и CRS определяются спецификой перфузии и движения потока воды через жаберный аппарат. CRC и CRS находятся под контролем парасимпатической нервной системы (волокна блуждающего нерва). Установлено, что в условиях гипоксии сердце рыб заметно снижает частоту своих сокращений [48]. Брадикардия считается приспособительным механизмом, поддерживающим оптимальное перфузионно-вентиляционное соотношение жаберного аппарата [49]. Брадикардия и снижение сократимости миокарда предсердия костистых рыб являются результатом тормозного влияния блуждающего нерва, реализуемого через мускариновые холинергические рецепторы [48]. Одновременно, учитывая степень сопряжения частоты сердечных сокращений и дыхания у костистых рыб [46, 47], следствием CRS при гипоксии может быть одновременное замедление дыхания (сокращения количества дыхательных экскурсий жабр). По-видимому, при кислородном голодании ПМ и предсердие одновременно становятся локусом метаболической и функциональной супрессии, что служит обеспечению нового, “гипоксического” режима кардиореспираторной рефлекторной деятельности.
Функциональное состояние мозга при гипоксии определяется рядом механизмов. Большая часть энергетического “бюджета” мозга приходится на достаточно затратное поддержание или восстановление трансмембранных ионных градиентов. В условиях ограниченной доступности кислорода экономизация АТФ в мозге рыб может достигаться за счет снижения проницаемости плазматических мембран для отдельных ионов в виде “ареста каналов” (ion channel arrest), что уменьшает потребность в АТФ и ведет к существенному энергосбережению [50]. Предполагается, что в возбудимых тканях мозга “арест каналов” приводит к “аресту спайковой активности” (spike arrest [51], что является эффективным средством снижения частоты генерации потенциалов действия и приводит к существенному снижению количества расходуемой АТФ [52].
Так же как в мозге, ионные градиенты, которые создаются ионными токами через Na+-, K+- и Са2+-каналы, необходимы для поддержания потенциала покоя и потенциала действия кардиомиоцитов [53]. Вместе с тем в отличие от характерного для тканей мозга “ареста ионных каналов” [50] при гипоксической брадикардии в кардиомиоцитах срабатывает механизм “ареста потенциала действия” [53]. Упомянутый механизм предполагает достижение баланса между производством и потреблением энергии за счет не затрагивающего количество или кинетику ионных каналов уменьшения частоты потенциалов действия, что позволяет сердцу существенно экономить энергию в условиях кислородного голодания [53].
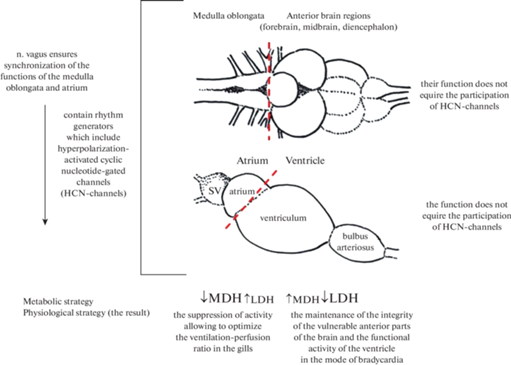
Общим моментом электрофизиологических особенностей мозга и сердца (рис. 4) является экспрессия управляемых циклическими нуклеотидами гиперполяризационно-активируемых каналов (hyperpolarization-activated cyclic nucleotide-gated channels; HCN-каналы), принадлежащих к суперсемейству потенциал-зависимых калиевых каналов (Kv) [54]. Функцией данных каналов является обеспечение смешанных ионных Na+/K+ токов (“a funny current”, If). HCN-каналы медленно активируются при гиперполяризации клеточной мембраны при потенциалах, более отрицательных, чем –50 мВ, в то время как ионные токи в клетках сердца обычно активируются деполяризацией, а не гиперполяризацией. Результирующий ток через HCN-каналы имеет входящее направление и натриевую природу, одновременно ионы К+ при таких значениях потенциала будут выходить из клетки.
Рис. 4.
Схема соотношения активности оксидоредуктаз отделов мозга и сердца Scorpaena porcus при гипоксии. Продолговатый мозг содержит моторные ядра VII, IX, X ЧМН, которые являются частью генератора респираторного ритма. Стенки предсердия также оснащены локусами, генерирующими сердечный ритм (клетки-пейсмейкеры синоатриального и атриовентрикулярного узлов). Предполагается, что основное звено генерации ритма обеих структур – ионные HCN-каналы, проницаемость которых регулируется цАМФ, синтезируемой из АТФ. При гипоксии продукция цАМФ снижается; открытие HCN-каналов минимально, что уменьшает плотность If токов. Механизмам подавления электрических процессов внутри генераторов ритма продолговатого мозга и предсердия “выгодно” падение активности МДГ при несущественном повышении активности ЛДГ; низкая производительность оксидоредуктаз (метаболическая депрессия) снижает энергетический потенциал тканей. Следствием метаболической депрессии и функциональной супрессии продолговатого мозга и предсердия является оптимизация вентиляционно-перфузионного соотношения жаберного аппарата, обеспечиваемая согласованностью брадикардии и брадипноэ. Блуждающий нерв контролирует кардио-респираторное взаимодействие и синхронизацию как при нормоксии, так и при гипоксии. Подавление аэробного метаболизма и выраженная активация гликолиза в чувствительных к кислородному голоданию передних отделах мозга и остро нуждающемся в АТФ миокарде желудочка сердца обеспечивает “выживание” нейронов и функционирование миокарда при краткосрочной гипоксии.
HCN4-каналы играют важную роль в синаптической передаче и интеграции мозга [54, 55]. Генерация дыхательного ритма является результатом взаимодействия возбуждающей глутаматергической передачи и спайковой активности подмножества респираторных нейронов [56]. HCN-каналы являются составной частью механизма генерации респираторного ритма. В частности, у эмбрионов мышей была выявлена экспрессия мРНК субъединиц HCN-каналов в нейронах комплекса пре-Бетцингера (preBötC), формирующих ядро генерации инспираторного ритма RRG [56]. Предшественником preBötC высших позвоночных у рыб служит паравагальный регион ПМ, содержащий моторные ядра IX-X ЧМН [23].
Помимо мозга HCN-каналы экпрессируются в участках миокарда, связанных с генерацией сердечного ритма и обеспечивающих вегетативную регуляцию работы сердца [54]. В SA-узле D. rerio преобладают HCN4-каналы [39, 40]. HCN4-каналы представляют собой резервный механизм, который имеет особое значение для стимуляции и стабилизации функции водителя ритма сердца при снижении частоты сердечных сокращений; вместе с тем HCN4-каналы не требуются для ускорения частоты сердечных сокращений [57]. Проводимость HCN-каналов модулируется прямым взаимодействием с циклическим аденозинмонофосфатом (цАМФ), продуцируемым в сарколемме клеток SA-узла из АТФ Са2+-активируемой и Са2+-ингибируемой аденилатциклазами (АСs). цАМФ может влиять на частоту сердечных сокращений путем прямого связывания с HCN-каналами. Присоединение цАМФ к HCN-каналам приводит к их открытию, сопровождающемуся увеличением частоты сердечных сокращений. Симпатические и парасимпатические ветви вегетативной нервной системы могут контролировать сердечный ритм также путем активации или ингибирования ACs [58, 59].
Существует вероятность того, что при острой гипоксии именно HCN-каналы (в частности, подвид HCN4), тесно связанные с энергетическим метаболизмом, обеспечивают функциональную супрессию/подавление электрической активности ПМ и предсердия. При ведущей роли HCN-каналов в настройке дыхательной и сердечной функции относительно РО2 работа самого механизм ритмогенеза при краткосрочной адаптации к гипоксии “не требует” активной продукции макроэргов за счет аэробного (снижение активности МДГ), так и анаэробного (слабое изменение активности ЛДГ) метаболизма. В то же время при снижении РО2 происходит дополнительное, “уточняющее” ограничение сердечной функции в виде брадикардии, достигаемой через аппарат мускариновых рецепторов синоатриальных пейсмекерных клеток [60]. Можно предположить, что в условиях гипоксии блуждающий нерв продолжает неукоснительно обеспечивать классическую синхронизацию/согласование сердечного и дыхательного ритмов, обеспечивая брадипноэ.
Толерантность к гипоксии для мозга позвоночных часто включает химические модуляторы/медиаторы, которые блокируют активность нейронов для сохранения энергии. ГАМК (γ-аминомасляная кислота) является известным медиатором метаболической депрессии при гипоксии/аноксии. При ограничении кислорода уровень ГАМК заметно повышается в мозге устойчивых позвоночных [61]. Пресинаптические HCN-каналы способны модулировать и ограничивать ГАМКергическую синаптическую передачу [62]; существует вероятность того, что при гипоксии инактивация HCN-каналов становится одним из механизмов высвобождения ГАМК, обеспечивающей состояние метаболической депрессии нейронов [63, 64]. Отсутствие макроэргов (энергетическая недостаточность) – вернее, чем ингибирующая модуляция – угнетает респираторную сеть при гипоксии и подчеркивает необходимость учета метаболических ограничений в подавлении активности как адаптационный механизм, способствующий сохранению энергии [63].
Вместе с тем при острой гипоксии в СППМ скорпены отмечаются наиболее яркие по сравнению с ПМ проявления перехода энергетического метаболизма к анаэробному гликолизу, составляющему безусловный резерв мозга в условиях дефицита кислорода. Ранее было показано [65], что воздействие аноксии сопровождается двух-трехкратным увеличением интенсивности гликолиза в мозге по сравнению с печенью (т.е. мозг проявлял эффект Пастера) у чувствительной к аноксии радужной форели Salmo gairdneri и устойчивого канального сомика Ictalurus nebulosus. Одновременно, демонстрировавшие более выраженный эффект Пастера ткани мозга Ictalurus nebulosus содержали примерно в пять раз больше гликогена, чем мозг Salmo gairdneri, что указывает на его несколько больший анаэробный резерв и гораздо большую анаэробную емкость по сравнению с anoxia-sensitive форелью [65]. В случае скорпены косвенные признаки указывают на наличие определенного анаэробного резерва и соответствующей емкости наиболее чувствительных к кислородному голоданию передних отделов мозга СППМ, определение истинной величины которых требует дальнейшего изучения.
Предполагается [50], что мозг устойчивых к гипоксии/аноксии видов может иметь либо более низкую плотность ионных каналов на единицу площади мембраны, либо проницаемость ионных каналов меняется с началом кислородного голодания, что приводит к снижению потребности в АТФ для ионных насосов. Другим дополнением к “блокировке/остановке каналов” может быть экспрессия форм ионных каналов с более низкой проводимостью [52]. Так или иначе, природа нейронных взаимодействий и биохимических сигнальных механизмов, которые организуют скоординированное снижение метаболизма мозга, остается до настоящего времени неясной.
В то же время желудочек скорпены, которому при гипоксии необходимо поддерживать свою нагнетающую функцию, достаточно интенсивно осуществлял производство макроэргов путем гликолиза, на что указывает подъем активности ЛДГ при менее выраженном снижении активности МДГ. В условиях резкого ограничения доступности кислорода анаэробный гликолиз становится основным источником продукции АТФ кардиомиоцитов. Так, в частности, такое воздействие гипоксии в виде повышения активности ЛДГ было зафиксировано в миокарде Clarias batrachus [45], астронотуса Astronotus crassipinnis и дискуса Symphysodon aequifasciatus [66].
Предполагают, что в направленности и “объеме” метаболической реакции миокарда на воздействие гипоксии существенное значение отводится экспрессии изоформ ЛДГ [66]. Показано, что преобладание ЛДГ мышечного типа в сердце A. crassipinnis было сопряжено с активацией анаэробного гликолиза на фоне накопления пирувата, возникающего при снижении окислительного метаболизма. Фактически, в условиях кислородного голодания в миокарде наблюдается увеличение активности ЛДГ одновременно со снижением активности цитратсинтазы, лимитирующей первый этап цикла Кребса, которая катализирует реакцию конденсации ацетата (ацетил-CoA) и оксалоацетата. Таким образом, в сердце таких животных происходит подавление окислительного метаболизма с последующей активацией анаэробного гликолиза, что обычно наблюдается у так называемых “хороших анаэробов”, таких, как водные черепахи и некоторые виды рыб [67].
Согласно результатам нашего исследования, отдельные структуры мозга и сердца скорпены различаются интенсивностью, направленностью и “предпочтением” путей энергетического метаболизма. Компартменты мозга и сердца, содержащие осцилляторы и задающие частоту сердечного и респираторного ритма – предсердие и продолговатый мозг, – по-видимому, в большей степени нуждаются в интенсивном производстве АТФ. При гипоксии реализуются две стратегии преобразования энергетического метаболизма, которые сосуществуют в пределах одного органа, но в его разных отделах. Очевидно, в условиях кислородного голодания выбор определенной метаболической стратегии детерминирован потребностями встроенных механизмов, связанных со спецификой функционирования конкретной структуры. Сходство метаболических реакций на гипоксию продолговатого мозга и предсердия может базироваться на механизмах, связанных с HCN-каналами, регулируемыми цАМФ как производным АТФ. При снижении РО2 на фоне уменьшения продукции и потребления АТФ (метаболическая депрессия) инактивация HCN-каналов переводит дыхательную и сердечную функции в выгодный для выживания скорпены режим супрессии. В свою очередь, интенсивный анаэробный гликолиз обеспечивает функционирование желудочка и передних отделов мозга в ограниченном режиме. Обращает на себя внимание тот факт, что установленное нами соответствие энергетического обмена компартментов мозга и сердца скорпены при нормоксии и гипоксии осуществляется на фоне многократной разницы в уровне содержания кислорода в артериальной и венозной крови, перфузирующей эти жизненно важные органы.
Список литературы
Ostadal B (2014) Hypoxia and the heart of poikilotherms. Curr Res Cardiol 1:28–32.
Chesnokova NP, Ponukalina EV, Bizenkova MN (2006) Modern conceptions of hypoxia pathogenesis. Hypoxia classification and the starters of its development. Modern Science-Intensive Technol 5 :23–27.
Lutz PL, Nilsson GE, Peréz-Pinzón MA (1996) Anoxia tolerant animals from a neurobiological perspective. Comp Biochem Physiol B Biochem Mol Biol 113:3–13. https://doi.org/10.1016/0305-0491(95)02046-2
Nilsson GE, Lutz PL Anoxia tolerant brains (2004) J Cereb Blood Flow Metab 24:475–486. https://doi.org/10.1097/00004647-200405000-00001
Grimes AC, Kirby ML (2009) The outflow tract of the heart in fishes: anatomy, genes and evolution. J Fish Biol 74: 983–1036. https://doi.org/10.1111/j.1095-8649.2008.02125.x
Milton SL, Dawson-Scully K (2013) Alleviating brain stress: what alternative animal models have revealed about therapeutic targets for hypoxia and anoxia. Future Neurol 8: 287–301. https://doi.org/10.2217/fnl.13.12
Somero GN (2010) The physiology of climate change: how potentials for acclimatization and genetic adaptation will determine “winners” and “losers”. J Exp Biol 213: 912–920. https://doi.org/10.1242/jeb.037473
Soldatov AA, Andreenko TI, Kukhareva TA, Andreeva AYu, Kladchenko ES (2021) Catalase and Superoxide Dismutase Activity in Erythrocytes and the Methemoglobin Level in Blood of the Black Scorpionfish (Scorpaena porcus, Linnaeus 1758) Exposed to Acute Hypoxia. Russ J Marine Biol 47: 283–289. https://doi.org/10.1134/S106307402104012X
Lushchak VI, Bahnjukova TV, Storey KB (1998) Effect of hypoxia on the activity and binding of glycolytic and associated enzymes in sea scorpion tissues. Braz J Med Biol Res 31: 1059–1067. https://doi.org/10.1590/s0100-879x1998000800005
Kolesnikova EE, Soldatov AA, Golovina IV, Sysoeva IV, Sysoev AA, Kukhareva TA (2021) Activity of Energy Metabolism Enzymes and the Adenylate System in Heart Chambers of a Black Sea Scorpionfish (Scorpaena porcus L.) under Acute Hypoxia. J Evol Biochem Physiol 57: 1050–1059. https://doi.org/10.1134/S0022093021050070
Kolesnikova EE, Soldatov AA, Golovina IV, Sysoeva IV, Sysoev AA (2022) Effect of acute hypoxia on the brain energy metabolism of the scorpionfish Scorpaena porcus Linnaeus, 1758: the pattern of oxidoreductases activity and adenylate system. Fish Physiol Biochem 48: 1105–1115. https://doi.org/10.1007/s10695-022-01103-2
Childress JJ, Somero GN (1979) Depth-related enzymic activities in muscle, brain and heart of deep-living pelagic marine teleosts. Marine Biol 52: 273–283.
Nilsson GE, Östlund-Nilsson S (2008) Does size matter for hypoxia tolerance in fish? Biol Rev Camb Philos Soc 83: 173–189. https://doi.org/10.1111/j.1469-185X.2008.00038.x
Мильман ЛС, Юровецкий ЮГ, Ермолаева ЛП (1974) Определение активности важнейших ферментов углеводного обмена. В кн.: Методы биологии развития. М. Наука. 346–364. [Mil’man LS, Yurovetskiy YG, Ermolaeva LP (1974) In: The methods of developmental biology. Determination of the activity of the essential enzymes of carbohydrate metabolism. M. Nauka. 346–364. (In Russ)].
Kotrschal K, Van Staaden MJ, Huber R (1998) Fish brains: evolution and anvironmental relationships. Rev Fish Biol Fish 8: 373–408. https://doi.org/10.1023/A:1008839605380
Northcutt RG (2002) Understanding vertebrate brain evolution. Integr Comp Biol 42: 743–756. https://doi.org/10.1093/icb/42.4.743
Swanson LW (2000) What is the brain? Trends Neurosci 23:519–527. https://doi.org/10.1016/s0166-2236(00)01639-8
Ito H, Ishikawa Y, Yoshimoto M, Yamamoto N (2007) Diversity of brain morphology in teleosts: brain and ecological niche. Brain, Behavior and Evolution 69: 76–86. https://doi.org/10.1159/000095196
Puelles L (1995) A segmental morphological paradigm for understanding vertebrate forebrains. Brain Behav Evol 4–5: 319–337. https://doi.org/10.1159/000113282
Kage T, Takeda H, Yasuda T, Maruyama K, Yamamoto N, Yoshimoto M, Araki K, Inohaya K, Okamoto H, Yasumasu S, Watanabe K, Ito H, Ishikawa Y (2004) Morphogenesis and regionalization of the medaka embryonic brain. J Comp Neurol 476: 219–239. https://doi.org/10.1002/cne.20219
Almeida-Val VMF, Val AL, Duncan WP, Souza FC, Paula-Silva MN, Land S (2000) Scaling effects on hypoxia tolerance in the Amazon fish Astronotus ocellatus (Perciformes: Cichlidae): contribution of tissue enzyme levels. Comp Biochem Physiol B Biochem Physiol 125: 219–226. https://doi.org/10.1016/s0305-0491(99)00172-8
Taylor EW, Leite CAC, McKenzie DJ, Wang T (2010) Control of respiration in fish, amphibians and reptiles. Braz J Med Bio Res 43:409–424. https://doi.org/10.1590/S0100-879X2010007500025
Milsom WK (2010) The phylogeny of central chemoreception. Resp Physiol Neurobiol 173: 195–200. https://doi.org/10.1016/j.resp.2010.05.022
Milsom WK, Taylor ETW (2015) Control of breathing in elasmobranchs. Fish Physiol 34: 83–126. https://doi.org/10.1016/B978-0-12-801286-4.00002-2
Shulman GE, Love RM (1999) Advances in Marine Biology: The biochemical ecology of marine fishes. Acad Press.
Houlihan DF, Mathers EM, Foster A (1993) Biochemical correlates of growth rate in fish. In Fish ecophysiol. Rankin JC, Jensen FB (Eds). Chapman & Hall: Falmouth, Cornwall. 45–71.
Almeida-Val VMF, Farias IP, Silva MN, Duncan WP, Val AL (1995) Biochemical adjustments to hypoxia by Amazon cichlids. Braz J Med Biol Res 28:1257–1263.
Schultz IR, Barron MG, Newman MC, Vick AM (1999) Blood flow distribution and tissue allometry in channel catfish. J Fish Biol 54: 1275–1286. https://doi.org/10.1111/j.1095-8649.1999.tb02054.x
Soldatov AA (2006) Organ blood flow and vessels of microcirculatory bed in fish. J Evol Biochem Physiol 42: 243–252. https://doi.org/10.1134/S002209300603001X
Kieffer JD, Tufts BL (1998) Effects of food deprivation on white muscle energy reserves in rainbow trout (Oncorhynchus mykiss): the relationships with body size and temperature. Fish Physiol Biochem 19:239–245. https://doi.org/10.1023/A:1007759407275
Foster GD, Youson JH, Moon TW (1993) Carbohydrate metabolism in the brain of the adult lamprey. J Exp Zool 267: 27–32. https://doi.org/10.1002/jez.1402670105
Vornanen M, Paajanen V (2006) Seasonal changes in glycogen content and Na+-K+-ATPase activity in the brain of crucian carp. Am J Physiol 291: R1482–R1489. https://doi.org/10.1152/ajpregu.00172.2006
Tota B, Cimini V, Salvatore G, Zummo G (1983) Comparative study of the arterial and lacunary systems of the ventricular myocardium of elasmobranchs and teleost fishes. Am J Anat 167: 15–32. https://doi.org/10.1002/aja.1001670103
Olson E (2006) Gene Regulatory Networks in the Evolution and Development of the Heart. Science 313: 1922–1927. https://doi.org/10.1126/science.1132292
Harvey RP (2002) Patterning the vertebrate heart. Nat Rev Gen 3: 544–556. https://doi.org/10.1038/nrg843
Simões-Costa MS, Vasconcelos M, Sampaio AC, Cravo RM, Linhares VL, Hochgreb T, Yan CYI, Davidson B, Xavier-Neto J (2005) The evolutionary origin of cardiac chambers. Dev Biol 277: 1–15. https://doi.org/10.1016/j.ydbio.2004.09.026
Kibler NA, Nuzhny VP, Kharin SN, Shmakov DN (2020) Does Atrial Electrical Stimulation to the Sequence of Depolarization of the Ventricles of Rainbow Trout Oncorhynchus mykiss. J Evol Biochem Physiol 56: 60–65. https://doi.org/10.1134/S0022093020010056
Farrell AP, Jones DR, Hoar WS, Randall DJ (1992) The heart. In Fish Physiology. Hoar WS, Randall DJ, Farrell AP (Eds). Acad Press Inc San Diego USA 1–88.
Tessadori F, van Weerd JH, Burkhard SB, Verkerk AO, de Pater E, Boukens BJ, Vink A, Christoffels VM, Bakkers J (2012) Identification and functional characterization of cardiac pacemaker cells in zebrafish. PLoS One 7: e47644. https://doi.org/10.1371/journal.pone.0047644
Stoyek MR, Croll RP, Smith FM (2015) Intrinsic and extrinsic innervation of the heart in zebrafish (Danio rerio). J Comp Neurol 523: 1683–1700. https://doi.org/10.1002/cne.23764
Short CE, Driedzic WR (2018) Species-specific low plasma glucose in fish is associated with relatively high tissue glucose content and is inversely correlated with cardiac glycogen content. J Comp Physiol 188: 809–819. https://doi.org/10.1007/s00360-018-1172-3
Vornanen M (1994) Seasonal adaptation of crucian carp (Carassius carassius L.) heart: glycogen stores and lactate dehydrogenase activity. Can J Zool 72: 433–442. https://doi.org/10.1139/z94-061
Lutz PL, Nilsson GE (1997) Contrasting strategies for anoxic brain survival–glycolysis up or down. J Exp Biol 200: 411–419. https://doi.org/10.1242/jeb.200.2.411
Richards JG (2009) Metabolic and molecular responses of fish to hypoxia. Fish Physiol 27: 443–485. https://doi.org/10.1016/S1546-5098(08)00010-1
Kumar A, Gopesh A (2015) Effect of hypoxia and energy conservation strategies in the air-breathing Indian catfish, Clarias batrachus. Natl Acad Sci Lett 38: 135–137. https://doi.org/10.1007/s40009-014-0332-6
Taylor EW (1992) Nervous control of the heart and cardiorespiratory interactions. Fish Physiol 12: 343–387. https://doi.org/10.1016/S1546-5098(08)60013-8
Taylor EW, Leite CAC, Florindo LH, Belao T, Rantin FT (2009) The basis of vagal efferent control of heart rate in a neotropical fish, the pacu, Piaractus mesopotamicus. J Exp Biol 212: 906–913. https://doi.org/10.1242/jeb.020529
Vornanen M, Tuomennoro J (1999) Effects of acute anoxia on heart function in crucian carp: importance of cholinergic and purinergic control. Am J Physiol 277: R465–R475. https://doi.org/10.1152/ajpregu.1999.277.2.R465
Sollid J, Nilsson GE (2006) Plasticity of respiratory structures–adaptive remodeling of fish gills induced by ambient oxygen and temperature. Resp Physiol Neurobiol 154:241–251. https://doi.org/10.1016/j.resp.2006.02.006
Hochachka PW (1986) Defense strategies against hypoxia and hypothermia. Science 231: 234–241. https://doi.org/10.1126/science.2417316
Sick TJ, Perez-Pinon M, Lutz PL, Rosenthal M (1993) Maintaining coupled metabolism and membrane function in anoxic brain: A comparison between the turtle and rat. In Surviving hypoxia. Hochachka PW, Lutz PL, Sick T, Rosenthal M, van den Thillart D (Eds). CRC Press: Boca Raton, Florida. 351–363.
Buck LT, Pamenter ME (2018) The hypoxia-tolerant vertebrate brain: arresting synaptic activity. Comp Biochem Physiol B Biochem Mol Biol 224: 61–70. https://doi.org/10.1016/j.cbpb.2017.11.015
Paajanen V, Vornanen, M (2003) Effects of chronic hypoxia on inward rectifier K+ current (I K1) in ventricular myocytes of crucian carp (Carassius carassius) heart. J Membr Biol 194:119–127. https://doi.org/10.1007/s00232-003-2032-x
Liu H, Aldrich RW (2011) Tissue-specific N terminus of the HCN4 channel affects channel activation. J Biol Chem 286: 14209–14214. https://doi.org/10.1074/jbc.m110.215640
Robinson RB, Siegelbaum SA (2003) Hyperpolarization-activated cation currents: from molecules to physiological function. Annu Rev Physiol 65: 453–480. https://doi.org/10.1146/annurev.physiol.65.092101.142734
Bouvier J, Autran S, Dehorter N, Katz DM, Champagnat J, Fortin G, Thoby-Brisson M (2008) Brain-derived neurotrophic factor enhances fetal respiratory rhythm frequency in the mouse preBötzinger complex in vitro. Eur J Neurosci 28: 510–520. https://doi.org/10.1111/j.1460-9568.2008.06345.x
Herrmann S, Stieber J, Stockl G, Hofmann F, Ludwig A (2007) HCN4 provides a “depolarization reserve” and is not required for heart rate acceleration in mice. EMBO J 26: 4423–4432. https://doi.org/10.1038/sj.emboj.7601868
Di Francesco D (2006) Funny channels in the control of cardiac rhythm and mode of action of selective blockers. Pharmacol Res 53: 399–406. https://doi.org/10.1016/j.phrs.2006.03.006
Monfredi O, Maltsev VA, Lakatta EG (2013) Modern concepts concerning the origin of the heartbeat. Physiol 28: 74–92. https://doi.org/10.1152/physiol.00054.2012
Laurent P, Holmgren S, Nilsson S (1983) Nervous and humoral control of the fish heart: structure and function. Comp Biochem Physiol A Physiol 76: 525–542. https://doi.org/10.1016/0300-9629(83)90455-3
López-Barneo J, Nurse CA, Nilsson GE, Buck LT, Gassmann M, Bogdanova AY (2010) First aid kit for hypoxic survival: sensors and strategies. Physiol Biochem Zool 83: 753–763. https://doi.org/10.1086/651584
Cai W, Liu SS, Li BM, Zhang XH (2022) Presynaptic HCN channels constrain GABAergic synaptic transmission in pyramidal cells of the medial prefrontal cortex. Biol Open 11: bio058840. https://doi.org/10.1242/bio.058840
Adams S, Zubov T, Bueschke N, Santin JM (2021) Neuromodulation or energy failure? Metabolic limitations silence network output in the hypoxic amphibian brainstem. Am J Physiol Regul Integr Comp Physiol 320: R105–R116. https://doi.org/10.1152/ajpregu.00209.2020
Park K, Yi JH, Kim H, Choi K, Kang SJ, Shin KS (2011) HCN channel activity-dependent modulation of inhibitory synaptic transmission in the rat basolateral amygdala. Biochem Biophys Res Commun 404: 952–957. https://doi.org/10.1016/j.bbrc.2010.12.087
Heath AG (1988) Anaerobic and aerobic energy metabolism in brain and liver tissue from rainbow trout (Salmo gairdneri) and bullhead catfish (Ictalurus nebulosus). J Exp Zool 248: 140–146. https://doi.org/10.1002/jez.1402480203
Chippari-Gomes AR, Gomes LDC, Lopes NP, Val AL, Almeida-Val VMF (2005) Metabolic adjustments in two Amazonian cichlids exposed to hypoxia and anoxia. Comp Biochem Physiol B Biochem Physiol 141: 347–355. https://doi.org/10.1016/j.cbpc.2005.04.006
Hochachka PW, Somero GN (2002) Biochemical adaptation: mechanism and process in physiological evolution. Oxford Univer Press Oxford Great Britain.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


