Журнал эволюционной биохимии и физиологии, 2022, T. 58, № 6, стр. 507-519
ГЕМОЦИТЫ АВСТРАЛИЙСКОГО КРАСНОКЛЕШНЕВОГО РАКА (CHERAX QUADRICARINATUS): МОРФОЛОГИЯ И ГЕМОГРАММА
Д. Н. Скафарь 1, *, Д. В. Шумейко 1
1 Кубанский государственный университет
Краснодар, Россия
* E-mail: skafden@mail.ru
Поступила в редакцию 26.05.2022
После доработки 08.09.2022
Принята к публикации 14.09.2022
- EDN: XMJPEQ
- DOI: 10.31857/S0044452922060109
Аннотация
Целью настоящей работы было проведение морфологического анализа гемоцитов, нахождение общего числа гемоцитов и процентной доли каждого типа гемоцитов австралийского красноклешневого рака (Cherax quadricarinatus). Изучали гемоциты в нативной, обработанной антикоагулянтом и окрашенной по Май-Грюнвальду и Романовскому гемолимфе. Гемолимфу отбирали шприцом из вентрального синуса. Микроскопию проводили при увеличении объектива 40× или 100×. Подсчет гемоцитов и определение процентной доли каждого типа производили в камере Горяева. Выделено три основных типа гемоцитов, а также обнаружены клетки, морфологически отличающиеся от первых трех, они названы прозрачными клетками. Агранулоциты (гиалиноциты) – клетки овальной или веретенообразной формы, длиной и шириной порядка 26.6 и 9.2 мкм. У них отсутствуют гранулы, однако иногда можно обнаружить малое число размером менее 0.5 мкм. Этот тип клеток способен дольше других оставаться на предметном стекле после извлечения. Полугранулоциты – клетки овальной или веретенообразной формы, длиной и шириной 26.7 и 9.3 мкм, с умеренно развитыми небольшими гранулами размером менее 0.5 мкм и редко встречающимися средними гранулами размером от 0.77 до 1.69 мкм. Гранулоциты – клетки овальной формы, наиболее крупные из всех типов с длиной и шириной 28.7 и 11.1 мкм. Имеют крупные (0.8–2.48 мкм) обильно развитые гранулы и высокое лучепреломление, ввиду чего этот тип клеток хорошо определим под микроскопом. У них наблюдается наименьшее по сравнению с первыми двумя типами ядерно-цитоплазматическое отношение. Прозрачные клетки – особенностью данного типа клеток являются обильно развитые псевдоподии. Среднее значение диаметра клетки после ее округления составляет 10.7 ± 1.11 мкм. Клетки этого типа начинают проявляться через 10 мин после извлечения в необработанной антикоагулянтом гемолимфе. Доминирующим типом в гемолимфе являются агранулоциты, их доля составляет 48.3 ± 11.4%. На долю полугранулоцитов и гранулоцитов приходится 26.3 ± 7.8% и 25.2 ± 6.9% соответственно. Общее число гемоцитов колеблется в широком диапазоне от 820 до 5510 шт./мкл, среднее количество клеток составляет 2707 ± 1096 шт./мкл. Средняя доля прозрачных клеток составила 18.2 ± 3.8%.
Кровь ракообразных представлена гемолимфой, клеточной частью которой являются гемоциты. Как правило, у декапод (Decapoda) выделяют три типа гемоцитов: агранулоциты (гиалиноциты), полугранулоциты (гранулоциты с малыми гранулами) и гранулоциты [1–4], некоторые исследователи выделяют у речных раков видов Аstacus astacus и Pontastacus leptodactyhis четвертый тип гемоцитов – прозрачные клетки [5–7], а Roulston [8] выделил у морского краба Hyas araneus, помимо основных трех типов гемоцитов, еще и прогемоциты. В последние несколько десятилетий происходит интенсивное изучение гемоцитов представителей семейства Decapoda. Для ряда ракообразных, являющихся объектами аквакультуры и промысла, даны классификация и характеристика как по морфологическим и цитохимическим показателям, так и по молекулярным особенностям гемоцитов, определены общее число гемоцитов и процентная доля каждого типа клеток в гемолимфе [8–22]. Полученные результаты позволяют без затруднений классифицировать клетки крови этих гидробионтов. При этом для некоторых видов существуют различные точки зрения по поводу классификации гемоцитов; так, Hose и соавт. [13] выделил три типа гемоцитов у Homarus americanus, в то время как Battison и соавт. [23] в своей работе выделяет одиннадцать типов, большая часть которых являются не отдельными клеточными линиями, а гемоцитами разных стадий развития. У перспективного объекта аквакультуры, австралийского красноклешневого рака (Cherax quadricarinatus (Von Martens, 1868)) [24–26], гемоциты являются относительно хорошо изученными. На этом организме экспериментально подтверждена концепция, по которой различные типы гемоцитов происходят не от различных клеточных линий, как считалось ранее, а представляют собой гемоциты разных стадий развития [27]. Исходя из нее, предшественниками гранулоцитов являются полугранулоциты, при этом агранулоциты (гиалиноциты) считаются прогемоцитами, высвободившимися из гемопоэтической ткани. Также у C. quadricarinatus изучены иммунные функции гемоцитов [28, 29] и их молекулярные особенности [27, 29–31], проведены исследования популяций гемоцитов с помощью проточной цитометрии и с использованием флуоресцентных маркеров [27, 32]. Но при этом отсутствует подробная морфологическая характеристика гемоцитов, так, например, отсутствуют данные о ядерно-цитоплазматическом отношении и размерах гранул различных типов клеток. Среди прочего остается открытым вопрос о количестве типов гемоцитов. Так, в ряде вышеперечисленных работ авторы выделяют только три основных типа, однако Лагуткина и соавт. [33] выделяют в гемолимфе австралийского красноклешневого рака еще и прозрачные клетки, которые предположительно являются прогемоцитами или рано высвободившимися из гемопоэтической ткани гемоцитами. Это не единственная работа, в которой авторы выделили в гемолимфе помимо основных типов клеток еще и дополнительные; так, Wentao и соавт. [34] обнаружили с помощью иммуноцитохимии клетки CD34+, которые, возможно, являются подобными стволовым, полученными из недифференцированной гемопоэтической такни. Предполагается, что эти клетки могут расти и дифференцироваться в зрелые гемоциты будучи циркулирующими в кровеносной системе. В работе по изучению гемоцитов, пораженных внутриклеточными микроорганизмами [35], были обнаружены инфицированные стволовые клетки кроветворной ткани, некоторые из которых по предположению авторов высвобождались в кровоток. Помимо этого, актуальной задачей является нахождение общего числа гемоцитов (ОЧГ) и процентной доли каждого типа гемоцитов, так как в различных источниках уровень ОЧГ и доля различных типов клеток австралийского красноклешневого рака имеют различные значения [29, 32, 33, 36, 37]. ОЧГ и процентная доля каждого типа гемоцитов являются важными показателями физиологического состояния ракообразных. Описанное выше создает необходимость проведения исследований с целью получения информации о морфологических особенностях каждого типа гемоцитов, их процентной доли и общем числе. Это расширит возможности более точного определения типов клеток при работе с гемолимфой рака как для научно-исследовательских целей, так и для прижизненного мониторинга физиологического состояния ракообразного в условиях рыбохозяйственных предприятий [3, 5, 7, 14, 38].
Целью настоящей работы было проведение морфологического анализа гемоцитов, нахождение ОЧГ и процентной доли каждого типа гемоцитов австралийского красноклешневого рака (Cherax quadricarinatus).
МЕТОДЫ ИССЛЕДОВАНИЯ
Работу проводили в лаборатории перспективных технологий в аквакультуре на базе бизнес-инкубатора ФГБОУ ВО “Кубанский государственный университет”.
Содержание животных. Раков содержали в установках замкнутого водоснабжения (УЗВ), включающих в себя бассейны объемом 2.5 м3 и площадью 3.14 м2 каждый при температуре воды 20–28° С. В УЗВ были размещены укрытия из ПВХ труб для снижения внутривидовой агрессии. В зависимости от массы, особи содержались раздельно при плотностях посадки от 6 до 20 особей/м2. Кормление осуществляли ежедневно кормом Coppens Start Premium 1.5 мм (Нидерланды) (белок – 54%, жиры – 15%, зола – 10.4%, фосфор – 1.59%), суточная норма составляла 3% от биомассы ракообразных. Фотопериод составлял 12/12 ч (день/ночь). Концентрация кислорода в воде составляла 5 мг/л, pH 7.9.
Исследование состояло из нескольких частей. В первой изучали гемоциты в обработанной антикоагулянтом гемолимфе, когда они имели веретенообразную или овальную форму. В качестве антикоагулянта использовали 4%-ный раствор Трилона-Б (ЭДТА-Na2) (BASF, Китай), так как по нашим наблюдениям этот антикоагулянт предотвращает быстрый распад и округление клеток, а также образование скоплений из них. Шприц заполняли антикоагулянтом в соотношении 1: 1 к планируемому объему изымаемой гемолимфы. Во второй части исследовали гемоциты в нативной гемолимфе – определяли диаметр округлившихся клеток. В третьей части работы исследовали мазки, окрашенные по Май-Грюнвальду и Романовскому. Определяли ОЧГ и процентную долю каждого типа гемоцитов.
Окрашивание по Май-Грюнвальду. Для окраски по Май-Грюнвальду в краситель-фиксатор (Минимед, Россия), разведенный 1: 3 в фосфатном буфере с pH 6.4 ± 0.2 (Минимед, Россия), помещали на 5 мин высушенные мазки, с последующей отмывкой буфером и высушиванием.
Окрашивание по Романовскому. При окраске по Романовскому в краситель (Минимед, Россия), разведенный в фосфатном буфере с pH 6.4 ± 0.2 в соотношении 1:24, помещали высушенные мазки на 2 мин, затем раствор разбавляли 1: 1 фосфатным буфером и окрашивали еще 10 мин с последующей отмывкой буфером и высушиванием.
Отбор гемолимфы. Гемолимфу отбирали из вентрального синуса шприцом объемом 2 мл с иглой 23G с учетом норм санитарии. Такой способ позволяет прижизненно отбирать кровь, не нанося здоровью раков значительный ущерб [3].
Микроскопия и измерение гемоцитов. Микроскопию гемоцитов проводили на световом микроскопе Микромед-1 (Микромед, Россия) при увеличении объектива 40× или 100× c масляной иммерсией. Для морфометрических измерений использовали камеру UCMOS08000KPB (ToupCam, Китай) c разрешением 3264 × 2448 пикселей и программное обеспечение ToupView 3.7 (ToupTek Photonics, Китай). Находили длину и ширину клетки и ядра у гемоцитов в нативном состоянии (имеющих овальную и веретеновидную формы), а также вычисляли ядерное-цитоплазматическое отношение (ЯЦО). Для этого произведения длины и ширины ядра и клетки использовали вместо площади этих структур, для последующего расчета ЯЦО по формуле: ЯЦО = Sя/Sкл, где Sя – площадь ядра клетки; Sкл – площадь клетки. В одном окрашенном образце гемолимфы исследовали гемоциты из 10–15 полей зрения. Для исследования гемолимфы, обработанной антикоагулянтом, проводили по 10 измерений гемоцитов каждого типа в одном образце гемолимфы, всего было проанализировано 10 образцов гемолимфы из 10 особей различной массы обоих полов.
Определение общего числа гемоцитов и их дифференцированный подсчет. Определение ОЧГ проводили на 138 разнополых раках массой от 8 до 100 г (40.4 ± 23.6 г). Установление процентной доли каждого типа гемоцитов проводили на 50 раках обоих полов (25 самок и 25 самцов) массой 56.5 ± ± 18.4 г, у них также определяли ОЧГ. Подсчет гемоцитов и определение процентной доли каждого типа производили в камере Горяева. Для подсчета общего числа гемоцитов (ОЧГ) применяли следующую формулу: ОЧГ в 1 мкл = N × 5, где N – число всех гемоцитов в 50 больших квадратах на сетке камеры.
Статистическая обработка данных. Расчеты полученных данных производили с использованием программ Microsoft Excel (Microsoft Corporation, США) и Statistica 14 (TIBCO Software Inc.). Вычисляли такие показатели, как среднее значение (μ), среднеквадратичное отклонение (σ). Для проверки статистической достоверности различий использовали U-критерий Манна–Уитни и критерий Краскела–Уоллиса. Различия считались статистически достоверными при p < 0.05. Для обнаружения корреляционных связей использовали коэффициент корреляции Спирмена, корреляция считалась статистически достоверной при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ОБСУЖДЕНИЕ
Основанием для классификации гемоцитов стали наличие и размер гранул в цитоплазме клеток, размеры клеток и ядра, их форма. Нами было выделено в гемолимфе Cherax quadricarinatus три основных типа гемоцитов: агранулоциты (гиалиноциты), полугранулоциты (гранулоциты с малыми гранулами), гранулоциты, а также были обнаружены клетки, морфологически отличающиеся от первых трех. Упоминание о них имеется в ряде работ [5–7], где они названы прозрачными клетками.
Все гемоциты сразу же после изъятия при отсутствии антикоагулянта начинают из нативной формы превращаться в округлые образования. Через 5–7 мин клетки начинают разрушаться. Спустя 30–40 мин после изъятия гранулоциты и полугранулоциты разрушаются, однако их учет и типизация возможны по выброшенным гранулам. Данные по морфологическим характеристикам гемоцитов представлены в табл. 1.
Таблица 1.
Цитологические характеристики гемоцитов C. quadricarinatus
| Показатели | Типы клеток | ||
|---|---|---|---|
| агранулоциты | полугранулоциты | гранулоциты | |
| Форма клеток | овальная, веретено-образная | овальная, веретенообразная | овальная |
| Гранулы | отсутствуют или в не-большом количестве, мелкие менее 0.5 мкм | небольшого размера, умеренно развитые 0.5 мкм, реже встречаются среднего размера 1.05 ± 0.243 мкм | крупные, обильно развиты 1.4 ± 0.5 мкм |
| Ядро (расположение в клетке, форма) | центральное, овальное | центральное, овальное | центральное или эксцентричное, овальное, круглое или почкообразное |
| Длина клетки, мкм | 25.2 ± 3.2 | 26.6 ± 4.5 | 28.8 ± 3.8 |
| Ширина клетки, мкм | 8.5 ± 1.0 | 9.2 ± 1.1 | 11.1 ± 1.7 |
| Диаметр клетки после округления, мкм | 10.3 ± 1.2 | 11.2 ± 0.8 | 14.6 ± 1.4 |
| ЯЦО, % | 25.9 ± 8.5 | 22.6 ± 6.9 | 13.2 ± 5.3 |
Размерные характеристики клеток могут варьировать в широком диапазоне и зависеть от того, как долго они находятся на стекле, какой антикоагулянт и в каком соотношении и концентрации используется, исходя из этого наиболее надежным критерием при классификации гемоцитов являются наличие и размер гранул.
Агранулоциты (гиалиноциты) (ГЦ I) (рис. 1a, 2d). Клетки овальной или веретенообразной формы, длиной и шириной порядка 25.2 и 8.5 мкм соответственно. Длина и ширина клеток колеблются в диапазоне 18.5–34.5 и 6.2–11.3 мкм соответственно, ЯЦО 9.7–44.6%. У агранулоцитов отсутствуют гранулы, однако иногда можно обнаружить малое число размером порядка 0.5 мкм и менее. После изъятия округляются в течение одной минуты (рис. 1a2). Этот тип клеток способен дольше других оставаться на предметном стекле после извлечения. При окрашивании по Романовскому ядра клеток окрашиваются в темно-фиолетовый цвет (рис. 2d). Окрашивание по Май-Грюнвальду (рис. 1a3) дает более светлое окрашивание ядра по сравнению с окраской по Романовскому (рис. 2d).
Рис. 1.
Микрофотографии трех типов гранулоцитов. (a) – агранулоцит, (b) – полугранулоцит, (c) – гранулоцит. 1 – в антикоагулянте, 2 – округленный, 3 – окрашенный по Май-Грюнвальду. Размер масштабной линейки 10 мкм.
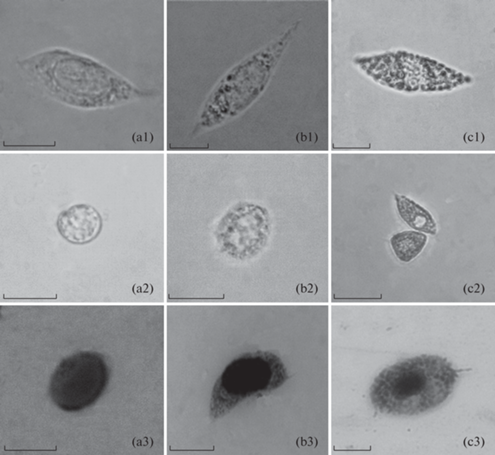
Рис. 2.
Микрофотографии гемоцитов окрашенных по Романовскому. (a), (b) – гранулоциты, (c) – полугранулоцит, (d) – агранулоцит. Размер масштабной линейки 5 мкм.

Полугранулоциты (гранулоциты с малыми гранулами) (ГЦ II) (рис. 1b, 2c). Клетки овальной или веретенообразной формы, длиной и шириной 26.6 и 9.2 мкм соответственно, с умеренно развитыми небольшими гранулами, варьирующих в широком диапазоне, от гранул по размером сопоставимых с гранулами агранулоцитов до редко встречающихся гранул среднего размера, схожих с гранулами гранулоцитов размером от 0.77 до 1.7 мкм, при этом есть статистические различия между размером гранул у полугранулоцитов и гранулоцитов (p < 0.05). Длина и ширина клеток колеблются в диапазоне 18.3–39.6 и 7.3–11.9 мкм соответственно, ЯЦО 10.8–40.8%. Начинают округляться через 1–2 мин после изъятия (рис. 1b2). В окрашенных по Май-Грюнвальду мазках полугранулоциты представляют из себя клетки с небольшими гранулами и цитоплазмой фиолетового цвета (рис. 1b3). При окраске по Романовскому цитоплазма и гранулы окрашиваются в синий цвет. Полугранулоциты, являясь предшественниками гранулоцитов, имеют различия по некоторым молекулярным характеристикам, цитохимии и функциям [1, 13, 31, 39], ввиду чего есть основание выделять гранулоциты и полугранулоциты в два отдельных типа.
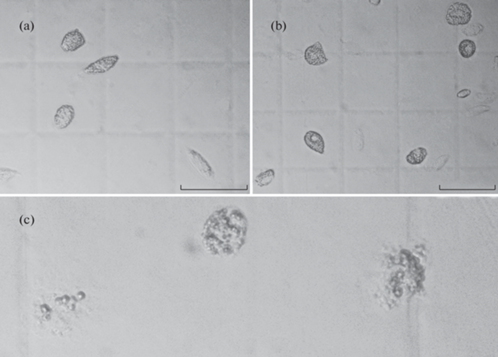
Гранулоциты (ГЦ III). Клетки овальной формы (рис. 1с1, 2a,b, 3a,b). Наиболее крупные из всех типов гемоцитов с длиной и шириной 28.8 и 11.1 мкм соответственно, с крупными (0.8–2.48 мкм) обильно развитыми гранулами, имеющими высокое лучепреломление, ввиду чего этот тип клеток хорошо определим под микроскопом. Размер гранул варьирует от 0.8 до 2.5 мкм. Длина и ширина клеток колеблются в диапазоне 21.3–38.6 и 7.8–15.3 мкм соответственно, ЯЦО 4.1–34.8%. У гранулоцитов наблюдается наименьшее по сравнению с первыми двумя типами ядерно-цитоплазматическое отношение. Клетки начинают округляться через 2–3 мин после изъятия. Через 5–10 мин с момента изъятия происходит разрушение клетки, после которого остаются гранулы (рис. 3c). В окрашенных по Май-Грюнвальду мазках гранулоциты представляют из себя клетки с крупными обильно развитыми окрашенными фиолетовым цветом гранулами (рис. 1b3). При окрашивании по Романовскому ядро и гранулы окрашиваются в фиолетовый цвет, в то время как цитоплазма в светло-фиолетовый. Дифференциальное окрашивание гранулоцитов несколькими красителями может свидетельствовать о гетерогенности их гранул или гетерогенности самих гранулоцитов, как это наблюдается у гранулоцитов асцидии Halocynthia aurantium [40], что может быть обусловлено их несинхронностью созревания. Так, в мазках можно выделить гранулоциты с крупным ядром и малым количеством гранул по сравнению с гранулоцитами, имеющими ядра меньшего размера, но превосходящие первые по количеству гранул. Первые могут быть более молодыми формами по сравнению с последним. Наблюдаются различия в окрашивании разновозрастных гранулоцитов, ядра молодых гранулоцитов способны окрашиваться более светлыми тонами по сравнению со старшевозрастными клетками. Морфологическую гетерогенность популяции гранулоцитов также можно заметить при световой микроскопии гемолимфы. Гипотеза о гетерогенности гранулоцитов ввиду нахождения в гемолимфе разновозрастных клеток подтверждается исследованиями [27], так как созревание гранулоцитов может доходить от одного до трех месяцев, а после созревания могут жить до двух месяцев.
Рис. 3.
(a), (b) – гемоциты в камере Горяева, (c) – разрушенные гранулоциты. Размер масштабной линейки 50 мкм.
Проведение сравнений длины, ширины, диаметра (после округления) и ЯЦО трех типов гемоцитов дали следующий результат: различий в длинах агранулоцитов и полугранулоцитов не наблюдается (p > 0.05), в то время как во всех остальных случаях различия статистически достоверны (p < 0.05).
Прозрачные клетки (ГЦ IV) (рис. 4a). Эти гемоциты начинают проявляться через 5–10 мин после извлечения гемолимфы. Клетки овальной формы через 5–10 мин после проявления начинают округляться, среднее значение диаметра клетки после ее округления составляет 10.7 ± 1.11 мкм, что сопоставимо с диаметром агранулоцитов (p > 0.05) и полугранулоцитов (p > 0.05). Особенностью прозрачных клеток являются обильно развитые псевдоподии (рис. 4a). При микроскопировании эти клеточные структуры проглядываются тяжело, ввиду того, что являются прозрачными. Прозрачные клетки окрашивались только по Май-Грюнвальду в мазках, где использовалась нативная гемолимфа, не обработанная антикоагулянтом (рис. 4b). При окрашивании мазков по Романовскому этот тип клеток в нашем исследовании не обнаруживался.
Рис. 4.
Микрофотографии прозрачных клеток. (a) – округлившаяся прозрачная клетка с псевдоподиями, (b) – прозрачная клетка, окрашенная по Май-Грюнвальду. Размер масштабной линейки 5 мкм.

Можно предположить, что это прикрепленный распластанный на стекле гиалиноцит, который практически не отличается по диаметру (10.3 ± ± 1.20 мкм), но это не объясняет проявление его только спустя некоторое время на тех участках, где они ранее отсутствовали. Возможно, проявление клеток спустя определенное количество времени обусловлено тем, что из-за большого количества цитоплазмы они при рассмотрении под световым микроскопом просвечиваются, однако по прошествии 10 мин они начинают разрушаться, ввиду чего становятся видимыми. Этот механизм требует дополнительных исследований. Допустим, что мы могли принять цианоциты за прозрачные клетки, однако размерные характеристики цианоцитов [41] не соответствуют таковым. Цианоциты имеют размеры, в несколько раз превышающие размеры циркулирующих гемоцитов. Также можно предположить, что это клетки с отклонениями в дифференцировке, которые были охарактеризованы Ковачевой как не идентифицированные гемоциты [4], однако они морфологически отличаются от представленных нами.
Происхождение и функции прозрачных клеток остаются не ясны, возможно, именно этот тип клеток выделил у Hyas araneus Roulston и соавт. [8] и определил их как прогемоциты. Этот тип клеток может являться предшественником других гемоцитов. Этой гипотезе сопутствует тот факт, что из агранулоцитов, помеченных 3H-тимидином, не происходит образование гранулярных гемоцитов [42], как это считалось ранее [43]. Однако данные, полученные Li и соавт. [27], говорят о том, что гранулоциты развиваются из полугранулоцитов, при этом остается не до конца ясным процесс возникновения агранулярных клеток. Как было указано во введении в гемолимфе, C. quadricarinatus также были обнаружены прозрачные клетки или циркулирующие в гемолимфе стволовые клетки. Вентао и соавт. [34] обнаружили клетки CD34+, однако не привели данные о том, какой процент от всех гемоцитов составляют CD34+ клетки. Ромеро и соавт. [35] вместе с гемоцитами, пораженными внутриклеточными микроорганизмами, обнаружили инфицированные стволовые клетки кроветворной ткани, некоторые из которых предположительно высвобождались в кровоток. Перечисленные выше наблюдения могут свидетельствовать о том, что прозрачными клетками могут являться высвободившиеся из кроветворной ткани стволовые клетки, которые по сути представляют из себя незрелые формы гемоцитов. В этом случае вызывает интерес проведение работы с возможным выделением и культивированием прозрачных клеток с целью доведения их до созревших стадий гемоцитов in vitro, по аналогии с работой Li и соавт. [30], в которой осуществили полную дифференцировку гемоцитов из кроветворной ткани.
В исследованиях при работе с гемолимфой австралийского красноклешневого рака в ряде работ, например [27–29, 32], не обнаруживают прозрачные клетки. Это может быть объяснено тем, что прозрачные клетки могут быть не зафиксированы прибором при проточной цитометрии, либо же просчитанные прозрачные клетки были отнесены к агранулоцитам, ввиду сопоставимых размеров и отсутствия гранул. При световой микроскопии эти клетки могли быть упущены из виду, так как в нативной гемолимфе их проявление начинает происходить через 10 мин после ее извлечения, а антикоагулянт сдвигает это время в большую сторону.
В связи с этим остаются актуальными дополнительные исследования по определению функций и происхождения прозрачных клеток, которые, возможно, помогут дать полную картину гемопоэза у ракообразных.
Не идентифицированные гемоциты. К этой группе клеток относятся гемоциты со смешанными морфологическими характеристиками, либо с характеристиками, не совпадающими с тремя известными типами гемоцитов, также гемоциты без гранул со слабо красящейся цитоплазмой. Не идентифицированные клетки затруднительно обнаружить в нативной гемолимфе, однако их можно обнаружить в мазке. Возможно, эти клетки являются переходными стадиями между циркулирующими и прикрепленными гемоцитами. Не исключено, что эти клетки могут быть артефактами, возникшими при изготовлении мазка.
В итоге полученные значения размеров изученных нами гемоцитов соответствуют тем, что освещены в работах ряда исследователей [8, 13, 16, 19, 22, 42, 44], посвященных некоторым высшим ракообразным (креветки, омары, лангусты, крабы, пресноводные раки – Fenneropenaeus chinensis, Paranephrops planifrons, Hyas araneus, Homarus americanus, Panulirus interruptus, Loxorhynchus grandi, Loxorhynchus grandi, Astacus astacus, Astacus leptodactylus) и, в частности, австралийскому красноклешневому раку [27, 28, 30, 45], но противоречат результатам Лагуткиной и соавт. [33]. В их работе приведены в 4.6–9.7 раза большие размеры гемоцитов, а самыми крупными элементами гемолимфы были прозрачные клетки – 103.6 мкм, у нас же они одни из самых маленьких – 10.7 мкм. При этом самыми мелкими были гранулоциты 67.1 мкм, которые в наших исследованиях наибольшие с диаметром 14.6 мкм.
Процентное содержание типов гемоцитов. На рис. 5 представлено процентное содержание трех типов гемоцитов. Доминирующим типом в гемолимфе C. quadricarinatus являются агранулоциты, их доля составляет 48.3 ± 11.4%. На долю полугранулоцитов и гранулоцитов приходится 26.3 ± 7.8% и 25.2 ± 6.9% соответственно от всех клеточных элементов в гемолимфе. Процентная доля гемоцитов в гемолимфе самок и самцов имела различные значения, так, статистически различалась доля полугранулоцитов (p < 0.05) и агранулоцитов (p < 0.05) (табл. 2). Выявлены корреляционные связи между долей гранулоцитов и агранулоцитов r = –0.762 (p < 0.01), между долей агранулоцитов и полугранулоцитов r = –0.786 (p < 0.01), также между долей гранулоцитов и полугранулоцитов 0.348 (p < 0.05).
Рис. 5.
Процентное содержание трех типов гемоцитов в гемолимфе C. quadricarinatus. GC – гранулоциты, SGC – полугранулоциты, HH – гиалиноциты (агранулоциты).

Таблица 2.
Гематологические показатели самцов и самок С. quadricarinatus
| Показатели | Самцы (n = 25) | Самки (n = 25) |
|---|---|---|
| ОЧГ, шт./мкл | 2808 ± 970 | 2709 ± 795 |
| Агранулоциты, % | 52.0 ± 10.0 | 44.5± 11.5 |
| Полугранулоциты, % | 24.0 ± 4.5 | 28.6 ± 9.6 |
| Гранулоциты, % | 23.8 ± 7.1 | 26.4 ± 6.5 |
Полученные данные не соотносятся с некоторыми литературными данными. Например, в работе Wentao и соавт. [34] показано, что доля гранулоцитов составляет примерно 60% от общего числа гемоцитов, а доля агранулоцитов и полугранулоцитов составляет 25 и 15% соответственно. В исследовании Li и соавт. [27] – наоборот, гранулоциты и полугранулоциты занимают доминирующее место в гемолимфе австралийского красноклешневого рака, а агранулоциты занимают незначительный процент. В то же время полученные нами данные совпадают с результатами нескольких других работ [32, 36].
Как указывалось ранее, прозрачные клетки не были обнаружены в гемолимфе, обработанной антикоагулянтом, поэтому для обнаружения процентной доли этих клеточных структур мы провели дополнительные наблюдения с нативной гемолимфой на десяти особях (рис. 6). Средняя доля прозрачных клеток составила 18.2 ± 3.8%, при этом снизилась доля агранулоцитов – она составила 38.5 ± 7.0% по сравнению с приведенными выше измерениями. Исходя из этого можно предположить, что часть прозрачных клеток в обработанной антикоагулянтом гемолимфе может быть воспринята как агранулоциты. Полученные данные сопоставимы с результатами Лагуткиной и соавт. [33], в работе которых доля прозрачных клеток составляет 23%. При этом как наши результаты, так и Лагуткиной [33] отличаются от полученных при исследовании других видов. У речных раков видов Аstacus astacus и Pontastacus leptodactyhis доля прозрачных клеток составляет в среднем 6.5–8.8 и 3.3–5.5% соответственно [5, 46], у краба Hyas araneus доля прогемоцитов составляет порядка 11.3% и возрастает при создании искусственной гемоцитопении путем отбора гемолимфы [8].
Рис. 6.
Процентное содержание четырех типов гемоцитов в гемолимфе C. quadricarinatus. GC – гранулоциты, SGC – полугранулоциты, HH – гиалиноциты (агранулоциты), TC – прозрачные клетки.

Общее число гемоцитов колеблется в широком диапазоне от 820 до 5510 шт./мкл, среднее количество клеток составляет 2707 ± 1096 шт./мкл. Наиболее частые значения ОЧГ находятся в интервалах от 1500 до 2500 шт./мкл и 3000–3500 шт./мкл (рис. 7).
Различия в ОЧГ между самками и самцами были статистически не достоверны (p = 0.82). Для изучения изменчивости ОЧГ в зависимости от массы был проведен корреляционный анализ Спирмена, а также сравнение пяти размерных групп рис. 8 с помощью критерия Краскела–Уоллиса. Достоверно значимых корреляционных связей между массой и ОЧГ не было обнаружено (p > 0.05). Сравнение с помощью критерия Краскела–Уоллиса показало, что различия в ОЧГ у пяти размерных групп статистически не достоверны (p > 0.05). Однако исходя из рис. 8 с увеличением массы в группах незначительно увеличивается ОЧГ, однако, стоит учитывать тот факт, что число наблюдений в каждой из групп разнится. Различия в уровне ОЧГ между самцами и самками были статистически не достоверны (p > 0.05), однако у самцов уровень ОЧГ был незначительно выше (табл. 2).
При сравнении данных уровня ОЧГ ряда других работ [32, 36, 47] с настоящим исследованием, было обнаружено, что он ниже в среднем в 1.4 раза. При этом у Wu и соавт. [37] ОЧГ ниже, чем в нашей работе, в 3.1 раза. Наиболее близкими к полученным нами значениям являются данные, приводящиеся в работе Bone и соавт. [48] – при содержании C. quadricarinatus в воде с температурой 27°С, ОЧГ составляет около 2500 шт./мкл, в то время как в нашей работе при содержании рака в воде с температурой 20–28°С среднее количество составляет 2707 шт./мкл. Нужно учитывать особенности и различия в условиях проведения исследований австралийского красноклешневого рака в приведенных работах: емкости содержания – аквариумы или УЗВ, плотности посадки, режим и качество кормления. Также внимания заслуживает тот факт, что для некоторых ракообразных наблюдаются различия в ОЧГ у диких и содержащихся в неволе животных. У новозеландских пресноводных раков Paranephrops planifrons дикого типа уровень ОЧГ превышает в несколько раз этот уровень у особей домашнего типа, при этом дифференцированное количество гемоцитов существенно не меняется, поэтому также стоит учитывать, откуда были взяты раки для исследований [19].
ЗАКЛЮЧЕНИЕ
Таким образом, дана морфологическая характеристика трех типов гемоцитов C. quadricarinatus. Обнаружены и описаны прозрачные клетки, имеющие дискуссионное происхождение и функции. Определены уровень ОЧГ и процентная доля типов гемоцитов. Однако необходимо проведение дополнительных цитохимических, молекулярных и биохимических исследований гемоцитов, так как каждый тип гемоцитов имеет ряд своих функций и особенностей.
Список литературы
Johansson MW, Keyser P, Sritunyalucksana K, Söderhäll K (2000) Crustacean haemocytes and haematopoiesis. Aquaculture 191 (1–3): 45–52. https://doi.org/10.1016/s0044-8486(00)00418-x
Cerenius L, Jiravanichpaisal P, Liu H, Söderhäll I (2010) Crustacean Immunity. In: Söderhäll K (ed) Invertebrate Immunity. Advanc Experiment Med Biol 708. Springer, Boston, MA. https://doi.org/10.1007/978-1-4419-8059-5_13
Александрова EH, Ковачева НП (2010) Прижизненное определение физиологического статуса десятиногих ракообразных (Сrustacea: Decapoda) по гематологическим показателям. Усп Физиол Наук 41 (2): 51–67. [Alexandrova EH, Kovatcheva NP (2010) In life determination of the physiological status of decapod crustaceans (Crustacea: Decapoda) by hematological characteristics. Prog Physiol Sci 41 (2): 51–67. (In Russ)].
Ковачева НП, Александрова ЕН (2010) Гематологические показатели как индикаторы физиологического состояния декапод: камчатского краба Paralithodes camtschaticus и речных раков родов Astacus и Pontastacus. М.Изд. ВНИРО. [Kovatcheva NP, Aleksandrova EN (2010) Hematological parameters as an indicators of physiological status of the decapods: red king crab Paralithodes camttshaticus and freshwater crayfish genus Astacus and Pontastacus. VNIRO Publ, Moscow. (In Russ)].
Аджиев ДД, Пронина ГИ, Иванов АА, Корягина НЮ (2018) Функциональные показатели пойкилотермных гидробионтов из природных и искусственных водных биоценозов. Сельскохоз Биол 53 (2): 337–347. [Adzhiev DD, Pronina GI, Ivanov AA, Koryagina NYu (2018) Functional indicators of poikilothermic aquatic species from natural and artificial water biocenoses. Agricult Biol 53 (2): 337–347. (In Russ)]. https://doi.org/10.15389/agrobiology.2018.2.337rus
Иванов АА, Пронина ГИ, Корягина НЮ, Ревякин АО (2013) Гомеостаз внутренней среды гидробионтов: видовые особенности хладнокровных. Изв Тимиряз Сельскохоз Акад (3):7 5–88. [Ivanov AA, Pronina GI, Koryagina NYu, Revyakin AO (2013) Internal environment homeostasis of hydrobionts: specific peculiarities of cold-blooded animals. Izvest Timiryazev Agricult Acad (3): 75–88. (In Russ)].
Пронина ГИ, Корягина НЮ (2014) Комплексная прижизненная физиологическая оценка речных раков в аквакультуре. Теор Прикладн Пробл Агропром Компл (4): 46–48. [Pronina GI, Koryagina NYu (2014) Comprehensive intravital physiological assessment of crayfishes in aquaculture. Theor Appl Probl Agro-industrial Complex (4): 46–48. (In Russ)].
Roulston C, Smith VJ (2011) Isolation and in vitro characterisation of prohaemocytes from the spider crab, Hyas araneus (L.). Devel Comparat Immunol 35 (5): 537–544. https://doi.org/10.1016/j.dci.2010.12.012
Mix MC, Sparks AK (1980) Hemocyte classification and differential counts in the dungeness crab, Cancer magister. J Invertebr Pathol 35 (2): 134–143. https://doi.org/10.1016/0022-2011(80)90176-7
Sternshein DJ, Burton PR (1980) Light and3 electron microscopic studies of crayfish hemocytes. J Morphol 165 (1): 67–83. https://doi.org/10.1002/jmor.1051650107
Martin GG, Graves BL (1985) Fine structure and classification of shrimp hemocytes. J Morphol 185: 339–348. https://doi.org/10.1002/jmor.1051850306
Tsing A, Arcier J-M, Brehélin M (1989) Hemocytes of Penaeid and Palaemonid shrimps: Morphology, cytochemistry, and hemograms. J Invertebr Pathol 53 (1): 64–77. https://doi.org/10.1016/0022-2011(89)90075-x
Hose JE, Martin GG, Gerard AS (1990) A decapod hemocyte classification scheme integrating morphology, Cytochemistry, and Function. Biol Bull 178 (1): 33–45. https://doi.org/10.2307/1541535
Jussila J (1997) Physiological responses of Astacid and Parastacid Crayfishes (Crustacea: Decapoda) to conditions of intensive culture. doc. dissertation. Perth: University of Kuopio.
Hijran YY, Hasan HA (2002) Haemocyte Classification and Differential Counts in the Freshwater Crab, Potamon fluviatilis. Tukr J Vet Anim Sci 26: 403–406.
Zhang ZF, Shao M, Kang KH (2006) Classification of haematopoietic cells and haemocytes in Chinese prawn Fenneropenaeus chinensis. Fish & Shellfish Immunol 21: 159–169. https://doi.org/10.1016/j.fsi.2005.11.003
Giulianini PG, Bierti M, Lorenzon S, Battistella S, Ferrero EA (2007) Ultrastructural and functional characterization of circulating hemocytes from the freshwater crayfish Astacus leptodactylus: Cell types and their role after in vivo artificial non-self challenge. Micron 38 (1): 49–57. https://doi.org/10.1016/j.micron.2006.03.019
Li C, Shields JD (2007) Primary culture of hemocytes from the Caribbean spiny lobster, Panulirus argus, and their susceptibility to Panulirus argus Virus 1 (PaV1). J Invertebr Pathol 94 (1): 48–55. https://doi.org/10.1016/j.jip.2006.08.011
Taylor S, Landman MJ, Ling N (2009) Flow cytometric characterization of freshwater crayfish hemocytes for the examination of physiological status in wild and captive animals. J Aquatic Animal Health 21 (3) 195–203. https://doi.org/10.1577/h09-003.1
Ding ZZ, Du JJ, Ou JJ, Li WW, Wu TT, Xiu YY, Meng QQ, Ren QQ, Gu WW, Xue HH, Tang JJ, Wang WW (2012) Classification of circulating hemocytes from the red swamp crayfish Procambarus clarkii and their susceptibility to the novel pathogen Spiroplasma eriocheiris in vitro. Aquaculture 356–357: 371–380. https://doi.org/10.1016/j.aquaculture.2012.04.042
Du J, Zhu H, Ren Q, Liu P, Chen J, Xiu Y, Yao W, Meng Q, Gu W, Wang W (2012) Flow cytometry studies on the Macrobrachium rosenbergii hemocytes sub-populations and immune responses to novel pathogen spiroplasma MR-1008. Fish & Shellfish Immunol 33 (4): 795–800. https://doi.org/10.1016/j.fsi.2012.07.006
Lv SS, Xu JJ, Zhao JJ, Yin NN, Binjie Lu B, Li SS, Chen YY, Xu HH (2014) Classification and phagocytosis of circulating haemocytes in Chinese mitten crab (Eriocheir sinensis) and the effect of extrinsic stimulation on circulating haemocytes in vivo. Fish & Shellfish Immunol 39 (2): 415–422. https://doi.org/10.1016/j.fsi.2014.05.036
Battison A, Cawthorn R, Horney B (2003) Classification of Homarus americanus hemocytes and the use of differential hemocyte counts in lobsters infected with Aerococcus viridans var. homari (Gaffkemia). J Invertebr Pathol 84 (3): 177–197. https://doi.org/10.1016/j.jip.2003.11.005
Лагуткина ЛЮ, Пономарев СВ (2008) Новый объект тепловодной аквакультуры – австралийский красноклешневый рак (Cherax quadricarinatus). Вестник АГТУ (6): 220–223. [Lagutkina LYu, Ponomarev SV 2008. New object of аquaculture – australian redclaw crayfish (Cherax quadricarinatus). Vestnik AGTU (6): 220–223.].
Лагуткина ЛЮ, Кузьмина ЕГ, Таранина АА, Ахмеджанова АБ, Ясинский ВС, Пономарев РА (2020) Фактологическое обеспечение практик повышения эффективности выращивания тропических пресноводных видов. Вестн Астраханск гос техн универ. Серия: Рыбное хозяйство (2): 94–105. [Lagutkina LYu, Kuzmina EG, Taranina AA, Ahmedzhanova AB, Yasin-skij VS, Ponomarev RA (2020) Factual support of practices to increase the efficiency of cultivation of tropical freshwater species. Bull Astrakhan State Techn Univer. Series: Fisheries (2): 94–105. (In Russ)].https://doi.org/10.24143/2073-5529-2020-2-94-105
Лагуткина ЛЮ, Кузьмина ЕГ, Таранина АА, Ахмеджанова АБ, Ясинский ВС, Пономарев РА (2020) Фактологическое обеспечение практик повышения эффективности выращивания тропических пресноводных видов. Вестн Астрахан Гос Технич Универ Серия: Рыбное хозяйство (2): 94–105. [Lagutkina LYu, Kuzmina EG, Taranina AA, Ahmedzhanova AB, Yasinskij VS, Ponomarev RA (2020) Factual support of practices to increase the efficiency of cultivation of tropical freshwater species. Bull Astrakhan State Techn Univers Series: Fisheries (2): 94–105. (In Russ)]. https://doi.org/10.24143/2073-5529-2020-2-94-105
Li F, Zheng Z, Li H, Fu R, Xu L, Yang Fet al (2021) Crayfish hemocytes develop along the granular cell lineage. Sci Rep 11 (1): 13099. https://doi.org/10.1038/s41598-021-92473-9
Duan H, Jin S, Zhang Y, Li F, Xiang J (2014) Granulocytes of the red claw crayfish Cherax quadricarinatus can endocytose beads, E. coli and WSSV, but in different ways. Develop & Compar Immunol 46 (2): 186–193. https://doi.org/10.1016/j.dci.2014.04.006
Li F, Chang X, Xu L, Yang F (2018) Different roles of crayfish hemocytes in the uptake of foreign particles. Fish & Shellfish Immunol 77: 112–119. https://doi.org/10.1016/j.fsi.2018.03.029
Li F, Xu L, Hui X, Huang W, Yang F (2019) Directed differentiation of granular cells from crayfish hematopoietic tissue cells. Fish & Shellfish Immunol 88: 28–35. https://doi.org/10.1016/j.fsi.2019.02.054
Zhu K, Yang F, Li F (2022) Molecular markers for hemocyte subpopulations in crayfish Cherax quadricarinatus. Devel & Compar Immunol 132: 104407. https://doi.org/10.1016/j.dci.2022.104407
Mauro M, Arizza V, Arculeo M, Attanzio A, Pinto P, Chirco P, Badalamenti G, Tesoriere L, Vazzana M (2022) Haemolymphatic Parameters in Two Aquaculture Crustacean Species Cherax destructor (Clark, 1836) and Cherax quadricarinatus (Von Martens, 1868). Animals 12 (5): 543. https://doi.org/10.3390/ani12050543
Лагуткина ЛЮ, Евграфова ЕМ, Кузьмина ЕГ, Мазлов АМ (2021) Гематологические и биохимические показатели гемолимфы австралийского красноклешневого рака. Вестн Астраханск гос техн универ. Серия: Рыбное хозяйство (2): 134–143. [Lagutkina LYu, Evgrafova EM, Kuzmina EG, Mazlov AM (2021) Hematological and biochemical indicators of Australian red-claw crayfish hemolymph. Bull Astrakhan State Technic Univer. Series: Fishing Industry (2): 134–143. (In Russ)].https://doi.org/10.24143/2073-5529-2021-2-134-143
Wentao Z, Wen L, Yunlong Z, Danli W, Zhongxiang M, Getao S (2017) Ultrastructural and immunocytochemical analysis of circulating hemocytes from Cherax quadricarinatus (von Martens, 1868). Indian J Anim Res 51 (1): 129–134. https://doi.org/10.18805/ijar.v0iOF.6823
Romero X, Turnbull JF, Jiménez R (2000). Ultrastructure and Cytopathology of a Rickettsia-like Organism Causing Systemic Infection in the Redclaw Crayfish, Cherax quadricarinatus (Crustacea: Decapoda), in Ecuador. J Invertebr Pathol 76 (2): 95–104. https://doi.org/10.1006/jipa.2000.4952
Sánchez-Salgado JL, Pereyra MA, Agundis C, Calzada-Ruiz M, Kantun-Briceño E, Zenteno E (2019) In vivo administration of LPS and β-glucan generates the expression of a serum lectin and its cellular receptor in Cherax quadricarinatus. Fish & Shellfish Immunol 94: 10–16. https://doi.org/10.1016/j.fsi.2019.08.061
Wu D-L, Liu Z-Q, Huang Y-H, Lv W-W, Chen M-H, Li Y-M, Zhao Y-L (2018) Effects of cold acclimation on the survival, feeding rate, and non-specific immune responses of the freshwater red claw crayfish (Cherax quadricarinatus). Aquacult Internat 26 (2): 557–567. https://doi.org/10.1007/s10499-018-0236-4
Paterson BD, Spanogle PT, Davidson GW, Hosking W, Nottingam S, Jussila J, Evans LH (2005) Prediction survival of western rock lobster Panuluris cygnus, using discriminant analysis of hemolymph parameters taken immediately following simulated handling treatments. New Zealand J Marine Freshwat Res 39 (5): 1129–1143. https://doi.org/10.1080/00288330.2005.9517380
Lin X, Söderhäll I (2011) Crustacean hematopoiesis and the astakine cytokines. Blood 117 (24): 6417–6424. https://doi.org/10.1182/blood-2010-11-320614
Sukhachev AN, Dyachkov IS, Romanyuk DS, Kumeyko VV, Sinitsina VF, Korolkova ED, Kharazova AD, Polevshchikov AV (2013) Morphological analysis of hemocytes of ascidian Halocynthia aurantium. Cell Tiss Biol (Tsitologiya) 55 (12): 901–906.
Ghiretti-Magaldi A, Milanesi C, Tognon G (1977) Hemopoiesis in crustacea decapoda: origin and evolution of hemocytes and cyanocytes of Carcinus maenas. Cell Different 6 (3–4): 167–186. https://doi.org/10.1016/0045-6039(77)90014-8
Мартынова МГ, Быстрова ОМ, Парфенов ВН (2008) Синтез нуклеиновых кислот и локализация предсердного натрийуретического пептида в гемоцитах речного рака. Цитология 50 (3): 243–248. [Martynova MG, Bystrova OA, Parfenov VN (2008) Synthesis of nucleic acids and localization of atrial natriuretic peptide in the crayfish haemocytes. Cell Tiss Biol (Tsitologiya) 50 (3): 243–248. (In Russ)].
Van de Braak CBT, Botterblom MHA, Liu W, Taverne N, van der Knaap WPW, Rombout JHWM (2002) The role of the haematopoietic tissue in haemocyte production and maturation in the black tiger shrimp (Penaeus monodon). Fish & Shellfish Immunol 12 (3): 253–272. https://doi.org/10.1006/fsim.2001.0369
Иванов АА, Пронина ГИ, Корягина НЮ (2021) Физиология гидробионтов. СПб. Лань. [Ivanov AA, Pronina GI, Koryagina NYu (2021) Physiology of hydrobionts. SPB. Lan (In Russ)].
Xu X, Duan H, Shi Y, Xie S, Song Z, Jin S, Li F, Xiang J (2018) Development of a primary culture system for haematopoietic tissue cells from Cherax quadricarinatus and an exploration of transfection methods. Develop & Comparat Immunol 88: 45–54. https://doi.org/10.1016/j.dci.2018.07.006
Пронина ГИ, Корягина НЮ (2015) Референсные значения физиолого-иммунологических показателей гидробионтов разных видов. Вестн Астраханск гос техн универ. Серия: Рыбное хозяйство 4:103–108. [Pronina GI, Ko-ryagina NYu (2015) Reference values of physiological and immunological parameters of hydrobionts of different species. Bull Astrakhan State Techn Univer. Series: Fisheries 4: 103–108. (In Russ)].
Liu YT, Chang CI, Hseu JR, Liu KF, Tsai JM (2013). Immune responses of prophenoloxidase and cytosolic manganese superoxide dismutase in the freshwater crayfish Cherax quadricarinatus against a virus and bacterium. Molec Immunol 56 (1–2): 72–80. https://doi.org/10.1016/j.molimm.2013.03.023
Bone JWP, Renshaw GMC, Furse JM, & Wild CH (2014). Using biochemical markers to assess the effects of imposed temperature stress on freshwater decapod crustaceans: Cherax quadricarinatus as a test case. J Compar Physiol B 185 (3): 291–301. https://doi.org/10.1007/s00360-014-0883-3
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии




