Журнал эволюционной биохимии и физиологии, 2023, T. 59, № 1, стр. 54-64
ВЛИЯНИЕ РАЗЛИЧНЫХ АГОНИСТОВ РЕЦЕПТОРА ЛЮТЕИНИЗИРУЮЩЕГО ГОРМОНА НА СТЕРОИДОГЕНЕЗ В ЯИЧНИКАХ ПОЛОВОЗРЕЛЫХ САМОК КРЫС
А. А. Бахтюков 1, К. В. Деркач 1, Е. А. Фокина 1, И. А. Лебедев 1, В. Н. Сорокоумов 2, Л. В. Баюнова 1, А. О. Шпаков 1, *
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
2 Институт химии, Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: alex_shpakov@list.ru
Поступила в редакцию 02.11.2022
После доработки 29.11.2022
Принята к публикации 30.11.2022
- EDN: GXGBYH
- DOI: 10.31857/S0044452923010035
Аннотация
Для стимуляции овариального стероидогенеза и контролируемой индукции овуляции в клинике применяют препараты гонадотропинов – хорионического гонадотропина человека (ХГЧ) и лютеинизирующего гормона (ЛГ), которые, однако, имеют ряд побочных эффектов, таких как снижение чувствительности яичников к эндогенному ЛГ и синдром гиперстимуляции яичников. Альтернативой ХГЧ и ЛГ могут стать аллостерические агонисты рецептора ЛГ/ХГЧ, в том числе разработанное нами тиено-[2,3-d]-пиримидиновое производное TP03. Целью работы было изучить влияние TP03 (40 мг/кг, в/б) и взятого для сравнения ХГЧ (30 МЕ/крысу, п/к) на овариальный стероидогенез у половозрелых самок крыс, находящихся в фазе позднего проэструса, в том числе обработанных антагонистом гонадолиберина Оргалутраном (100 мкг/кг, п/к, за 3 ч до введения TP03 или ХГЧ). В крови крыс оценивали уровни эстрадиола, прогестерона и ЛГ, в яичниках – экспрессию генов стероидогенеза (Star, Cyp11a1, Hsd3b, Cyp17a1, Hsd17b, Cyp19a1) и рецептора ЛГ/ХГЧ (Lhcgr). Через 3 ч после введения TP03 и ХГЧ повышали уровень прогестерона в крови, стимулировали экспрессию генов холестерин-транспортирующего белка StAR, цитохрома P450c17 и ароматазы (цитохрома P450c19), и этот эффект выявлялся как у контрольных крыс с нормальным уровнем ЛГ, так и у Оргалутран-обработанных крыс с пониженным уровнем ЛГ. Эффекты TP03 были сопоставимы с таковыми ХГЧ, но в отличие от ХГЧ аллостерический агонист не снижал функционирования гипоталамо-гипофизарно-гонадной оси, на что указывает отсутствие его влияния на уровень ЛГ в крови и экспрессию рецепторов ЛГ/ХГЧ. Полученные данные свидетельствуют о способности TP03 эффективно стимулировать овариальный стероидогенез и указывают на перспективность разработки на его основе лекарственных форм для контролируемой индукции овуляции.
Разработка эффективных подходов для коррекции нарушений овариального стероидогенеза при различных репродуктивных расстройствах, а также для осуществления контролируемой индукции овуляции при вспомогательных репродуктивных технологиях представляет собой одну из актуальных проблем современной репродуктивной эндокринологии. Используемые для этого гонадотропины – лютеинизирующий гормон (ЛГ) и хорионический гонадотропин человека (ХГЧ), имеют ряд существенных недостатков [1]. Во многом это обусловлено использованием ХГЧ и ЛГ в дозах, которые приводят к значительному превышению физиологических концентраций гонадотропинов в крови. В случае индукции овуляции при вспомогательных репродуктивных технологиях это может приводить к тяжелому осложнению – синдрому гиперстимуляции яичников [2]. Применение других фармакологических стратегий, в которых гонадотропины заменяют на агонисты гонадолиберина (GnRH) или используют протокол комбинированного применения GnRH и низких доз ХГЧ, снижает риск развития синдрома гиперстимуляции яичников, но при этом в значительном числе случаев снижает частоту наступления беременности [3]. Еще одной причиной могут быть значимые отличия паттерна N-гликозилирования препаратов ЛГ и ХГЧ, как правило их рекомбинантных форм, от такового эндогенных гонадотропинов, что влияет на их фармакокинетику и специфичность активации внутриклеточных эффекторных белков и транскрипционных факторов [4, 5]. Известно, что активация рецептора ЛГ/ХГЧ приводит к стимуляции сразу нескольких типов гетеротримерных G-белков и адаптерных белков β-аррестинов: через Gs-белок и сопряженный с ним фермент аденилатциклазу активируются цАМФ-зависимые сигнальные пути, через Gq/11-белок и фосфолипазу Сβ – кальций-зависимые пути, через β-аррестины осуществляются эндоцитоз лиганд-рецепторного комплекса с последующей деградацией или рециклизацией рецептора и происходит стимуляция каскада митоген-активируемых протеинкиназ [5, 6]. Изменение паттерна N-гликозилирования гонадотропинов может существенно изменить профиль активации ими G-белков и β-аррестинов, одним из следствий чего может стать даун-регуляция рецепторов ЛГ/ХГЧ. Так, длительная активация фолликулярных клеток с помощью ЛГ или ХГЧ вызывает в значительной степени выраженное снижение экспрессии гена рецептора ЛГ/ХГЧ и уменьшает число активных рецепторов на поверхности клеток, что является причиной развития резистентности к ЛГ [7–9]. Снижение чувствительности к эндогенному ЛГ было продемонстрировано у мужчин, которых длительное время лечили ХГЧ [10], а также у самцов крыс, которых многократно обрабатывали ХГЧ в дозах, превышающих физиологические, причем ключевым фактором развития резистентности к ЛГ в этом случае было значимое снижение числа рецепторов ЛГ/ХГЧ [11, 12].
Все вышесказанное указывает на необходимость разработки альтернативных путей специфичной активации рецептора ЛГ/ХГЧ, которые позволят стимулировать овариальный стероидогенез и индуцировать овуляцию, не вызывая синдром гиперстимуляции яичников, развитие резистентности к ЛГ и другие нежелательные последствия гонадотропиновой терапии. Основные ожидания здесь связывают с низкомолекулярными гетероциклическими соединениями со свойствами агонистов рецептора ЛГ/ХГЧ, в первую очередь, с производными тиено[2,3-d]-пиримидина [13–15]. Нами ранее были разработаны тиено[2,3-d]-пиримидиновые производные TP01, TP03 и TP04 с активностью агонистов рецептора ЛГ/ХГЧ, которые при внутрибрюшинном и пероральном способах введения самцам крыс повышали уровень тестостерона в семенниках и крови, стимулировали стероидогенез в семенниках, восстанавливали уровни тестостерона и сперматогенез при диабетической патологии и старении [11, 16, 17]. Однако данные о влиянии низкомолекулярных аллостерических агонистов рецептора ЛГ/ХГЧ на овариальный стероидогенез у половозрелых самок грызунов отсутствуют.
Целью работы было изучить влияние соединения TP03 и взятого для сравнения ХГЧ на овариальный стероидогенез у половозрелых самок крыс, находящихся в стадии позднего проэструса, в том числе предварительно обработанных Оргалутраном, антагонистом GnRH с пролонгированным действием. В крови крыс оценивали динамику изменений уровней эстрадиола, прогестерона и ЛГ, в яичниках – экспрессию генов стероидогенеза и рецептора ЛГ/ХГЧ.
МЕТОДЫ ИССЛЕДОВАНИЯ
В опытах использовали четырех-пятимесячных самок крыс, которых содержали в стандартных условиях вивария, по пять животных в клетке, со свободным доступом к воде и сухому корму.
Перед началом эксперимента определяли фазу эстрального цикла у половозрелых самок крыс и отбирали тех животных, которые находились в фазе проэструса. Определение фазы эстрального цикла крыс производили путем микроскопического изучения вагинального мазка, в соответствии со стандартными методиками [18, 19]. Мазки забирали ежедневно в 11:00 по следующей схеме. Переднюю часть тела крысы фиксировали, и с помощью поднятия животного за хвост визуализировали преддверие влагалища. Смоченный в физиологическом растворе ватный тампон вводили во влагалище и несколько раз проворачивали, после чего мазок переносили с тампона на сухое предметное стекло. Препарат высушивали на воздухе и окрашивали метиленовым синим для проведения микроскопии. Стадии эстрального цикла определяли исходя из соотношения трех типов клеток в мазке: ядросодержащих эпителиоцитов, безъядерных ороговевших эпителиоцитов и лейкоцитов. В фазе проэструса в мазке присутствовали только ядросодержащие эпителиоциты.
У животных с верифицированной фазой проэструса из хвостовой вены забирали образцы крови для оценки базовых уровней гормонов (12.00), после чего их сразу обрабатывали Оргалутраном (Organon N.V., Нидерланды), антагонистом GnRH, который вводили подкожно в разовой дозе 100 мкг/кг массы тела. Крысам без обработки Оргалутраном (контроль) вводили физиологический раствор в том же объеме и в те же сроки. Спустя 3 ч после обработки Оргалутраном (15.00) у животных забирали образцы крови для оценки ранних эффектов антагониста GnRH, после чего им однократно вводили агонисты рецептора ЛГ/ХГЧ – TP03 и ХГЧ, используя дозы, подобранные на основании предварительных экспериментов и вызывающие максимальный стероидогенный эффект. В случае TP03 доза составила 40 мг/кг (внутрибрюшинно), в случае ХГЧ – 30 МЕ/крысу (подкожно). Контрольным животным (без обработки Оргалутраном) также вводили эти препараты в тех же дозах. Части контрольных крыс и животным с обработкой Оргалутраном вместо агонистов рецептора ЛГ/ХГЧ вводили ДМСО (внутрибрюшинно) в том же объеме (200 мкл), что и TP03. Ранее нами было показано, что ДМСО при внутрибрюшинном введении в указанном объеме не влияет на показатели стероидогенеза и на метаболические, гормональные и функциональные показатели [11]. Через 3 ч после введения агонистов (через 6 ч после обработки Оргалутраном) животных подвергали анестезии (хлоральгидрат, 400 мг/кг, в/б), повторно забирали у них кровь для оценки уровней гормонов и затем декапитировали. После декапитации забирали и взвешивали яичники и с помощью ПЦР в реальном времени измеряли в них экспрессию целевых генов.
В общей сложности были сформированы и изучены следующие 6 групп (в каждой по 5 крыс): контрольные крысы, без обработки Оргалутраном и агонистами рецептора ЛГ/ХГЧ (группа C), крысы с обработкой Оргалутраном, но без введения агонистов рецептора ЛГ/ХГЧ (группа Org), крысы без обработки Оргалутраном, но с введением TP03 (группа C+TP) или ХГЧ (группа C + hCG), крысы с обработкой Оргалутраном и с последующим введением TP03 (группа Org+TP) или ХГЧ (группа Org + hCG).
5-амино-N-трет-бутил-2-(метилсульфанил)-4-(3(никотинамидо)фенил)тиено[2,3-d]пиримидин-6-карбоксамид (TP03) синтезировали с использованием реакции 1.0 эквивалента 5-амино-4-(3-аминофенил)-N-трет-бутил-2-(метилсульфанил)тиено[2,3-d]пиримидин-6-карбоксамида с 1.1 эквивалентом никотиновой кислоты в присутствии 1.1 эквивалента 1-[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиний 3-оксид гексафторфосфата (HATU) и 1.2 эквивалента N,N-диизопропилэтиламина в сухом N,N-диметилформамиде, как описано ранее [17]. Реакцию осуществляли в течение 5 ч (t = 22°C), целевой продукт очищали перекристаллизацией из этанола, на заключительном этапе использовали колоночную хроматографию. Соединение TP03 представляло собой желтый негигроскопичный порошок с температурой плавления, равной 157–159°C. Структура соединения TP03 была подтверждена данными ЯМР-спектроскопии и масс-спектрометрии высокого разрешения. Результаты 1H-ЯМР-спектроскопии (ДМСО-d6), δ, ppm (J, Hz): 1.37 (9H, s, C(CH3)3); 2.62 (3H, s, SCH3); 6.14 (2H, s, NH2); 6.98 (1H, s, NH-t-Bu); 7.42 (1H, d, J = 7.8, 4'-H); 7.57–7.64 (2H, m, 5'-H и 5"-H); 8.04 (1H, d, J = 8.2, 2'-H); 8.08 (1H, s, 6'-H); 8.33 (1H, d, J = 7.7, 4"-H); 8.78 (1H, d, J = 4.8, 6"-H); 9.14 (1H, s, 2"-H), 10.72 (1H, s, 3'-NH). Результаты 13C-ЯМР-спектроскопии (ДМСО-d6), δ, ppm: (14.3 (SCH3); 29.2 (C(CH3)3); 51.9 (C(CH3)3); 97.7; 117.8; 120.9; 122.5; 124.0; 124.9; 129.8; 130.8; 136.0; 137.1; 139.6; 144.7; 149.2; 152.8; 162.5; 164.9; 165.2; 167.8; 168.8). По данным масс-спектрометрии высокого разрешения (electrospray ionization – time of flight, ESI-TOF) масса молекулярного иона соединения TP03 (M + Na+) составила 515.1304, что практически совпадало с рассчитанной массой молекулярного иона для этого соединения (515.1294). Для регистрации масс-спектров использовали спектрометр “Bruker micrOTOF” (“Bruker”, Германия), для регистрации ЯМР-спектров – спектрометр “Bruker Avance III 400” (400.13 МГц для 1H-ЯМР и 100.61 МГц для 13C‑ЯМР) (“Bruker”, Германия).
Уровни эстрадиола и прогестерона в крови крыс определяли с помощью иммуноферментного анализа, используя наборы “Эстрадиол-ИФА” и “Прогестерон-ИФА” (“ХЕМА”, Россия). Уровень ЛГ определяли с помощью набора “ELISA for LH, Rat” (“Cloud-Clone Corp.”, США).
Тотальную РНК из яичников выделяли с помощью реагента “ExtractRNA” (“Евроген”, Россия), затем проводили обратную транскрипцию для получения кДНК с помощью набора “MMLV RT Kit” (“Евроген”, Россия). ПЦР в реальном времени проводили на амплификаторе “Applied Biosystems® 7500 Real-Time PCR System” (“Life Technologies, Thermo Fisher Scientific Inc.”, США) в смеси, содержащей 0.4 мкМ прямого и обратного праймеров, используя реагент “qPCR-HS SYBR+Low ROX” (“Евроген”, Россия). Последовательности праймеров представлены в табл. 1. Для количественного анализа данных по генной экспрессии использовали метод delta-delta Ct [20]. Для расчетов использовали программное обеспечение 7500 Software v2.0.6 и Expression Suite Software v1.0.3. Значения RQ для генной экспрессии рассчитывали по отношению к контролю, который был принят за единицу. Экспрессия гена Actb, кодирующего актин B, была использована в качестве эндогенного контроля.
Таблица 1.
Последовательности праймеров, используемых для оценки экспрессии генов в яичниках крыс
| Ген | Прямой и обратный праймеры | GenBank |
|---|---|---|
| Lhcgr | (For) CTGCGCTGTCCTGGCC; (Rev) CGACCTCATTAAGTCCCCTGAA |
NM_012978.1 |
| Star | (For) AAGGCTGGAAGAAGGAAAGC; (Rev) CACCTGGCACCACCTTACTT |
NM_031558.3 |
| Cyp11a1 | (For) TATTCCGCTTTGCCTTTGAG; (Rev) CACGATCTCCTCCAACATCC |
NM_017286.3 |
| Hsd3b | (For) AGGCCTGTGTCCAAGCTAGTGT; (Rev) CTCGGCCATCTTTTTGCTGTAT |
XM_017591325.1 |
| Cyp17a1 | (For) CATCCCCCACAAGGCTAAC; (Rev) TGTGTCCTTGGGGACAGTAAA |
XM_006231435.3 |
| Hsd17b | (For) CCTTTGGCTTTGCCATGAGA; (Rev) CAATCCATCCTGCTCCAACCT |
NM_024392.2 |
| Cyp19a1 | (For) GGTATCAGCCTGTCGTGGAC; (Rev) AGCCTGTGCATTCTTCCGAT |
NM_017085.2 |
| Actb | (For) CTGGCACCACACCTTCTACA; (Rev) AGGTCTCAAACATGATCTGGGT |
NM_031144.3 |
Для статистического анализа полученных данных использовали программу “Microsoft Office Excel 2007”. Нормальность распределения оценивали в соответствии с критерием Шапиро–Уилка. Для сравнения двух выборок с нормальным распределением использовали t-критерий Стьюдента, для сравнения трех групп – дисперсионный анализ с поправкой Бонферрони. Статистически значимыми считали различия при p < 0.05. Данные представляли как M ± SEM.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Масса яичников, которая в контрольной группе самок крыс составила 0.114 ± 0.010 г, при обработке TP03 и ХГЧ значимо не менялась и составила 0.132 ± 0.007 и 0.138 ± 0.007 г соответственно (p > 0.05 в сравнении с контролем). При обработке Оргалутраном масса яичников также не менялась (0.104 ± 0.011 г, p > 0.05 в сравнении с группой “C”). Отмечали тенденцию к повышению массы яичников в группах “Org+TP” (0.136 ± 0.010 г) и “Org + hCG” (0.140 ± 0.011 г), но различия с группой “Org” не были значимыми (p > 0.05).
Уровень ЛГ в крови контрольных крыс менялся в ходе эксперимента, в значительной степени повышаясь к 15.00 в сравнении с исходной точкой (12.00), и сохранялся на высоком уровне до 18.00 (рис. 1). Обработка Оргалутраном, антагонистом GnRH подавляла продукцию ЛГ, что выражалось в значительном снижении уровня гормона, который через 6 ч после введения Оргалутрана был почти в два раза ниже, чем в контрольной группе. На это указывают значения AUC12.00–18.00, интегрированной площади под кривой “концентрация ЛГ (нг/мл)–время (ч)”, для исследуемых групп (табл. 2). Обработка TP03 спустя 3 ч после его введения (18.00) слабо влияла на уровень ЛГ в группах с обработкой Оргалутраном и без таковой, в то время как обработка ХГЧ через 3 ч значимо снижала уровень ЛГ у контрольных крыс (“C + hCG” vs. “C”, p = 0.016), но не влияла на уровень гормона в группе “Org + hCG” (рис. 1). При этом, однако, значения AUC12.00–18.00 в группах “C” и “C + hCG” не различались (табл. 2).
Рис. 1.
Уровни лютеинизирующего гормона в крови самок крыс в фазе проэструса и влияние на них обработки антагонистом GnRH Оргалутраном (однократно, подкожно, 100 мкг/кг) и агонистами рецептора ЛГ/ХГЧ – TP03 (однократно, внутрибрюшинно, 40 мг/кг) и ХГЧ (однократно, подкожно, 30 МЕ/крысу).
a – различия внутри каждой группы во временных точках 15.00 и 18.00 по сравнению с начальной точкой (12.00) и b – различия между контролем и группами “Org”, “C + TP”, “C + hCG” в сходных временных точках статистически значимы при p < 0.05. Во всех группах n = 5, значения представлены как M ± SEM.
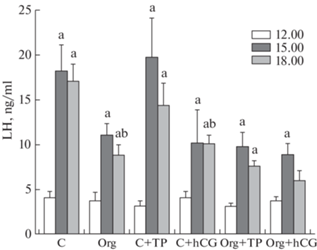
Таблица 2.
Значения AUC (интегрированной площади под кривыми “концентрация гормона – время”) для прогестерона, эстрадиола и ЛГ у контрольных крыс и у животных, обработанных Оргалутраном и агонистами рецептора ЛГ/ХГЧ
| Группа | ЛГ | Прогестерон | Эстрадиол |
|---|---|---|---|
| C | 85.9 ± 7.8 | 271 ± 38 | 3.09 ± 0.22 |
| Org | 52.6 ± 6.1 a | 125 ± 14 a | 2.27 ± 0.20 a |
| C+TP | 85.9 ± 16.0 | 407 ± 29 a | 3.80 ± 0.32 |
| C + hCG | 79.2 ± 11.3 | 381 ± 52 | 3.47 ± 0.44 |
| Org+TP | 46.0 ± 4.7 | 249 ± 32 b | 2.66 ± 0.33 |
| Org + hCG | 41.7 ± 4.4 | 262 ± 24 b | 2.84 ± 0.26 |
Примечание. Значения AUC включают шестичасовой временной промежуток (с 12.00 до 18.00) и выражены в относительных единицах. a – различия между контролем и группами “Org”, “C+TP”, “C + hCG” и b – различия между группой “Org” и группами “Org+TP”, “Org + hCG” статистически значимы при p < 0.05. Во всех группах n = 5, значения представлены как M ± SEM.
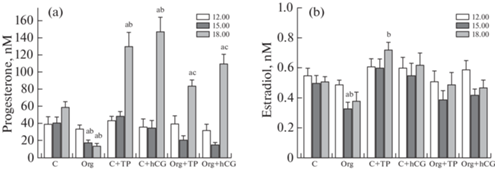
Уровень прогестерона в крови контрольных крыс, находившихся в фазе проэструса, на протяжении эксперимента существенно не менялся, в то время как через 3 ч после обработки крыс с помощью TP03 и ХГЧ он значимо повышался, причем эффективность препаратов в выбранных для исследования дозах была сходной (рис. 2, табл. 2). После обработки Оргалутраном отмечали значимое снижение уровня прогестерона – через 6 ч после обработки его концентрация в крови крыс группы “Org” была в 4.3 раза ниже, чем у контрольных животных (рис. 2). На ослабление продукции прогестерона указывают значения AUC12.00–18.00 интегрированной площади под кривой “концентрация прогестерона (нМ)–время (ч)”, которые в группе “Org” были на 54% ниже, чем в контроле (табл. 2). Оба агониста рецептора ЛГ/ХГЧ повышали уровень прогестерона у крыс, обработанных Оргалутраном, но их эффекты были менее выражены, чем в контрольных группах (рис. 2). Уровень эстрадиола на протяжении эксперимента слабо менялся в контрольной группе, и обработка Оргалутраном и агонистами рецептора ЛГ/ХГЧ на него влияла лишь в небольшой степени (рис. 2).
Рис. 2.
Уровни прогестерона (а) и эстрадиола (b) в крови самок крыс в фазе проэструса и влияние на них обработки Оргалутраном и агонистами рецептора ЛГ/ХГЧ – TP03 и ХГЧ.
a – различия внутри каждой группы во временных точках 15.00 и 18.00 по сравнению с начальной точкой (12.00), b – различия между контролем и группами “Org”, “C+TP”, “C + hCG” и c – различия между группой “Org” и группами “Org+TP”, “Org + hCG” в сходных временных точках статистически значимы при p < 0.05. Во всех группах n = 5, значения представлены как M±SEM.
Исследование в яичниках крыс экспрессии генов овариального стероидогенеза и гена, кодирующего рецептор ЛГ/ХГЧ, привело к следующим результатам. Экспрессия гена Star, кодирующего холестерин-транспортирующий белок StAR, снижалась в группе с обработкой Оргалутраном и повышалась при обработке обоими агонистами рецептора ЛГ/ХГЧ контрольных и обработанных Оргалутраном животных (табл. 3). Экспрессия гена Cyp11a1, кодирующего цитохром P450scc (side chain cleavage enzyme, CYP11A1), превращающий холестерин в прегненолон, имела тенденцию к снижению в группе “Org”, но различия с контролем не были статистически значимыми (p = 0.069). При этом TP03 и ХГЧ слабо влияли на экспрессию гена Cyp11a1 в контрольных группах, но значимо повышали ее в группах с обработкой Оргалутраном (табл. 3).
Таблица 3.
Экспрессия стероидогенных генов в яичниках крыс и влияние на нее обработки Оргалутраном (100 мкг/кг) и агонистами рецептора ЛГ/ХГЧ – TP03 (40 мг/кг) и ХГЧ (30 МЕ/крысу)
| Группа | Star | Cyp11a1 | Hsd3b | Cyp17a1 | Hsd17b |
|---|---|---|---|---|---|
| RQ, отн. ед. | |||||
| C | 1.03 ± 0.13 | 1.03 ± 0.16 | 1.01 ± 0.13 | 1.05 ± 0.13 | 1.01 ± 0.09 |
| Org | 0.57 ± 0.11 a | 0.65 ± 0.08 | 0.80 ± 0.10 | 0.15 ± 0.03 a | 1.11 ± 0.04 |
| C+TP | 1.51 ± 0.10 a,b | 1.37 ± 0.03 b | 0.96 ± 0.06 | 2.44 ± 0.33 a,b | 1.29 ± 0.15 |
| C + hCG | 1.62 ± 0.13 a,b | 1.24 ± 0.18 b | 0.76 ± 0.08 | 3.42 ± 0.55 a,b | 0.72 ± 0.06 a,b |
| Org+TP | 1.52 ± 0.19 b | 1.41 ± 0.16 b | 1.08 ± 0.16 | 1.75 ± 0.20 a,b | 1.52 ± 0.19 |
| Org + hCG | 1.56 ± 0.15 b | 1.25 ± 0.12 b | 1.07 ± 0.09 | 2.98 ± 0.53 a,b | 1.15 ± 0.10 |
Обработка антагонистом GnRH приводила к снижению в 7 раз экспрессии гена Cyp17a1, кодирующего цитохром P450c17 (CYP17A1), который катализирует двухстадийное превращение прегненолона в дегидроэпиандростерон (ДГЭА) или прогестерона в андростендион. При этом обработка TP03 и ХГЧ эффективно стимулировала экспрессию этого гена как у контрольных, так и у обработанных Оргалутраном животных (табл. 3). Следует, однако, отметить, что стимулирующий эффект ХГЧ в обоих случаях превышал таковой TP03. Экспрессия генов Hsd3b и Hsd17b, кодирующих соответственно 3β- (3β-HSD) и 17β-гидроксистероиддегидрогеназы (17β-HSD), существенно не менялась как при обработке Оргалутраном, так и агонистами рецептора ЛГ/ХГЧ, за исключением группы “C + hCG”, в которой отмечали понижение экспрессии гена Hsd17b как по сравнению с контролем, так и группой “Org” (табл. 3). Фермент 3β-HSD осуществляет превращение прегненолона в прогестерон, в то время как 17β-HSD в зависимости от подтипа фермента катализирует широкий спектр реакций на заключительных стадиях овариального стероидогенеза, включая синтез эстрогенов.
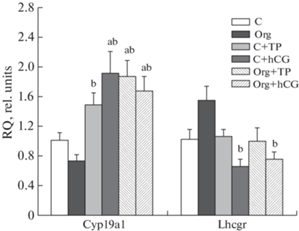
Экспрессия гена Cyp19a1, кодирующего фермент ароматазу, превращающего андрогены в эстрогены, слабо менялась при обработке самок крыс Оргалутраном, но значимо повышалась при обработке TP03 и ХГЧ как в контрольных, так и в обработанных антагонистом GnRH группах животных (рис. 3). Экспрессия гена Lhcgr, кодирующего рецептор ЛГ/ХГЧ, при обработке Оргалутраном имела тенденцию к повышению (p = 0.05), что ассоциировано со снижением уровня эндогенного ЛГ в крови животных (рис. 3). Обработка ХГЧ значимо снижала ее по отношению к группе “Org”, но не по сравнению с контролем. Во всех группах с обработкой TP03 экспрессия гена Lhcgr была сходной с ее значением в контроле (рис. 3).
Рис. 3.
Экспрессия генов ароматазы (Cyp19a1) и рецептора ЛГ/ХГЧ в яичниках крыс и влияние на нее обработки Оргалутраном (100 мкг/кг), TP03 (40 мг/кг) и ХГЧ (30 МЕ/крысу).
a – различия с группой “C” и b – различия с группой “Org” статистически значимы при p < 0.05. Во всех группах n = 5, значения представлены как M ± SEM.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
У препаратов мочевой формы ХГЧ и рекомбинантного ЛГ, широко применяемых для лечения репродуктивных дисфункций у женщин и во вспомогательных репродуктивных технологиях, имеются существенные недостатки, обусловленные гиперактивацией овариального стероидогенеза, снижением чувствительности яичников к эндогенным гонадотропинам, развитием синдрома гиперстимуляции яичников. В качестве возможной альтернативы рассматривают низкомолекулярные агонисты рецептора ЛГ/ХГЧ, взаимодействующие с его аллостерическим сайтом, расположенным внутри трансмембранного домена. Ранее нами были получены производные тиено[2,3-d]-пиримидина – соединения TP01, TP03 и TP04, способные активировать рецептор ЛГ/ХГЧ по аллостерическому механизму, которые при внутрибрюшинном и пероральном введении самцам крыс стимулировали у них тестикулярный стероидогенез [11, 16, 17], а в условиях диабета и при физиологическом старении восстанавливали андрогенный дефицит и сперматогенез [11, 17]. Другими авторами производные тиено[2,3-d]-пиримидина, в том числе соединение Org43553, были использованы для стимуляции стероидогенеза в овариальных клетках in vitro и для индукции овуляции у самок крыс в условиях in vivo [14, 21, 22], а также для контролируемой индукции овуляции у женщин-добровольцев [23]. Следует отметить, что наряду с агонистами, в настоящее время нами и другими авторами разработаны низкомолекулярные антагонисты рецептора ЛГ/ХГЧ, которые взаимодействуют с тем же трансмембранным аллостерическим сайтом, но при этом стабилизируют неактивную конформацию рецептора [24, 25].
В настоящем исследовании было впервые изучено влияние TP03, наиболее активного из разработанных нами производных тиено[2,3-d]-пиримидинов [17], на уровни стероидных гормонов в крови и на экспрессию ключевых генов овариального стероидогенеза у половозрелых самок крыс, в том числе обработанных Оргалутраном. При внутрибрюшинном введении TP03 вызывал значимое повышение уровня прогестерона как у контрольных крыс, так и у животных, обработанных Оргалутраном (действующее вещество Ганиреликс). По величине стимулирующего эффекта в обеих группах животных TP03 был сопоставим с ХГЧ (рис. 2). Выявленная нами способность TP03 эффективно стимулировать продукцию прогестерона согласуется с результатами экспериментов in vitro, полученными другими авторами при обработке фолликулярных клеток другим тиено[2,3-d]-пиримидиновым производным – Org43553 [14, 21]. Необходимо отметить, что антагонисты GnRH с пролонгированным действием, включая Ганиреликс, в условиях in vitro и in vivo быстро и эффективно снижают секрецию ЛГ и, как следствие, ингибируют продукцию прогестерона яичниками [26, 27]. В нашем случае Оргалутран значимо снижал уровень циркулирующего в крови ЛГ через 6 ч после обработки, хотя уже через 3 ч отмечалась тенденция к снижению уровня гормона (рис. 1). Вследствие этого прирост уровня прогестерона, который вызывали TP03 и ХГЧ у крыс, обработанных Оргалутраном, был обусловлен почти исключительно стимулирующим воздействием вводимых препаратов на овариальный стероидогенез.
Стимулирующие продукцию прогестерона эффекты TP03 и ХГЧ, оцениваемые по вызываемому ими приросту концентрации гормона над его уровнем в соответствующей необработанной агонистами рецептора ЛГ/ХГЧ группе, были сходными, что указывает на отсутствие значимых изменений чувствительности к ним рецепторов ЛГ/ХГЧ и системы овариального стероидогенеза в условиях подавления секреции ЛГ Оргалутраном. В этой связи нужно отметить, что через 6 ч после обработки антагонистом GnRH в яичниках отмечалась тенденция к повышению экспрессии гена рецептора ЛГ/ХГЧ, как компенсаторная реакция на снижение уровня ЛГ в крови и недостаточную в связи с этим активацию ЛГ-зависимых сигнальных путей в фолликулярных клетках. В пользу этого свидетельствует тот факт, что применение ХГЧ вызывало двукратное снижение экспрессии гена Lhcgr (рис. 3). Необходимо отметить, что ХГЧ-индуцированное снижение экспрессии гена рецептора ЛГ/ХГЧ было показано другими авторами в фолликулярных клетках яичников [7–9], а нами ранее в клетках Лейдига семенников крыс [11, 25]. Наряду с этим обработка контрольных крыс с помощью ХГЧ приводила к значимому снижению уровня ЛГ в крови, что указывает на ХГЧ-индуцированное подавление продукции эндогенных гонадотропинов.
Нами установлено, что TP03 и ХГЧ практически не влияли на продукцию эстрадиола, Это обусловлено тем, что пик эстрадиола в ходе эстрального цикла приходится на заключительную стадию диэструса и первую половину фазы проэструса, а исследование включало вторую половину фазы проэструса с характерным для него повышением продукции прогестерона, вызываемого агонистами рецептора ЛГ/ХГЧ, в том числе эндогенным ЛГ [28, 29].
Исследование экспрессии стероидогенных генов показало, что введение TP03 и ХГЧ контрольным и обработанным Оргалутраном крысам существенно повышает в яичниках экспрессию генов Star и Cyp17a1, кодирующих ключевые для протекания овариального стероидогенеза белки – холестерин-транспортирующий белок StAR и цитохром P450c17 (CYP17A1). Белок StAR является одной из основных мишеней при стимуляции клеток теки и гранулезы яичников ЛГ и ХГЧ, поскольку промотор гена Star содержит сайты связывания с цАМФ-зависимыми транскрипционными факторами, в первую очередь CREB, которые активируются через посредство сигнального пути рецептор ЛГ/ХГЧ–Gs-белок–аденилатциклаза–протеинкиназа А [30]. Согласно ранее полученным нами в условиях in vitro данным, TP03 и его структурные аналоги через посредство рецептора ЛГ/ХГЧ селективно стимулируют аденилатциклазу и повышают внутриклеточный уровень цАМФ, действуя подобно ХГЧ, но более селективно в отношении Gs-белок-зависимых путей [31, 32]. Вследствие этого способность TP03 активировать цАМФ-зависимые сигнальные каскады является причиной повышения экспрессии гена Star, сопоставимого с таковым при использовании ХГЧ. Тот факт, что стимулирующий эффект в яичниках не столь значителен, как в случае воздействия TP03 на экспрессию гена Star в тестикулярных клетках [17], может быть обусловлен сравнительно высоким базовым уровнем экспрессии этого гена на стадии позднего проэструса [33].
Цитохром P450c17 совмещает в себе активности 17-гидроксилазы и 17,20-лиазы и катализирует различные стероидогенные реакции, в зависимости от фазы цикла, типа клеток и видовой принадлежности организма. Основными реакциями, которые катализируются цитохромом P450c17, являются превращение прегненолона в 17ОН-прегненолон и далее в дегидроэпиандростерон (ДГЭА) и превращение прогестерона в 17ОН-прогестерон и далее в андростендион [34]. Необходимо отметить, что в фазе проэструса экспрессия и активность цитохрома P450c17 существенно повышаются, что обусловлено повышением синтеза андрогенов клетками теки [34]. Регуляция экспрессии гена Cyp17a1 в клетках теки осуществляется в основном через цАМФ-зависимые сигнальные пути как результат активации рецепторов ЛГ/ХГЧ гонадотропинами, но в этот процесс могут быть вовлечены и другие сигнальные пути, в том числе реализуемые через стимуляцию форбол-чувствительных изоформ протеинкиназы С. При этом активация цАМФ-зависимых путей и протеинкиназы А приводит к повышению экспрессии гена Cyp17a1, в то время активация протеинкиназы С вызывает снижение стимулированной цАМФ экспрессии этого гена [34, 35]. Следует отметить, что в клетках гранулезы экспрессия гена Cyp17a1 существенно ниже и менее подвержена влиянию цАМФ-зависимого сигналинга [34]. В наших экспериментах стимулирующие эффекты TP03 и ХГЧ на экспрессию гена Cyp17a1 были отчетливо выражены не только у контрольных животных, но и у самок крыс, предварительно обработанных Оргалутраном, которые в отсутствие стимуляции агонистами рецептора ЛГ/ХГЧ имели крайне низкий уровень генной экспрессии цитохрома P450c17 (табл. 3). С учетом вызываемой TP03 избирательной стимуляции цАМФ-сигналинга, можно сделать заключение, что именно активация цАМФ-зависимых путей в яичниках крыс с дефицитом эндогенного ЛГ является основной причиной повышения экспрессии гена Cyp17a1. Однако следует учитывать временную динамику этого эффекта, поскольку с использованием вестерн-блоттинга показано, что через 7 ч после введения ХГЧ содержание белка цитохрома P450c17 в фолликулярных клетках крысы существенно снижалось, что можно рассматривать как компенсаторную реакцию, следующую за всплеском стероидогенной активности [36].
Достаточно неожиданным было отсутствие в контрольной группе значимого стимулирующего эффекта TP03 и ХГЧ на экспрессию гена Cyp11a1, кодирующего цитохром P450scc (CYP11A1), катализирующий превращение холестерина в прегненолон. С другой стороны, у крыс с обработкой Оргалутраном, у которых отмечали незначительное снижение экспрессии гена Cyp11a1, стимулирующие эффекты обоих исследуемых агонистов рецептора ЛГ/ХГЧ были статистически значимы (табл. 3). Основываясь на данных литературы, имеются основания считать, что причинами этого являются сравнительно высокий уровень экспрессии гена Cyp11a1 и количества белка цитохрома P450scc в фазе позднего проэструса [37, 38], а также более медленное в сравнении с генами Star и Cyp17a1 стимулирующее влияние агонистов рецептора ЛГ/ХГЧ на экспрессию гена Cyp11a1 [39]. Так, у контрольных крыс повышенный в проэструсе уровень экспрессии гена Cyp11a1 маскирует стимулирующие эффекты TP03 и ХГЧ, но при небольшом снижении этого уровня в условиях дефицита эндогенного ЛГ эти эффекты начинают выявляться.
Ароматаза (цитохром P450c19) является одним из ключевых ферментов овариального стероидогенеза, катализируя превращение андрогенов в эстрогены. В ходе эстрального цикла экспрессия и активность ароматазы сильно меняются, причем изменение активности фермента “отстает” от экспрессии гена Cyp19a1. Так, экспрессия гена Cyp19a1 максимальна в диэструсе, немного снижается в первой половине проэструса и резко снижается, становясь почти неопределяемой, в фазе эструса, в то время как пик активности фермента приходится на проэструс и далее постепенно снижается до наступления фазы диэструса следующего цикла [40], и это положительно коррелирует с количеством белка ароматазы и с количеством эстрадиола в крови в эти периоды развития фолликула [41]. Эти изменения активности также ассоциированы с подъемом уровня ЛГ и активацией ЛГ-зависимых сигнальных путей в клетках гранулезы и, в меньшей степени, в клетках теки [41]. Нами показано сопоставимое по величине стимулирующее влияние ХГЧ и TP03 на экспрессию гена Cyp19a1, как у контрольных самок крыс, так и у животных с обработкой Оргалутраном, и это повышение положительно коррелировало со стероидогенной активностью обоих агонистов рецептора ЛГ/ХГЧ (рис. 3). Интересно отметить, что стимулирующий эффект ХГЧ на экспрессию гена ароматазы, в отличие от такового на экспрессию гена Cyp17a1, слабо отличался от такового TP03. Так, соотношение экспрессий гена Cyp17a1 в группах “Org + hCG” и “Org + TP” составило 1.70, а гена ароматазы – 0.89.
Таким образом, нами впервые показано, что введение половозрелым самкам крыс TP03, низкомолекулярного аллостерического агониста рецептора ЛГ/ХГЧ, вызывает у них повышение уровня прогестерона, в различной степени усиливает экспрессию ряда стероидогенных генов – холестерин-транспортирующего белка StAR, цитохрома P450c17 и ароматазы, и этот эффект проявлялся как у контрольных крыс, в присутствии нормального эндогенного ЛГ, так и у крыс, обработанных антагонистом GnRH, с пониженным уровнем эндогенного ЛГ. Эффекты TP03 были сопоставимы с таковыми ХГЧ, широко используемого в клинике активатора овариального стероидогенеза и индуктора овуляции. При этом, в отличие от ХГЧ, TP03 не вызывал ослабления функционирования компонентов гонадной оси, на что указывает отсутствие его влияния на уровень ЛГ в крови и на экспрессию рецепторов ЛГ/ХГЧ в яичниках. Имеются основания считать, что более мягкая стимуляция стероидогенеза под действием TP03 может снижать риски развития гиперстимуляции яичников, что требует дальнейшего исследования. Полученные данные свидетельствуют о способности TP03 стимулировать овариальный стероидогенез у половозрелых крыс и о перспективности разработки на основе этого соединения лекарственных форм для контролируемой индукции овуляции.
Список литературы
Martinez F, Racca A, Rodríguez I, Polyzos NP (2021) Ovarian stimulation for oocyte donation: a systematic review and meta-analysis. Hum Reprod Update 27 (4): 673–696. https://doi.org/10.1093/humupd/dmab008
Namavar Jahromi B, Parsanezhad ME, Shomali Z, Bakhshai P, Alborzi M, Moin Vaziri N, Anvar Z (2018) Ovarian Hyperstimulation Syndrome: A Narrative Review of Its Pathophysiology, Risk Factors, Prevention, Classification, and Management. Iran J Med Sci 43 (3): 248–260. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5993897
Engmann LL, Maslow BS, Kaye LA, Griffin DW, DiLuigi AJ, Schmidt DW, Grow DR, Nulsen JC, Benadiva CA (2019) Low dose human chorionic gonadotropin administration at the time of gonadotropin releasing-hormone agonist trigger versus 35 h later in women at high risk of developing ovarian hyperstimulation syndrome - a prospective randomized double-blind clinical trial. J Ovarian Res 12 (1): 8. https://doi.org/10.1186/s13048-019-0483-7
Jiang X, Dias JA, He X (2014) Structural biology of glycoprotein hormones and their receptors: insights to signaling. Mol Cell Endocrinol 382 (1): 424–451. https://doi.org/10.1016/j.mce.2013.08.021
Casarini L, Simoni M (2021) Recent advances in understanding gonadotropin signaling. Fac Rev 10: 41. https://doi.org/10.12703/r/10-41
Riccetti L, Yvinec R, Klett D, Gallay N, Combarnous Y, Reiter E, Simoni M, Casarini L, Ayoub MA (2017) Human Luteinizing Hormone and Chorionic Gonadotropin Display Biased Agonism at the LH and LH/CG Receptors. Sci Rep 7 (1): 940. https://doi.org/10.1038/s41598-017-01078-8
Segaloff DL, Wang HY, Richards JS (1990) Hormonal regulation of luteinizing hormone/chorionic gonadotropin receptor mRNA in rat ovarian cells during follicular development and luteinization. Mol Endocrinol 4 (12): 1856–1865. https://doi.org/10.1210/mend-4-12-1856
Menon B, Sinden J, Franzo-Romain M, Botta RB, Menon KM (2013) Regulation of LH receptor mRNA binding protein by miR-122 in rat ovaries. Endocrinology 154 (12): 4826–4834. https://doi.org/10.1210/en.2013-1619
Menon B, Gulappa T, Menon KM (2015) miR-122 Regulates LH Receptor Expression by Activating Sterol Response Element Binding Protein in Rat Ovaries. Endocrinology 156 (9): 3370–3380. https://doi.org/10.1210/en.2015-1121
Veldhuis JD, Liu PY, Takahashi PY, Keenan DM (2012) Dynamic testosterone responses to near-physiological LH pulses are determined by the time pattern of prior intravenous LH infusion. Am J Physiol Endocrinol Metab 303 (6): E720–728. https://doi.org/10.1152/ajpendo.00200.2012
Bakhtyukov AA, Derkach KV, Gureev MA, Dar’in DV, Sorokoumov VN, Romanova IV, Morina IY, Stepochkina AM, Shpakov AO (2020) Comparative Study of the Steroidogenic Effects of Human Chorionic Gonadotropin and Thieno[2,3-D]pyrimidine-Based Allosteric Agonist of Luteinizing Hormone Receptor in Young Adult, Aging and Diabetic Male Rats. Int J Mol Sci 21 (20): 7493. https://doi.org/10.3390/ijms21207493
Bakhtyukov AA, Derkach KV, Romanova IV, Sorokoumov VN, Sokolova TV, Govdi AI, Morina IYu, Perminova AA, Shpakov AO (2021) Effect of low-molecular-weight allosteric agonists of the luteinizing hormone receptor on its expression and distribution in rat testes. J Evol Biochem Physiol 57 (2): 208–220. https://doi.org/10.1134/S0022093021020034
Heitman LH, Oosterom J, Bonger KM, Timmers CM, Wiegerinck PH, Ijzerman AP (2008) [3H]Org 43553, the first low-molecular-weight agonistic and allosteric radioligand for the human luteinizing hormone receptor. Mol Pharmacol 73 (2): 518–524. https://doi.org/10.1124/mol.107.039875
van Koppen CJ, Zaman GJ, Timmers CM, Kelder J, Mosselman S, van de Lagemaat R, Smit MJ, Hanssen RG (2008) A signaling-selective, nanomolar potent allosteric low molecular weight agonist for the human luteinizing hormone receptor. Naunyn Schmiedebergs Arch Pharmacol 378 (5): 503–514. https://doi.org/10.1007/s00210-008-0318-3
Nataraja SG, Yu HN, Palmer SS (2015) Discovery and Development of Small Molecule Allosteric Modulators of Glycoprotein Hormone Receptors. Front Endocrinol (Lausanne) 6: 142. https://doi.org/10.3389/fendo.2015.00142
Derkach KV, Dar’in DV, Lobanov PS, Shpakov AO (2014) Intratesticular, intraperitoneal, and oral administration of thienopyrimidine derivatives increases the testosterone level in male rats. Dokl Biol Sci 459: 326–329. https://doi.org/10.1134/S0012496614060040
Bakhtyukov AA, Derkach KV, Sorokoumov VN, Stepochkina AM, Romanova IV, Morina IY, Zakharova IO, Bayunova LV, Shpakov AO (2021) The Effects of Separate and Combined Treatment of Male Rats with Type 2 Diabetes with Metformin and Orthosteric and Allosteric Agonists of Luteinizing Hormone Receptor on Steroidogenesis and Spermatogenesis. Int J Mol Sci 23 (1): 198. https://doi.org/10.3390/ijms23010198
Cora MC, Kooistra L, Travlos G (2015) Vaginal Cytology of the Laboratory Rat and Mouse: Review and Criteria for the Staging of the Estrous Cycle Using Stained Vaginal Smears. Toxicol Pathol 43 (6): 776–793. https://doi.org/10.1177/0192623315570339
Ajayi AF, Akhigbe RE (2020) Staging of the estrous cycle and induction of estrus in experimental rodents: an update. Fertil Res Pract 6: 5. https://doi.org/10.1186/s40738-020-00074-3
Schmittgen TD, Livak KJ (2008) Analyzing real-time PCR data by the comparative C(T) method. Nat Protoc 3 (6): 1101–1108. https://doi.org/10.1038/nprot.2008.73
van de Lagemaat R, Timmers CM, Kelder J, van Koppen C, Mosselman S, Hanssen RG (2009) Induction of ovulation by a potent, orally active, low molecular weight agonist (Org 43553) of the luteinizing hormone receptor. Hum Reprod 24 (3): 640–648. https://doi.org/10.1093/humrep/den412
van de Lagemaat R, Raafs BC, van Koppen C, Timmers CM, Mulders SM, Hanssen RG (2011) Prevention of the onset of ovarian hyperstimulation syndrome (OHSS) in the rat after ovulation induction with a low molecular weight agonist of the LH receptor compared with hCG and rec-LH. Endocrinology 152 (11): 4350–4357. https://doi.org/10.1210/en.2011-1077
Gerrits M, Mannaerts B, Kramer H, Addo S, Hanssen R (2013) First evidence of ovulation induced by oral LH agonists in healthy female volunteers of reproductive age. J Clin Endocrinol Metab 98 (4): 1558–1566. https://doi.org/10.1210/jc.2012-3404
Wortmann L, Lindenthal B, Muhn P, Walter A, Nubbemeyer R, Heldmann D, Sobek L, Morandi F, Schrey AK, Moosmayer D, Günther J, Kuhnke J, Koppitz M, Lücking U, Röhn U, Schäfer M, Nowak-Reppel K, Kühne R, Weinmann H, Langer G (2019) Discovery of BAY-298 and BAY-899: Tetrahydro-1,6-naphthyridine-Based, Potent, and Selective Antagonists of the Luteinizing Hormone Receptor Which Reduce Sex Hormone Levels in Vivo. J Med Chem 62 (22): 10321–10341. https://doi.org/10.1021/acs.jmedchem.9b01382
Derkach KV, Dar’in DV, Shpakov AO (2020) Low-Molecular-Weight Ligands of Luteinizing Hormone with the Activity of Antagonists. Biochemistry (Moscow) Suppl Ser A: Membrane and Cell Biology 14 (3): 223–231. https://doi.org/10.1134/S1990747820030034
Broqua P, Riviere PJ, Conn PM, Rivier JE, Aubert ML, Junien JL (2002) Pharmacological profile of a new, potent, and long-acting gonadotropin-releasing hormone antagonist: degarelix. J Pharmacol Exp Ther 301 (1): 95–102. https://doi.org/10.1124/jpet.301.1.95
Weiss JM, König SJ, Polack S, Emons G, Schulz KD, Diedrich K, Ortmann O (2006) Actions of gonadotropin-releasing hormone analogues in pituitary gonadotrophs and their modulation by ovarian steroids. J Steroid Biochem Mol Biol 101 (2–3):118–126. https://doi.org/10.1016/j.jsbmb.2006.06.009
Smith MS, Freeman ME, Neill JD (1975) The control of progesterone secretion during the estrous cycle and early pseudopregnancy in the rat: prolactin, gonadotropin and steroid levels associated with rescue of the corpus luteum of pseudopregnancy. Endocrinology 96 (1): 219–226. https://doi.org/10.1210/endo-96-1-219
Donner NC, Lowry CA (2013) Sex differences in anxiety and emotional behavior. Pflugers Arch 465 (5): 601–626. https://doi.org/10.1007/s00424-013-1271-7
Manna PR, Dyson MT, Stocco DM (2009) Regulation of the steroidogenic acute regulatory protein gene expression: present and future perspectives. Mol Hum Reprod 15 (6): 321–333. https://doi.org/10.1093/molehr/gap025
Shpakov AO, Derkach KV, Dar’in DV, Lobanov PS (2014) Activation of adenylyl cyclase by thienopyrimidine derivatives in rat testes and ovaries. Cell Tissue Biol 8 (5): 400–406. https://doi.org/10.1134/S1990519X14050071
Derkach KV, Dar’in DV, Bakhtyukov AA, Lobanov PS, Shpakov AO (2016) In vitro and in vivo studies of functional activity of new low molecular weight agonists of the luteinizing hormone receptor. Biochemistry (Moscow) Suppl Ser A: Membrane and Cell Biology 10 (4): 294–300. https://doi.org/10.1134/S1990747816030132
Manna PR, Stetson CL, Slominski AT, Pruitt K (2016) Role of the steroidogenic acute regulatory protein in health and disease. Endocrine 51 (1): 7–21. https://doi.org/10.1007/s12020-015-0715-6
Patel SS, Beshay VE, Escobar JC, Carr BR (2010) 17α-Hydroxylase (CYP17) expression and subsequent androstenedione production in the human ovary. Reprod Sci 17 (11): 978–986. https://doi.org/10.1177/1933719110379055
Beshay VE, Havelock JC, Sirianni R, Ye P, Suzuki T, Rainey WE, Carr BR (2007) The mechanism for protein kinase C inhibition of androgen production and 17alpha-hydroxylase expression in a theca cell tumor model. J Clin Endocrinol Metab 92 (12): 4802–4809. https://doi.org/10.1210/jc.2007-1394
Hedin L, Rodgers RJ, Simpson ER, Richards JS (1987) Changes in content of cytochrome P450(17)alpha, cytochrome P450scc, and 3-hydroxy-3-methylglutaryl CoA reductase in developing rat ovarian follicles and corpora lutea: correlation with theca cell steroidogenesis. Biol Reprod 37 (1): 211–223. https://doi.org/10.1095/biolreprod37.1.211
Conley AJ, Howard HJ, Slanger WD, Ford JJ (1994) Steroidogenesis in the preovulatory porcine follicle. Biol Reprod 51 (4): 655–661. https://doi.org/10.1095/biolreprod51.4.655
Peña-Rico M, Guadalupe Ortiz-López M, Camacho-Castillo L, Cárdenas M, Pedraza-Chaverri J, Menjívar M (2006) Steroidogenic impairment due to reduced ovarian transcription of cytochrome P450 side-chain-cleavage (P450scc) and steroidogenic acute regulatory protein (StAR) during experimental nephrotic syndrome. Life Sci 79 (7): 702–708. https://doi.org/10.1016/j.lfs.2006.02.023
Lavoie HA, King SR (2009) Transcriptional regulation of steroidogenic genes: STARD1, CYP11A1 and HSD3B. Exp Biol Med (Maywood) 234 (8): 880–907. https://doi.org/10.3181/0903-MR-97
Lephart ED, Doody KJ, McPhaul MJ, Simpson ER (1992) Inverse relationship between ovarian aromatase cytochrome P450 and 5 alpha-reductase enzyme activities and mRNA levels during the estrous cycle in the rat. J Steroid Biochem Mol Biol 42 (5): 439–447. https://doi.org/10.1016/0960-0760(92)90255-h
Zurvarra FM, Salvetti NR, Mason JI, Velazquez MM, Alfaro NS, Ortega HH (2009) Disruption in the expression and immunolocalisation of steroid receptors and steroidogenic enzymes in letrozole-induced polycystic ovaries in rat. Reprod Fertil Dev 21 (7): 827–839. https://doi.org/10.1071/RD09026
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


