Журнал эволюционной биохимии и физиологии, 2023, T. 59, № 2, стр. 90-99
АНАЛИЗ СОСТАВА ФРАКЦИИ ИЗ ОСМОТИЧЕСКИ АКТИВНЫХ БЕЛКОВ СЫВОРОТКИ КРОВИ АТЛАНТИЧЕСКОЙ ТРЕСКИ GADUS MORHUA
А. М. Андреева 1, *, З. М. Базарова 1, И. Ю. Торопыгин 1, 2, А. С. Васильев 1, Р. А. Федоров 1, П. А. Павлова 3, Д. В. Гарина 1
1 Институт биологии внутренних вод им. И.Д. Папанина РАН
пос. Борок, Ярославской обл, Россия
2 Институт биомедицинской химии им. В.Н. Ореховича
Москва, Россия
3 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: aam@ibiw.ru
Поступила в редакцию 01.11.2022
После доработки 15.12.2022
Принята к публикации 10.01.2023
- EDN: BIKKFO
- DOI: 10.31857/S004445292302002X
Аннотация
Предприняты поиск и идентификация осмотически активных белков (ОАБ) в сыворотке крови атлантической трески Gadus morhua с использованием методов электрофореза в полиакриламидном геле и масс-спектрометрии MALDI. Было идентифицировано 17 ОАБ. В соответствии с аннотациями генной онтологии кандидатов, 13 ОАБ отнесены к внеклеточным, а 4 ОАБ – к внутриклеточным белкам. Относительное содержание ОАБ в сыворотке трески составило ~50% от общего белка. В пуле ОАБ доминировали внеклеточные белки аполипопротеины (в составе липопротеинов высокой плотности) и гемопексины, причем относительное содержание первых составило ~25% общего белка сыворотки. Из внутриклеточных белков на протеомной карте сыворотки доминировали низкомолекулярные фрагменты тяжелой цепи миозина. Полученные результаты согласуются с положениями “безальбуминовой” гипотезы капиллярного обмена, которая в качестве осмотически активных белков плазмы “безальбуминовых” костистых рыб рассматривает множественные внеклеточные и внутриклеточные белки разных функциональных классов.
ВВЕДЕНИЕ
Сывороточный альбумин, относящийся к суперсемейству альбуминоидов, играет ключевую роль в поддержании гомеостаза всех физиологических функций организма высших позвоночных, участвуя в транспорте множества лигандов и обеспечивая около 80% коллоидно-осмотического давления плазмы крови [1, 2]. В плазме млекопитающих его концентрация достигает ~30–50 мг/мл, что составляет около 60% от общего белка [3–5]. В плазме низших водных позвоночных концентрация альбумина также достаточно высока: у миноги Petromyzon marinus (Cyclostomata, Petromyzontiformes) она составляет ~30 мг/мл [6] или более 40% от общего белка; у чавычи Oncorhynchus tshawytscha, кумжи Salmo trutta, лосося атлантического Salmo salar (Teleostei, Salmoniformes) ~15 мг/мл или 25–28% от общего белка [7–10].
Между тем, в некоторых группах низших позвоночных альбумины не найдены [11]. Нет альбуминов у пластиножаберных (Elasmobranchii) [12] и костнопузырных и колючеперых костистых рыб (Teleostei: Ostariophysi, Acanthopterygii) [13]. Неизвестно, какие белки взяли на себя функцию альбумина у акул и скатов, но установлено, что в качестве основного органического осмолита плазмы они выбрали мочевину [12]. Остается открытым и вопрос функционального замещения альбумина у “безальбуминовых” костистых рыб. На наш взгляд, причина нерешенности этой проблемы заключается в отсутствии методологических подходов для поиска белков, способных выполнять вместо альбумина осмотическую функцию.
В качестве основы для поиска осмотически активных белков (ОАБ) в крови “безальбуминовых” Teleostei мы предлагаем использовать параметры, характеризующие осмотические свойства альбуминов Mammalia, – высокий отрицательный поверхностный заряд, небольшую молекулярную массу (Mr) и высокое содержание в плазме (сыворотке) крови [14]; эти параметры достаточно легко определяются с помощью электрофореза и биохимических методов. Проявление осмотической активности такими белками мы предлагаем рассматривать в формате разработанной для рыб “безальбуминовой” гипотезы капиллярного обмена [14].
Как применить этот подход для поиска ОАБ у костистых рыб? Несмотря на то что в физиологических условиях все белки плазмы проявляют осмотическую активность, разные белки вносят разный вклад в КОД [2]. Так, очищенные препараты фибриногена (Fg) и иммуноглобулина G (IgG) создают меньшие величины КОД, чем альбумин (Alb) [15]. Поскольку в электрофорезе плазмы Fg и IgG расположены в катодной области, а альбумины в анодной области, то в ряду “Fg → IgG → Alb” имеет место снижение величины Mr и увеличение отрицательного заряда [16]. Из этого следует очевидный вывод о более высокой осмотической активности небольших белков плазмы с высоким отрицательным зарядом и о локализации таких белков в анодной зоне подвижности диск-электрофореграммы [14, 17].
В отличие от гипотезы Старлинга, которая в своем обновленном формате [18–23] согласуется с представлениями о максимально высоком вкладе альбумина в КОД плазмы у Mammalia [2], “безальбуминовая” гипотеза капиллярного обмена, разработанная на примере карповых рыб, исходит из того, что наибольшую осмотическую активность проявляют множественные белки разных функциональных классов, имеющие небольшие размеры, высокий отрицательный поверхностный заряд и высокое суммарное содержание в плазме (сыворотке) крови. Они могут быть не только внеклеточными, но и внутриклеточными белками, попавшими в кровоток в результате разрушения клеток.
Цель работы – идентифицировать осмотически активные белки в сыворотке крови атлантической трески Gadus morhua; оценить их относительное содержание в сыворотке; с помощью аннотаций генной онтологии выяснить принадлежность кандидатов к внеклеточным и внутриклеточным белкам; а также обсудить состав осмотически активных сывороточных белков трески в формате “безальбуминовой” гипотезы капиллярного обмена.
МЕТОДЫ ИССЛЕДОВАНИЯ
Объекты исследования
Использовали индивидуальные образцы сыворотки крови от 6 экземпляров трески атлантической Gadus morhua (Teleostei, Paracanthopterygii, Gadiformes), отловленных в июне в районе мыса Картеш, Белое море. Для поиска и идентификации ОАБ использовали методы протеомного анализа – электрофорез и масс-спектрометрию MALDI.
Получение сыворотки крови
Для получения крови использовали каудотомию. Индивидуальные образцы крови, собранные из хвостовых сосудов рыб, собирали в отдельные пластиковые пробирки. Далее кровь отстаивали в холодильнике при 4°С в течение ночи, после чего жидкость над сгустком осторожно отбирали пипеткой. Отделенные образцы сыворотки собирали в чистые пластиковые пробирки и использовали для электрофореза.
Определение концентрации общего белка в сыворотке крови
Для определения концентрации белка в сыворотке использовали микробиуретовый метод [24].
Электрофорез
Белки сыворотки разделяли методами электрофореза в полиакриламидном геле (ПААГ). Для разделения белков по величине поверхностного заряда использовали диск-электрофорез (диск-Е) в 7.5%-ном ПААГ. Для разделения нативных белков по величине молекулярной массы использовали электрофорез в градиенте концентраций 5–40% ПААГ. Для разделения денатурированных белков использовали двумерный SDS-электрофорез (2D-Е) с диск-Е в первом направлении и SDS-электрофорезом (SDS-Е) в 12.5%-ном ПААГ (восстанавливающие условия) – во втором направлении [25]. Отдельные белковые пятна после SDS-Е вырезали для последующей идентификации с помощью MALDI масс-спектрометрии. Для приготовления разделяющего и концентрирующего геля использовали трис-HCl буфер с рН 8.9 и 6.9 соответственно. В лунки концентрирующего геля вносили 1.5–2 мкл сыворотки (~6–8 мкг белка), разведенной таким же количеством 40%-ного раствора сахарозы. После диск-Е гели фиксировали 10%-ной ТХУ и после отмывания окрашивали 0.01%-ным раствором Coomassie R-250 на смеси этанол – уксусная кислота – вода в соотношении 10:1:30. После SDS-Е гели фиксировали 70%-ным изопропиловым спиртом и далее окрашивали 0.04%-ным раствором Coomassie R-250, приготовленным на смеси изопропанол – этанол – уксусная кислота – вода в соотношении 2 : 1 : 1 : 6. Величину Mr нативных белков в градиенте концентраций ПААГ определяли с помощью маркеров молекулярной массы – полимерных форм бычьего сывороточного альбумина БСА (67, 134, 201, 268, 335, 402 kDa) и овальбумина ОА (45, 90, 135, 190 kDa). Для определения величин молекулярной массы тестируемых белков в SDS-E (Mrobs) использовали маркеры в составе набора PageRulerTM Prestained Protein Ladder Plus (10, 17, 28, 36, 55, 72, 95, 130, 250 kDa) (Fermentas, США).
Определение положения фракции из ОАБ на электрофореграмме
При определении положения фракции из ОАБ на электрофореграмме сыворотки трески мы ориентировались на сопоставимые с альбумином человека показатели молекулярной массы белков и их поверхностного заряда, оцениваемого по величине электрофоретической подвижности (Rf). В соответствии с этими критериями, в диск-Е фракция из ОАБ должна располагаться в анодной области. Четкое определение ее границ у костистых рыб затрудняется фактом множественности белков в этой зоне подвижности, что подтверждают многочисленные примеры [26]. В.С. Кирпичников [26] обозначил эту фракцию как низкомолекулярную (НМФ), не давая определения ее границ. Для проведения четких границ фракции мы предложили использовать белок-“навигатор” трансферрин (Tf) [27–30]. В диск-Е сыворотки он ограничивает НМФ со стороны катода, в то время как со стороны анода ее ограничивает фронт бромфенолового синего (БФС). Таким образом, по положению на диск-электрофореграмме, фракция из ОАБ совпадает с НМФ, условные границы которой заданы трансферрином и БФС. Ввиду использования Tf для обозначения “верхней” границы фракции ОАБ на диск-электрофореграмме, условную “верхнюю” границу Mr для этой фракции мы также установили по Tf (76–80 kDa).
Масс-спектрометрия MALDI
Пробоподготовку белков проводили по протоколу: кусочек геля, содержащего тестируемый белок, дважды промывали для удаления красителя путем инкубации в 100 мкл 40%-ного раствора ацетонитрила в 0.1 М NH4HCO3 в течение 20 мин при 37°С. После удаления раствора для дегидратации геля добавляли по 100 мкл ацетонитрила. Удалив ацетонитрил и высушив кусочек геля, прибавляли к нему 4 мкл раствора модифицированного трипсина (Promega) в 0.05М NH4HCO3 в концентрации 15 мкг/мл. Гидролиз проводили в течение 4 ч при 40°С, затем к раствору добавляли 7 мкл 0.5%-ной трифторуксусной кислоты в 10%-ном водном ацетонитриле и тщательно перемешивали. Надгелевый раствор использовали для получения масс-спектров. Масс-спектры (ms) получали на тандемном MALDI TOF-TOF масс-спектрометре Ultraflex II BRUKER (Германия), оснащенном УФ лазером (Nd) в режиме положительных ионов в линейной моде, с использованием рефлектрона и в тандемном режиме; обрабатывали с помощью програмного пакета Flex Analysis 2.4 (Bruker Daltonics, Германия). При помощи программы Mascot (опция “пептидный фингерпринт”, www.matrixscience.com) устанавливали расчетные величины молекулярной массы Mrcalc (Da) и проводили поиск в DB NCBI среди белков всех организмов. При необходимости получали спектры фрагментации ms/ms отдельных пептидов в тандемном режиме. С использованием программ Biotools 3.0 и Flex Аnalysis 2.4 (Bruker Daltonics, Германия) проводили поиск по ms/ms. Если кандидаты обнаруживались в неаннотированной базе данных в виде библиотек кДНК, сконструированных на основе популяций мРНК, то аминокислотную последовательность реконструировали на основе мРНК, используя Protein BLAST; поиск проводили среди белков всех позвоночных. В этом случае значение расчетной Mrcalc представляли в виде количества аминокислотных остатков в соответствии с PDB NCBI.
Для определения принадлежности кандидатов к внеклеточным или внутриклеточным белкам использовали аннотации генной онтологии (Gene Ontology, GO) с использованием базы данных Uniprot. В случае отсутствия GO-аннотаций для кандидатных белков использовали гомологичные им белки человека (Homo sapiens) или модельных видов рыб – карпозубой рыбы Cyprinodon variegatus и карпа Cyprinus carpio.
Статистические методы
Денситометрирование, расчет относительного содержания отдельных белков и фракции ОАБ, а также величин молекулярной массы белков (Mrobs) проводили с помощью программы ONE-Dscan, Ver 1.31 (Scananalytic Inc.). Результаты расчета относительного содержания белков в анодной области диск-электрофореграммы сыворотки крови трески в выборке из 6 рыб представляли в виде средних значений и стандартной ошибки (±SEM).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Определение положения анодной фракции на электрофореграмме сыворотки трески
В анодной области диск-электрофореграммы сыворотки трески было выявлено ~10 белковых полос (рис. 1а); в 2D-E им соответствовали ~40 белков (рис. 1b). ~7 белковых пятен имели Mr > 80 kDa; их не считали ОАБ и не использовали для идентификации с помощью MALDI. Молекулярные массы остальных белков соответствовали критерию ОАБ. 17 ОАБ вырезали из геля и идентифицировали с помощью MALDI масс-спектрометрии (рис. 1b; табл. 1).
Рис. 1.
Электрофорез сыворотки крови трески атлантической Gadus morhua:(a) – диск-Е; Tf – трансферрин; OAP – фракция из осмотически активных белков; (b) – фрагмент 2D-SDS- электрофореграммы сыворотки, содержащий трансферрин (Tf) и фракцию из OAP (1–17); справа дана шкала Mr, построенная по маркерам PageRulerTM Prestained Protein Ladder Plus (Fermentas). Стрелки указывают направление электрофореза.

Таблица 1.
Идентификация трансферрина и осмотически активных белков из сыворотки крови трески
| №* | Сandidate proteins | Mascot Search Results | Mrcalc/Mrobs,Da | Score |
|---|---|---|---|---|
| Tf | serotransferrin [Gadus morhua] | XP_030218894.1 | 73516/70000 | 280 |
| 1 | alpha-2-HS-glycoprotein-like [Gadus morhua] | XP_030228808.1 | 32309/54500 | 95 |
| 2 | beta-Ala-His dipeptidase-like isoform X1 [Lepisosteus oculatus] | XP_015212653.1 | 54227/54000 | 128 |
| 3 | stonustoxin subunit beta-like [Gadus morhua] | XP_030206226.1 | 28266/40000 | 102 |
| 4 | alpha-1-antitrypsin homolog [Gadus morhua] | XP_030201052.1 | 47082/44000 | 173 |
| 5 | fetuin-B-like [Gadus morhua] | XP_030228824.1 | 53059/72000 | 96 |
| 6 | hemopexin-like [Gadus morhua] | XP_030199795.1 | 48611/60000 | 194 |
| 7 | n-1-like isoform X2 [Gadus morhua] | XP_030227991.1 | 38746/68000 | 49 |
| 8 | hemopexin-like [Gadus morhua] | XP_030210065.1 | 48611/55000 | 149 |
| 9 | hemopexin-like [Gadus morhua] | XP_030210065.1 | 47494/45000 | 140 |
| 10 | myosin heavy chain, fast skeletal muscle-like [Anabas testudineus] | XP_026220654.1 | 222030/31000 | 88 |
| 11 | myosin heavy chain, fast skeletal muscle-like [Notolabrus celidotus] | XP_034540808.1 | 221203/30000 | 81 |
| 12 | apolipoprotein A-I-2-like [Gadus morhua] | XP_030236469.1 | 29769/26000 | 260 |
| 13 | apolipoprotein A-I-2-like [Gadus morhua] | XP_030236469.1 | 29769/26000 | 232 |
| 14 | apolipoprotein A-I-like [Gadus morhua] | XP_030216412.1 | 27807/26000 | 129 |
| 15 | apolipoprotein A-IV-like [Gadus morhua] | XP_030203246.1 | 28610/25000 | 182 |
| 16 | coactosin-like protein [Channa argus] | KAF3689264.1 | 16060/17000 | 75 |
| 17 | apolipoprotein A-II [Sander lucioperca] | XP_035862199.1 | 143aa**/12000 | 171 |
* Обозначение (Tf) и нумерация (1–17) белков даны в соответствии с рис. 1.
Определение концентрации общего белка и относительного содержания ОАБ в сыворотке крови
Концентрация общего белка в сыворотке составила 4.6 ± 0.3 г%. Относительное содержание ОАБ составило 51.2 ± 6.5% от общего белка (~2.4 г%). На протеомной карте (SDS-E) имеется мощное пятно АроА-I (пятно 12, рис. 1b); его относительное содержание составило 25.4 ± 4.3% от общего белка (~1.2 г%). В градиенте ПААГ, ApoA-I вместе с Аро-II (пятно 17, рис. 1b) обнаруживались в зоне подвижности α1-глобулинов в области пятна с Mr~100–140 kDa, соответствующего положению липопротеинов высокой плотности (ЛПВП) на электрофореграмме. Идентификация с помощью MALDI белков в составе этих нативных частиц выявила кандидаты в виде ApoA-I Danio rerio (NP_571203.14, score 220) и Apo-II Oncorhynchys mykiss (NP_001154920.1, score 159). Отдельно от дорожки АроА-I и Аро-II, на протеомной карте выявлено четкое пятно АроА-IV (пятно 15, рис. 1b).
Помимо АроА-I, на протеомной карте сыворотки трески (рис. 1b) представлены мощные пятна внеклеточного белка гемопексина (пятна 6 и 8), пятна ингибиторов протеиназ (пятна 1, 4 и 5), а также внутриклеточные белки в виде низкомолекулярных фрагментов тяжелой цепи миозина (пятна 10, 11); идентифицированы “следы” коактозина (пятно 16), на который приходится 0.8 ± 0.1% от общего белка или ~0.04 г%, и бета-Ala-His дипептидаза (пятно 2).
Разделение кандидатов на внеклеточные и внутриклеточные белки с помощью аннотаций генной онтологии
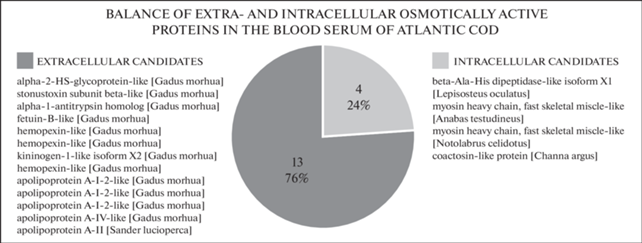
6 из 17 белков (1, 3, 4, 7, 16, 17) из табл. 1 не имели аннотаций GO в UniProtKB. Для определения их принадлежности к внеклеточным или внутриклеточным белкам использовали гомологичные белки человека (Homo sapiens) и модельных видов рыб – карпозубой рыбы Cyprinodon variegatus и карпа Cyprinus carpio (табл. 2). С учетом их аннотаций GO, 13 кандидатов (76% от пула из 17 ОАБ) относятся к внеклеточным белкам, а 4 кандидата (24%) – к внутриклеточным белкам (рис. 2).
Таблица 2.
Список аннотированных последовательностей, гомологичных кандидатным белкам, не имеющих аннотации генной онтологии в UniProtKB
| №* | Сandidate proteins without GO annotation | Homologous proteins with GO annotation |
|---|---|---|
| 1 | alpha-2-HS-glycoprotein-like [Gadus morhua] XP_030228808.1 |
alpha-2-HS-glycoprotein [Homo sapiens] UniProtKB: P02765, FETUA_HUMAN |
| 3 | Stonustoxin subunit beta-like [Gadus morhua] XP_030206226.1 |
Stonustoxin subunit beta-like [Cyprinodon variegatus] UniprotKB: A0A3Q2CPI0, 0A3Q2CPI0_CYPVA |
| 4 | alpha-1-antitrypsin homolog [Gadus morhua] XP_030201052.1 |
Alpha-1-antitrypsin homolog [Cyprinus carpio]UniprotKB: P32759, A1AT_CYPCA |
| 7 | kininogen-1-like isoform X2 [Gadus morhua] XP_030227991.1 |
Kininogen-1 [Homo sapiens] UniprotKB: P01042, KNG1_HUMAN |
| 16 | coactosin-like protein [Channa argus] KAF3689264.1 | Coactosin-like protein [Homo sapiens] UniprotKB: Q14019, COTL1_HUMAN |
| 17 | apolipoprotein A-II [Sander lucioperca] XP_035862199.1 | Apolipoprotein A-II [Homo sapiens] UniprotKB: P02652, APOA2_HUMAN |
* Нумерация дана по рис. 1b.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные результаты указывают на то, что белковый состав фракции ОАБ в сыворотке трески, с одной стороны, отличается от таковой у млекопитающих, а с другой стороны, имеет общие с ней черты. Сходство заключается в том, что рассчитанное нами суммарное относительное содержание ОАБ у трески оказалось сопоставимым с относительным содержанием альбумина в крови млекопитающих. В то же время множественность ОАБ, их принадлежность к разным функциональным классам, а также повышенное содержание внутриклеточных белков, – являются отличительными чертами этой фракции у трески. Рассмотрим эти черты более подробно.
Множественность ОАБ в сыворотке трески
Характерный для млекопитающих белок альбумин из суперсемейства альбуминоидов (cl00031, PDB NCBI) в анодной области диск-электрофореграммы сыворотки трески не обнаружен. Вместо него выявлено более 30 белков, соответствующих критериям осмотически активных белков. Среди них доминирует аполипопротеин АроА-I, на который приходится четверть общего белка сыворотки (25.4 ± 4.3%). Другой аполипопротеин – Аро-II – на протеомной карте представлен минорным пятном; у костистых часто идентифицируют его гомолог – 14 kDa apolipoprоtein (Apo-14); оба белка являются гомологами Аро-II млекопитающих [31]. На диск-электрофореграмме они находятся в зоне подвижности ЛПВП. Относительное содержание этих частиц, рассчитанное по белку, в сыворотке костистых может достигать 30–36% [32–34]. Это более чем в 3 раза превышает относительное содержание ЛПВП в плазме человека. АроА-I и Apo-II относятся к суперсемействам “Apolipoprotein superfamily A1/A4/E domain” (cl27567, PDBNCBI) и “ApoA-II superfamily” (cl04697, PDBNCBI) соответственно. АроА-I присутствует в сыворотке в виде разных изоформ; оба белка в составе ЛПВП участвуют в транспорте липидов к клеткам и регулируют отток холестерина от них [35].
Еще один аполипопротеин из суперсемейства “Apolipoprotein superfamily A1/A4/E domain” – Аро-IV, – обнаружен на электрофореграмме сыворотки трески в виде минорного компонента. У человека, как правило, он ассоциирован с хиломикронами, но может присутствовать и в виде минорного компонента в составе ЛПВП или находиться в плазме в свободном состоянии [35], как это нами и обнаружено у трески.
Другой белок, представленный на электрофореграмме сыворотки мощным пятном, – гемопексин (Нх) – принадлежит суперсемейству гемопексинов (cl02471, PDB NCBI). У костистых, как правило, он представлен гомологичным белком тепловой акклимации (warm temperature acclimated 65 kDa protein, Wap65) [36]. И Нх, и Wap65 рыб гомологичны гемопексину млекопитающих. Его основные функции – связывание гема, попавшего в плазму при деструкции гем-содержащих белков, и транспортировка его в печень; участие в воспалительных процессах как белка острой фазы [37]. В организме представлен двумя изоформами [36]. Его концентрация в плазме меняется при повышении температуры и бактериальной и вирусной инфекциях [38, 39].
Другой широко представленной у трески группой белков являются ингибиторы протеиназ. К ним относятся 4 белка: alpha-2-HS-glycoprotein-like, fetuin-B-like, kininogen-1-like и alpha-1-antitrypsin homolog. Первые три являются ингибиторами цистеиновых протеиназ, или фетуинами, из суперсемейства “Cystatin (CY)” (cl09238, PDBNCBI). Они участвуют в остром воспалении, иммунном ответе на бактериальные инфекции и органогенезе [40]. Кининоген-подобный белок в составе кинин-калликреиновой системы участвует в свертывании крови, регуляции артериального давления и воспалении. Аlpha-1-antitrypsin относится к ингибиторам сериновых протеиназ серпинам из суперсемейства “Serine рroteinase inhibitors” (cl38926, PDBNCBI); они регулируют различные физиологические процессы, реагируют на воспаление и вирусный патогенез [41].
Белок стонустоксин (cl02614, PDBNCBI) идентифицирован у трески в виде бета-подобной субъединицы (stonustoxin subunit beta). Он участвует в процессах апоптоза, в регуляции клеточного цикла, росте клеток, мейозе, клеточной дифференцировке и везикулярном транспорте (PDB NCBI).
Перечисленные сывороточные белки трески относятся к внеклеточным. Кроме них, среди ОАБ обнаружены и внутриклеточные белки. Один из них – beta-Ala-His dipeptidase из суперсемейства цинковых пептидаз “Zinc_peptidase_like Superfamily” (cl14876, PDB NCBI), – участвует в метаболических и сигнальных путях во всех царствах организмов. Остальные прямо или косвенно связаны с мышечным сокращением. Два низкомолекулярных пятна на протеомной карте идентифицированы как низкомолекулярные фрагменты Н-цепи сократительного белка миозина (myosin heavy chain, fast skeletal muscle-like) с различными Mr. Различают несколько функциональных классов миозина (I–XVIII). Обнаруженные фрагменты могут принадлежать миозину класса II (MYH), состоящему из 2 пар неидентичных L- и пары H-цепей. Моторные домены последних сгруппированы в 35 классов [42]. Еще один внутриклеточный белок трески – коактозин-подобный белок (coactosin-likeprotein), из семейства actin-depolymerizing factor homology (ADF-H) domain, вероятно, как и у других эукариот, участвует в сократительной активности путем взаимодействия с F-актином [43].
Таким образом, множественность ОАБ создается не только за счет принадлежности того или иного белка разным функциональным классам, но и за счет представленности белка разными изоформами, “свободными” и связанными в составе частиц молекулами, а также разноразмерными фрагментами – продуктами деградации – исходного белка. Множественность аполипопротеинов и гемопексинов у позвоночных, включая рыб, подтверждают литературные данные [35, 36, 44].
Высокое суммарное относительное содержание ОАБ в сыворотке трески
Особенностью трески, сближающей ее с млекопитающими, является высокое суммарное относительное содержание в ее сыворотке белков с высоким электроотрицательным потенциалом. У трески оно составляет половину от общего белка сыворотки (51.2 ± 6.5%). Этот вклад, хотя и уступает, но все же сопоставим с относительным содержанием альбумина в плазме млекопитающих (~60% от общего белка) [3–5]. Таким образом, если у млекопитающих ~80% КОД плазмы создает один осмотически активный белок – альбумин [1], то у трески за создание КОД отвечают около трех десятков белков.
Баланс вне- и внутриклеточных ОАБ в сыворотке трески
Дифференцированный с помощью аннотаций генной онтологии на внеклеточные и внутриклеточные белки пул ОАБ трески показал доминирование в нем внеклеточных “истинных” белков. У позвоночных “истинными” белками плазмы считаются специализированные внеклеточные белки, выполняющие в системе кровообращения функции транспорта, иммунной защиты, создания КОД и некоторые другие [2]. Именно такие белки и доминируют в протеоме плазмы высших позвоночных. У трески среди ОАБ нами идентифицированы 13 внеклеточных белков. Среди них доминируют аполипопротеины, гемопексины и ингибиторы протеиназ. Ранее эти группы белков были описаны в составе НМФ сыворотки карповых рыб [27–30]. И именно эти белки присутствуют в плазме человека [45].
Одной из отличительных особенностей трески является повышенное содержание внутриклеточных белков в составе ОАБ. Идентифицированные нами 4 внутриклеточных белка относятся к гидролазам (протеазам) и мышечному комплексу. Отметим, что у человека вклад внутриклеточных белков в общий белковый пул плазмы оценивается в “следовых” концентрациях $ \ll $ пкг/мл [45]. В то же время у трески концентрация в сыворотке только одного “минорного” внутриклеточного белка коактозина составила ~400 мкг/мл. С учетом вклада других внутриклеточных белков, их общий вклад в КОД сыворотки трески может оказаться еще более значительным.
Состав ОАБ в сыворотке крови трески и человека в формате гипотезы Старлинга и “безальбуминовой” гипотезы
В соответствии с “обновленной” гипотезой Старлинга, прошедшей через ряд ревизий [18], основным осмотически активным белком плазмы у высших позвоночных считается альбумин, создающий ~80% ее КОД [1, 2]. Альбумин проявляет активность за счет небольших размеров и высокой концентрации в плазме. За счет этих свойств, а также из-за отсутствия ковалентных углеводов в структуре белка, поверхность альбуминовой глобулы имеет максимальную концентрацию отрицательного заряда. Вследствие этого белок эффективно связывает неорганические катионы, создавая их незначительный перевес в плазме относительно интерстициальной жидкости; этот эффект известен под названием Гиббса–Доннана [46]. В условиях низкой концентрации белка или его отсутствия в интерстиции, эффект Гиббса–Доннана усиливает связывание альбумином диполей воды. Таким образом, альбумин можно считать белком, идеально приспособленным для выполнения осмотической функции.
Поскольку, с одной стороны, альбумины в крови большинства костистых рыб отсутствуют [13], а с другой стороны, в интерстиции рыб содержится много общего белка, что мешает реализации эффекта Гиббса-Доннана [47], то существует мнение о незначительной роли белков плазмы в капиллярном обмене жидкости рыб [48]. К тому же оказалось, что в отличие от альбумина человека, идентифицированные нами внеклеточные и внутриклеточные ОАБ трески содержат ковалентно связанные углеводы (UniProtKB). Это предполагает меньшую, по сравнению с альбумином млекопитающих, концентрацию отрицательного поверхностного заряда и, как следствие, меньшую эффективность в связывании неорганических катионов и диполей воды, характеризующих осмотическую активность белка. Вследствие этих причин, в рамках гипотезы Старлинга оказалось затруднительным объяснить, каким образом белки плазмы рыб реализуют свой осмотический потенциал.
Ответить на этот вопрос может “безальбуминовая” гипотеза капиллярного обмена [14, 17]. Первоначально она разрабатывалась на примере карповых рыб. Гипотеза предлагает рассматривать в качестве осмотически активных белков плазмы и сыворотки рыб не альбумины, а множественные белки с высоким электроотрицательным потенциалом, среди которых преобладают аполипопротеины, гемопексины, ингибиторы протеиназ, а также внутриклеточные белки, попавшие в кровь вследствие разрушения клеток. Полученные нами результаты показали, что именно эти группы белков, специализирующиеся не на осмотической функции, а на функциях транспорта и иммунной защиты, доминируют среди ОАБ трески.
Представленные в сыворотке в меньшем количестве внутриклеточные белки – гидролазы и компоненты сократительной системы – отвечают в клетках за протеолиз и работу сократительного аппарата. Будучи коллоидами, они также вносят вклад в КОД плазмы, но вклад этот значительно меньше, чем тот, который вносят “истинные” внеклеточные белки плазмы. Тем не менее результаты работы не исключают более значительный вклад внутриклеточных белков в КОД плазмы трески по сравнению с человеком. Проявление осмотической активности белков плазмы у рыб в условиях наличия белка в интерстиции, вероятно, можно объяснить обнаружением скоплений белка в субгликокаликсной зоне на примере модельных млекопитающих [49]. На силу фильтрации жидкости оказывает влияние белок из этой зоны, в то время как белок интерстиция вносит вклад в поддержание изотонии плазмы и интерстициальной жидкости [14, 22, 23, 49].
Нельзя не отметить, что специальные исследования по вопросу функционального замещения альбуминов в крови “безальбуминовых” костистых рыб в литературе отсутствуют. Имеется ряд единичных высказываний о возможном участии сывороточных липопротеинов в замещении транспортной функции альбумина [8, 9, 50] и аполипопротеина АроА-I в осморегуляции рыб [51]. В то же время в начатых нами исследованиях обнаружена осмотическая активность ЛПВП [29, 30]. На примере серебряного карася Carassius auratus показано, что на фоне гипернатриемии сыворотки крупные формы ЛПВП распадаются на мелкие, которые при восстановлении нормонатриемии вновь формируют исходные крупные частицы [52]. Учитывая высокое содержание ЛПВП в крови костистых рыб и их гидрофильную природу, осмотический эффект от их распада может влиять на осмотические свойства плазмы.
ЗАКЛЮЧЕНИЕ
Полученные результаты указывают, с одной стороны, на отсутствие в крови трески характерного для млекопитающих осмотически активного альбумина, и, с другой стороны, на наличие в ней множественных, заменяющих альбумины белков, чья основная специализация связана не с осморегуляцией, а с функциями транспорта и иммунной защиты. Будучи представленными в сыворотке трески сопоставимой с альбумином суммарной концентрацией и имея подходящие для осмотически активных белков параметры молекулярной массы и электроотрицательного потенциала, эти белки могут быть способными к поддержанию осмотических свойств плазмы.
Полученные результаты сложно объяснить с точки зрения гипотезы Старлинга. Однако они согласуются с положениями “безальбуминовой” гипотезы капиллярного обмена у рыб, в соответствии с которой функцию потерянного в ходе эволюционного процесса в группе высших Teleostei альбумина взяли на себя множественные “истинные” внеклеточные белки плазмы и, отчасти, внутриклеточные белки, которые по своим физико-химическим и структурным характеристикам оказались способными к выполнению осмотической функции.
Список литературы
Levitt D, Levitt M (2016) Human serum albumin homeostasis: a new look at the roles of synthesis, catabolism, renal and gastrointestinal excretion, and the clinical value of serum albumin measurements. Int J Gen Med 9: 229–255. https://doi.org/10.2147/IJGM.S102819
Schulz GE, Schirmer RH (1979) Principles of Protein Structure. New York. Springer-Verlag.
Dziegielewska KM, Evans CA, Fossan G., Lorscheider FL, Malinowska DH, Møllgård K, Reynolds ML, Saunders NR, Wilkinson S (1980) Proteins in cerebrospinal fluid and plasma of fetal sheep during development. J Physiol 300: 441–455. https://doi.org/10.1113/jphysiol.1980.sp013171
Majorek KA, Porebski PJ, Dayal A, Zimmerman MD, Jablons- ka K, Stewart AJ, Chruszcz M, Minor W (2012) Structural and immunologic characterization of bovine, horse, andrabbit serum albumins. Mol Immunol 52 (3–4):174–182. https://doi.org/10.1016/j.molimm.2012.05.011
Anguizola J, Matsuda R, Barnaby OS, Hoy KS, Wa C (2013) Review: glycation of human serum albumin. Clin Chim Acta 425: 64–76. https://doi.org/10.1016/j.cca.2013.07.013
Gray JE, Doolittle RF (1992) Characterization, primary structure, and evolution of lamprey plasma albumin. Protein Sci 1 (2): 289–302. https://doi.org/10.1002/pro.5560010211
Byrnes L, Gannon F (1990) Atlantic salmon (Salmo salar) serum albumin: cDNA sequence, evolution, and tissue expression. DNA Cell Biol 9 (9): 647–655. https://doi.org/10.1089/dna.1990.9.647
Metcalf V, Brennan S, Chambers G, George P (1998) The albumins of Chinook salmon (Oncorhynchus tshawytscha) and brown trout (Salmo trutta) appear to lack a propeptide. Arch Biochem Biophys 350 (2): 239–244. https://doi.org/10.1006/abbi.1997.0509
Metcalf VJ, Brennan SO, Chambers GK, George PM (1998) The albumin of the brown trout (Salmo trutta) is a glycoprotein. Biochim Biophys Acta 1386 (1): 90–96.
Xu Y, Ding Z (2005) N-terminal sequence and main characteristics of Atlantic salmon (Salmo salar) albumin. Prep Biochem Biotechnol 35 (4): 283–290. https://doi.org/10.1080/10826060500218081
Li S, Cao Y, Geng F (2017) Genome-wide identification and comparative analysis of albumin family in vertebrates. Evol Bioinf Online 13: 1. https://doi.org/10.1177/1176934317716089
Ballantyne JS (2016) Some of the most interesting things we know, and don’t know, about the biochemistry and physiology of elasmobranch fishes (sharks, skates and rays). Comp Biochem Physiol B Biochem Mol Biol 199: 21–28. https://doi.org/10.1016/j.cbpb.2016.03.005
Andreeva AM (2022) Evolutionary transformations of albumin using the example of model species of jawless Agnatha and bony jawed fish (review). Inland Water Biol 15 (5): 641–658. https://doi.org/10.1134/S1995082922050029
Andreeva AM (2020) Structural organization of plasma proteins as a factor of capillary filtration in Pisces. Inland Water Biol 13 (4): 664–673. https://doi.org/10.1134/S1995082920060036
Michelis R, Sela S, Zeitun T, Geron R, Kristal B (2016) Unexpected normal colloid osmotic pressure in clinical states with low serum albumin. PLoS One 11 (7): e0159839. https://doi.org/10.1371/journal.pone.0159839
Gaal O, Medgyesi GA, Vereczkey L (1980) Electrophoresis in the separation of biological macromolecules. Chichester, John Wiley & Sons, 83–87.
Andreeva AM (2021) Organization and function of osmotically active fraction of fish (Pisces) plasma proteome. Inland Water Biol 14 (4): 449–460. https://doi.org/10.1134/S1995082921040039
Michel CC (1997) Starling: the formulation of his hypothesis ofmicrovascular fluid exchange and its significance after 100 years. Exp Physiol 82: 1–30. https://doi.org/10.1113/expphysiol.1997.sp004000
Weinbaum S (1998) Whitaker distinguished lecture: model tosolve mysteries in biomechanics at the cellular level; a newview of fiber matrix layers. Ann Biomed Eng 26: 627–643. https://doi.org/10.1114/1.134
Adamson RH, Lenz JF, Zhang X., Adamson GN, Weinbaum S, Curry FE (2004) Oncotic pressures opposing filtration across non-fenestrated rat microvessels. J Physiol 557 (3): 889–907. https://doi.org/10.1113/jphysiol.2003.058255
Rosengren BI, Carlsson O, Venturoli D, Rayyes O, Rippe B (2004) Transvascular passage of macromolecules into the peritoneal cavity of normo- and hypothermic rats in vivo: active or passivetransport? J Vasc Res 41: 123–130. https://doi.org/10.1159/000077131
Curry FE, Adamson RH (2012) Endothelial glycocalyx: permeability barrier and mechanosensor. Ann Biomed Eng 40: 828–839. https://doi.org/10.1007/s10439-011-0429-8
Chappell D, Jacob M (2014) Role of the glycocalyx in fluid management: small things matter. Best Pract Res Clin Anaesthesiol 28: 227–234. https://doi.org/10.1016/j.bpa.2014.06.003
Itzhaki RF, Gill DM (1964) A micro-biuret method for estimatingproteins. Anal Biochem 9: 401–410.
Laemmli UK (1970) Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 227 (5259): 680–685. https://doi.org/10.1038/227680a0
Kirpichnikov VS (1987) Genetics and selectics of fish. Leningrad. Nauka (In Russ).
Andreeva AM, Lamash NE, Serebryakova MV, Ryabtseva IP, Bolshakov VV (2015) Reorganization of low-molecular-weight fraction of plasma proteins in the annual cycle of Cyprinidae. Biochemistry (Mosc) 80 (2): 208–218. https://doi.org/10.1134/S0006297915020078
Andreeva AM, Serebryakova MV, Lamash N (2017) Oligomeric protein complexes of apolipoproteins stabilize the internal fluid environment of organism in redfins of the Tribolodon genus [Pisces; Cypriniformes, Cyprinidae]. Comp Biochem Physiol D 22:90–97. https://doi.org/10.1016/j.cbd.2017.02.007
Andreeva AM, Vasiliev AS, Toropygin IY, Garina DV, Lamash N, Filippova A (2019) Involvement of apolipoprotein A in maintaining tissue fluid balance in goldfish Carassius auratus. Fish Physiol Biochem 45 (5): 1717–1730. https://doi.org/10.1007/s10695-019-00662-1
Andreeva AM, Toropygin IYu, Garina DV, Lamash NE, Vasiliev AS (2020) The Role of High-Density Lipoproteins in Maintaining Osmotic Homeostasis in the Goldfish Carassius auratus L. (Cyprinidae). J Evol Biochem Physiol 56: 102–112. https://doi.org/10.1134/S0022093020020027
Choudhury M, Yamada S, Komatsu M, Kishimura H, Ando S (2009) Homologue of mammalian apolipoprotein A-II in non-mammalian vertebrates. Acta Biochim Biophys Sin (Shanghai) 41 (5): 370–378. https://doi.org/10.1093/abbs/gmp015
Babin PJ, Vernier JM (1989) Plasma lipoproteins in fish. J Lipid Res 30: 467.
Stoletov K, Fang L, Soo-Ho Choin, Hartvigsen K, Hansen LF, Hall C, Pattison J, Juliano J, Miller ER, Almazan F, Crosier Ph, Witztum J, Klemke R, Miller Yu (2009) Vascular lipid accumulation, lipoprotein oxidation, and macrophage lipid uptake in hypercholesterolemic zebrafish. Circul Res 104: 952–960. https://doi.org/10.1161/CIRCRESAHA.108.189803
Andreeva AM (2019) The strategies of organization of the fishplasma proteome: with and without albumin. Russ J Mar Biol 45 (4): 263–274. https://doi.org/10.1134/S1063074019040023
Saito H, Lund-Katz S, Phillips M (2004) Contributions of domain structure and lipid interaction to the functionality of exchangeable human apolipoproteins. Progress Lipid Res 43 (4): 350–380. https://doi.org/10.1016/j.plipres.2004.05.002
Diaz-Rosales P, Pereiro P, Figueras A, Novoa B, Dios S (2014) The warmtemperature acclimation protein (Wap65) has an important role in the inflammatory response of turbot (Scophthalmus maximus). Fish Shellfish Immunol 41 (1): 80–92. https://doi.org/10.1016/j.fsi.2014.04.012
Sha Z, Peng Xu, Tomokazu T, Hong Liu, Terhune J (2008) The warm temperature acclimation protein Wap65 as an immuneresponse gene: its duplicates are differentially regulated by temperature and bacterial infections. Mol Immunol 45 (5): 1458–1469. https://doi.org/10.1016/j.molimm.2007.08.012
Sarropoulou E, Fernandes JMO, Mitter K, Magoulas A, Mulero V, Sepulcre M, Figueras A, Novoa B (2010) Evolution of a multifunctional gene: the warm temperature acclimation protein Wap65 in the European seabass Dicentrarchus labrax. Mol Phylogen Evolut 55 (2): 640–649. https://doi.org/10.1016/j.ympev.2009.10.001
Cho YS, Kim BS, Kim DS, Nam YK (2012) Modulation of warm-temperature acclimation- associated 65-kDa protein genes (Wap65-1 and Wap65-2) in mud loach (Misgurnus mizolepis, Cypriniformes) liver in response to different stimulatory treatments. Fish Shellfish Immunol 32 (5): 662–669. https://doi.org/10.1016/j.fsi.2012.01.009
Li Ch, Gao Ch, Fu Q, Su B, Chen J (2017) Identification and expression analysis of fetuin B (FETUB) in turbot (Scophthalmus maximus L.) mucosal barriers following bacterial challenge. Fish & Shellfish Immunol 68: 386–394. https://doi.org/10.1016/j.fsi.2017.07.032
Janciauskiene S (2001) Conformational properties of serineproteinase inhibitors (serpins) confer multiple pathophysiological roles. Biochim Biophys Acta 1535 (3): 221. https://doi.org/10.1016/s0925-4439(01)00025-4
Odronitz F, Kollmar M (2007) Drawing the tree of eukaryotic life based on the analysis of 2,269 manually annotated myosins from 328 species. Genome Biol 8 (9): R196.https://doi.org/10.1186/gb-2007-8-9-r196
Poukkula M, Kremneva E, Serlachius M, Lappalainen P (2011) Actin-depolymerizing factor homology domain: a conserved fold performing diverse roles in cytoskeletal dynamics. Cytoskeleton (Hoboken) 68 (9): 471–490. https://doi.org/10.1002/cm.20530
Otis J, Zeituni EM, Thierer JH, Anderson JL, Brown AC, Boehm ED, Cerchione DM, Ceasrine AM, Avraham-David I, Tempelhof H, Yaniv K, Farber SA (2015) Zebrafish as a model for apolipoprotein biology: comprehensive expression analysis and a role for ApoA-IV in regulating food intake. Dis Model Mech 8 (3): 295–309. https://doi.org/10.1242/dmm.018754
Anderson NL, Polanski M, Pieper R, Gatlin T, Tirumalai R, Conrads TP, Veenstra TD, Adkins JN, Pounds JG, Fagan R, Lobley A (2004) The human plasma proteome: a nonredundant list developedby combination of four separate sources. Mol Cell Proteomics 3: 311–326. https://doi.org/10.1074/mcp.M300127-MCP200
Nguyen MK, Kurtz I (2006) Quantitative interrelationship between Gibbs-Donnan equilibrium, osmolality of body fluid compartments, and plasma water sodium concentration. J Appl Physiol 100: 1293–1300. https://doi.org/10.1152/japplphysiol.01274.2005
Olson KR (1992) Blood and extracellular fluid volume regulation: role of the renin-angiotensin system, kallikrein-kinin system, and atrial natriuretic peptides. Fish Physiol 12 (B): 135–234. https://doi.org/10.1016/S1546-5098(08)60010-2
Olson KR, Kinney DW, Dombrowski RA, Duff DW (2003) Transvascular and intravascular fluid transport in the rainbow trout: revisiting Starling’s forces, the secondary circulation and interstitial compliance. J Exp Biol 206 (3): 457–467. https://doi.org/10.1242/jeb.00123
Sarin H (2010) Physiologic upper limits of pore size of differentblood capillary types and another perspective on the dualpore theory of microvascular permeability. J Angiog Res 2 (1): 14. https://doi.org/10.1186/2040-2384-2-14
De Smet H, Blust R, Moens L (1998) Absence of albumin in the plasma of the common carp Cyprinus carpio: binding of fatty acids to high density lipoprotein. Fish Physiol Biochem 19 (1): 71–81.
Chen J, Yu H Shi, Hai Q Hu, He Niu, Ming Y Li (2009) Apolipoprotein A-I, a hyperosmoic adaptation-related protein in ayu (Plecoglossus altivelis). Comp Biochem Physiol B 152: 196–201. https://doi.org/10.1016/j.cbpb.2008.11.005
Andreeva AM., Martemyanov V, Vasiliev AS, Toropygin IYu., Lamash N, Garina DV, Pavlov D (2022) Goldfish as a model for studying the effect of hypernatremia on blood plasma lipoproteins. Bratisl Med J 123 (3): 172–177. https://doi.org/10.4149/BLL_2022_028
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии