Журнал эволюционной биохимии и физиологии, 2023, T. 59, № 6, стр. 485-502
Коррекция когнитивных нарушений и сигнальных путей в гиппокампе крыс с сахарным диабетом 2-го типа с помощью интраназально вводимых инсулина и ганглиозидов
И. О. Захарова 1, *, Л. В. Баюнова 1, К. В. Деркач 1, А. О. Шпаков 1, Н. Ф. Аврова 1
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: zakhar@iephb.ru
Поступила в редакцию 28.07.2023
После доработки 04.10.2023
Принята к публикации 04.10.2023
- EDN: GKANFO
- DOI: 10.31857/S0044452923060104
Аннотация
Инсулин контролирует не только системный гомеостаз глюкозы, но и функциональную активность мозга. При сахарном диабете 2-го типа (СД2) в мозге снижаются содержание инсулина и активность инсулиновой сигнальной системы. Это приводит к нарушению энергетического обмена, включая гипометаболизм глюкозы в мозге, и к когнитивным дисфункциям. Для компенсации недостатка гормона в мозге может быть использован интраназально вводимый инсулин (ИВИ). В целях повышения эффективности ИВИ для коррекции функций мозга целесообразно его комбинированное применение с веществами, наделенными свойствами нейропротекторов, в том числе со сложными гликосфинголипидами ганглиозидами. Для доставки ганглиозидов в мозг также может быть использовано их интраназальное введение (ИВГ). Целью работы было оценить эффективность раздельных и совместных интраназальных введений инсулина и ганглиозидов для коррекции когнитивных нарушений у крыс Wistar с СД2, для чего использовали водный лабиринт Морриса (ВЛМ) и анализ в гиппокампе экспрессии белков (BDNF, GLUT-1, GLUT-3, GLUT-4, GFAP, PSD95) и активности протеинкиназ (Akt, GSK3β, ERK1/2), вовлеченных в процессы обучения и формирования долговременной памяти. ИВИ и ИВГ при введении крысам с СД2 улучшали пространственную ориентацию в ВЛМ, причем эффект совместного использования ИВИ и ИВГ был сходным с таковым при их раздельном применении. При совместном введении ИВИ и ИВГ отмечали сохранение активности эффекторных протеинкиназ (Akt и ERK1/2), в то время как при монотерапии ИВИ уровень их фосфорилирования был снижен. При комбинированной терапии также увеличивалось фосфорилирование GSK3β по Ser9, защищающее нейроны от тауропатии. Таким образом, совместное применение ИВИ и ИВГ улучшает функциональное состояние компонентов инсулиновой системы в мозге крыс с СД2, хотя значимо не усиливает эффекты ИВИ на показатели долговременной памяти.
ВВЕДЕНИЕ
Инсулин контролирует не только системный гомеостаз глюкозы, но и функциональную активность мозга, а следовательно, и функции ЦНС, осуществляя регуляторные влияния на молекулярном, клеточном и поведенческом уровнях [1–3]. В настоящее время мозг стали причислять к инсулин-чувствительным органам, так как инсулиновые рецепторы и другие компоненты инсулиновой сигнальной системы экспрессируются и функционально активны во многих структурах мозга, включая обонятельные луковицы, гипоталамус, гиппокамп, мозжечок, амигдалу, кору [4, 5]. Если контроль метаболизма глюкозы, пищевого поведения и энергетического обмена в основном обусловлен взаимодействием инсулина с нейронами гипоталамуса, то нейротрофические и нейромодуляторные эффекты инсулина связывают с его взаимодействием с экстра-гипоталамическими структурами, включая гиппокамп [6–10].
Состояние устойчивой постпрандиальной гипер-инсулинемии является предвестником инсулиновой резистентности (ИР), невосприимчивости клеток к действию гормона, что характерно для ожирения, сахарного диабета 2-го типа (СД2), а также для сердечно-сосудистых и онкологических заболеваний, являющихся осложнениями метаболического синдрома [11]. Развитие ИР наблюдается не только на периферии, но и в ЦНС. При метаболических расстройствах отмечается также усиленная деградация инсулина, в которую вовлечен инсулин-деградирующий фермент (IDE), который, наряду с инсулином, расщепляет β-амилоидный пептид (Аβ). По мнению ряда авторов, нарушения в утилизации Аβ, возникающие из-за насыщения IDE инсулином в условиях гиперинсулинемии и ИР, приводят к накоплению Aβ и его последующей агрегации с образованием амилоидных бляшек [12, 13]. В этой связи становится понятным, почему при метаболическом синдроме и СД2 значительно чаще наблюдаются когнитивные расстройства, которые после прогрессирования диагностируются как деменция или болезнь Альцгеймера [4, 14, 15].
Если метаболический синдром и СД2 характеризуются повышенным содержанием инсулина в крови, то в мозге наблюдается его недостаток, вызванный ослаблением рецептор-опосредованного транспорта инсулина через гематоэнцефалический барьер [16–18]. Учитывая важность инсулинового сигналинга для таких основополагающих процессов, как рост и дифференцировка нейронов и синаптическая трансмиссия, имеются все основания полагать, что функциональные нарушения, вызванные снижением содержания инсулина в мозге или ослаблением активности инсулиновой системы в нейронах, будут приводить к нейродегенеративным расстройствам [4, 5]. Влияние инсулина на транспорт глюкозы в клетках мозга имеет существенные отличия от такового на периферии, поскольку инсулин-зависимый транспортер глюкозы 4-го типа (GLUT-4) экспрессируется в нейронах мозга в незначительных количествах [19, 20]. Нейрональный транспортер глюкозы GLUT-3 и астроцитарный транспортер GLUT-1, напротив, доминируют в мозге по сравнению с периферическими тканями. При этом показано, что инсулин и структурно родственный ему инсулиноподобный фактор роста-1 (IGF-1) способны вызывать транслокацию переносчика глюкозы GLUT-1 в астроцитах в результате стимуляции ими митоген-активируемых протеинкиназ (МАПК) и протеинкиназы D, что может иметь большое значение для регуляции метаболизма глюкозы в мозге [21–23]. На фоне ИР снижается скорость утилизации глюкозы клетками мозга, что приводит к состоянию гипометаболизма, наблюдаемому при СД2 и нейродегенеративных заболеваниях [24]. Когнитивные расстройства также рассматриваются как одно из проявлений нарушений метаболизма глюкозы.
Взаимосвязь между содержанием инсулина в мозге и формированием памяти наиболее наглядно проявляется при СД 1-го типа, когда дефицит гормона обусловлен нарушением синтеза в клетках поджелудочной железы. Так, в условиях пролонгированного, шестимесячного СД1, вызываемого инъекциями средних доз стрептозотоцина взрослым самцам крыс, у них развиваются отчетливо выраженные нарушения когнитивных функций [25]. Компенсировать недостаток инсулина в мозге с благоприятным влиянием на процессы обучения и без риска развития гипогликемических состояний удается путем интраназальных введений гормона, что широко используется не только в экспериментальной практике на животных, но и в клинике при лечении болезни Альцгеймера, мягкого когнитивного дефицита и некоторых форм диабетической энцефалопатии [25–28]. Поскольку СД2 имеет достаточно сложную этиологию, включающую воспалительные процессы, окислительный стресс, митохондриальную дисфункцию, амилоидогенез, представляет интерес использование комбинаций препаратов, наделенных нейропротекторными, антиоксидантными и противовоспалительными свойствами, для коррекции нарушений функций ЦНС, в том числе когнитивных, а также нормализации церебрального сигналинга [29]. Среди соединений природного происхождения, обладающих как нейропротекторными, так и противовоспалительными свойствами, следует выделить ганглиозиды [30–34]. Они хорошо растворяются и в водных растворах, и в полярных органических растворителях, поскольку обладают амфифильной природой. Для быстрой адресной доставки ганглиозидов в мозг, как и в случае инсулина, может быть использован интраназальный способ введения. Можно ожидать, что многофункциональные по своему фармакологическому профилю ганглиозиды усилят действие инсулина в ЦНС при СД2.
Основная цель работы состояла в оценке эффективности раздельных и совместных интраназальных введений инсулина и ганглиозидов для коррекции когнитивных нарушений у крыс линии Wistar с СД2, для чего использовали водный лабиринт Морриса с последующим анализом в гиппокампе уровня экспрессии белков и активности протеинкиназ, вовлеченных в процессы обучения и формирования долговременной памяти.
МЕТОДЫ ИССЛЕДОВАНИЯ
Подготовка препаратов для интраназальных инъекций. Ганглиозиды экстрагировали из мозга теленка по методу, разработанному Фолчем, как описано нами ранее [35]. Выделенные суммарные глико-сфинголипиды дополнительно очищали на колонках Sephadex G-25 “Fine” (“Pharmacia”, Щвеция) [36]. Для количественной оценки содержания гликосфинголипидов использовали специфическую реакцию сиаловых кислот с резорциновым реагентом. Полученный препарат ганглиозидов после упаривания растворяли в физиологическом растворе до концентрации 1 мг/10 мкл. Инсулин (#I5500, “Sigma”, США), используемый для интраназального введения, растворяли в 0.1 М цитратном буфере, pH 4.5, до концентрации 0.5 МЕ/20 мкл. Совместное интраназальное введение инсулина и ганглиозидов проводилось с разницей в 10 мин.
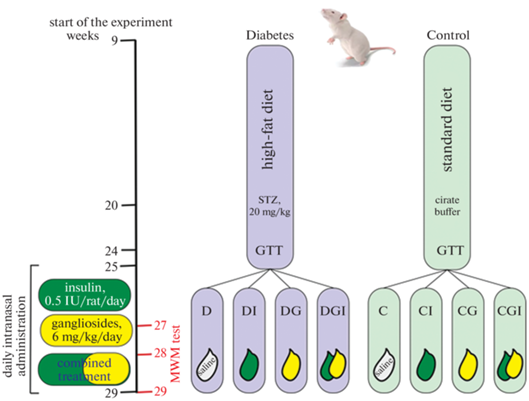
Экспериментальная модель диабета. Самцы линии Wistar в возрасте двух месяцев использовались для моделирования СД2, индуцируемого высокожировой диетой (ВЖД), описанной нами ранее [37], и однократной инъекцией низкой дозы стрептозотоцина (20 мг/кг), вводимого в/б через 11 нед после перевода животных на ВЖД (рис. 1). Результаты глюкозотолерантного теста, проведенного через 4 нед после введения стрептозотоцина, показали, что у животных развилась среднетяжелая форма СД2 с выраженными нарушениями толерантности к глюкозе. Животные четырех контрольных групп получали стандартный корм и однократную инъекцию 0.1 М натрий-цитратного буфера (pH 4.5) вместо стрептозотоцина. Из крыс с подтвержденным СД2 были сформированы 4 группы. В течение последующих 4 нед, как представлено на схеме рис. 1, проводились однократные ежедневные интраназальные введения следующих препаратов: Группа 1 (Контроль, К) – физиологический раствор, Группа 2 (Контроль, Инсулин, КИ) – инсулин (0.5 МЕ/крысу), Группа 3 (Контроль, Ганглиозиды, КГ) – ганглиозиды (6 мг/кг), Группа 4 (Контроль, Ганглиозиды + Инсулин, КГИ) – ганглиозиды (6 мг/кг) + инсулин (0.5 МЕ/крысу), Группа 5 (Диабет, Д) – физиологический раствор, Группа 6 (Диабет + Инсулин, ДИ) – инсулин (0.5 МЕ/крысу), Группа 7 (Диабет + Ганглиозиды, ДГ) – ганглиозиды (6 мг/кг), Группа 8 (Диабет + Ганглиозиды + Инсулин, ДГИ) – ганглиозиды (6 мг/кг) + инсулин (0.5 МЕ/крысу). Все процедуры по работе с животными проводили в соответствии с утвержденным Комиссией по контролю содержания и использования лабораторных животных протоколом-заявкой ИЭФБ РАН (Протокол № 1-11/2022 от 27.01.2022 г.) и требованиями, предусмотренными European Communities Council Directive 1986 и изложенными в Guide for the Care and Use of Laboratory Animals, 2010. По окончании эксперимента животных наркотизировали хлоралгидратом (400 мг/кг массы тела, “Sigma”, США), осуществляли декапитацию, извлекали мозг для дальнейшего выделения необходимых структур. Образцы гиппокампа замораживали на сухом льду сразу после извлечения и хранили в холодильнике при –80°С для последующей оценки содержания интересующих белков и их фосфорилированных форм методом Вестерн блоттинга и изучения экспрессии генов методом ПЦР в реальном времени.
Рис. 1.
Схема эксперимента по изучению эффективности раздельных и совместных интраназальных введений инсулина (ИВИ, 0.5 МЕ/крысу/сутки) и ганглиозидов (ИВГ, 6 мг/кг/сутки) для коррекции когнитивных нарушений у крыс с СД2, вызванным высокожировой диетой и низкой дозой стрептозотоцина. Обозначения групп на схеме: группа 1 (C) – контроль (К), группа 2 (CI) – контроль + инсулин (КИ), группа 3 (CG) – контроль + ганглиозиды (КГ), группа 4 (CGI) – контроль + ганглиозиды + инсулин (КГИ), группа 5 (D) – диабет (Д), группа 6 (DI) – диабет + инсулин (ДИ), группа 7 (DG) – диабет + ганглиозиды (ДГ), группа 8 (DGI) – диабет + ганглиозиды + инсулин (ДГИ). MWM – водный лабиринт Морриса.
Глюкозотолерантный тест. За два дня до окончания лечения эффективность проводимой терапии оценивалась с помощью орального глюкозотолерантного теста (оГТТ), для чего крысам перорально через зонд вводили глюкозу (2 г/кг), уровень которой в крови измеряли затем в течение 120 мин с помощью глюкометра и тест-полосок “One Touch Ultra” (США).
Иммуноферментный анализ. Уровень инсулина в плазме крови оценивали, используя набор “Rat Insulin ELISA kit” (“Mercodia”, Швеция) в соответствии с инструкцией производителя.
Поведенческий тест “Водный лабиринт Морриса”. Изучение пространственной памяти у крыс контрольных и диабетических групп проводили в водном лабиринте Морриса (ВЛМ). Подопытные животные во время заплывов должны были найти платформу диаметром 15 см, скрытую под водой и находящуюся на 1–2 см ниже ее уровня. Для этого использовался бассейн диаметром 150 см и высотой 70 см, заполненный водой c температурой 22 ± 1°C. Чтобы скрыть положение платформы, воду подкрашивали молоком. Первую тренировку проводили через 2 нед после начала интраназальных введений препаратов и повторяли в течение пяти последующих дней по 4 попытки в день для каждой особи. Для пространственной ориентации на внутренней стенке бассейна каждое направление (север, юг, запад, восток) маркировалось картинками с изображением различных знаков (круг, квадрат, треугольник или крест). В каждой попытке, длившейся 60 с, животное запускалось с различных стартовых точек. В том случае, если платформа не была обнаружена за 60 с, крысу рукой направляли к цели. После нахождения платформы животным предоставлялось 15 с для запоминания ее местоположения. На 2-й неделе испытаний положение платформы менялось, чтобы оценить способность особей к переобучению. Ежедневные интраназальные введения в периоды обучения и переобучения, длившиеся в совокупности 2 нед, проводились по окончании заплывов. Трассировка перемещения испытуемых животных регистрировались на веб-камеру для последующего анализа в программе “AnyMaze”. Для каждого показателя (латентный период нахождения платформы, длина пути или дистанция, скорость плавания) суммировались значения четырех попыток, на основании которых строились графики изменения данного параметра от времени обучения для каждой особи. Для обобщения данных рассчитывались площади под кривыми (AUC), которые использовались для представления полученных результатов.
Вестерн блоттинг. Кусочки гиппокампа гомогенизировали в соотношении 1:20 в лизисном буфере 20 мM Tris-HCl (pH 7.5), 150 мM NaCl, 2 мM EDTA, 2 мM EGTA, 0.5% Triton X-100, 0.5% дезоксихолат натрия, 15 мM NaF, 10 мM глицерофосфат натрия, 10 мM пирофосфат натрия, 1 мM Na3VO4, 1 мM фенилметилсульфонил фторид (PMSF), 0.02% NaN3 и протеазный ингибиторный коктейль (“Roche”, Швейцария). Клеточные фрагменты и неразрушенные клетки осаждали центрифугированием 500 g × 10 мин (+4°C). Концентрацию белка в пробах измеряли по модифицированному методу Лоури. Для вертикального электрофореза в камерах Mini-Protean (“Bio-Rad”, США) на 8–14% акриламидные гели загружали пробы, содержащие 25–30 мкг белка. В качестве стандарта молекулярного веса использовали окрашенные маркеры “Spectra Multicolour Broad Range Protein Ladder (10–260 кДа)” (“Thermo Fisher Scientific”, США). Перенос белков на нитроцеллюлозную мембрану (0.45 μM, “Amersham”, Великобритания) методом мокрого переноса осуществлялся в минитранс-блоттере (“Bio-Rad”, США) в буфере 25 мМ Tris, 192 мМ глицин, 20% этанола (v/v) при постоянном напряжении 100 V. Для блокировки сайтов неспецифического связывания мембраны инкубировались 30 мин при комнатной температуре в буфере, содержащем 20 мМ Tris-HCl (pH 7.5), 150 мМ NaCl, 5% обезжиренного молока (“Europek”, Россия), 0.1% Tween 20. Для взаимодействия с растворами первичных антител мембраны оставляли на ночь при +4°С на шейкере MR-1 (“Biosan”, Латвия). Первичные антитела разводились в большинстве случаев в 20 мМ Tris-HCl (pH 7.6), 150 мМ NaCl, 5% БСА-V фракция (“Amresco”, США), 0.1% Tween 20 в соотношении (1:1000). Антитела для pAkt(Ser473) (#4058), Akt (#9272), pGSK3β(Ser9) (#9322), GSK3β (#9315), total ERK1/2 (#9102), PSD95 (# 3450) были приобретены у компании “Cell Signaling Technology” (США), anti-phospho-ERK1 (pThr202/pTyr204) &ERK2 (pThr186/pTyr187) (#E7028) – у компании “Sigma” (США), GLUT1 (#M00163) – у компании “Boster” (США), GFAP (#NBP1-05197), IL-6 (#DF6087) – у компании “Affinity Biosciences” (Китай), GAPDH (#NB600-502) – у компании “Novus Biologicals” (США). После 3-х кратной промывки буфером, содержащим 20 мМ Tris-HCl (pH 7.6), 150 мМ NaCl, 0.1% Tween-20, мембраны покрывали растворами вторичных антител, приготовленными на 5%-ном обезжиренном молоке в том же буфере, для 1 ч инкубации при комнатной температуре. В качестве вторичных антител использовали анти-кроличьи (#7074) или анти-мышиные (#7076) IgG (“Cell Signaling Technology”, США), конъюгированные с пероксидазой хрена (HRP), либо биотинилированные IgG(H+L) (#14708) и (#14709). Сигнал HRP усиливали коммерческим ECL (“Novex”, США) или аналогом ECL, приготовленным в лабораторных условиях (люминол – пара-кумаровая кислота – Н2О2). Хемилюминесцентное свечение фиксировали на голубой фотопленке (“Phenix”, “Research Products”, США). Для нормализации данных мембраны после стриппинга проводили реакцию на GAPDH. Проявленные фотопленки визуализировали на сканере “Canon” (“CanoScan 8800F”, США). Денситометрическая обработка данных проводилась с помощью программы Bio7.
Иммуногистохимия. Для иммуногистохимических исследований фиксация мозга проводилась в течение 6 дней в 4%-ном растворе пара-формальдегида, разбавленном 0.02 М Na+-фосфатным буфером (+4°С). Для промывки использовали 0.02 M фосфатный буфер (PBS, рН 7.4) с 0.9%-ным NaCI. В целях криопротекции мозг выдерживал 7 дней в 30%‑ном растворе сахарозы в PBS, после чего замораживали. Из области гиппокампа получали чередующиеся серии фронтальных срезов (16 мкм) с помощью криостата (“Leika”, Германия). Каждый десятый срез монтировали на стекла “SuperFrost/plus” (“Menzel”, Германия). Стекла кипятили в цитратном буфере (pH 6.0) 5 мин для демаскировки антигена, промывали в PBS. Чтобы блокировать эндогенную пероксидазу, препараты 30 мин обрабатывали 0.3%-ным раствором перекиси водорода, разведенной в РВS. После промывки в PBS, содержащем 0.1% Triton X-100 (PBST), срезы инкубировали 1 ч при комнатной температуре в блокирующем растворе (2% сыворотки быка и 2% сыворотки козы в PBST) для предотвращения неспецифического связывания, затем еще 12 ч при комнатной температуре с первичными антителами анти-BDNF (#DF6387, “Affinity Biosciences”, Китай) в разведении 1:100. После тщательной промывки срезы инкубировали 1 ч при комнатной температуре со вторичными антителами козы против кролика, конъюгированными с биотином (“VectorLabs”, Великобритания) и разведенными (1:600) на PBST. После промывки на стекла наносили комплекс стрептавидин-пероксидаза (“Sigma”, США) в разведении (1:700) в PBS. Визуализацию проводили с помощью 0.05%-ного раствора диаминобензидина (“Sigma”, США) и 0.015%-ного раствора перекиси водорода. Реакцию останавливали дистиллированной водой и после промывки и стандартной гистологической обработки срезы заключали под покровное стекло и высушивали. Изображения получали с помощью микроскопа “Сarl Ziess Axio A1” (“Ziess”, Германия) со встроенной телевизионной камерой “AxioCam 712 color” (“Ziess”, Германия) и программы ZEN 3.4 (Zen pro). Оптическую плотность иммунопозитивных структур измеряли с помощью программы Bio7 (США) и представляли в условных единицах.
Статистическая обработка. Анализ полученных данных проводили с помощью программы “Prism”. Результаты представляли как среднее значение ± SEM. Нормальность распределения проверяли с помощью критерия Шапиро–Уилка. Для сравнения двух выборок с нормальным распределением использовали t-критерий Стьюдента. Результаты оГТТ по AUC0–120 (глюкоза) и чувствительности тканей к инсулину по AUC0–120 (инсулин) проверялись также методом однофакторного дисперсионного анализа ANOVA. Статистически значимыми считали отличия при уровне значимости p < 0.05. Достоверность различий по сравнению с контрольными крысами (К) обозначалась на графиках как: a – p < 0.05, b – p < 0.02; c – p < 0.001. Достоверность различий по сравнению с необработанными диабетическими крысами (Д) обозначалась на графиках как: d – p < 0.05, e – p < 0.02; f – p < 0.001.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Содержание животных на ВЖД в течение 5 мес в совокупности с однократным введением низкой дозы стрептозотоцина (20 мг/кг, в/б) приводило к развитию СД2, для которого характерны нарушение толерантности к глюкозе и снижение чувствительности тканей к действию инсулина, что подтверждают результаты глюкозотолерантного теста (ГТТ) и уровни инсулина в плазме крови при нагрузке глюкозой (рис. 2). У крыс диабетической группы (Д) на 34% (F(5, 48) = 19.265, p < 0.0001) увеличилось значение интегрированной площади AUC0–120 для глюкозных кривых (рис. 2a) и на 73% (F(5, 23) = 3.9716, p = 0.01) значение интегрированной площади AUC0–120 для инсулиновых кривых в ГТТ (рис. 2b) по сравнению с таковыми в контрольной группе (К). Это означает, что, начиная с уровней глюкозы и инсулина в крови натощак, до их концентрации после нагрузки глюкозой через 15, 30, 60 и 120 мин, показания для крыс из диабетической группы были значимо выше, чем у животных из группы контроля.
Рис. 2.
Оценка влияния интраназально вводимого инсулина (ИВИ, 0.5 МЕ/крысу/сутки) и ганглиозидов (ИВГ, 6 мг/кг/сутки) при раздельном и совместном введении на уровни глюкозы и инсулина в крови крыс с СД2, вызванным высокожировой диетой и низкой дозой стрептозотоцина, при проведении орального глюкозотолерантного теста. Обозначения групп на графике: группа 1 (C) – контроль (К), группа 4 (CGI) – контроль + ганглиозиды + инсулин (КГИ), группа 5 (D) – диабет (Д), группа 6 (DI) – диабет + инсулин (ДИ), группа 7 (DG) – диабет + ганглиозиды (ДГ), группа 8 (DGI) – диабет + ганглиозиды + инсулин (ДГИ). (a) – AUC0–120, интегрированная площадь под кривой “концентрация глюкозы (мМ) – время (мин)” для глюкозных кривых в течение 120 мин после нагрузки глюкозой. Данные представлены как среднее ± SEM (n = 9). (b) – AUC0–120, интегрированная площадь под кривой “концентрация инсулина (нг/мл) – время (мин)” для инсулиновых концентрационных кривых в течение 120 мин после нагрузки глюкозой. Данные представлены как среднее ± SEM (n = 5). Достоверность различий проверялась методом дисперсионного анализа ANOVA. Различия значимы по сравнению с контрольными крысами (К) при: b – p < 0.02; c – p < 0.001. Различия значимы по сравнению с необработанными диабетическими крысами (Д) при: f – p < 0.001.

Для коррекции метаболических и биохимических нарушений использовалась монотерапия в виде интраназальных введений инсулина (0.5 МЕ/крысу, ИВИ) или суммарных ганглиозидов мозга теленка (6 мг/кг, ИВГ), а также совместные введения ИВИ и ИВГ в указанных дозах в течение 4 нед. Поскольку у крыс контрольных групп с введениями только инсулина (КИ) или одних ганглиозидов (КГ) уровень глюкозы натощак достоверно не отличался от показателей контрольной группы (К), ГТТ проводился только для группы, получавшей совместно ИВИ и ИВГ (группа КГИ). Через 4 нед у диабетических животных после ИВИ и ИВГ, как раздельных, так и совместных, полностью восстанавливалась чувствительность тканей к инсулину, о чем свидетельствует отсутствие значимых различий между группой контроля (К) и группами ДИ, ДГ и ДГИ (рис. 2b) соответственно. В то же время толерантность к глюкозе полностью восстанавливалась только у крыс в группе ДГИ после обработки совместно ИВИ и ИВГ, что подтверждает нивелирование различий AUC0–120 для глюкозных кривых между группами К и ДГИ. Более того, между группами ДГИ и Д различия становились значимыми (p < 0.001). Следует отметить, что после раздельных ИВИ и ИВГ наблюдались изменения в скорости поглощения глюкозы тканями, но они не достигали показателей контрольной группы (рис. 2a).
Для изучения влияния метаболических нарушений на когнитивные функции у экспериментальных животных исследовали способность к пространственному обучению (1-я сессия) и переобучению (2-я сессия) в водном лабиринте Морриса. Различия между группами в большей мере проявились в таком показателе, как длина пути от места старта до платформы (рис. 3a,b). Поскольку в первый день обучения всем животным требовалась помощь в нахождении платформы, различия между контрольной группой (К) и группой с СД2 без лечения (Д) не были выявлены. Однако, начиная со 2-го дня и до конца обучения в первой сессии, крысы из группы Д без лечения двигались по более длинной траектории в поисках платформы в целевом квадранте по сравнению с контролем (рис. 3b), причем все различия были значимыми. Тестирование животных контрольных групп показало улучшение когнитивных функций у крыс после введений одного инсулина в группе КИ, но эффект проявился только на 2-й, 4-й и 5-й дни. У животных с СД2 после раздельных и совместных ИВИ и ИВГ наблюдалось улучшение пространственной ориентации, благодаря которой они совершали перемещение по оптимальной траектории. При этом лишь на 5-й и 6-й дни эффект в группе ДГИ при комбинированном применении препаратов был более выраженным (p < 0.02 по отношению к группе Д) по сравнению с введением одного инсулина в группе ДИ (p < 0.05 по отношению к группе Д). Несмотря на то что ганглиозиды модулируют активность тирозинкиназных рецепторов ростовых факторов, достоверные изменения при СД2 в группе ДГ не были постоянными, а проявились лишь в отдельные дни (1-й и 4-й).
Рис. 3.
Влияние ИВИ (0.5 МЕ/крысу/сутки) и ИВГ (6 мг/кг/сутки) при раздельном и совместном введении контрольным крысам и крысам с СД2 на длину пути к платформе в ВЛМ при обучении и переобучении. Обозначения групп на графике: группа 1 (C) – контроль (К), группа 2 (CI) – контроль + инсулин (КИ), группа 3 (CG) – контроль + ганглиозиды (КГ), группа 4 (CGI) – контроль + ганглиозиды + инсулин (КГИ), группа 5 (D) – диабет (Д), группа 6 (DI) – диабет + инсулин (ДИ), группа 7 (DG) – диабет + ганглиозиды (ДГ), группа 8 (DGI) – диабет + ганглиозиды + инсулин (ДГИ). (a) – Изменение длины пути от старта до платформы при обучении с 1-го по 6-й день. (b) – Пример траектории движения в период обучения (день 3). (c) – Изменение длины пути от старта до платформы при переобучении с 7-го по 12-й день. (d) – Пример траектории движения в период переобучения (день 9). Данные представлены как среднее ± SEM (n = 9). Различия статистически значимы по t-тесту по сравнению с группой К при: a – p < 0.05; b – p < 0.02. Различия статистически значимы по сравнению с группой Д при: d – p < 0.05; e – p < 0.02.
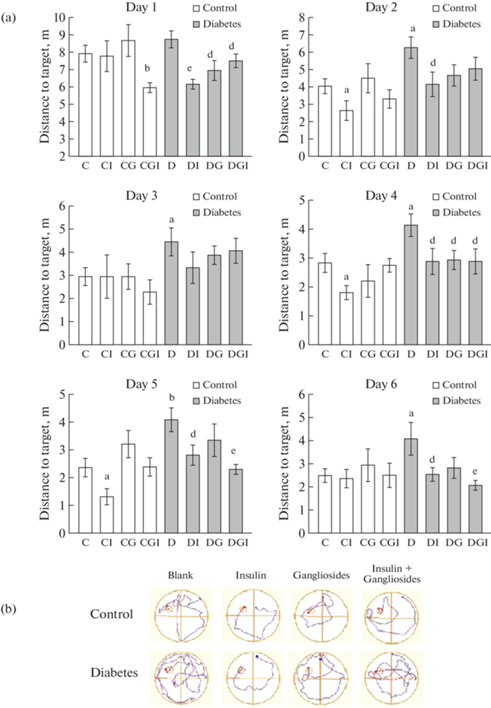
Рис. 3.
Окончание.
Итоги пространственного обучения по нахождению платформы в целевом квадранте, суммирующие результаты заплывов всех дней, представлены также в виде интегрированной площади под кривой (AUC) “латентное время – дни (1–6)” и “длина пути – дни (1–6)” (табл. 1). При метаболических нарушениях животным требуется больше времени для решения задач по навигации (130.4 ± ± 7.9 усл. ед. для СД2 без лечения против 101.7 ± ± 6.7 усл. ед. для контроля, p < 0.05), поскольку увеличивается траектория движения (24.1 ± 1.5 усл. ед. для СД2 против 18.9 ± 1.5 усл. ед. для контроля, p < 0.05). Измерение средней скорости перемещения показало, что животные всех групп двигались с одинаковой скоростью (табл. 1). По совокупности полученных данных можно сделать вывод, что пространственная ориентация улучшалась благодаря ИВИ и ИВГ. Однако при совместных ИВИ и ИВГ она оставалась на том же уровне, что и при раздельном введении препаратов.
Таблица 1.
Влияние раздельных и совместных интраназальных введений инсулина (0.5 МЕ/крысу/сутки) и ганглиозидов (6 мг/кг/сутки) животным контрольных групп и с СД2 на латентное время (AUC), длину пути (AUC) и скорость плавания в водном лабиринте Морриса
| Группа | AUC (Латентное время-дни), усл. ед. | AUC (Дистанция до платформы-дни), усл. ед. | Скорость плавания, м/с |
|---|---|---|---|
| Обучение с 1-го по 6-й день | |||
| К | 101.7 ± 6.7 | 18.9 ± 1.5 | 0.168 ± 0.003 |
| КИ | 76.1 ± 5.4* | 13.2 ± 1.3* | 0.157 ± 0.007 |
| КГ | 110.6 ± 6.3 | 20.7 ± 1.8 | 0.163 ± 0.004 |
| КГИ | 89.0 ± 6.9 | 16.6 ± 2.2 | 0.159 ± 0.004 |
| Д | 130.4 ± 7.9** | 24.1 ± 1.5* | 0.164 ± 0.005 |
| ДИ | 108.0 ± 6.6х## | 18.2 ± 1.3хх# | 0.164 ± 0.004 |
| ДГ | 124.6 ± 10.2 | 19.9 ± 1.5 | 0.155 ± 0.004 |
| ДГИ | 110.5 ± 8.3 | 19.8 ± 1.3х | 0.156 ± 0.003 |
| Переобучение с 7-го по 12-й день | |||
| К | 66.3 ± 4.3 | 11.8 ± 0.9 | 0.162 ± 0.003 |
| КИ | 53.2 ± 4.2 | 8.9 ± 0.9* | 0.158 ± 0.005 |
| КГ | 56.0 ± 4.3 | 9.7 ± 0.9 | 0.162 ± 0.004 |
| КГИ | 73.0 ± 8.3 | 13.2 ± 2.3 | 0.157 ± 0.006 |
| Д | 76.9 ± 11.4 | 14.0 ± 2.1 | 0.168 ± 0.005 |
| ДИ | 82.2 ± 11.5 | 14.2 ± 1.7# | 0.168 ± 0.007 |
| ДГ | 84.3 ± 12.5 | 13.0 ± 2.0 | 0.153 ± 0.006 |
| ДГИ | 72.4 ± 5.6 | 12.7 ± 1.1 | 0.165 ± 0.005 |
Примечание. Данные представлены как среднее ± SEM (n = 9). Различия статистически значимы по t-тесту по сравнению с группой К при: * – p < 0.05,** – p < 0.02. Различия статистически значимы по сравнению с группой Д при: x – p < 0.05, xx– p < 0.02. Различия статистически значимы по сравнению с группой КИ при: #– p < 0.05, ##– p < 0.02.
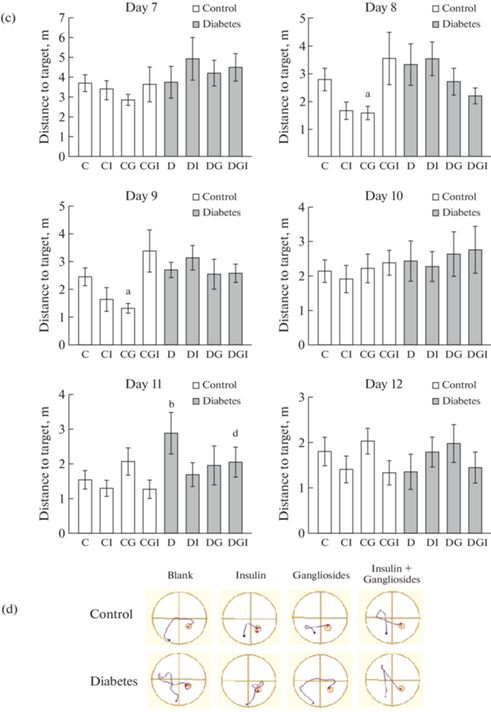
Для переобучения (2-я сессия) платформа перемещалась в противоположный целевой квадрант. В ходе переобучения значимых стабильных различий, проявляющихся в течение нескольких дней, между контрольной и диабетическими группами выявить не удалось (рис. 3c, d и табл. 1), что, как мы полагаем, может быть обусловлено благотворным влиянием физических нагрузок в ходе выполнения ВЛМ на когнитивные функции у животных всех групп, в том числе с СД2. Следует отметить, что в ходе переобучения животные контрольной группы после ИВИ по итогам 6 дней показали способность к перемещению по более короткой траектории, что подтверждает более низкое значение интегрированной площади под кривой AUC “длина пути – дни (7–12)” по сравнению с контрольной группой без введений, хотя AUC “латентное время – дни (7–12)” между этими группами достоверно не отличаются.
Способность животных к обучению и формированию памяти определяется изменениями на уровне сигнальных и эффекторных систем мозга, которые инициируются в том числе различными ростовыми факторами, прежде всего нейротрофическим фактором мозга (BDNF). Положительное влияние ИВИ на когнитивные функции у крыс контрольной группы КИ может быть обусловлено увеличением содержания BDNF в иммунопозитивных клетках СА1 области гиппокампа с 0.42 ± 0.06 усл. ед. в контроле (К) до 0.64 ± 0.10 усл. ед. в группе КИ (p < 0.001) (рис. 4). Однако сравнение экспрессии BDNF в клетках гиппокампа крыс из диабетических групп (Д, ДИ, ДГ и ДГК) не выявило достоверных различий по сравнению с группой контроля (К). Несмотря на то что обработка совместно ИВГ и ИВИ также повышала уровень BDNF на срезах мозга группы КГИ, в ВЛМ-тесте более эффективную пространственную ориентацию крысы из этой группы показали только в 1-й день обучения. По совокупности 4 попыток они двигалась по более короткой траектории, чем группа контроля (К).
Рис. 4.
Влияние ИВИ (0.5 МЕ/крысу/сутки) и ИВГ (6 мг/кг/сутки) при раздельном и совместном введении на экспрессию нейротрофического фактора мозга (BDNF) в СА1 области гиппокампа контрольных крыс и крыс с СД2. Обозначения групп на графике: группа 1 (C) – контроль (К), группа 2 (CI) – контроль + инсулин (КИ), группа 3 (CG) – контроль + ганглиозиды (КГ), группа 4 (CGI) – контроль + ганглиозиды + инсулин (КГИ), группа 5 (D) – диабет (Д), группа 6 (DI) – диабет + инсулин (ДИ), группа 7 (DG) – диабет + ганглиозиды (ДГ), группа 8 (DGI) – диабет + ганглиозиды + инсулин (ДГИ).@(a) – Экспрессия нейротрофического фактора BDNF, выявляемая по иммуногистохимической реакции со специфическим антителом. Масштаб – 100 мкм. (b) – Количественная оценка экспрессии BDNF. Данные представлены как среднее ± SEM. Различия статистически значимы по t-тесту по сравнению с группой К при: b – p < 0.02, c – p < 0.001.

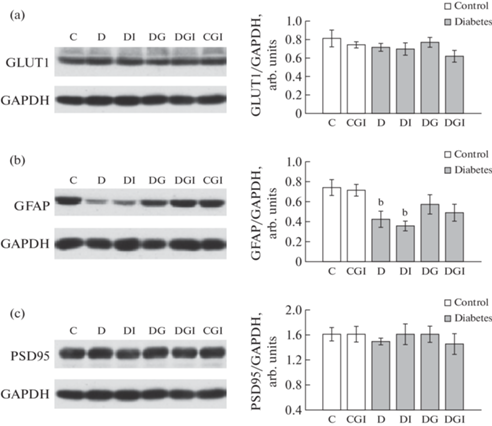
Для изучения причин когнитивных нарушений при СД2 представляло интерес сравнить экспрессию белков и активность ключевых протеинкиназ, участвующих в регуляции синаптической пластичности, в гиппокампе крыс контрольной группы (К) и крыс с СД2. Обучение представляет собой весьма энергозатратный процесс, в ходе которого нейроны активно поглощают глюкозу, которая поступает в клетки через глюкозный транспортер GLUT-3. В то же время большую часть глюкозы в мозге через GLUT-1 поглощают астроциты, где она метаболизируется и далее в виде лактата поступает в нейроны через астроцитарно-нейрональный лактатный челнок. Анализ экспрессии GLUT-1 в лизатах гиппокампа методом Вестерн блоттинга не выявил достоверных различий между изучаемыми группами (рис. 5a). Эти данные не согласуются с уровнем маркерного белка астроцитов GFAP, экспрессия которого снижается во всех группах с СД2, хотя значимыми по сравнению с контролем эти изменения были только у крыс с СД2 без лечения и после обработки ИВИ (рис. 5b). Анализ экспрессии белка постсинаптического уплотнения PSD-95, который выполняет важную роль в связывании рецепторов и закреплении их в синаптическом уплотнении, а также в связывании ферментов, регулирующих фосфорилирование, нитрозилирование и другие модификации рецепторов, показал, что его содержание в гиппокампе не претерпевает изменений (рис. 5c).
Рис. 5.
Влияние ИВИ (0.5 МЕ/крысу/сутки) и ИВГ (6 мг/кг/сутки) при раздельном и совместном введении на экспрессию GLUT-1, GFAP и PSD95 в гиппокампе контрольных крыс и крыс с СД2. Обозначения групп на графике: группа 1 (C) – контроль (К), группа 4 (CGI) – контроль + ганглиозиды + инсулин (КГИ), группа 5 (D) – диабет (Д), группа 6 (DI) – диабет + инсулин (ДИ), группа 7 (DG) – диабет + ганглиозиды (ДГ), группа 8 (DGI) – диабет + ганглиозиды + инсулин (ДГИ). (a) – Экспрессия GLUT-1, (b) – Экспрессия GFAP, (c) – Экспрессия PSD95. Данные представлены как среднее ± SEM (n = 7). Различия значимы по t-тесту по сравнению с контрольными крысами (К) при: b – p < 0.02.
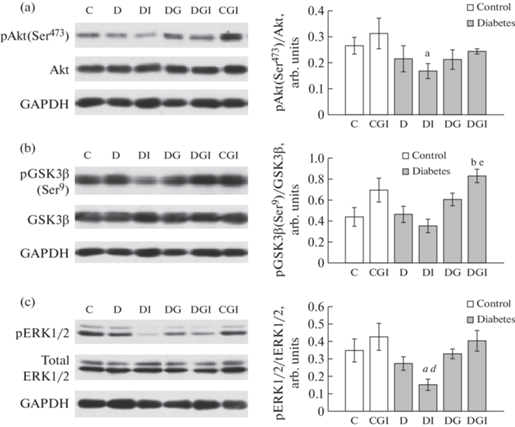
На межнейрональном уровне в основе таких феноменов, как обучение и память, лежит взаимодействие двух форм синаптической пластичности, а именно долговременной потенциации (LTP) и долговременной депрессии (LTD), баланс между которыми модулируется серин/треониновыми протеинкиназами – Akt-киназой (протеинкиназой B) и киназой гликогенсинтетазы 3β (GSK3β), нижележащей мишенью Akt-киназы. Поскольку одним из регуляторов функциональной активности этих протеинкиназ в мозге является инсулин, то представляло интерес провести оценку их активности при СД2 и в группах с лечением ИВИ с помощью специфических антител. Об активации Akt-киназы можно судить по ее фосфорилированию по остатку Ser473, в то время как основным сайтом для фосфорилирования в молекуле GSK3β является расположенный недалеко от N-конца фермента остаток Ser9, фосфорилирование которого приводит к ингибированию фермента. Анализ лизатов гиппокампа методом Вестерн блоттинга показал, что после лечения диабетических крыс ИВИ (группа ДИ) уровень фосфорилирования Akt-киназы по остатку Ser473 значимо снижался по сравнению с контрольной группой (К) (рис. 6a). Однако в гиппокампе диабетических крыс после обработки с помощью ИВИ (группа ДИ) уровень фосфорилирования GSK3β по остатку Ser9 не менялся, оставаясь на уровне значений в контрольной группе (К). В отличие от контрольных животных совместные введения инсулина и ганглиозидов оказывали значительное модулирующее влияние на фосфорилирование GSK3β по остатку Ser9, вследствие чего содержание этой формы фермента в группе с СД2 (группа ДГИ) достоверно увеличивалось как по отношению к контролю, так и к группе с СД2 без лечения (p < 0.02) (рис. 6b). Если 3-фосфоинозитидный путь, включающий в качестве эффекторного компонента Akt-киназу, активируется через посредство инсулинрецепторных субстратов (IRS), функционально сопряженных с инсулиновым рецептором, то каскад МАПК запускается через посредство белка Grb2, который также функционально взаимодействует с рецептором инсулина. Для ERK1/2, важнейшего представителя семейства МАПК, в гиппокампе наблюдали такую же закономерность, как и для Akt-киназы. Уровень фосфорилирования ERK1/2 в гиппокампе крыс с СД2 после 4-х недельных введений инсулина (группа ДИ) достоверно снижался как по отношению к контролю (К), так и по сравнению с диабетической группой без лечения (Д) (p < 0.05) (рис. 6c).
Рис. 6.
Влияние ИВИ (0.5 МЕ/крысу/сутки) и ИВГ (6 мг/кг/сутки) при раздельном и совместном введении на уровень фосфорилирования протеинкиназ Akt, GSK3β, ERK1/2 в гиппокампе контрольных крыс и крыс с СД2. Обозначения групп на графике: группа 1 (C) – контроль (К), группа 4 (CGI) – контроль + ганглиозиды + инсулин (КГИ), группа 5 (D) – диабет (Д), группа 6 (DI) – диабет + инсулин (ДИ), группа 7 (DG) – диабет + ганглиозиды (ДГ), группа 8 (DGI) – диабет + ганглиозиды + инсулин (ДГИ). (a) – Фосфорилирование Akt-киназы по Ser473, (b) – фосфорилирование киназы GSK3β по Ser9, (c) – фосфорилирование ERK1 по Thr202/Tyr204 и ERK2 по Thr186/Tyr187. Данные представлены как среднее ± SEM (n = 7). Различия значимы по t-тесту по сравнению с контрольными крысами (К) при: а – p < 0.05, b – p < 0.02. Различия значимы по сравнению с необработанными диабетическими крысами (Д) при: d – p < 0.05; e – p < 0.02.
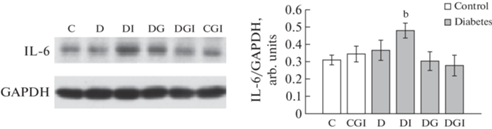
Метаболические нарушения в организме сопровождаются интенсификацией воспалительных процессов, в том числе в мозге. Накопление провоспалительных цитокинов коррелирует с интенсивностью этих процессов. Анализ лизатов гиппокампа на содержание в них цитокина интерлейкина-6 (IL-6) показал, что его количество увеличивается только у крыс с СД2 после обработки ИВИ (группа ДИ), что, возможно, и является причиной одновременного снижения степени фосфорилирования ключевых протеинкиназ Akt и ERK1/2 (рис. 7).
Рис. 7.
Влияние ИВИ (0.5 МЕ/крысу/сутки) и ИВГ (6 мг/кг/сутки) при раздельном и совместном введении на уровень экспрессии IL-6 в гиппокампе контрольных крыс и крыс с СД2. Обозначения групп на графике: группа 1 (C) – контроль (К), группа 4 (CGI) – контроль + ганглиозиды + инсулин (КГИ), группа 5 (D) – диабет (Д), группа 6 (DI) – диабет + инсулин (ДИ), группа 7 (DG) – диабет + ганглиозиды (ДГ), группа 8 (DGI) – диабет + ганглиозиды + инсулин (ДГИ). Данные представлены как среднее ± SEM (n = 7). Различия значимы по t-тесту по сравнению с контрольными крысами (К) при: b – p < 0.02.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Метаболизм глюкозы и энергетический обмен на периферии, прежде всего в печени и жировой ткани, регулируются инсулином не только напрямую, но и через посредство ЦНС. В этой связи большинство работ, в которых описываются центральные эффекты гормона на метаболические процессы, посвящены изучению его действия на нейроны гипоталамуса [38–40]. Однако высокий уровень экспрессии инсулиновых рецепторов выявлен также в гиппокампе [41, 42]. Инсулин, как было показано в опытах in vitro и in vivo, модулирует синаптическую пластичность в гиппокампе [7–10, 43, 44]. Учитывая взаимосвязь синаптической пластичности и когнитивных функций, логично предположить, что инсулин способен оказывать позитивное влияние на процессы обучения и формирования памяти, что и было подтверждено экспериментально [45–48]. Представления о роли инсулиновой сигнальной системы в гиппокампе были значительно расширены, благодаря работе с животными нокаутными по рецепторам инсулина и IGF-1 в этой области мозга [49]. У нокаутных мышей наблюдали не только когнитивные расстройства, вызванные снижением экспрессии GluА1 субъединицы АМРА-рецепторов в синаптосомальных мембранах гиппокампа, но и нарушенную толерантность к глюкозе. Это подчеркивает важность гиппокампа не только как центра консолидации памяти, но и как важнейшего звена в нейрональной сети, регулирующей метаболизм глюкозы в организме.
Для улучшения запоминания или коррекции когнитивных нарушений используются различные способы доставки инсулина в мозг, среди которых интрацеребровентрикулярный (i.c.v.), непосредственное введение гормона в область гиппокампа, а также интраназальный способ доставки [45–48]. Первые два подхода высокотравматичны и трудно реализуемы не только для человека, но и для животных, и не могут быть использованы в клинике.
В качестве вспомогательного вещества, наделенного нейропротекторными свойствами, способного усилить действие инсулина, в наших экспериментах использовался препарат суммарных ганглиозидов мозга быка. Помимо нейропротекторного, антиоксидантного и противовоспалительного действия описано положительное влияние ганглиозидов в контроле энергетического гомеостаза, реализуемого через гипоталамические механизмы [50]. В составе липидных рафтов ганглиозиды регулируют активность тирозинкиназных доменов рецепторов инсулина и ростовых факторов [33]. Взаимодействие различных видов гликосфинголипидов с GluА2-субъединицей АМРА-рецепторов препятствует интернализации этих рецепторов и пролонгирует нахождение в синаптической мембране в функционально активном состоянии [51, 52], что имеет большое значение в процессе обучения, в который вовлечены АМРА-рецепторы. Если эффективность ИВИ общепризнана и этот способ введения инсулина широко применяется в клинике для лечения нейродегенеративных заболеванний, то ИВГ, помимо наших исследований [53], применялся еще лишь в одной работе [54].
Сравнивая различные способы доставки инсулина в мозг, следует отметить, что при i.c.v. и при введении в определенные области мозга через имплантированные канюли эффективная концентрация гормона при однократном применении не превышает 1–4 мЕД [45–47], тогда как для длительных воздействий используются ИВИ в суточных дозах 0.48 ЕД и выше. Тем не менее при обработке ИВИ контрольных животных через 2 нед мы наблюдали улучшение пространственной ориентации в водном лабиринте Морриса, благодаря чему сокращались латентное время поиска платформы и длина пути (табл. 1). Если эффект прямого введения может быть связан с быстрой активацией Akt-киназы в клетках гиппокампа [47], то в нашем случае улучшение когнитивных функций является следствием накопления BDNF в нейронах гиппокампа (рис. 4), усиливающего долговременную потенциацию (LTP) [55]. Отсутствие значимого эффекта на формирование пространственной памяти при введении одних ганглиозидов как контрольным крысам, так и животным с СД2, возможно, связано с тем, что в LTP на нашей модели задействованы АМРА-рецепторы с ионным каналом, сформированным не GluА2-субъединицей, к которым ганглиозиды имеют наибольшее сродство, а преимущественно GluА1- или GluА3-субъединицами.
Активные межнейронные взаимодействия, в том числе при обучении, сопровождаются интенсификацией метаболических процессов, увеличивающих расход глюкозы [56, 57]. Анализ экспрессии транспортера GLUT-1, через который глюкоза поступает в астроциты, показал, что содержание GLUT-1 в общем лизате гиппокампа у животных как контрольных, так и групп с СД2 остается неизменным (рис. 5). Нельзя исключать, что существуют различия между группами в распределении GLUT-1 между плазматической мембраной и цитозолем, однако это требует дальнейших исследований. Интерес представляет уменьшение содержания маркерного белка астроцитов GFAP в гиппокампе крыс с СД2 без лечения и после обработки ИВИ. Однако на основании этих данных неправомерно делать заключение, что снижается и количество самих астроцитов. GFAP – всего лишь один из компонентов промежуточных филаментов. Мыши, нокаутные по GFAP и его аналогу виментину, жизнеспособны, хотя и лишены промежуточных филаментов и менее устойчивы к стрессорным воздействиям [58, 59]. Проверка когнитивных функций у таких мышей в различных поведенческих тестах не выявила существенных различий по сравнению с животными дикого типа за исключением их особенности к более быстрому “выгоранию” памяти [60]. Благодаря введению ганглиозидов как раздельно, так и вместе с инсулином крысам с СД2, уровень GFAP в гиппокампе возрастал и достоверно не отличался от контрольной группы. В свою очередь, постоянство экспрессии белка PSD95 свидетельствует об отсутствии изменений в постсинаптической мембране.
В отличие от периферии GLUT-4 не является доминирующим переносчиком глюкозы в мозге. Однако в отдельных синапсах требуется его присутствие, чтобы поддержать развитие потенциала действия [61]. GLUT-4 причисляют к критически важным молекулярным компонентам гиппокампа, без которых невозможно формирование памяти [62]. Мы также попытались оценить вклад GLUT-4 в развитие когнитивного дефицита при СД2. Однако анализ уровня его экспрессии в гиппокампе с помощью ПЦР в реальном времени не принес никакого результата из-за низкого содержания исходной матрицы (мРНК данного гена), количество которой не удалось амплифицировать до необходимого порогового уровня даже при большом числе циклов. Используя специфические антитела к GLUT-4, были выявлены иммунопозитивные клетки на срезах гиппокампа без видимых различий в оптической плотности между группами. С помощью иммуногистохимии также не было обнаружено различий в экспрессии GLUT-3, основного транспортера глюкозы в нейронах. Отчасти это может быть связано с временным фактором, так как после завершения последних испытаний в ВЛМ декапитация животных проводилась только через 72 ч. Анализ экспрессии генов и белков, обеспечивающих сопряжение метаболизма между нейронами и астроцитами при обучении и формировании долговременной памяти, показал значительные изменения уже через 3, 6 и 24 ч после окончания тестирований [63]. Лишь некоторые из них сохранялись на более поздних сроках.
В отношении когнитивных функций протеинкиназы Akt, GSK3β и ERK1/2 рассматриваются как регуляторы синаптической пластичности [64–66]. Ингибиторы GSK3β блокируют индукцию LTD, тогда как развитие LTP приводит к подавлению активности GSK3β [64]. Столь сложные взаимодействия способствуют защите информации, кодируемой LTP, от последующего удаления при развитии LTD, что обеспечивает консолидацию памяти. Семейство киназ GSK3 чаще всего связывают с патогенезом болезни Альцгеймера, поскольку фермент участвует в гиперфосфорилировании Tau-белка, что вызывает его агрегацию и образование нейрофибриллярных клубков [67]. В таком случае высокий уровень ингибирующего фосфорилирования GSK3β по остатку Ser9, наблюдаемый в гиппокампе крыс с СД2 после обработки совместно ИВИ и ИВГ, способен обеспечить защиту не только от гиперфосфорилирования Tau-белка и тауропатии, но и от когнитивного дефицита.
В клинической практике интраназальные введения инсулина используются для улучшения когнитивных функций у пациентов с болезнью Альцгеймера и легкими нарушениями памяти, внимания, восприятия информации и логического мышления [68–70]. При введении людям с когнитивными расстройствами детемира, фармакологического препарата инсулина пролонгированного действия (40 ЕД/сутки) через 3 нед наблюдались улучшения различных видов памяти [68]. Если же введения продолжались в течение 4 мес, то позитивный эффект отсутствовал, что связывают с развитием ИР [69]. Одним их побочных эффектов длительной обработки ИВИ здоровых животных и животных с СД 1-го типа можно считать увеличение содержания в крови тиреотропного гормона, определяющего не только функциональную активность тиреоидной системы, но и зависимых от нее функций ЦНС и эндокринной систем [71]. Возможно, наблюдаемое нами через 4 нед ежедневных интраназальных введений инсулина снижение активности Akt-киназы и ERK1/2, оцениваемое по уровню их специфического фосфорилирования, а также увеличение содержания IL-6 являются предвестниками развивающейся ИР и дисбаланса выработки тиролиберина, рилизинг-фактора тиреотропного гормона (рис. 6 и 7). Неясным остается источник, продуцирующий IL-6, поскольку иммуногистохимический анализ с антителом к Iba1 показал отсутствие активированной микроглии в гиппокампе.
Таким образом, ИВИ улучшает пространственную память у животных с СД2, но длительные введения гормона могут привести к десенситизации в гиппокампе как инсулиновой сигнальной системы, так и функционально взаимодействующих с ней других сигнальных и нейромедиаторных систем. Процессы десенситизации, как мы полагаем, по крайней мере в некоторых случаях удается преодолеть путем комбинированного применения ИВИ с ганглиозидами. Крайне важным представляется установление временной динамики восстанавливающего эффекта комбинированной терапии ИВИ+ИВГ на сниженную при СД2 чувствительность к инсулину, на измененные в условиях диабетической патологии протеинкиназные каскады, мишени инсулина, и экспрессию факторов нейродифференцировки и воспаления, и это требует дальнейших исследований. Полученные данные свидетельствуют в пользу перспективности применения комбинаций ИВИ с ганглиозидами как для предотвращения диабетической энцефалопатии, так и для восстановления центральной регуляции энергетического обмена.
Список литературы
Duarte AI, Moreira PI, Oliveira CR (2012) Insulin in central nervous system: more than just a peripheral hormone. J Aging Res 2012: 384017. https://doi.org/10.1155/2012/384017
Petersen MC, Shulman G (2018) Mechanisms of Insulin Action and Insulin Resistance. Physiol Rev 98: 2133–2223. https://doi.org/10.1152/physrev.00063.2017
White MF, Kahn CR (2021) Insulin action at a molecular level – 100 years of progress. Mol Metab 52: 101304. https://doi.org/10.1016/j.molmet.2021.101304
Vinuesa A, Pomilio C, Gregosa A, Bentivegna M, Presa J, Bellotto M, Saravia F, Beauquis J (2021) Inflammation and Insulin Resistance as Risk Factors and Potential Therapeutic Targets for Alzheimer’s Disease. Front Neurosci 15: 653651. https://doi.org/10.3389/fnins.2021.653651
Sullivan M, Fernandez-Aranda F, Camacho-Barcia L, Harkin A, Macrì S, Mora-Maltas B, Jiménez-Murcia S, O’Leary A, Ottomana AM, Presta M, Slattery D, Scholtz S, Glennon JC (2023) Insulin and disorders of behavioural flexibility. Neurosci Biobehav Rev 150: 105169. https://doi.org/10.1016/j.neubiorev.2023.105169
Obici S, Zhang BB, Karkanias G, Rossetti L (2002) Hypothalamic insulin signaling is required for inhibition of glucose production. Nat Med 8: 1376–1382. https://doi.org/10.1038/nm1202-798
Viswaprakash N, Vaithianathan T, Viswaprakash A, Judd R, Parameshwaran K, Suppiramaniam V (2015) Insulin treatment restores glutamate (α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid) receptor function in the hippocampus of diabetic rats. J Neurosci Res 93: 1442–1450. https://doi.org/10.1002/jnr.23589
Zhao F, Siu JJ, Huang W, Askwith C, Cao L (2019) Insulin Modulates Excitatory Synaptic Transmission and Synaptic Plasticity in the Mouse Hippocampus. Neuroscience 411: 237–254. https://doi.org/10.1016/j.neuroscience.2019.05.033
Hammoud H, Netsyk O, Tafreshiha AS, Korol SV, Jin Z, Li JP, Birnir B (2021) Insulin differentially modulates GABA signalling in hippocampal neurons and, in an age-dependent manner, normalizes GABA-activated currents in the tg-APPSwe mouse model of Alzheimer’s disease. Acta Physiol 232: e13623. https://doi.org/10.1111/apha.13623
Shypshyna M, Kolesnyk O, Fedulova S, Veselovsky N (2023) Insulin modulates the paired-pulse plasticity at glutamatergic synapses of hippocampal neurons under hypoinsulinemia. Front Cell Neurosci 17: 1132325. https://doi.org/10.3389/fncel.2023.1132325
Janssen JAMJL (2021) Hyperinsulinemia and Its Pivotal Role in Aging, Obesity, Type 2 Diabetes, Cardiovascular Disease and Cancer. Int J Mol Sci 22: 7797. https://doi.org/10.3390/ijms22157797
Farris W, Mansourian S, Chang Y, Lindsley L, Eckman EA, Frosch MP, Eckman CB, Tanzi RE, Selkoe DJ, Guenette S (2003) Insulin-degrading enzyme regulates the levels of insulin, amyloid beta-protein, and the beta-amyloid precursor protein intracellular domain in vivo. Proc Natl Acad Sci U S A 100: 4162–4167. https://doi.org/10.1073/pnas.0230450100
Qiu WQ, Folstein MF (2006) Insulin, insulin-degrading enzyme and amyloid-beta peptide in Alzheimer’s disease: review and hypothesis. Neurobiol Aging 27: 190–198. https://doi.org/10.1016/j.neurobiolaging.2005.01.004
Spinelli M, Fusco S, Grassi C (2019) Brain Insulin Resistance and Hippocampal Plasticity: Mechanisms and Biomarkers of Cognitive Decline. Front Neurosci 13: 788. https://doi.org/10.3389/fnins.2019.00788
Reinke C, Buchmann N, Fink A, Tegeler C, Demuth I, Doblhammer G (2022) Diabetes duration and the risk of dementia: a cohort study based on German health claims data. Age Ageing 51: afab231. https://doi.org/10.1093/ageing/afab231
Heni M, Schöpfer P, Peter A, Sartorius T, Fritsche A, Synofzik M, Häring HU, Maetzler W, Hennige AM (2014) Evidence for altered transport of insulin across the blood-brain barrier in insulin-resistant humans. Acta Diabetol 51: 679–681. https://doi.org/10.1007/s00592-013-0546-y
Sartorius T, Peter A, Heni M, Maetzler W, Fritsche A, Häring HU, Hennige AM (2015) The brain response to peripheral insulin declines with age: a contribution of the blood-brain barrier? PLoS One 10: e0126804. https://doi.org/10.1371/journal.pone.0126804
Derkach K, Zakharova I, Zorina I, Bakhtyukov A, Romanova I, Bayunova L, Shpakov A (2019) The evidence of metabolic-improving effect of metformin in Ay/a mice with genetically-induced melanocortin obesity and the contribution of hypothalamic mechanisms to this effect. PLoS One 14: e0213779. https://doi.org/10.1371/journal.pone.0213779
Jurcovicova J (2014) Glucose transport in brain - effect of inflammation. Endocr Regul 48: 35–48. https://doi.org/10.4149/endo_2014_01_35
Koepsell H (2020) Glucose transporters in brain in health and disease. Pflugers Arch 472: 1299–1343. https://doi.org/10.1007/s00424-020-02441-x
Hernandez-Garzón E, Fernandez AM, Perez-Alvarez A, Genis L, Bascuñana P, Fernandez de la Rosa R, Delgado M, Angel Pozo M, Moreno E, McCormick PJ, Santi A, Trueba-Saiz A, Garcia-Caceres C, Tschöp MH, Araque A, Martin ED, Torres Aleman I (2016) The insulin-like growth factor I receptor regulates glucose transport by astrocytes. Glia 64: 1962–1971. https://doi.org/10.1002/glia.23035
Fernandez AM, Hernandez-Garzón E, Perez-Domper P, Perez-Alvarez A, Mederos S, Matsui T, Santi A, Trueba-Saiz A, García-Guerra L, Pose-Utrilla J, Fielitz J, Olson EN, Fernandez de la Rosa R, Garcia Garcia L, Pozo MA, Iglesias T, Araque A, Soya H, Perea G, Martin ED, Torres Aleman I (2017) Insulin Regulates Astrocytic Glucose Handling Through Cooperation With IGF-I. Diabetes 66: 64–74. https://doi.org/10.2337/db16-0861
Fernandez AM, Hernandez E, Guerrero-Gomez D, Miranda-Vizuete A, Torres Aleman I (2018) A network of insulin peptides regulate glucose uptake by astrocytes: Potential new druggable targets for brain hypometabolism. Neuropharmacology 136 (Pt B): 216–222. https://doi.org/10.1016/j.neuropharm.2017.08.034
Blázquez E, Hurtado-Carneiro V, LeBaut-Ayuso Y, Velázquez E, García-García L, Gómez-Oliver F, Ruiz-Albusac JM, Ávila J, Pozo MÁ (2022) Significance of Brain Glucose Hypometabolism, Altered Insulin Signal Transduction, and Insulin Resistance in Several Neurological Diseases. Front Endocrinol (Lausanne) 13: 873301. https://doi.org/10.3389/fendo.2022.873301
Sukhov IB, Shipilov VN, Chistyakova OV, Trost AM, Shpakov AO (2013) Long-term intranasal insulin administration improves spatial memory in male rats with prolonged type 1 diabetes mellitus and in healthy rats. Dokl Biol Sci 453: 349–352. https://doi.org/10.1134/S001249661306015X
Rajasekar N, Nath C, Hanif K, Shukla R (2017) Intranasal Insulin Administration Ameliorates Streptozotocin (ICV)-Induced Insulin Receptor Dysfunction, Neuroinflammation, Amyloidogenesis, and Memory Impairment in Rats. Mol Neurobiol 54: 6507–6522. https://doi.org/10.1007/s12035-016-0169-8
Craft S, Raman R, Chow TW, Rafii MS, Sun CK, Rissman RA, Donohue MC, Brewer JB, Jenkins C, Harless K, Gessert D, Aisen PS (2020) Safety, Efficacy, and Feasibility of Intranasal Insulin for the Treatment of Mild Cognitive Impairment and Alzheimer Disease Dementia: A Randomized Clinical Trial. JAMA Neurol 77: 1099–1109. https://doi.org/10.1001/jamaneurol.2020.1840
Yang L, Zhang X, Li S, Wang H, Zhang X, Liu L, Xie A (2020) Intranasal insulin ameliorates cognitive impairment in a rat model of Parkinson’s disease through Akt/GSK3β signaling pathway. Life Sci 259: 118159. https://doi.org/10.1016/j.lfs.2020.118159
Mastrototaro L, Roden M (2021) Insulin resistance and insulin sensitizing agents. Metabolism 125: 154892. https://doi.org/10.1016/j.metabol.2021.154892
Avrova NF, Victorov IV, Tyurin VA, Zakharova IO, Sokolova TV, Andreeva NA, Stelmaschuk EV, Tyurina YY, Gonchar VS (1998) Inhibition of glutamate-induced intensification of free radical reactions by gangliosides: possible role in their protective effect in rat cerebellar granule cells and brain synaptosomes. Neurochem Res 23: 945–952. https://doi.org/10.1023/a:1021076220411
Zakharova IO, Sokolova TV, Vlasova YA, Furaev VV, Rychkova MP, Avrova NF (2014) GM1 ganglioside activates ERK1/2 and Akt downstream of Trk tyrosine kinase and protects PC12 cells against hydrogen peroxide toxicity. Neurochem Res 39: 2262–2275. https://doi.org/10.1007/s11064-014-1428-6
Nikolaeva S, Bayunova L, Sokolova T, Vlasova Y, Bachteeva V, Avrova N, Parnova R (2015) GM1 and GD1a gangliosides modulate toxic and inflammatory effects of E. coli lipopolysaccharide by preventing TLR4 translocation into lipid rafts. Biochim Biophys Acta 1851: 239–247. https://doi.org/10.1016/j.bbalip.2014.12.004
Sipione S, Monyror J, Galleguillos D, Steinberg N, Kadam V (2020) Gangliosides in the Brain: Physiology, Pathophysiology and Therapeutic Applications. Front Neurosci 14: 572965. https://doi.org/10.3389/fnins.2020.572965
Galleguillos D, Wang Q, Steinberg N, Zaidi A, Shrivastava G, Dhami K, Daskhan GC, Schmidt EN, Dworsky-Fried Z, Giuliani F, Churchward M, Power C, Todd K, Taylor A, Macauley MS, Sipione S (2022) Anti-inflammatory role of GM1 and other gangliosides on microglia. J Neuroinflammat 19: 9. https://doi.org/10.1186/s12974-021-02374-x
Zakharova IO, Avrova NF (2001) The effect of cold stress on ganglioside fatty acid composition and ganglioside-bound sialic acid content of rat brain subcellular fractions. J Therm Biol 26: 215–222. https://doi.org/10.1016/s0306-4565(00)00045-0
Vanier MT, Holm M, Ohman R, Svennerholm L (1971) Developmental profiles of gangliosides in human and rat brain. J Neurochem 18: 581–592. https://doi.org/10.1111/j.1471-4159.1971.tb11988.x
Derkach KV, Bondareva VM, Chistyakova OV, Berstein LM, Shpakov AO (2015) The Effect of Long-Term Intranasal Serotonin Treatment on Metabolic Parameters and Hormonal Signaling in Rats with High-Fat Diet/Low-Dose Streptozotocin-Induced Type 2 Diabetes. Int J Endocrinol 2015: 245459. https://doi.org/10.1155/2015/245459
Könner AC, Janoschek R, Plum L, Jordan SD, Rother E, Ma X, Xu C, Enriori P, Hampel B, Barsh GS, Kahn CR, Cowley MA, Ashcroft FM, Brüning JC (2007) Insulin action in AgRP-expressing neurons is required for suppression of hepatic glucose production. Cell Metab 5: 438–449. https://doi.org/10.1016/j.cmet.2007.05.004
Loh K, Zhang L, Brandon A, Wang Q, Begg D, Qi Y, Fu M, Kulkarni R, Teo J, Baldock P, Brüning JC, Cooney G, Neely GG, Herzog H (2017) Insulin controls food intake and energy balance via NPY neurons. Mol Metab 6: 574–584. https://doi.org/10.1016/j.molmet.2017.03.013
Shin AC, Filatova N, Lindtner C, Chi T, Degann S, Oberlin D, Buettner C (2017) Insulin Receptor Signaling in POMC, but Not AgRP, Neurons Controls Adipose Tissue Insulin Action. Diabetes 66: 1560–1571. https://doi.org/10.2337/db16-1238
Hill JM, Lesniak MA, Pert CB, Roth J (1986) Autoradiographic localization of insulin receptors in rat brain: prominence in olfactory and limbic areas. Neuroscience 17: 1127–1138. https://doi.org/10.1016/0306-4522(86)90082-5
Doré S, Kar S, Rowe W, Quirion R (1997) Distribution and levels of [125I]IGF-I, [125I]IGF-II and [125I]insulin receptor binding sites in the hippocampus of aged memory-unimpaired and -impaired rats. Neuroscience 80: 1033–1040. https://doi.org/10.1016/s0306-4522(97)00154-1
Izumi Y, Yamada KA, Matsukawa M, Zorumski CF (2003) Effects of insulin on long-term potentiation in hippocampal slices from diabetic rats. Diabetologia 46: 1007–1012. https://doi.org/10.1007/s00125-003-1144-2
van der Heide LP, Kamal A, Artola A, Gispen WH, Ramakers GM (2005) Insulin modulates hippocampal activity-dependent synaptic plasticity in a N-methyl-d-aspartate receptor and phosphatidyl-inositol-3-kinase-dependent manner. J Neurochem 94: 1158–1166. https://doi.org/10.1111/j.1471-4159.2005.03269.x
Park CR, Seeley RJ, Craft S, Woods SC (2000) Intracerebroventricular insulin enhances memory in a passive-avoidance task. Physiol Behav 68: 509–514. https://doi.org/10.1016/s0031-9384(99)00220-6
Babri S, Badie HG, Khamenei S, Seyedlar MO (2007) Intrahippocampal insulin improves memory in a passive-avoidance task in male wistar rats. Brain Cogn 64: 86–91. https://doi.org/10.1016/j.bandc.2007.01.002
McNay EC, Ong CT, McCrimmon RJ, Cresswell J, Bogan JS, Sherwin RS (2010) Hippocampal memory processes are modulated by insulin and high-fat-induced insulin resistance. Neurobiol Learn Mem 93: 546–553. https://doi.org/10.1016/j.nlm.2010.02.002
Erichsen JM, Calva CB, Reagan LP, Fadel JR (2021) Intranasal insulin and orexins to treat age-related cognitive decline. Physiol Behav 234: 113370. https://doi.org/10.1016/j.physbeh.2021.113370
Soto M, Cai W, Konishi M, Kahn CR (2019) Insulin signaling in the hippocampus and amygdala regulates metabolism and neurobehavior. Proc Natl Acad Sci U S A 116: 6379–6384. https://doi.org/10.1073/pnas.1817391116
Inamori KI, Inokuchi JI (2020) Roles of Gangliosides in Hypothalamic Control of Energy Balance: New Insights. Int J Mol Sci 21: 5349. https://doi.org/10.3390/ijms21155349
Cole AA, Dosemeci A, Reese TS (2010) Co-segregation of AMPA receptors with G(M1) ganglioside in synaptosomal membrane subfractions. Biochem J 427: 535–540. https://doi.org/10.1042/BJ20091344
Prendergast J, Umanah GK, Yoo SW, Lagerlöf O, Motari MG, Cole RN, Huganir RL, Dawson TM, Dawson VL, Schnaar RL (2014) Ganglioside regulation of AMPA receptor trafficking. J Neurosci 34:13246–13258. https://doi.org/10.1523/JNEUROSCI.1149-14.2014
Sukhov IB, Lebedeva MF, Zakharova IO, Derkach KV, Bayunova LV, Zorina II, Avrova NF, Shpakov AO (2020) Intranasal Administration of Insulin and Gangliosides Improves Spatial Memory in Rats with Neonatal Type 2 Diabetes Mellitus. Bull Exp Biol Med 168: 317–320. https://doi.org/10.1007/s10517-020-04699-8
Itokazu Y, Fuchigami T, Morgan JC, Yu RK (2021) Intranasal infusion of GD3 and GM1 gangliosides downregulates alpha-synuclein and controls tyrosine hydroxylase gene in a PD model mouse. Mol Ther 29: 3059–3071. https://doi.org/10.1016/j.ymthe.2021.06.005
Leal G, Comprido D, Duarte CB (2014) BDNF-induced local protein synthesis and synaptic plasticity. Neuropharmacology 76 Pt C: 639–656. https://doi.org/10.1016/j.neuropharm.2013.04.005
Gold PE (2005) Glucose and age-related changes in memory. Neurobiol Aging 26 Suppl 1: S60–S64. https://doi.org/10.1016/j.neurobiolaging.2005.09.002
McNay EC, Canal CE, Sherwin RS, Gold PE (2006) Modulation of memory with septal injections of morphine and glucose: effects on extracellular glucose levels in the hippocampus. Physiol Behav 87: 298–303. https://doi.org/10.1016/j.physbeh.2005.10.016
Li L, Lundkvist A, Andersson D, Wilhelmsson U, Nagai N, Pardo AC, Nodin C, Ståhlberg A, Aprico K, Larsson K, Yabe T, Moons L, Fotheringham A, Davies I, Carmeliet P, Schwartz JP, Pekna M, Kubista M, Blomstrand F, Maragakis N, Nilsson M, Pekny M (2008) Protective role of reactive astrocytes in brain ischemia. J Cereb Blood Flow Metab 28: 468–481. https://doi.org/10.1038/sj.jcbfm.9600546
de Pablo Y, Nilsson M, Pekna M, Pekny M (2013) Intermediate filaments are important for astrocyte response to oxidative stress induced by oxygen-glucose deprivation and reperfusion. Histochem Cell Biol 140: 81–91. https://doi.org/10.1007/s00418-013-1110-0
Wilhelmsson U, Pozo-Rodrigalvarez A, Kalm M, de Pablo Y, Widestrand Å, Pekna M, Pekny M (2019) The role of GFAP and vimentin in learning and memory. Biol Chem 400: 1147–1156. https://doi.org/10.1515/hsz-2019-0199
Ashrafi G, Wu Z, Farrell RJ, Ryan TA (2017) GLUT4 Mobilization Supports Energetic Demands of Active Synapses. Neuron 93: 606–615.e3. https://doi.org/10.1016/j.neuron.2016.12.020
McNay EC, Pearson-Leary J (2020) GluT4: A central player in hippocampal memory and brain insulin resistance. Exp Neurol 323: 113076. https://doi.org/10.1016/j.expneurol.2019.113076
Tadi M, Allaman I, Lengacher S, Grenningloh G, Magistretti PJ (2015) Learning-Induced Gene Expression in the Hippocampus Reveals a Role of Neuron -Astrocyte Metabolic Coupling in Long Term Memory. PLoS One 10: e0141568. https://doi.org/10.1371/journal.pone.0141568
Peineau S, Taghibiglou C, Bradley C, Wong TP, Liu L, Lu J, Lo E, Wu D, Saule E, Bouschet T, Matthews P, Isaac JT, Bortolotto ZA, Wang YT, Collingridge GL (2007) LTP inhibits LTD in the hippocampus via regulation of GSK3beta. Neuron 53: 703–717. https://doi.org/10.1016/j.neuron.2007.01.029
Racaniello M, Cardinale A, Mollinari C, D’Antuono M, De Chiara G, Tancredi V, Merlo D (2010) Phosphorylation changes of CaMKII, ERK1/2, PKB/Akt kinases and CREB activation during early long-term potentiation at Schaffer collateral-CA1 mouse hippocampal synapses. Neurochem Res 35: 239–246. https://doi.org/10.1007/s11064-009-0047-0
Martínez-Mármol R, Chai Y, Conroy JN, Khan Z, Hong SM, Kim SB, Gormal RS, Lee DH, Lee JK, Coulson EJ, Lee MK, Kim SY, Meunier FA (2023) Hericerin derivatives activates a pan-neurotrophic pathway in central hippocampal neurons converging to ERK1/2 signaling enhancing spatial memory. J Neurochem 165: 791–808. https://doi.org/10.1111/jnc.15767
Hernandez F, Lucas JJ, Avila J (2013) GSK3 and tau: two convergence points in Alzheimer’s disease. J Alzheimers Dis 33 Suppl 1: S141–S44. https://doi.org/10.3233/JAD-2012-129025
Claxton A, Baker LD, Hanson A, Trittschuh EH, Cholerton B, Morgan A, Callaghan M, Arbuckle M, Behl C, Craft S (2015) Long-acting intranasal insulin detemir improves cognition for adults with mild cognitive impairment or early-stage Alzheimer’s disease dementia. J Alzheimers Dis 44: 897–906. https://doi.org/10.3233/JAD-141791
Craft S, Claxton A, Baker LD, Hanson AJ, Cholerton B, Trittschuh EH, Dahl D, Caulder E, Neth B, Montine TJ, Jung Y, Maldjian J, Whitlow C, Friedman S (2017) Effects of Regular and Long-Acting Insulin on Cognition and Alzheimer’s Disease Biomarkers: A Pilot Clinical Trial. J Alzheimers Dis 57: 1325–1334. https://doi.org/10.3233/JAD-161256
Avgerinos KI, Kalaitzidis G, Malli A, Kalaitzoglou D, Myserlis PG, Lioutas VA (2018) Intranasal insulin in Alzheimer’s dementia or mild cognitive impairment: a systematic review. J Neurol 65: 1497–1510. https://doi.org/10.1007/s00415-018-8768-0
Derkach KV, Bogush IV, Berstein LM, Shpakov AO (2015) The Influence of Intranasal Insulin on Hypothalamic-Pituitary-Thyroid Axis in Normal and Diabetic Rats. Horm Metab Res 47: 916–924. https://doi.org/10.1055/s-0035-1547236
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


