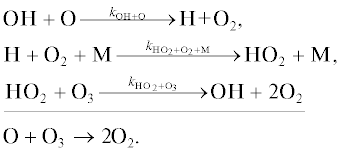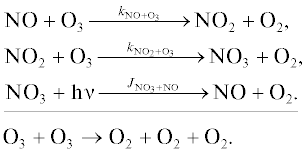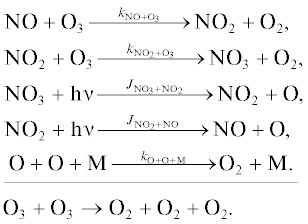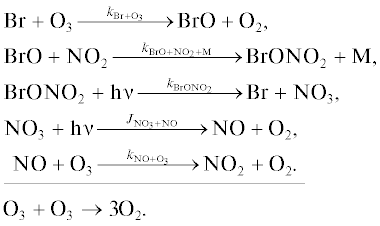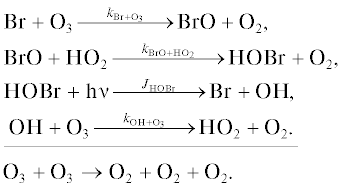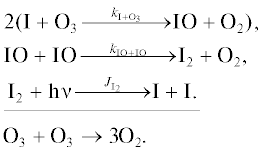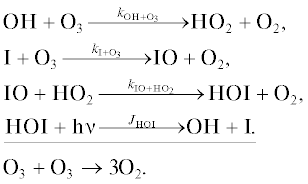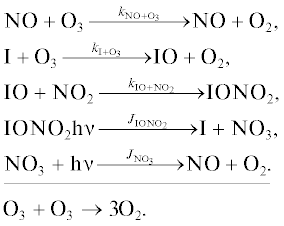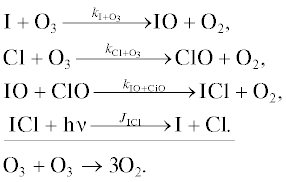Известия РАН. Физика атмосферы и океана, 2020, T. 56, № 2, стр. 195-202
О разрушении атмосферного озона в Ox, HOx, NOx, ClOx, BrOx и IOx каталитических циклах
И. К. Ларин *
Институт энергетических проблем химической физики им. В.Л. Тальрозе Федерального государственного бюджетного учреждения науки Федерального исследовательского центра химической физики
им. Н.Н. Семенова РАН
119334 Москва, Ленинский пр., 38, корп. 2, Россия
* E-mail: iklarin@narod.ru
Поступила в редакцию 04.07.2019
После доработки 05.09.2019
Принята к публикации 25.09.2019
Аннотация
Представлены данные об относительном вкладе каталитических циклов Ox, HOx, NOx, ClOx, BrOx и IOx в разрушение атмосферного озона для условий июня и январе 2000-го года на широте 50° с.ш. в диапазоне высот 0–50 км. Расчеты высотных профилей компонент указанных выше семейств производились с помощью интерактивной двумерной модели SOCRATES, а также с помощью одномерной фотохимической модели, разработанной в Институте энергетических проблем химической физики РАН им. В.Л. Тальрозе. В качестве начальных данных для расчетов использовались прогнозы атмосферного содержания парниковых газов Межправительственной группы экспертов по изменению климата RCP 4.5 для 2000-го года. Расчеты скорости гибели озона проводились с помощью предложенного ранее автором алгоритма для определения скорости лимитирующей стадии каталитического цикла.
ВВЕДЕНИЕ
Ранее в работах автора неоднократно рассматривался вопрос о разрушении стратосферного озона в каталитических циклах Ox, HOx, NOx, ClOx и BrOx (см. [1–4]). При этом вопрос о влиянии йодных частиц на озоновый слой оставался в стороне. В настоящей работе наряду с влиянием галоидных семейств ClOx и BrOx рассматривается также вопрос о влиянии на атмосферный озон компонент семейства IOx, что позволяет более полно выявить общую картину воздействия галоидных частиц на озоновый слой. Представляет также интерес сравнение эффективности в отношении атмосферного озона галоидных и всех других известных каталитических циклов, что является одной из задач настоящей работы. При этом следует иметь в виду, что йодный цикл, в отличие от антропогенных хлорного и бромного каталитических циклов, имеет естественное происхождение, таким образом, его влияние на озоновый слой можно отнести к воздействию на озон одного из естественных факторов. Заметим здесь в скобках, что таким же естественным фактором является и воздействие на озон кислородного цикла (образующегося из атмосферного кислорода), хотя последний разрушает озон не цепным путем (т. е., строго говоря, он не является каталитическим циклом). Таким же естественным фактором является воздействие на озон и водородного цикла, компоненты которого образуются из атмосферной воды.
Работа состоит из двух частей: в первой части рассматривается воздействие на озоновый слой Ox, HOx, NOx, ClOx и BrOx циклов, а во второй части – воздействие цикла IOx.
1. РАЗРУШЕНИЕ СТРАТОСФЕРНОГО ОЗОНА В Ox, HOx, NOx, ClOx И BrOx КАТАЛИТИЧЕСКИХ ЦИКЛАХ
Расчету скорости гибели озона в указанных выше циклах предшествовал расчет высотных профилей компонент, участвующих в соответствующих цепных процессах. Эти расчеты производились с помощью интерактивной двумерной фотохимической модели SOCRATES [5], позволяющей получать данные с разрешением 1 км в диапазоне от 0 до 120 км в диапазоне широт от 85° ю.ш. до 85° с.ш. с разрешением 5°. В качестве начальных условий для расчетов с помощью модели SOCRATES использовался сценарий концентраций парниковых газов Межправительственной группы экспертов по изменению климата (IPCC) RCP 4.5 [6] для условий июня и января 2000-го года.
Расчеты скорости гибели стратосферного озона, Wx(–O3), в каталитических циклах Ox, HOx, NOx, ClOx и BrOx производились по формуле (1) [7]:
(1)
${{W}_{x}}( - {{{\text{O}}}_{3}}) = 2{{\sum\limits_{i = 2}^{i = n} {\left( {\frac{1}{{{{W}_{i}}(X)}}} \right)} }^{{ - 1}}},$Далее, не вдаваясь в детали, мы приведем список всех реакций продолжения цепи в указанных выше циклах (кроме IOx цикла), по скоростям которых с помощью формулы (1) рассчитывалась скорость гибели озона в данном цикле. Скорость конкретной реакции определялась как произведение константы скорости на произведение концентраций компонент, участвующих в реакции.
Кислородный цикл Ox [11].
Цикл 1
Цикл 2
Цикл 3
Цикл 4
Цикл 5
Азотноокисный цикл NOx [12–15].
Цикл 1
Цикл 2
Цикл 3
Хлорный цикл ClOx [16, 17].
Цикл 1
Цикл 2
Бромный цикл BrOx.
Цикл 1 [18]
Цикл 2
Цикл 3 [19]
Цикл 4
Цикл 5
Цикл 6
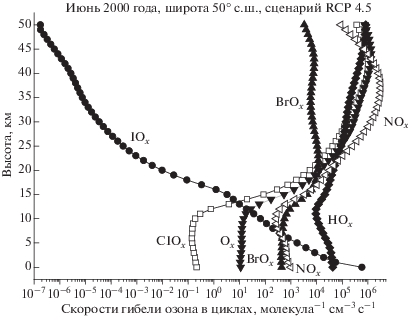
Результаты расчетов относительного (в %) вклада Ox, HOx, NOx, ClOx и BrOx циклов в разрушение озона в тропосфере и стратосфере для условий июня и января 2000 г., показаны на рис. 1а и 1б, а также в табл. 1. Там же приводятся данные об относительном вкладе цикла IOx, которые обсуждаются во второй части работы. Кроме того, на рис. 2 для условий июня 2000-го года показаны высотные профили абсолютных скоростей разрушения озона во всех циклах на широте 50° с.ш. Эти данные мы обсудим во второй части работы. Сейчас же замети только, что влияние йодного цикла на озон ограничивается тропосферой, с нулевым вкладом в гибель озона в стратосфере.
Рис. 1.
(а) Относительный (в %) вклад Ox, HOx, NOx, ClOx, BrOx и IOx циклов в разрушение озона в июне 2000 г., сценарий RCP 4.5. (б) Относительный (в %) вклад Ox, HOx, NOx, ClOx, BrOx и IOx циклов в разрушение озона в январе 2000 г., сценарий RCP 4.5.
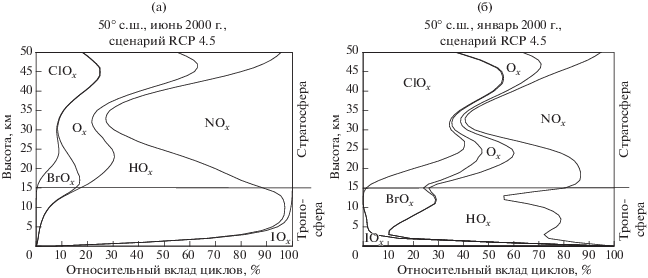
Таблица 1.
Относительный вклад циклов в разрушение озона в тропосфере и стратосфере в июне и январе 2000 г. на широте 50° с.ш. в %
| IOx | ClOx | BrOx | Ox | HOx | NOx | |
|---|---|---|---|---|---|---|
| Троп. июнь, 2000 | 14.78 | 0.0095 | 3.99 | 0.149 | 78.67 | 2.39 |
| Страт. июнь, 2000 | 0 | 12.26 | 3.238 | 19.60 | 22.35 | 42.53 |
| Троп. январь, 2000 | 11.07 | 0.105 | 16.34 | 0.341 | 46.49 | 25.65 |
| Страт. январь, 2000 | 0 | 36.91 | 6.28 | 9.20 | 16.06 | 31.54 |
2. РАЗРУШЕНИЕ ОЗОНА В IOx ЦИКЛЕ
Расчеты влияния на атмосферный озон йодного цикла IOx проводились с помощью интерактивной одномерной фотохимической модели [20]. Общее число рассчитываемых в модели компонент атмосферы может достигать нескольких десятков (причем оно может увеличиваться, с заданием необходимых параметров для новых компонент). Для части этих компонент задаются постоянные профили концентрации, концентрации остальных компонент рассчитываются. Модель позволяет также рассчитывать поля солнечной радиации и вычислять коэффициенты фотодиссоциации газовых составляющих атмосферы для условий расчетов. Задаваемыми параметрами являются также высотные профили температуры и коэффициента турбулентной диффузии (которые были заимствованы из данных, рассчитываемых в двумерной модели SOCRATES, где предусмотрен перенос тепловой радиации). Привязка к широте места и сезону осуществляется через задание зенитного угла Солнца, который определяется с помощью параметризации, предложенной в [21].
Основные атмосферные процессы с участием компонент йодного семейства показаны на рис. 3, где пунктирными линиями показаны источники, сплошными – стоки, а взаимные переходы – точечными. Принимается, что семейство IOx включает атомарный йод, I, и окись йода, IO.
Рис. 3.
Основные процессы с участием йодных частиц: источники показаны пунктирными линиями, стоки – сплошными, взаимные переходы – точечными. Принимаем, что группа Ix включает I и IO.
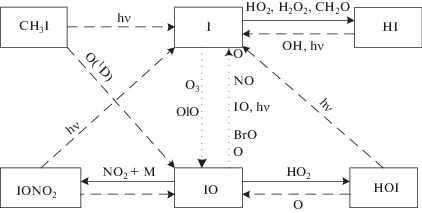
Первые шесть циклов разрушения озона йодными частицами были предложены в [22], где учитывались взаимные превращения йодных частиц и их взаимодействие с азотноокисным (NOx) и водородным (HOx) циклами. В [23] к этим циклам были добавлены еще два цикла, учитывающих взаимодействие IOx цикла с ClOx и BrOx циклами. В наших расчетах мы использовали более полную схему циклов, предложенную в [23]. Она выглядит следующим образом.
Превращения внутри IOx цикла
Цикл 1
Цикл 2
Цикл 3
Взаимодействие IOx цикла с HOx циклом
Цикл 4
Взаимодействие IOx цикла с NOx циклом
Цикл 5
Взаимодействие IOx цикла с ClOx/BrOx циклами
Цикл 6
Цикл 7
Цикл 8
Константы скоростей химических реакций, участвующих в приведенных выше циклах, были взяты из [24], коэффициенты фотодиссоциации рассчитывались в самой модели. Принималось также, что основным источником йодных частиц в атмосфере является CH3I океанического происхождения, мощность которого, согласно [24], составляет 3.04 × 1011 г год–1. Относительное содержание CH3I в тропосфере среди других источников йодных частиц согласно [24] составляет 96%. Относительное содержание других источников йодных частиц в тропосфере, таких, как CH2ICl, CH2I2 и CH2IBr, составляет соответственно 2.7, 0.8 и 0.1%. Поэтому в расчетах скорости гибели озона учитывался только один источник йодных частиц в атмосфере, а именно, CH3I с учетом указанной выше мощности источника. Расчеты для ситуации в будущем не проводились, поскольку в литературе отсутствуют надежные данные о, мощности будущего источника йодных частиц в атмосфере, хотя и имеются указания на то, что ситуация в будущем в отношении атмосферного йода будет меняться [25].
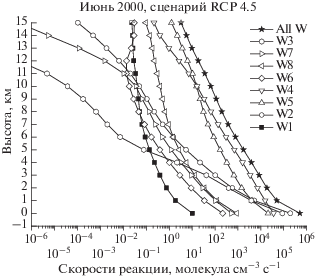
Расчеты скорости гибели озона в йодных циклах проводились с помощью формулы (1), приведенной выше. Результаты расчетов в виде высотных профилей абсолютных скоростей гибели озона для условий июня 2000 г. на широте 50° с.ш. в диапазоне высот 0–15 км показаны на рис. 4.
3. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Как это следует из данных, представленных на рис. 4, основной вклад в разрушение озона йодными компонентами практически во всей тропосфере вносят йодные циклы 4 и 5, т.е. циклы, в которых происходит взаимодействие с компонентами HOx и NOx семейств соответственно. При этом до 10 км лидирует цикл 4, а выше – цикл 5. Лимитирующей стадией в йодном цикле 4 в диапазоне высот 1–10 км является реакция IO + + ${\text{H}}{{{\text{O}}}_{2}}\xrightarrow{{{{k}_{{{\text{IO}} + {\text{H}}{{{\text{O}}}_{2}}}}}}}{\text{HOI}} + {{{\text{O}}}_{2}},$ а выше – реакция HOI + hν $\xrightarrow{{{{J}_{{{\text{HOI}}}}}}}$ OH + I. Эти две реакции и определяют скорость разрушения озона в йодном цикле 4, причем константы обеих реакций не зависят от температуры. В цикле 5 лимитирующую стадию определяют две реакции, имеющие близкие скорости во всей тропосфере – IO + + NO2$\xrightarrow{{{{k}_{{{\text{IO}} + {\text{N}}{{{\text{O}}}_{2}}}}}}}$ IONO2 и IONO2 hν $\xrightarrow{{{{J}_{{{\text{ION}}{{{\text{O}}}_{2}}}}}}}$ I + + NO3. Константа скорости первой реакции имеет отрицательный показатель при температуре, т.е. она будет расти при понижении температуры, чем, возможно, и объясняется то, что в верхней тропосфере, гле температура падает, скорость этой реакции становится больше скорости реакции IO + HO2 $\xrightarrow{{{{k}_{{{\text{IO}} + {\text{H}}{{{\text{O}}}_{2}}}}}}}$ HOI + O2.
В целом же, влияние йодного цикла на озон невелико, и, как это следует из табл. 1, оно ограничивается тропосферой, в которой вклад йодного цикла в суммарную скорость гибели озона в июне 2000 г. составлял 14.78%, а в январе 2000 г. – 11.07%. Остальной вклад в июне в тропосфере приходился на долю ClOx цикла (0.0095%), BrOx цикла (3.99%), Ox цикла (0.149%), HOx цикла (78.67%) и NOx цикла (2.39%). В январе он составлял 0.106% (ClOx), 16.34% (BrOx), 0.341% (Ox), 46.49% (HOx) и 25.65 (NOx). В стратосфере в июне (см. табл. 1) наибольший вклад в гибель озона приходится на долю NOx цикла. Далее идут HOx, Ox, BrOx и ClOx циклы. В январе первое место в разрушении озона в стратосфере занимает ClOx цикл (36.919%), второе место занимает NOx цикл (31.542%), далее идут HOx, Ox и BrOx циклы.
В литературе вопрос о влиянии йодных частиц на атмосферный озон рассматривался неоднократно (см. [22, 26, 27]). При качественной близости литературных и наших данных их количественное сравнение представляет значительные трудности, что объясняется рядом факторов, таких, как различные схемы расчета воздействия йодных частиц на атмосферный озон, различие в начальных данных и др. В качестве примера рассмотрим, каким образом рассчитывалось действие на озон йодных и других семейств в работе [24].
Методика расчета в [24] представлена в табл. 5 , которая озаглавлена, как реакции потери нечетного кислорода в циклах семейств. В табл. 5 сообщается, в частности, что реакция O(1D) + H2O → OH + OH приводит к гибели одной частицы нечетного кислорода, что противоречит теории Чепмена [11], согласно которой нечетный кислород погибает только в случае одновременной гибели двух частиц Ox (как об этом уже говорилось выше). Далее в табл. 5 приводятся две реакции семейства HOx с участием HO2, O3 и O – HO2 + O → OH + O2 и HO2 + O3 → OH + 2O2, которые не только не образуют цепного процесса, но и вообще не разрушают озон, поскольку в результате образуется радикал OH, содержащий атом O, который может покинуть OH, например, в результате фотодиссоциации. Заметим также, что приведенные реакции входят в циклы 1, 2 и 3 водородного цикла (см. выше). Реакции NOx семейства – NO2 + O → → NO + O2 и NO3 + hν → NO + O2 также не создают цепи и не разрушают озон, из-за присутствия атома O в NO. Приведенные реакции входят в циклы 1 и 3 NOx цикла (см. выше). Что касается BrOx и ClOx циклов в [24], то не вызывает вопросов только реакции ClO + O → Cl + O2 и BrO + O → Br + O2, в которых действительно погибают две частицы нечетного кислорода (два атома O). Правде, при этом игнорируются цепной хлорный и бромный процессы гибели озона, которые является основными механизмами гибели озона с участием галоидных частиц. Реакция же Cl2O2 + hν → 2Cl + O2 не приводит к гибели Ox потому, что частицы нечетного кислорода в этой реакции не участвуют. Реакции с образованием HOCl и HOBr также не разрушают озон из-за присутствия атома O в HOCl и HOBr. Это принципиальное соображение: если в продуктах присутствует компонента, содержащая атом O, то это означает, что нечетный кислород сохраняется. Почему-то это простое соображение осознается с большим трудом. Приведенные реакции йодного семейства вызывают вопросы, которые приводились выше по поводу других семейств. Главное замечание заключается в том, что эти реакции не имеют отношения к цепному разрушению озона. Можно также указать на то, что о реакции OIO + hν → I + O2 автору не удалось найти никаких сведений. Зато хорошо описана реакция OIO + hν → O + IO, образующая озон и идущая с заведомо большей скоростью, чем приведенная выше [28]. Из сказанного следует, что сравнение количественных данных, представленных в настоящей работе и в [24] по понятным причинам не имеет особого смысла, в то же время сравнение относительных данных показывает, что (правда, по менее понятным причинам) они различаются гораздо меньше.
ВЫВОДЫ
1. Представлены данные о разрушении атмосферного озона в Ox, HOx, NOx, ClOx, BrOx и IOx каталитических циклах для условий января и июня 2000 г. на широте 50° с.ш.
2. Показано, что воздействие йодного цикла на озон ограничивается тропосферой, в которой его относительный вклад в гибель озона на широте 50° с.ш. составляет 14.78% летом и 11.07% зимой.
Список литературы
Ларин И.К. Химическая физика озонового слоя. М.: ГЕОС. 2013. С. 159.
Larin I.K. Unresolved Problems in the Chemistry of the Middle Atmosphere // Russian Journal of Physical Chemistry B. 2018. V. 12. № 4. P. 791–796.
Ларин И.К., Кусков М.Л. Механизм разрушения стратосферного озона 2. О длине цепи и скорости разрушения озона в основных стратосферных циклах // Хим. физика. 2013. Т. 32. № 10. С. 72–80.
Ларин И.К. О вкладе Ox, HOx, NOx, CLOx и BrOx‑циклов в разрушение стратосферного озона в XXI в. // Хим. физика. 2017. Т. 36. № 1. С. 90–96.
http://acd.ucar.edu/models/SOCRATES/
http://tntcat.iiasa.ac.at:8787/RcpDb/dsd?Action=htmlpage&page=welcome
Ларин И.К. Химическая физика озонового слоя. М.: Российская академия наук. 2018. С. 208.
Пурмаль А.П. А, Б, В… Химической кинетики. M.: ИКЦ “Академкнига”. 2004. С. 277.
Jacob Daniel J. Introduction to Atmospheric Chemistry. Princeton: University Press. 1999. P. 259.
Brasseur G., Solomon S. Aeronomy of the Middle Atmosphere: Chemistry and Physics of the Stratosphere and Mesosphere. Third revised and enlarged edition. Montreal, Canada. Springer. 2005. P. 644.
Chapman S. On Ozone and Atomic Oxygen in the Upper Atmosphere // Phil. Mag. 1930. V. 10. P. 369–383.
Cruzen P.J. Ozone production rates in an oxygen-hydrogen-nitrogen oxide atmosphere // J. Geophys. Res. 1971. V. 76. P. 7311–7327.
Конашенок В.Н. О фотохимической теории озона // Изв. АН СССР. Физ. атм. и океана. 1968. Т. 4. № 7. С. 797–799..
Гущин Г.П. Дис. … докт. физ.-мат. наук. Л.: Главная геофизическая обсерватория, 1968.
Johnston H.S. Reduction of stratospheric ozone by nitrogen oxide catalysts from supersonic transport exhaust // Science. 1971. V. 173. P. 517–522.
Stolarski R.S., Cicerone R.J. Stratospheric Chlorine: a Possible Sink for Ozone // Can. J. Chem. 1974. V. 52. P. 1610–1615.
Wofsy S.C., McElroy M.B. HO, NO, and ClO: Their Role in Atmospheric Photochemistry // Can. J. Chem. 1974. V. 52. P. 1582–1591.
Wofsy S.C., McElroy M.B., Yung Y.L. The chemistry of atmospheric bromine// Geophys. Res. Lett. 1975. V. 2. P. 215–218.
Yung, Y.L., Pinto J.P., Watson R.T., Sander S.P. Atmospheric bromine and ozone perturbations in the lower stratosphere // J. Atm. Sci. 1980. V. 37. P. 339–353.
Ларин И.К., Угаров А.А. О росте общего содержания атмосферного озона в 2000–2100 гг. // Хим. физика. 1999. Т. 18. № 6. С. 21–25.
Gerstl S.A.W., Zardecki A., Wiser H.L. Biologically damaging radiation amplified by ozone depletions // Nature. 1981. V. 294. № 5839. P. 352–354.
Chameides W.L., Davis D.D. Iodine: Its possible role in tropospheric photochemistry // J. Geophys. Res. 1980. V. 85. № C12. P. 7383–7398.
Li Y., Patten K. O., Youn D., Wuebbles D.J. Potential impacts of CF3I on ozone as a replacement for CF3Br in aircraft applications // Atmospheric Chemistry and Physics, European Geosciences Union, 2006. V. 6. № 12. P. 4559–4568.
Saiz-Lopez1 A., Fernandez1 R.P., Ordóñez C., Kinnison D.E., Gómez Martín1 J.C., Lamarque J.-F., Tilmes S. Iodine chemistry in the troposphere and its effect on ozone // Atmos. Chem. Phys. 2014. V. 14. P. 13119–13143.
Carlos A. Cuevas, Niccolò Maffezzoli, Juan Pablo Corella1, Andrea Spolaor, Paul Vallelonga, Helle A. Kjær, Marius Simonsen, Mai Winstrup, Bo Vinther, Christopher Horvat, Rafael Douglas Kinnison, Jean-François Lamarque, Carlo Barbante & Alfonso Saiz-Lopez Rapid increase in atmospheric iodine levels in the North Atlantic since the mid-20th century // Nature Comm. 2018. V. 9. P. 1452–1458.
Solomon S., Garcia R.R., Ravishankara A.R. On the role of iodine in ozone depletion // J. Geophys. Res. 1994. V. 99. P. 20491–20499.
Carpenter L.J. Iodine in the Marine Boundary Layer // Chem. Rev. 2003. V. 103. № 12. P. 4953–4962.
https://jpldataeval.jpl.nasa.gov/
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Физика атмосферы и океана