Известия РАН. Физика атмосферы и океана, 2021, T. 57, № 4, стр. 444-451
О моделировании состава органического аэрозоля в атмосфере
А. Н. Ермаков a, *, А. Е. Алоян b, **, В. О. Арутюнян b
a Институт энергетических проблем химической физики РАН им. В.Л. Тальрозе ФИЦ ХФ им. Н.Н. Семенова РАН
119334 Москва, Ленинский просп., 38, корп. 2, Россия
b Институт вычислительной математики им. Г.И. Марчука РАН
119333 Москва, ул. Губкина, 8, Россия
* E-mail: polclouds@yandex.ru
** E-mail: ezmakr2010@yandex.ru
Поступила в редакцию 18.01.2020
После доработки 04.02.2021
Принята к публикации 17.02.2021
Аннотация
В работе рассматривается модель формирования суррогатного органического аэрозоля (ОА) в атмосфере при конденсации компонентов разной летучести. Модель построена с учетом физико-химических свойств индивидуальных компонентов, определяющих их парциальные давления над частицами (Pi, атм) и гигроскопичность. В качестве органических соединений (ОС) – компонентов суррогатных частиц – рассматривались продукты фото- и химических превращений в атмосфере биогенных α-пинена и изопрена – органические пероксиды и нитраты: IALD, ISNP, INPN. По результатам вычислений (модель AIOMFAC) обнаружен сложный характер изменений коэффициентов активности (γi) компонентов при вариациях состава ОА. Найдено, что суррогатные частицы характеризуются заметной гигроскопичностью. Рассчитанный по этим данным применительно к фоновой атмосфере равновесный состав частиц c учетом их гигроскопичности и γi компонентов обнаруживает выраженные отклонения от найденного в приближении независимости физико-химических свойств ингредиентов частиц, что следует принимать во внимание при построении моделей формирования реального вторичного ОА в атмосфере.
ВВЕДЕНИЕ
Современное состояние климата Земли характеризуется начавшимся в индустриальную эпоху глобальным потеплением. При этом влияние на тепловой баланс атмосферы аэрозоля, бóльшая часть содержания которого обязана присутствием частиц органического аэрозоля (ОА), остается неопределенным [1, 2]. Причина – дефицит знаний о микрофизике образования, причинах изменчивости массовой концентрации и состава частиц ОА, разнообразия их морфологии, размеров и о многом другом.
Источниками ОА в атмосфере помимо первичных частиц выступают химические и фотохимические процессы с участием неметановых летучих органических соединений (ОС) [3]. Примером служат превращения эмитируемых в атмосферу биогенных изопрена и α-пинена, а также других ОС, в том числе абиогенного происхождения. В результате в воздухе возникает большое количество разнообразных вторичных ОС (ВОС) с различными функциональными группами (–OH, С(O)OH, –О–NO2 и др.) в составе их молекул. Появление этих групп в ВОС сопровождает значительное снижение летучести этих соединений [1, 4], ведущее к их конденсации и образованию частиц вторичных ОА (ВОА) в атмосфере.
При построении современных моделей формирования ВОА принято обыкновенно опираться на давления насыщения конденсирующихся ВОС ($P_{i}^{^\circ }$, атм). При этом упускаются из вида различного рода неспецифические взаимодействия (long-range, middle-range и short-range [5]) компонентов в частицах, полагая их γi равными единице [6–9]. Эти взаимодействия в частицах служат причиной известных отклонений от идеальности, т.е. отклонений Pi (как положительных, так и отрицательных) от $P_{i}^{^\circ }$, атм [10]. В [11] сообщалось также, что влияние таких взаимодействий может сказываться и на морфологии частиц; при высокой влажности воздуха в этой публикации рассматривалась возможность расслоения фаз в гигроскопичных ВОА. Все это демонстрирует сложность предсказания действительных оптических характеристик частиц ВОА и их реального влияния на тепловой баланс в атмосфере.
Цель данной работы – на примере рассмотрения совместной конденсации в атмосфере компонентов разной летучести проследить за тем, насколько велики изменения состава суррогатных частиц, вызванные взаимодействием их ингредиентов. Это приводит к задаче нахождения реальных значений коэффициентов распределения индивидуальных ВОС (Ki, м3/мкг) между газом и частицами аэрозоля [10] и определения по этим данным состава частиц в атмосфере при учете γi их компонентов. Здесь и далее Ki = RT × 10–6/Miγi$P_{i}^{^\circ }$, м3/мкг [10]), где R = 8.2 × 10–5 м3 атм/моль К – универсальная газовая постоянная, 10–6 размерный коэффициент мкг/г, Mi – усредненная молекулярная масса компонентов аэрозоля, включая воду, г/моль.
ТЕРМОДИНАМИЧЕСКАЯ МОДЕЛЬ
Для расчетов γi компонентов в суррогатных частицах использовалась модель AIOMFAC (Aerosol Inorganic Organic Mixtures Functional groups Activity Coefficients) [12]. Данная полуэмпирическая модель, базирующаяся на предложенной Ленгмюром концепции “group-contribution concept”, предназначена для расчетов термодинамических свойств различных композиций ОС, их смесей с водой, а также сложных смесей ОС в водных растворах минеральных солей при Т = 298.15 К. При этом компоненты частиц ВОА рассматриваются как переохлажденная жидкость [5]. В качестве стандартного состояния рассматривается их состояние в чистом виде [11]. В последние годы в эту модель добавлены пероксидные (–OOH) и нитратные (–O–NO2 и др.) группы [12]. С учетом более низкой чувствительности γi к температуре [12] в сравнении с температурной зависимостью $P_{i}^{^\circ }$ результаты расчетов при Т = 298.15 К можно использовать и при температурах на 15–20 K меньших или больших этой температуры. Это расширяет возможности использования данной модели. Более подробно модель AIOMFAC описана в [12].
В качестве компонентов суррогатных частиц в работе рассматривались органические пероксиды и нитраты – продукты фотохимических преобразований в фоновой и загрязненной атмосфере биогенных изопрена (C5H8) и α-пинена (C10H16). Оба эти компонента по данным [13] характеризуют значительные эмиссии в атмосферу. При этом образование пероксидов характерно в незагрязненной фоновой атмосфере, а образование нитратов ОС, напротив, в урбанизованной атмосфере, т.е. при повышенных уровнях NOx [14]. В качестве примеров органических пероксидов в работе рассматривались два соединения: IALD (HOCH2C(CH3)=CHCHO) и INPN (NO2OCH2C(OOH)(CH3)CH=CH2). В качестве примера органического нитрата – соединение ISNP (HOCH2C(OOH)(CH3)CH(ONO2)CH2OH). Отметим, что формирование органических нитратов с участием нестойких к солнечному излучению нитратных радикалов NO3 возможно и в дневное время. На это указали результаты 3D расчетов формирования частиц ВОА вблизи очагов лесных и торфяных пожаров. Эти результаты свидетельствуют о значительных концентрациях NO3 в дневное время [15]. Их возникновение связано с повышенными концентрациями озона и оксидов азота в шлейфах пожаров.
Выбранные компоненты аэрозоля в качестве значимых ингредиентов ВОА фигурируют и в других публикациях [8, 9]. В [8], например, приводятся их концентрации в ВОА, рассчитанные по результатам лабораторных [16, 17] и натурных измерений [7]. При этом концентрации этих соединений в газовой фазе, с использованием которых находилось содержание ВОА, рассчитывались с применением детального механизма окисления биогенных и абиогенных ОС [18]. Похожие их концентрации применительно к условиям рассматриваемых экспериментов были получены и при использовании в [8] детального механизма фотохимических превращений первичных органических соединений MCM v3.1 [19].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 1 приведены некоторые из рассчитанных нами зависимостей коэффициентов активности (безразмерных) IALD (γIALD) от мольной доли (NIALD) в суррогатных частицах разного состава. Различия кривых на рисунке отражают изменчивость γIALD к изменению соотношения между ISNP и INPN в аэрозольной фазе αIALD = = [ISNP](aer)/[INPN](aer) = 0.25–4. Видно, что в избытке IALD рассчитанные γIALD для всех смесей приближаются к предельному значению (единице), т.е. к значению для чистого компонента IALD ($\gamma _{{{\text{IALD}}}}^{^\circ }$ = 1). При этом в смеси с αIALD = 0.25 приближение γIALD → $\gamma _{{{\text{IALD}}}}^{^\circ }$ начинается уже при $N_{{{\text{IALD}}}}^{*}$ > 0.6, а в смесях с αIALD = 1–4 при $N_{{{\text{IALD}}}}^{*}$ > > 0.9. Из рисунка видно также, что при NIALD < < $N_{{{\text{IALD}}}}^{*}$ для всех αIALD наблюдается снижение γIALD в сравнении с чистым компонентом. В случае αIALD = 0.25 это снижение оказывается почти трехкратным. Это указывает на снижение парциального давления IALD над композициями ISNP и INPN и одновременно на рост KIALD. Эти изменения PIALD служат отражением сложной суммы взаимодействий гидрофобных (C–C, C=C, CH) и гидрофильных (–OH, CHO) групп в IALD при переходе его молекул из состояния чистого компонента в раствор ISNP и INPN, в состав которых в дополнение входят перекисная (–OOH) и нитратная (–О–NO2) группы. Видно, что учет внутри- и межмолекулярных взаимодействий между этими тремя компонентами в аэрозольной фазе приводит к снижению парциального давления IALD над частицами в сравнении с ожидаемым PIALD при формировании идеальных смесей (PIALD = $P_{{{\text{IALD}}}}^{^\circ }$γIALDNIALD).
Рис. 1.
Рассчитанные зависимости коэффициента активности IALD (γIALD) от мольной доли IALD (NIALD) в композициях IALD/ISNP/INPN. Светлые кружки: αIALD = NISNP/NINPN = 0.25; светлые треугольники: αIALD = 1; светлые прямоугольники: αIALD = 2 и светлые ромбы: αIALD = 4. Модель AIOMFAC, Т = 298.15 К. Пунктир показывает $\gamma _{{{\text{IALD}}}}^{^\circ }$.

Внимание привлекает и различие поведения γIALD в разбавленных (NIALD < 0.2) и концентрированных по IALD (NIALD ≥ 0.2) суррогатных частицах. В обоих случаях снижение NIALD сопровождается уменьшением γIALD, а вместе с этим и спадом PIALD. При этом, однако, если при NIALD < 0.2 парциальное давление IALD над конденсированной фазой оказывается тем ниже, чем меньше αIALD, т.е. в избытке INPN над ISNP, то при NIALD ≥ 0.2, напротив, уменьшение NIALD оказывается тем бóльшим, чем выше αIALD, т.е. в избытке ISNP над INPN. Это значит, что в разбавленных по IALD суррогатных частицах конденсация ISNP приводит и к увлечению IALD в конденсированную фазу, тогда как в концентрированных по IALD композициях рост содержания ISNP оборачивается “выталкиванием” более летучего IALD.
Подобные данные об изменчивости индивидуальных коэффициентов активности ISNP (γISNP) и INPN (γINPN) в аэрозольной фазе в смесях IALD и INPN (αISNP) и IALD и ISNP (αINPN) различного состава при Т = 298.15 К приведены на рис. 2 и 3. Из данных рис. 2 следует, что при αISNP = 0.25–1 переход мало летучего ISNP в конденсированную фазу, включающую IALD + INPN, практически для всех NISNP требует определенного пересыщения, так как γISNP > 1. В то же время при αISNP > 1 переход молекул ISNP в конденсированную фазу становится возможным при давлениях, меньших давления насыщения. Такой переход требует, однако, избытка летучего компонента IALD. Похожую изменчивость перехода в конденсированную фазу в зависимости от соотношения IALD и ISNP демонстрирует и другой компонент рассматриваемых смесей – INPN (см. рис. 3). Здесь приведены данные расчетов γINPN в смесях IALD и ISNP (αINPN) различного состава при Т = 298.15 К. Эти данные показывают, что переход молекул INPN в конденсированную фазу по мере снижения NINPN сопряжен с преодолением определенного энергетического барьера. При этом снижение содержания летучего компонента (IALD) приводит к его росту для перехода молекул INPN в конденсированную фазу, т.е. к росту пересыщения. Переход INPN в аэрозольную фазу при давлениях, меньших значения насыщения, возможен лишь при достаточно высоких NINPN и αINPN > 1.
Рис. 2.
Рассчитанные зависимости коэффициента активности ISNP (γISNP) от мольной доли ISNP (NISNP) в композициях IALD/ISNP/INPN. Светлые кружки: αISNP = NIALD/NINPN = 0.25; светлые треугольники: αIALD = 1; светлые прямоугольники: αIALD = 2 и светлые ромбы: αIALD = 4. Модель AIOMFAC, Т = 298.15 К. Пунктир показывает $\gamma _{{{\text{ISNP}}}}^{^\circ }$.
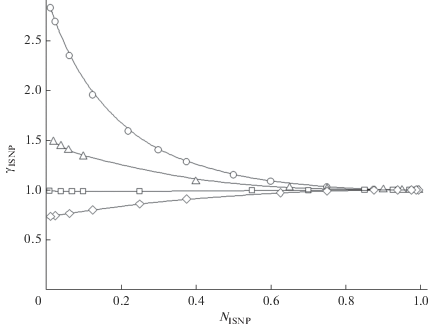
Рис. 3.
Рассчитанные зависимости коэффициента активности INPN (γINPN) от мольной доли INPN (NINPN) в композициях IALD/ISNP/INPN. Светлые кружки: αINPN = NIALD/NISNP = 0.25; светлые треугольники: αIALD = 1; светлые прямоугольники: αIALD = 2 и светлые ромбы: αIALD = 4. Модель AIOMFAC, Т = 298.15 К. Пунктир показывает $\gamma _{{{\text{INPN}}}}^{^\circ }$.

Полученные расчетные данные об изменчивости γi компонентов позволяют количественно проследить за тем, как сказывается взаимодействие органических пероксидов и нитратов на составе суррогатных частиц. С целью определения равновесного распределения этих соединений между газовой и аэрозольной фазой в работе решалась система из 6 алгебраических уравнений. Три из них описывают постоянство содержания в системе каждого из компонентов системы. Остальные уравнения описывают их содержание в конденсированной фазе. При этом заимствованные из [10] эти уравнения имеют вид: [xi(aer)] = Ki[xi(gas)](Σ[xi(aer)] + q). Здесь xi(aer) и xi(gas) – концентрации i-компонента в аэрозольной и газовой фазах соответственно (мкг/м3), а q – концентрация частиц первичного аэрозоля (мкг/м3).
Построенная таким образом система уравнений решалась с использованием оператора solve block, встроенного в коммерческий пакет программ Mathcad13. При этом решение системы для заданных Т, [xi(aer)], [xi(gas)] и q находилось методом итераций до получения сходящегося результата, что требовало обыкновенно нескольких итераций [10]. По результатам каждой итерации производилось обновление [xi(aer)], [xi(gas)] и значений коэффициентов активности.
В качестве примера ниже рассматриваются данные расчетов распределения компонентов в суррогатных частицах в условиях преобладания пероксидов над нитратами, т.е. применительно к условиям фоновой атмосферы. Расчеты проводились для сухой атмосферы при Т = 298.15 К и общих концентрациях компонентов в обеих фазах: [IALD] = 1.496, [ISNP] = 8.68 × 10–7 и [INPN] = = 1.26 мкг/м3. При этом [IALD] + [ISNP] + [INPN] = = 2.756, а q = 1 мкг/м3. Выбранные концентрации не слишком расходятся от их значений в [8]. С учетом этого и в приближении γIALD = γISNP = γINPN = 1 для равновесного состава двухфазной системы находим: [IALD(gas)] ≈ 1.496, [IALD(aer)] ≈ 1.2 × 10–6, [ISNP(gas)] ≈ 2.65 × 10–7, [ISNP(aer)] ≈ 6 × 10–7 и [INPN(gas)] ≈ 1.26, [INPN(aer)] ≈ 3.32 × 10–5 мкг/м3 (αIALD ≈ 0.015). Далее, принимая во внимание значения γIALD = 0.46, γISNP = 3.5 и γINPN ≈ 1 для найденного выше состава суррогатных частиц, путем нескольких итераций приходим к: [IALD(gas)] ≈ 1.496, [IALD(aer)] ≈ 2.6 × 10–6, [ISNP(gas)] ≈ 5.26 × 10–7, [ISNP(aer)] ≈ 3.39 × 10–7 и [INPN(gas)] ≈ 1.26, [INPN(aer)] ≈ 3.38 × 10–5 мкг/м3 (αIALD ≈ 0.01). Видно, что учет взаимодействий между органическими пероксидами (IALD/INPN) нивелирует “выталкивающее” действие органического нитрата (ISNP) и приводит к заметному обогащению аэрозольной фазы относительно летучим компонентом IALD. Его содержание в частицах возрастает при этом более чем вдвое от NIALD ≈ 0.05 до NIALD ≈ 0.11, что связано с понижением PIALD вследствие спада γIALD. При этом NISNP/NINPN в частицах снижается от ≈1.4 × 10–2 до ≈10–2. Причиной столь сильных изменений состава суррогатных частиц служит перераспределение между аэрозольной и газовой фазой малолетучего ISNP (органического нитрата), т.е. снижение концентрации ISNPaer. Так, если в приближении γIALD = = γISNP = γINPN = 1 соотношение масс этого компонента в аэрозольной и газовой фазах составляет ≈2.3, то принимая во внимание действительные их значения, находим, что это соотношение масс ISNP снижается до ≈0.6. При этом общее массовое содержание аэрозоля (≈3.7 × 10–5 мкг/м3) даже несколько нарастает (≈5%). Найденное перераспределение органического нитрата между газом и конденсированной фазой обусловлено в основном более чем трехкратным уменьшением KISNP: [ISNP(aer)]/[ISNP(gas)] = KISNP(Σ[xi(aer)] + q) ≈ ≈ KISNPq, вызванным ростом γISNP. Этот рост γISNP обусловлен “выталкиванием” ISNP органическими пероксидами в частицах. На достаточно высокие концентрации IALD в ВОА в незагрязненной атмосфере указывалось и в [8]. Рост [IALD(aer)] увеличивается еще более, примерно вдвое (до ≈1.2 × 10–5 мкг/м3) при понижении температуры до Т = 280 К. При этом вопреки ожиданиям NIALD снижается примерно наполовину (до ≈0.05), что вызвано заметным ростом массовой концентрации INPN (NINPN ≈ 0.9) в суррогатных частицах вследствие уменьшения PINPN (PINPN ≈ ≈ $P_{{{\text{INPN}}}}^{^\circ }$) из-за снижения Т.
В работе были проведены и расчеты влияния относительной влажности (RH) на изменения состава суррогатных частиц из-за падения М. Так, при Т = 298.15 К, RH = 0.6, αIALD = 0.25 и NIALD = = 0.01–0.6 весовое содержание воды в суррогатных частицах возрастает примерно втрое от ≈0.037 до ≈0.11. При этом NН2О нарастает от ≈0.26 до ≈0.4. Усредненный по компонентам молекулярный вес в частицах (М ≈ 163) снижается по этим данным примерно до М ≈ 130, что ≈20% приросту и величины KIALD во влажной атмосфере. Эту величину KIALD не слишком меняет дальнейший рост относительной влажности, вплоть до RH = 0.95. Эти результаты качественно согласуются с данными независимых опытов, базирующихся на измерениях размеров частиц ВОА при вариациях RH. По данным [20, 21], при RH = 90%, например, размер частиц возрастает на 10%. Это значит, что около 25% объема фазы частиц ВОА обеспечивается содержанием в них воды. Поэтому соответствующее снижение усредненной молекулярной массы компонентов (и связанное с этим увеличение Кi) оказывается небольшим (≤3) для ОС с М ≈ 170.
Подытоживая, приходим к заключению, что влияние RH в атмосфере вместе с влиянием неспецифического взаимодействия органических пероксидов и нитратов в частицах может оборачиваться ростом эффективных значений Кi компонентов ВОА приблизительно на половину порядка величины. В то же время по данным [7] согласие расчетных и измеренных массовых концентраций ВОА удается достигнуть лишь приписывая продуктам превращения в атмосфере в ≈500 раз бóльшие значения Кi. В этой публикации расчетные данные сравнивались с результатами натурных измерений в атмосфере ВOA и газовых примесей в местечке Writtle College, Writtle, Essex, UK (51.74° N; 0.42° E) (TORCH 2003, Tropospheric Organic Chemistry Experiment). При этом концентрации газовых примесей, в том числе предшественников ВОА – органических нитратов и пероксидов, воспроизводились с применением траекторной химической модели (ТХМ), базирующейся на механизме МСМ v3, в деталях описывающего фотохимические и химические превращения в атмосфере компонентов биогенного и абиогенного происхождения [19]. Траектории перемещения воздушных масс для высоты над подстилающей поверхностью 300 м заимствовались из онлайн-сервиса траекторий NOAA. Отметим, что в [7, 22] сообщалось о неплохом согласии между расчетными и измеренными концентрациями ряда легких первичных ОС и ВОС по ходу кампании TORCH 2003 с использованием с ТХМ и МСМ 3, что говорит о работоспособности данного подхода. Подобное расхождение данных численного моделирования и измеренных массовых концентраций ВОА в независимых работах (smog-chamber) [16, 17] при использовании детального механизма превращений в атмосфере биогенных и абиогенных органических соединений (МСМ 3, γi = 1) отмечалось ранее и в [6]. Как и в [8], в этих расчетах использовали приближение γi ≈ 1, игнорируя взаимодействие между компонентами в ОА.
Сказанное означает, что построение адекватной модели формирования частиц ВОА в атмосфере требует, по-видимому, привлечения каких-то дополнительных механизмов их роста. Отметим в этой связи, что в [23–26] сообщалось об обнаружении в составе ВОА соединений с Мi = 250–1600 г/моль, заметно бóльших, чем у их предшественников. В [14] по данным лабораторных опытов в условиях низких [NOx] было обнаружено образование 2-метилглицериновой кислоты (OH–C(O)–C(CH3)(OH)CH2–OH). Данное соединение, как отмечалось в [14], может выступать в качестве мономера (М = 120) при формировании димеров (М = 222), тримеров (М = 324) и еще больших n-меров. Их формирование (олигомеризация) при захвате из газа мономеров приводит к компонентам аэрозоля, молекулярный вес которых превышает молекулярный вес предшественников в газовой фазе. Данный мономер является при этом продуктом окисления в атмосфере метакролеина (CH2=C(CH3)CHO), возникающего при окислении изопрена. В загрязненной атмосфере, т.е. в условиях повышенного содержания NOx, роль подобного мономера может играть органический нитрат, возникающий при окислении метилвинилкетона (CH2=CHC(O)CH3) – продукт окисления изопрена. Температуры кипения таких соединений значительно превышают температуры кипения их мономера, что обеспечивает их стабилизацию на частицах ВОА. При построении модели формирования ВОА с участием подобных процессов необходимо, однако, располагать прямыми данными об образовании таких полимерных цепей в частицах, данными о константах скорости их образования и др., остающимися пока неизвестными.
ЗАКЛЮЧЕНИЕ
В работе построена модель формирования частиц органического аэрозоля в атмосфере, включающих компоненты различной летучести. В качестве модельных компонентов суррогатных частиц аэрозоля рассматривались продукты фотохимических и химических превращений биогенных соединений α-пинена и изопрена – органические пероксиды и нитраты: IALD, ISNP и INPN. Модель построена с учетом взаимодействий органических пероксидов и нитратов и гигроскопичности частиц. Найденный по этим данным состав частиц ОА заметно отклоняется (положительные и отрицательные отклонения) от рассчитанного по давлениям насыщения ($P_{i}^{^\circ }$, атм) индивидуальных компонентов частиц, что следует принимать во внимание при построении моделей формирования частиц ВОА в атмосфере. При этом возникающие при конденсации IALD, ISNP и INPN суррогатные частицы ВОА характеризуются заметной гигроскопичностью, что также сказывается на изменениях состава частиц ВОА.
Список литературы
Kanakidou M., Seinfeld J.H., Pandis S.N. et al. Organic aerosol and global climate modeling: a review // Atmos. Chem. Phys. 2005. V. 5. № 4. P. 1053–1123.
Jimenez J.L., Canagaratna M.R., Donahue N.M. et al. Evolution of organic aerosols in the atmosphere // Science. 2009. V. 326. P. 1525–1529.
Middleton P., Stockwell W.R., Carter W.P.L. Aggregation and analysis of volatile organic compound emissions for regional modeling // Atmos. Environ. 1990. V. 24A. P. 1107–1133.
Griffin R.J., Cocker D.R., Flagan R.C., Seinfeld J.H. Organic aerosol formation from oxidation of biogenic hydrocarbons // J. Geophys. Res. 1999. V. 104. P. 3555–3567.
Pitzer K.S. Thermodynamics of electrolytes. I, Theoretical basis and general equations. // J. Phys. Chem. 1973. V. 77. № 2. P. 268–277.
Jenkin M.E. Modelling the formation and composition of secondary organic aerosol from α- and β-pinene ozonolysis using MCM v3 // Atmos. Chem. Phys. 2004. V. 4. № 7. P. 1741–1757.
Johnson D., Utembe S.R., Jenkin M.E. et al. Simulating regional scale secondary organic aerosol formation during the TORCH 2003 campaign in the southern UK // Atmos. Chem. Phys. 2006. V. 6. № 2. P. 403–418.
Olcese L.E., Penner J.E., Sillman S. Development of a secondary organic aerosol formation mechanism: comparison with smog chamber experiments and atmospheric measurements // Atmos. Chem. Phys. 2007. V. 7. P. 8361–8393.
Taraborrelli D., Lawrence M.G., Butler T.M., Sander R., Lelieveld J. A new isoprene mechanism MIM2 for atmospheric modelling // Atmos. Chem. Phys. 2009. V. 9. № 8. P. 2751–2777.
Pankow J.F. An absorption model of gas/particle partitioning of organic compounds in the atmosphere // Atmos. Environ. 1994. V. 28. № 2. P. 185–188.
Zuend A., Seinfeld J.H. Modeling the gas-particle partitioning of secondary organic aerosol: the importance of liquid-liquid phase separation // Atmos. Chem. Phys. 2012. V. 12. № 9. P. 3857–3882.
Zuend A., Marcolli C., Luo B.P., Peter T. A thermodynamic model of mixed organic-inorganic aerosols to predict activity coefficients // Atmos. Chem. Phys. 2008. V. 8. № 16. P. 4559–4593.
Amiro B.D., Todd J.B., Wotton B.M. et al. Direct carbon emissions from Canadian forest fires, 1959–1999 // Can. J. Forest Res. 2001. V. 31. № 3. P. 512–515.
Surratt J.D., Murphy S.M., Kroll J.H. et al. Chemical composition of secondary organic aerosol formed from the photooxidation of isoprene // J. Phys. Chem. A. 2006. V. 110. № 31. P. 9665–9690.
Aloyan A.E., Yermakov A.N., Arutyunyan V.O. Dynamics of gas admixtures and aerosols in forest and peat fires // Russ. J. Numer. Anal. Math. Modell. 2014. V. 29. № 2. C. 79–92.
Kamens R.M., Jaoui M. Modeling aerosol formation from α-pinene + NO in the presence of natural sunlight using gas-phase kinetics and gas-particle partitioning theory // Environ. Sci. Technol. 2001. V. 35. № 7. P. 1394–1405.
Takekawa H., Minoura H., Yamazaki S. Temperature dependence of secondary organic aerosol formation by photooxidation of hydrocarbons // Atmos. Environ. 2003. V. 37. № 24. P. 3413–3424.
Ito A., Sillman S., Penner J.E. Effects of additional non-methane volatile organic compounds, organic nitrates and direct emissions of oxygenated organic species on global tropospheric chemistry // J. Geophys. Res. 2007. V. 112. D06309. https://doi.org/10.1029/2005JD006556
Jenkin M.E., Saunders S.M., Pilling M.J. The tropospheric degradation of volatile organic compounds: A protocol for mechanism development // Atmos. Env. 1997. V. 31. № 1. P. 81–104.
Virkkula A., van Dingenen R., Raes F., Hjorth J. Hygroscopic properties of aerosol formed by oxidation of limonene, α-pinene and β-pinene // J. Geophys. Res. 1999. V. 104. P. 3569–3579.
Cocker D.R., Clegg S.L., Flagan R.C., Seinfeld J.H. The effect of water on gas-particle partitioning of secondary organic aerosol. Part I: α-pinene/ozone system // Atmos. Environ. 2001. V. 35. № 35. P. 6049–6072.
Utembe S.R., Jenkin M.E., Derwent R.G., Lewis A.C., Hopkins J.R., Hamilton J.F. Modelling the ambient distribution of organic compounds during the August 2003 ozone episode in the southern UK // Faraday Discuss. 2005. V. 130. P. 311–326.
Jang M., Czoschke N.M., Lee S., Kamens R.M. Heterogeneous atmospheric aerosol production by acid catalyzed particle-phase reactions // Science 2002. V. 298. P. 814–817.
Kroll J.H., Chan A.W.H., Ng N.L., Flagan R.C., Seinfeld J.H. Reactions of semivolatile organics and their effects on secondary organic aerosol formation // Environ. Sci. Technol. 2007. V. 41. № 10. P. 3545–3550.
Gao S., Ng N.L., Keywood M. et al. Particle phase acidity and oligomer formation in secondary organic aerosol // Environ. Sci. Technol. 2004. V. 38. № 24. P. 6582–6589.
Zhao R., Kenseth C.M., Huang Y. et al. Rapid aqueous-phase hydrolysis of ester hydroperoxides arising from Criegee intermediates and organic acids // J. Phys. Chem. A. 2018. V. 122. № 23. P. 5190–5201. https://doi.org/10.1021/acs.jpca.8b02195
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Физика атмосферы и океана


