Журнал физической химии, 2019, T. 93, № 6, стр. 803-809
Особенности термолиза смеси [Pd(NH3)4]Cl2 и (NH4)2Cr2O7 в инертной атмосфере
Е. В. Фесик a, f, *, Т. М. Буслаева b, Т. И. Мельникова c, Л. С. Тарасова d, А. В. Лаптенкова e
a Самарский университет
Самара, Россия
b МИРЭА-Российский технологический университет (Институт тонких химических технологий имени
М.В. Ломоносова)
Москва, Россия
c Некоммерческое партнерство “Содействие химическому и экологическому образованию”
Москва, Россия
d Российская академия наук, Сибирское отделение, Федеральный исследовательский центр
“Красноярский научный центр”
Красноярск, Россия
e Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
f Медицинский университет “Реавиз”
Самара, Россия
* E-mail: 1707-fesik@mail.ru
Поступила в редакцию 10.08.2018
После доработки 06.11.2018
Принята к публикации 11.11.2018
Аннотация
В работе методами термического анализа и масс-спектрометрии изучена последовательность термических превращений смеси 3[Pd(NH3)4]Cl2 и 2(NH4)2Cr2O7 (мольное отношение металлов Pd : Cr = 3 : 4), в атмосфере аргона в интервале температур от 50 до 550°С. Установлено (РФА, элементный анализ), что твердый продукт, образующийся в результате термолиза исследуемой смеси в выбранных условиях, представлен твердым раствором на основе палладия Pd1 – xCrx, изоструктурным Pd, с параметром ячейки a = 3.8921(5) Å, и оксидной фазой Cr2O3. Предложена модель твердофазных превращений в рассматриваемой смеси в атмосфере аргона, включающая стадии образования металлических фаз палладия и хрома.
Неослабевающий интерес исследователей к изучению биметаллических материалов на основе металлов платиновой группы (МПГ) и хрома обусловлен их уникальными свойствами, прежде всего, высокой термической и химической стойкостью [1–3]. Так, частицы биметаллического сплава Pd–Cr находят применение в качестве активной каталитической составляющей при приготовлении трехмаршрутных катализаторов (TWC) [4], в процессах анодного окисления муравьиной кислоты [5], в качестве материала датчиков высоких концентраций водорода [6], катализаторов гидрирования 1,3-бутадиена [7] и др.
Одним из наиболее распространенных путей приготовления тонкодисперсных частиц биметаллического сплава является термолиз смеси соединений-предшественников, например, различных неорганических [8] или металлоорганических [9] соединений или двойных комплексных солей (ДСК) [10], содержащих в качестве комплексообразователей атомы различных металлов. Показано [11, 12], что продукты термолиза хромсодержащих ДСК принципиально отличаются от продуктов разложения, не содержащих в своем составе хрома. Так, продукты термолиза солей состава [Cr(NH3)5Cl][PtCl4] и [Cr(NH3)5Cl][PdCl4] · H2O даже в атмосфере водорода представлены двумя фазами – твердым раствором MxCry (M = = Pt, Pd) и Cr2O3. Твердый раствор Cr0.5Pd0.5 получен лишь при термолизе [Cr(NH3)5Cl][PdCl4] в водороде при 800°С с последующим длительным выдерживанием также в атмосфере водорода [12].
Настоящее сообщение является продолжением наших исследований по изучению взаимодействия аммиакатов платины и палладия с аммонийными солями кислородсодержащих кислот элементов VIB группы [13, 14] и получению на их основе биметаллических частиц. Известно [15, 16], что система Cr–Pd характеризуется смешиваемостью в жидком состоянии и наличием областей твердых растворов (Сr) и (Pd). В твердом состоянии при температурах ниже 500°С образуется соединение CrPd при содержании Pd 43–54 ат. %, и появляется упорядоченная фаза состава Cr2Pd3 при содержании Pd 55–57 ат. %.
Целью настоящей работы явилось установление возможности восстановления Cr2O$_{7}^{{2 - }}$ – иона до металлического состояния аммиаком “в момент выделения” и выявление стадий твердофазного термолиза смеси [Pd(NH3)4]Cl2 и (NH4)2Cr2O7, где Pd : Cr = 3 : 4, что соответствует содержанию Pd 42.8 ат. % , в интервале температур от 50 до 550°С в инертной атмосфере.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходными веществами в работе служили [Pd(NH3)4]Cl2, синтезированный из дихлорида палладия (Pd = 59.903%, ТУ 2625-058-00196533-2002, ОАО “Красцветмет” им. В.Н. Гулидова) по методике [13] и (NH4)2Cr2O7, “х.ч.”, ГОСТ 3763-76. Прочие реактивы также имели квалификацию не ниже “х.ч.”. Навески солей палладия и хрома, взятых в заданном соотношении, растворяли в минимальном количестве дистиллированной воды, смешивали полученные растворы в выпарительной чашке, которую помещали в сушильный шкаф при температуре 100–110°С до полного высыхания смеси.
Термический анализ смесей выполняли на приборе синхронного термического анализа STA 449С Jupiter (NETZSCH), совмещенном с масс-спектрометром QMS 403 С Aeolos. Навеску смеси помещали в корундовый тигель и нагревали со скоростью 10 К/мин в токе аргона (40 мл/мин), на воздухе – в трубчатой воздушной печи при скорости нагрева 10 К/мин. Точечные эксперименты для получения твердых промежуточных продуктов при температурах, соответствующих эндо- и экзоэффектам на термограммах, и изучения фазового и химического состава проводили в проточном кварцевом реакторе, вставленном в трубчатую печь, в токе аргона со скоростью 40 мл/мин.
Все полученные образцы, содержащие продукты термолиза смесей при различных температурах, снимали на порошковом дифрактометре ARL X’TRA (Termo Fisher Scientific, Швейцария) с использованием монохроматического излучения CuKα c длиной волны 1.54056 Å и линейной коррекцией длины волны 1.54433 Å (сканирование с шагом 2 град, время набора импульсов 3 с, интервал углов 2θ = 5–80 град). Для идентификации образовавшихся фаз проводили рентгенофазовый анализ (РФА) с использованием автоматизированной базы данных PCPDFWIN PDF2. Параметры элементарной ячейки уточняли с помощью программы DICVOL04 [17].
Элементный состав продуктов термолиза смесей определяли при помощи энергодисперсионного микроанализатора JED 2300 (напряжение 20 кВ).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Ранее мы сообщали [14], что [Pd(NH3)4]Cl2 в атмосфере аргона при нагревании до 550°С устойчив до 190°С, затем разлагается в две стадии, сопровождающиеся эндоэффектами при 191 и 326°С с образованием металлического палладия. Разложение (NH4)2CrO4 при нагревании в аргоне до 550°С протекает в три стадии: первый эндоэффект при температуре 157°С – соответствует переходу хромата аммония в дихромат. Последующие термические превращения образовавшегося дихромата описываются двумя экзоэффектами: небольшим с максимумом при 232.2 и сильным – при 269.1°С.
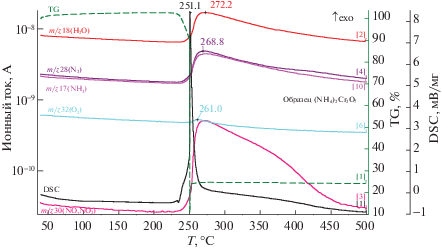
Термограмма (NH4)2Cr2O7 в атмосфере аргона и масс-спектры образующейся газовой фазы приведены на рис. 1. Очевидно, что соединение термически устойчиво до 225°С, разложение происходит в две стадии, в отличие от (NH4)2CrO4 [14] и начинается при температуре на 10°С ниже, чем на воздухе [19–21]11. В области температур 225–250°С происходит заметное разложение соли, и потеря исходной массы составляет 12.8% за счет выделения аммиака, азота и воды (рис. 1).
Затем следует мощный экзотермический эффект взрывного характера с максимумом при температуре 251.1°С и выделением тепла в количестве ΔН = –214.1 ± 6 Дж/г в течение 5–6 с. При этом общая потеря массы составляет 75.5% от исходной: в газовой фазе детектируются Н2О, NH3, N2 и О2. Присутствие азота указывает на протекание процессов окисления свободного аммиака, следовательно, и восстановление дихромат-иона до диоксида хрома, по уравнению
(1)
$3{{({\text{N}}{{{\text{H}}}_{4}})}_{2}}{\text{C}}{{{\text{r}}}_{2}}{{{\text{O}}}_{7}} \to 6{\text{Cr}}{{{\text{O}}}_{2}} + 2{{{\text{N}}}_{2}} + 2{\text{N}}{{{\text{H}}}_{3}} + 9{{{\text{H}}}_{2}}{\text{O}},$(2)
$6{\text{Cr}}{{{\text{O}}}_{2}} \to 3{\text{C}}{{{\text{r}}}_{2}}{{{\text{O}}}_{3}} + 3{\text{/}}2{{{\text{O}}}_{2}},$(3)
$\begin{gathered} 3{{({\text{N}}{{{\text{H}}}_{4}})}_{2}}{\text{C}}{{{\text{r}}}_{2}}{{{\text{O}}}_{7}} \to 3{\text{C}}{{{\text{r}}}_{2}}{{{\text{O}}}_{3}} + 2{{{\text{N}}}_{2}} + \\ + \;2{\text{N}}{{{\text{H}}}_{3}} + 9{{{\text{H}}}_{2}}{\text{O}} + 3{\text{/}}2{{{\text{O}}}_{2}}. \\ \end{gathered} $Выделение кислорода объясняет присутствие оксидов азота (N2O, NO, NO2) в газовой фазе.
Таким образом, восстановление анионов CrO$_{4}^{{2 - }}$ и Cr2O$_{7}^{{2 - }}$ носит разный характер. Не исключено, что это обусловлено тем, что дихромат-ион более подвержен действию восстановителей. В частности, длина связи Cr–Oмост в ионе Cr2O$_{7}^{{2 - }}$ равна 0.179 нм, в то время, как в CrO$_{4}^{{2 - }}$ ионе, все связи Cr–Oконц короче и равноценны: 0.166 нм [18].
Термолиз исследуемой смеси 3[Pd(NH3)4]Cl2 и 2(NH4)2Cr2O7, где Pd : Cr = 3 : 4 в температурном интервале от 50–550°С в аргоне начинается при температуре 180°С, следовательно, определяется термической устойчивостью [Pd(NH3)4]Cl2 (190°С) [14], и протекает в три стадии (рис. 2а, б).
Рис. 2.
Термограмма смеси 3[Pd(NH3)4]Cl2 и 2(NH4)2Cr2O7, где Pd : Cr = 3 : 4, в атмосфере аргона (а) и масс-спектры образующейся газовой фазы (б).

На первой стадии в температурном интервале 50–260°С наблюдается потеря массы 3.7% (∆mвыч = 4.1%), соответствующая удалению трех молекул аммиака. Слабые эндотермические эффекты (188, 199°С), вероятно, обусловлены вхождением хлорид-ионов во внутреннюю сферу комплекса [Pd(NH3)4]Cl2 и образованием транс-[Pd(NH3)2Cl2] [21].
На второй стадии термолиза в температурном интервале 250–300°С наблюдается основная потеря массы, которая сопровождается экзотермическим эффектом с максимумом при 283°С на кривой DSC и носит взрывной характер. Потеря массы составляет 21.0% (∆mрасч = 20.6%), что отвечает удалению 9NH3, N2, O2, 2H2O, 3H2, сигналы которых зафиксированы в масс-спектрах газовой фазы (рис. 2б). Присутствие водорода в газовой фазе (286.6°С), возможно, вызвано образованием гидридов палладия и их последующим разложением до металла, как описано в [22]. Отметим, что при термолизе смеси 3[Pd(NH3)4]Cl2 и (NH4)2CrO4, где Pd : Cr = 3 : 1, водорода в составе газовой фазы не обнаружено [14].
На третьей, заключительной стадии термолиза, в температурном интервале 300–550°С наблюдается уменьшение массы на 16.4% (∆mвыч = 15.6%), что соответствует удалению N2, 5O2, H2O и 3H2, сигналы которых детектируются в газовой фазе.
Эндотермические эффекты (310, 338°С) связаны с полным восстановлением палладия (338°С) [11, 12, 21], и формированием конечного продукта.
В отличие от мощных эндотермических эффектов (ΔН = 433.5 Дж/г ± 13.0) в области 290–340°С, соответствующих разложению [Pd(NH3)2Cl2] [14], для рассматриваемой смеси наблюдается серия небольших эндотермических эффектов (ΔН = 93.8 ± 3.0 Дж/г).
Общая потеря массы – 41.1% (∆mвыч = 40.3%), масса твердого остатка – 58.9% (∆mвыч = 59.7%). Суммарное содержание металлов в смеси составляет 42.5%. Расчет на Pd3Cr4O6 (3Pd + 2Cr2O3) составляет 50.1%. Расчет на Pd3Cr4Cl6 – 59.6%, что хорошо согласуется с экспериментальными данными и соответствует составу 3Pd + Cr + 3CrCl2. Присутствие последнего в конечном продукте термолиза, по нашему мнению, можно объяснить образованием металлического хрома и его последующим взаимодействием с HCl, сигнал которого фиксируется в масс-спектре газовой фазы (рис. 2б). Однако при извлечении из печи CrCl2 быстро окисляется на воздухе до Cr2O3 [12]. По данным термического анализа, состав твердого продукта термолиза отвечает брутто-формуле Pd3Cr4Cl6, что, в свою очередь, косвенно указывает на образование металлических фаз Pd и Cr и хорошо согласуется с литературными данными [3].
Наличие в масс-спектре газообразных продуктов разложения смеси оксидов азота NO, NO2 (m/z = 30), обусловлено протеканием в газовой фазе следующих реакций, катализируемых металлическим палладием:
(4)
$4{\text{N}}{{{\text{H}}}_{3}} + 5{{{\text{O}}}_{2}} \to 4{\text{NO}} + 6{{{\text{H}}}_{2}}{\text{O}},$Методом рентгенофазового анализа изучены твердые промежуточные продукты термолиза смеси 3Pd(NH3)4]Cl2 и 2(NH4)2Cr2O7, где Pd : Cr = = 3 : 4, в аргоне.
На рис. 3 представлены рентгенограммы промежуточных продуктов термолиза рассматриваемой смеси при 220, 285, 340 и 550°С.
Рис. 3.
Рентгенограммы твердых продуктов разложения смеси 3Pd(NH3)4]Cl2 и 2(NH4)2Cr2O7, где Pd : Cr = 3 : 4, в аргоне при 220, 285, 340° (а) и 550°С (б).

Выявлено, что продукт термолиза смеси при 220°С содержит две фазы: транс-Pd(NH3)2Cl2 и Cr, что не противоречит литературным данным [3, 21]. Продукт термолиза смеси при 285°С содержит металлический Cr, транс-Pd(NH3)2Cl2 и кубическую фазу, изоструктурную Pd (пр.гр. Fm-3m), с параметром ячейки a = 3.894(8) Å. Параметр ячейки кубической фазы на основе Pd немного меньше параметра ячейки чистого Pd (a = = 3.905(5) Å), полученного нами в ходе термического разложения исходного Pd(NH3)2Cl2, что свидетельствует об образовании неупорядоченного твердого раствора на основе палладия Pd1 ‒ xCrx, так как r(Cr) = 1.27 Å меньше r(Pd) = 1.37 Å [23]. Этот факт хорошо согласуется с результатами, описанными в [24] и подтверждающими образование твердого раствора на основе палладия путем термолиза двойной соли [Cr(NH3)5Cl][PdBr4] · H2O в атмосфере водорода [12].
Анализ рентгенограммы продукта термолиза смеси, полученного при 340°С (рис. 3а) с учетом литературных данных [15, 16, 24–26] позволяет предположить присутствие в образце, наряду с Pd (a = = 3.908(1) Å), упорядоченной интерметаллической фазы PdxCry и, возможно, некоторое количество Cr.
Конечный продукт термолиза рассматриваемой смеси, полученный при температуре 550°С, представлен неупорядоченным твердым раствором с кубической структурой на основе палладия Pd1 – xCrx со значением параметра a = 3.8921(5) Å и оксидной фазой Cr2O3 (рис. 3б). Заметим, что для смеси 3[Pd(NH3)4]Cl2 – (NH4)2CrO4, где Pd : Cr = 3 : 1, конечный продукт термолиза, по данным РФА, представлен только одной фазой, а именно неупорядоченным твердым раствором на основе палладия Pd1 – xCrx (a = 3.897(2) Å). Полученные результаты подтверждают наше предположение о том, что термическое взаимодействие компонентов смеси протекает через образование металлических фаз Pd и Cr, образующих твердый раствор. Хром, не вошедший в состав твердого раствора при температуре выше 400°С, взаимодействует с HCl с образованием дихлорида хрома, который при быстром извлечении из печи окисляется на воздухе до Cr2O3.
Таким образом, в настоящей работе впервые установлено, что термическую устойчивость смеси 3[Pd(NH3)4]Cl2 и 2(NH4)2Cr2O7, где Pd : Cr = = 3 : 4, определяет температура начала разложения [Pd(NH3)4]Cl2 (190°С). Представляется, что уменьшение параметра решетки конечного продукта для рассматриваемой смеси по сравнению с системой, включающей хромат-ион, свидетельствует о большем количестве хрома, вошедшего в кристаллическую решетку палладия.
При элементном анализе твердого продукта термического взаимодействия смеси 3[Pd(NH3)4]Cl2 и 2(NH4)2Cr2O7, где Pd : Cr = 3 : 4, при 500°С в аргоне найдено, %: Pd 46.60 ± 0.02%, Cr 39.75 ± 0.04%, O 13.65 ± 0.09%. Содержание в нем кислорода указывает на присутствие небольшого количества Cr2O3, образующегося при окислении хрома, не вошедшего в состав твердого раствора [11, 12]. Тогда термолиз рассматриваемой смеси в аргоне описывается уравнением реакции:
(6)
$\begin{gathered} 3[{\text{Pd}}{{({\text{N}}{{{\text{H}}}_{3}})}_{4}}]{\text{C}}{{{\text{l}}}_{2}} + 2{{({\text{N}}{{{\text{H}}}_{4}})}_{2}}{\text{C}}{{{\text{r}}}_{2}}{{{\text{O}}}_{7}} \to 3{\text{Pd}} + {\text{Cr}} + \\ + \;3{\text{CrC}}{{{\text{l}}}_{2}} + 12{\text{N}}{{{\text{H}}}_{3}}{\kern 1pt} \uparrow + \;2{{{\text{N}}}_{2}}{\kern 1pt} \uparrow + \;4{{{\text{H}}}_{2}}{\text{O}}{\kern 1pt} \uparrow + \\ + \;5{{{\text{O}}}_{2}}{\kern 1pt} \uparrow + \;4{{{\text{H}}}_{2}}{\kern 1pt} \uparrow {\kern 1pt} . \\ \end{gathered} $Твердый продукт термолиза рассматриваемой смеси на воздухе при 550°С, по данным РФА, содержит две фазы – PdO и Cr2O3. При элементном анализе найдено, %: Pd 34.63 ± 0.05%, Cr 44.77 ± 0.06%, O 21.60 ± 0.09%.
Таким образом, термолиз рассматриваемой смеси на воздухе при 550°С описывается уравнением:
(7)
$\begin{gathered} 3[{\text{Pd}}{{({\text{N}}{{{\text{H}}}_{3}})}_{4}}]{\text{C}}{{{\text{l}}}_{2}} + 2{{({\text{N}}{{{\text{H}}}_{4}})}_{2}}{\text{C}}{{{\text{r}}}_{2}}{{{\text{O}}}_{7}} \to 3{\text{PdO}}\;{\text{ + }} \\ + \;2{\text{C}}{{{\text{r}}}_{2}}{{{\text{O}}}_{3}} + 14{\text{N}}{{{\text{H}}}_{3}}{\kern 1pt} \uparrow + \;{{{\text{N}}}_{2}}{\kern 1pt} \uparrow + \\ + \;2{{{\text{H}}}_{2}}{\text{O}}{\kern 1pt} \uparrow + \;3{\text{/}}2{{{\text{O}}}_{2}}{\kern 1pt} \uparrow + \;6{\text{HCl}}{\text{.}} \\ \end{gathered} $В заключение отметим разницу в термическом поведения смесей 3[Pd(NH3)4]Cl2 и 2(NH4)2Cr2O7, где Pd : Cr = 3 : 4 (I), и 3[Pd(NH3)4]Cl2 и (NH4)2CrO4, где Pd : Cr = 3 : 1 (II).
Во-первых, экзотермический эффект разложения смеси (I) более, чем на порядок (ΔН = = ‒158.6 ± 5.0 Дж/г), превышает тепловой эффект разложения смеси (II) – ΔН = –9.16 ± 0.3 Дж/г. При этом происходит убыль 21% от исходной массы смеси (I), по сравнению с 9.1% при разложении смеси (II). Видимо, причиной тому служит большее содержание хрома в смеси (I) (57 мол. %), по сравнению со смесью (II) (25 мол. %).
Во-вторых, процесс разложения [Pd(NH3)2Cl2] в смеси (I) протекает медленнее, тогда как скорость разложения дихромата аммония (14.3%/мин) вдвое больше скорости разложения хромата, что приводит к быстрому выходу в газовую фазу восстанавливающего агента (NH3) из сферы твердофазной реакции. В отличие от мощных эндотермических эффектов (ΔН = 433.5 ± ± 13.0 Дж/г) в области 290–340°С, соответствующих разложению [Pd(NH3)2Cl2], в этой же температурной зоне для рассматриваемой смеси наблюдается серия небольших эндотермических эффектов (ΔН = 93.8 ± 3.0 Дж/г). Слабый сигнал выделения HCl в масс-спектре газовой фазы (рис. 3б) фиксируется при 304.8°С, а наиболее интенсивный – при 462°С, что указывает на продолжение процесса восстановления Pd и Cr, который не заканчивается к 500°С.
Отметим, что для систем 3[Pd(NH3)4]Cl2 и (NH4)2CrO4 (Pd : Cr = 3 : 1) (II) [14] и 3[Pt(NH3)4]Cl2 и (NH4)2CrO4 (Pt : Cr = 3 : 1) (III) продукты термолиза в аргоне при 500°С – твердые растворы с кубической структурой на основе палладия Pd1 – xCrx (a = 3.897(2) Å) и платины Pt1 ‒ xCrx (a = 3.9271(6) Å) соответственно, а для 3[Pt(NH3)4]Cl2 и 2(NH4)2Cr2O7(Pt : Cr = 3 : 4) (IV) – упорядоченная фаза PtxCry и Cr2O3 [13], что подтверждает наше предположение о том, что ионы Pt2+, Pd2+ и аммиак [2]22 “в момент выделения” могут являться восстановителями дихромат-иона до металлического состояния с образованием биметаллического сплава.
Полученные в работе результаты могут быть положены в основу синтеза Pd–Cr-содержащих биметаллических сплавов оптимального состава для получения материалов различного назначения.
Список литературы
Эллерт О.Г., Цодиков М.В., Николаев С.А., Новоторцев В.М. // Успехи химии. 2014. Т. 83. № 8. С. 718.
Sankar M., Dimitratos N., Miedziak Peter J., Wells Peter P. et al. // Chem. Soc. Rev. 2012. V. 41. P. 8099. https://doi.org/10.1039/c2cs35296f
Белоусов О.В., Борисов Р.В., Жарков С.М. и др. // Журн. физ. химии. 2012. Т. 86. № 3 С.557. https://doi.org/10.1134/S0036024412020070
Iglesias-Juez A., Martínez-Arias A., Hungría A.B. et al. // App. Cat. A: Gen. 2004. V. 259. № 2. P. 207. https://doi.org/10.1016/j.apcata.2003.09.020
Wen W., Li C., Li W., Tian Y. // Electrochim. Acta. 2013. V. 109. № 30. P. 201.
Zhang L., Mc Cullen E.F., Rahman Md H. et al. // Sens. and Act. B: Chem. 2006. V. 113. № 2. P. 843.
Borgna A., Moraweck B., Massardier J., Renouprez A. // J. Catalysis. 1991. V. 128. № 1. P. 99–112.
Машковский И.С., Марков П.В., Брагина Г.О. и др. // Кинетика и катализ. 2017. Т. 58. № 4. С. 499. https://doi.org/10.7868/S045388111704013X
Зеликман В.М., Тарханова И.Г., Хомякова Е.В. // Там же. 2012. Т.53. № 2. С. 232. https://doi.org/10.1134/S0023158412020164
Потемкин Д.И., Сапарбаев Э.С., Задесенец А.В. // Кат. в пром. 2017. № 5. С. 383. https://doi.org/10.18412/1816-0387-2017-5-383-389
Коренев С.В., Венедиктов А.Б., Шубин Ю.В. и др. // ЖСХ. 2003.Т. 44. № 1. С. 58.
Шубин Ю.В., Задесенец А.В., Венедиктов А.Б., Коренев С.В. // ЖНХ. 2006. Т. 51. № 2. С. 245.
Фесик Е.В., Буслаева Т.М., Мельникова Т.И., Тарасова Л.С. // Неорган. материалы. 2017. Т. 53. № 10. С. 78.
Фесик Е.В., Буслаева Т.М., Мельникова Т.И., Тарасова Л.С. // Там же. 2018. Т. 54. №. 12. С. 1–10.
Диаграммы состояния двойных металлических систем: Справочник: в 3 т.: Т. 2. Под общ. ред. Н.П. Лякишева. М.: Машиностроение. 1997. 1024 с.
Благородные металлы. Справ. изд. / Под ред. Е.М. Савицкого М.: Металлургия, 1984. 592 с.
Boultif A., Louer D. // J. of Appl. Cryst. 2004. V. 37. P. 724.
Гринвуд Н., Эрншо А. Химия элементов. Том 2. М.: Бином, 2008. 670 с.
Неорганические соединения хрома: Справ. / Сост.: Рябин В.А., Киреева М.В., Берг Н.А. и др. Л.: Химия, 1981. 208 с.
Неорганическая химия: в 3 томах / Под ред. Третьякова Ю.Д. Т. 3. Кн. 1. Химия переходных элементов. М.: Академия, 2007. 352 с.
Смирнов И.И., Рюмин А.И., Блохина М.Л. // ЖНХ. 1985. Т. 30. № 12. С. 3139.
Wang D., Flanagan T.B., Balasubramaniam R., Shanahan K. // J. All. and Comp. 2005. V. 404–406. P. 38. https://doi.org/10.1016/j.jallcom.2004.10.082
Бокий Г.Б. Кристаллохимия М.: Наука, 1971. 400 с.
Raub E., Mahler W. // Zeitschrift fuer Metallkunde. 1954. V. 45. P. 648.
van Reuth E.C., Waterstrat R.M. // Acta Crystallographica B. 1968. V. 24. P. 186.
Antolini E. //Applied Catalysis B: Environmental. 2017. V. 217. P. 201.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии