Журнал физической химии, 2020, T. 94, № 11, стр. 1678-1684
Адсорбционно-структурные свойства порошка АСД-4 после модификации поверхности формиатами Mn, Fe, Co, Ni
А. В. Рябина a, *, В. Г. Шевченко a
a Российская академия наук, Уральское отделение, ФГБУН Институт химии твердого тела
620219 Екатеринбург, Россия
* E-mail: anna-ryabina@yandex.ru
Поступила в редакцию 17.01.2020
После доработки 05.03.2020
Принята к публикации 17.03.2020
Аннотация
Методами низкотемпературной адсорбции азота, рентгенофазового анализа (РФА), электронной микроскопии проанализированы физико-химические свойства (морфология, текстура, фазовый состав, удельная поверхность, пористость) ультрадисперсного порошка АСД-4 и продуктов взаимодействия нанопорошка АСД-4 с формиатами Mn, Fe, Co, Ni. Приведены результаты исследования морфологии и фазового состава продуктов окисления, рассчитана удельная поверхность и пористость порошков. Обсуждаются особенности изотерм адсорбции исследуемых образцов после модификации формиатами с точки зрения соответствия их определенному типу согласно рекомендациям Международного союза по теоретической и прикладной химии (IUPAC), а также определенному виду пористости. Согласно данным пористости наибольшей адсорбционной активностью обладают образцы АСД-4 + 2%Mn и АСД-4 + 2%Ni. Удельная поверхность АСД-4 + 2%Mn составила 19.7907 м2/г, для АСД-4 + 2%Ni 10.1244 м2/г. Образец АСД-4 + 2%Mn имеет большее количество пор смешанной формы (щелевидные и цилиндрические) с шириной порядка 48.7234 и 44.2675 Å для АСД-4 + 2% Ni. Объем пор составил соответственно 0.028250 см3/г для АСД-4 + 2%Mn и 0.012156 см3/г для АСД-4 + 2%Ni.
В последние годы, в связи с активным развитием технологии селективного лазерного сплавления (СЛС) для 3D-печати изделий специального назначения авиационной и космической техники, а также получения материалов и изделий медицинского назначения [1], возникла потребность в аттестации и сертификации порошков алюминия и сплавов на его основе. Совершенствование технологии СЛС требует поиска модификаторов поверхности частиц порошков для оптимизации эксплуатационных характеристик изделий. При этом основной задачей модифицирования является разрушение оксидных оболочек, препятствующих консолидации частиц порошка в моменты плавления и последующей кристаллизации.
При стандартных условиях (а также на воздухе) поверхность металлического алюминия самопроизвольно окисляется, что объясняется большим отрицательным изменением свободной энергии Гиббса. Введение химически активных добавок снижает защитные характеристики барьерного слоя оксида алюминия на поверхности частиц. Так среди существующих методов активации порошков алюминия заслуживает внимания подход, основанный на использовании добавок оксидов MnO2, Fe2O3, NiO являющихся сильными окислителями и направляющими реакцию на поверхности по термитному типу [2].
Характерной особенностью переходных металлов является незавершенность их электронных d-оболочек. Наличие свободных валентностей на поверхности определяет их специфические химические, многие физические, каталитические свойства, прежде всего, их адсорбционные свойства [3]. Переходные металлы являются активными катализаторами в подавляющем большинстве окислительно-восстановительных реакций. Наиболее каталитически активны переходные металлы 8 группы: среди них Co, Fe, Ni и др. Железо например, является классическим катализатором синтеза аммиака. Существенными преимуществами при высокой температуре обладает семейство катализаторов на основе оксидов марганца, которые проявляют различные термическую стойкость и сродство к кислороду. Образование высокотемпературных форм МnxOy не только обеспечивает термическую стабильность катализаторов, но и существенно повышает их реакционную способность [4–12].
В работе [13] исследовано влияние малых добавок оксидов марганца, железа, кобальта и никеля на окисление порошка алюминия марки АСД-4 при нагревании в воздушной среде. Показано что оксиды, образовавшиеся на поверхности порошка алюминия, при модификации порошка формиатами Mn, Fe, Co, Ni влияют на интенсивность его окисления за счет термитных реакций на поверхности частиц в процессе их нагрева. Кобальт известен как активный компонент каталитических систем в процессах синтеза жидких углеводородов по Фишеру–Тропшу. Исследования системы Co/Al2O3 показали наличие сильного взаимодействия металл-носитель. Было установлено [14–16] что на электронное строение металлического компонента системы заметно влияют взаимодействия с носителем следующих типов: металл-поверхностные гидроксильные группы, металл-основные центры и металл-льюисовские центры. Становится очевидным, что свойства носителя во многом определяют поведение всей системы.
Направленность, избирательность и эффективность адсорбционных и каталитических процессов во многом определяются структурой и природой веществ, применяемых в качестве адсорбентов и катализаторов. Поскольку химическая природа поверхности реальных адсорбентов и катализаторов характеризуется неоднородностью, которая индуцируется взаимодействием между адсорбированными частицами, то избирательность и результативность работы этих адсорбентов и особенно катализаторов будут зависеть от распределения активных мест по их доступной поверхности. Поэтому, зная величину удельной поверхности, ее природу и геометрическую характеристику, можно не только предвидеть поведение адсорбента и катализатора и определить роль их в осуществлении того или иного процесса, но и путем химического воздействия изменить их свойства в желаемом направлении. Величина поверхности одна из главных характеристик адсорбционных и каталитических свойств твердого тела, функционально связана с его пористостью, определяющей доступность поверхности для адсорбирующихся молекул.
В настоящей работе приведены результаты исследования адсорбционных свойств порошка сплава алюминия с Mn, Fe, Co, Ni 2% каждого, проанализированы распределение частиц сплавов по размерам, морфология и фазовый состав продуктов активации порошка алюминия формиатами Mn, Fe, Co, Ni.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В эксперименте использован порошок алюминия марки АСД-4, полученный методом распыления расплавленного металла азотом. Содержание активного металла составило 98.7 ± 0.5%. Методика модифицирования порошка алюминия марки АСД-4 формиатами Mn, Fe, Co, Ni подробно описана в работе [13]. Адсорбционные измерения проводили на адсорбционном анализаторе Gemini VII 2390 принцип действия которого основан на адсорбции и десорбции газа на внешней и внутренней поверхностях (в порах) исследуемых образцов дисперсных и пористых веществ и материалов при температуре жидкого азота. Азот является наиболее широко распространенным газом, который используют для определения площади поверхности, так как он показывает промежуточные значения для константы С (50–250) для большинства твердых поверхностей, предотвращая как локальную адсорбцию, так и поведение газа как двумерного в области значений относительного давления Р/Рs = 10~3–0.999. Диапазон измерения этим методом удельной поверхности от 0.01 до 4000 м2/г, погрешность измерения не более 5%. Всю серию измерений проводили в одной и той же измерительной бюретке. Расчет удельной поверхности подробно описан в работе [17]. До и после эксперимента все образцы взвешивались на электронных весах высокой точности марки Shimadzu AUW 120D.
Форма и размер частиц порошка являются важнейшими структурообразующими характеристиками. Знание распределения частиц по размерам важно для понимания физических и химических свойств материала. Размер частиц влияет на реакционную способность твердых тел, участвующих в химических реакциях, определяет величину удельной поверхности, а плотность их упаковки – объем и радиус пор. Морфологию частиц анализировали на растровом электронном микроскопе JEOL JSM-6390LA с энергодисперсионным рентгеновским анализатором (EDS). Распределение частиц по размерам на лазерном гранулометре Horiba LA-950.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Сила адсорбционного взаимодействия поверхности адсорбента с парами адсорбата оценивалась по характеру начального участка экспериментальной изотермы адсорбции при низких относительных давлениях пара азота (Р/Р0 < 0.2) при незначительной степени заполнения адсорбционных центров.
Изотермы адсорбции образцов АСД-4, АСД-4 + + 2%Co, Fe (рис. 1) принадлежат ко второму типу по классификации БДДТ (классическая классификация изотерм адсорбции–десорбции Брунауэра, Деминга, Деминга и Теллера согласно рекомендациям Международного союза по теоретической и прикладной химии (IUPAC)) [18] что соответствует непористому или макропористому телу, этот тип изотерм представляет свободную моно-полислойную адсорбцию. Адсорбционные ветви при Р/Р0 = 1 практически совпадают с вертикальной линией что характеризует макропористые тела. Форма изотермы согласуется с представлением о системе рыхло упакованных непористых частиц с размерами порядка нескольких микрон.
Рис. 1.
Изотермы адсорбции порошка: а – АСД4, АСД4 + 2% (Fe, Co, Ni, Mn) , б – АСД-4, АСД4 + + 2%(Fe, Co).

На изотермах (рис. 1а) азот слабо адсорбируется что выражается в уменьшении наклона изотермы в начальной области, до тех пор, пока Р/Р0 не достигнет достаточно большой величины (Р/Р0 = 0.8). Затем кривая резко поднимается вверх и при Р/Р0 = 1 достигает предельной адсорбционной емкости. Наблюдается сдвиг участка резкого подъема изотермы вправо. Слабый гистерезис АСД-4 + 2%Co свидетельствует о капиллярной конденсации, вероятно, вблизи точек контакта соприкасающихся сферических частиц. Для образца поры представляют зазоры между частицами скелета.
Проблема капиллярной конденсации в промежутках между сферическими частицами более детально изучена Карнауховым и Киселевым [19], которые показали, что сначала капиллярная конденсация происходит вблизи точек соприкосновения частиц, а на следующей стадии седлообразные мениски соединяются вместе. Удельная поверхность образцов составила 0.7728 м2/г для АСД-4, 1.4482 м2/г для АСД-4 + 2%Fe, 0.9492 м2/г для АСД-4 + 2%Co.
Для изотерм АСД-4 + 2%Mn, Ni характерно увеличение подъема изотермы адсорбции в мономолекулярной области, что говорит о сильном взаимодействии адсорбат–адсорбент, видимо частицы образцов обладают повышенной поверхностной свободной энергией и соответственно адсорбционной способностью. Адсорбционная ветвь образцов выпуклая при малых относительных давлениях. В области насыщения изотерма имеет характерный изгиб, обусловленный переходом полимолекулярной адсорбции в капиллярную конденсацию. Образцы согласно рекомендациям Международного союза по теоретической и прикладной химии (IUPAC) [18] соответствуют 4 типу по классификации БДДТ. Модифицирование частиц порошка АСД-4 + 2%Mn, Ni приводит к резкому увеличению удельной площади поверхности до 19.7907 м2/г для АСД-4 + 2%Mn и 10.1244 м2/г для АСД-4 + 2%Ni. Точность определения удельной поверхности твердых тел во многом зависит от правильного выбора пары адсорбат-адсорбент. При этом адсорбат как правило должен обладать химической инертностью к определяемым поверхностям, небольшим размером молекул и большой теплотой адсорбции.
Петля гистерезиса на изотермах в процессе десорбции смыкается ранее, чем относительное давление достигнет величины 0.3, что показывает отсутствие микропор. Изотермы адсорбции в обоих случаях обратимы в мономолекулярной области. Как известно [20], каждый тип петли гистерезиса связан с определенным типом пористой структуры. Согласно изотермам адсорбции форма гистерезисной петли соответствует щелевидным порам тип В согласно классификации де Бура. В щелевидных порах, открытых со всех сторон, заполнение осуществляется посредством формирования полимолекулярного слоя, который в определенный момент целиком заполняет пространство между стенками щели. В этот момент возникает мениск, и испарение в ходе десорбции будет контролироваться уже этим мениском. Для расчета размера пор целесообразнее брать десорбционную кривую в интервале относительных давлений от 0.95 до 0.3, так как именно она соответствует полному смачиванию стенок пор [18–21].
Алгоритм большинства современных методов расчета пористости базируется на модификациях численного решения уравнения Уилера [22]. Одной из таких модификаций является теория Баррета, Джойнера и Халенды (метод БДХ) [18]. Данные по пористости получены этим методом. Для полной характеристики адсорбционных свойств сорбента необходимо иметь представление также о распределении объема пор по величинам их радиусов. Радиус кривизны мениска или цилиндрического пространства между адсорбционными пленками для n-го этапа десорбции, соответствующего относительному давлению $P{\text{/}}{{P}_{0}}$, выражается уравнением Томсона–Кельвина [18, 23–26]:
где $\sigma $ – поверхностное натяжение жидкости, пар которой адсорбируется, ${{V}_{m}}$ – молярный объем жидкого азота, $T$ – температура кипения азота (77К), $P{\text{/}}{{P}_{0}}$ – относительное давление азота, $d$ – диаметр пор по Кельвину.Поскольку перед началом конденсации имеет место некоторая адсорбция на стенках пор, $d$ не является истинным диаметром пор, тем более, что при десорбции адсорбированный слой остается на стенках при испарении.
Истинный диаметр пор был вычислен по уравнению:
где $t$ – толщина адсорбированного слоя.Толщина $t$ является одним из основных свойств адсорбированного слоя, зависит от состава поверхности, на которой происходит адсорбция, и состава адсорбируемого вещества:
где $a$ – количество адсорбированного вещества, ${{V}_{m}}$ – молярный объем адсорбированного вещества, $S$ – величина удельной поверхности.Математическая модель, выражающаяся уравнением Томсона-Кельвина выведенная для цилиндрических пор также справедлива и для щелевидных капилляров и для открытых пор любой формы, поскольку к моменту конденсации в щелеобразных углублениях также происходит округление сечения пор и эффективный радиус будет аналогичен действительной величине [27–32].
По результатам эксперимента были построены дифференциальные кривые распределения объема пор по их эффективным диаметрам (рис. 2а– 2г).
Рис. 2.
Дифференциальные кривые распределения объема пор по их эффективным диаметрам АСД-4 + 2% (а) Fe, (б) Co, (в) Ni, (г) Mn.
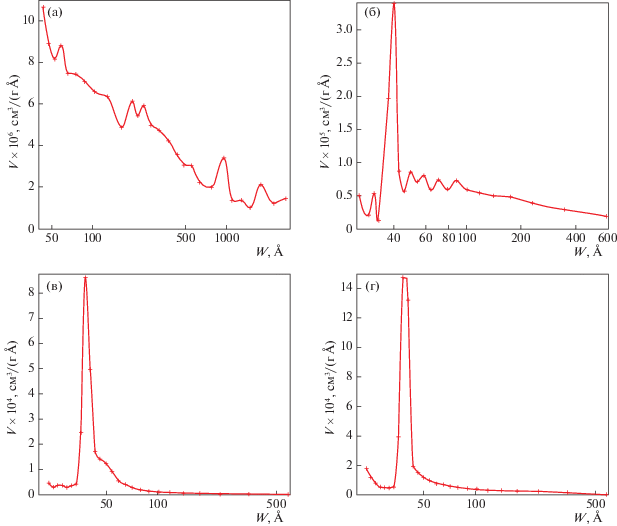
Дифференциальные кривые распределения объема пор по диаметрам для исследованных образцов различаются в значительной степени (рис. 2а–2г). Образцы АСД-4 + 2%Fe и АСД-4 + 2%Co обладают близкими величинами объемов пор, но разным характером их распределения по величинам эффективных диаметров. Наибольшей неоднородностью характеризуется образец АСД-4 + + 2%Fe, с размером пор преимущественно 194.1839 Å. Образец АСД-4 + 2%Co более однороден с размером пор шириной 93.9261 Å. Объем пор составил 0.006813 см3/г для АСД-4 + 2%Fe, и 0.005157 см3/г для образца АСД-4 + 2%Co. Кривые распределения объема пор по величинам эффективных диаметров для АСД-4 + 2%Mn, Ni обладают более узким пиком, что говорит о достаточно однородной пористости. Образец АСД-4 + + 2%Mn имеет большее количество пор с шириной порядка 48.7234 и 44.2675 Å для АСД-4 + 2% Ni. Объем пор составил соответственно 0.028250 см3/г для АСД-4 + 2%Mn и 0.012156 см3/г для АСД-4 + 2%Ni. Для порошка АСД-4 пористость составила 0.002231 см3/г, ширина пор 366.347 А. Для данного образца характерна рыхлая структура с большими расстояниями между частицами – возможно, этому способствует электростатическое взаимодействие между частицами, препятствующее более плотной усадке порошкообразных частиц.
Электронно-микроскопическое исследование порошка АСД-4 и АСД-4 + 2%Mn, Fe, Co, Ni показало, что порошки состоят из сферических частиц правильной формы (рис. 3) с примерно одинаковым средним размером частиц около 5–7 мкм.
Частицы АСД-4 модифицированные формиатами показаны на примере АСД-4 + 2%Fe (рис. 3б). Как видно частицы сохранили свою сферическую форму.
Фазовый состав исследуемых образцов определяли методом рентгенофазового анализа (РФА) на дифрактометре XRD-6000, “Shimadzu” Япония (CuKα-излучение, λ = 1.5418 Å) с использованием банка картотеки стандартов JCPDS. Диапазон углов сканирования составлял от 1 до 100°, скорость – 1 град/мин.
Фазовый состав порошка АСД-4 представлен двумя фазами Al и Al2O3. Хорошо окристаллизованный и однородный по параметрам решетки материал дает узкие и высокие дифракционные пики (рис. 4).
Наиболее трудно однозначно идентифицировать вещества, кристаллизующиеся в кубической сингонии, особенно если такое вещество присутствует в небольшом количестве (большинство его немногочисленных линий может совпадать с линиями основных фаз смеси) [33]. Следует отметить, что на дифрактограммах порошка АСД-4 модифицированного формиатами отсутствуют специфические пики, отвечающие введенным модифицирующим агентам. Это обусловлено малым относительным количеством (около 2 мас. %) добавок, на рентгенограммах четко проявляются линии алюминия, составляющего основную массу образцов.
Таким образом, модифицирующее действие формиата обуславливает увеличение удельной поверхности образцов. Наряду с удельной поверхностью объем переходных пор играет существенную роль в поглощении вещества, а, следовательно, характеризует адсорбционную активность адсорбента. Согласно данным пористости наибольшей адсорбционной активностью обладает АСД-4 + 2%Mn и АСД-4 + 2%Ni. Таким образом, целенаправленно путем внесения модификаторов можно формировать поверхность, адсорбционный слой носителя, состав и структуру активированных порошков алюминия.
Работа выполнена по госбюджетной теме № АААА-А19-119031890028-0.
Список литературы
Olacanmi E.O., Cohrane R.F., Dalgarno K.W. // Progress in Materials Science. 2015. V. 74. P. 401.
Poda A.R., Moser R.D., Cuddy M.F. et al. // J. Nanomater. Mol. Nanotechnol. 2013. V. 2. P. 100.
Ахметов С.А. Физико-химические технологии глубокой переработки нефти и газа. Уфа: Изд-во УГНТУ, 1997. 304 с.
Пармон В.Н., Исмагилов З.Р., Фаворский О.Н. и др. // Вестн. РАН. 2007. Т. 77. № 9. С. 819.
Стайлз Э.Б. Носители и нанесенные катализаторы: теория и практика / Под ред. А.А. Слинкина. М.: Химия, 1991. 240 с.
Ведь М.В., Сахненко Н.Д. // Коррозия: материалы, защита. М.: ИФХЭ РАН, 2007. № 10. С. 36.
Эмсли Дж. Элементы. М.: Мир, 1991.
El-Shobaky H.G. // Applied Catalysis A: General. 2004. V. 278. № 1. P. 1.
Ефремов B.H., Голосман Е.З. // Кинетика и катализ. 2006. Т. 47. № 5. С. 805.
El-Shobaky H.G., Fahmy Y.M. // Applied Catalysis B: Environmental. 2006. V. 63. P. 168.
Meille V. // Applied Catalysis A: General. 2006. V. 315. P. 1.
Avila P., Monies M., Miro E.E. // Chemical Engineering Journal. 2005. V. 109. № 1–3. P. 11.
Шевченко В.Г., Красильников В.Н., Еселевич Д.А., Конюкова А.В. // Физико-химия поверхности и защита материалов. 2019. Т. 55. № 1. С. 25.
Михайлов М.Н., Жидомиров Г.М., Крылова А.Ю. // Изв. АН. Сер. хим. 2005. С. 2194.
Lapidus A., Krylova A., Kazanskii V. et al. // Appl. Catal. A Gener. 1991. V. 73 (1). P. 65.
Селезнев А.С., Петров Л.А., Чупахин О.Н. и др. // Журн. прикл. химии. 2009. Т. 82. Вып. 5. С. 766.
Рябина А.В., Кононенко В.И. // Изв. вузов. Порошковая металлургия и функциональные покрытия. № 2. 2014. С. 3.
Грег С., Синг К. Адсорбция. Удельная поверхность. Пористость / Пер. с англ. 2-е изд. М.: Мир, 1984. 306 с.
Карнаухов А.П., Киселев А.В. // Журн. физ. химии. 1957. Т. 31. Вып. 12.
De Boer J.H. The structure and properties of porous Materials / Butterworth, London, 1958.
Efremov D.K., Fenelonov V.B. // Elsevier. 1991. P. 115.
Wheeler A. // Advances in Catalysis. V. III. 1952. P. 249.
Толмачев А.М. // Физико-химия поверхности и защита материалов. 2010. Т. 46. № 3. С. 242.
Экспериментальные методы в адсорбции и молекулярной хроматографии / Под ред. А.В. Киселева и В.П. Древинга. М.: Изд-во МГУ, 1973. 448 с.
Авгуль Н.Н., Джигит О.М., Киселев А.В. // Журн. физ. химии. 1955. Т. 29. С. 316.
Fisher L.R., Israelachvili J.N. // J. Colloid Interface Sci. 1981. V. 80. P. 528.
Thommes M. // Chemie Ingenieur Technik. 2010. V. 82. № 7. P. 1059.
Monson P.A. // Langmuir. 2008. V. 24. P. 12295.
Ball P.C., Evans R. // Ibid. 1989. V. 5. P. 714.
Evans R. // Phys. Condens. Matter. 1990. V. 2. P. 8989.
Ravikovitch P.I., Neimark A.V. // Langmuir. 2000. V. 16. P. 2419.
Valiullin R., Naumov S., Galvosas P. et al. // Nature. 2006. V. 443. P. 965.
Ковба Л.М. Рентгенография в неорганической химии / Л.М. Ковба. М.: МГУ, 1991. 255 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии




