Журнал физической химии, 2020, T. 94, № 2, стр. 265-275
Релаксация физико-химических процессов при химическом синтезе наночастиц серебра в обратно мицеллярных растворах
В. И. Кузьмин a, А. Ф. Гадзаов a, Д. Л. Тытик b, *, С. А. Бусев b, В. В. Высоцкий b, О. В. Суворова b, А. А. Ревина b
a Российский технологический университет (МИРЭА)
119454 Москва, Россия
b Российская академия наук, Институт физической химии и электрохимии им. А.Н. Фрумкина
119991 Москва, Россия
* E-mail: dtytik@yandex.ru
Поступила в редакцию 25.03.2019
После доработки 25.03.2019
Принята к публикации 14.05.2019
Аннотация
Получены экспериментальные результаты по кинетике изменения оптических свойств обратно-мицеллярной системы (ОМС) состава: Аэрозоль ОТ (диоктилсульфосукцинат натриевая соль)/изооктан/Qr (кверцетин)/Ag+) в процессе химического синтеза наночастиц (НЧ) Ag. По кинетическим данным оптического поглощения света ОМС при длине волны λ = 432 нм с хронометрированным разрешением 0.14 с и 1 с рассчитаны границы стадий формирования НЧ Ag (уровень достоверности не менее 0.99). Определены времена релаксации (почти периоды) в ОМС, которые можно использовать для оценки параметров управления кинетикой на определенных стадиях химического синтеза НЧ металлов.
ВВЕДЕНИЕ
Физико-химические периодические процессы играют важную роль при формировании коллоидных систем как в природе [1], так и в нанотехнологиях [2]. Современные оптические приборы высокого разрешения чувствительны даже к незначительным изменениям оптических свойств коллоидов. Необходимо отметить, что математические методы обработки экспериментальных результатов скорее ориентированы на осреднение (сглаживание) особенностей спектра и не учитывают наличие “малых” нелинейных колебаний в сигнале. Это часто приводит к тому, что при построении модели физико-химических процессов, например, на основе спектров оптического поглощения (ОП) не рассматривается возможность учета явлений “микромасштаба”. По-видимому, в этом заключается одно из противоречий современной нанотехнологии – не всегда удается сопоставить адекватную детальную модель процесса с результатами измерений на приборах высокого разрешения. Тем не менее, в последние годы появились работы, где эта проблема частично решается, например, методом фликкер-шумовой спектроскопии [3].
Если при анализе нелинейных сигналов отказаться от процедуры его аппроксимации в том или ином базисе функций, то возникает проблема – какая характеристика может определять основное свойство сигнала? Этой характеристикой является почти период11. Для определения почти периода/периодов в сигнале общего вида (колебания с трендом) необходимо корректно извлечь тренд и выделить нелинейные колебания с нулевым средним значением. Когда же для них будут определены все почти периоды, можно вернуться к проблеме “формы” колебаний, вычислив, например, для первичного сигнала скользящую среднюю. При этом базой осреднения явятся реальные почти периоды, относящиеся к некоторым физико-химическим процессам. Определенный интерес также представляет и “привязка” колебательных характеристик процесса по фазе [4].
Иными словами, наличие “малых” колебаний физико-химических свойств системы вызывает закономерный вопрос об их природе – либо это случайные флуктуации, либо колебания имеют регулярный характер и соответствуют некоторым “микропроцессам” как это показано в работах [4, 5]. Следовательно “быстрые” периодические процессы, происходящие на фоне более “медленных” процессов, можно использовать для определения взаимосвязи микро- и макросвойств системы. При этом использование специальной функциональной метрики [5, 6] позволяет также определить набор почти периодов, соответствующих временам релаксации процессов разного пространственно-временного масштаба. Применительно к броуновскому движению вопрос о механизмах согласования процессов, происходящих на микро- (например, молекулярном) и макро- (коллоидная частица) уровнях был решен в [7, 8].
Обычно в термодинамике процессы перехода, например, коллоидных систем в равновесное состояние характеризуются процессами релаксации, в основном связанными с переносом массы, импульса или энергии [9]. Актуальной задачей нанотехнологии является исследование релаксационных характеристик эволюционирующих коллоидных систем, поскольку это позволяет устанавливать взаимосвязи не только между физико-химическими процессами на микро- и макроуровнях, но и прогнозировать область/области стабильного существования системы в целом.
В данной статье исследована кинетика изменения интенсивности поглощения света (с высоким хронометрированным разрешением – 0.14 и 1 с) при длине волны λ = 432 нм при химическом синтезе НЧ Ag в обратно мицеллярном растворе (ОМР). Это позволило рассчитать моменты времени наступления и смены “отдельных” стадий реакции. Длина волны выбрана исходя из наличия соответствующего максимума в спектре ОП света ОМС с НЧ Ag. Для обработки полученных экспериментальных данных использован алгоритм разделения кинетической кривой интенсивности поглощения света на выбранной длине волны на “медленную” (тренд) и “быструю” (малые колебания относительно тренда) компоненты [10]. При анализе “формы” колебаний относительно тренда на разных стадиях реакции химического синтеза в ОМС НЧ Ag использованы модели известные в математической физике [11]. Представлен набор почти периодов (времена релаксации), характеризующие протекание физико-химических процессов в ОМР разного пространственно-временного масштаба.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объектом исследования являлась ОМС состава AgNO3/H2O/Qr/Аэрозоль ОТ/изооктан. Химический синтез наночастиц Ag [12, 13], основан на восстановлении ионов металлов в ОМР в присутствии восстановителя, природного пигмента кверцетина (Qr) – полифенольного флавоноида и кислорода. Процесс химического синтеза можно представить следующей схемой: Ag+ + + [Qr+δ…${\text{O}}_{2}^{{ - \delta }}$] $ \to [{\text{A}}{{{\text{g}}}^{ + }}$…Qr+δ…${\text{O}}_{2}^{{ - \delta }}$] $ \to $ [Qr+δ…${\text{O}}_{2}^{{ - \delta }}$] + + Ag0$ \to $ … ${\text{Ag}}_{n}^{{m + }}$.
ОМР, содержащий ионы Ag+, готовился введением в 0.15 М раствор АОТ/изооктан 0.3 М водного раствора соли AgNO3 в количестве, соответствующем степени гидратации ω = [H2O]/[АОТ] = 4, которое было выбрано как оптимальное по данным нашей работы [10]. Раствор Qr приготовлен с концентрацией 150 мкМ.
Конкретные параметры синтеза следующие: раствор (Aэрозоль OT/изооктан/Qr) объемом 1.5 мл смешивался с 16.5 мкл водного раствора 0.3 М AgNO3 в кварцевой кювете с длиной оптического пути (ДОП) 10 мм. Далее проводилось четырехкратное забор/сброс полученной смеси наконечником пипетдозатора, и кювета размещалась в кюветном отделении прибора. Детали синтеза приведены в работе [10].
Для исследования кинетики изменения интенсивности поглощения света ОМС использовался спектрофотометр Hitachi 3310. Время непрерывной регистрации кинетики определялось общим ограничением числа отсчетов (3600) и выбранным интервалом между соседними измерениями (0.14 с–30 с). При интервале записи 0.14 с оно составляет примерно 504 с. Для продолжения регистрации интенсивности поглощения света необходимо заново активизировать программу измерения спектрофотометра (загрузка параметров занимает 9 с), что и определяет “слепые” интервалы в кинетических данных.
Поскольку интенсивность поглощения света образцом в кварцевой кювете (ДОП 10 мм) довольно быстро достигает рекомендуемого разработчиками прибора ограничения (Abs = 4), мы ограничились длительностью эксперимента примерно 4100 с. В эксперименте также использовалась кварцевая кювета с ДОП 2 мм для записи кинетики с хронометрированным разрешением 1 с, при этом время регистрации составило примерно 180 мин (3 цикла по 3600 точек с “пробелами” между циклами 9 с). Отметим, что при длительном воздействии света на образец необходимо было убедиться в том, что он не оказывает влияния на ход реакции химического синтеза НЧ Ag. Для этого часть исходного ОМР сохранялась на воздухе вне кюветного отделения прибора. После завершения эксперимента был проведен сравнительный анализ спектров оптического поглощения этими образцами (при одинаковых условиях регистрации) и установлена их практическая идентичность.
Кроме того, проведены эксперименты по динамическому рассеянию света (ДРС, Malvern ZS, λ = 633 нм) образцами как в статике – после извлечения образцов из спектрофотометра, так и в динамике, когда исследовалась эволюция размеров НЧ в образцах. Время между измерениями составляло 10 с, были получены данные согласующиеся с приведенными в [14]. Средний размер обратных мицелл (ОМ) в ОМР через 180 мин от начала смешения компонентов реакции составил примерно 16÷18 нм. Поскольку коллоидные системы продолжают эволюционировать во времени, изменяя свои физико-химические свойства, то проводился контроль ОМС через продолжительные временные интервалы (несколько суток). Маркером степени завершения реакции химического синтеза НЧ Ag явилось прекращение заметного роста интенсивности ОП для полосы (полос), соответствующей электронному “плазмонному” резонансу НЧ Ag или его металлокомплекса (λ = 410 – 450 нм).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Кинетика22 с хронометрированным разрешением 0.14 с. На рис. 1а представлены исходные кинетические данные с временным разрешением 0.14 с изменения интенсивности поглощения света на длине волны λ = 432 нм образцом в кювете с ДОП 10 мм. Следует отметить, что на начальном участке для колебательной компоненты кинетической кривой (см. врезку на рис. 1б в увеличенном масштабе) есть разрывы (типа разрывов функции 1 рода), при этом отклонения от тренда в местах разрывов указывают пиковые значения. Как правило, общая кинетика процессов, зарегистрированных с высоким разрешением, представлена нелинейными колебаниями с трендом. Детализация характеристик кинетической кривой проведена с использованием модели разделения быстрых и медленных движений (Приложение 1 и [5]). При этом тренд характеризует механизмы “медленных” процессов, определяемые большими характерными временами, тогда как колебания связаны с протеканием “быстрых” процессов.
Рис. 1.
Кинетика изменения интенсивности оптического поглощения света на длине волны λ = 432 нм с хронометрированным разрешением 0.14 с в процессе химического синтеза НЧ серебра в ОМР (а). Прямоугольником выделен начальный участок кривой и стрелкой он указан в увеличенном масштабе. Колебания относительно нуля (χ) после извлечения тренда (см. а) из исходных данных (б). Прямоугольником выделен начальный участок кривой и стрелкой он указан в увеличенном масштабе.

В результате исключения тренда из исходной кинетической кривой по формуле
где $\tau $ – величина фиксированного сдвига по времени, а $D_{{t - \tau }}^{*},\;D_{t}^{*},\;D_{{t + \tau }}^{*}$ – значения ОП в соответствующие моменты времени [5] имеем колебания с нулевым средним значением, представленные на рис. 1б.Вид начального участка кинетической кривой (от 0 до 3600 × 0.14 с = 504 с) указывает на ее возможную принадлежность к кривым контролируемого (ограниченного) роста. Отметим, что интенсивность поглощения света образцом зависит от нескольких параметров, отраженных в формуле: I = I0 × 10–εcl (I0 – начальная интенсивность света, ε – молярный коэффициент экстинкции; с – концентрация раствора; l – длина оптического пути). Поэтому на этом этапе оценка, например, концентрации соответствующего компонента реакции в текущий момент времени может носить лишь качественный характер.
Анализ кинетической кривой интенсивности поглощения света (рис. 1а) в функциональных координатах (построение анаморфозы33) показал, что начальный участок может быть представлен моделью Гомперца $\frac{{dy}}{{dt}} = - ky\ln \frac{y}{{{{y}_{\infty }}}}$ (Приложение 2) [5] с величиной достоверности линейной аппроксимации44 R2 = 0.99. Для этой модели известны особые (критические) точки [5], выраженные в единицах измерения, определяемых пределом роста во времени для кинетической кривой ($D{\text{*}}$ = y, $D_{\infty }^{*} = {{y}_{\infty }}$) и параметром модели k. При этом характерное время (параметр релаксации) процесса химического синтеза НЧ Ag на начальном участке (первые 504 с) определяется по формуле
Использование параметра релаксации (86 с) позволило маркировать положения особых (критических) точек кинетической кривой на начальном этапе химического синтеза НЧ Ag (Приложение 2 ), согласующиеся с изменением характера колебаний относительно тренда (рис. 2). Для модели Гомперца они отстоят на характерное время процесса (86 с) влево и вправо от точки перегиба интегральной кривой и соответствуют точкам перегиба на кривой скорости этой кривой. Таким образом, на начальном участке кинетической кривой можно выделить следующие “стадии”: 1-я от 0 до 86 с, 2-я 86 – 169 с, 3-я 169 – 252 с и 4-я стадия 252 – 373 с). Сама точка перегиба интегральной кинетической кривой также маркирует границу между стадиями и соответствует максимуму на кривой скорости (см. Приложение 2).
Рис. 2.
Фрагмент колебательной компоненты относительно нуля (χ) для кинетической кривой после извлечения тренда (увеличенный масштаб). Вертикальными линиями маркированы положения особых точек модели Гомперца (t1, ${{t}_{*}}$, t2 – см. Приложение 2), расстояние между которыми равно характерному времени процесса или обратному значению параметра k модели Гомперца.
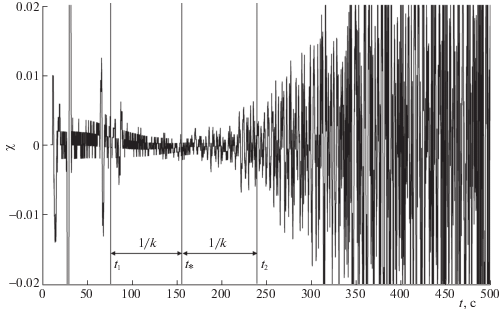
Следует отметить, что идентификация типа физико-химических процессов, определяющих каждую из выделенных стадий при использовании только спектрофотометрических данных, имеет статус предположения. По нашему мнению, на первых двух стадиях идет активный процесс солюбилизации обратных мицелл, что проявляется, в частности, фазой “мутности с молочной окраской” ОМР. Затем раствор на короткое время становится прозрачным, в дальнейшем у него появляется слабая золотистая окраска. Это свидетельствует о появлении в ОМР тройного металлокомплекса и начале химического синтеза НЧ Ag, переходящая на 3-й и 4-й стадиях в интенсивную окраску красного оттенка. Для выделенных стадий процесса определены почти периоды (табл. 1), соответствующие течению некоторых описанных “микропроцессов” в ходе химического синтеза. Первая стадия на этом этапе анализа исключена из детального рассмотрения, поскольку она относится к переходному процессу (см. рис. 1а).
Таблица 1.
Почти периоды для начальных стадий процесса (400 с)
| Номер стадии | Почти период, с | ||||||
|---|---|---|---|---|---|---|---|
| 2 | 1.4 | 9.9 | 12 | 27.6 | |||
| 3 | 1.5 | 8.5 | 12.5 | 16.7 | 23.7 | ||
| 4 | 1.5 | 8.1 | 20.4 | 25.3 | 39.5 | ||
Отметим, что за рамками исследования остаются особенности кривой кинетики интенсивности поглощения света, связанные с колебаниями сигнала относительно тренда, индивидуальные для разных ее участков. В первом приближении эти колебания характеризуют процесс устойчивого типа, когда амплитуда колебаний уменьшается, в случае же нелинейных колебаний с растущей амплитудой – процесс неустойчивого типа, либо процесс стационарных нелинейных колебаний (при “постоянной” амплитуде). Мы связываем наличие того или иного типа колебаний на первом этапе (до 504 с) химического синтеза НЧ Ag в ОМР с доминирующим действием определенных физико-химических механизмов. Механизмы таких процессов, рассматриваемые в математической физике, представлены интегралами волнового уравнения (для временной компоненты – нелинейные колебания с “постоянной” амплитудой), а также композицией волнового и диффузионного уравнений для колебаний с экспоненциально меняющейся амплитудой (Приложение 3). Тогда можно предположить, что первые две стадии (до ~150 с) характеризуются композицией волновых и диффузионных процессов (солюбилизация ОМ, упругая деформация их оболочки, диффузия молекул воды внутрь ОМ и др.) (рис. 2). Затем начинают доминировать процессы, которые проявлены на кинетической кривой нелинейными колебаниями с возрастающей амплитудой (примерно до 350 с), которые сменяются колебаниями с достаточно стабильной амплитудой относительно основного тренда (после 350 с) (рис. 2).
Неожиданным оказался результат, связанный с определением для начального участка интегральной кинетической кривой (504 с) (рис. 3а) скорости, вычисленной (центральная разность) как эмпирическая производная (рис. 3б). Зависимость имеет бимодальный характер в окрестности особой точки (точка перегиба на интегральной кривой) и показывает явное рассогласование с теоретическим видом кривой скорости для средних значений (см. Приложение 2 , рис. 8 ). Такие эффекты были рассмотрены И.Р. Пригожиным [16, 17] как реализация флуктуаций при существовании разных механизмов кинетики процесса слева и справа от точки неравновесного “фазового” перехода, соответствующей точке максимума на кривой скорости. При этом сами положения точек t1 и t2 соответствуют не только особенностям кривой скорости, представленной эмпирической производной (рис. 3б), но и определяются механизмом релаксации процесса (параметр релаксации 86 с) на начальном этапе (до 504 с) химического синтеза НЧ Ag. По нашему мнению, бимодальный характер для скорости кинетической кривой изменения интенсивности поглощения света ОМС с высоким временным разрешением (0.14 с) позволяет сделать предположение о многостадийном механизме формирования НЧ Ag. Отметим, что после добавления водного раствора AgNO3 начинается активное проникновение в обратные мицеллы воды и ионов Ag, которые, встречаясь с оксокомплексом Qr [Qr+δ…${\text{O}}_{2}^{{ - \delta }}$], формируют тройной металлокомплекс [Ag+…Qr+δ…${\text{O}}_{2}^{{ - \delta }}$]. Например, в водно-спиртовых растворах этот тройной комплекс стабилен, а в водном пуле поляризованной воды обратной мицеллы – чрезвычайно лабилен. В этом случае, происходит перенос заряда и восстановление Ag+ с образованием Ag0, который участвует в дальнейших процессах агрегации и формировании НЧ Ag, ${\text{Ag}}_{n}^{{m + }}$. По-видимому, процессы переноса заряда протекают с высокой частотой обмена, что и может вызывать при взаимодействии со светом с характерной длиной волны флуктуации ОП в ОМС.
Рис. 3.
Начальный участок кинетической кривой (а); эмпирическая производная для кинетических данных (б). Вертикальными линиями маркированы положения особых точек модели Гомперца (t1, ${{t}_{*}}$, t2 – см. Приложение 2), расстояние между которыми равно характерному времени процесса или обратному значению параметра k модели Гомперца.

Модель ограниченного роста требует определения значения трех параметров, один из которых определяется как величина обратная почти периоду, второй (на уровне оценки) может быть получен по характеристике процесса на макро- уровне, соответствующий начальной точке появления в структуре колебаний данного почти периода. Третий параметр, соответствующий пределу роста, определяется анаморфозой модели ограниченного роста (рис. 4). Это показывает, что уже на уровне анализа характеристик тренда процесса выявляется значение времени, определяющее последовательность временных ритмов его кинетики.
Рис. 4.
Анаморфоза модели Гомперца для начального участка кинетической кривой интенсивности оптического поглощения образцом.
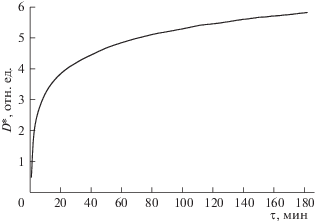
Кинетика с хронометрированным разрешением 1 с. На рис. 5 представлены данные кинетики изменения интенсивности поглощения света при химическом синтезе НЧ Ag в ОМР с хронометрированным разрешением 1 с (продолжительность регистрации примерно 180 мин). Поскольку использована кювета с ДОП 2 мм, то о характере изменения концентрации компонента химического синтеза можно судить непосредственно по изменению интенсивности поглощения света на выбранной длине волны. Отметим, что при выборе математической модели для описания кинетических данных используется общий подход, основанный на подборе подходящей анаморфозы. Предпочтение отдается модели с максимальным значением коэффициента достоверности (R2), вычисленным при линейной аппроксимации кинетических данных процесса в соответствующих функциональных координатах. Для данных рис. 5 оптимальная анаморфоза получается в двойных логарифмических координатах и при выборе значения ${{t}_{0}}$ (0.45 мин или 27 с55), обеспечивающего максимум коэффициента достоверности (R2 = 0.999). Физический смысл значения момента времени ${{t}_{0}}\; = \;27$ с еще предстоит выяснить.
Рис. 5.
Кинетика изменения интенсивности оптического поглощения света на длине волны λ = 432 нм с хронометрированным разрешением 1 с в процессе химического синтеза НЧ серебра в ОМР.
В итоге зарегистрированная кинетика изменения ОП света образцом описывается степенной функцией. Теперь можно оценить положения “внутренних” особых точек, характеризующих, по-видимому, локальные физико-химические механизмы отдельных стадий реакции синтеза НЧ Ag.
Для определения границ этих стадий на кинетической кривой ОП света образцом использован критерий R2, который максимизирован не для всей кинетики, а для ее кусочно-гладких участков. Причем последовательный поиск “гладких” участков осуществляется слева направо от самой правой точки графика последовательным добавлением точек слева к ветви графика с одновременной проверкой критерия R2. В табл. 2 представлены результаты определения границ “стадий” химического синтеза НЧ Ag по этому алгоритму (границы стадий обозначены стрелками на рис. 6).
Таблица 2.
Границы стадий химического синтеза НЧ Ag в ОМР (180 мин)
| Номер границы | $\ln (t - {{t}_{0}})$ [мин] | $t - {{t}_{0}}$, мин | t, мин |
|---|---|---|---|
| 1 | 0 | 1 | 1.5 |
| 2 | 0.91 | 2.5 | 2.9 |
| 3 | 1.3 | 3.7 | 4.1 |
| 4 | 3.9 | 48.4 | 48.9 |
| 5 | 5.1 | 167.3 | 167.8 |
Рис. 6.
Анаморфоза для исходных кинетических данных (рис. 5) в двойных логарифмических координатах. Стрелками указаны границы стадий химической реакции синтеза НЧ серебра в ОМР.

Также определены почти периоды для кинетических данных, составившие: 180, 220, 280, 300 и 320 с. Для физико-химической интерпретации этих релаксационных параметров процессов необходима дополнительная информация, которую предполагается получить в дальнейших исследованиях в рамках метода лазерной дифракции для ОМС в процессе химического синтеза НЧ серебра.
Сравнение кинетических данных с разным хронометрированным разрешением. Результат исключения тренда из кинетической кривой с хронометрированным разрешением 1 с в сопоставлении с кинетической кривой с разрешением 0.14 с (рис. 7) показывает согласованность положения особых точек модели Гомперца с изменением характера отклонений от тренда (для процесса продолжительностью 180 мин). Этим представлено качественное соответствие временных характеристик физико-химических процессов, происходящих в принципиально разных временных масштабах. В одном случае это проявляется на уровне особенностей тренда, а в другом на уровне отклонений от тренда (малые колебания). Точка t1 на графике (рис. 7) соответствует минимуму, точка t* завершает процесс резкого изменения отклонения от тренда, тогда как точка t2 соответствует переходу к колебаниям относительно постоянного уровня.
Рис. 7.
Сравнение данных двух кинетических экспериментов с разным хронометрированным разрешением 0.14 и 1 с. Представлены данные кинетики поглощения света (0.14 с) для начальной стадии эксперимента в сравнении с данными о колебаниях после извлечения тренда для кинетической кривой длительностью 180 мин (хронометрированное разрешение 1 с). Вертикальными линиями маркированы положения особых точек модели Гомперца (t1, t*, t2 – см. Приложение 2).

ЗАКЛЮЧЕНИЕ
При определении моментов смены “стадий” реакции химического синтеза НЧ Ag в ОМС были использованы, как свойства идеальных математических моделей (особые точки модели Гомперца), так и результаты эмпирической оценки границ “гладких” участков с помощью максимизации критерия достоверности R2 анаморфозы кинетической кривой процесса химического синтеза НЧ. В общем случае, в свойствах кинетических данных изменения интенсивности ОП выделены компоненты, относящиеся к протеканию медленных процессов в системе (на уровне изменения трендов) и быстрых процессов (уровень колебаний относительно тренда). Причем для анализа колебательных компонент процесса эффективным оказался почти периодический анализ, позволивший выделить набор почти периодов (параметр релаксации), характерных для ОМС в разные моменты ее эволюции. Отметим, что на данном этапе исследования выделенные моменты времени изменения оптических свойств ОМС, не всегда удается в полной мере соотнести с протеканием конкретного физико-химического процесса/процессов (например, солюбилизация ОМ, агрегация/дезагрегация ОМ и ряд других). Тем не менее, первый шаг в этом направлении сделан и на начальной стадии реакции определены границы, в которых преобладают диффузионные, либо волновые механизмы (или их комбинация). Кроме того, регистрация кинетики процесса синтеза на выбранной длине волны с хронометрированным разрешением 0.14 с привела к качественно новому результату – обнаружению неравновесного фазового перехода на начальной стадии химического синтеза в ОМС НЧ Ag.
В случае кинетических данных с хронометрированным разрешением 1 с и линеаризации их в двойном логарифмическом масштабе показано, что для их описания с высоким уровнем достоверности подходит степенная функция. Дальнейшая детализация кинетики этого процесса по критерию локальной максимизации коэффициента достоверности R2 позволила выделить на кинетической кривой ряд “особенностей”, которые, по-видимому, определяются сменой “стадий” химической реакции синтеза НЧ Ag.
В дальнейшем с увеличением пространственного разрешения оптических приборов при регистрации динамики ОМС разного пространственно-временного масштаба (метод лазерной дифракции), соответствующих выделенным во времени стадиям реакции будут сформулированы и адекватные физико-химические модели процессов.
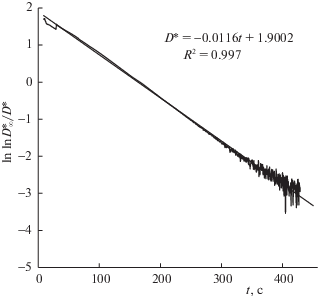
Рис. 9.
Логарифм модуля колебаний относительно нуля (χ), соответствующих отклонению от тренда (см. рис. 1б).

Список литературы
Шемякин Ф.М., Михалев П.Ф. Физико-химические периодические процессы. М.-Л.: Изд. АН СССР, 1938. 185 с.
Encyclopedia of Nanotechnology / Eds. Bharat Bhushan. Springer. 2012. P. 4427.
Тимашев С.Ф. Фликкер-шумовая спектроскопия. Информация в хаотических сигналах. М.: ФИЗМАТЛИТ, 2007. 248 с.
Кузьмин В.И., Гадзаов А.Ф., Тытик Д.Л. и др. // Коллоидн. журн. 2014. Т. 76. № 4. С. 477.
Кузьмин В.И., Тытик Д.Л., Гадзаов А.Ф. и др. Дискретность и непрерывность в свойствах физико-химических систем М.: Наука, ФИЗМАТЛИТ. 2014. 176 с.
Бор Г. Почти периодические функции М.: URSS. 2009. 128 с.
Эйнштейн А. К теории броуновского движения. Собр. соч. М.: Наука, 1966. Т. 3. С. 118.
Смолуховский М. О понятии случайности и о происхождении законов вероятностей в физике // УФН. 1927. Вып. 5. С. 329.
Товбин Ю.К. Малые системы и основы термодинамики. М.: ФИЗМАТЛИТ, 2018. 403 с.
Кузьмин В.И., Гадзаов А.Ф., Тытик Д.Л. и др. // Коллоид. журн. 2015. Т. 77. № 4. С. 477.
Фарлоу С. Уравнения с частными производными для научных работников и инженеров. М.: Мир, 1985.
Ревина А.А. Пат. РФ № 2312741 // Бюл. № 35. 20.12.2007.
Egorova E.M., Revina A.A. // Colloids and Surfaces A. 2000. V. 73. P. 87.
Кузьмин В.И., Гадзаов А.Ф., Тытик Д.Л. и др. // Коллоидн. журн. 2017. Т. 79. № 3. С. 289.
Кузьмин В.И., Гадзаов А.Ф. // Электромагнитные волны и электронные системы. 2015. Т. 20. № 2. С. 56.
Пригожин И.Р. От существующего к возникающему. Время и сложность в физических науках. М.: Наука, 1985. 328 с.
Пригожин И.Р., Стенгерс И. Порядок из хаоса. Новый диалог человека с природой. М.: Прогресс, 1986. 432 с.
Johnson M. Correlations of cycles in weather, solar activity, geomagnetic values and planetary configurations. San Fransisco. Phillips and Van Orden. 1944. P. 149.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии



