Журнал физической химии, 2020, T. 94, № 3, стр. 443-447
Биофизические свойства и стабильность наночастиц на основе перфторуглеродов и фосфолипидов
И. Н. Кузнецова a, *, Н. Н. Старицына a, **, А. Ю. Лянгузов b
a Федеральное государственное бюджетное учреждение “Российский научно-исследовательский институт гематологии и трансфузиологии Федерального медико-биологического агентства”
191024 Санкт-Петербург, Россия
b Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: kuz-ir@inbox.ru
** E-mail: nata.staritsyna@gmail.com
Поступила в редакцию 26.03.2019
После доработки 26.03.2019
Принята к публикации 09.04.2019
Аннотация
Получены серии эмульсий одинакового состава на основе перфторуглеродов (ПФУ) и фосфолипидов (ФЛ). Статистический анализ результатов определения контролируемых физико-химических и биофизических параметров показал стабильность их структуры в течение двух лет хранения в незамороженном состоянии (~+4°С)
Наночастицы перфторуглеродов (ПФУ) являются активным началом эмульсий ПФУ, которые рассматриваются в качестве основы “искусственной крови” или кровезаменителя, обладающего газотранспортными свойствами. Использование ПФУ для этих целей обусловлено их химической инертностью и способностью растворять большие объемы газов крови без образования химической связи “ПФУ-О2”; “ПФУ-СО2”. Состояние исследований, начатых в 60–70-е годы прошлого столетия, и составы практически всех ПФУ препаратов приведены в обзорах [1–3].
С 1996 г. разрешен к клиническому применению отечественный препарат Перфторан, при получении которого используется водорастворимый эмульгатор проксанол 268. Препарат недостаточно стабилен и должен храниться в замороженном состоянии [4]. Считается перспективным использовать природные фосфолипиды (ФЛ) для диспергирования ПФУ, что позволяет хранить эмульсии при положительной температуре (не замораживая) [5]. Созданные американскими фирмами ПФУ-препараты (Oxygent, Oxyflor, Oxycite) с использованием ФЛ в качестве эмульгатора до настоящего времени не вышли на рынок лекарственных средств по причине проявления побочных реакций при их клинических испытаниях [6, 7]. Подробный анализ клинических и побочных эффектов препарата Перфторан сделан в работе [4]. Механизм и причины проявления этих реакций до конца не выяснены.
Следует подчеркнуть, что ПФУ практически не растворимы в воде и являются плохими растворителями для ФЛ [8, 9]. Эмульсии получают путем диспергирования ПФУ в растворе эмульгатора, используя для этого гомогенизаторы высокого давления. Частицы ПФУ имеют структуру двухслойного шара. В центре его находится ПФУ, где растворяются газы крови. На поверхности шара находится тонкий слой эмульгатора (оболочка) [10]. Прочность поверхностного слоя ПАВ и сохранение размера двухслойного шара характеризуют целостность структуры частиц. Прочность структуры частиц из-за отсутствия химической связи “ПФУ–газ” служит главным условием выполнения ими газотранспортной функции in vivo. Вместе с тем, этот параметр не фигурирует в требованиях, принятых для эмульсий ПФУ медико-биологического назначения [11]: размер частиц эмульсии должен находиться в пределах 0.1–0.2 мкм; распределение частиц по размерам должно находиться в узких пределах; эмульсии должны выдерживать тепловую стерилизацию; должны быть стабильными при хранении в незамороженном состоянии; должны обеспечивать минимальный побочный эффект.
Последнее требование к эмульсиям не является полным. Наличие побочного эффекта проверяют по реакции пациента на внутривенное введение буквально первых капель эмульсионного препарата, как результат контакта частиц ПФУ с кровью. Кажется очевидным, что взаимодействие двух гетерогенных систем, эмульсии и крови, это – прежде всего взаимодействие поверхностей, пространственно-организованных структур: макромолекул плазмы крови и поверхности частиц. Попадание частиц в сосудистое русло является для них стресс-воздействием, которое может привести к разрушению их структуры просто из-за разведения эмульсионной среды кровью, изменению состава эмульгатора и сорбции биоактивных молекул на поверхности частиц [12, 13]. Поэтому при создании эмульсионных ПФУ-сред необходим контроль за прочностью формирования структуры наночастиц ПФУ. В работах одного из авторов предложены методические подходы изучения стабильности эмульсий ПФУ с учетом прочности связи поверхностного слоя ПАВ с ядром частицы, т.е. с ПФУ [14, 15]. В литературе не описаны физико-химические критерии, которые позволили бы иметь количественную оценку прочности данной связи, т. е. структуры частиц.
Цель настоящей работы – изучение стабильности структуры разработанной эмульсии на основе ПФУ и ФЛ. Для оценки полученных результатов о стабильности полученных эмульсий длительных сроков хранения и о воспроизводимости технологического процесса использовали статистические методы (описательный, дисперсионный, регрессионный анализы).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Эмульсии получали методом гомогенизации при высоком давлении на гомогенизаторе APV-1000. Основную часть фторуглеродной основы эмульсий составлял перфтордекалин (ПФД). В качестве эмульгатора использовали ФЛ сои. В состав эмульсий для получения величины рН, близкой к физиологическому значению (~7.4), введены соли одно- и двухзамещенного фосфата натрия. Осмолярность исследуемых эмульсий составляла ~240–250 Мосм. Эмульсии в завальцованном флаконе стерилизовали при ~100°С в течение 1 ч. Наблюдали за изменением физико-химических параметров эмульсий в течение 21–23 месяцев.
Статистический анализ проводили с использованием функций открытого статистического пакета “R” (http://cran.r-project.org). При исследовании полученных эмульсий были разработаны скрипты (микропрограммы) для расчета диаметра частиц эмульсии по значению волнового экспонента n (по экспериментальному значению характеристической функции – волнового экспонента), вычисления средних значений различных параметров эмульсии в разные периоды хранения, дисперсионного и регрессионного анализа зависимости размеров частиц от времени хранения эмульсии, графического отображения полученных результатов.
Размер частиц оценивали методом спектра мутности (СМ) на спектрофотометрах типа СФ-16 или PerkinElmer Lambda 35 при комнатной температуре (22 ± 2°С), используя для этого характеристическую функцию данного метода – волновой экспонент
где Di – оптическая плотность эмульсии (безразмерная величина) при соответствующей длине волны λi (нм) [16]. В свою очередь n связан cо средним диаметром частиц для тонкодисперсных ПФУ эмульсий $\bar {a}$ ≈ 0.1–0.2 мкм [17]. Метод СМ не требует предварительной калибровки и дополнительного определения числа частиц в единице объема, поэтому его использовали для оценки ширины распределения частиц в исследуемом образце (нативная или предварительно разведенная водой эмульсия 1/1) после его фракционирования методом центрифугирования.Для перехода от экспериментально определяемой величины n к $\bar {a}$ ранее нами была предложена номограмма [17] для тонкодисперсных частиц ПФУ. Более удобным в применении оказался (предложенный одним из авторов) численный метод определения диаметра частиц эмульсии по значениям волнового экспонента. Табулированные зависимости данной характеристической функции n даны в таблицах [16] для относительного диаметра частиц α при различных значениях относительного показателя преломления частиц m1 = μ1/μ0, где μ0 и μ1 – абсолютные значения показателей преломления среды и частиц соответственно. Из приведенного в работе [16] соотношения относительного диаметра частиц α и их среднего диаметра $\bar {a}$:
подставляя экспериментальные значения параметров (середина интервала длин волн, выбранного для измерений, λ = 0.5 мкм = 500 нм, μ0 = 1.33), пришли к формуле для пересчета:Из таблиц [16] выбирали значения волнового экспонента для m = 1.01, 1.03, 1.05, 1.07 в диапазоне α от 1.0 до 2.0. Значения α пересчитывали в размер частиц $\bar {a}$ по формуле (2), затем выбранный массив числовых данных аппроксимировали найденным посредством линейной регрессии полиномом второй степени от $\bar {a}$ (n = 5.44–22.4$\bar {a}$ + + 38.1${{\bar {a}}^{2}}$). Один из корней полученного после подстановки экспериментального значения волнового экспонента n квадратного уравнения представляет собой искомый диаметр частиц. Расчет осуществляется автоматически в скрипте статистического анализа результатов. Метод применим при значениях волнового экспонента 3.2–2.4 (диаметр частиц 0.12–0.2 мкм). Результаты обработки экспериментальных данных показали несущественное различие между значениями среднего диаметра частиц, полученными по номограмме и с использованием предложенного численного метода (точность до 15%).
Для проверки однородности природы частиц в эмульсии ПФУ/ФЛ использовали прием центрифугирования исследуемого образца (~3000 об./мин, 10 мин). Однородные по своей природе частицы (гомогенные частицы) оседают равномерно. Свободные ФЛ, не связанные с фторуглеродным ядром частиц, как более легкие дисперсные формы по удельному весу сравнительно с частицами ПФУ, всплывают наверх. Выделение фракций исследуемого образца, определение мутности каждой фракции с учетом ее доли позволяют найти расчетные значения суммарной мутности (τр) и сопоставить ее с экспериментальными значениями этого параметра (τэ), определяемого до центрифугирования образца:
(3)
${{\tau }_{{{\text{э}}{\text{.}}}}} = 2.3D{\text{/}}l,\quad {{\tau }_{{\text{p}}}} = \Sigma {{V}_{i}}{{\tau }_{i}}\quad (\Sigma {{V}_{i}} = 1),$Хорошее совпадение значений τэ и τр свидетельствует о гомогенности и однородности по своей природе частиц в исследуемом образце эмульсии.
Поверхностные свойства частиц (их “микроструктура”), которые зависят от состояния молекул ПАВ в оболочке вокруг частиц, их взаимного расположения, упорядоченности, окисленности и др., оценивали с помощью косвенного физико-химического параметра – индекса (или коэффициента) взаимодействия эмульсии с сывороткой крови Kτ [18]:
где τ1 – мутность смеси сыворотка крови/эмульсия (опыт); τ2 – мутность смеси сыворотка крови/физиологический раствор (контроль). Сыворотка в данном случае служит модельной биологической средой, одинаковой в опыте и контроле.ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
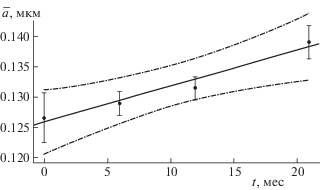
За время хранения четырех групп полученных эмульсий значения волнового экспонента n снизились от 3.23 ± 0.05 до 3.07 ± 0.03, что соответствовало некоторому увеличению $\bar {a}$ в пределах 0.10–0.15 мкм. Регрессионный анализ экспериментальных результатов показал, что изменения среднего диаметра частиц можно описать с помощью линейной регрессии (рис. 1). Прямая линия отражает линейный характер изменения ā при хранении, пунктиром показаны 95%-ные доверительные интервалы для расчетной прямой. На основании значений параметров линии регрессии ($\bar {a}$ = 0.126 + 0.00060 t, p < 0.01, где t – время хранения в мес.) можно оценить изменение размеров частиц за время хранения; средние размеры не выйдут за пределы 0.15 мкм, что свидетельствует о достаточной стабильности эмульсии.
Рис. 1.
Результаты регрессионного анализа зависимости диаметра ($\bar {a}$) частиц эмульсии от времени хранения (t). Сплошная линия – аппроксимация линейной зависимостью, штрих-пунктир – 95%-ный доверительный интервал для нее.
Разведение водой эмульсий как стресс-воздействие не изменяло общую тенденцию изменения указанных параметров с увеличением срока хранения (p ≈ 0.02): средний диаметр частиц в обоих случаях находился в тех же пределах 0.10–0.15 мкм в течение всего срока хранения.
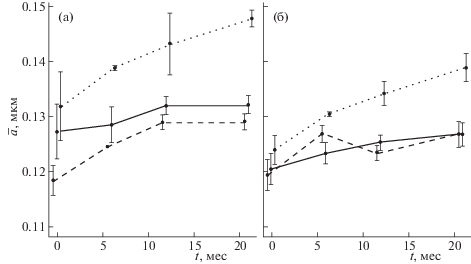
На рис. 2 представлены значения среднего диаметра частиц для фракционированных эмульсий, нативной (а) и разведенной (б), в течение срока хранения. Выделяли (точно) три фракции: верхнюю (20%), среднюю (60%) и нижнюю (20%) от общего объема пробы. Для каждой фракции находили n и $\bar {a}$. Для верхней и средней фракции величины $\bar {a}$ находились в узких пределах (~0.12–0.13 мкм). Для нижней фракции значения $\bar {a}$ были несколько выше, но не превышали ~0.15 мкм. Эмульсии были практически монодисперсны.
Рис. 2.
Изменение размеров ($\bar {a}$) частиц разных фракций полученных серий эмульсии ПФУ/ФЛ от времени хранения (t); сплошная линия – средняя фракция, пунктир – верхняя фракция, точечная – нижняя фракция; а – нативная эмульсия, б – разведение 1:1. Средняя и верхняя фракции статистически неотличимы во все сроки хранения.
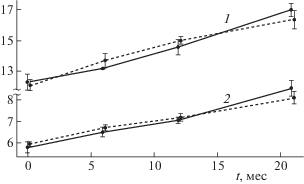
Сопоставление экспериментальных и расчетных значений мутности (τ) для изученных нативных и разведенных водой эмульсий (рис. 3) показало их хорошее совпадение для всего срока наблюдений (p > 0.05). Эти результаты свидетельствуют о сохранении однородности природы частиц ПФУ/ФЛ, что обусловлено прочностью связи эмульгатора (ФЛ) с фторуглеродным ядром частиц.
Рис. 3.
Изменение мутности (τ) полученных серий эмульсии ПФУ/ФЛ в течение хранения. 1 – нативная эмульсия, 2 – разбавленная 1:1 эмульсия. Сплошная линия – экспериментально найденные значения, пунктир – расчетные значения.
Подтверждением этого положения служат данные о поверхностных свойствах частиц. Результаты дисперсионного анализа показали, что статистически значимых изменений величин индексов взаимодействия эмульсий с сывороткой крови экспериментальных и расчетных значений мутности (τ) не обнаружено, p > 0.05. Среднее значение Kτ за период наблюдений равно 2.45 ± ± 0.11. Величины указанных индексов находятся в установленных нами ранее пределах (1.5–3.0) для эмульсий того же состава и способа получения со сроком хранения до одного года [19, 20].
Основные физико-химические параметры эмульсий (макропараметры) оставались в пределах, допустимых для физиологических значений крови: значения рН находились в пределах 7.0–7.2. Относительная вязкость (относительно воды) не превышала вязкости плазмы ~1.7 и составляла 1.45–1.49, что соответствовало сохранению размера и структуры частиц.
Таким образом, эмульсии ПФУ, будучи мутными средами, относятся к трудноопределяемым системам. Большая часть исследований эмульсионных ПФУ препаратов касается медико-биологических аспектов их применения. Молекулярные и физико-химические механизмы их действия, как причина полученного эффекта, изучены мало. Рассмотрение особенностей поведения наночастиц ПФУ с позиций биофизики при попадании в сосудистое русло позволило предложить [14] и использовать (настоящее исследование) критические параметры, которые необходимо учитывать при разработке инфузионных препаратов данного типа. Использование такого инновационного подхода позволило нам добиться воспроизводимости технологического процесса диспергирования ПФУ. Статистический анализ полученных результатов показал, что полученные эмульсии ПФУ/ФЛ в течение ~2 лет хранения при +4°С сохраняют следующие физико-химические параметры: средний диаметр и распределение частиц по размерам, однородность природы эмульгированных частиц, корпускулярную структуру частиц (или структуру двухслойного шара). Эти результаты свидетельствуют о прочности оболочки эмульгатора (структурно-механического барьера) вокруг частиц in vitro, которые были получены нами ранее [19, 20]. Мы не встретили работ, в которых был бы достигнут подобный уровень качества и стабильности эмульсий ПФУ/ФЛ.
Исследования проведены с использованием оборудования ресурсного центра “Обсерватория экологической безопасности” Научного парка СПбГУ.
Список литературы
Riess J.G. // Chemical Review. 2001. T. 101. P. 2797.
Кузнецова И.Н. // Хим.-фарм. журн. 2003. Т. 37. № 8. С. 20.
Воробьев С.И. // Там же. 2009. Т. 43. № 4. С. 30.
Маевский Е.И., Аксенова О.Г., Богданова Л.А. и др. // Вестн. службы крови России. 2001. № 4. С. 23.
Lowe K.C. // Art. Cells, Blood Substit., Immobil. Biotech. 2000. T. 28. № 1. P. 25.
Coch C.S., Cushing M.M. // Crit. Care Clin. 2009. V. № 2. P. 399. Doi: 1016/j/ccc. 2008.12.007
Henkel-Hanke T., Oleck M. // Am. As. Nurse Anesthetist J. 2007. V. 75. № 3. P. 205.
Задымова Н.М., Цикурина Н.Н., Потешина М.В. // Коллоидн. журн. 2003. Т. 65. № 3. С. 347.
Sole-Violan L., Devallez B., Postel M. et al. // New J. Chem. 1993. V. 17. № 8–9. P. 581.
Кузнецова И.Н., Безрукова А.Г., Лопатин В.Н. и др. // Биофизика 1988. Т. 33. № 1. С. 126.
Riess J.G. // Art. Cells, Blood Substit., Immobil. Biotechnol. 2006. Vol. 34. P. 567. Doi:https://doi.org/10.1080/10731190600973824
Кузнецова И.Н., Рыбакова Л.П. // Хим.-фарм. журн. 2007. Т. 41. № 12. С. 40.
Склифас А.Н., Евдокимов В.А., Кукушкин Н.И. // Биофизика. 2008. Т. 53. № 2. С. 359.
Кузнецова И.Н. Функциональная активность и стабильность эмульсий перфторуглеродов: Дис. … докт. биол. наук. С.-Пб.: Рос. НИИ гематологии и трансфузиологии, 1999. 319 с.
Kuznetsova I.N. // Current Bionanotechnology 2015. V. 1. C. 51.
Кленин В.И., Щеголев С.Ю., Лаврушин В.И. Характеристические функции светорассеяния дисперсных систем. Саратов: Изд-во Саратовского ун-та, 1977. 177 с.
Кузнецова И.Н., Кругляк З.А. // Хим.-фарм. журн. 1987. Т. 31. № 12. С. 1492.
Кузнецова И.Н., Гохман Н.С., Лаврова Ю.В. // Журн. физ. химии. 1993. Т. 67. № 9. С. 1884.
Кузнецова И.Н., Юрченко В.С., Кочеткова Г.А. // Хим.- фарм. журн. 2012. Т. 46. № 2. С. 52. (Kuznetsova I.N., Yurchenko V.S., Kochetkova G.A. Stability of nanodispersions based on Perfluorphydrocarbon and Phospholipids // Pharmaceutical Chemical Journal. 2012. V. 46. № 2. https://doi.org/10.1007/s11094-012-0745-9
Kuznetsova I.N. // Journal of Physics: Conference Series. 2011. V. 291. P. 012022. https://doi.org/10.1088/1742-6596/291/012022
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


