Журнал физической химии, 2020, T. 94, № 7, стр. 1066-1072
Электрически индуцированные конформационные изменения связанных с кластером золота полиамфолитных полипептидов на золотой поверхности: молекулярно-динамическое моделирование
Н. Ю. Кручинин a, *, М. Г. Кучеренко a
a Оренбургский государственный университет, Центр лазерной и информационной биофизики
Оренбург, Россия
* E-mail: kruchinin_56@mail.ru
Поступила в редакцию 27.06.2019
После доработки 27.06.2019
Принята к публикации 10.12.2019
Аннотация
Методом молекулярной динамики исследована конформационная структура связанных с кластером золота полиамфолитных полипептидов на поверхности золотой подложки при различных значениях поверхностной плотности электрического заряда. Показано, что наличие кластеров небольшого размера в структуре макроцепи оказывает слабое влияние на конформационную структуру полипептидов, адсорбированных на золотой подложке. Установлено, что, располагая кластеры золота вблизи положительных или отрицательных звеньев полипептидов с разными порядками распределения заряженных звеньев, можно получить конформационные структуры, в которых кластеры золота будут находиться на различных расстояниях от поверхности подложки при изменении поверхностной плотности электрического заряда. Сделан вывод, что это может быть использовано при создании и модификации датчиков на основе эффектов поверхностного плазмонного резонанса и гигантского комбинационного рассеяния с регулируемыми под воздействием электрического поля параметрами.
В настоящее время гибридные плазмонные наноструктуры, состоящие из расположенных на золотой подложке полимерных цепей связанных с золотыми наночастицами, находят широкое применение в биомедицинских исследованиях, а также при создании различных химических сенсоров, в том числе сенсоров на основе эффекта поверхностного плазмонного резонанса (ППР) [1–7] или эффекта гигантского комбинационного рассеяния (ГКР) [7, 8]. При этом особый интерес вызывает управление конформационными изменениями полимерных цепей под воздействием регулируемого электрического поля [9–11].
Конформационная структура и динамика макромолекул, которые адсорбированы на твердой поверхности, существенно отличаются от конформационных характеристик свободных макромолекулярных цепей [12]. Форма поверхности существенно влияет на конформационную структуру адсорбированных макромолекулярных цепей: распределения концентрации звеньев макромолекул на поверхностях различной кривизны заметно отличаются друг от друга [13–19]. Если изменять плотность электрического заряда на поверхности адсорбента, то для полиамфолитов с разными законами распределения положительных и отрицательных звеньев будут формироваться разные конформационные структуры [19].
В датчиках на основе эффектов поверхностного плазмонного резонанса или гигантского комбинационного рассеяния на поверхности золота могут быть размещены макромолекулярные цепи, которые либо могут сами служить рецепторами, либо содержать рецепторы в своей структуре. Если макроцепь содержит положительные и отрицательные звенья, то под воздействием электрического поля конформационная структура на поверхности будет изменяться. Это приведет к изменению условий эффектов ППР и ГКР и соответственно к изменению выходного сигнала датчика. С целью усиления сигнала и повышения чувствительности сенсоров на основе ППР и ГКР полимерные молекулы, адсорбированные на золотой подложке, часто связывают с наночастицами золота [1–8].
Кроме того, в процессе взаимодействия лиганда с макроцепью может происходить изменение количества заряженных звеньев полипептида, например, процесс фосфорилирования полипептида, содержащего аминокислоты серина, треонина, тирозина. При фосфорилировании заряд аминокислотного остатка меняется на отрицательный. Если такая макроцепь располагается на поверхности, то во внешнем электрическом поле при фосфорилировании произойдет изменение конформационной структуры макроцепи, что может быть использовано при создании сенсора протеинкиназы [9].
Цель данной работы – исследование характера расположения связанных с кластером золота полиамфолитных полипептидов с разными законами распределения положительных и отрицательных звеньев на золотой подложке.
ДЕТАЛИ КОМПЬЮТЕРНОГО ЭКСПЕРИМЕНТА
Молекулярно-динамическое моделирование было произведено для молекулярной системы, в которой полиамфолитный полипептид располагался на плоской поверхности золотой подложки. При этом аминокислотный остаток Cys полиамфолитного полипептида, адсорбированного на поверхности золота, мог быть ковалентно связан с кластером золота из 32 или 80 атомов. Были рассмотрены пять полиамфолитных полипептидов, составленных из 100 аминокислотных остатков:
1) полипептид A89R5D5C1_R, состоящий из 89 звеньев Ala (A) с равномерно распределенными пятью звеньями Asp (D, заряд $ - 1e$) и пятью звеньями Arg (R, заряд $ + 1e$), а также одним Cys (C) звеном, расположенным в середине рядом со звеном Arg – (A4RA9DA5)2A4RСA8DA5(A4RA9DA5)2;
2) полипептид A89R5D5C1_D, состоящий из 89 звеньев Ala с равномерно распределенными пятью звеньями Asp и пятью звеньями Arg, а также одним Cys-звеном, расположенным в середине рядом со звеном Asp – (A4RA9DA5)2A4RA9DCA4(A4RA9DA5)2;
3) полипептид A79R10D10C1_R, состоящий из 79 звеньев Ala с равномерно распределенными пятью парами (10 звеньев) Asp и пятью парами (10 звеньев) Arg, а также одним Cys-звеном, расположенным в середине рядом с парой звеньев Arg – (A4RRA8DDA4)2A4RRCA7DDA4(A4RRA8DDA4)2;
4) полипептид A79R10D10C1_D, состоящий из 79 звеньев Ala с равномерно распределенными пятью парами (10 звеньев) Asp и пятью парами (10 звеньев) Arg, а также одним Cys-звеном, расположенным в середине рядом с парой звеньев Asp – (A4RRA8DDA4)2A4RRA8DDCA3(A4RRA8DDA4)2;
5) полипептид A91R4D4C1_D, состоящий из 91 звена Ala с равномерно распределенными двумя парами (четыре звена) Asp и двумя парами (четыре звена) Arg, а также одним Cys (C) звеном, расположенным в середине рядом с парой звеньев Asp – A11DDA23RRA22CDDA23RRA12.
Была построена модель золотой подложки со сторонами 14 нм и толщиной в две элементарные ячейки из кристалла золота (гранецентрированная кубическая решетка). Полипептид располагался вблизи кристаллографической поверхности Au(001). В стартовой конфигурации полиамфолитный полипептид располагался на небольшом расстоянии от поверхности золотой подложки и был свернут в неравновесную клубковую структуру – три разных стартовых клубка для каждого рассмотренного полипептида. Модели кластеров золота из 32 и 80 атомов были построены согласно работе [20]. Вся молекулярная система была помещена в куб со сторонами 24 нм, заполненный молекулами воды. Поверхность золотой подложки заряжалась путем присваивания парциальных зарядов [21] атомам наночастицы, расположенным на поверхности. Были получены следующие значения поверхностной плотности заряда (индекс означает парциальный заряд одного атома на поверхности наночастицы): ${{\sigma }_{0}} = 0$, ${{\sigma }_{{ \pm 0.05}}} = \pm 1.24$, ${{\sigma }_{{ \pm 0.1}}} = \pm 2.48$, ${{\sigma }_{{ \pm 0.15}}} = \pm 3.72$ e/нм2.
МД-моделирование производилось с использованием программного комплекса NAMD 2.12 [22] при постоянной температуре 300 K (термостат Берендсена) с шагом по времени 0.001 пс. Длина временной траектории достигала 15 нс, атомы золотой подложки в процессе моделирования фиксировались. Данного времени было достаточно для получения равновесных конформаций полипептидов. При МД-моделировании с максимальными абсолютными значениями поверхностной плотности заряда подложки равновесные конформации полипептидов достигались значительно быстрее. Для контроля получения равновесных конформаций осуществлялось наблюдение за изменением среднеквадратичного расстояния между атомами полипептида в различных конформациях (RMSD). Использовалась модель воды TIP3P [23]. Для полипептидов использовалось силовое поле CHARMM22 [24]. Нековалентные взаимодействия с золотой подложкой и кластером золота описывались потенциалом 6–12 Леннард–Джонса [25, 26], разработанным в работе [27]. Взаимодействие между аминокислотным остатком Cys и связанным с ним кластером золота описывалось потенциалами, разработанными в [28]. Потенциал Ван-дер-Ваальса обрезался на расстоянии 1.2 нм с помощью функции сглаживания между 1.0 и 1.2 нм. Электростатические взаимодействия рассчитывались непосредственно на расстоянии 1.2 нм, для более дальних дистанций использовался метод частица–сетка Эвальда (PME) [29] с шагом сетки 0.11 нм.
По результатам МД-моделирования на конечном стационарном участке траектории по полученным конформациям рассчитывалась средняя линейная (“высотная”) концентрация атомов полипептида на поверхности подложки, а также расстояние между центром кластера золота, связанного с полипептидом, и поверхностью золотой подложки. По полученным средним на конечном стационарном участке “высотным” распределениям концентрации атомов из разных стартовых клубков для каждого полипептида рассчитывалось полное среднее “высотное” распределение, которое в дальнейшем будет указываться просто как среднее “высотное” распределение.
Согласно статистической теории распределения плотности звеньев полимерной цепи на поверхностях адсорбентов [12], на поверхности плоского адсорбента концентрация звеньев идеальной макромолекулы экспоненциально убывает при удалении от поверхности. Поэтому для случая нейтральной поверхности проводилась аппроксимация полученных зависимостей средней “высотной” концентрации атомов полипептида экспоненциальной кривой [12]:
где $k$ – коэффициент показателя экспоненты, $A$ – коэффициент, $z$ – координата в направлении, перпендикулярном притягивающей плоскости; ${{z}_{0}}$ – координата максимума “высотного” распределения.ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Было произведено МД-моделирование всех выбранных полипептидов с кластером золота из 32 атомов (Au32), а также полипептидов A79R10D10C1_R, A79R10D10C1_D и A91R4D4C1_D с кластером золота из 80 атомов (Au80) на поверхности золотой подложки при значениях поверхностной плотности заряда: ${{\sigma }_{0}}$, ${{\sigma }_{{ \pm 0.05}}}$, ${{\sigma }_{{ \pm 0.1}}}$ и ${{\sigma }_{{ \pm 0.15}}}$.
На рис. 1 изображены результаты некоторых из проведенных вариантов МД-моделирований полипептида A89R5D5C1_R с кластером золота из 32 атомов на поверхности золотой подложки при поверхностных плотностях заряда: ${{\sigma }_{0}}$, ${{\sigma }_{{ + 0.15}}}$ и ${{\sigma }_{{ - 0.15}}}$. При МД-моделировании на нейтральной поверхности (рис. 1а) происходила адсорбция остатков полипептида вне зависимости от их типа, а кластер золота находился в цепи полипептида на небольшом расстоянии от подложки. На рис. 2а изображена зависимость средней “высотной” концентрации атомов полипептида A89R5D5C1_R с кластером Au32 на нейтральной золотой подложке. Параметры аппроксимирующей кривой (1) распределения средней “высотной” концентрации атомов полипептида A89R5D5C1_R: ${{z}_{0}} = 0.3$ нм, $k = 4.7$ нм–1 и $A = 2.8{\text{ }} \times {{10}^{3}}$ нм–1. При МД-моделировании данного полипептида в отсутствие кластера золота параметры аппроксимирующей кривой распределения средней “высотной” концентрации атомов полипептида незначительно отличаются: ${{z}_{0}} = 0.3$ нм, $k = 4.9$ нм–1 и $A = 3.1{\text{ }} \times {{10}^{3}}$ нм–1. В случае нейтральной поверхности центр кластера золота в среднем находился на расстоянии 1 нм от поверхности.
Рис. 1.
Изменения конформаций полипептида A89R5D5C1_R с кластером золота из 32 атомов на поверхности золотой подложки после МД-моделирования (черным цветом изображен кластер Au32, светло-серым – звенья Ala и Cys, темно-серым – Arg и Asp) при различных значениях поверхностной плотности заряда: а – ${{\sigma }_{0}}$, б – ${{\sigma }_{{ + 0.15}}}$, в – ${{\sigma }_{{ - 0.15}}}$.

Рис. 2.
“Высотные” зависимости средней концентрации атомов полипептида A89R5D5C1_R над поверхностью золотой подложки с дифференциацией по типам звеньев после МД-моделирования с кластером Au32 при различных значениях поверхностной плотности заряда: а – ${{\sigma }_{0}}$, б – ${{\sigma }_{{ + 0.15}}}$, в – ${{\sigma }_{{ - 0.15}}}$ (pep – “высотная” зависимость концентрации атомов всего полипептида; ala, arg и asp – “высотные” зависимости концентрации атомов по типам аминокислотных остатков; 1 – аппроксимирующая экспоненциальная кривая).

С ростом абсолютной величины поверхностной плотности заряда в конечных конформационных структурах наблюдалось перераспределение заряженных остатков полипептида вместе с кластером золота (рис. 1б и 1в) схожим образом со случаем МД-моделирования без кластера золота: все большее количество остатков, имеющие знак заряда, одинаковый с подложкой, удалялись от нее, а остатки с противоположным знаком располагались на поверхности, что видно на графиках распределений средних “высотных” концентраций атомов полипептида (рис. 2б и 2в). При достижении значений поверхностной плотности заряда ${{\sigma }_{{ + 0.15}}}$ все отрицательные звенья полипептида располагались на золотой подложке (рис. 1б и 2б), а при ${{\sigma }_{{ - 0.15}}}$ наблюдается адсорбция всех положительных звеньев (рис. 1в и 2в). Кластер золота был связан с остатком Cys, который находился в середине макроцепи рядом с положительно заряженным аминокислотным остатком Arg. При МД-моделировании на положительно заряженной подложке по мере увеличения поверхностной плотности заряда кластер золота вместе с этим аминокислотным остатком Arg удалялся от поверхности: при ${{\sigma }_{{ + 0.05}}}$ кластер находился в среднем на расстоянии 1.3 нм, при ${{\sigma }_{{ + 0.1}}}$ – на расстоянии 1.8 нм, а при ${{\sigma }_{{ + 0.15}}}$ – на расстоянии 3 нм от поверхности (рис. 1б), а на отрицательно заряженной поверхности кластер Au32 при ${{\sigma }_{{ - 0.05}}}$ находился на расстоянии 1.3 нм, при ${{\sigma }_{{ - 0.1}}}$ – на расстоянии 1.7 нм, а при ${{\sigma }_{{ - 0.15}}}$ – на расстоянии 2 нм от поверхности (рис. 1в). Такое поведение связано с тем, что положительный заряд Arg-звена и отрицательный Asp-звена сосредоточены на конце R-группы аминокислотного остатка, а у аминокислотного остатка Arg R-группа имеет значительный размер. Это видно на рис. 1в, где аминокислотный остаток Arg касается отрицательно заряженной подложки концом R-группы.
При МД-моделировании полипептида A89R5D5C1_D с кластером Au32 на нейтральной поверхности кластер находился в среднем на расстоянии 0.9 нм от подложки, а параметры аппроксимирующей кривой распределения средней “высотной” концентрации атомов полипептида: ${{z}_{0}} = 0.3$ нм, $k = 4.7$ нм–1 и $A = 3{\text{ }} \times {{10}^{3}}$ нм–1. При этом из-за того, что кластер Au32 был соединен с полипептидом около звена Asp, наблюдалось зеркальное смещение кластера золота на заряженной подложке по сравнению с МД-моделированием полипептида A89R5D5C1_R: при поверхностной плотности ${{\sigma }_{{ + 0.15}}}$ кластер Au32 в среднем находился на расстоянии 1.5 нм, а при ${{\sigma }_{{ - 0.15}}}$ – на расстоянии 3 нм от подложки.
Полипептид A79R10D10C1_D вместе с кластером Au80 также адсорбировался на нейтральной подложке, а центр кластера находился в среднем на расстоянии 0.8 нм от поверхности. Параметры аппроксимирующей кривой распределения средней “высотной” концентрации атомов полипептида A79R10D10C1_D с кластером Au80: ${{z}_{0}} = 0.3$ нм, $k = 2.88$ нм–1 и $A = 2.24{\text{ }} \times {{10}^{3}}$ нм–1. При этом параметры аппроксимирующей кривой, полученные при МД-моделировании полипептида A79R10D10C1_D с кластером Au32, составили: ${{z}_{0}} = 0.3$ нм, $k = 4.7$ нм–1 и $A = 3{\text{ }} \times {{10}^{3}}$ нм–1, а при МД-моделировании без кластера золота: ${{z}_{0}} = 0.3$ нм $k = 4.6$ нм–1 и $A = 3{\text{ }} \times {{10}^{3}}$ нм–1. Как видно, данные параметры практически не отличаются в последних двух случаях, а отличия в случае МД-моделирования с кластером Au80 обусловлены его размером, так как его обволакивает полипептид.
При МД-моделировании на заряженной подложке полипептида A79R10D10C1_D с кластером Au32, а также в отсутствие кластера золота, перестройка конформационной структуры, при которой звенья с зарядом, одинаковым по знаку заряду подложки, были максимально от нее удалены, происходила уже при значениях поверхностной плотности заряда ${{\sigma }_{{ + 0.1}}}$ и ${{\sigma }_{{ - 0.1}}}$. Это связано с большей плотностью заряженных звеньев полипептида A79R10D10C1_D по сравнению с полипептидами A89R5D5C1_D и A89R5D5C1_R. Кластер Au32 при значении поверхностной плотности заряда ${{\sigma }_{{ + 0.05}}}$ находился на расстоянии 1.1 нм, при ${{\sigma }_{{ + 0.1}}}$ и ${{\sigma }_{{ + 0.15}}}$ – на расстоянии 1.3 нм от поверхности, а на отрицательно заряженной подложке при ${{\sigma }_{{ - 0.05}}}$ кластер находился на расстоянии 1.8 нм, при ${{\sigma }_{{ - 0.1}}}$ и ${{\sigma }_{{ - 0.15}}}$– на расстоянии 2.5 нм от поверхности. При МД-моделировании полипептида A79R10D10C1_D с кластером Au80 такая перестройка конформационной структуры происходила только при значениях поверхностной плотности заряда ${{\sigma }_{{ + 0.15}}}$ и ${{\sigma }_{{ - 0.15}}}$: при ${{\sigma }_{{ + 0.05}}}$ кластер находился на расстоянии 1.4 нм, при ${{\sigma }_{{ + 0.1}}}$ – на расстоянии 1.7 нм, при ${{\sigma }_{{ + 0.15}}}$ – на расстоянии 2 нм от поверхности, а на отрицательно заряженной подложке: при ${{\sigma }_{{ - 0.05}}}$ кластер находился на расстоянии 1.8 нм, при ${{\sigma }_{{ - 0.1}}}$ – на расстоянии 2.4 нм, при ${{\sigma }_{{ - 0.15}}}$ – на расстоянии 3.5 нм от поверхности.
При МД-моделировании полипептида A79R10D10C1_R на заряженной подложке наблюдались зеркальные по сравнению с A79R10D10C1_D изменения конформационной структуры. При МД-моделировании полипептида A79R10D10C1_R на положительно заряженной поверхности кластер Au80 смещался от поверхности по мере увеличения поверхностной плотности заряда: при ${{\sigma }_{{ + 0.05}}}$ кластер находился на расстоянии 1.3 нм, при ${{\sigma }_{{ + 0.1}}}$ – на расстоянии 1.9 нм, а при ${{\sigma }_{{ + 0.15}}}$ – на расстоянии 3.3 нм от поверхности. На отрицательно заряженной подложке при ${{\sigma }_{{ - 0.05}}}$ кластер находился на расстоянии 1.1 нм, при ${{\sigma }_{{ - 0.1}}}$ – на расстоянии 2.1 нм, а при ${{\sigma }_{{ - 0.15}}}$ – на расстоянии 2.3 нм от поверхности. При МД-моделировании полипептида A79R10D10C1_R с кластером Au32 на положительно заряженной поверхности кластер при ${{\sigma }_{{ + 0.05}}}$ находился на расстоянии 2 нм, а при ${{\sigma }_{{ + 0.1}}}$ и ${{\sigma }_{{ + 0.15}}}$ – на расстоянии 2.9 нм от подложки, а на отрицательно заряженной подложке при ${{\sigma }_{{ - 0.05}}}$ кластер находился на расстоянии 1.3 нм, при ${{\sigma }_{{ - 0.1}}}$ и ${{\sigma }_{{ - 0.15}}}$ – на расстоянии 1.9 нм от поверхности.
На рис. 3 изображены результаты некоторых вариантов МД-моделирования полипептида A91R4D4C1_D с кластером Au32 на поверхности золотой подложки при различных поверхностных плотностях заряда. При МД-моделировании на нейтральной поверхности (рис. 3а) происходила адсорбция всех звеньев полипептида, а кластер золота находился в цепи полипептида на небольшом расстоянии от подложки, в среднем равном 1 нм. При этом параметры аппроксимирующей кривой распределения средней “высотной” концентрации атомов полипептида A91R4D4C1_D с кластером Au32 равны: ${{z}_{0}} = 0.3$ нм, $k = 5.3$ нм–1 и $A = 3{\text{ }} \times {{10}^{3}}$ нм–1, в сравнении с МД-моделированием данного полипептида в отсутствие кластера золота: ${{z}_{0}} = 0.3$ нм, $k = 5.1$ нм–1 и $A = 3.1{\text{ }} \times {{10}^{3}}$, а при расчетах с кластером Au80: ${{z}_{0}} = 0.3$ нм, $k = 3.4$ нм–1 и $A = 2.6{\text{ }} \times {{10}^{3}}$ нм–1.
Рис. 3.
Изменение конформаций полипептида A91R4D4C1_D с кластером золота из 32 атомов на поверхности золотой подложки после МД-моделирования (черным цветом изображен кластер Au32, светло-серым – звенья Ala и Cys, темно-серым – Arg и Asp) при различных значениях поверхностной плотности заряда: а – ${{\sigma }_{0}}$, б – ${{\sigma }_{{ + 0.15}}}$, в – ${{\sigma }_{{ - 0.15}}}$.
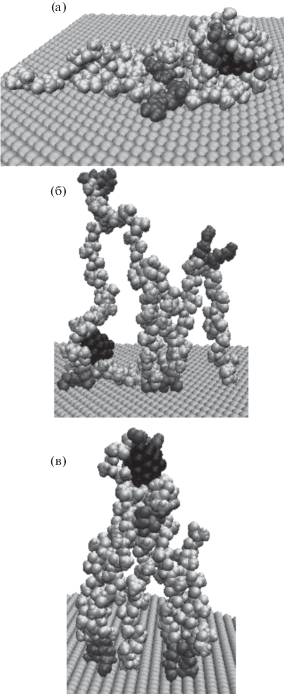
С ростом абсолютной величины поверхностной плотности заряда в конечных конформационных структурах полипептида A91R4D4C1_D наблюдалось перераспределение заряженных остатков полипептида вместе с кластером золота (рис. 3б и 3в) схожим образом со случаем МД-моделирования без кластера золота. Из-за того, что расстояние между положительными и отрицательными звеньями полипептида A91R4D4C1_D значительно больше, чем у рассмотренных выше полипептидов, заряженные аминокислотные остатки удаляются от поверхности, а вместе с ними и кластер Au32, на большее расстояние. При МД-моделировании на положительной поверхности кластер золота находился вблизи поверхности на расстоянии в среднем 1.2 нм (рис. 3б), а на отрицательно заряженной подложке по мере увеличения абсолютной величины поверхностной плотности заряда кластер Au32 вместе со звеньями Asp удалялся от поверхности: при ${{\sigma }_{{ - 0.05}}}$ кластер находился на расстоянии 1.5 нм, при ${{\sigma }_{{ - 0.1}}}$ – на расстоянии 2.9 нм, а при ${{\sigma }_{{ - 0.15}}}$ – на расстоянии 5.1 нм (рис. 3в). Схожие изменения конформационной структуры макроцепи наблюдались и при МД-моделировании полипептида A91R4D4C1_D с кластером Au80 на заряженной поверхности золотой подложки. На положительно заряженной подложке кластер Au80 незначительно смещался от поверхности: при ${{\sigma }_{{ + 0.05}}}$ кластер находился на расстоянии 1.2 нм, при ${{\sigma }_{{ + 0.1}}}$ – на расстоянии 2 нм, при ${{\sigma }_{{ + 0.15}}}$ – на расстоянии 2.3 нм, а на отрицательно заряженной подложке: при ${{\sigma }_{{ - 0.05}}}$ кластер находился на расстоянии 1.3 нм, при ${{\sigma }_{{ - 0.1}}}$ – на расстоянии 3.1 нм, а при ${{\sigma }_{{ - 0.15}}}$ – на расстоянии 5.2 нм от поверхности.
ЗАКЛЮЧЕНИЕ
Наличие металлических кластеров небольшого размера в структуре макроцепи оказывает слабое влияние на конформационную структуру полипептидов, адсорбированных как на нейтральной, так и на заряженной золотой подложке. Расстояние от подложки до кластера золота, который связан с полипептидом около заряженного аминокислотного остатка, может изменяться под воздействием электрического поля, достигая максимального расстояния, приблизительно равного толщине макромолекулярного слоя. Поэтому, располагая малые кластеры золота вблизи положительных или отрицательных звеньев полипептида, можно получить конформационные структуры, в которых кластеры золота будут находиться на различных расстояниях от поверхности подложки при изменении поверхностной плотности электрического заряда подложки. При использовании полипептидов с различными расстояниями между противоположно заряженными аминокислотными остатками полипептида на макроцепи на заряженной поверхности изменяется толщина макромолекулярного слоя и соответственно расстояние между кластером золота и подложкой. Изменяя плотность заряда звеньев полипептида и группируя их в различных соотношениях, можно варьировать величину конформационных изменений структуры полипептида, индуцированных действием электрического поля. При этом изменения расстояния между кластером и подложкой будут более чувствительны к воздействию электрического поля. Исследованные структуры могут быть использованы при создании и модификации датчиков на основе эффектов ППР и ГКР с регулируемыми при воздействии электрического поля параметрами.
Исследование выполнено при финансовой поддержке РФФИ и Оренбургской области в рамках научного проекта № 19-43-560003.
Список литературы
Lee J., Chung K., Lee J. et al. // Adv. Funct. Mater. 2015. V. 25. P. 6716. https://doi.org/10.1002/adfm.201570279
Choi J., Choi M., Yoo J. et al. // Nanoscale. 2013. V. 5. P. 7403. https://doi.org/10.1039/C3NR01453C
Bai Y., Feng F., Zhao L. et al. // Biosensors and Bioelectronics. 2013. V. 47. P. 265. https://doi.org/10.1016/j.bios.2013.02.004
Altintas Z., Guerreiro A., Piletsky S.A., Tothill I.E. // Sensors and Actuators B. 2015. V. 213. P. 305. https://doi.org/10.1016/j.snb.2015.02.043
Gao Y., Zou F., Wu B. et al. // Biosensors and Bioelectronics. 2016. V. 81. P. 207. https://doi.org/10.1016/j.bios.2016.02.075
Bedford E.E., Spadavecchia J., Pradier C.M., Gu F.X. // Macromol. Biosci. 2012. V. 12. P. 724. https://doi.org/10.1002/mabi.201100435
Ferhan A.R., Kim D. // Nano Today. 2016. V. 11. P. 415. https://doi.org/10.1016/j.nantod.2016.07.001
Li Q., Lu Z., Tan X. et al. // Biosensors and Bioelectronics. 2017. V. 97. P. 59. https://doi.org/10.1016/j.bios.2017.05.031
Chen Y., Cruz-Chu E.R., Woodard J. et al. // ACS Nano. 2012. V. 6. P. 8847. https://doi.org/10.1021/nn3027408
Cantini E., Wang X., Koelsch P. et al. // Acc. Chem. Res. 2016. V. 49. P. 1223. https://doi.org/10.1021/acs.accounts.6b00132
Boonchiangma S., Srijaranai S., Tuntulani T., Ngeontae W. // J. Appl. Polym. Sci. 2014. V. 131. P. 40356. https://doi.org/10.1002/app.40356
Гросберг А.Ю., Хохлов А.P. Статистическая физика макромолекул. М.: Наука, 1989.
Кучеренко М.Г., Чмерева Т.М. // Вестник ОГУ. 2008. № 9. С. 177.
Kucherenko M.G., Rusinov A.P., Chmereva T.M. et al. // Optics and Spectroscopy. 2009. V. 107. № 3. P. 480. https://doi.org/10.1134/S0030400X0909029X
Kucherenko M.G., Izmodenova S.V., Kruchinin N.Yu., Chmereva T.M. // High Energy Chemistry. 2009. V. 43. № 7. P. 592.
Kucherenko M.G., Stepanov V.N., Kruchinin N.Yu. // Optics and Spectroscopy. 2015. V. 118. № 1, P. 103. https://doi.org/10.1134/S0030400X15010154
Кручинин Н.Ю., Кучеренко М.Г. // Химическая физика и мезоскопия. 2016. Т. 18. № 2. С. 225.
Кручинин Н.Ю., Кучеренко М.Г. // Сибирский физический журнал. 2018. Т. 13. № 2. С. 86. https://doi.org/10.25205/2541-9447-2018-13-2-86-94
Kruchinin N.Y., Kucherenko M.G. // Colloid Journal. 2019. V. 81 № 2. P. 110. https://doi.org/10.1134/S1061933X19020078
Doye J.P.K., Wales D.J. // New J. Chem. 1998. V. 22. P. 733. https://doi.org/10.1039/A709249K
Shankla M., Aksimentiev A. // Nat. Commun. 2014. V. 5. P. 5171. https://doi.org/10.1038/ncomms6171
Phillips J.C., Braun R., Wang W. et al. // J. Comput. Chem. 2005. V. 26. P. 1781. https://doi.org/10.1002/jcc.20289
Jorgensen W.L., Chandrasekhar J., Madura J.D. et al. // J. Chem. Phys. 1983. V. 79. P. 926. https://doi.org/10.1063/1.445869
MacKerell A.D., Bashford D., Bellott M. et al. // J. Phys. Chem. B. 1998. V. 102. P. 3586. https://doi.org/10.1021/jp973084f
Mhashal A.R., Roy S. // PLoS One. 2014. V. 9. P. e114152. https://doi.org/10.1371/journal.pone.0114152
Shao Q., Hall C.K. // Langmuir. 2016. V. 32. P. 7888. https://doi.org/10.1021/acs.langmuir.6b01693
Heinz H., Vaia R.A., Farmer B.L., Naik R.R. // J. Phys. Chem. C. 2008. V. 112. P. 17281. https://doi.org/10.1021/jp801931d
Bizzarri A.R., Costantini G., Cannistraro S. // Biophys.Chem. 2003. V. 106. P. 111. https://doi.org/10.1016/S0301-4622(03)00156-X
Darden T., York D., Pedersen L. // J. Chem. Phys. 1993. V. 98. P. 10089. https://doi.org/10.1063/1.464397
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


