Журнал физической химии, 2021, T. 95, № 10, стр. 1538-1543
Координационные числа двухвалентных ионов в органических растворителях
a Российская академия наук, Объединенный институт высоких температур
Москва, Россия
b Московский физико-технический институт (Государственный университет)
Долгопрудный, Россия
c Национальный исследовательский университет “Высшая школа экономики”
Москва, Россия
* E-mail: mo2411@mail.ru
Поступила в редакцию 27.08.2020
После доработки 21.01.2021
Принята к публикации 12.03.2021
Аннотация
Проведено молекулярно-динамическое моделирование свойств двухвалентных ионов в органических растворителях. Показано, что молекулы рассмотренных растворителей связываются с ионами через атомы кислорода. На основе этого построена теоретическая модель, описывающая координационное число иона. В данной модели координационное число определяется соотношением размера иона и атома органической молекулы, связывающегося с ионом. Показано, что координационное число слабо зависит от растворителя и существенно от сорта иона. На основе теоретической модели получено значение 0.13 нм для эффективного размера атома кислорода, связывающегося с двухвалентным ионом. Построенная теоретическая модель согласуется с результатами молекулярно-динамических расчетов и имеющимися экспериментальными данными.
Свойства ионов в жидкости важны для описания различных электрохимических процессов [1]. Определяющее влияние на такие процессы оказывает образование у ионов сольватных оболочек. Сольватация ионов влияет на перенос заряда [2, 3], взаимодействие с поверхностью [4], кинетику химических реакций [5]. В частности, свойства сольватных оболочек ионов в растворах на основе органического растворителя важны для разработки аккумуляторов [6–11].
Свойства сольватных оболочек атомарных ионов в водных растворах достаточно полно описаны как теоретически, так и экспериментально. В частности, определены значения координационных чисел [12], времена жизни оболочек [13], энергии сольватации [14].
В теоретических и экспериментальных работах по органическим растворителям в основном рассмотриваются свойства ионов лития [5, 15, 16]. Это связано с акцентом на разработке материалов для литий-ионных аккумуляторов. Однако, помимо широко распространенных литий-ионных аккумуляторов, ведется разработка технологий на основе двухвалентных ионов. Активно рассматривается применение ионов магния [17], кальция [18] и других [19]. Кроме того, список перспективных растворителей постоянно расширяется [19]. Это приводит к существованию большого числа комбинаций ион-растворитель, на основе которых могут быть созданы аккумуляторы нового поколения. Таким образом, имеется потребность в построении универсального описания свойств сольватных оболочек в широком спектре органических растворителей, в том числе, для двухвалентных ионов.
Основной характеристикой геометрии сольватной оболочки является координационное число иона, представляющее собой количество молекул, являющихся ближайшими соседями иона. В данной статье рассмотрены сольватные оболочки и координационные числа двухвалентных ионов в шести растворителях, наиболее часто рассматриваемых при разработке аккумуляторов [20, 21]. Проведены численные расчеты с использованием метода молекулярной динамики [22], который активно применяется для моделирования свойств материалов [23–25]. Построена теоретическая модель, описывающая координационные числа ионов. Для проверки полноты теоретических выводов, помимо ионов магния и кальция рассмотрены ионы бериллия, которые не примененяются в аккумуляторах.
В первом разделе описана методика молекулярно динамического моделирования и используемые потенциалы межатомного взаимодействия. Во втором разделе приводятся данные молекулярно-динамических расчетов и сравнении с литературными экспериментальными данными. В третьем разделе представлена модель, которая позволяет, без проведения молекулярно-динамических расчетов, определить координационное число иона в жидкости. Показано, что данная модель согласуется с расчетами и экспериментом.
МЕТОД РАСЧЕТА
Рассмотрены следующие растворители: диметилкарбонат (DMC), диэтилкарбонат (DEC), этилметилкарбонат (EMC), этиленкарбонат (EC), этилацетат (EA), метилацетат (MA) [20, 21].
Для описания потенциала взаимодействия атомов растворителя применялось силовое поле GROMOS [26]. Для взаимодействия ионов Mg2+ и Ca2+ с атомами молекул растворителя также применялось силовое поле GROMOS. В данном силовом поле отсутствует параметризация для ионов Be2+. Взаимодействие иона с атомами жидкости продставленно в виде кулоновского потенциала и потенциала Леннарда-Джонса
Для задания взаимодействия Be2+ с атомами жидкости использовались параметры потенциала (1) из статьи [27]. Параметры взаимодействия атомов кислорода друг с другом в расчетах с данным ионом также брались из статьи [27]. Топологии связей между атомами в молекулах растворителя и частичные заряды на этих атомах брались из базы Automated Topology Builder (ATB) [28, 29]. Дальнодействующее взаимодействие описывалось с использованием метода Particle-mesh Ewald (PME) [30].Для расчетов применялся метод классической молекулярной динамики. Температура системы 330 K. Давление 1 бар. Шаг численного интегрирования 1 фс. Число молекул растворителя: 300. Проверка зависимости величины координационного числа от числа молекул растворителя для диэтилкарбоната показывает, что отклонения от результатов по сравнению с системой содержащей 1200 молекул составляют не более 2%. Молекулы добавлялись в расчетную ячейку в случайные места. Далее в случайное место добавлялся один ион. Проводилась минимизация энергии для исключения перекрывания молекул. Далее проводился вывод системы на равновесие в расчете с применением термостата и баростата в течение 450 пс. После этого проводилось вычисление координационного числа в течение 1.55 нс. Результаты усреднялись по времени и по 16 траекториям с независимыми начальными условиями. Расчеты выполнены с использованием программного пакета GROMACS [31].
Число соседей иона на расстоянии r вычислялось по количеству молекул, хотя бы один атом которых находится на расстоянии менее r от иона. Координационные числа получались исходя из горизонтальных участков графика числа соседей от r. Пример таких графиков показан на рис. 1.
Рис. 1.
Зависимости среднего количества молекул от расстояния до иона в диметилкарбонате. Синие квадраты (1) – данные для иона Be2+, зеленые круги (2) – Mg2+, красные треугольники (3) – Ca2+.

Флуктуации координационных чисел вычислялись по отличию их значений (Сi) на N = 16 траекториях с независимыми начальными условиями. Использовалась формула
РЕЗУЛЬТАТЫ РАСЧЕТОВ И СРАВНЕНИЕ С ЭКСПЕРИМЕНТОМ
Результаты расчетов. Полученные в молекулярной динамике значения координационных чисел показаны на рис. 2. Координационное число слабо зависит от выбора растворителя. Изменение координационного числа для конкретного иона при смене растворителя составляет не более 0.1 для всех веществ. Помимо средних значений были также рассчитаны флуктуации координационных чисел. Они показаны на рис. 2 в виде крестов ошибок. Для всех веществ, значения флуктуаций перекрывают отклонения от среднего по данному иону координационного числа.
Рис. 2.
Координационные числа ионов в различных органических растворителях по данным молекулярной динамики. Три группы столбцов разного цвета соответствуют различным ионам (Ca2+, Mg2+, Be2+). Внизу показаны сокращенные названия соответствующих растворителей. Кресты ошибок соответствуют флуктуации координационного числа. Статистическая погрешность расчетов существенно меньше величины флуктуаций.

Слабую зависимость координационного числа от растворителя можно обьяснить тем, что молекулы всех рассмотренных растворителей связываются с ионом через атом кислорода. Чтобы подтвердить это были построены зависимости количества атомов молекулы растворителя от расстояния до иона. Пример такой зависимости для иона Be2+ в диметилкарбонате (DMC) приведен на рис. 3. Видно, что ближе всего к иону находятся четыре атома кислорода. С другой стороны, из рис. 1 видно, что ион окружен четырьмя молекулами. Следовательно, окружающие ион атомы кислорода относятся к различным молекулам. При этом остальные атомы углерода и кислорода молекулы находятся существенно дальше от иона. Аналогичная картина наблюдается и для других растворителей и ионов. Это подтверждает гипотезу связывания иона с атомами кислорода. Таким образом, ион окружен оболочкой из атомов кислорода, по одному от каждой окружающей молекулы.
Рис. 3.
Зависимости количества атомов различного сорта от расстояния до иона Be2+ в диметилкарбонате. Красными кругами (1) показаны данные для кислорода, связывающегося с ионом. Квадратами различных цветов (2) показаны данные для различных атомов углерода и других атомов кислорода молекулы диметилкарбоната. Данные для атомов водорода не приведены.
Имеется существенная зависимость координационного числа от сорта иона (рис. 2). Изменение координационного числа при изменении иона превышает величину среднеквадратичной флуктуации.
Сравнение с экспериментом. Все рассмотренные растворители объединяет то, что ион связывается с молекулой растворителя через атом кислорода данной молекулы. Это позволяет провести аналогию с ионами в воде, где ион также окружен атомами кислорода. Экспериментальные значения координационных чисел ионов в воде показаны горизонтальными линиями на рис. 2. Экспериментальное значение координационного числа в воде совпадает со значением в рассмотренных органических растворителях для всех рассмотренных ионов [12, 27]. Для иона кальция в литературе имеется некоторый разброс экспериментальных данных [32] от 7.2 до 10. В большинстве экспериментов [27, 32, 33] получено значение 8.
Таким образом, имеется согласие с экспериментальными значениями координационного числа иона в воде. Другая аналогия, которую можно рассмотреть: сравнение с координационными числами в кристалах оксидов металлов. Значения координационных чисел соответствующих ионов в органических растворителях совпадают со значениями координационных чисел в кристалах оксидов данных металлов [33].
ТЕОРЕТИЧЕСКАЯ МОДЕЛЬ КООРДИНАЦИОННОГО ЧИСЛА
Для теоретического описания координационных чисел ионов в жидкости можно адаптировать модель Магнуса–Гольдшмидта [34, 35]. Данная модель построена для описания координационных чисел в кристаллах. Она основывается на предположении, что координационное число зависит от соотношения радиусов соседних ионов. Атомы кристалла описываются твердыми сферами и, из геометрических соображений, определяется устойчивая конфигурация окружения иона.
Для описания координационного числа иона в жидкости необходимо вместо радиуса атомов кристалла использовать радиус атома органической молекулы, который связывается с ионом. В рассмотренных растворителях с ионом связывается атом кислорода. Это приводит к следующей формуле
(2)
$C = \left\{ \begin{gathered} {\text{8,}}\quad {{r}_{{{\text{ion}}}}}{\text{/}}{{r}_{{{\text{oxygen}}}}}{\text{ }} \in [{\text{1;}}\;{\text{0}}{\text{.732],}} \hfill \\ {\text{7,}}\quad {{r}_{{{\text{ion}}}}}{\text{/}}{{r}_{{{\text{oxygen}}}}}{\text{ }} \in {\text{ [0}}{\text{.592;}}\;{\text{0}}{\text{.732],}} \hfill \\ {\text{6,}}\quad {{r}_{{{\text{ion}}}}}{\text{/}}{{r}_{{{\text{oxygen}}}}}{\text{ }} \in [{\text{0}}{\text{.414;}}\;0.592{\text{],}} \hfill \\ {\text{4,}}\quad {{r}_{{{\text{ion}}}}}{\text{/}}{{r}_{{{\text{oxygen}}}}}{\text{ }} \in [{\text{0}}{\text{.225;}}\;{\text{0}}{\text{.414],}} \hfill \\ {\text{3,}}\quad {{r}_{{{\text{ion}}}}}{\text{/}}{{r}_{{{\text{oxygen}}}}}{\text{ }} \in [{\text{0}}{\text{.155;}}\;{\text{0}}{\text{.225],}} \hfill \\ \end{gathered} \right.$Для применения данной модели требуется значение радиуса иона металла и атома кислорода органической молекулы. Существуют различные определения радиусов атомов и ионов. Один из подходов заключается в использвании межатомных расстояний в различных веществах, содержащих данные атомы и ионы. Предполагается, что расстояние между парой атомов является суммой их радиусов. Таким образом, задав радиус одного из атомов можно получить радиус другого. Предполагая, что нам известен радиус атома кислорода и расстояние ион-атом, получаем для отношения радиуса кислорода и иона
(3)
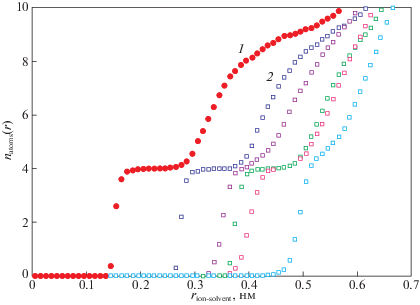
${{r}_{{{\text{ion}}}}}{\text{/}}{{r}_{{{\text{oxygen}}}}} = ({{d}_{{{\text{ion}} - {\text{oxygen}}}}} - {{r}_{{{\text{oxygen}}}}}){\text{/}}{{r}_{{{\text{oxygen}}}}},$Для наиболее точного описания свойств ионов в органических растворителях целесообразно использовать roxygen в качестве подгоночного параметра модели. Для определения значения данного параметра были вычислены значения координационных чисел ионов различных размеров. Результаты молекулярно динамических расчетов представлены на рис. 4. Размеры ионов выбраны в широком диапазоне путем варьирования параметров потенциала (1). Расстояние ион-атом кислорода определялось по первому максимуму парной корреляционной функции. Согласие результатов молекулярно-динамических расчетов и теоретической модели достигнуто при значении roxygen = 0.13 нм. Отклонение roxygen на 0.1 нм приводит к существенному расхождению модели и данных молекулярной динамики.
Рис. 4.
Точками показано координационное число иона размера rion в диметилкарбонате по данным молекулярной динамики. Линией показана теоретическая оценка координационного числа согласно модифицированной модели Магнуса–Гольдшмидта (2), (3) с roxygen = 0.13 нм.

С другой стороны, использование экспериментального занчения расстояния между атомами кислорода в воде приводит к оценке радиуса кислорода roxygen = 0.14 нм [34]. В таблице 1 показаны значения координационных чисел, которые получаются c применением различных значений радиуса кислорода.
Таблица 1.
Значение расстояний (d, нм) между ионом и атомом кислорода в различных веществах
| Ион | doxide | dwater | dorganic | Сoxide | Cwater | Corganic | Сoxide | Сwater | Corganic | Сexp |
|---|---|---|---|---|---|---|---|---|---|---|
| roxygen = 0.14 нм | roxygen = 0.13 нм | |||||||||
| Be2+ | 0.164 | 1.67 | 1.65 | 3 | 3 | 3 | 4 | 4 | 4 | 4 |
| Mg2+ | 0.21 | 0.209 | 0.1995 | 6 | 6 | 6 | 7 | 7 | 6 | 6 |
| Ca2+ | 0.243 | 0.246 | 0.25 | 8 | 8 | 8 | 8 | 8 | 8 | 8 |
Примечание. Данные для оксидов doxide и воды dwater взяты из эксперимента [32]. Данные для органических растворителей dorganic взяты по первому пику парной корреляционной функции полученной из молекулярной динамики. dorganic совпадают для всех рассмотренных в данной работе растворителей. Теоретические значения координационных чисел расчитаны с использованием (2), (3) по соответствующим значениям d и roxygen. Значения Cexp соответствуют экспериментальной величине [12, 27] координационного числа в воде и расчетным значениям для органических растворителей, полученным из молекулярной динамики.
Значения, полученные при roxygen = 0.14 нм согласуются с расчетными и экспериментальными для ионов Mg2+ и Ca2+. Имеется расхождение с результатми для иона Be2+. Значения, полученные из межатомных расстояний в молекулярной динамике, согласуются с расчетными и экспериментальными для всех ионов при значении roxygen = 0.13 нм. Таким образом, использование значения roxygen = 0.13 нм позволяет добиться согласия теоретической модели с расчетными данными и экспериментом, в отличие от roxygen = 0.14 нм, определяемого по межатомному расстоянию в воде.
Таким образом, методом молекулярной динамики и с применением теоретических моделей исследованы свойства сольватных оболочек двухвалентных ионов в органических растворителях. Показано, что координационное число иона слабо зависит от растворителя для случая молекул, связывающихся с ионом атомом кислорода. С другой стороны, имеется существенная зависимость от сорта иона. Координационное число иона в таких растворителях совпадает с координационным числом в воде. Это связано с тем, что в молекулах воды также происходит связывание иона с атомами кислорода. Построен теоретический подход, обобщающий модель Магнуса–Гольдшмидта на координационные числа двухвалентных ионов в растворах. Полученная формула позволяет рассчитать координационное число исходя из размера иона и размера атома, связывающегося с ним. Показано, что использование значения радиуса атома кислорода в качестве подгоночного параметра позволяет добиться согласия молекулярной динамики и теоретической модели в широком диапазоне размеров иона. Теоретическая модель координационного числа является чувствительной к выбору величины данного параметра. Полученное значение радиуса атома кислорода 0.13 нм близко к половине расстояния между атомами кислорода в воде 0.14 нм. Однако, использование значения 0.14 нм для радиуса кислорода не позволяет добиться согласия модели с молекулярной динамикой и экспериментом. Теоретическая модель и молекулярно динамическиме расчеты согласуются с имеющимися экспериментальными данными по координационным числам ионов в водных растворах.
Расчеты выполнены на вычислительном кластере МСЦ РАН и суперкомпьютерном центре ОИВТ РАН. Автор выражает благодарность Г.Э. Норману за полезные обсуждения по теме статьи. Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 19-38-90063.
Список литературы
Lefrou C., FabryP., Poignet J. Electrochemistry: The Basics, With Examples. Springer. 2012. 353 p.
Møller K., Rey R., Masia M., Hynes J. // J. Chem. Phys. 2005. V. 122. P. 114508.
Ланкин А.В., Норман Г.Э., Орехов М.А. // Журн. физ. химии. 2019. Том. 93. № 8. С. 1123. https://doi.org/10.1134/s003602441908017x
Yamada Y., Takazawa Y., Miyazaki K., Abe T. // J. Phys. Chem. C. 2010. V. 114. P. 11680.
Smirnov V.S., Kislenko S.A. // Chem. Phys. Chem. 2019. V. 20. P. 1960
Веденяпина М.Д., Кулова Т.Л., Кудряшова Ю.О. и др. // Журн. физ. химии. 2020. Том. 94. № 6. С. 947. https://doi.org/10.1134/S0036024420060308
Pavlov S.V., Kislenko S.A. // Phys. Chem. Chem. Phys. 2016. V. 18. P. 30830.
Smirnov V.S., Kislenko S.A. // Chem. Phys. Chem. 2017. V. 19. P. 75.
Рахманова О.Р., Галашев А.Е. // Журн. физ. химии. 2017. Том. 91. № 5. С. 887.https://doi.org/10.1134/S003602441705020X
Шестаков А.Ф., Юдина А.В., Тулибаева Г.З. и др. // Журн. физ. химии. 2017. Том. 91. № 8. С. 1313. https://doi.org/10.1134/S0036024417080301
Chen F., Kerr R., Forsyth M. // J. Chem. Phys. 2018. V. 148. P. 193813.
Ohtaki H. // Chem. Rev. 1993. V. 93. P. 1157.
Putnis A., Putnis C.V. // Phys. Chem. Chem. Phys. 2014. V. 16. P. 7772.
Jiao D., King K., Grossfield A. et al. // J. Phys. Chem. B 2006. V. 110 P. 18553.
Han S. // Sci. Rep. 2019. V. 9. P. 5555.
Soetens J., Millot C., Maigret B. // J. Phys. Chem. A 1998. V. 102. P. 1055.
Salama M., Shterenberg I., Gizbar H. et al. // J. Phys. Chem. C. 2016. V. 120. P. 19586.
Ponrouch A., Bitenc J., Dominko R. et al. // Energy Storage Mater. 2019. V. 20. P. 253.
Cheng L., Assary R., Qu X. et al. // J. Phys. Chem. Lett. 2015. V. 6. P. 283.
Xie J., Lu Y. // Nat. Commun. 2020. V. 11. P. 2499.
Flamme B., Garcia G., Weil M. et al. // Green Chem. 2017. V. 19. P. 1828.
Norman G.E., Stegailov V.V. // Math. Models Comput. Simul. 2013. V. 5. № 4. P. 305.
Orekhov M. // Phys.Chem.Chem.Phys. 2017. V. 19. P. 32398.
Antropov A., Stegailov V. // J. Nucl. Mater. 2020. V. 553. P. 152110.
Dai J., Zhang W., Ren C., Guo X. // J. Mol. Liq. 2020. P. 114059.
Schmid N., Eichenberger A., Choutko A. // Eur. Biophys. J. 2011. V. 40. P. 843.
Zhen Li., Lin Frank Song, Pengfei Li, Kenneth M. Merz, Jr. // J. Chem. Theory Comput. 2020. V. 16. P. 4429.
Malde A.K., Zuo L., Breeze M. et al. // J. Chem. Theory. Comput. 2011. V. 7. P. 4026.
Stroet M., Caron B., Visscher K. et al. // J. Chem. Theory Comput. 2018. V. 14. P. 5834.
Darden T., York D., Pedersen L. // J. Chem. Phys. 1993. V. 98. P. 10089.
Hess B., Kutzner C., van der Spoel D., Lindahl E. // J. Chem. Theory Comput. 2008. V. 4. P. 435.
Megyes T., Gro´sz T., Radnai T. // J. Phys. Chem. A 2004. V.108. P.7261.
Lei X., Pan B. // J. Phys. Chem. A 2010. V. 114. P. 7595.
Бугаенко Л.Т., Рябых С.М., Бугаенко А.Л. // Вестн. Моск. ун-та. Сер. 2. Химия. 2008. Том. 49. № 6. С. 363.
Вайнштейн В.Б., Инденбом Л.М., Фридкин В.М. Современная кристаллография. Том 2. Структура кристаллов. М.: Наука, 1979. 360 с.
Bondi A. // J. Phys. Chem. 1964. V. 63. P. 441.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


