Журнал физической химии, 2021, T. 95, № 11, стр. 1716-1723
Сорбционные взаимодействия углеродных нанотрубок с энантиомерами гистидина в водных растворах
Д. Т. Ле a, *, Е. В. Бутырская a, **, Т. В. Елисеева a
a Воронежский государственный университет, Химический факультет
Воронеж, Россия
* E-mail: ledinhtuan@hpu2.edu.vn
** E-mail: bev5105@yandex.ru
Поступила в редакцию 12.03.2021
После доработки 20.04.2021
Принята к публикации 22.04.2021
Аннотация
Построены изотермы адсорбции энантиомеров гистидина на одностенных углеродных нанотрубках mkNANO-MKN-SWCNT-S1 из водных растворов. Установлено более высокое сродство нанотрубок к D-изомеру. Интерпретация данного явления проведена на основе квантово-химического моделирования взаимодействий в системе нанотрубка – L-(D-)гистидин и модели кластерной адсорбции.
Углеродные нанотрубки (УНТ) – новый тип наноматериалов с широким спектром технологических приложений, обусловленных их уникальными сорбционными, механическими, оптическими и др. свойствами [1–3]. Перспективным научным направлением является применение УНТ для разделения энантиомеров вследствие хиральности и высоких сорбционных свойств нанотрубок. Проблема энантиоразделения – одна из актуальнейших в современной фармакологии. Это обусловлено требованием хиральной чистоты лекарственных препаратов [4, 5], поскольку только один из энантионеров обладает фармакологическим эффектом, а второй может оказывать негативное влияние на организм. Cинтез же препаратов в лабораторных условиях позволяет, как правило, получить только смесь L- и D-изомеров. Хиральные УНТ использованы в ряде работ в качестве стационарных фаз для энантиоразделения фармацевтических и биологических препаратов, продемонстрировав эффективную способность к хиральному разделению [4–7]. В отдельных работах хиральные УНТ были внедрены в полимерные неподвижные фазы для улучшения хроматографического разделения [8, 9]. Важный момент применения УНТ в энантиоразделении – их высокая сорбционная способность к различным классам веществ. Поэтому нанотрубки, вероятно, могут стать универсальным сорбентом [10] для хирального разделения большого класса оптических соединений.
В литературе практически отсутствуют сведения о физико-химическом механизме взаимодействия УНТ с энантиомерами. Отдельные сведения о данных взаимодействиях могут быть получены методами квантовой химии и при анализе изотерм адсорбции L- и D-изомеров на УНТ, однако такие данные в литературе практически не представлены, за исключением нашей работы [11].
Квантово-химические расчеты энергии адсорбции аминокислот на углеродных наночастицах (УНЧ) представлены в литературе только для L-изомеров [12–14]. Данные расчеты в большинстве работ выполнены в рамках квантово-химических моделей, без учета дисперсионных поправок. Такое приближение не всегда правомочно из-за большой поляризуемости углеродных наночастиц.
В настоящей работе построены изотермы адсорбции L- и D-гистидина из водных растворов на одностенных углеродных нанотрубках. Методами квантовой химии исследована адсорбция их цвиттер-ионов на хиральной правовращающей трубке (7, 6) в водной среде в рамках теории функционала плотности с учетом дисперсионных поправок. Интерпретация изотерм также проведена в рамках модели кластерной адсорции [15].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Построение изотерм адсорбции. В качестве сорбента использованы одностенные углеродные нанотрубки mkNANO-MKN-SWCNT-S1 (Канада) с характеристиками: чистота 90%, диаметр 1–2 нм, длина 0.5–2 нм. Данные УНТ представляют собой смесь трубок различных хиральностей. В качестве сорбтива использованы основные аминокислоты L- и D-гистидин от производителя Sigma Aldrich (рKСООН = 1.7, ${\text{р}}{{K}_{{{\text{N}}{{{\text{H}}}_{{\text{2}}}}}}}$ = 9.09, рKR = 6.04 при 25°С). Углеродные нанотрубки заливали водным раствором аминокислот различных концентраций. Значение pH в водном растворе при варьировании исходной концентрации изменялось от 7.5 до 8.5, при этом гистидин находится в цвиттер-ионной форме. Полученные суспензии подвергали воздействию ультразвука в течение 3 мин с использованием ультразвуковой установки МЭФ91. Затем суспензии непрерывно перемешивали в течение 21 ч в шейкер-инкубаторе ES-20 для установления равновесия при 25°С. Данный режим подготовки был выявлен в результате кинетических исследований. Затем суспензии центрифугировали 10 мин на центрифуге Centurion Scientific. Определение концентрации аминокислоты в супернатанте проводили методом спектрофотометрии.
Компьютерный эксперимент. Оптимизация структуры и квантово-химический расчет энергий адсорбции цвиттер-ионов L- и D-гистидина на правовращающей углеродной нанотрубке в водном растворе выполнены с использованием программы Gaussian 09 [16, 17] методом B3LYP/6-31G(d,p) с учетом дисперсионной поправки GD3 (DFT-D3-метод) [18]. Поскольку УНТ обладают высокой поляризуемостью, учет дисперсионной поправки позволяет получить более точные значения энергии сорбции на УНТ химических соединений. Для учета водной среды применена модель сольватации РСМ [19]. В качестве модели УНТ использована правовращающая нанотрубка хиральности (7.6) длиной 16 Å с открытыми концами, что обусловлено сложностью выполнения процедуры закрытия концов хиральной трубки и незначительным влиянием концов на адсорбцию боковой поверхностью. В стартовых структурах сорбат + УНТ аминокислота располагалась на внешней боковой стороне. Такая фиксация вследствие большого аспектного отношения использованных в эксперименте УНТ дает больший вклад в адсорбцию.
Расчеты выполнены в Сибирском суперкомпьютерном центре Института вычислительной математики и математической геофизики Сибирского отделения Российской академии наук [20] и суперкомпьютерном центре Воронежского государственного университета.
Энергии адсорбции рассчитывали по формуле:
(1)
$ - {{E}^{{{\text{адс}}}}} = {{E}^{{{\text{сорбат}}}}} + {{E}^{{{\text{УНТ}}}}} - {{E}^{{{\text{сорбат}} + {\text{УНТ}}}}},$Модель кооперативной адсорбции. Данная модель разработана в нашей работе [15] и описывает адсорбцию мономерных молекул сорбата А с формированием на поверхности сорбента S кластеров различных размерностей в соответствии с уравнением:
(2)
$\left\{ \begin{gathered} S + A = SA, \hfill \\ S + 2A = S{{A}_{2}}, \hfill \\ \quad \;\; \ldots \hfill \\ S + nA = S{{A}_{n}}. \hfill \\ \end{gathered} \right.$(3)
$\begin{gathered} q = {{q}_{m}} \times \\ \times \;\frac{{{{K}_{1}}{{C}_{e}} + \frac{2}{{{{m}_{2}}}}{{K}_{2}}C_{e}^{2} + \ldots + \frac{i}{{{{m}_{i}}}}{{K}_{i}}C_{e}^{i} + \ldots + \frac{n}{{{{m}_{n}}}}{{K}_{n}}C_{e}^{n}}}{{1 + {{K}_{1}}{{C}_{e}} + {{K}_{2}}C_{e}^{2} + \ldots + {{K}_{i}}C_{e}^{i} + \ldots + {{K}_{n}}C_{e}^{n}}}. \\ \end{gathered} $1) i = mi для всех i = 1,2,…,n, что соответствует ситуации, когда все i-кластеры расположены в первом слое. При этом сорбент покрыт не одиночными невзаимодействующими молекулами сорбата, а кластерами сорбата разных размерностей, между молекулами которых возможны межмолекулярные взаимодействия. Уравнение (3) принимает вид:
(4)
$q = {{q}_{m}}\frac{{{{K}_{1}}{{C}_{e}} + {{K}_{2}}C_{e}^{2} + \ldots + {{K}_{i}}C_{e}^{i} + \ldots + {{K}_{n}}C_{e}^{n}}}{{1 + {{K}_{1}}{{C}_{e}} + {{K}_{2}}C_{e}^{2} + \ldots + {{K}_{i}}C_{e}^{i} + \ldots + {{K}_{n}}C_{e}^{n}}},$2) ${{m}_{i}} = 1$ (i = 1, 2, …, n) соответствует случаю, когда в первом слое каждого i- кластера находится одна молекула. Уравнение (3) принимает вид:
(5)
$q = {{q}_{m}}\frac{{{{K}_{1}}{{C}_{e}} + 2{{K}_{2}}C_{e}^{2} + \ldots + i{{K}_{i}}C_{e}^{i} + \ldots + n{{K}_{n}}C_{e}^{n}}}{{1 + {{K}_{1}}{{C}_{e}} + {{K}_{2}}C_{e}^{2} + \ldots + {{K}_{i}}C_{e}^{i} + \ldots + {{K}_{n}}C_{e}^{n}}}.$ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Изотермы адсорбции. Изотермы адсорбции L- и D-гистидина на УНТ марки mkNANO-MKN-SWCNT-S1 представлены на рис. 1. Относительное стандартное отклонение в экспериментах составило 6%. Изотермы относятся к IV типу по классификации ИЮПАК. Обе изотермы на каждом из участков выпуклы относительно оси Х. Для D-гистидина в области Ce < 0.02 моль/дм3 имеет место только начало формирования первого плато, для L-гистидина первое плато выражено более четко.
Из рис. 1 следует, что величина адсорбции D-гистидина для всех концентраций выше, чем для L-изомера. Большее сродство нанотрубок к D-изомеру проинтерпретировано методами квантовой химии и на основе кластерной модели адсорбции [15].
Квантово-химическое моделирование. На рис. 2 представлены оптимизированные структуры энантиомеров гистидина на боковой поверхности правовращающей углеродной нанотрубки (7, 6). Данные структуры при оптимизиции помещали в водную среду, учет которой осуществляли с применением модели сольватации.
Рис. 2.
Оптимизированные структуры энантиомеров гистидина на боковой поверхности правовращающей углеродной нанотрубки (7, 6) в водной среде.

В табл. 1 приведены характеристики систем УНТ – оптический изомер гистидина, представленных на рис. 2. Из табл. 1 следует, что энергия адсорбции D-гистидина больше, чем для L-изомера (столбец 1). Правовращающая УНТ более комплементарна к D-энантиомеру. Вследствие хиральности D-аминокислоты и закрученности УНТ, D-гистидин несколько ближе расположен к правовращающей УНТ (расстояние между их центрами масс составляет 7.91 Å (L) и 7.69 Å (D), табл. 1). Кроме того, анализ наименьших расстояний от атомов кислорода и азота цвиттер-иона аминокислоты до атома углерода УНТ показывает, что данные расстояния для трех атомов азота D-изомера меньше, чем для L-аминокислоты (табл. 1). Однако только один из атомов кислорода D-изомера расположен ближе к соответствующему атому С нанотрубки, а второй– несколько дальше по сравнению с L-изомером (табл. 1). По данным расчета три атома азота и два атома кислорода аминокислот имеют отрицательный заряд на атомах по Малликену, а ближайшие к ним атомы углерода – положительный. Таким образом, четыре атома (три атома N и один атом O) из пяти электроотрицательных атомов карбонильной группы и аминогруппы D-гистидина менее удалены от ближайших атомов углерода нанотрубки с положительным зарядом, чем для L-изомера. Это – одна из причин большей величины энергии адсорбции D-изомера на УНТ и коррелирует с теорией трехточечного взаимодействия [21].
Таблица 1.
Энергия адсорбции (Еads, ккал/моль), наименьшее расстояние от атомов кислорода и азота цвиттер-иона аминокислоты до атома углерода нанотрубки (RCO1, RCO2, RCN1, RCN2, RCN3), расстояние между центрами масс аминокислоты и УНТ (R), дипольный момент (d, D), суммарные заряды на атомах по Малликену АК и УНТ (рис. 2)
| –Eads, ккал/моль |
RCO1, RCO2, Å |
RCN1 RCN2 RCN3, Å |
R, Å | d, D | qАК qунт |
|---|---|---|---|---|---|
| L-изомер | |||||
| 14.06 | 3.24 3.31 |
3.29 3.75 4.42 |
7.91 | 24.99 | –0.0007 0.0007 |
| D-изомер | |||||
| 14.89 | 3.22 3.41 |
3.23 3.69 4.08 |
7.69 | 15.06 | 0.006 –0.006 |
В оптимизированных структурах расстояния от атомов О и N сорбата до атомов С нанотрубки больше сумм соответствующих ковалентных радиусов, поэтому ковалентные связи между гистидином и нанотрубкой не образуются. Анализ зарядов на атомах в оптимизированных структурах (табл. 1) позволяет сделать вывод о практически полном отсутствии переноса электронной плотности с сорбата на сорбент при адсорбции, поэтому комплекс с переносом заряда в системе аминокислота – УНТ не образуется. Это позволяет сделать вывод о том, что наиболее вероятным механизмом закрепления аминокислоты на УНТ являются силы Ван-дер-Ваальса и π–π-взаимодействия между имидазольным кольцом гистидина и УНТ.
Интерпретация изотерм в рамках модели кластерной адсорбции. Изотермы были проинтерпретированы на основе уравнения (3) кластерной адсорбции. Несмотря на сложность уравнения (3) его форма для конкретных систем часто является более простой. Для изотерм с двумя плато и S-образных изотерм в качестве начального уравнения можно принять
(6)
$q = {{q}_{m}}\frac{{{{K}_{1}}{{C}_{e}} + \frac{n}{{{{m}_{n}}}}{{K}_{n}}C_{e}^{n}}}{{1 + {{K}_{1}}{{C}_{e}} + {{K}_{n}}C_{e}^{n}}},$В настоящее время доступно большое количество программных пакетов для определения неизвестных параметров аппроксимирующего уравнения по набору экспериментальных точек (Datafit, Scilab, Matlab CurveFitting, Fityk и т.д.). Определив значения параметров изотермы (2), можно определить наиболее вероятную структуру сорбата на поверхности сорбента, т.е. определить размерности кластеров i (i = 1, 2, …, n), сорбированных на поверхности сорбента, и mi – количество мономеров в первом слое кластера размерности i по данным экспериментальной изотермы адсорбции.
Для адсорбции L- и D-гистидина на УНТ такой подход дает следующие уравнения экспериментальных изотерм:
для L-гистидина
(7)
$\begin{gathered} q = {{q}_{m}}\frac{{{{K}_{1}}{{C}_{e}} + \frac{{13}}{{12}}{{K}_{{13}}}C_{e}^{{13}}}}{{1 + {{K}_{1}}{{C}_{e}} + {{K}_{n}}C_{e}^{{13}}}} = {{q}_{1}} + {{q}_{{13}}}, \\ {{R}^{2}} = 0.999, \\ \end{gathered} $для D-гистидина
(8)
$q = {{q}_{m}}\frac{{{{K}_{1}}{{C}_{e}} + {{K}_{9}}C_{e}^{9}}}{{1 + {{K}_{1}}{{C}_{e}} + {{K}_{9}}C_{e}^{9}}},\quad {{R}^{2}} = 0.996,$Согласно физико-химическому смыслу параметров уравнений изотермы (3), (7), (8) можно сделать вывод, что L-гистидин сорбируется на поверхности преимущественно в форме мономеров и кластеров размерности 13. Причем в первом слое данных кластеров находится 12 мономеров (т.е. все молекулы, кроме одной, находящейся во втором слое). D-гистидин сорбируется на поверхности преимущественно в форме мономеров и кластеров размерности 9, расположенных в первом слое. Объяснение этому дано в конце настоящего раздела. Мономеры, входящие в состав кластеров, связаны между собой водородными связями.
Экспериментальные изотермы изображены на рис. 3 и 4 точками, а теоретические (графики уравнений (7) и (8)) – сплошной кривой. Величины R2 позволяют сделать вывод, что указанные уравнения достаточно хорошо аппроксимируют экспериментальные изотермы. Поэтому выбор уравнения в форме (6) достаточен. Каждое из уравнений (7), (8) может быть представлено в виде суммы двух слагаемых ${{q}_{1}} + {{q}_{n}}$ (n = 13 для L-, n = = 9 для D-гистидина) в соответствии с числом слагаемых в числителях (7), (8). Первое слагаемое описывает вклад в адсорбцию мономеров, второе – кластеров. В соответствии с этим, теоретическая изотерма может быть разложена на вклады в адсорбцию мономеров и кластеров. Такие разложения также представлены на рис. 3, 4 точечными и пунктирными линиями.
Рис. 3.
Экспериментальная (точки) и рассчитанная по уравнению (7) (сплошная линия) изотермы адсорбции L-гистидина на УНТ MKN-SWCNT-S1 из водного раствора: точечная и пунктирная кривые – вклады в адсорбцию мономеров и кластеров из 13 молекул L-гистидина соответственно.

Рис. 4.
Парциальные и суммарные изотермы адсорбции D-гистидина на УНТ MKN-SWCNT-S1 из водного раствора: точки – эксперимент, сплошная кривая – расчет по уравнению (8), точечная и пунктирная кривые – вклады в адсорбцию мономеров и кластеров из 9 молекул D-гистидина, соответственно.
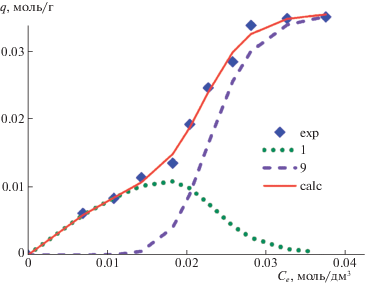
Данные рис. 3 показывают, что при равновесной концентрации внешнего раствора Се < < 0.02 моль/дм3, L-гистидин адсорбируется на УНТ в форме мономеров. Их вклад в адсорбцию (q1) при малых Се является основным и увеличивается с ростом концентрации до значений Ce = = 0.0215 моль/ дм3. При Сe > 0.0215 моль/дм3 вклад в адсорбцию мономеров начинает уменьшаться. Процесс адсорбции кластеров из 13 молекул начинается при концентрации Ce = 0.02 моль/дм3. Соответствующая величина адсорбции (q13) монотонно возрастает с ростом концентрации. В точке пересечения кривых q1 и q13 (Ce = 0.0265 моль/л), вклад мономеров и кластеров в величину адсорбции L-гистидина на УНТ одинаков.
На рис. 4 представлены экспериментальные и рассчитанные по уравнению (8) изотермы адсорбции D-гистидина на УНТ MKN-SWCNT-S1 из водного раствора. Из данных рис. 4 следует, что при равновесной концентрации внешнего раствора Се < 0.0133 моль/дм3 имеет место только адсорбция мономеров (q1). Ее вклад в адсорбцию преобладает до Ce = 0.0183 моль/дм3, после чего начинает уменьшаться. При Ce = 0.0133 моль/дм3 начинается процесс адсорбции кластеров из девяти молекул. Соответствующая величина адсорбции (q9) монотонно возрастает с увеличением Се. В точке пересечения кривых q1 и q9 (Ce = = 0.0205 моль/л), вклад мономеров и кластеров в величину адсорбции D-гистидина на УНТ одинаков.
Емкость монослоя (qm) D-гистидина на УНТ (8) больше, чем для L-изомера (7). Это обусловлено влиянием аминокислот на диспергируемость УНТ в водных растворах. Несмотря на их плохую диспергируемость в воде, нанотрубки образуют стабильные суспензии в водных растворах ряда аминокислот [22]. При этом диспергируемость УНТ зависит от того, в водный раствор какой аминокислоты они добавлены. Энергия адсорбции D-гистидина на правовращающей УНТ, больше, чем L-аминокислоты (табл. 1). Как следствие, нанотрубки лучше диспергируются в водном растворе D-изомера, имеющего большую энергию взаимодействия с УНТ. Взаимодействие хиральных сорбатов с сорбентом максимально, если сорбент обладает определенным типом хиральности. Следовательно, в нанотрубках mkNANO-MKN-SWCNT-S1, использованных в эксперименте, преобладают правовращающие трубки.
Улучшение диспергируемости УНТ в водном растворе аминокислоты обусловлено следующим. Нанотрубки гидрофобны, поэтому вблизи УНТ в результате сорбции находятся в основном молекулы аминокислоты. Сорбированные на УНТ молекулы аминокислоты связаны водородными связями с молекулами воды внешнего раствора. Это ослабляет ван-дер-ваальсово взаимодействие нанотрубок друг с другом в водном растворе аминокислоты вследствие высокого сродства аминокислоты к воде, что улучшает диспергируемость.
Выше отмечено, на первом этапе сорбция осуществляется в виде мономеров (первое плато на изотерме адсорбции). Мономеры заполняют наиболее реакционные места поверхности: концы нанотрубок, нанотрубки меньшего диаметра, дефекты нанотрубок. Использованные УНТ содержат нанотрубки различных диаметров от 1 до 2 нм. Согласно данным литературы, нанотрубки меньшего диаметра и конечные участки УНТ имеют большую реакционную способность вследствие большей кривизны поверхности [23–25]. Кроме того, нанотрубки не являются идеально прямыми цилиндрами, вследствие чего кривизна участков внешней боковой поверхности может различаться [26, 27]. Следовательно, даже на внешней боковой поверхности УНТ имеются участки с различной энергией взаимодействия с молекулами сорбата. Мономеры сорбируются на участках с большей энергией взаимодействия сорбент–сорбат. Внутрь УНТ молекулы аминокислоты не проникают, поскольку использованные нанотрубки имеют закрытые концы, а размеры дефектов недостаточны для проникновения молекул сорбата внутрь.
Адсорбция аминокислоты на УНТ в форме кластеров (второе плато на изотерме, см. комментарии к (7), (8)) может быть проинтерпретирована следующим образом. У поверхности УНТ находятся два атома азота для L-гистидина (три для D-гистидина) и два атома кислорода для обеих оптических изомеров (рис. 2). При сорбции энантиомеров разрываются их водородные связи с молекулами воды раствора. Число таких водородных связей не менее 4 в соответствии с числом атомов О и N аминокислоты, повернутых к трубке (рис. 2). Энергия водородной связи О–Н…О (О–Н…N) составляет ~4.7 ккал/моль [28]. Энергия адсорбции гистидина на УНТ недостаточна для разрыва четырех Н-связей (табл. 1). Поэтому на менее реакционных участках при низких концентрациях адсорбция не имеет места. Десорбция молекул сорбата с данных участков в раствор энергетически выгодна, силы взаимодействия сорбент–сорбат недостаточно для прочной фиксации вследствие наличия водородных связей аминокислоты с молекулами воды раствора. Однако ситуация может измениться при одновременной (или достаточно быстрой последовательной) адсорбции нескольких молекул с формированием на поверхности кластера сорбата.
Очевидно, что формирование кластеров сорбата вдоль поверхности УНТ наиболее энергетически выгодно, поскольку здесь достаточно сильным является адсорбционный потенциал нанотрубки. Дополнительный выигрыш в энергии получается вследствие наличия взаимодействий сорбат–сорбат (водородных связей в данном случае) между молекулами кластера. Причем их число увеличивается с ростом размера кластера, что способствует более прочной фиксации кластера сорбата. Данные взаимодействия также вносят вклад в понижение энергии системы в результате адсорбции.
Водородные связи обладают свойством кооперативности. Свойство кооперативности (или неаддитивности) заключается в изменении величины межмолекулярного взаимодействия между молекулами в сложных кластерах по сравнению с димерами. Так, изменение энергии Н-связи в сложном кластере из 10 молекул по сравнению с димером составляет, по данным литературы, от 30 до 200% [29]. Поэтому формирование кластера сорбата на УНТ может привести к достаточному усилению межмолекулярных связей между его молекулами и сделать адсорбцию кластера энергетически выгодной на менее реакционных участках УНТ.
Такую адсорбцию можно назвать кооперативной. Термин “кооперативная адсорбция” обозначает сорбционный процесс, при котором начальное связывание вещества сорбентом облегчает дальнейшую адсорбцию [30]. В данном случае адсорбция мономеров на начальном этапе может способствовать формированию вокруг них кластеров вследствие дополнительного понижения энергии системы, обусловленного взаимодействиями сорбат–сорбат. Кроме того, предпочтительная адсорбция в форме кластеров на менее реакционных участках обусловлена увеличением числа сорбат-сорбатных связей и свойством кооперативности Н-связи.
Таким образом, показано, что в интервале концентраций 0.005–0.04 моль/дм3 величина адсорбции D-аминокислоты на УНТ выше, чем для L-изомера. Методами квантовой химии показано, что мономеры D-гистидина имеют более высокую энергию адсорбции на правовращающих трубках и большее число близких контактов функциональных групп аминокислоты с поверхностью трубки. На основе модели кластерной адсорбции [15] показано, что L- и D-гистидин сорбируются на поверхности нанотрубки, главным образом, в форме мономеров и кластеров размерности 13 (L-) и 9 (D-гистидин). Предложена интерпретация энергетической предпочтительности адсорбции в форме кластеров.
Список литературы
Раков Е.Г. // Успехи химии. 2013. Т. 82. № 1. С. 27. https://doi.org/10.1070/RC2013v082n01ABEH004227
Dai H., Hafner J.H., Rinzler A.G. et al. // Nature. 1996. V. 384. P. 147. https://doi.org/10.1038/384147a0
Zhai P., Isaacs J.A., Eckelman M.J. // Appl. Energy. 2016. V. 173. P. 624.https://doi.org/10.1016/j.apenergy.2016.04.001
Yoshio M., Hiroyuki N. // Pharmaceuticals and Drugs. 2006. https://doi.org/10.1002/9780470027318.a1906
Карцова Л.А., Объедкова Е.В., Протасова И.Д. // Сорбционные и хроматографические процессы. 2013. Т. 13. № 3. С. 257.
Ankur G., Nirmal M., Surajit K. et al. // Molecules. 2019. V. 24. № 6. P. 1007. https://doi.org/10.3390/molecules24061007
Hemasa A.L., Naumovski N., Maher W.A., Ghanem A. // Nanomaterials. 2017. V. 7. 186. P 1. https://doi.org/10.3390/nano7070186
Ayman L.H., Nenad N., William A.M. et al. // Nanomaterials. 2017. V. 7. № 7. P. 186. https://doi.org/10.3390/nano7070186
Speltini A., Merli D., Dondi D. et al. // Anal. Bioanal.Chem. 2012. V. 403. P. 1157. https://doi.org/10.1007/s00216-011-5606-y
Федорова И.А., Шаповалова Е.Н., Шпигун О.А. // Сорбционные и хроматографические процессы. 2018. Т. 18. № 5. С. 916.
Butyrskaya E.V., Zapryagaev S.A., Izmailova E.A. et al. // J. Phys. Chem. C. 2017. V. 121. № 37. P. 20524. https://doi.org/10.1021/acs.jpcc.7b06849
Leon de. A., Jalbout A.F., Basiuk V.A. // Chem. Phys. Letters. 2008. V. 457. P. 185. https://doi.org/10.1016/j.cplett.2008.03.079
Roman T., Dino W.A., Nakanishi H., Kasai H.// Eur. Phys. J. D. 2006. V. 38. № 1. P. 117. https://doi.org/10.1140/epjd/e2006-00043-1
Ganji M.D. // Diamond and related materials. 2009. V. 18. № 4. P. 662. https://doi.org/10.1016/j.diamond.2008.11.021
Butyrskaya E.V., Zapryagaev S.A., Izmailova E.A. // Carbon. 2019. V. 143. P. 276. https://doi.org/10.1016/j.carbon.2018.10.086
Frisch M.J., Trucks G.W., Schlegel H.B. et al. Gaussian 09. Revision D.01. Gaussian, Inc., Wallingford CT. 2013.
Бутырская Е.В. Компьютерная химия: основы теории и работа с программами Gaussian и GaussView. М.: Солон-Пресс, 2011.
Grimme S., Antony J., Ehrlich S. et al. // J. Chem. Phys. 2010.V. 132. P. 154104. https://doi.org/10.1063/1.3382344
Foresman J.B., Keith T.A., Wiberg K.B. et al. // J. Phys. Chem. 1996. V. 100. № 40. P. 16098. https://doi.org/10.1021/jp960488j
“Сибирский суперкомпьютерный центр СО РАН” (ЦКП ССКЦ СО РАН). http://www.sscc.icmmg.nsc.ru/info.html
Dalgliesh C. // J. Chem. Soc.1952. V. 137.
Lingyu P., Quanrun L., Yongdan L. // J. Phys. Chem. 2012. V. 116. № 2. P. 1724. https://doi.org/10.1021/jp2085318
Бадамшина Э.Р., Гафурова М.П., Эстрин Я.И. // Успехи химии. 2010. V. 79. № 11. P. 1027. https://doi.org/10.1070/RC2010v079n11ABEH004114
Seongjun P., Deepak S., Kyeongjae C. // Nano Letters. 2003. V. 3. № 9. P. 1273. https://doi.org/10.1021/nl0342747
Gulseren O.,Yildirim T., Ciraci S. // Phys. Rev. Letters. 2001. V. 87. № 11. https://doi.org/10.1103/PhysRevLett.87.116802
Schaefer D.W., Justice R.S. // Macromolecules. 2007. V. 40. № 24. P. 8501. https://doi.org/10.1021/ma070356w
Раков Э.Г. // Успехи химии, 2013. Т. 82. № 6. С. 538.https://doi.org/10.1070/RC2013v082n06ABEH004340
Takagi S., Shintani R., Chihara H. et al. // Bull. Chem. Soc. Japan. 1959. V. 32. P. 137.
Mahadevi A.S., Sastry G.N. // Chem. Rev. 2016. V. 116. P. 2775. https://doi.org/10.1021/cr500344e
Reed D.A., Keitz B.K., Oktawiec J. et al. // Nature. 2017. V. 550. P. 96. https://doi.org/10.1038/nature23674.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии



