Журнал физической химии, 2021, T. 95, № 2, стр. 285-293
Особенности рекуррентной аппроксимации параметров удерживания полифункциональных соединений в обращенно-фазовой высокоэффективной жидкостной хроматографии
И. Г. Зенкевич a, *, Д. А. Никитина a
a Санкт-Петербургский государственный университет, Институт химии
Санкт-Петербург, Россия
* E-mail: izenkevich@yandex.ru
Поступила в редакцию 21.04.2020
После доработки 10.06.2020
Принята к публикации 23.06.2020
Аннотация
Пять препаратов противоопухолевого действия выбраны в качестве примеров полифункциональных органических соединений для проверки возможностей аппроксимации их параметров удерживания в обращенно-фазовой высокоэффективной жидкостной хроматографии с использованием рекуррентных соотношений вида tR(C + ΔС) = atR(C) + b, где С – концентрация органического модификатора в составе элюента (ацетонитрил), ΔС = const – постоянный “шаг” изменения его концентрации, a и b – коэффициенты, вычисляемые методом наименьших квадратов. В результате выявлены примеры как идеально линейных зависимостей во всех интервалах содержаний ацетонитрила, так и отклонений от линейности в различных диапазонах его концентраций. Обсуждение возможных причин таких отклонений (как структурных факторов, так и физико-химических свойств) позволяет предположить, что главными из них являются не кислотно-основные равновесия в элюенте, положение которых зависит от содержания органического компонента. Более вероятным представляется обратимое образование гидратных форм, типичное для соединений, молекулы которых содержат такие полярные фрагменты, как амидные –CO–NH- и сульфонамидные –SO2–NH-группы. Показано, что именно рекуррентную аппроксимацию параметров удерживания можно считать наиболее простым и наглядным способом выявления специфических взаимодействий анализируемых соединений с компонентами элюента.
Во всех хроматографических методах уравнения, связывающие параметры удерживания аналитов с характеристиками процессов разделения, относятся к важнейшим соотношениям. В газовой хроматографии зависимость исправленных времен удерживания ($t_{R}^{'}$ = tR – t0, где t0 – время удерживания несорбируемого компонента) любых соединений на любых неподвижных фазах или сорбентах от температуры хроматографической колонки (Т) с достаточно высокой точностью может быть аппроксимирована двухпараметровым уравнением Антуана [1]:
где a и b – коэффициенты, вычисляемые методом наименьших квадратов.Однако в обращенно-фазовой высокоэффективной жидкостной хроматографии (ОФ ВЭЖХ) для характеристики зависимости параметров удерживания от содержания органического компонента в составе элюента (С) единого уравнения столь же высокой степени общности не существует. Для соединений различной химической природы в различных условиях элюирования используют несколько аппроксимирующих уравнений, в том числе даже полиномы второй степени [2–5]:
Логарифмическая зависимость вида (2) является основой известных уравнений Снайдера и Снайдера–Сочевинского [6, 7], гиперболическое соотношение (4) – суть модели Скотта и Кучеры [8]. Следует отметить, что для аппроксимации зависимостей tR(C) разных соединений даже в рамках одних и тех же циклов разделения оптимальными могут оказаться разные уравнения, в том числе “нестандартное” соотношение (3) [9]. Однако, несмотря на такое многообразие функциональных зависимостей tR(C) в ОФ ВЭЖХ, все они могут быть заменены единым уравнением, относящимся к типу так называемых линейных рекуррентных соотношений [9–11]:
где ΔС = const – постоянный “шаг” изменения концентрации органического модификатора в составе элюента, a и b – коэффициенты, вычисляемые методом наименьших квадратов.Линейные рекуррентные соотношения применимы к монотонным функциям целочисленных (n) (7) или равноотстоящих на величину (Δx = const) (8) значений аргумента (x) и обладают рядом необычных математических свойств. В частности, они сочетают свойства арифметических и геометрических прогрессий, а их математическими эквивалентами являются полиномы переменных степеней [12].
Как функции целочисленных аргументов (7) рекуррентные соотношения аппроксимируют зависимости большинства физико-химических свойств органических соединений от числа атомов углерода (nC) в молекулах гомологов, так как такой аргумент по определению не может быть нецелочисленным. Их применимость к функциям равноотстоящих значений аргумента (8) распространяется на свойства, зависящие от температуры, давления или концентраций компонентов смесей [12]. Именно последняя область применения рекуррентных соотношений (концентрация органического растворителя в составе элюента в ОФ ВЭЖХ) рассматривается в настоящей работе.
Применимость уравнений вида (6) в ОФ ВЭЖХ была продемонстрирована всего для нескольких относительно несложных соединений, в том числе фенола и природного флавоноида кверцетина [10, 11]. Это представляется недостаточным, так как, в отличие от соотношения (1), описывающего газохроматографическое поведение любых органических соединений, характер взаимодействий аналитов с компонентами элюента и с модифицированным силикагелем в ОФ ВЭЖХ значительно сложнее. В первую очередь на их хроматографическое удерживание влияют кислотно-основные равновесия вида АН + H2O $ \rightleftarrows $ $ \rightleftarrows $ [H3O]+ + A– или B + [H3O]+$ \rightleftarrows $ BH+ + H2O. Дополнительные сложности связаны с тем, что положение таких равновесий и, следовательно, значения pKa зависят от содержания органического растворителя (С) в составе элюента. Известно, что увеличение С приводит к заметному увеличению значений рKа [13, 14]. Это можно проиллюстрировать, например, данными для растворов двух циклических производных фосфорной кислоты в смесях воды с этиловым спиртом, когда замена воды 50%-ным этиловым спиртом увеличивает рKа на единицу, а 95%-ным этиловым спиртом – уже на три единицы [15]:
| Соединение | рКа (концентрация EtOH, об. %) |
|---|---|
| 2-Гидрокси-4-метил-1,3,2-диоксафосфан-2-оксид | 1.75(0), 2.85(50), 3.21(80), 4.54(95) |
| 2-Гидрокси-5,5-диметил-1,3,2-диоксафосфоринан-2-оксид | 1.67(0), 2.76(50), 4.70(95) |
Кроме того, закономерности хроматографического удерживания в ОФ ВЭЖХ значительно усложняются в результате обратимого взаимодействия анализируемых соединений с компонентами элюента, прежде всего, образования гидратов. Подобные процессы, в частности, позволили объяснить аномалии хроматографического удерживания таких природных флавоноидов как кверцетин и дигидрокверцетин, содержащих бензо-γ-пироновый фрагмент структуры, определяющий легкость образования их гидратных форм в растворах [16].
Таким образом, для органических соединений, содержащих несколько функциональных групп, можно ожидать проявления сложных зависимостей tR(C), для описания которых уравнения (2)–(5) могут оказаться непригодными. Именно для подобных полифункциональных соединений актуальна проверка возможностей рекуррентной аппроксимации зависимостей их параметров удерживания от содержания органического компонента элюента, что составило предмет настоящей работы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Используемые реактивы и приготовление образцов. В качестве полифункциональных соединений выбраны пять противоопухолевых препаратов (I–V), производимых ЗАО “Биокад” (Санкт-Петербург). Их названия, формулы, молекулярные массовые числа и номера CAS приведены далее в табл. 1. Для приготовления подвижных фаз использовали деионизованную воду (удельное сопротивление 18.2 мОм⋅м), полученную на установке Milli-Q (Millipore, США), ацетонитрил (HPLC-gradient grade, Panreac, Испания), трифторуксусную и муравьиную кислоты (Panreac, Испания); дегазирование элюентов осуществляли фильтрованием под вакуумом и обработкой приготовленных водно-ацетонитрильных смесей ультразвуком с использованием установки Сапфир ТТЦ, 420 Вт (Сапфир, Россия). Образцы для анализа готовили растворением индивидуальных веществ в соответствующей подвижной фазе.
Таблица 1.
Химические и тривиальные названия, молекулярные и структурные формулы характеризуемых соединений
| Тривиальное название | Молекулярная формула | Структурная формула | Название IUPAC | М | CAS № |
|---|---|---|---|---|---|
| Гефитиниб (I) (Gefitinib) | C22H24ClFN4O3 | 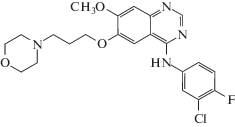 |
N-(4-Фтор-3-хлор-4-фторфенил)-7-метокси-6-[3-(морфолин-4-ил)пропокси]хиназолин-4-амин | 446 | 184475-35-2 |
| BTK (II) | C26H23FN8O2 | 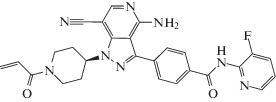 |
4-(4-Амино-7-циано-1-[(3R)-1-проп-2-еноил)пиперидин-3-ил)-1H-пиразоло[4,3-с]пиридин-3-ил)-N-фторпиридин-2-ил)бензамид | 494 | Нет |
| Пазопаниб (III) Pazopanib* | C21H23N7O2S | 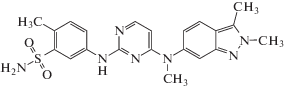 |
5-[[4-[(2,3-Диметилиндазол-6-ил)метиламино]пиримидин-2-ил]амино]-2-метилбензолсульфонамид | 437 | 444731-52-6 |
| Бозентан (IV) Bozentan |
C27H29N5O6S | 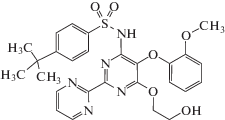 |
4-(1,1-Диметилэтил)-N-[6-(2-гидроксиэтокси)-5-(2-метоксифенокси)-[2,2'-бипиримидин]-4-илбензолсульфонамид | 551 | 147536-97-8 |
| Иматиниб (V) Imatinib | C29H31N7O | 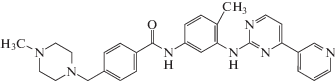 |
4-[(4-Метил-1-пиперазинил)метил]-N-[4-метил-3-[4-(3-пиридинил)-2-пиримидиниламино]фенил]бензамид | 493 | 152459-95-5 |
Условия хроматографического анализа в режиме изократического разделения. Хроматографические эксперименты выполнены на жидкостном хроматографе Agilent 1260 Infinity с диодно-матричным детектором с использованием следующих колонок: InfinityLab Poroshell 120 EC-C18, 50 × 3.0 мм, размер частиц сорбента 2.7 мкм (соединение I); InfinityLab Poroshell 120 EC-C18, 100 × 3.0 мм (2.7 мкм) (II); XBridge, Waters Phenyl, 50 × 4.6 мм (3.5 мкм) (III); Poroshell 120 EC-CN, 100 × 3.0 мм (2.7 мкм) (IV); InfinityLab Poroshell 120 EC-C18, Xbridge Phenyl 50 × 4.6 мм (3.5 мкм) (V) в водно-ацетонитрильных подвижных фазах с добавками ацетата аммония или муравьиной и трифторуксусной кислот в изократическом режиме при расходе элюента 0.4 мл/мин и температуре колонки 40°C. Состав подвижных фаз для каждого из соединений I–V указан далее в табл. 2. Объем проб составлял 5 мкл. Число параллельных определений для одних и тех же образцов в одинаковых условиях равно трем, времена удерживания несорбируемого компонента (t0), указанные в табл. 2, оценивали по 0.1 М раствору бромиду калия (“х.ч.”, Sigma-Aldrich, Москва).
Таблица 2.
Константы кислотности характеризуемых соединений (экспериментальные данные со структурным отнесением) и абсолютные времена удерживания при разных составах элюента
| Название | pKa (отнесение к фрагменту) | Состав элюента | рН(B) | t0, мин | tR (мин) [C(A)] |
|---|---|---|---|---|---|
| Гефитиниб (I) | 5.4 (аминохиназолиновый), 7.2 (морфолиновый) |
A. CH3CN B. 4 мM CH3CO2NH4 в H2O |
5.7 | 0.58 | 3.63(35), 2.39(40), 1.68(45), 1.33(50), 1.11(55), 0.99(60), 0.91 (65) |
| BTK (II) | 3.1 (индазольный) 10.4* |
A. CH3CN B. H2O |
** | 0.94 | 1.78(40), 1.43(45), 1.23(50), 1.08(55)***, 1.03(60), 0.99(65) |
| Пазопаниб (III) | 2.3 (индазольный), 5.1 (аминопиримидиновый), 10.4 (сульфонамидный) |
A. 0.02% CF3CO2H
в CH3CN B. 0.02% CF3CO2H в смеси H2O (85%) и CH3CN (15%) |
2.6 | 0.96 | 2.17(20), 1.63(25), 1.36(30), 1.21(35), 1.11(40), 1.04(45), 0.99(50) |
| Бозентан (IV) | 5.5 (бипиримидиновый) | A. 0.1% HCO2H в CH3CN B. 0.1% HCO2H в H2O |
2.7 | 1.2 | 5.54(50), 3.79(55), 2.96(65), 2.45(70), 2.11(70) |
| Иматиниб (V) | 2.5* 4.0 (аминопиримидиновый), 8.3 (пиперазиновый) |
A. 0.2% HCO2H в CH3CN B. 0.2% HCO2H в H2O |
2.9 | 2.2 | 2.47(35), 2.28(40), 2.17(45), 2.10(50), 2.06(55), 2.02(60), 1.99(65) |
Обработка результатов. Хроматограммы получали, обрабатывали и хранили в программе Mass Hunter (Agilent Technologies), для статистической обработки данных использовали ПО Excel (Microsoft Office, 2010). Вычисление параметров рекуррентных зависимостей проводили с использованием ПО Origin (версия 4.1).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Общая характеристика объектов анализа. В качестве модельных полифункциональных соединений для рассмотрения рекуррентной аппроксимации зависимостей их параметров удерживания от состава элюента выбраны пять противоопухолевых препаратов (I–V), производимых ЗАО “Биокад” (Санкт-Петербург). Их характеристика, включающая химические и тривиальные названия, молекулярные и структурные формулы, молекулярные массовые числа и номера CAS приведена в табл. 1.
Оптимальные условия хроматографического разделения [состав элюента, соотношения органической (А) и водной (В) фаз] подобраны для каждого соединения индивидуально и указаны в табл. 2. Поскольку контроль реальных значений рН элюентов разного состава представляет собой достаточно непростую задачу, значения рН указаны только для водных составляющих элюента (В). Кроме того, в табл. 2 указаны экспериментальные значения pKa с их отнесением к тем или иным структурным фрагментам молекул.
В последней графе табл. 2 перечислены средние значения непосредственно измеряемых (неисправленных) времен удерживания соединений I–V при разных составах элюента. Соответствующие исправленные времена удерживания могут быть вычислены (при необходимости) вычитанием приведенных в этой же таблице значений t0. Содержание органического компонента (ацетонитрил) в элюенте варьирует приблизительно от 35–40 до 65 об.%, минимально для соединения III, а максимально – для наиболее гидрофобного соединения V, $\lg P$ = 3.70.
Рекуррентная аппроксимация времен удерживания. На рис. 1 на примере соединения I сопоставлены два варианта представления зависимости его времен удерживания от содержания органического компонента элюента. “Традиционный” способ (а) представляет собой нелинейную зависимость tR(C), которую можно аппроксимировать разными способами с использованием уравнений (2)–(4) [аппроксимация полиномом второй степени (5) в данном случае дает неудовлетворительные результаты].
Рис. 1.
График зависимости времени удерживания (tR, мин) гефитиниба (I) от содержания ацетонитрила в элюенте (С, об. %) (а); б – график линейной рекуррентной зависимости tR(C+5%) = atR(C) + b, параметры линейной регрессии: a = 0.555 ± 0.007, b = 0.372 ± 0.016, R = 0.9996, S0 = 0.017.
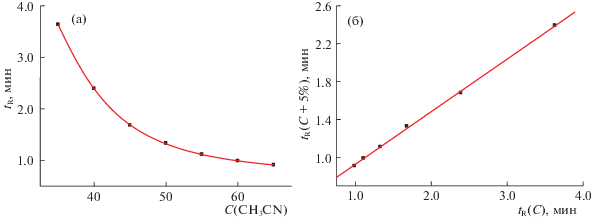
На рис. 1б приведен график линейной рекуррентной зависимости (6), соответствующий “шагу” варьирования концентрации ацетонитрила 5% (параметры уравнения линейной регрессии указаны в подписи к рисунку). Поскольку значение коэффициента корреляции превышает 0.999, то расположение точек на рис. 1б визуально неотличимо от прямой линии, что может быть интерпретировано как отсутствие каких-либо аномалий хроматографического поведения гефитиниба (I) в интервале концентраций ацетонитрила в элюенте от 35 до 65%. Значение рН водной составляющей элюента равно 5.7 (табл. 2) и превышает величину рKа, определяемую аминохиназолиновым фрагментом молекулы (5.4), но меньше значения 7.2, обусловленную морфолиновым фрагментом структуры (все значения рН и рKа симбатно увеличиваются по мере возрастания содержания CH3CN в элюенте). Можно ожидать, что интерпретация линейной рекуррентной зависимости (рис. 1б) существенно нагляднее по сравнению с нелинейной зависимостью, представленной на рис. 1а. Кроме того, важным практическим преимуществом рекуррентных соотношений (6) по сравнению с “традиционными” уравнениями (1)–(5) является отсутствие необходимости определения “мертвого” времени хроматографической системы (t0) и пересчета непосредственно измеряемых времен удерживания в исправленные времена ($t_{R}^{'}$ = tR – t0) или коэффициенты емкости [k = (tR – t0)/t0].
Несколько иных комментариев заслуживает зависимость tR(C) для соединения II – единственного, для разделения которого был использован элюент, не имеющий буферной емкости (смесь воды и ацетонитрила без стабилизирующих рН добавок). На рис. 2а приведен график рекуррентной зависимости (5), построенный по исходным данным. Обращают на себя внимание заметные отклонения двух точек от линии регрессии. В результате коэффициент корреляции зависимости (5) составляет всего 0.997, что недостаточно [9–12] для рекуррентных соотношений.
Рис. 2.
График линейной рекуррентной зависимости tR(C+5%) = atR(C) + b соединения II (а), две точки заметно отклоняются от линии регрессии; б – график аналогичной зависимости после коррекции значения 1.08 (С = 55%) → 1.10 мин; параметры линейной регрессии: a = 0.591 ± 0.008, b = 0.380 ± 0.011, R = 0.9997, S0 = 0.005.
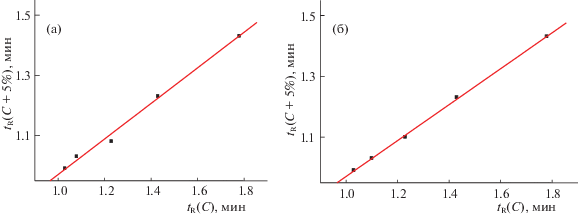
В связи с этим необходимо отметить еще одну важную особенность рекуррентных зависимостей. Если на графиках “обычных” функций y = f(x) (например, (1)–(5)) каждая точка соответствует одному значению аргумента и одному значению функции, то на графиках рекуррентных зависимостей каждая точка отвечает двум значениям функции, а значения аргумента на них вовсе не представлены. Таким образом, причиной отклонений на рис. 2(а) является только одно “подозрительное” значение tR = 1.08 мин, соответствующее концентрации CH3CN 55%, так как оно одновременно искажает две соседних точки на графике. Незначительная коррекция этого значения (1.08 → 1.10 мин, т.е. менее чем на две секунды) позволяет полностью устранить аномалии двух точек на рис. 2б и увеличить коэффициент корреляции до величины R = 0.9997; остальные параметры рекуррентной регрессии приведены в подписи к рис. 2. При этом важно отметить, что упомянутая особенность регрессионных соотношений (одновременное влияние вариаций единичных значений исходного массива данных на две соседние точки на графиках соответствующих зависимостей) важна при решении таких задач, как выявление ненадежных экспериментальных или справочных данных и, при необходимости, их коррекции.
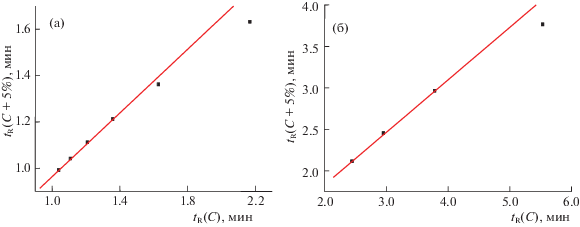
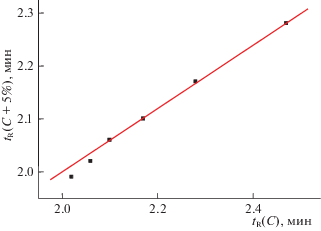
Анализ рекуррентных зависимостей времен удерживания соединений III и IV, в отличие от рассмотренных выше примеров, также позволяет выявить некоторые аномалии, иллюстрируемые графиками на рис. 3а и 3б. В обоих случаях линейность рекуррентных зависимостей наблюдается только в области наибольших концентраций ацетонитрила в элюенте. Точки, соответствующие меньшим концентрациям ацетонитрила заметно (даже визуально) отклоняются “вниз” от линий регрессии. Для пазопаниба (III) отклонения от линейности зависимости (6) проявляются в области концентраций CH3CN менее 30%, а для бозентана (IV) – менее 55%. Кроме того, можно отметить, что значения коэффициентов а рекуррентных зависимостей вида (6) для соединений III и IV несколько больше, чем для соединений I и II, однако факторы, определяющие их значения, пока еще не ясны.
Рис. 3.
График линейной рекуррентной зависимости tR(C+5%) = atR(C) + b для соединения III(а), четыре точки, отвечающие наибольшей концентрации CH3CN в элюенте, соответствуют уравнению линейной регрессии с параметрами a = 0.687 ± 0.008, b = 0.277 ± 0.009, R = 0.9998, S0 = 0.002; две других заметно от него отличаются; б – то же для соединения IV, параметры уравнения линейной регрессии для трех точек, отвечающих максимальной концентрации CH3CN в элюенте: a = 0.632 ± 0.014, b = 0.567 ± 0.043, R = 0.9997, S0 = 0.013.
Несколько иначе выглядит аномалия рекуррентной аппроксимации соединения V, график которой представлен на рис. 4. Здесь линейность зависимости tR(C) наблюдается в области малых концентраций ацетонитрила (менее 50%), тогда как соответствующие бóльшим значениям С точки расположены ниже линии регрессии.
Рис. 4.
График линейной рекуррентной зависимости tR(C+5%) = atR(C) + b для соединения V; две точки, отвечающие минимальной концентрации CH3CN в элюенте, заметно отклоняются от линии регрессии. Параметры уравнения регрессии: a = 0.597 ± 0.008, b = 0.806 ± 0.018, R = 0.9998, S0 = 0.002.
Поскольку для более простых органических соединений не было обнаружено аномалий рекуррентных зависимостей вида (6) [9–12], то их появление для полифункциональных соединений III, IV и V можно объяснить либо более сложным характером кислотно-основных взаимодействий в растворах, либо обратимым образованием в элюенте их нестабильных гидратированных форм. Оба фактора относятся к числу достаточно трудно учитываемых, однако влияние первого из них представляется относительно маловероятным, так как ни для одного из соединений I–V экспериментальные значения pKa не совпадают со значениями рН водной фазы элюента.
Что же касается второго фактора (образования гидратов в растворах), то здесь следует заметить, что четыре из пяти выбранных соединений содержат либо амидные –CO–NH- (II и V), либо сульфонамидные фрагменты –SO2–NH- (III и IV). Для амидов карбоновых кислот возможность образования гидратов известна [17]. Сульфонамиды в этом отношении охарактеризованы хуже, но в Интернете можно найти упоминания нескольких соединений этого класса, существующих в кристаллическом состоянии в виде гидратов и, следовательно, способных к их легкому образованию в растворах. Информация о двух таких соединениях приведена в табл. 3, форма которой аналогична табл. 1. Первое из них (CID 24768606) образует гидрат с неизвестным числом молекул кристаллизационной воды, второе (CID 3272524) – моногидрат. Возможно, что упомянутая выше незначительная аномалия значения tR(С = 55%) для соединения II вызвана аналогичной причиной, связанной с обратимым образованием его гидратированной формы (молекула II содержит два амидных фрагмента).
Таблица 3.
Некоторые полифункциональные органические соединения класса сульфонамидов, существующие в кристаллическом состоянии в виде гидратов
| Тривиальное название |
Молекулярная формула |
Структурная формула | Название IUPAC, источник информации |
Мол. масса |
CAS № |
|---|---|---|---|---|---|
| VU0255035 CID 24768606 |
C18H20N6O3S2 ⋅ ⋅ xH2O | 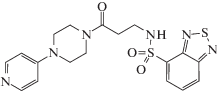 |
N-(3-Оксо-3-(4-пиридин-4-ил)пиперазин-1-ил)пропил)бензо[c] [1, 2, 5]тиадиазол-4-сульфонамид www.sigmaaldrich.com/catalog/product |
432 | 1135243-19-4 (безводный) 1202864-36-5 (гидрат) |
| CID 3272524 | C12H8N4O6S ⋅ ⋅ H2O | 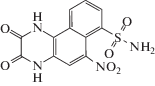 |
1,2,3,4-Тетрагидро-6-нитро-2,3-диоксобензо[f]хиноксалин-7-сульфонамид pubchem.ncbi.nlm.nih. gov/compound /71312122 |
336 | нет |
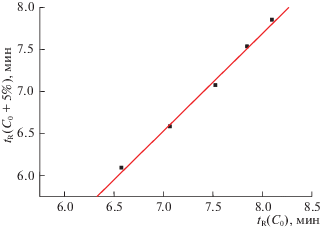
В заключение в качестве еще одной иллюстрации уникальных возможностей рекуррентной аппроксимации хроматографических параметров удерживания стоит привести пример обработки данных, полученных в режиме не изократического, а ступенчатого градиентного элюирования. Использована та же колонка, что и при анализе соединения V. Режим разделения: С0 варьирует от 5 до 30% CH3CN (0 → 1 мин), С0 → 95% CH3CN (1 → 8 мин), 95% CH3CN (8 → 9 мин), 95% → С0 (9 → 10 мин), С0 (10 → 13 мин); времена удерживания ацетофенона tR(C0) составляют 8.10 мин (55), 7.85 (10), 7.53(15), 7.07(20), 6.58(25) и 6.09 мин (С0 = 30% СН3СN). График рекуррентной зависимости tR(C0 + 5%) = atR(C0) + b приведен на рис. 5, параметры уравнения линейной регрессии указаны в подписи к рисунку. Значение коэффициента корреляции в данном случае несколько меньше (R = 0.997), чем в рассмотренных выше примерах изократического элюирования. Это обусловлено одновременными вариациями не одного, а двух параметров режима разделения: начальной концентрации ацетонитрила в элюенте (С0 от 5 до 30%) и градиента (от С0 ≠ const до 95% за одинаковое время 7 мин). Однако даже в таких условиях линейность рекуррентной зависимости (6) обеспечивает высокую точность аппроксимации данных.
Рис. 5.
График линейной рекуррентной зависимости tR(C0+5%) = atR(C0) + b для ацетофенона в режиме ступенчатого градиентного элюирования: С0 варьирует от 5 до 30% (0 → 1 мин), С0 → 95% CH3CN (1 → → 8 мин), 95% CH3CN (8 → 9 мин), 95% → С0 (9 → → 10 мин), С0 (10 → 13 мин). Параметры уравнения регрессии: a = 1.16 ± 0.05, b = –1.59 ± 0.37, R = 0.997, S0 = 0.06.
Таким образом, именно существование равновесий вида
Показано, что для выявления аномалий, в том числе обусловленных обратимым образованием гидратов анализируемых соединений в элюенте, можно рекомендовать рекуррентные зависимости параметров удерживания при разных концентрациях органической составляющей элюента. Именно отклонения таких зависимостей от линейности являются наиболее удобным и наглядным способом выявления специфических взаимодействий анализируемых соединений с компонентами элюента.
Более того, полученные результаты позволяют сделать вывод, что для оптимизации селективности разделения в обращенно-фазовой высокоэффективной жидкостной хроматографии необходимо принимать во внимание не только рН элюента, кислотно-основные равновесия в растворах и предполагаемые механизмы сорбции, [18–21], но и возможное изменение химической природы анализируемых соединений в элюенте за счет образования его гидратных форм.
Список литературы
Руководство по газовой хроматографии. Под ред. Э. Лейбница и Х.Г. Штруппе. Пер. с нем. М.: Мир, 1988. В 2-х тт. (Handbuch der Gaschromatographie. Herausgegeben von E. Leibnitz, H.G. Struppe. Leipzig, Akademische Verlag, 1984.).
Схунмакерс П. Оптимизация селективности в хроматографии. М.: Мир, 1989. 244 с.
Valko K. Retention Prediction of Pharmaceutical Compounds. Ch. 2 in Retention and Selectivity in Liquid Chromatography. Amsterdam: Elsevier, 1995. P. 47.
Рудаков О.Б., Востров И.А., Федоров С.В. и др. Спутник хроматографиста. Методы жидкостной хроматографии. Воронеж: Изд. Водолей, 2004. 528 с.
Shoenmakers P.J., Billet H.A.H., De Galan L. // J. Chromatogr. 1979. V. 185. P. 179. https://doi.org/10.1016/S0021-9673(00)85604-6
Snyder L.R., Dolan J.W., Gant J.R. // J. Chromatogr. 1979. V. 165. P. 3. https://doi.org/10.1016/S0021-9673(00)-85726-X
Snyder L.R. // Anal. Chem. 1974. V. 46. № 11. P. 1384. https://doi.org/10.1021/ac60347a052
Scott R.P.W., Kucera P. // J. Chromatogr. 1975. V. 12. P. 425. https://doi.org/10.1016/S0021-9673(00)99974-6
Zenkevich I.G. // Ibid. 2009. V. 23. P. 179. https://doi.org/10.1002/cem.1214
Зенкевич И.Г. // Журн. физ. химии. 2008. Т. 82. № 6. С. 1–7. https://doi.org/10.1134/S0036024408060022
Zenkevich I.G. Recurrent Relationships in Separation Science. Ch. 24 in Chemometrics in Chromatography. / Eds. L. Komsta, Y.V. Heyden, J. Sherma. London: CRC Press. 2018. P. 449.
Zenkevich I.G. // J. Chemometr. 2010. V. 24. P. 158–167. https://doi.org/10.1002/cem.1297
Хартли Ф., Бергес К., Олкок Р. Равновесия в растворах. М.: Мир, 1983. 360 с.
Иванов А.В., Тессман А.Б., Кубышев С.С. // Вестн. Моск. ун-та. Сер. 2. Химия. 2004. Т. 45. № 5. С. 339.
Dictionary of Organophosphorous Compounds. Ed. R. Edmundsen. London: CRC-Press, 1987. 1370 p.
Зенкевич И.Г., Гущина С.В. // Журн. физ. химии. 2011. Т. 85. № 9. С. 1762. https://doi.org/10.1134/S0036024411090317
Kobayashi M., Nishioka K. // J. Phys. Chem. 1987. V. 91. P. 1247.
Snyder L.R., Dolan J.W. // J. Chromatogr. A. 2013. V. 1302. P. 45. https://doi.org/10.1016/j.chroma.2013.05.082
Saifutdinov B.R., Buriak A.K. // Colloid J. 2019. V. 81. № 5. P. 555. https://doi.org/10.1134/S1061933X19050107
Saifutdinov B.R., Buriak A.K. // Ibid. 2019. V. 81. № 6. P. 754. https://doi.org/10.1134/S1061933X19060176
Zuvela P., Skoczylas M., Lin J.J. et al. // Chem. Rev. 2019. V. 119. № 6. P. 3674. https://doi.org/10.1021/acs.chemrev8b00246
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


