Журнал физической химии, 2021, T. 95, № 5, стр. 780-786
Физико-химические свойства растворов перхлората натрия в сульфолане
Л. В. Шеина a, *, Е. В. Карасева a, **, В. С. Колосницын a
a Российская академия наук, Уфимский федеральный исследовательский центр,
Уфимский Институт химии
Уфа, Россия
* E-mail: sheina.l.v@gmail.com
** E-mail: karaseva@anrb.ru
Поступила в редакцию 16.06.2020
После доработки 28.10.2020
Принята к публикации 30.10.2020
Аннотация
Оценена растворимость и изучены физико-химические свойства (электропроводность, вязкость и относительная плотность) растворов перхлората натрия в сульфолане в широком концентрационном и температурном диапазонах. Установлено, что растворимость NaClO4 в сульфолане (0.53 моль/л) значительно ниже растворимости LiClO4 (2.77 моль/л). Удельные электропроводности растворов перхлоратов натрия и лития равных концентраций в сульфолане сопоставимы, а вязкость растворов перхлората натрия выше, чем растворов перхлората лития. Показано, что коррегированная электропроводность растворов перхлората натрия в сульфолане выше, чем растворов перхлората лития, что указывает на более высокую степень электролитической диссоциации перхлората натрия. Сделан вывод, что энергии активации электропроводности и вязкого течения сульфолановых растворов перхлората натрия выше, чем перхлората лития, что обусловлено бóльшим размером сольватированных ионов Na+, по сравнению с сольватированными ионами Li+. Анодная устойчивость раствора перхлората натрия в сульфолане составляет 5.45 В отн. Na/Na+ электрода сравнения, что на 0.2–0.5 В превышает анодную устойчивость растворов перхлората натрия в органических карбонатах.
Преимуществом литий-ионных и литий-серных аккумуляторов являются высокие удельные энергия и мощность, недостатком – высокая цена [1, 2]. Высокая стоимость литиевых аккумуляторов во многом объясняется растущим спросом на литий и ограниченностью запасов литийсодержащего сырья. Содержание натрия в недрах планеты на три порядка превосходит содержание лития, цены на натрий существенно ниже цен на литий, и поэтому натрий-ионные и натрий-серные аккумуляторы рассматриваются как перспективные направления развития “пост-литиевых” технологий хранения энергии.
Натрий-ионные и натриевые аккумуляторы уступают литий-ионным и литиевым аналогам по удельной энергии, поскольку удельная электрохимическая емкость и стандартный электродный потенциал металлического натрия (QNa = = 1166 (мА·ч)/г, E(Na+/Na) = –2.71 В) меньше удельной емкости и стандартного электродного потенциала лития (QLi = 3860 мА·ч/г, E(Li+/Li) = = –3.05 В). Имея неоспоримое преимущество по экономическим показателям, натрий-ионные аккумуляторы несомненно будут востребованы в областях, где не так важны энергетические характеристики, а решающим фактором является стоимость источника энергии, например, в стационарных системах хранения энергии [1–4].
Важной задачей разработки натрий-ионных и натрий-серных аккумуляторов является создание стабильных электролитов. Согласно библиографическому анализу, проведенному Vignarooban K. с соавт. [5], за последние 25 лет наблюдается рост исследований по электролитам для натриевых и натрий-ионных аккумуляторов. Наиболее изученными жидкими электролитными системами являются электролитные растворы на основе органических карбонатов, их смесей, а также смесей с некоторыми эфирами (глимами, тетрагидрофураном) [5–7]. В качестве электролитных солей исследуются такие соли натрия, как перхлорат (NaClO4), тетрафторборат (NaBF4), трифторметансульфонат (NaSO3CF3), гексафторфосфат (NaPF6) и бис(трифторметансульфонил)имид (NaN(CF3SO2)2).
Сульфоны, благодаря высокой электрохимической устойчивости, давно признаны перспективными электролитными растворителями и сорастворителями для электролитов высоковольтных литиевых и литий-ионных аккумуляторов [8, 9]. Еще более перспективно применение электролитных растворов на основе сульфонов в натриевых аккумуляторах, поскольку более низкий электродный потенциал натрия может быть компенсирован применением в положительных электродах высокопотенциальных электродных материалов. Однако свойства растворов солей натрия в сульфонах практически не изучены. Наиболее ранние публикации [10, 11] посвящены изучению электропроводности сильно разбавленных растворов перхлората натрия в водно-сульфолановых смесях при 30 и 35°С. В последнее десятилетие появились работы, в которых сульфолан предлагается в качестве сорастворителя в электролитных системах на основе карбонатов [12], в смесях с ионными жидкостями [13] и в полимерных электролитах [14] с целью повышения термической устойчивости электролитов и пожаробезопасности натрий-ионных аккумуляторов в целом.
Целью данной работы являлись оценка растворимости и изучение физико-химических свойств растворов перхлората натрия в сульфолане в широком концентрационном и температурном диапазонах и сравнение со свойствами растворов перхлората лития в сульфолане.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Тетраметиленсульфон (сульфолан) (99%, Sigma-Aldrich) осушали двойной вакуумной перегонкой. Перхлорат натрия получали реакцией нейтрализации гидроокиси натрия (“х.ч.”, ГОСТ 4328-77) хлорной кислотой (“х.ч.”, ТУ 6-09-2878-84). Соль очищали перекристаллизацией из водного раствора и осушали в вакууме при температуре 100°С в присутствие цеолитов (4 Å). Содержание воды в соли контролировали методом ИК-спектроскопии по интенсивности полосы поглощения в области 3450–3620 см–1, соответствующей валентным симметричным колебаниям гидроксильной группы. Спектры поглощения твердой соли снимали в таблетках с мелкокристаллическим бромидом калия (KBr) на ИК-спектрометре Shimadzu IR Prestige 21. Использовали бромид калия марки FT-IR grade, ≥99% (Sigma Aldrich), который дополнительно прокаливали при 600°С и снимали его спектр. В спектре прокаленного KBr полосы валентных колебаний гидроксильных групп отсутствовали. Для исключения адсорбции атмосферной влаги в мелкокристаллический бромид калия подготовку образцов (взятие навески NaClO4, перетирание с KBr в агатовой ступке, загрузку образца в пресс-форму и прессование таблеток) проводили в перчаточном боксе в атмосфере осушенного воздуха. Система осушки атмосферы внутри перчаточного бокса позволяет поддерживать влажность на уровне 10–20 ppm.
Приготовление электролитных растворов осуществляли объемно-весовым методом в перчаточном боксе в атмосфере осушенного воздуха (содержание H2O 10–20 ppm). Содержание влаги в электролитных растворах устанавливали методом кулонометрического титрования в среде реактива Фишера с использованием автоматического титратора Titroline®7500 KF trace (SI Analytics). Содержание воды в 0.53 М растворе NaClO4 в сульфолане по результатам кулонометрического титрования составляло 45 ± 4 ppm.
Удельную электропроводность электролитных растворов определяли в кондуктометрических ячейках с платиновыми черненными электродами, откалиброванных по стандартным растворам KCl [15]. Для измерения относительной плотности и кинематической вязкости использовали стеклянные пикнометры и вискозиметры Убеллоде [16], модернизированные для работы с безводными растворами.
Электрохимическую устойчивость растворов перхлоратов натрия и лития в сульфолане определяли методом циклической вольтамперометрии (ЦВА) в трехэлектродной стеклянной ячейке с платиновым рабочим электродом (S = 0.092 см2) относительно Na/Na+ (для раствора NaClO4 в сульфолане) и относительно Li/Li+ (для раствора LiClO4 в сульфолане) в диапазоне потенциалов ‒100–6000 мВ при комнатной температуре (22 ± ± 1°С). Скорость развертки потенциала варьировалась от 2 до 100 мВ/с.
Растворимость перхлората натрия в сульфолане при 25 ± 1°С оценивали методом последовательного растворения навесок и разбавления насыщенного раствора соли до исчезновения донной фазы.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Растворимость перхлората натрия в сульфолане при 25 ± 1°С, оцененная методами растворения навески соли и последовательного разбавления насыщенного раствора, составила около 0.43 моль/кг, что соответствует 0.53 моль/л. Это значение значительно ниже, чем растворимость перхлората лития в сульфолане (2.77 моль/л [17]).
Физико-химические свойства растворов NaClO4 в сульфолане, изученные в температурном диапазоне 30–60°С, суммированы в табл. 1 и 2.
Таблица 1.
Удельная электропроводность растворов перхлората натрия в сульфолане
| ${{С}_{{{\text{NaCl}}{{{\text{O}}}_{{\text{4}}}}}}}$, моль/л | χ × 103, Ом–1 см–1 | ||||
|---|---|---|---|---|---|
| 293.15 K | 303.15 K | 313.15 K | 323.15 K | 333.15 K | |
| 0.014 | 0.042 | 0.115 | 0.145 | 0.178 | 0.214 |
| 0.034 | 0.129 | 0.260 | 0.329 | 0.404 | 0.486 |
| 0.270 | 1.042 | 1.352 | 1.710 | 2.109 | 2.575 |
| 0.532 | 1.410 | 1.868 | 2.410 | 3.020 | 3.497 |
Таблица 2.
Динамическая вязкость и относительная плотность растворов перхлората натрия в сульфолане
| ${{С}_{{{\text{NaCl}}{{{\text{O}}}_{{\text{4}}}}}}}$, моль/л | η × 103, Па с | ρ, г/см3 | ||||||
|---|---|---|---|---|---|---|---|---|
| 303.15 K | 313.15 K | 323.15 K | 333.15 K | 303.15 K | 313.15 K | 323.15 K | 333.15 K | |
| 0.014 | – | – | – | – | 1.2734 | 1.2658 | 1.2550 | 1.2465 |
| 0.034 | – | – | – | – | 1.2748 | 1.2666 | 1.2572 | 1.2482 |
| 0.068 | 11.06 | 8.46 | 6.61 | 5.25 | 1.2764 | 1.2681 | 1.2583 | 1.2508 |
| 0.135 | 11.89 | 9.10 | 7.19 | 5.71 | 1.2797 | 1.2717 | 1.2629 | 1.2542 |
| 0.270 | 13.93 | 10.53 | 8.28 | 6.46 | 1.2892 | 1.2818 | 1.2729 | 1.2647 |
| 0.532 | 18.87 | 13.96 | 10.59 | 8.05 | 1.3080 | 1.2983 | 1.2908 | 1.2803 |
Удельные электропроводности растворов перхлоратов натрия и лития в сульфолане практически совпадают (рис. 1а), а вязкость растворов перхлората натрия (рис. 1б) выше вязкости растворов перхлората лития равной концентрации [15]. Электропроводность, исправленная на вязкость (коррегированная электропроводность), растворов перхлората натрия выше, чем растворов перхлората лития (рис. 1в). Это указывает на то, что степень диссоциации перхлората натрия в сульфолане выше, чем перхлората лития.
Рис. 1.
Изотермы (303.15 К) удельной электропроводности (а), динамической вязкости (б) и коррегированной электропроводности (в) растворов перхлората натрия и перхлората лития в сульфолане.

С увеличением концентрации соли энергия активации электропроводности перхлората натрия в сульфолане изменяется слабо, а энергия активации вязкого течения увеличивается. Энергии активации электропроводности и вязкого течения сульфолановых растворов перхлората натрия выше, чем растворов перхлората лития равных концентраций (табл. 3). Этот факт может быть следствием бóльшего размера сольватированных сульфоланом ионов натрия, по сравнению с размерами сольватированного иона лития.
Таблица 3.
Энергии активации электропроводности (Еакт(χ)) и вязкого течения (Еакт(η)) растворов перхлоратов натрия и лития [15] в сульфолане (303.15–333.15 К)
| ${{С}_{{{\text{NaCl}}{{{\text{O}}}_{{\text{4}}}}}}}$, моль/л | Еакт ± 0.1 кДж моль–1 | ${{С}_{{{\text{LiCl}}{{{\text{O}}}_{{\text{4}}}}}}}$, моль/л | Еакт ± 0.1 кДж моль–1 | ||
|---|---|---|---|---|---|
| Еакт(χ) | Еакт(η) | Еакт(χ) | Еакт(η) | ||
| 0.068 | 17.2 | 20.7 | 0.069 | 17.1 | 20.3 |
| 0.135 | 17.2 | 20.4 | 0.136 | 16.8 | 20.6 |
| 0.270 | 18.0 | 21.4 | 0.268 | 15.7 | 20.5 |
| 0.532 | 17.7 | 23.8 | 0.527 | 15.6 | 20.8 |
Сравнительный анализ литературных [10, 11, 15, 18–21] и полученных нами экспериментальных данных показал, что предельная эквивалентная электропроводность (λ0) растворов перхлората натрия в сульфолане, как и в других апротонных растворителях (АДР), незначительно выше, чем растворов перхлората лития (табл. 4), а константы ассоциации этих солей примерно равны.
Удельная электропроводность растворов NaClO4 и LiClO4 в сульфолане в 3–6 раз ниже удельной проводимости растворов этих солей в карбонатных растворителях. Но значения коррегированной электропроводности этих растворов отличаются незначительно (табл. 5). Это указывает на то, что причиной низкой электропроводности растворов перхлоратов натрия и лития в сульфолане является высокая вязкость, которая в 4–6 раз превышает вязкость карбонатных растворов. Различия в физико-химических свойствах растворов перхлоратов натрия и лития коррелируют с размерами катионов, катион натрия примерно на 25% больше катиона лития.
Таблица 5.
Удельная электропроводность, динамическая вязкость и коррегированная электропроводность растворов NaClO4 и LiClO4 в РС, в смесях РС с этиленкарбонатом (ЕС), диметилкарбонатом (DMC) и в диметилсульфоксиде (DMSO) при 298.15 K
| АДР | Соль | Ссоли, моль/л | χ × 103, Ом–1 см–1 | η × 103, Па с | χη × 106, Па с Ом–1 см–1 | Ссылка |
|---|---|---|---|---|---|---|
| SL (303.15 K) | NaClO4 | 0.532 | 1.9 | 18.9 | 35.3 | |
| LiClO4 | 0.524 | 2.0 | 16.3 | 32.6 | [15] | |
| PC | NaClO4 | 1.0 | 6.4 | 6.9 | 44.9 | [7] |
| LiClO4 | 1.0 | 8.2 | 3.9 | 32.0 | [22] | |
| EC : PC | NaClO4 | 1.0 | 8.0 | 5.0 | 45.0 | [7] |
| EC : PC : DMC | NaClO4 | 1.0 | 10.0 | 3.5 | 35.0 | [7] |
| DMC | LiClO4 | 1.0 | 9.44 | 1.75 | 16.5 | [23] |
| DMSO | LiClO4 | 1.0 | 9.45 | 3.82 | 36.1 | [23] |
Различия в электропроводностях перхлората лития и перхлората натрия в сульфолане и пропиленкарбонате обусловлены как различиями в степенях ассоциации солей, так и различиями в ионной подвижности (табл. 4). В концентрированных растворах эти тенденции сохраняются. Поскольку сульфолан обладает более слабыми донорными свойствами, по сравнению с пропиленкарбонатом, различия в энергии сольватации катионов лития и натрия в сульфолане проявляются в меньшей степени, чем в пропиленкарбонате. Эта гипотеза подтверждается сравнением величин электропроводности, исправленной на вязкость, растворов LiClO4 и NaClO4 в сульфолане и пропиленкарбонате (табл. 5), показывающим, что различия в ионных концентрациях растворов солей в сульфолане существенно ниже, чем в пропиленкарбонате.
Известно, что сульфолан отличается высокой устойчивостью к окислению, но может подвергаться восстановлению. Наши исследования электрохимической стабильности растворов литиевых солей в сульфолане показали, что их анодная устойчивость составляет от 5.0 до 5.8 В (относит. Li/Li+) в зависимости от аниона соли [15].
Изучение электрохимической устойчивости растворов перхлоратов натрия и лития в сульфолане равных концентраций методом ЦВА на платиновом электроде показало, что анодная (окислительная) устойчивость раствора NaClO4 в сульфолане составляет 5.45 В (относительно Na/Na+), а LiClO4 в сульфолане 5.65 В (относительно Li/Li+) (рис. 2). Мы полагаем, что разница окислительных потенциалов растворов перхлоратов натрия и лития (~0.2 В) может быть обусловлена разницей стандартных электродных потенциалов лития и натрия (E(Li+/Li) = –3.05 В, E(Na+/Na) = = –2.71 В).
Рис. 2.
Циклические вольтамперограммы (на Pt электроде) растворов 0.53 M NaClO4 (а) и 0.52 M LiClO4 (б) в сульфолане. Температура 22 ± 1°C, скорость развертки потенциала 2 мВ/с.
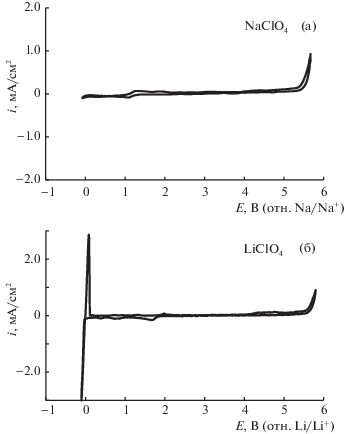
Следует отметить, что катодное осаждение натрия из растворов NaClO4 в сульфолане осуществляется с трудом (рис. 2а) – пик катодного тока при скорости поляризации 2 мВ/с очень незначительный (0.1 мА/см2). Отсутствие ответного пика анодного тока, вероятно, указывает на активное взаимодействие электрохимически осажденного натрия с сульфоланом. Напротив, для LiСlO4 в сульфолане при той же скорости поляризации (рис. 2б) наблюдаются значительные (3.0 мА/см2) пики катодного тока и ответного анодного тока, соответствующие процессам катодного осаждения и анодного растворения лития.
Анодная устойчивость раствора перхлората натрия в сульфолане на 0.2–0.5 В выше анодной устойчивости растворов перхлората натрия в органических карбонатах (табл. 6).
Таблица 6.
Окислительная (анодная) устойчивость растворов перхлората натрия в карбонатных растворителях (PC, EC, DMC, диэтилкарбонате (DEC)) и тетраглиме [6, 24–27]
| Электролит | Рабочий электрод | Eокисл., В (отн. Na/Na+) |
Ссылка |
|---|---|---|---|
| 1 M NaClO4 в тетраглиме | нерж. сталь | 3.7 | [24] |
| 1 M NaClO4 в PC | нерж. сталь | 5.02 | [25] |
| 1 M NaClO4 в PC | Al | 5.0 | [26] |
| 0.5 M NaClO4 в EC : PC | нерж. сталь | 4.5 | [6] |
| 1 M NaClO4 в EC : PC | Al | 5.1 | [26] |
| 1 M NaClO4 в EC : DMC | нерж. сталь | 4.6 | [25] |
| 1 M NaClO4 в EC : DMC | Al | 5.0 | [26] |
| 1 M NaClO4 в EC : DMC (30 : 70) | углерод GDL | 4.5 | [27] |
| 1 M NaClO4 в EC : DEC | нерж. сталь | 4.7 | [25] |
| 1 M NaClO4 в EC : DEC | Al | 4.9 | [26] |
| 0.5 M NaClO4 в EC : PC : DMC | нерж. сталь | 4.6 | [6] |
Таким образом, проведенные исследования показали, что растворимость перхлората натрия в сульфолане при комнатной температуре (0.53 моль/л) ниже, чем перхлората лития (2.77 моль/л). Удельные электропроводности растворов перхлоратов натрия и лития равных концентраций практически совпадают, а вязкость растворов перхлората натрия выше вязкости растворов перхлората лития. Коррегированная (исправленная на вязкость) электропроводность растворов перхлората натрия в сульфолане выше, чем растворов перхлората лития, что указывает на более высокую степень электролитической диссоциации перхлората натрия. Энергии активации электропроводности и вязкого течения сульфолановых растворов перхлората натрия выше, чем перхлората лития, что обусловлено бóльшим размером сольватированных ионов Na+, по сравнению с сольватированными ионами Li+. Окислительная устойчивость раствора перхлората натрия в сульфолане составляет 5.45 В (отн. Na/Na+), что на 0.2–0.5 В превышает окислительную устойчивость растворов перхлората натрия в органических карбонатах.
Работа выполнена в рамках государственного задания по теме № AAAA-A20-120012090022-1 “Развитие методов повышения эффективности аккумулирования электрической энергии в электрохимических системах различного типа. Разработка новых электролитов и электродных материалов для суперконденсаторов, литиевых и литий-ионных аккумуляторов, повышающих их удельную энергию, мощность и длительность эксплуатации”.
Список литературы
Li F., Wei Z., Manthiram A. et al. // J. Mater. Chem. A. 2019. V. 7. P. 9406. https://doi.org/10.1039/c8ta11999f
Кулова Т.Л., Скундин А.М. // Электрохимическая энергетика. 2016. Т. 16. № 3. С. 122. https://doi.org/10.18500/1608-4039-2016-3-122-150
Kuzu S., Kageura J., Matsumoto S. et al. // SUMITOMO KAGAKU (English Edition). V. 2013. Report 3. P. 1.
Slater M.D., Kim D., Lee E., Johnson C.S. // Adv. Funct. Mater. 2013. V. 23. P. 947. https://doi.org/10.1002/adfm.201200691
Vignarooban K., Kushagra R., Elango A. et al. // Intern. J. of Hydrogen Energy. 2016. 41 (4). P. 2829. https://doi.org/10.1016/j.ijhydene.2015.12.090
Lee Y., Lee J., Kim H. et al. // J. Power Sources. 2016. V. 320. P. 49.https://doi.org/10.1016/j.jpowsour.2016.04.070
Ponrouch A., Monti D., Boschin A. et al. // J. Mater. Chem. A. 2015. V. 3 (1). P. 22. https://doi.org/10.1039/c4ta04428b
Xu K. // Chem. Rev. 2014. V. 114. P. 11503.https://doi.org/10.1021/cr500003w
Borodin O., Behl W., Jow T.R. // J. Phys. Chem. C. 2013. V. 117. P. 8661. https://doi.org/10.1021/jp400527c.
Petrella G., Sacco A., Castagnolo M. et al. // J. Solution Chemistry. 1977. V. 6 (1). P. 13. https://doi.org/10.1007/BF00650788
Petrella G., Castagnolo M., Sacco A. // Z. Naturforsch. 1975. V. 30a. P. 533.
Thanh V.D., An P.L.B., Binh T.T. et al. // Science & Technology Development Journal. 2019. V. 22 (3). P. 335.https://doi.org/10.32508/stdj.v22i3.1682
Sulfolane based binary sodium ion electrolyte and preparation method thereof // Patent CN 105811001 A. 2016.
Vondrák J., Musil M., Sedlařiková M. et al. // Electrochem. Energy Technol. 2016. V. 2. P. 6.https://doi.org/10.1515/eetech-2016-0002
Колосницын В.С., Шеина Л.В., Мочалов С.Э. // Электрохимия. 2008. Т. 44. № 5. С. 620.
Абросимов В.К., Королев В.В., Афанасьев В.Н. Экспериментальные методы химии растворов: денсиметрия, вискозиметрия, кондуктометрия и другие методы. М.: Наука, 1997. 351 с.
Karaseva E.V., Kuzmina E.V., Kolosnitsyn D.V. et al. // Electrochim. Acta. 2019. V. 296. P. 1102.https://doi.org/10.1016/j.electacta.2018.11.019
Chernozhuk T., Kalugin O. // Chemistry & Chemical technology. 2016. V. 10 (1). P. 9.
Salomon M. // J. of Solution Chemistry. 1990. V. 19 (12). P. 1225.https://doi.org/10.1007/BF00652547
Salomon M., Plichta E. // Electrochim. Acta. 1984. V. 29 (6). P. 731.
Moumouzias G., Ritzoulif G. // Bes Bunsenges. Phys. Chem. 1998. V. 102 (5). P. 786.
Nwokobia F.U., Cookey G.A., Abia A.A. // J. Appl. Chem. 2015. V. 8 (2). P. 35. https://doi.org/10.9790/5736-08223541
Edimeh A.I., Cookey G.A., Maduelosi J.N., Abia A.A. // Chem Sci Rev Lett. 2017. V. 6 (23). P. 1773.
Kim J.-S., Lee S.-W., Liu X. et al. // Current Applied Physics. 2011. V. 11. S11.
Chen J., Huang Z., Wang C. et al. // Chem. Commun. 2015. V. 51. P. 9809. https://doi.org/10.1039/c5cc02901e
Ponrouch A., Marchante E., Courty M. et al. // Energy Environ. Sci. 2012. V. 5. P. 8572.
Bhide A., Hofmann J., Dűrr A. K. et al. // Phys. Chem. Chem. Phys. 2014. V. 16 (5). P. 1987. https://doi.org/10.1039/C3CP53077A
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


