Журнал физической химии, 2021, T. 95, № 9, стр. 1433-1440
Синтез и физико-химические свойства координационного соединения гадолиния (III) с 2,5-диметоксибензойной кислотой
М. А. Назаренко a, С. Н. Иванин a, *, А. И. Офлиди a, В. Ю. Бузько a, М. Е. Соколов a, В. Т. Панюшкин a, М. Х. Мутузова b
a Кубанский государственный университет
350040 Краснодар, Россия
b ФГБОУ ВО “Чеченский государственный университет”
364024 Грозный, Россия
* E-mail: Ivanin18071993@mail.ru
Поступила в редакцию 22.12.2020
После доработки 12.02.2021
Принята к публикации 12.02.2021
Аннотация
Методом электрохимического синтеза получено новое координационное соединение гадолиния(III) с 2,5-диметоксибензойной кислотой. Состав координационного соединения исследовали методами С,Н-анализа, рентгеноспектрального энергодисперсионного микроанализа, ИК-спектроскопии, термогравиметрического анализа. По данным спектров люминесценции полученного металлокомплекса определен триплетный уровень 2,5-диметоксибензойной кислоты. По спектрам ЭПР порошка металлокомплекса определены параметры тонкой структуры.
Как известно [1] ионы лантаноидов, обладая высокими координационными числами (более 7), образуют с органическими лигандами сложные по составу и структуре координационные соединения, зачастую имеющие би-, три- и полиядерное строение. Особенное электронное строение ионов лантаноидов, связанное с экранированием электронов 4f-орбиталей и запретом на электронные переходы между состояниями различной мультиплетности (переходы с изменением спинового момента) объясняет уникальные свойства соединений лантаноидов – парамагнетизм (до семи неспаренных электронов на один ион лантаноида для соединений гадолиния), большое время существования возбужденных состояний, наличие электронных переходов от ультрафиолетового до длинноволнового диапазона и т.д. Эти свойства открывают возможности использования соединений лантаноидов при изготовлении органических транзисторов, сверхпроводящих магнитов, фотоэлектрических батарей, органических светоизлучающих диодов, термоэлектрических элементов, спинтронных устройств хранения информации, генераторов лазерного излучения, в качестве компонента контрастных реагентов для магнитно-резонансной томографии (МРТ), а также в качестве меток и зондов при изучении процессов обмена веществ в живых объектах [2–6].
Комплексы Gd3+ с ароматическими карбоновыми кислотами используются для экспериментального определения триплетных уровней лигандов с целью установления их фотофизических свойств и прогнозирования эффективности люминесценции комплексов с другими ионами лантаноидов [7–10]. Тем самым появляется возможность вести синтез комплексных соединений лантаноидов с заданными люминесцентными характеристиками [11].
Также большое внимание уделяется исследованию магнитных свойств как моно- так и полиядерных комплексных соединений Gd(III) [12, 13], а в работах [14–16] исследовались зависимости магнитной и диэлектрической проницаемостей металлокомплексов Gd(III) от частоты приложенного электромагнитного излучения.
При использовании классических химических методов синтеза координационных соединений лантаноидов (основанных на реакциях ионного обмена) не всегда удается получить вещества, полностью удовлетворяющие предъявляемым к ним требованиям, из-за возможных процессов гидролиза, гидратации, загрязнения целевого вещества побочными продуктами реакции. Как было показано [17], данных недостатков лишен метод электрохимического синтеза, который позволяет проводить процессы в одну стадию, получать безводные соединения, не содержащие посторонних ионов, а также варьировать состав целевого продукта и направление синтеза [17].
Электрохимический синтез относится к прямым методам синтеза, суть которых заключается в образовании координационной сферы за счет окисления металлов в нулевой степени окисления и лигандов. Основным его преимуществом является синтез тех координационных соединений, которые невозможно получить другими классическими методами, а также проведение синтеза в мягких условиях с относительно высокими выходами целевого продукта [18].
Целью данной работы является исследование строения и характеристик нового комплексного соединения гадолиния(III) с 2,5-диметоксибензойной кислотой полученного методом электрохимического синтеза.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе в качестве металла-комплексообразователя использовался гадолиний металлический в пластинах (чистота – 99.9%). В качестве лиганда при синтезе координационного соединения использовалась 2,5-диметоксибензойная кислота “х.ч.” (2,5-MeOBenzH).
Прямой электрохимический синтез координационного соединения гадолиния (III) осуществляли методом растворимого анода [18]. Схема установки для проведения синтеза координационных соединений включает электрохимическую ячейку, источник постоянного тока, кулонометр, амперметр, вольтметр. Электрохимическая ячейка для анодного синтеза безводных комплексных соединений описана в [17].
В качестве неводного растворителя при электрохимическом синтезе использовался обезвоженный ацетонитрил “ч.д.а.”. Время синтеза комплекса определяли, исходя из начальной концентрации лиганда (0.01 М) по закону Фарадея, оно составляло 2.5 ч. Процессы осуществляли в инертной атмосфере в герметичной системе.
Растворимый комплекс гадолиния (III) c 2,5-диметоксибензойной кислотой предварительно выделяли путем высаливания смесью толуола и хлороформа. При этом выпадал белый осадок комплексного соединения, который отфильтровывали на фильтре Шотта и затем сушили до постоянной массы.
Содержание гадолиния (III) в полученном комплексе определяли методом комплексонометрического титрования и энергодисперсионного микроанализа (ЭДА) выполненного с помощью приставки “INCA x-sight” на растровом электронном микроскопе “JEOL JSM-7500F”, а содержание углерода и водорода определяли методом элементного микроанализа на C,H,N,S-анализаторе “VARIO MICRO CUBE” в токе кислорода при температуре печи 1200°С.
Для определения микроструктуры порошка исследуемого комплекса использовался метод растровой электронной микроскопии с использованием микроскопа “JEOL JSM-7500F”.
Термический анализ выполняли на синхронном термическом анализаторе “NETSCH STA 409 PC/PG”. Анализ вели в атмосфере воздуха от 25 до 1000°C со скоростью нагрева 10 К /мин.
ИК-спектры комплекса и лиганда записывали на ИК-фурье-спектрометре “VERTEX 70 (Bruker)” в области 4000–400 см–1 в твердом виде с использованием приставки нарушенного полного внутреннего отражения с алмазным кристаллом. Оптическая система ИК-фурье-спектрометра “VERTEX 70” вакуумирована, за счет чего достигается максимальная чувствительность в ближнем, среднем и дальнем инфракрасном диапазоне. Также исключено перекрытие слабых сигналов полосами поглощения воды или углекислого газа.
При снятии ИК-спектров измерительная головка протирается спиртом, чтобы исключить попадание посторонних примесей. Затем немного порошка исследуемого соединения шпателем наносится на измерительную головку, после чего производится запись ИК-спектров.
Спектр люминесценции комплекса регистрировали на спектрофлюориметре “Флюорат – 02 Панорама” (Люмэкс) с использованием оптоволоконной приставки для измерения спектров твердых образцов при параметрах прибора: задержка 20 мкс, длительность 4000 мкс. Спектр записывали при температуре 77 К, для чего образец с оптоволокном помещали в жидкий азот.
ЭПР-спектры полученного порошка комплексного соединения регистрировали на ЭПР спектрометре “JEOL JES FA-300”. Порошок в твердом виде помещался в кварцевую ампулу. Запись спектров ЭПР проводилась в X-диапазоне с частотой модуляции 100 кГц. Измерения проводились в температурном диапазоне 103–293 К при прокачке паров жидкого азота через резонатор.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Электрохимический синтез
Для достижения максимальной эффективности процесса синтеза необходимо было определить оптимальные параметры синтеза: состав электролитной системы, подаваемое напряжение, силу тока, плотность тока, температуру, выход по току.
Выбор растворителя – ацетонитрила обусловлен тем, что данный растворитель удовлетворяет требованиям, предъявляемым при электрохимическом синтезе: электрохимическая устойчивость, слабая координирующая способность, растворимость в нем лиганда и фонового электролита, доступность и легкость осушки.
Для увеличения электропроводности системы при синтезе в качестве фонового электролита применялся перхлорат лития, который хорошо растворим в ацетонитриле, и ионы которого имеют низкую координирующую способность по отношению к ионам лантаноидов.
Оптимальная cила тока в ходе синтеза комплексного соединения гадолиния(III) с 2,5-диметоксибензойной кислотой составляет 0.015–0.02 А, для достижения этого на электрохимическую ячейку подавалось напряжение в пределах 6–8 В. Выбор диапазона силы тока обусловлен тем, что при более низких значениях силы тока процесс синтеза идет медленно, а при более высоких происходит нагревание раствора, что может приводить к протеканию побочных процессов. По этой причине синтез проводили при температуре, не превышающей 30°С. Оптимальная анодная плотность тока в ходе процесса находилась в пределах 0.008–0.011 А/см2. При более высоких значениях плотности тока начинается интенсивная деструкция анода, что приводит к снижению эффективности синтеза и загрязнению конечного продукта металлсодержащими твердыми частицами.
Концентрация лиганда составляла 0.01 M и определялась исходя из его растворимости, рассчитанного времени синтеза и оптимальной силы тока.
Выход по металлу при синтезе комплексного соединения составил 80%, по току – 75%, что свидетельствует об эффективности электрохимического анодного синтеза при получении данного вещества при выборе оптимальных условий [17, 18].
Элементный анализ
По результатам элементного анализа синтезированного порошка Gd (2,5-MeOBenz)3 (C27H27O12Gd) содержание химических элементов:
найдено, %: С 46.02, H 4.12 (для соединения GdC27H27O12),
вычислено, %: С 46.28, Н 4.11.
Содержание гадолиния (III) в полученном комплексном соединении определяли методом комплексонометрического титрования. Согласно полученным данным процентное содержание (содержится/вычислено) ионов гадолиния (III) в соединении Gd (2,5-MeOBenz)3 – (22.39/22.43).
ЭДА и РЭМ-микроскопия
Помимо данных элементного анализа и комплексонометрического титрования, присутствие атомов гадолиния, кислорода и углерода в составе синтезированного комплексного соединения также подтверждается спектром энергодисперсионного микроанализа, изображенном на рис. 1б. На рис. 1а изображена частица порошка Gd(2,5-MeOBenz)3 с выбранной зоной для энергодисперсионного анализа. Также результаты ЭДА свидетельствуют об отсутствии примесей хлор-содержащих соединений в исследованном соединении.
Рис. 1.
Фото частицы синтезированного Gd(2,5-MeOBenz)3 с выбранной зоной для энергодисперсионного анализа (а) и спектр энергодисперсионного анализа (б).

На рис. 2 представлены фотографии микроструктуры синтезированного Gd(2,5-MeOBenz)3. Анализируя рис. 1а и рис. 2 можно сделать вывод, что синтезированное соединение представляет собой агломераты наноразмерных, нитевидных частиц с четко выделенными гранями: размер агломератов 20–120 мкм; размер кристаллических частиц в диаметре ≈150 нм, в длине > 1 мкм (рис. 2б).
ИК-спектроскопия
Сравнение ИК-спектров полученного Gd(2,5-MeOBenz)3 и исходной 2,5-диметоксибензойной кислоты (таблица 1, рис. 3) показало, что кислота в комплексе находится в ионизированной форме, так как появляются полосы поглощения ассиметричных и симметричных колебаний депротонированной карбоксильной группы в области 1530 см–1 и 1400–1360 см–1 соответственно и исчезает полоса поглощения в области 1730–1680 см–1, которая относится к валентным колебаниям связи C=O неионизированной карбоксильной группы. Разница между ассиметричными и симметричными валентными колебаниями ионизированной карбоксильной группы Δν(СOO–) меньше 220 см–1, что позволяет предположить [19] ее бидентатную координацию с ионом гадолиния (III) в полученном соединении. По этой же причине можно сделать вывод о том, что тип связи карбоксилатного атома кислорода лиганда с ионом гадолиния (III) носит преимущественно ионный характер.
Таблица 1.
Отнесение характеристичных полос поглощения функциональных групп в ИК-спектре лиганда и его координационного соединения с Gd3+
| Соединение | Отнесение частот, см–1 | |||
|---|---|---|---|---|
| ν(C=O)карбокс.гр | νas(СOO–) | νs(СOO–) | Δν(СOO–) | |
| 2,5-MeOBenzH | 1730 | – | – | – |
| Gd(2,5-MeOBenz)3 | – | 1530 | 1394 | 136 |
Рис. 3.
ИК-спектры 2,5-MeOBenzH (1) и Gd(2,5-MeOBenz)3 (2). Вставка (а) – фрагмент спектров в диапазоне 2800–3600 см–1.

В спектре комплекса Gd(2,5-MeOBenz)3 отсутствует широкая полоса поглощения валентного колебания O–H-группы координированных молекул воды в области 3600–3300 см–1, что свидетельствует об образовании безводного соединения.
Для 2,5-диметоксибензойной кислоты происходит симметричное смещение полос поглощения эфирных ассиметричных валентных колебаний νas(СOС)эфир в комплексе, что свидетельствует об отсутствии участия эфирного кислорода с ионом гадолиния (III). Это также говорит в пользу образования симметричной внешней сферы у комплексного соединения [20]. Таким образом, можно считать, что в полученном Gd(2,5-MeOBenz)3 координация лиганда с ионом Gd3+ осуществляется аналогично бензойной кислоте.
Термогравиметрическое исследование комплексов
По данным термогравиметрического анализа (рис. 4) синтезированный Gd(2,5-MeOBenz)3 термостабилен до 250–300°С. Данные термического анализа подтверждают отсутствие молекул воды в полученном комплексном соединении, так как не наблюдается эффектов до 200°С, соответствующих дегидратации. Остаточная масса соответствует оксиду гадолиния Gd2O3, подтверждая состав комплекса. В интервале температур 300–600°С присутствуют экзоэффекты, сопровождающиеся резкой потерей массы, что связано с термоокислительной деструкцией комплекса.
По данным элементного анализа, термогравиметрии, энергодисперсионного анализа и ИК-спектроскопии установлено, что полученный комплекс является безводным, индивидуальным соединением и имеет состав Gd(2,5-MeOBenz)3.
Люминесценция координационных соединений
Для полученного комплексного соединения Gd3+ были записаны спектры люминесценции при температуре жидкого азота (77 К) (для максимального нивелирования теплового тушения фосфоресценции), путем гауссовой деконволюции по максимумам полос испускания которых был определен триплетный уровень используемой 2,5-диметоксибензойной кислоты (рис. 5). Определение триплетного уровня лиганда проводили по положению коротковолнового края полосы фосфоресценции, соответствующего 0-0 переходу [21, 22]. Экспериментальное определение триплетных уровней лигандов производится с целью установления их фотофизических свойств и прогнозирования эффективности люминесценции комплексов с другими ионами лантанидов [7–10]. Рассчитанный триплетный уровень 2,5-диметоксибензойной кислоты в Gd(2,5-MeOBenz)3 составил 19646 см–1.
Известно [23], что для того, чтобы в комплексных соединениях лантаноидов, излучающих в видимой области, наблюдалась интенсивная люминесценция, необходимо, чтобы триплетный уровень лиганда располагался на 1500–4000 см–1 выше резонансного уровня иона Ln3+. При более высоких значениях перенос энергии становится неэффективным из-за малой вероятности такого перехода электронов, а при более низких значениях вследствие теплового колебания молекул будет возрастать обратный перенос части энергии на молекулу лиганда. В связи с этим, определение триплетного уровня используемого лиганда становится весьма актуальной задачей.
ЭПР-спектроскопия координационных соединений
На рис. 6а представлены спектры ЭПР порошка синтезированного комплексного соединения Gd(2,5-MeOBenz)3 в исследуемом температурном диапазоне.
Рис. 6.
Спектры ЭПР исследуемого Gd(2,5-MeOBenz)3, полученные в температурном диапазоне 293–103 К (а) и сравнение экспериментального (1), полученного при 103 К, с теоретическим спектром ЭПР (2) (б).

Из рисунка 6а видно, что сигналы ЭПР Gd(2,5-MeOBenz)3 состоят из асимметричной широкой линии с неразрешенной структурой. С уменьшением температуры происходит увеличение интенсивности спектра ЭПР, но ширина линии поглощения и форма ЭПР спектра не изменяются.
Для теоретического описания спектра ЭПР исследуемого комплексного соединения мы использовали спин-гамильтониан следующего вида:
где, ${{{{\mu }}}_{{\text{B}}}}$ – магнетон Бора, $\hat {S}$ – оператор полного спина, g – фактор спектроскопического расщепления Ланде, ${{B}_{0}}$ – величина статического магнитного поля,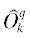 – спиновые операторы Стивенса, коэффициенты $~B_{k}^{q}$ – параметры тонкой структуры, определяемые из эксперимента.
– спиновые операторы Стивенса, коэффициенты $~B_{k}^{q}$ – параметры тонкой структуры, определяемые из эксперимента.
На рис. 6б представлены экспериментальный (1) и теоретический (2) спектры ЭПР для исследуемого комплексного соединения. Теоретический спектр для исследуемого комплексного соединения Gd(2,5-MeOBenz)3 моделировали в программе MATLAB на основе модуля EasySpin версии 5.2.28 [24, 25]. Аппроксимацию параметров выполняли методом наименьших квадратов с использованием алгоритма оптимизации Нелдера-Мида при достижении наименьшего значения среднеквадратичного отклонения (rmsd). Наименьшее значение rmsd = 0.038 было получено при использовании следующих параметров: ΔНрр = 107.8 мТл (ширина линии от пика до пика), параметр $B_{2}^{0}$ = 453.7 МГц, $B_{4}^{0}$ = 8.4 МГц, g-фактор = 1.99, использовали форму линии Лоренца. Как видно из рис. 6б, при данном наборе используемых параметров при модуляции спектра ЭПР, теоретический спектр хорошо описывает форму экспериментального спектра ЭПР исследуемого соединения Gd(2,5-MeOBenz)3.
Принимая во внимание данные растровой электронной микроскопии и используемый набор параметров тонкой структуры спектра ЭПР [26], можно предположить, что координационный полиэдр исследуемого комплексного соединения Gd(2,5-MeOBenz)3 имеет высокую симметрию выше тригональной.
Таким образом, электрохимически синтезировано новое безводное термостабильное комплексное соединение гадолиния (III) с 2,5-диметоксибензойной кислотой. По данным ИК-спектроскопии тип связи карбоксилатного атома лиганда с ионом Gd3+ преимущественно ионный. Исходя из спектров фосфоресценции комплексов Gd3+ определен триплетный уровень используемого в качестве лиганда 2,5-диметоксибензойной кислоты.
Работа выполнена на оборудовании НОЦ “Диагностика структуры и свойств наноматериалов” ЦКП ФГБОУ ВО “Кубанского государственного университета” при поддержке Министерства науки и образования РФ (проект государственного задания FZEN-2020-0022), а также при финансовой поддержке РФФИ и Администрации Краснодарского края в рамках научного проекта № 19-43-233003 р_мол_а.
Список литературы
Панюшкин В.Т., Афанасьев Ю.А. Лантаноиды. Простые и комплексные соединения Ростов н/Д.: Изд-во Ростовского университета, 1980. 295 с.
Bunzli J.-C.G., Eliseeva S.V. // J. Rare Earths. 2010. V. 28. P. 824. https://doi.org/10.1016/S1002-0721(09)60208-8
Bunzli J.-C.G. // Chem. Rev. 2010. V. 110. P. 2729. https://doi.org/10.1021/cr900362e
Kido J., Okamoto Y. // Chem. Rev. 2002. V. 102. P. 2357. https://doi.org/10.1021/cr010448y
Utochnikova V.V., Kuzmina N.P. // Rus. J. Coord. Chem. 2016. V. 42. № 10. P. 679. https://doi.org/10.1134/S1070328416090074
Zolin V.F. // Z. Alloys and Compounds. 2004. V. 380. № 1–2. P. 101. https://doi.org/10.1016/j.jallcom.2004.03.006
Hilder M., Junk P.C., Kynast U.H., Lezhnina M.M. // Z. Photochem. and Photobiology A: Chemistry. 2009. V. 202. P. 10. https://doi.org/10.1016/j.jphotochem.2008.10.026
Latva M., Takalo H., Mukkala V.-M. et al. // J. of luminescence. 1997. V. 75. № 149. P. 149. https://doi.org/10.1016/S0022-2313(97)00113-0
Meshkova S.B. // J. of Fluorescence. 2000. V. 10. № 4. P. 333. https://doi.org/10.1023/A:1009418227641
Hilder M., Junk P.C., Kynast U.H., Lezhnina M.M. // Z. Photochem. and Photobiology A: Chemistry. 2009. V. 202. P. 10. https://doi.org/10.1016/j.jphotochem.2008.10.026
Katkova M.A., Vitukhnovsky A.G., Bochkarev M.N. // Russ. Chem. Rev. 2005. V. 74. № 12. P. 1089. https://doi.org/10.1070/RC2005v074n12ABEH002481
Taha Z.A., Ajlouni A.M., Hijazi A.K. et al. // J. Lumin. 2015. V. 161. P. 229. https://doi.org/10.1016/j.jlumin.2015.01.013
Alexandropoulos D.I., Vignesh K.R., Dolinar B.S. et al. // Polyhedron. 2018. V. 151. P. 255. https://doi.org/10.1016/j.poly.2018.04.034
Ivanin S.N., Buz’ko V.Yu., Goryachko A.I. et al. // Russ. J. Phys. Chem. A. 2020. V. 94. № 8. P. 1623–1627. https://doi.org/10.1134/S0036024420080130
Ivanin S.N., Buz’ko V.Yu., Goryachko A.I. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 6. P. 880–886. https://doi.org/10.1134/S0036023620060066
Ivanin S.N., Buz’ko V.Yu., Goryachko A.I. et al. // Russ. J. Phys. Chem. A. 2021. V. 95. № 2. P. 326–331. https://doi.org/10.1134/S0036024421020114
Nazarenko M.A., Oflidi A.I., Kolokolov F.A., Panyushkin V.T. // Rus. J. Gen. Chem. 2017. V. 87. № 5. P. 1022. https://doi.org/10.1134/S1070363217050218
Frolov V.Yu., Oflidi A.I., Bolotin S.N. et al. // Russ. J. Appl. Chem. 2008. V. 81. № 4. P. 639. https://doi.org/10.1134/S1070427208040137
Накамото К. Инфракрасные спектры неорганических и координационных соединений М.: Мир, 1991. 536 с.
Беллами Л. Инфракрасные спектры сложных молекул М.: Ин. лит., 1963. 590 с.
Kalyakina A.S., Sokolova E.Y., Vaschenko A.A. // Proceedings to the SID Mid-Europe Chapter Spring Meeting. 2013. P. 19.
Trivedi E.R., Eliseeva S.V., Jankolovist J. et al. // J. Am. Chem. Sos. 2014. V. 136. P. 1526. https://doi.org/10.1021/ja4113337
Kleinerman M. // J. Chem. Phys. 1969. V. 51. № 6. P. 2370. https://doi.org/10.1063/1.1672355
Stoll S., Schweiger A. // J. Magn. Reson. 2006. V. 178. № 1. P. 42. https://doi.org/10.1016/j.jmr.2005.08.013
Stoll S., Schweiger A. // Biol. Magn. Reson. 2007. V. 27. P. 299. https://doi.org/10.1063/1.3426295
Altshuler S.A., Kozyrev B.M. Electronic paramagnetic resonance of compounds of elements of intermediate groups. Moscow: Nauka, 1972. 672 p.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии






