Журнал физической химии, 2022, T. 96, № 10, стр. 1527-1532
Фотохимические свойства метилбензоатов европия(III)
И. В. Калиновская a, *, А. Н. Задорожная b
a Институт химии Дальневосточного отделения РАН
690022 Владивосток, Россия
b Тихоокеанский государственный медицинский университет Минздрава России
690002 Владивосток, Россия
* E-mail: kalinovskaya@ich.dvo.ru
Поступила в редакцию 12.08.2021
После доработки 05.04.2022
Принята к публикации 06.04.2022
- EDN: ZCIAOL
- DOI: 10.31857/S0044453722100119
Аннотация
Изучены спектрально-люминесцентные свойства комплексных соединений европия(III) с о-метилбензойной кислотой, азот- и фосфорсодержащими нейтральными лигандами. Рассчитаны триплетные уровни о- и м-метилбензойных кислот. Проведен анализ электронных спектров поглощения, спектров возбуждения люминесценции и штарковской структуры 5D0–7Fj (j = 0–2) электронных переходов в низкотемпературных спектрах люминесценции комплексных разнолигандных о-метилбензоатов европия(III). Установлено, что передача энергии возбуждения к иону европия(III) осуществляется как с уровней о-метилбензойной кислоты, так и с уровней азот- и фосфорсодержащих нейтральных лигандов. Проведен сравнительный анализ люминесцентных параметров м- и о-метилбензоатов европия(III). Показано, что интенсивность люминесценции о-метилбензоатов европия(III) выше интенсивности люминесценции м-метилбензоатов европия(III).
Разработка интенсивных люминесцентных и фотостабильных функциональных материалов на основе комплексных соединений редкоземельных элементов для оптоэлектроники, аналитической химии, сельского хозяйства и медицины является актуальной задачей [1–5]. Интенсивные люминесцентные, триболюминесцентные, сенсорные и фотохимические свойства соединений лантаноидов с карбоновыми кислотами позволяют использовать их в качестве легирующих добавок для функциональных оптических материалов (светопреобразующих материалов) [6–8]. Органические карбоновые кислоты используют как распространенные мостиковые лиганды в комплексных соединениях f-элементов и подобно другим мостиковым лигандам в целом определяют физико-химические, спектрально-люминесцентные свойства данных комплексных соединений. Большое разнообразие состава и строения карбоксилатов лантаноидов, позволяет считать комплексные соединения лантаноидов с карбоновыми кислотами удобными модельными объектами для изучения связи между спектрально-люминесцентными свойствами и строением комплексных соединений [8–21].
Сведения о синтезе и физико-химических свойствах разнолигандных соединений редкоземельных элементов с о-метилбензойной кислотой ограничены [22, 23]. Описанные в литературе разнолигандные комплексные соединения РЗЭ являются димерами, в них реализуется как бидентатная, так и мостиковая координация кислотных остатков [16, 18, 19], в то время как гидрат толуилата европия(III) представлен бесконечной полимерной цепочкой состава [Eu(МВА)3⋅2H2O]n [20].
В настоящей работе представлены результаты изучения спектрально-люминесцентных свойств комплексных соединений европия(III) с о-метилбензойной кислотой азот- и фосфорсодержащими нейтральными лигандами состава [Eu(о-MBA)3⋅D]2⋅xH2O и [Eu(о-MBA)3⋅2H2O]n, где о-MBA – анион о-метилбензойной кислоты, D – 1,10-фенантролин (phen), 2,2'-дипиридил (dipy), трифенилфосфиноксид (tppo), диметилформамид (dmf) (х = 0), гексаметилфосфотриамид (hmpa) (x = 1), бензотриазол (bt) (x = 2). Проведен сравнительный анализ люминесцентных свойств разнолигандных о- и м-метилбензоатов европия(III).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза разнолигандных комплексных соединений европия(III) состава [Eu(о-MBA)3⋅D]2⋅ ⋅хH2O и [Eu(о-MBA)3⋅2H2O]n использовали следующие препараты марки “ч”: шестиводный нитрат европия(III), о-метилбензойную кислоту, азотсодержащие нейтральные лиганды (dipy, phen, bt, dmf) и фосфорсодержащие нейтральные лиганды (tppo, hmpa).
Синтез разнолигандных соединений осуществляли по следующей методике: к 3 мМ NaOH (раствор в минимальном количестве воды) добавляли 3 мМ о-метилбензойной кислоты. Затем к смеси добавляли 1 мМ Eu(NO3)3⋅6H2O (раствор в 10–15 мл Н2О) и 2 мМ нейтрального лиганда (в 15–20 мл 96% этилового спирта); 10% раствором аммиака реакционной смеси доводили рН до 6–7 и оставляли стоять до образования осадка. Осадок отфильтровывали, промывали водой и сушили на воздухе. Выход составил 75–83%. Полученные комплексные соединения с о-метилбензойной кислотой устойчивы, не разлагаются при длительном хранении. Синтез, состав и строение данных соединений описан в работе [24].
Спектры возбуждения люминесценции и люминесценции для твердых образцов регистрировали на приборе RF-5301 Shimadzu при 293 К. Мелкокристаллические образцы твердых веществ тщательно перетирали в агатовой ступке, насыпали в стандартную пробирку. Высота образца в пробирке 2 см, толщина образца в ней 3 мм. Предполагается, что полученные соединения поглощают 100% возбуждающего света. Проводили фронтальное облучение образцов под углом 45° луча к поверхности заполненной пробирки c твердыми образцами.
Спектры фосфоресценции комплексных соединений гадолиния(III) снимали на дифракционном спектрометре СДЛ-1 при температуре 77 К, электронные спектры поглощения – на спектрометре RF-2550 Shimadzu. Концентрация соединения в 96%-ном этаноле равна 10–4 моль/л.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Электронные спектры поглощения полученных соединений европия(III) с о-метилбензойной кислотой, азот- и фосфорсодержащими нейтральными лигандами приведены на рис. 1. Как видно из рис. 1, комплексообразование приводит к изменению положения полосы, соответствующей π–π*-переходу о-метилбензойной кислоты (λmах = 225–235 нм). Для полученных разнолигандных метилбензоатов европия(III) характерен более сложный вид спектров поглощения, чем для о-метилбензойной кислоты. В электронных спектрах поглощения (ЭСП) [Eu(о-MBA)3⋅bta]2⋅ ⋅2H2O, [Eu(о-MBA)3⋅tppo]2 и [Eu(о-MBA)3⋅dipy]2 наблюдаются дополнительные полосы поглощения, характерные для координированных нейтральных молекул лигандов. Так, в спектре [Eu(о-MBA)3⋅dipy]2 проявляется полоса поглощения dipy с λmах = 260–300 нм. В ЭСП [Eu(о-MBA)3⋅tppo]2 полоса поглощения о-MBA с λmах = 215–250 нм сдвинута в более коротковолновую область по сравнению с ее положением в спектре “свободной” о-метилбензойной кислоты, которая обязана синглетному (Sππ*)-переходу [9].
Рис. 1.
Электронные спектры поглощения 10–4 М растворов (С2Н5ОН): 1 – [Eu(о-MBA)3⋅tppo]2, 2 – [Eu(о-MBA)3⋅2Н2О]n, 3 – [Eu(о-MBA)3⋅dmf]2, 4 – [Eu(о-MBA)3⋅hmpa]2⋅Н2О, 5 – [Eu(о-MBA)3⋅bt]2⋅2Н2О, 6 – [Eu(о-MBA)3⋅phen]2, 7 – [Eu(о-MBA)3⋅dipy]2.

Спектры возбуждения люминесценции разнолигандых соединений европия(III) с о-метилбензойной кислотой состоят из широкой высокочастотной полосы, обусловленной полосами поглощения лигандов и узких линий f–f-переходов ионов Eu3+. В спектрах возбуждения разнолигандных соединений европия присутствует полоса π–π*-перехода о-метилбензойной кислоты и соответствующего азот- или фосфорсодержащего нейтрального лиганда (рис. 2), что приводит к эффективной передаче энергии, как с триплетных уровней кислоты, так и с уровней нейтрального лиганда на европий.
Рис. 2.
Спектры возбуждения люминесценции (λlum = 615 nm) при 293 К: 1 – [Eu(о-MBA)3⋅2Н2О]n, 2 – [Eu(о-MBA)3⋅tppo]2, 3 – [Eu(о-MBA)3⋅hmpa]2⋅Н2О, 4 – [Eu(о-MBA)3⋅dmf]2, 5 – [Eu(о-MBA)3⋅dipy]2, 6 – [Eu(о-MBA)3⋅phen]2, 7 – [Eu(о-MBA)3⋅bt]2⋅2Н2О.
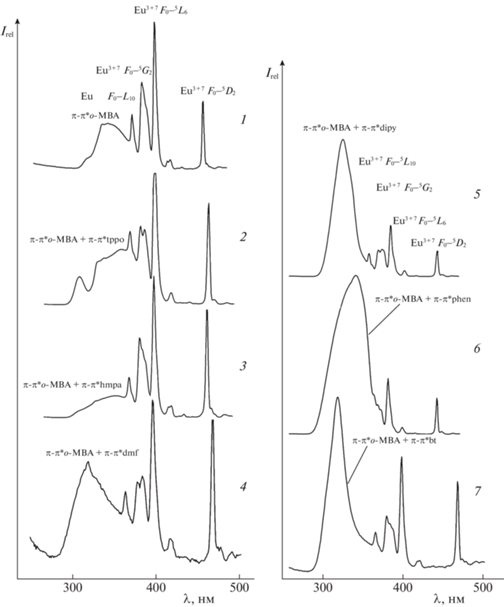
Полученные нами разнолигандные о-метилбензоаты европия(III) люминесцируют (в твердом состоянии и в растворе) как при комнатной температуре, так и при 77 К (рис. 3). Общий характер спектров люминесценции по ряду полученных о-метилбензоатов европия(III) с азот- и фосфорсодержащими нейтральными лигандами сохраняется. В спектрах люминесценции комплексных соединений наиболее интенсивные полосы относятся к электродипольному 5D0–7F2-переходу. Данный переход наиболее чувствителен к замене нейтрального лиганда в разнолигандных комплексах: наблюдаются перераспределение интенсивностей отдельных линий и изменения в структуре расщепления штарковских компонент 7F2-уровня. В спектрах люминесценции комплексных соединений в области электродипольного 5D0–7F2-перехода наблюдается до пяти компонент. Интенсивность полос магнитнодипольного перехода 5D0–7F1 на порядок ниже интенсивности полос электродипольного 5D0–7F2-перехода. Расщепление двух крайних полос магнитнодипольного 5D0–7F1-перехода существенно меняется при замене нейтрального лиганда, что указывает на вхождение его в координационную сферу иона европия(III).
Рис. 3.
Спектры люминесценции (λex = 338 nm) при 293 К: 1 –[Eu(о-MBA)3⋅2Н2О]n, 2 – [Eu(о-MBA)3⋅tppo]2, 3 – [Eu(о-MBA)3⋅hmpa]2⋅Н2О, 4 – [Eu(о-MBA)3⋅dmf]2, 5 – [Eu(о-MBA)3⋅dipy]2, 6 – [Eu(о-MBA)3⋅phen]2, 7 – [Eu(о-MBA)3⋅bt]2⋅2НО.

Для полученных нами разнолигандных комплексных соединений европия(III) были определены значения интегральных интенсивностей 5D0–7F2-перехода иона европия(III) (табл. 1). Было обнаружено увеличение интенсивности люминесценции перехода европия при переходе от гидрата к комплексным соединениям с нейтральными лигандами. Для о-метилбензоатов европия с 1,10-фенантролином и 2,2'-дипиридилом характерно максимальное значение интенсивности люминесценции, обусловленное наличием более развитой π-сопряженной системы эффективных поглотителей УФ-света, отсутствием молекул воды в координационной сфере разнолигандного комплексного соединения, а также наибольшим поглощением в области 260–310 нм.
Таблица 1.
Значение интенсивности люминесценции при 293 К разнолигандных м- и о-метилбензоатов европия
| Соединения | Irel(5D0–7F2),% | Соединения | Irel(5D0–7F2),% |
|---|---|---|---|
| [Eu(о-MBA)3⋅2Н2О]n | 10 | [Eu(м-MBA)3⋅2Н2О]n | 9 |
| [Eu(о-MBA)3⋅phen]2 | 100 | [Eu(м-MBA)3⋅phen]2 | 86 |
| [Eu(о-MBA)3⋅dipy]2 | 95 | [Eu(м-MBA)3⋅dipy]2 | 53 |
| [Eu(о-MBA)3⋅tppo]2 | 45 | [Eu(м-MBA)3⋅tppo]2⋅2Н2О | 40 |
| [Eu(о-MBA)3⋅bt]2⋅2Н2О | 32 | [Eu(м-MBA)3⋅bt]2⋅2Н2О | 15 |
| [Eu(о-MBA)3⋅dmf]2 | 35 | [Eu(м-MBA)3⋅dmf]2⋅2Н2О | 13 |
| [Eu(о-MBA)3⋅hmpa]2⋅Н2О | 24 | [Eu(м-MBA)3⋅hmpa]2⋅2Н2О | 12 |
Известно, что на квантовый выход люминесценции влияет величина энергетического зазора между положением триплетных уровней лигандов и резонансным уровнем иона европия(III). Из спектров фосфоресценции полученных нами м- и о-метилбензоатов гадолиния(III) были определены положения триплетных уровней (Т) используемых ароматических кислот: для м-метилбензоатов –19 230 см–1, для о-метилбензоатов – 21 740 см–1. Таким образом, в случае о-метилбензоатов величина энергетического зазора составляет 4520 см–1, а в случае м-метилбензоатов – 2010 см–1.
Сравнительный анализ интенсивности люминесценции разнолигандных комплексных о-метилбензоатов европия(III) и изученных раннее м-метилбензоатов [21] показал, что интенсивность люминесценции о-метилбензоатов европия(III) выше (в 1.5–5 раз), чем м-метилбензоатов (табл. 1). Этот факт, по-видимому, можно объяснить более оптимальной величиной энергетического зазора между триплетными уровнями метилбензойных кислот и резонансным уровнем иона европия(III) [25].
Таким образом, нами синтезированы новые люминесцирующие разнолигандные комплексные о-метилбензоаты европия(III) с азот- и фосфорсодержащими нейтральными лигандами. Показано, что передача энергии возбуждения к иону европия осуществляется как с уровней о-метилбензойной кислоты, так и с уровней нейтральных лигандов. Установлено, что при введении в орто-положение по отношению к фенильному кольцу метильного заместителя, в отличие от мета-положения, интенсивность люминесценции комплексных соединений европия(III) увеличивается.
Список литературы
Zhao L., Chen Y., Chai X. et al. // J. Mol. Struct. 2013. V. 1032. P. 213. https://doi.org/10.1016/j.molstruc.2012.10.012
Li Y., Yan B. // J. Solid State Chem. 2008. V. 181. P. 1032. https://doi.org/10.1016/j.jssc.2008.02.001
Zhao L., Chen Y., Zhang H. et al. // J. Mol. Struct. 2009. V. 920. P. 441. https://doi.org/10.1016/j.molstruc.2008.12.003
Chen Z.M., Wang S.P., Yang N. et al. // Russ. J. Coord. Chem. 2009. V. 35. № 7. P. 541. https://doi.org/10.1134/S1070328409070124
Utochnikova V., Kovalenko A., Burlov A. et al. // Dalton Trans. 2015. V. 44. P. 12660. https://doi.org/10.1039/C5DT01161B
Bunzli J.-C.G., Eliseeva S.V. // Chem. Sci. 2013. V. 4. № 5. P. 1913. https://doi.org/10.1039/C3SC22126A
Zhang J., Wang R., Bai J., Wang S. // J. Rare Earths. 2002. V. 20. № 5. P. 449.
Hasegawa Y., Nakanishi T. // RSC. Adv. 2015. V. 5. P. 338. https://doi.org/10.1039/C4RA09255D
Калиновская И.В., Карасев В.Е., Пяткина А.Н. // Журн. неорган. химии. 1999. Т. 44. № 3. С. 432.
Kalinovskaya I.V. // J. Mol. Struct. 2018. V. 1173. P. 328. https://doi.org/10.1016/jmolstruc.2018.06.118
Kurbatov I.A., Kharchenko V.I., Mirochnik A.G. et al. // J. Struct. Chem.2018. V. 59. № 2. P. 328; https://doi.org/10.1134/S0022476618020105
Калиновская И.В., Николенко Ю.М. // Оптика и спектроскопия. 2018. Т. 125. № 3. С. 344; https://doi.org/10.1134/S0030400X18090126
Kataoka H., Kitano T., Takizawa T. et al. // J. Alloys Compd. 2014. V. 601. P. 293. https://doi.org/10.1016/j.jallcom.2014.01.165
Chen Z.M., Wang S.P., Yang N. et al. // Russ. J. Coord. Chem. 2009. № 7. P. 541.
Hui-Juan Sun, Ai-Ling Wang, Hai-Bin Chu, Young-Liang Zhao // Luminescence. 2015. № 30. P. 131.
Блатун Л.А., Митиш В.А., Терехова Р.П. и др. // Журн. им. проф. Б.М. Костюченка. 2014. Т. I. С. 13.
Jin L.-P., Wang R.-F., Wang M.-Z. // Chem. J. Chin. Univ. 1993. V. 14. № 9. P. 1195.
Yang Q.Q., Zhu Z.J. // Rare Metals. 2000. V. 19. № 1. P. 59.
Wang Rui-Fen, Jin Lin-Pei, Wang Ming-Zhao et al. // Acta Chim. Sin. 1995. V. 53. P. 39.
Lam A.W.H., Wong W.T., Gao S. et al. // Eur. J. Inorg. Chem. 2003. № 1. P. 149. https://doi.org/10.1002/ejic.200390021
Задорожная А.Н., Калиновская И.В., Карасев В.Е., Шапкин Н.П. // Коорд. химия. 2001. Т. 27. № 7. С. 555.
Zhang J., Wang R., Yang H. et al. // Chin. J. Anal. Chem. 2003. V. 31. № 4. P. 472.
Zhang J., Wang R., Liu H.-M. // J. Therm. Anal. Cal. 2001. V. 66. P. 431.
Калиновская И.В., Задорожная А.Н., Привар Ю.О. // Журн. общ. химии. 2021. Т. 91. № 2. С. 238.
Золин В.Ф., Коренева Л.Г. Редкоземельный зонд в химии и биологии. М.: Наука, 1980. 349 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


